10.3803/jkes.2009.24.2.75
서 론 1)
인슐린은 1922년, Banting 등[1]에 의해 처음 발견된 이 래 당뇨병의 치료에 널리 이용되고 있으며, 생체 내 포도당 대사 및 생명 현상의 유지에 필수적인 펩타이드 호르몬이다.
인슐린은 근육과 지방 조직에서 포도당이 흡수되어 적절히 이용되게 하고, 간에서 당신생을 억제하여 혈중 포도당을 일 정하게 유지하는 작용을 한다. 인슐린은 이러한 전통적인 대 사작용 외에도 뇌, 췌장 베타세포, 심장, 혈관내피세포 등에 작용하는데 대사작용과 연계하여 생명 현상을 조절한다. 대표 적인 예로 인슐린은 혈관내피세포에서 phosphatidylinositol 3-kinase (PI3K)를 경유하는 세포 내 신호전달체계를 통하 여 nitric oxide (NO)를 생성함으로써 혈관확장 효과를 나타 내고, mitogen-activated protein kinase (MAPK)를 경유하 는 세포 내 신호전달체계를 통해 강력한 혈관 수축 물질인 endothelin-1 (ET-1)을 생성하여 혈관수축작용을 나타내는 데, 건강한 상태에서는 이 두 가지 신호전달체계가 적절히 균형을 이루고 있지만, 이 균형이 깨어지게 되면 각종 병적 인 상태가 나타나게 된다[2]. 인슐린 저항성이란 1936년, 더 많은 용량의 인슐린이 치료에 필요한 당뇨병 환자를 기술하 면서 처음 제안된 개념으로[3], 전통적으로 인슐린 감수성이 감소한 상태, 즉 인슐린 매개 포도당 흡수와 간에서의 당신 생을 억제하는 인슐린의 대사 작용에 대한 반응이 감소한 상태를 일컫는다. 인슐린 저항성은 제2형 당뇨병의 발생에 주된 역할을 할 뿐만 아니라 이와 관련된 고혈압, 비만, 관 상동맥질환, 이상지질혈증 등의 주요 보건 문제와 더불어 이 들 대사질환과 심장혈관질환들의 집합체로 정의되는 대사증 후군의 핵심적인 원인요소로 잘 알려져 있다[4]. 전 세계적 으로 비만한 인구의 폭발적인 증가는 제2형 당뇨병의 발생
률과 유병률, 그리고 이와 관련된 심혈관계 합병증의 급격한 증가로 이어지고 있다[5]. 따라서 인슐린 저항성을 인체와 실험 동물에서 정확하게 측정하여 인슐린 저항성의 유병률 과 병태생리학적인 기전, 치료 효과, 인슐린 저항성을 가진 환자의 임상 경과 등을 규명하고 이를 임상에 적용하는 것 은 매우 중요하기 때문에 인슐린 저항성을 정확히 측정하는 방법을 고안하는 것은 매우 중요하다. 본 지상강좌에서는 인 슐린 저항성의 측정을 위하여 개발된 각종 기법들에 대해서 설명하고, 이를 임상 연구와 환자의 진료에 적용하는데 도움 이 되고자 하였다.
직접적인 인슐린 저항성 측정 방법 1. 고인슐린혈증 정상혈당 글루코스 클램프
(Hyperinsulinemic Euglycemic Glucose Clamp)
글루코스 클램프 기법은 DeFronzo 등에 의해 처음 개발 이 되었는데, 현재 생체 내 인슐린 감수성 및 저항성을 측정 하고 평가하는 가장 표준적인 방법으로 알려져 있다[6]. 밤 새 금식시킨 환자에게 인슐린을 일정한 속도로 정주하게 되 면, 금식 상태일 때보다 높은 농도의 새로운 평형 상태인 인 슐린 농도가 유지되는데, 이 때 간에서의 당신생은 억제가 되고, 근육과 지방 조직에서의 글루코스 흡수는 증가하게 된 다. 이런 상태에서 환자 옆에 위치한 글루코스 측정기로 5분 에서 10분 간격으로 환자의 혈당을 지속적으로 측정하면서, 20% 덱스트로스 용액을 일정한 혈당이 유지되도록 주입 속 도를 조절하면서 정주한다(Fig. 1). 고인슐린혈증과 당흡수 의 증가로 인한 저칼륨혈증을 예방하기 위해 칼륨 용액도 함께 주입하여야 한다. 일정한 속도로 인슐린이 정주된 수시
* 이 논문은 2008년 정부(교육인적자원부)의 재원으로 한국학술진흥재단의 지원을 받아 수행된 연구임(KRF-2008- E00124)
인슐린 저항성의 측정 및 임상 적용
가천의과학대학교 의학전문대학원 내과학교실1, 분자내분비연구실2
김지훈1․이이영2․이시훈1,2
Assessment of Insulin Resistance and Its Clinical Application
Jihoon Kim1, Lee Young Lee2, Sihoon Lee1,2 Department of Internal Medicine1, Laboratory of Molecular Endocrinology2,
Graduate School of Medicine, Gachon University of Medicine and Science
간 후에는 혈장 인슐린, 혈당, 그리고 글루코스 주입속도 (GIR)가 일정하게 유지되는 평형 상태에 도달하게 된다. 고 인슐린혈증이 간에서의 당신생을 충분히 억제한다고 가정하 면, 이러한 평형 상태 하에서는 주입한 글루코스와 흡수된 글루코스 사이에 차이가 없기 때문에, 글루코스 주입속도 (GIR)는 글루코스 흡수속도(M)와 일치한다. 따라서, 특정 고인슐린혈증 하에서 전신 글루코스 흡수율을 직접 구할 수 있다. M은 체중, 특히 지방질을 제외한 질량에 보정되어 인 슐린 감수성 혹은 저항성의 지표로 이용될 수 있다. 이와 더 불어, M을 평형 상태의 혈당인 G에 보정하고, ΔI을 공복 시 와 평형 상태의 혈장 인슐린 농도라고 했을 때, SIClamp = M / (G × ΔI)라는 공식으로부터 인슐린 감수성 지표를 구할 수 도 있다. 글루코스 클램프 기법으로 측정된 인슐린 감수성 및 저항성의 유효성은 평형 상태에 도달했다는 가정하에서 성립이 되는데, 이 평형 상태에서는 간에서의 당신생이 철저 히 억제된다는 가정이 필요하다. 글루코스 클램프 기법은 몇 가지의 가정만 확립이 된다면 가장 정확하고, 직접적으로 전 신의 글루코스 흡수율을 측정함으로써 인슐린 감수성 및 저 항성을 평가할 수 있는 기법이라는 장점이 있다. 글루코스
클램프 기법을 시행하는 동안 방사성 동위원소가 흡착된 글 루코스 탐식자를 이용하면 간에서의 당신생과 전신에서 글 루코스 흡수율을 측정할 수 있으며[7], 각종 방사성 동위원 소가 흡착된 글라이세롤이나 아미노산 탐식자를 이용하면 지방 분해 및 단백질 대사와 관련된 인슐린 감수성을 측정 할 수 있어 임상 연구에 매우 유용한 방법이다[8]. 31P를 이 용한 자기공명분광기(MRS)를 글루코스 클램프 검사와 연계 하여 인슐린 자극 근육 내 미토콘드리아 ATP synthase의 흐 름과 인슐린 자극 근육 내 무기인의 농도 증가를 측정할 수 있고[9], 도플러 검사와 마이크로 버블을 이용한 조영제 증 강 초음파 검사를 연계하여 인슐린의 혈관 작용과 관련된 인슐린 저항성을 평가할 수 있다(Fig. 2)[10]. 인슐린 민감도 가 증가되면 투여된 글루코스의 용량이 증가되기 때문에 이 경우, 동맥과 정맥의 혈중 글루코스의 농도차가 증가하게 된 다. 따라서 정맥혈에서 측정된 글루코스의 농도를 기준으로 GIR을 결정하게 되면 인슐린 민감도가 과잉으로 측정될 수 있다. 이 문제를 해결하기 위해서 채혈을 위한 정맥 내 카테 터는 혈행의 반대 방향으로 유치하고, 따뜻한 패드를 덮어 온도를 상승시켜 동정맥 연결을 개통함으로써 정맥혈의 동 Fig. 1. Hyperinsulinemic Euglycemic Glucose Clamp Technique. After an overnight fast, insulin is infused intravenously at a constant rate that may range from 5~120 mU/m2/min (dose per body surface area per minute). This constant insulin infusion results in a new steady-state insulin level that is above the fasting level (hyperinsulinemic). As a consequence, glucose disposal in skeletal muscle and adipose tissue is increased while hepatic glucose production is suppressed. Under these conditions, a bedside glucose analyzer is used to frequently monitor blood glucose levels at 5~10 min intervals while 20% dextrose is given intravenously at a variable rate in order to “clamp” blood glucose concentrations in the normal range (euglycemic). An infusion of potassium phosphate is also given to prevent hypokalemia resulting from hyperinsulinemia and increased glucose disposal.
After several hours of constant insulin infusion, steady-state conditions can typically be achieved for plasma insulin, blood glucose, and the glucose infusion rate (GIR). Assuming that the hyperinsulinemic state is sufficient to completely suppress hepatic glucose production, and since there is no net change in blood glucose concentrations under steady-state clamp conditions, the GIR must be equal to the glucose disposal rate (M). Thus, whole body glucose disposal at a given level of hyperinsulinemia can be directly determined (Adopted from Muniyappa R, et al. Am J Physiol Endocrinol Metab 294:E15-26, 2008).
맥혈화로 해결할 수 있다[11]. 그러나, 글루코스 클램프 기 법은 시간이 많이 소요되고, 노동 집약적이며, 비용이 많이 드는 검사이다. 그리고 숙련된 검사자가 반드시 필요하기 때 문에 대규모 역학 연구 및 일상적인 환자 진료에 이용하기
에는 적절하지 못하다. 그래서 개개인의 인슐린 저항성 측정 이 연구의 목표가 아니라면 비용대비 효율면에서 추천할 만 한 검사법은 아니다. 그리고 평형 상태에 도달하기 위해서는 생리적인 인슐린 혈중 농도보다 고농도의 인슐린혈증을 유 A
B
Insulin
(2 h, steady-state ~300 μU/mL) Baseline
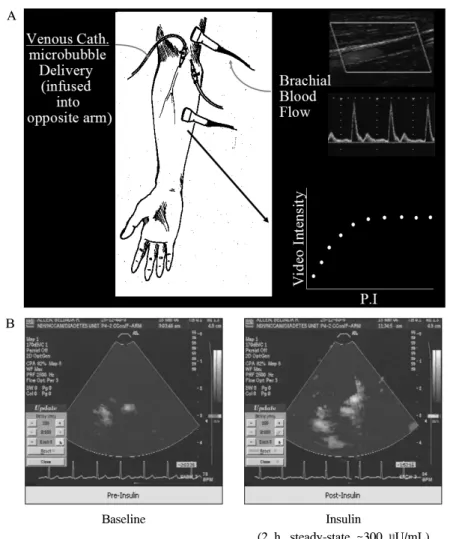
Fig. 2. Brachial artery measurements and insulin-stimulated capillary recruitment measured by contrast enhanced ultrasonography.
A. Brachial artery measurements are made ~10 cm proximal to the antecubital fold while the patient is in the supine position using a high frequency L12-5 linear array transducer interfaced to an HDI5000 ultrasound (Philips Medical Systems, Andover, MA). Artery diameter is measured using 2-D imaging of the longitudinal artery as the distance between each inside edge of the arterial intima. Velocity is determined using pulse-wave Doppler and brachial flow calculated from the diameter and velocity measurements. Contrast ultrasound measurements are performed using an HDI5000 (Philips Medical Systems) while the patient is sitting upright. A P4-2 phased array transducer (Philips Medical Systems) is positioned with a ring stand and clamp to image the flexor muscles of the forearm in cross section. Microbubbles (Bristol-Myers Squibb, Princeton, NJ) are delivered intravenously at a rate that produced moderate opacification (below saturation level) at the longest pulsing interval used (16s).
Microbubbles are detected by power Doppler imaging using a mechanical index capable of destroying all bubbles in the ultrasound beam. After an initial equilibration period, a pulsing interval (time) versus video-intensity curve is generated. The pulsing interval is the time between successive ultrasound pulses, which destroy microbubbles, and video intensity is the intensity of signal generated from the microbubbles. At a low pulsing interval (e.g., 500 ms) only microbubbles in the larger arteries and arterioles are filled before another destructive pulse is delivered, hence all of signal intensity is secondary to filling of these vessels. At a longer pulsing interval (e.g., 16 s) the microbubbles will again have filled larger arteries and arterioles but will have also entered the microvasculature. Subtracting images obtained at 500 ms from those taken at 16 s eliminates signals generated from the background tissue or larger vessels, leaving a measure of MBV. B. Images are recorded onto SVHS videotape, captured using Adobe Premiere software (Version 6.0) and analyzed using MCE software (University of Virginia) (Adopted from Clerk LH, et al. Diabetes 55:1436-1442, 2006).
발하기 때문에, 생리적인 상태에서의 인슐린 작용과 글루코 스의 역동학을 정확하게 반영하지 못한다.
2. 인슐린 억제 검사(Insulin Suppression Test) 인슐린 억제 검사는 Shen 등[12]에 의해 개발되고, Harano 등[13]에 의해 조금 변형된 인슐린 저항성을 직접적 으로 측정하는 방법이다. 밤새 금식을 시킨 후, somatostatin 이나 somatostatin analogue인 octreotide를 주입하여 내인성 인슐린과 글루카곤의 분비를 억제한 후, 일정 용량의 인슐린 과 글루코스를 같은 편 상박에 3시간 동안 일정하게 정주한 다. 동시에 반대 편 상박에서는 150분 동안 매 30분마다 혈 액을 채취하여 인슐린과 글루코스의 농도를 측정하고, 150 분에서 180분 동안은 매 10분 간격으로 측정을 한다. 150분 에서 180분까지를 평형 상태로 간주하고, 이 때 일정하게 주입된 인슐린과 글루코스를 통해 평형 상태의 인슐린 (SSPI)과 글루코스(SSPG)를 구할 수 있다. SSPI는 개체마 다 대략 비슷한 값을 보이기 때문에, SSPG는 인슐린 감수 성과 역의 상관관계를 갖게 되어, 인슐린 저항성이 있는 개 체에서는 SSPG 농도가 높게 되고, 인슐린 감수성이 있는 개체에서는 낮게 되어, 인슐린 감수성 및 저항성을 나타내는 지표로 이용할 수 있다. SSPG는 재현성이 우수하고, 덜 노 동집약적이며 특별한 기술을 요하지 않는 인슐린 저항성의 측정법이지만, 실제로 대규모의 역학 연구나 임상에 직접 적 용하기에는 글루코스 클램프와 마찬가지로 어려움이 따르게 된다. 그리고 인슐린 감수성이 현저한 개체에서는 저혈당을 유발할 가능성도 있고, 제2형 당뇨병 환자에서는 고혈당으 로 요당이 발생할 수도 있으며, 정확한 인슐린 저항성을 측 정하기 어려울 때도 있다.
간접적인 인슐린 저항성 측정 방법 1. 최소 모델 분석(Minimal Model Analysis) 최소 모델(minimal model)은 Bergman 등[14]에 의해 개 발되었으며, 다회 채취 정맥 혈당 내성 검사(frequently sampled intravenous glucose tolerance test)를 통해 얻은 인슐린과 글루코스를 통해 인슐린 감수성 및 저항성을 측정하는 간접 적인 방법이다. 밤새 금식을 한 후, 2분 동안 정맥으로 일정 량의 글루코스를 주입하고, 이 때를 검사의 시작으로 한다.
글루코스 정주 20분 후, 일정량의 인슐린을 5분 이상 주입 한다. -10, -1, 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 16, 20, 23, 24, 25, 27, 30, 40, 50, 60, 70, 80, 90, 100, 120, 160, 180 분에 혈액을 채취하여, 혈장 인슐린과 글루코스를 측정하고, 이 값을 MINMOD라고 하는 컴퓨터 프로그램에 입력하여 인슐린 감수성 지표를 구하게 된다. 평형 상태에 도달한 혈 중 글루코스와 인슐린 농도를 기반으로 하는 글루코스 클램 프나 인슐린 억제 검사와는 달리 최소 모델 분석은 동적인
결과치를 기반으로 한다. 최소 모델 분석은 글루코스 클램프 보다 덜 노동집약적이고 평형 상태를 유지할 필요가 없으며, 지속적으로 정맥 내 주입 속도를 조절해야 할 필요가 없다.
그리고 최소 모델 분석은 글루코스 클램프나 인슐린 억제 검사와는 달리 한번의 검사를 통해 인슐린 감수성 및 저항 성, 글루코스 효능과 베타세포 기능을 평가할 수 있다. 3시 간 이상 자주 채혈을 해야 하고, 최소 모델이 글루코스 대사 의 정상적인 생리학을 지나치게 간소화한 이유로 정확도가 떨어진다는 단점이 있다.
2. 경구 내당능 검사(Oral Glucose Tolerance Test)
경구 내당능 검사는 임상에서 내당능 평가와 제2형 당뇨 병의 진단에 가장 널리 쓰이고 있는 검사법이다. 밤새 금식 후, 표준 경구 글루코스(75 g)나 표준 식사 섭취 후, 0, 30, 60, 120분째 채혈하여 글루코스와 인슐린 농도를 측정한다[15].
경구 내당능 검사는 글루코스 클램프 검사에 비해 글루코스 와 인슐린의 생리적인 역동학에 더욱 유사하지만, 내당능과 인슐린 감수성 및 저항성은 일치하는 개념이 아니다. 따라 서, 표준 경구 글루코스(75 g)나 표준 식사 섭취 후 검사는 내당능을 평가하는 데 유용한 검사이지만, 인슐린 감수성 및 저항성을 평가하는 데에는 적합한 검사가 아니다. 더구나 내 당능의 유지에는 인슐린의 대사적 작용 외에도 인슐린 분비, 인크레틴 작용 등의 다른 요소들이 작용하기 때문에 내당능 의 평가만으로 인슐린 감수성 및 저항성을 평가하는 데에는 한계가 있다.
인슐린 저항성 대리 지표
1. 공복 시 평형 상태로부터 구한 대리 지표 건강한 개체에서 밤새 공복 상태가 유지되면 아침에는 인 슐린 농도의 변화가 거의 없고, 간에서 당신생이 일정하여 혈당이 정상 수준으로 평형 상태가 유지된다. 이 때의 채혈 로 구한 인슐린과 글루코스 농도를 이용한 수식으로 인슐린 저항성 대리 지표를 대신하려는 노력이 있어 왔다. 공복 시 의 인슐린과 글루코스를 이용한 인슐린 저항성 대리 지표는 주로 간에서의 인슐린 감수성 및 저항성을 대변하는데, 대개 의 경우 근육에서의 인슐린 감수성 및 저항성은 간에서의 인슐린 감수성 및 저항성과 서로 비례하기 때문에 전신 인 슐린 감수성 및 저항성의 지표로 사용해도 큰 무리는 없다.
다만, 당뇨병 환자에서는 공복 시에 인슐린 농도가 낮고, 정 상 혈당으로 유지하는 것이 불충분하기 때문에 이러한 대리 지표를 당뇨병 환자에도 적용하는 데는 재고의 여지가 있다 고 하겠다. Homeostasis model assessment (HOMA)는 글 루코스와 인슐린의 역동학 사이의 상관관계에 대한 모델로 1985년 개발되었는데[16], 인슐린 저항성과 베타세포 기능
사이의 가능한 광범위한 조합에 대한 공복 시 평형 상태의 글루코스와 인슐린 농도를 예측하는 데 이용될 수 있다.
HOMA는 간과 베타세포 사이의 되먹임 작용을 가정하는데, 예를 들면 글루코스 농도는 인슐린에 의한 간의 당신생에 의 해 조절이 되고, 인슐린 농도는 글루코스 농도에 대한 췌장 베타세포의 반응에 의해 조절이 된다는 것이다. 이를 이용하 면 인슐린 저항성과 베타세포의 기능을 대변하는 지표로 이 용될 수 있는데, 임상연구를 비롯한 실제에서는 인슐린 저항 성의 대리 지표로 사용되는 간단한 공식으로 ‘HOMA-IR = [공복 혈중인슐린(uU/mL)] × [공복 혈당(mmol/L)] / 22.5' 라는 식으로 얻을 수 있다. Quantitative insulin sensitivity check index (QUICKI)는 공복 시 혈당과 인슐린 농도로부 터 수학적인 변형을 통해 얻어진 인슐린 저항성 대리 지표 로 신뢰도와 재현성이 높고 우수한 양의 예측 능력을 나타 낸다[17]. ‘QUICKI = 1 / [log (공복 혈중인슐린, uU/mL) + log (공복 혈당, mg/dL)]'의 공식으로 얻어진 QUICKI는 글 루코스 클램프에서 얻어진 SIClamp 지표와 HOMA-IR이나 최소 모델에서 얻어진 SI보다 우수한 선형 관계를 보여준 다[18~21]. 간단하고, 유용하면서 가장 비침습적인 방법으로 인슐린 저항성 지표를 구하고, 이를 대규모 역학 연구나 임 상 시험 및 치료 효과를 검증하는 데 있어서 QUICKI와 log (HOMA)가 가장 우수한 인슐린 저항성의 대리 지표로 생각 된다. 인슐린 저항성 대리 지표로 널리 이용되는 HOMA와 QUICKI 이외에도 각종 지표들이 개발되어 왔다. 인슐린 저 항성이 대사증후군의 가장 핵심 요소이기 때문에, 혈중 인슐 린 농도의 측정 자체가 인슐린 감수성 및 저항성을 측정하 는데 유용할 것으로 생각되어 왔다. 특히, 건강한 개체에서 공복 시 정상 혈당을 보일 때, 공복 시 혈중 인슐린 농도의 증가는 인슐린 저항성의 증가와 상관관계를 보였다. 혈중 인 슐린 농도의 역수(1 / 공복 시 인슐린)는 개체의 인슐린 저항 성이 증가할수록 감소하는 인슐린 저항성 대리 지표로 잘 알 려져 있다[22]. 성호르몬결합글로불린(sex hormone binding globulin, SHBG)은 인슐린에 의해 조절되고 간에서 생성되 는 단백질로서 그 농도와 인슐린 저항성과 상관 관계가 있 는 것으로 보고되고 있고[23], 인슐린양성장인자결합단백 (insulin-like growth factor binding protein, IGFBP)의 공복 시 혈청 농도도 정상내당능을 보이는 개체에서 유용한 인슐 린 감수성 및 저항성 지표로 이용될 수 있다고 보고되고 있 다[24].
2. 동적인 검사를 통해 구한 대리 지표
경구 내당능 검사, 경정맥 내당능 검사 등의 동적인 검사 를 통한 결과를 토대로 한 인슐린 감수성 및 저항성의 대리 지료가 Matsuda index[25], Stumvoll index[26], Avignon index[27], Gutt index[28], Belfiore index[29]라는 이름으로 개발되어 왔다. 이들 지표들은 대체로 글루코스 클램프에
서 측정한 인슐린 감수성 및 저항성 지표와 상관관계가 높 고[25,28,30], 인슐린의 작용뿐만 아니라 인슐린 분비에 대 한 정보를 얻을 수 있다는 장점이 있다.
실험 동물에서 인슐린 저항성 측정
인슐린 저항성을 보이는 동물 모델은 인슐린 저항성의 병 태 생리를 이해하고 인슐린 저항성과 이와 관련된 질환의 치료 및 예방에 필요한 약제의 개발과 평가에 매우 유용하 다. 인체에서와 마찬가지로 동물에서도 고인슐린혈증 정상 혈당 글루코스 클램프가 인슐린 저항성을 평가하는데 가장 표준적인 방법으로 알려져 있는데[31], 이 외에도 경정맥 내 당능 검사(IVGTT), 구강 내당능 검사(OGTT), 경복강 인 슐린 자극 검사 (IPITT) 등의 동적인 검사들도 이용되고 있다[32~34]. 또한, 금식 상태에서 도출된 공복 시 인슐린 혈중 농도, HOMA와 QUICKI 등의 인슐린 저항성 대리 지 표를 이용한 경우도 있었다[35~37]. 마우스와 랫트에서 글 루코스 클램프를 통해 측정한 직접적인 인슐린 저항성 지표 와 대리 지표를 비교해 보았을 때, 인체에서 비교하는 것보 다 일치도가 떨어지는 것을 관찰할 수 있었다[38,39]. 마우 스의 체중으로 보정하였을 때, 일치도가 상승하는 것으로 보 아, 마우스에서 글루코스 클램프 결과와 인슐린 저항성의 대 리 지표와의 일치도가 감소하는 이유는 다음과 같이 추정해 볼 수 있다. 첫째, 마우스와 인체의 생리학적인 차이이다. 마 우스는 생리적인 공복 상태가 존재하지 않는데, 인위적인 15 시간 이상의 공복 상태가 말초의 인슐린 감수성을 증가시키 고 체중과 간내 글리코겐의 함량, 혈중 글루코스와 인슐린의 농도를 감소시킬 수 있다[31,40]. 둘째, 마우스와 인체에서 체표면과 체중의 비의 차이가 크기 때문에 마우스에서 공복 상태에 유의하게 체중이 감소했을 가능성이 있다. 셋째, 마 우스의 전체 혈액의 부피가 2 mL 이하이기 때문에 글루코 스 클램프 도중 충분한 양의 혈액을 채취하기 어려워 평형 상태에 도달하기가 어렵고 마취된 상태라 하더라도 글루코 스 클램프가 마우스에게 매우 스트레스가 되는 상황이기 때 문에 인체에서만큼 정확한 인슐린 감수성 및 저항성을 측정 하기 어렵다.
인슐린 저항성 측정과 임상 적용
인슐린 저항성은 당뇨병, 고혈압, 고지혈증 등의 총 집합 체인 대사증후군의 발생에 가장 중요한 역할을 하기 때문에 건강한 사람을 대상으로 인슐린 저항성을 측정하여 대사증 후군으로의 발생 위험성을 평가하려는 노력과 이를 위해 인 슐린 저항성 대리 지표의 기준선을 구하려는 노력이 있어 왔다[41]. 976명의 당뇨병이 없는 한국인 성인을 대상으로 한 연구에서 인슐린 저항성 대리 지표로 공복 시 인슐린 농
도, HOMA-IR, QUICKI를 이용하여 모든 대상군을 4개의 군 으로 나누어 분석해 본 결과, 인슐린 저항성이 있다고 판단할 수 있는 기준값은 공복 인슐린 농도의 경우는 12.94 uU/mL, HOMA-IR은 3.04 (이상, 상위 75%), 그리고 QUICKI는 0.32 (하위 25%)였고, 모든 인슐린 저항성 대리 지표에서 인슐린 저항성이 증가할수록 2배 이상의 대사증후군 발생의 위험성이 증가하는 것을 보여주었다[42]. 각 실험실마다 인 슐린 농도를 측정하는 것이 표준화되어 있지 않은 상태에서 공복 시 혈중 인슐린과 혈당을 기준으로 공식을 도출한 이 대리 지표의 기준값을 정하는 것은 합리적이지 못하다고 하 는 비판도 있으나, 환자나 개체의 인슐린 저항성 정도를 대 리 지표를 사용해 쉽게 구하고, 추후 경과를 관찰하거나 치 료 효과를 비교하는 것은 진료에 유용한 정보를 제공할 것 으로 생각된다. 193명의 제2형 당뇨병 환자를 대상으로 C-peptide를 이용한 인슐린 분비능과 인슐린 내성 검사를
이용한 인슐린 저항성의 지표로 6개의 환자군으로 나누어 인슐린 분비능이 떨어진 군에서는 인슐린 치료를 시행하였 고, 인슐린 저항성이 심한 군에서는 인슐린 저항성 개선제를 투여하는 맞춤형 당뇨병 치료를 시행하여 일년 동안 기존의 치료군과 효과를 비교한 연구(Fig. 3)에서는 환자 개개인의 인슐린 분비와 저항성에 적절한 맞춤 치료를 시행한 군에서 혈당 강하 효과가 우수했던 사실을 보고하고 있다[43].
결 론
인슐린 저항성은 제2형 당뇨병을 비롯한 고혈압, 비만, 고지혈증, 심장혈관 질환, 뇌혈관 질환 등의 집합체인 대사 증후군의 병인에 핵심적인 역할을 할 뿐만 아니라 각종 암 발생과도 높은 상관관계가 보고되고 있는데[44], 이러한 인슐 린 저항성을 정확히 측정하고, 이를 임상에 적용하는 것은 매 Fig. 3. New standardized therapeutic model in Korean patients with type 2 diabetes mellitus. Patients are allocated to one of six groups based on the reference value of C-peptide and the rate constant for plasma glucose disappearance (Kitt) as follows:
(i) diet and exercise only; (ii) patients treated with metformin (Met) and/or thiazolidinediones (Met/TZD); (iii) patients treated with sulphonylurea only (SU); (iv) patients treated with SU + Met/TZD; (v) patients treated with insulin only; and (vi) patients treated with insulin + Met. Kitt (%/min), rate constant for glucose disappearance by the insulin tolerance test (ITT); FPG, fasting plasma glucose concentration; PP2hG, postprandial 2-h plasma glucose concentration (Adopted from Choi SH, et al.. Clin Endocrinol (Oxf.) 69:549-555, 2008).
우 중요하다. 인슐린 저항성을 측정하기 위하여 수많은 방법 들이 개발되어 왔지만[41,45], 그 중 환자 진료에 있어 유용 한 방법으로 공복 시 혈중 인슐린 농도와 혈당으로부터 간 단한 공식에 의해 구해진 인슐린 저항성 대리 지표를 이용 할 수 있는데, 대리 지표 중 QUICKI와 log (HOMA)가 가 장 유용하고, 정확도가 높은 지표인 것으로 생각된다. 아울 러 인슐린 저항성과 함께 인슐린 분비능을 고려한 제2형 당 뇨병의 맞춤형 치료도 효과적인 혈당 관리를 위해 고려해 보아야 할 것으로 보인다.
감사의 글
이 논문을 작성하는데 많은 도움을 주신 National Institutes of Health의 Dr. Michael Quon, Dr. Ranganath Muniyappa와 University of Virginia의 Dr. Zhengqi Liu, Weidong Chai에게 감사드립니다.
참 고 문 헌
1. Banting FG, Best CH: The internal secretion of the pancreas 1922. Indian J Med Res 125:251-266, 2007 2. Muniyappa R, Montagnani M, Koh KK, Quon MJ:
Cardiovascular actions of insulin. Endocr Rev 28:463-491, 2007
3. Himsworth H: Diabetes mellitus: a differentiation into insulin-sensitive and insulin-insensitive types. Lancet 1:127-130, 1936
4. Reaven GM: The insulin resistance syndrome: definition and dietary approaches to treatment. Annu Rev Nutr 25:391-406, 2005
5. Geiss LS, Pan L, Cadwell B, Gregg EW, Benjamin SM, Engelgau MM: Changes in incidence of diabetes in U.S. adults, 1997-2003. Am J Prev Med 30:371-377, 2006
6. DeFronzo RA, Tobin JD, Andres R: Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 237:E214-E223, 1979 7. Campbell PJ, Mandarino LJ, Gerich JE: Quantification
of the relative impairment in actions of insulin on hepatic glucose production and peripheral glucose uptake in non-insulin-dependent diabetes mellitus.
Metabolism 37:15-21, 1988
8. Gelfand RA, Barrett EJ: Effect of physiologic hyperinsulinemia on skeletal muscle protein synthesis and breakdown in man. J Clin Invest 80:1-6, 1987 9. Petersen KF, Dufour S, Befroy D, Garcia R, Shulman
GI: Impaired mitochondrial activity in the insulin -resistant offspring of patients with type 2 diabetes. N Engl J Med 350:664-671, 2004
10. Clerk LH, Vincent MA, Jahn LA, Liu Z, Lindner JR, Barrett EJ: Obesity blunts insulin-mediated microvascular recruitment in human forearm muscle. Diabetes 55:1436-1442, 2006
11. Morris AD, Ueda S, Petrie JR, Connell JM, Elliott HL, Donnelly R: The euglycaemic hyperinsulinaemic clamp: an evaluation of current methodology. Clin Exp Pharmacol Physiol 24:513-518, 1997
12. Shen SW, Reaven GM, Farquhar JW: Comparison of impedance to insulin-mediated glucose uptake in normal subjects and in subjects with latent diabetes. J Clin Invest 49:2151-2160, 1970
13. Harano Y, Hidaka H, Takatsuki K, Ohgaku S, Haneda M, Motoi S, Kawagoe K, Shigeta Y, Abe H: Glucose, insulin, and somatostatin infusion for the determination of insulin sensitivity in vivo. Metabolism 27:1449- 1452, 1978
14. Bergman RN, Ider YZ, Bowden CR, Cobelli C:
Quantitative estimation of insulin sensitivity. Am J Physiol 236:E667-E677, 1979
15. Dalla Man C, Campioni M, Polonsky KS, Basu R, Rizza RA, Toffolo G, Cobelli C: Two-hour seven-sample oral glucose tolerance test and meal protocol: minimal model assessment of beta-cell responsivity and insulin sensitivity in nondiabetic individuals. Diabetes 54:3265-3273, 2005
16. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC: Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 28:412-419, 1985
17. Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, Quon MJ: Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab 85:2402-2410, 2000
18. Mather KJ, Hunt AE, Steinberg HO, Paradisi G, Hook G, Katz A, Quon MJ, Baron AD: Repeatability characteristics of simple indices of insulin resistance:
implications for research applications. J Clin Endocrinol Metab 86:5457-5464, 2001
19. Chen H, Sullivan G, Yue LQ, Katz A, Quon MJ:
QUICKI is a useful index of insulin sensitivity in
subjects with hypertension. Am J Physiol Endocrinol Metab 284:E804-E812, 2003
20. Chen H, Sullivan G, Quon MJ: Assessing the predictive accuracy of QUICKI as a surrogate index for insulin sensitivity using a calibration model.
Diabetes 54:1914-1925, 2005
21. Hanley AJ, Williams K, Gonzalez C, D'Agostino RB, Jr, Wagenknecht LE, Stern MP, Haffner SM: San Antonio Heart Study; Mexico City Diabetes Study;
Insulin Resistance Atherosclerosis study. Prediction of type 2 diabetes using simple measures of insulin resistance: combined results from the San Antonio Heart Study, the Mexico City Diabetes Study, and the Insulin Resistance Atherosclerosis Study. Diabetes 52:463-469, 2003
22. Laakso M: How good a marker is insulin level for insulin resistance? Am J Epidemiol 137:959-965, 1993 23. Nestler JE: Sex hormone-binding globulin: a marker
for hyperinsulinemia and/or insulin resistance? J Clin Endocrinol Metab 76:273-274, 1993
24. Borai A, Livingstone C, Zarif H, Ferns G: Serum insulin-like growth factor binding protein-1: an improvement over other simple indices of insulin sensitivity in the assessment of subjects with normal glucose tolerance. Ann Clin Biochem 46:109-113, 2009
25. Matsuda M, DeFronzo RA: Insulin sensitivity indices obtained from oral glucose tolerance testing:
comparison with the euglycemic insulin clamp.
Diabetes Care 22:1462-1470, 1999
26. Stumvoll M, Mitrakou A, Pimenta W, Jenssen T, Yki-Jarvinen H, Van Haeften T, Renn W, Gerich J:
Use of the oral glucose tolerance test to assess insulin release and insulin sensitivity. Diabetes Care 23:295-301, 2000
27. Avignon A, Boegner C, Mariano-Goulart D, Colette C, Monnier L: Assessment of insulin sensitivity from plasma insulin and glucose in the fasting or post oral glucose-load state. Int J Obes Relat Metab Disord 23:512-517, 1999
28. Gutt M, Davis CL, Spitzer SB, Llabre MM, Kumar M, Czarnecki EM, Schneiderman N, Skyler JS, Marks JB: Validation of the insulin sensitivity index (ISI(0,120)): comparison with other measures.
Diabetes Res Clin Pract 47:177-184, 2000
29. Belfiore F, Iannello S, Volpicelli G: Insulin sensitivity
indices calculated from basal and OGTT-induced insulin, glucose, and FFA levels. Mol Genet Metab 63:134-141, 1998
30. Mari A, Pacini G, Murphy E, Ludvik B, Nolan JJ: A model-based method for assessing insulin sensitivity from the oral glucose tolerance test. Diabetes Care 24:539-548, 2001
31. Ayala JE, Bracy DP, McGuinness OP, Wasserman DH: Considerations in the design of hyperinsulinemic -euglycemic clamps in the conscious mouse. Diabetes 55:390-397, 2006
32. Cho H, Mu J, Kim JK, Thorvaldsen JL, Chu Q, Crenshaw EB 3rd, Kaestner KH, Bartolomei MS, Shulman GI, Birnbaum MJ: Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science 292:1728 -1731, 2001
33. Dubois MJ, Bergeron S, Kim HJ, Dombrowski L, Perreault M, Fournes B, Faure R, Olivier M, Beauchemin N, Shulman GI, Siminovitch KA, Kim JK, Marette A: The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis.
Nat Med 12:549-556, 2006
34. Pacini G, Thomaseth K, Ahren B: Contribution to glucose tolerance of insulin-independent vs. insulin -dependent mechanisms in mice. Am J Physiol Endocrinol Metab 281:E693-E703, 2001
35. Herbach N, Rathkolb B, Kemter E, Pichl L, Klaften M, de Angelis MH, Halban PA, Wolf E, Aigner B, Wanke R: Dominant-negative effects of a novel mutated Ins2 allele causes early-onset diabetes and severe beta-cell loss in Munich Ins2C95S mutant mice. Diabetes 56:1268-1276, 2007
36. Maeda N, Shimomura I, Kishida K, Nishizawa H, Matsuda M, Nagaretani H, Furuyama N, Kondo H, Takahashi M, Arita Y, Komuro R, Ouchi N, Kihara S, Tochino Y, Okutomi K, Horie M, Takeda S, Aoyama T, Funahashi T, Matsuzawa Y: Diet-induced insulin resistance in mice lacking adiponectin/ACRP30. Nat Med 8:731-737, 2002
37. Potenza MA, Marasciulo FL, Tarquinio M, Quon MJ, Montagnani M: Treatment of spontaneously hypertensive rats with rosiglitazone and/or enalapril restores balance between vasodilator and vasoconstrictor actions of insulin with simultaneous improvement in hypertension and insulin resistance.
Diabetes 55:3594-3603, 2006
38. Lee S, Muniyappa R, Yan X, Chen H, Yue LQ, Hong EG, Kim JK, Quon MJ: Comparison between surrogate indexes of insulin sensitivity and resistance and hyperinsulinemic euglycemic clamp estimates in mice. Am J Physiol Endocrinol Metab 294:E261-E270, 2008
39. Tran TT, Gupta N, Goh T, Naigamwalla D, Chia MC, Koohestani N, Mehrotra S, McKeown-Eyssen G, Giacca A, Bruce WR: Direct measure of insulin sensitivity with the hyperinsulinemic-euglycemic clamp and surrogate measures of insulin sensitivity with the oral glucose tolerance test: correlations with aberrant crypt foci promotion in rats. Cancer Epidemiol Biomarkers Prev 12:47-56, 2003
40. Heijboer AC, Donga E, Voshol PJ, Dang ZC, Havekes LM, Romijn JA, Corssmit EP: Sixteen hours of fasting differentially affects hepatic and muscle insulin sensitivity in mice. J Lipid Res 46:582-588, 2005 41. Borai A, Livingstone C, Ferns GA: The biochemical
assessment of insulin resistance. Ann Clin Biochem 44:324-342, 2007
42. Lee S, Choi S, Kim HJ, Chung YS, Lee KW, Lee HC, Huh KB, Kim DJ: Cutoff values of surrogate measures of insulin resistance for metabolic syndrome in Korean non-diabetic adults. J Korean Med Sci 21:695-700, 2006
43. Choi SH, Hur KY, Kim DJ, Ahn CW, Kang ES, Cha BS, Lim SK, Huh KB, Lee HC: Staged diabetes management according to individual patient insulin resistance and beta-cell function ameliorates glycaemic control in type 2 diabetes mellitus. Clin Endocrinol (Oxf) 69:549-555, 2008
44. Park SM, Lim MK, Jung KW, Shin SA, Yoo KY, Yun YH, Huh BY: Prediagnosis smoking, obesity, insulin resistance, and second primary cancer risk in male cancer survivors: National Health Insurance Corporation Study. J Clin Oncol 25:4835-4843, 2007 45. Muniyappa R, Lee S, Chen H, Quon MJ: Current
approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 294:E15-E26, 2008