工學碩士學位論文
두 개의 온도 의존 매개변수가 있는 3차 상태방정식의 성능비교
Performance Comparison of Cubic Equations of State With Two Temperature Dependent
Parameters
國民大學校 大學院
機械工學科
權 英 旭
2 0 0 1
두 개의 온도 의존 매개변수가 있는 3차 상태방정식의 성능비교
Performance Comparison of Cubic Equations of State With Two Temperature Dependent
Parameters
指導敎授 朴 慶 根
이 論文을 工學碩士學位 請求 論文으로 提出함
2001年 12月 14日
國民大學校 大學院
機械工學科
權 英 旭
2 0 0 1
權 英 旭 의
工學碩士學位 請求論文을 認准함
2001年 12月 14日
審 査 委 員 長 김 석 현 印
審 査 委 員 정 태 용 印
審 査 委 員 박 경 근 印
國民大學校 大學院
목 차
국문요약 ···ⅱ
List of Tables ···ⅳ
List of Figures ···ⅴ
Nomenclature ···ⅵ
1. 서론 ···1
2. 3차 상태방정식의 형태 ···3
2.1 기본형태 ···3
2.2 Martin 상태방정식 ···4
2.3 Fuller 상태방정식 ···7
2.4 Harmens-Knapp 상태방정식 ···8
2.5 Schmidt-Wenzel 상태방정식 ···10
3. 상태방정식의 성능비교 ···11
3.1 대상물질 ···11
3.2 포화상태량을 이용한 상태방정식의 최적화 ···13
3.3 포화상태량 계산 결과 ···16
4. 결론 ···28
References ···29
Abstract ···33
국 문요약
기존에 냉매로 쓰였던 CFC물질이 대기중의 오존층을 파괴한 다는 사실이 알려지면서 CFC의 사용 및 생산의 규제에 대한 법 적인 기준의 틀인 몬트리올 의정서를 채택하게 되었다. 따라서 현시기 오존층 파괴지수가 0이고 지구온난화 지수가 낮을 뿐만 아니라 독성 및 가연성이 없으며 열역학적 성능이 우수한 새로 운 냉매 개발이 요구되고 있다. 열역학적 성능 파악을 위해서 알 아야 하는 상태량은 상태방정식을 이용하여 구하게 되므로, 성능 이 좋은 상태방정식 개발이 필요하게 된다.
본 연구에서는 비극성 물질인 메탄, 프로판, 부탄, 이소부탄, 이 산화탄소와 극성 물질인 R-32, R-125, R-134a, R-143a, R-152a, 물, 암모니아를 대상으로 3개의 매개변수가 있는 Martin, Fuller, Harmens-Knapp 식과 4개의 매개변수가 있는 Schmidt-Wenzel 식의 성능을 비교 평가하였다. 이 식들은 일반적으로 매개변수 중 a만을 온도의 함수로 정하였으나 본 연구에서는 식의 성능을 향상시키기 위해 매개변수들 중 2개를 온도의 함수로 정하였다.
즉, 3 개의 매개변수가 있는 식은 a( T) = a0[ 1+a1τ], c( T) = c0[ 1+c1τ]의 형태로 정하였고, 4개가 있는 Schmidt-Wenzel 식은 c 대신 d를d( T) = d0+ d1τ 로 정하였다. 여기서 τ = 1/Tr- 1 이며 환산온도 Tr= T/Tc, Tc는 임계온도이다.
포화압력 예측에 있어서는 Harmnes-Knapp 식을 제외한 나머지 식이 1% 내외의 편차로 비슷한 성능을 보였다. 포화액체 비체적의 예측에 있어서는 3개의 매개변수가 있는 식이 2∼5%의 편차를 보이 는 반면 4개의 매개변수가 있는 Schmidt-Wenzel 식이 1% 미만의
도 Schmidt-Wenzel 식이 1% 내외의 오차로 가장 우수하였다.
List of Tables
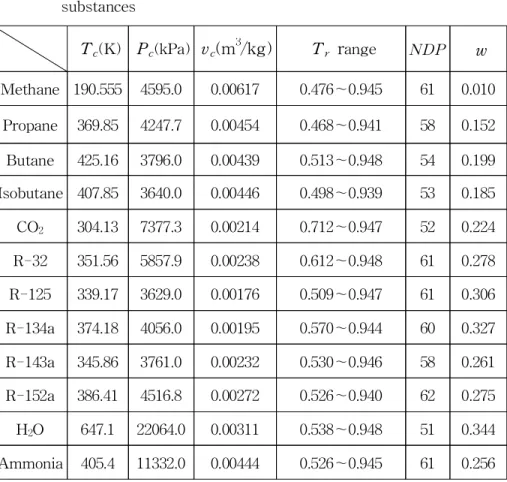
Table 1 Critical data, Tr range, NDP and acentric factor for substances
···12
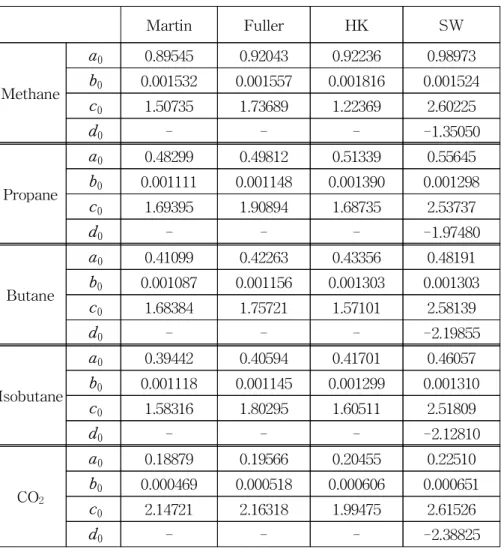
Table 2a Parameters a, b, c and d at the critical point for nonpolar substances ···19
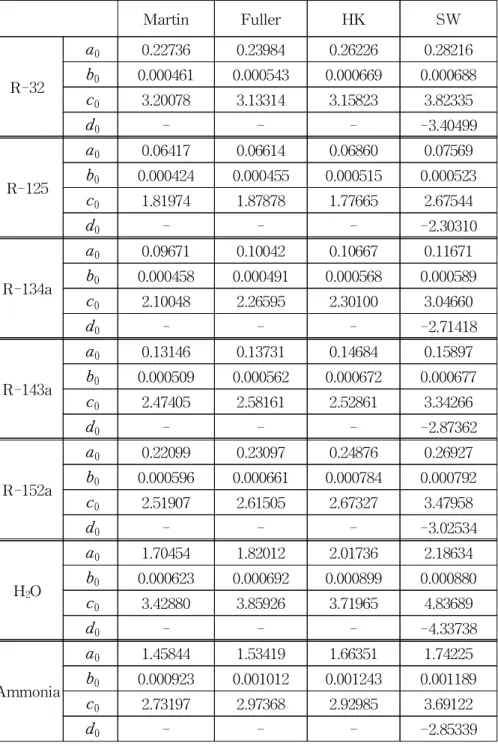
Table 2b Parameters a, b, c and d at the critical point for polar substances ···20
Table 3 β, ζ and Zcexp for substances ···21
Table 4 Optimized a1, c1 and d1 for substances ···22
Table 5a AAD and RMS of nonpolar substances ···23
Table 5b AAD and RMS of polar substances ···24
List of Figures
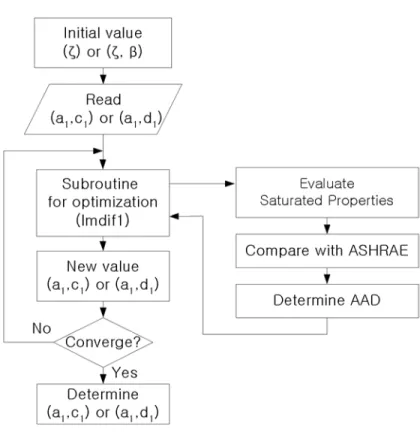
Fig. 1 Flow chart for optimization process ···15
Fig. 2 Deviations of saturation pressures using SW equation ···25
Fig. 3 Deviations of saturated liquid volumes using SW equation ···26
Fig. 4 Deviations of saturated vapor volumes using SW equation ···27
Nomenclatures
AAD : Average absolute deviation
BIAS : BIAS = 1
NDP
∑
DEV ( %) DEV : Deviation(%)NDP : Number of data points
RMS : Root mean squared deviation A : Constant ( = aP/R2T2)
a : Parameter in eqn of state B : Constant ( = bP/RT) b : Parameter in eqn of state C : Constant ( = cP/RT) c : Parameter in eqn of state d : Parameter in eqn of state
f : Fugacity [ kPa ]
g( v) : Function of volume
P : Pressure [ kPa ]
R : Gas constant [kJ/kg K]
T : Temperature [ K ]
v : Specific volume [m3/kg]
Z : Compressibility factor
Greeks
β : Constant ( = b/vc) δ : Constant
ζ : Constant
τ : Constant ( = 1/Tr- 1) φ : Fugacity coefficient ω : Acentric factor
Subscripts
A : Attraction R : Repulsion c : Critical point f : Saturated liquid g : Saturated vapor r : Reduced property
0 : Value at the critical point
Superscripts
cal : Calculated data exp : Experimental data
l : Saturated liquid state tbl : Data in ASHRAE Table
v : Saturated vapor state
1. 서론
염화불화탄소(CFC)는 우수한 열역학적, 화학적 성질과 높은 안정성 등으로 인해 지난 반세기 이상 동안 냉장고와 에어컨에 서 쓰이는 냉매, 스프레이 캔의 분사제, 전자회로판 등의 장치들 을 세척하기 위한 세정제 등 여러 분야에서 다양하게 사용되었 다. 그러나 대기중에 방출된 CFC계 화합물은 화학적으로 매우 안정하여 분해되지 않은채 약 15∼20년에 걸쳐 서서히 성층권까 지 확산되며, 일단 성층권에 도달하면 오랜 시간동안 성층권에 머무르며 태양의 자외선에 의해 분해되어 염소를 방출하여 오존 을 연쇄적으로 파괴한다. 이러한 이론들이 Molina 등(1)에 의해 발표된 이후, 1987년 CFC의 사용 및 생산의 규제에 대한 법적인 기준의 틀인 몬트리올 의정서(2)를 채택하였다. 따라서 현재 새로 운 대체냉매를 개발 중이거나 개발이 완료되었다.
대체냉매 개발에는 새로운 냉매의 개발, 천연냉매의 사용 그리 고 기존의 냉매를 혼합한 혼합냉매의 개발이 있다. 냉매는 우수 한 열역학적, 물리화학적 특성을 가짐과 동시에 환경친화적이어 야만 한다. 다시 말해, 에너지 효율이 높아야 하며, 오존층파괴 지수가 0이고 지구온난화 지수가 낮아야 하고, 독성 및 가연성이 없어야 한다.
열시스템을 해석하는데 있어서 알아야 하는 상태량들이 있다.
이러한 상태량들은 장기간의 정밀한 실험을 통한 측정이 필요하며
P - v- T의 관계를 나타내는 상태방정식을 이용하여 나타낼 수 있
다. 상태방정식에는 특정한 P - v - T 데이터로부터 상수들을 결정 하는 경험 상태방정식과 약간의 이론적 배경을 갖고 있는 일반 상 태방정식이 있다. 일반 상태방정식 중에 가장 오래된 식은 van der
Waals 식으로 1873년에 이상기체 모델에 약간의 이론적 수정을 가 한 식이다. 그외의 3차 상태방정식으로 2개의 매개변수가 있는 Soave(3), Redlich-Kwong(4), Peng-Robinson(5) 상태방정식 등이 있으 며, 3개의 매개변수가 있는 Martin(6), Fuller(7), Patel-Teja(8), Harmens-Knapp(9) 상태방정식 등이 있다. 또한 4개의 매개변수가 있는 Schmidt-Wenzel(10) 상태방정식 등이 있으며 계속 수정보완(11) 되고 있다. 국내에서도 이와 관련된 연구가 진행되었는데 박영무
(12,13)
는 Lee-Lesler 상태방정식을 이용한 CFC/HCFC계열의 혼합냉 매의 물성치 계산에 대한 연구와 대체냉매 R-32의 열역학적 물성과 R-22 대체냉매로서 열역학적 성능의 초기평가를 수행하였으며, 오 재균 등(14)은 Peng-Robinson의 상태방정식을 이용하여 혼합냉매의 상평형을 예측해 보았고, 박영무, 이흥원(15)은 R-134a의 열역학적 물 성치 계산과 냉동 성능에 관한 연구를 하였다. 김창년, 박영무(16.17)는 HFC125/134a계의 기-액평형에 관한 연구와 HFC-32/143a와 HFC-143a/134a계의 기-액평형에 대한 실험을 하였고, 강영복 등(18) 은 탄화수소 및 불화탄화수소의 기상-액상 평형에 관한 실험적인 연구를 수행하였다.
본 연구에서는 비극성 물질인 메탄, 프로판, 부탄, 이소부탄, 이산 화탄소와 극성 물질인 R-32, R-125, R-134a, R-143a, R-152a, 물, 암모니아를 대상으로 3개의 매개변수가 있는 3차 상태방정식 중 Martin, Fuller, Harmens-Knapp 상태방정식을, 그리고 4개의 매개 변수가 있는 Schmidt-Wenzel 상태방정식을 검토하고자 한다. 이러 한 상태방정식은 일반적으로 매개변수 중 한 개만을 온도의 함수로 간주한다. 그러나 본 연구에서는 식의 성능을 향상시키기 위하여 매 개변수 중 두 개를 온도의 함수로 간주하여 각 식의 성능을 비교 평가하고자 한다.
2. 3차 상태방정식의 형태
2.1 기본형태
온도 및 압력의 넓은 범위에 걸쳐 유체의 P - v - T 거동을 정확 히 묘사하기 위해서 상태방정식이 필요하다. 이러한 방정식은 기체 나 증기뿐만 아니라 액체에도 적용될 수 있어야 한다. 또한 식을 적 용하는데 있어서 수치 계산이나 혹은 해석적인 취급이 가능하도록 간단한 형태이어야 한다. 3차 상태방정식은 액체와 증기의 거동을 모두 설명할 수 있으며 비교적 간단한 형태의 방정식이다.
일반적으로 준경험적인 3차 상태방정식에서 압력은 다음과 같이 두 항의 합으로 나타낸다
P = PR+ PA (1)
여기서 PR은 척력항이고, PA는 인력항이다. 이러한 항에 주로 사 용되는 형태는 각각 다음과 같다.
PR= RT
v - b (2)
PA=- a
g( v) (3)
여기서 a는 분자간 인력에 대한 수정이며, 상수 b는 분자가 차지하 고 있는 공간을 수정한다. a와 b는 양수이며 이 값이 모두 0이면 이상기체 상태방정식이 된다. g( v)는 체적 v의 함수이다.
2.2 Martin 상태방정식
Martin 상태방정식(6)은 식(3)에서 체적의 함수인 g( v)를 ( v +1
2 cb)2으로 쓴 형태로 볼 수 있다.
P = RT
v - b- a ( v+1
2 cb)2
(4)
이 식을 압축성 인자 Z에 관하여 고쳐쓰면 다음과 같다.
Z3+ [ cB - ( 1 + B)]Z2 + [ A +1
4 c2B2- cB( 1 + B)]Z - [ AB +1
4 c2B2( 1 + B) ] = 0
(5)
여기서 Z, A, B는 다음과 같다.
Z = Pv
RT (6)
A = aP
R2T2 (7)
B = bP
RT (8)
P - v 선도 상에서 임계등온선은 임계점에서 수평 변곡점을 갖는
다. 따라서 임계점에서 체적에 대한 압력의 1차, 2차 도함수가 0이 되므로 다음과 같다.
(
∂P∂v)
Tc= 0 (9)
(
∂∂v2P2)
Tc= 0 (10)
Pcvc
RTc = Zc (11)
식(9)∼식(11)의 조건을 식(4)에 적용하면 매개변수 a, b, c의 임계 점에서 기준값 a0, b0, c0를 다음과 같이 구할 수 있다.
a0= ( 1 + βZc- Zc)3 R2Tc2
Pc (12)
b0= βZc RTc
Pc (13)
c0= 1 +1
β
[
Z1c- 3]
(14)여기서 Tc, Pc는 각각 물질의 임계온도, 임계압력이며 β는 다음과 같다.
β = b
vc (15)
또한 Zc는 수정 임계 압축성 인자이며, Zcexp는 임계 압축성 인자 의 실험값이다. 그 관계는 다음과 같으며 ζ는 비례상수이다.
Zc= ζ Zcexp (16)
Patel과 Teja(8), Abbott(19) 등은 실제 압축성 인자값과 수정 압축성 인자값의 비인 ζ가 약 1.1 정도일 때 식의 성능을 향상시킬 수 있 다고 주장한 바 있다. 따라서 실제 상태방정식에 사용되는 임계 압 축성 인자는 수정 임계 압축성 인자로서 임계 압축성 인자 실험값 과 차이가 있을 수 있다.
Martin 상태방정식에서 수정 임계 압축성 인자 Zc의 값은 다음과 같다.
Zc= 1
4( 1- β) (17)
포화상태량을 계산하기 위해서 압력단위를 갖는 물리량인 퓨개시
티 ( f )를 이용하며, 무차원화비인 퓨개시티 계수 φ는 다음과 같다.
φ≡ f
P (18)
식(4)를 퓨개시티를 나타내는 관계식
ln f P = ⌠⌡
P
0
(
RTv -P1)
dP (19)에 적용하면 다음과 같이 순수물질에 대한 퓨개시티 계수 식을 얻 을 수 있다.
ln f
P = Z- 1- ln ( Z - B) -A B ꀌ
ꀘ
︳︳
︳ B Z +1
2 cB ꀍ ꀙ
︳︳
︳ (20)
2.3 Fuller 상태방정식
Fuller 상태방정식(7)은 식(3)에서 체적함수 g( v)를 v( v + cb)로 쓴 형태로 다음과 같다.
P = RT
v - b- a
v( v + cb) (21)
이 식을 압축성 인자 Z에 관하여 고쳐쓰면 다음과 같다.
Z3+ [ ( c- 1)B - 1]Z2+ [ A - cB( 1 + B)]Z - AB = 0 (22)
Martin 상태방정식과 같은 방법으로 임계점에 대한 조건 식(9)∼
식(11)을 적용하면 매개변수 a, b, c의 임계점에서 기준값 a0, b0, c0의 표현식은 식(12)∼식(14)와 같다. 수정 임계 압축성 인자 Zc의 값은 다음과 같다.
Zc= 1
2( 1- β)3 [ β( 2β - 3) + β( 4- 3β)] (23)
임계점에서의 기준값 a0, b0, c0의 표현식은 Martin 식과 같으나 값 은 다르다. 그 이유는 β 와 Zc의 관계가 다르기 때문이다.
식(21)을 식(19)에 적용하면 다음과 같이 순수물질에 대한 퓨개시 티 계수 식을 얻을 수 있다.
ln f
P = Z - 1 - ln ( Z- B) -A B
1
c ln ( 1+cB
Z ) (24)
2.4 Harmens-Knapp 상태방정식
Harmens-Knapp (HK) 상태방정식(9)은 식(3)에서 체적의 함수인 g( v)를 v2+ cbv + ( 1 - c)b2로 쓴 형태로 다음과 같다.
P = RT
v- b - a
v2+ cbv+ ( 1 - c)b2 (25)
이 식을 압축성 인자 Z에 관하여 고쳐쓰면 다음과 같다.
Z3+ [ cB - ( 1 + B)]Z2 + [ A + B { ( 1- c)B - c ( 1 + B) }]Z - B [ A + ( 1 - c)B ( 1 + B)]= 0 (26)
Martin 상태방정식과 같은 방법으로 임계점에 대한 조건을 적용 하면 매개변수 a, b, c의 임계점에서 기준값 a0, b0,c0의 표현식은 식(12)∼식(14)와 같다. 수정 임계 압축성 인자 Zc의 값은 다음과 같다.
Zc= 2β2
( 1 - β)3 (27)
식(25)를 식(19)에 적용하면 다음과 같이 순수물질에 대한 퓨개시 티 계수 식을 얻을 수 있다.
ln f
P = Z - 1 - ln ( Z- B)
- A
B 1
δ ln ꀌ︳
︳︳
︳︳
︳︳ Z +1
2( c+ δ)B 1
ꀍ︳
︳︳
︳︳
︳︳
( δ > 0) (28)
ln f
P = Z - 1 - ln ( Z- B) -A
B ꀌ ꀘ
︳︳
︳ B Z +1
2 cB ꀍ ꀙ
︳︳
︳
( δ = 0) (29)
ln f
P = Z - 1 - ln ( Z- B) -A
B 1 1 2 - δ
ꀎ
ꀚ
︳︳
︳︳
︳︳
︳ π
2 - arctan ꀌ
ꀘ
︳︳
︳︳
︳︳
︳ Z +1
2 cB 1
2 - δB ꀍ
ꀙ
︳︳
︳︳
︳︳
︳ ꀏ
ꀛ
︳︳
︳︳
︳︳
︳
( δ < 0) (30)
여기서 δ = c2+ 4c - 4 이다.
2.5 Schmidt-Wenzel 상태방정식
Schmidt-Wenzel (SW) 상태방정식(10)은 식(3)에서 체적의 함수인 g( v)를 v2+ cbv + db2로 쓴 형태로 다음과 같다.
P = RT
v - b- a
v2+ cbv + db2 (31)
이 식에서 d를 c2/4으로 대체하면 Martin 식이 되며, d를 0으로 대체하면 Fuller 식이 된다. 또한 d를 1 - c로 대체하면 HK 식이 된다. 위 식을 압축성 인자 Z에 관하여 고쳐쓰면 다음과 같다.
Z3+ [ cB - ( 1 + B)]Z2 + [ A + B { dB - c ( 1 + B) }]Z
- B [ A + dB( 1+ B )] = 0 (32)
식(9)∼식(11)의 조건으로 매개변수 a, b, c, d의 임계점에서 기 준값 a0, b0, c0, d0를 구할 수 있다. a0, b0, c0의 표현식은 식(1 2)∼식(14)와 같고 d0는 다음과 같다.
d0= 1
β2Zc
[
( 1- β)3Z2c+ β( 3- 2β)Zc- β]
(33)식(31)을 식(19)에 적용하면 순수물질에 대한 퓨개시티 계수 식을 얻을 수 있는데 그 표현식은 식(28)∼식(30)과 같다. 그러나 SW 상 태방정식에서 δ = c2- 4d 이다.
3. 상태방정식의 성능비교
3.1 대상물질
본 연구의 대상물질은 주로 냉매로 쓰이는 물질로서 비극성 물질 인 메탄, 프로판, 부탄, 이소부탄, 이산화탄소와 극성 물질인 R-32, R-125, R-134a, R-143a, R-152a, 물, 암모니아이다. 이들에 대한 포 화상태량 값은 ASHRAE Table의 데이터(20.21)를 이용하였다.
Table 1에 각 물질의 임계점에서 상태량 값과 식의 성능평가에 사용된 각 물질의 Tr 범위와 데이터의 개수인 NDP 그리고 이심인 자 w를 나타내었다. 여기서 Tr은 환산온도로서 Tr= T/Tc이다.
이심인자 w는 다음의 정의에 의해서 구해진다.
w≡ - 1.0 - log ( Psatr )Tr= 0.7 (34)
이 정의에 의해서 이심인자 w는 임의의 유체에 대해서 Tc, Pc 그
리고 Tr= 0.7에서의 증기압에 의해 결정된다. 같은 w값을 갖는 모
든 유체들은 같은 Tr, Pr에서 대체로 유사한 Z값을 가지며 이상기 체 거동에서 벗어나는 정도도 거의 같다.
각 물질의 임계상태량 값과 상태방정식을 이용하여 포화상태량을 계산하고, 이렇게 계산된 포화상태량과 ASHRAE Table의 포화상태 량을 비교함으로써 상태방정식의 성능을 평가하고자 한다.
또한 본 연구에서는 Tr=0.95 이하의 포화상태량 데이터만을 사용 했다. 이것은 본질적으로 3차 상태방정식이 임계점 부근에서의 포화 상태량을 예측하는 목적으로 사용하기에는 부적절하기 때문이다.
Table 1 Critical data(20,21), Tr range, NDP and acentric factor for substances
Tc(K) Pc(kPa) vc(m3/kg) Tr range NDP w Methane 190.555 4595.0 0.00617 0.476∼0.945 61 0.010
Propane 369.85 4247.7 0.00454 0.468∼0.941 58 0.152 Butane 425.16 3796.0 0.00439 0.513∼0.948 54 0.199 Isobutane 407.85 3640.0 0.00446 0.498∼0.939 53 0.185 CO2 304.13 7377.3 0.00214 0.712∼0.947 52 0.224 R-32 351.56 5857.9 0.00238 0.612∼0.948 61 0.278 R-125 339.17 3629.0 0.00176 0.509∼0.947 61 0.306 R-134a 374.18 4056.0 0.00195 0.570∼0.944 60 0.327 R-143a 345.86 3761.0 0.00232 0.530∼0.946 58 0.261 R-152a 386.41 4516.8 0.00272 0.526∼0.940 62 0.275 H2O 647.1 22064.0 0.00311 0.538∼0.948 51 0.344 Ammonia 405.4 11332.0 0.00444 0.526∼0.945 61 0.256
3.2 포화상태량을 이용한 상태방정식의 최적화
Martin, Fuller, HK 상태방정식에서 매개변수 중 일반적으로 a만 을 온도의 함수로 간주한다. 그러나 본 연구에서는 식의 성능을 향 상 시키기 위해 매개변수 b는 상수로 간주하고(22), a와 c를 온도의 함수로 다음과 같이 정하였다.
a( T) = a0[ 1+a1τ] (35)
c( T) = c0[1 +c1τ] (36)
여기서 τ = 1 /Tr- 1이다. Tr= T /Tc로서 물질의 환산온도이며, T = Tc이면 a = a0, c = c0가 된다. a, c의 형태를 식(35)∼식(36)과 같은 형태로 결정한 것은 퓨개시티를 이용하여 a, c의 거동을 예측 한 결과 각각 1/Tr에 비례하는 형태로 나타났기 때문이다. 4개의 매개변수가 있는 SW 상태방정식에서는 a, d를 온도의 함수로 정하 고 b, c는 상수로 간주하였다. c값을 상수로 정한 것은 온도변화에 따른 c값의 변화가 크지 않기 때문이다. a의 형태는 식(35)와 같고
d의 형태는 다음과 같다.
d( T) = d0+ d1τ (37)
d의 형태를 식(37)과 같이 결정한 것은 역시 퓨개시티를 이용하여 a, d의 거동을 예측해 본 결과 각각 1/Tr에 비례하는 형태로 나타 났기 때문이다. 따라서 값을 결정해야 하는 변수들은 Martin, Fuller, HK 식의 경우 ζ, a1, c1이며, SW 식의 경우 ζ, β, a1, d1이다.
퓨개시티 f는 각 상태방정식을 퓨개시티를 나타내는 관계식인 식 (19)에 대입하여 계산한다. 포화상태량을 계산하기 위해 포화상태일 경우 포화증기와 포화액체의 퓨개시티는 같다라는 다음의 조건을 이용한다.(23)
fv= fl (38)
여기서 상첨자 v, l은 각각 포화증기, 포화액체를 나타낸다.
식(38)의 조건하에서 임계상태량과 상태방정식을 이용하여 계산한 포화상태량과 ASHRAE Table의 데이터와의 포화증기압, 포화액체 비체적, 포화증기 비체적과의 평균절대편차(AAD)를 최소화 하도록 변수들을 최적화한다. 최적화는 MINPACK(24)을 이용한다. Fig. 1에 는 최적화 과정에 대한 순서도를 나타내었다. 이러한 과정을 통해 얻어진 AAD와 분산의 의미를 가지는 제곱평균 제곱근(RMS)을 이 용하여 각 식의 성능을 비교 평가한다.
상태량 X에 대한 AAD와 RMS는 다음과 같이 계산한다.
AAD= 1
NDP
∑
|DEV | ( %) (39)RMS= 1
NDP
∑
( DEV- BIAS )2 (40)여기서 DEV와 BIAS는 다음과 같다.
DEV = X cal- X tbl
X tbl ×100 (%) (41)
BIAS= 1
∑
DEV (%) (42)또한 X cal은 상태방정식에 의해서 계산된 값이고 X tbl은 ASHRAE Table의 데이터값이다. NDP는 데이터의 개수이다.
Fig. 1 Flow chart for optimization process
3.3 포화상태량 계산 결과
Table 2a에 비극성물질인 메탄, 프로판, 부탄, 이소부탄 그리고 이 산화탄소에 대한 임계점에서의 기준값인 a0, b0, c0,d0의 값을 나타 내었다. 전반적으로 b0의 값은 작게 나타났으며 특히 이산화탄소의 경우 더 작게 나타났다. SW 상태방정식에서 a0, b0, c0는 양수이 나 d0는 모두 음수로 나타났다. Table 2b에는 극성물질인 R-32, R-125, R-134a, R-143a, R-152a, 물 그리고 암모니아에 대한 임계 점에서의 기준값을 나타내었다. 온도에 대한 편차의 경향은 비극성 물질과 비슷하게 나타났다.
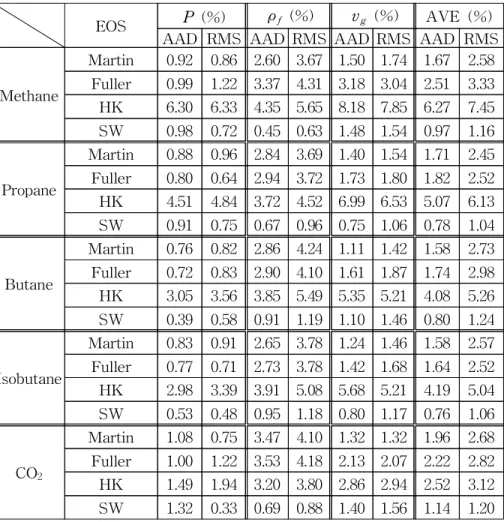
Table 3에는 최적화 과정을 통해 얻어진 β, ζ값을 나타내었다.
Martin, Fuller, HK 상태방정식의 경우 ζ값은 1.10∼1.29로 나타났 으며 β값은 0.156∼0.230으로 나타났다. SW 상태방정식의 ζ값은 1.03∼1.09로 나타났으며 β값은 0.24∼0.29로 나타났다. 전반적으로 Martin, Fuller, HK 상태방정식이 SW 상태방정식보다 ζ값은 크고 β값은 작게 나타났다. 한편, Patel과 Teja(8), Abbott(19)는 ζ값이 1보 다 클때 (약 1.1 정도) 식의 성능을 향상시킬 수 있다고 주장하였다.
본 연구에서도 최적의 ζ값이 식에 따라 약간씩 차이가 있으나 1.0 3∼1.29 정도로 1보다 크게 나타났다.
Table 4에는 최적화 과정을 통해 얻어진 a1, c1 및 d1의 값을 나 타내었다. 비극성물질, 극성물질 구분없이 비슷한 값들을 가지는 것 으로 나타났다.
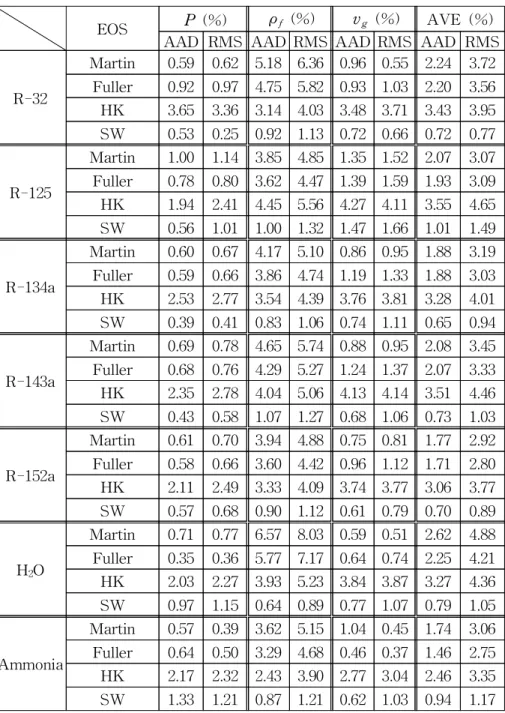
Table 5a와 Table 5b에는 포화압력 P, 포화액체 비체적 vf, 포 화증기 비체적 vg의 AAD와 RMS를 나타내었다. 포화압력 P의 예 측에 있어서 HK 상태방정식은 1∼6%의 AAD로 성능이 가장 좋지
않았으며 Martin, Fuller, SW 상태방정식은 1% 내외의 AAD로 비 슷한 정도의 성능을 나타내었다. 반면 포화액체 비체적 vf의 예측에 있어서는 약 2∼6%의 AAD를 가지는 다른 상태방정식보다 SW 상 태방정식의 성능이 상당히 좋았다. 즉, SW 상태방정식은 1% 미만 의 편차를 나타내었다. 포화증기 비체적 vg의 예측에 있어서는 물질 에 따라 조금씩 다르나 전반적으로 SW, Martin, Fuller, HK 상태방 정식 순으로 그 성능이 좋았다. 포화압력, 포화액체 비체적 그리고 포화증기 비체적의 평균 AAD를 살펴보면 SW 상태방정식이 모든 물질에 대해서 1% 내외의 AAD와 RMS를 보임으로써 그 성능이 우수함을 알 수 있다. 3개의 매개변수가 있는 식들 중에서 비극성물 질에서는 Martin 식이 Fuller 식보다 그 성능이 좀 더 우수하였으나 극성물질에서는 이와는 반대로 Fuller 식이 Martin 식보다 성능이 좀 더 좋은 것으로 나타났다. 반면 HK 상태방정식은 그 성능이 다 른 식들이 비해 상당히 좋지 않았다.
Fig. 2∼Fig. 4에는 본 연구의 결과 성능이 가장 우수하다고 판단 되는 SW 상태방정식을 이용하여 비극성물질과 극성물질에 대한 포 화압력 P, 포화액체 비체적 vf, 포화증기 비체적 vg의 편차를 나타 내었다. Fig. 2(a)에는 비극성물질에 대한 포화압력의 편차를 나타내 었다. 포화압력에 대한 편차는 최대 3%까지 나타났으나 저온 영역 에 한정되어 있고 대부분은 2% 이내의 편차를 보이고 있다. Fig.
2(b)는 극성물질에 대한 포화압력의 편차를 나타내었다. 비극성물질 과 마찬가지로 저온부에서는 좀 큰 편차가 나타났으나 고온부로 갈 수록 그 편차는 작아지고 있다.
Fig. 3(a)와 Fig. 3(b)에는 포화액체 비체적에 관한 편차를 나타내 었다. 저온영역과 고온영역에서 약간 큰 편차를 나타내고 있으나 실 제 응용영역에서 비극성물질의 경우 1.5% 미만의 편차가, 극성물질
의 경우 2% 미만의 편차가 나타났다. 메탄과 물의 경우는 저온영역 에서도 편차가 아주 작게 나타났다.
Fig. 4(a)와 Fig. 4(b)에는 포화증기 비체적에 관한 편차를 나타내 었다. 이것도 포화액체 비체적과 마찬가지로 저온영역과 고온영역에 서 약간 큰 편차를 나타났으나 실제 응용영역에서는 2% 미만의 편 차가 나타났다.
Table 2a Parameters a, b, c and d at the critical point for nonpolar substances.
Martin Fuller HK SW
Methane
a0 0.89545 0.92043 0.92236 0.98973
b0 0.001532 0.001557 0.001816 0.001524
c0 1.50735 1.73689 1.22369 2.60225
d0 - - - -1.35050
Propane
a0 0.48299 0.49812 0.51339 0.55645
b0 0.001111 0.001148 0.001390 0.001298
c0 1.69395 1.90894 1.68735 2.53737
d0 - - - -1.97480
Butane
a0 0.41099 0.42263 0.43356 0.48191
b0 0.001087 0.001156 0.001303 0.001303
c0 1.68384 1.75721 1.57101 2.58139
d0 - - - -2.19855
Isobutane
a0 0.39442 0.40594 0.41701 0.46057
b0 0.001118 0.001145 0.001299 0.001310
c0 1.58316 1.80295 1.60511 2.51809
d0 - - - -2.12810
CO2
a0 0.18879 0.19566 0.20455 0.22510
b0 0.000469 0.000518 0.000606 0.000651
c0 2.14721 2.16318 1.99475 2.61526
d0 - - - -2.38825
Table 2b Parameters a, b, c and d at the critical point for polar substances.
Martin Fuller HK SW
R-32
a0 0.22736 0.23984 0.26226 0.28216
b0 0.000461 0.000543 0.000669 0.000688
c0 3.20078 3.13314 3.15823 3.82335
d0 - - - -3.40499
R-125
a0 0.06417 0.06614 0.06860 0.07569
b0 0.000424 0.000455 0.000515 0.000523
c0 1.81974 1.87878 1.77665 2.67544
d0 - - - -2.30310
R-134a
a0 0.09671 0.10042 0.10667 0.11671
b0 0.000458 0.000491 0.000568 0.000589
c0 2.10048 2.26595 2.30100 3.04660
d0 - - - -2.71418
R-143a
a0 0.13146 0.13731 0.14684 0.15897
b0 0.000509 0.000562 0.000672 0.000677
c0 2.47405 2.58161 2.52861 3.34266
d0 - - - -2.87362
R-152a
a0 0.22099 0.23097 0.24876 0.26927
b0 0.000596 0.000661 0.000784 0.000792
c0 2.51907 2.61505 2.67327 3.47958
d0 - - - -3.02534
H2O
a0 1.70454 1.82012 2.01736 2.18634
b0 0.000623 0.000692 0.000899 0.000880
c0 3.42880 3.85926 3.71965 4.83689
d0 - - - -4.33738
Ammonia
a0 1.45844 1.53419 1.66351 1.74225
b0 0.000923 0.001012 0.001243 0.001189
c0 2.73197 2.97368 2.92985 3.69122
d0 - - - -2.85339
Table 3 β, ζ and Zcexp for substances
ZCexp
Martin Fuller HK SW
ζ β ζ β ζ β ζ β
Methane 0.287 1.12 0.222 1.10 0.230 1.14 0.258 1.03 0.24 Propane 0.276 1.15 0.213 1.13 0.224 1.14 0.255 1.06 0.27 Butane 0.274 1.16 0.214 1.15 0.229 1.16 0.256 1.06 0.28 Isobutane 0.278 1.15 0.218 1.13 0.227 1.14 0.256 1.05 0.28 CO2 0.275 1.13 0.194 1.12 0.216 1.12 0.253 1.05 0.29 R-32 0.248 1.20 0.161 1.18 0.193 1.14 0.246 1.07 0.27 R-125 0.272 1.16 0.208 1.15 0.225 1.15 0.255 1.06 0.28 R-134a 0.259 1.20 0.196 1.18 0.214 1.16 0.251 1.08 0.28 R-143a 0.255 1.20 0.183 1.18 0.205 1.16 0.250 1.08 0.27 R-152a 0.253 1.21 0.181 1.19 0.205 1.16 0.249 1.08 0.27 H2O 0.230 1.29 0.156 1.24 0.180 1.19 0.243 1.09 0.26 Ammonia 0.254 1.19 0.175 1.16 0.196 1.13 0.248 1.07 0.25
Table 4 Optimized a1, c1 and d1 for substances
Martin Fuller HK SW
a1 c1 a1 c1 a1 c1 a1 d1
Methane 0.8977 1.2341 1.0754 2.0825 0.7358 2.2854 0.6609 5.6321 Propane 1.0779 1.0438 1.2338 1.7632 1.0873 2.5375 0.6380 2.3187 Butane 1.1458 1.0392 1.2224 1.5922 1.4435 3.8696 0.6051 1.5207 Isobutane 1.0964 1.0102 1.2201 1.6190 1.4563 3.9720 0.6007 1.5541 CO2 1.2754 1.0774 1.1194 1.0612 0.8277 0.7741 0.5961 1.2595 R-32 1.3977 0.9754 1.3584 1.3662 0.8033 0.7366 0.5536 1.1978 R-125 1.3135 0.9881 1.3834 1.5219 1.7277 4.0451 0.7082 1.3972 R-134a 1.3491 0.9325 1.3735 1.3399 1.1856 1.6835 0.6812 1.2783 R-143a 1.2764 0.9181 1.3048 1.3693 1.3466 2.4489 0.6001 1.4293 R-152a 1.2904 0.9001 1.3222 1.3587 1.4097 2.5437 0.6087 1.4803 H2O 1.4402 0.8578 1.5361 1.4595 1.6270 2.6422 0.5823 1.4999 Ammonia 1.2449 0.8523 1.2700 1.2810 1.3444 2.3859 0.5934 1.5752
Table 5a AAD and RMS of nonpolar substances
EOS P (%) ρf (%) vg (%) AVE (%) AAD RMS AAD RMS AAD RMS AAD RMS
Methane
Martin 0.92 0.86 2.60 3.67 1.50 1.74 1.67 2.58 Fuller 0.99 1.22 3.37 4.31 3.18 3.04 2.51 3.33 HK 6.30 6.33 4.35 5.65 8.18 7.85 6.27 7.45 SW 0.98 0.72 0.45 0.63 1.48 1.54 0.97 1.16
Propane
Martin 0.88 0.96 2.84 3.69 1.40 1.54 1.71 2.45 Fuller 0.80 0.64 2.94 3.72 1.73 1.80 1.82 2.52 HK 4.51 4.84 3.72 4.52 6.99 6.53 5.07 6.13 SW 0.91 0.75 0.67 0.96 0.75 1.06 0.78 1.04
Butane
Martin 0.76 0.82 2.86 4.24 1.11 1.42 1.58 2.73 Fuller 0.72 0.83 2.90 4.10 1.61 1.87 1.74 2.98 HK 3.05 3.56 3.85 5.49 5.35 5.21 4.08 5.26 SW 0.39 0.58 0.91 1.19 1.10 1.46 0.80 1.24
Isobutane
Martin 0.83 0.91 2.65 3.78 1.24 1.46 1.58 2.57 Fuller 0.77 0.71 2.73 3.78 1.42 1.68 1.64 2.52 HK 2.98 3.39 3.91 5.08 5.68 5.21 4.19 5.04 SW 0.53 0.48 0.95 1.18 0.80 1.17 0.76 1.06
CO2
Martin 1.08 0.75 3.47 4.10 1.32 1.32 1.96 2.68 Fuller 1.00 1.22 3.53 4.18 2.13 2.07 2.22 2.82 HK 1.49 1.94 3.20 3.80 2.86 2.94 2.52 3.12 SW 1.32 0.33 0.69 0.88 1.40 1.56 1.14 1.20
Table 5b AAD and RMS of polar substances
EOS P (%) ρf (%) vg (%) AVE (%) AAD RMS AAD RMS AAD RMS AAD RMS
R-32
Martin 0.59 0.62 5.18 6.36 0.96 0.55 2.24 3.72 Fuller 0.92 0.97 4.75 5.82 0.93 1.03 2.20 3.56 HK 3.65 3.36 3.14 4.03 3.48 3.71 3.43 3.95 SW 0.53 0.25 0.92 1.13 0.72 0.66 0.72 0.77
R-125
Martin 1.00 1.14 3.85 4.85 1.35 1.52 2.07 3.07 Fuller 0.78 0.80 3.62 4.47 1.39 1.59 1.93 3.09 HK 1.94 2.41 4.45 5.56 4.27 4.11 3.55 4.65 SW 0.56 1.01 1.00 1.32 1.47 1.66 1.01 1.49
R-134a
Martin 0.60 0.67 4.17 5.10 0.86 0.95 1.88 3.19 Fuller 0.59 0.66 3.86 4.74 1.19 1.33 1.88 3.03 HK 2.53 2.77 3.54 4.39 3.76 3.81 3.28 4.01 SW 0.39 0.41 0.83 1.06 0.74 1.11 0.65 0.94
R-143a
Martin 0.69 0.78 4.65 5.74 0.88 0.95 2.08 3.45 Fuller 0.68 0.76 4.29 5.27 1.24 1.37 2.07 3.33 HK 2.35 2.78 4.04 5.06 4.13 4.14 3.51 4.46 SW 0.43 0.58 1.07 1.27 0.68 1.06 0.73 1.03
R-152a
Martin 0.61 0.70 3.94 4.88 0.75 0.81 1.77 2.92 Fuller 0.58 0.66 3.60 4.42 0.96 1.12 1.71 2.80 HK 2.11 2.49 3.33 4.09 3.74 3.77 3.06 3.77 SW 0.57 0.68 0.90 1.12 0.61 0.79 0.70 0.89
H2O
Martin 0.71 0.77 6.57 8.03 0.59 0.51 2.62 4.88 Fuller 0.35 0.36 5.77 7.17 0.64 0.74 2.25 4.21 HK 2.03 2.27 3.93 5.23 3.84 3.87 3.27 4.36 SW 0.97 1.15 0.64 0.89 0.77 1.07 0.79 1.05
Ammonia
Martin 0.57 0.39 3.62 5.15 1.04 0.45 1.74 3.06 Fuller 0.64 0.50 3.29 4.68 0.46 0.37 1.46 2.75 HK 2.17 2.32 2.43 3.90 2.77 3.04 2.46 3.35 SW 1.33 1.21 0.87 1.21 0.62 1.03 0.94 1.17
(a)
(b)
Fig. 2 Deviations of saturation pressures using SW equation
(a) nonpolar substances (b) polar substances
(a)
(b)
Fig. 3 Deviations of saturated liquid volumes using SW equation
(a) nonpolar substances (b) polar substances
(a)
(b)
Fig. 4 Deviations of saturated vapor volumes using SW equation
(a) nonpolar substances (b) polar substances
4. 결론
비극성 물질인 메탄, 프로판, 부탄, 이소부탄, 이산화탄소와 극성 물질인 R-32, R-125, R-134a, R-143a, R-152a, 물 그리고 암모니아 를 대상으로 하여 3개의 매개변수가 있는 Martin, Fuller, Harmens -Knapp 상태방정식과 4개의 매개변수가 있는 Schmidt-Wenzel 상 태방정식을 최적화하여 포화상태량 계산성능을 비교 평가하였다. 비 교 평가의 기준으로 ASHRAE Table의 데이터를 이용했다. 기존의 식들에서 일반적으로 매개변수 중 한 개를 온도의 함수로 간주하였 으나 식의 성능을 향상시키기 위해 매개변수 중 두 개를 온도의 함 수로 간주하였다.
포화압력 예측에 있어서 Harmens-Knapp 상태방정식을 제외한 나머지 식들은 물질에 따라 약간의 차이가 있었지만 1% 내외의 편 차로 그 성능이 비슷하게 나타났다. 포화액체 비체적의 예측에 있어 서는 3개의 매개변수가 있는 Martin, Fuller, Harmens-Knapp 상태 방정식이 2∼6%의 편차를 나타내는 반면 Schmidt-Wenzel 상태방 정식은 모든 물질에 대하여 1% 미만의 편차를 보임으로써 성능이 가장 우수하였다. 포화증기 비체적의 예측에 있어서도 Schmidt -Wenzel 상태방정식이 가장 성능이 좋았다. 3개의 매개변수가 있는 식들 중에서는 비극성물질에 대해 Martin 상태방정식이, 극성물질에 대해서는 Fuller 상태방정식이 우수하였다. 그러나 4개의 매개변수가 있는 Schmidt-Wenzel 상태방정식이 포화압력, 포화액체 비체적, 포 화증기 비체적을 예측하는데 있어서 모두 1% 내외의 편차로 성능이 가장 좋았다. 따라서 포화상태량을 예측함에 있어서 2개의 온도 의 존 매개변수가 있는 Schmidt-Wenzel 상태방정식을 사용하는 경우 비교적 정확한 결과를 얻을 수 있을 것으로 생각된다.
References
(1) Molina, M. J., and Rowland, F. S., 1974, “Stratospheric sink for chlorofluoromethanes : Chlorine atom catalyzed destruction of ozone”, Nature, Vol. 249, pp. 810-814.
(2) Montreal Protocol on Substances That Deplete the Ozone Layer, 1987, Final Act, United Nations Environment Programme.
(3) Soave, C., 1972, "Equilibrium constants from a modified Redlich-Kwong equation of state," Chemical Engineering Science, Vol. 27, pp. 1197-1203.
(4) Redlich, O. and Kwong, J. N. S., 1949, "On the thermodynamics of solutions. V: An equation of state.
Fugacities of gaseous solutions," Chem. Rev, Vol. 44, pp.
233-244.
(5) Peng, D. Y. and Robinson, D. B., 1976, "A new two-constant equation of state," Ind. Eng. Chem. Fundam., Vol. 15, No. 1, pp. 59-64.
(6) Martin, J. J., 1967, "Equations of state," Ind. Eng. Chem.
Fundam., Vol. 59, pp. 34-52.
(7) Fuller, G. G., 1976, "A modified Redlich-Kwong-Soave equation of state capable of representing the liquid state,"
Ind. Eng. Chem. Fundam., Vol. 15, No. 4, pp. 254-257.
(8) Patel, N. C. and Teja, A. S., 1982, "A new cubic equation of state for fluids and fluid mixtures," Chemical Engineering Science, Vol. 37, No. 3, pp 463-473.
(9) Harmens, A. and Knapp, H., 1980, "Three-parameter cubic equation of state for normal substance," Ind. Eng. Chem.
Fundam., Vol. 19, No. 3, pp. 291-294.
(10) Schmidt, G. and Wenzel, H., 1980, "A modified van der Waals type equation of state," Chemical Engineering Science, Vol. 35, pp. 1503-1512.
(11) Ji, W. R. and Lempe, D. A., 1998, "A systematic study of cubic three-parameter equations of state for deriving a structually optimized PVT relation," Fluid Phase Equilibria, Vol. 147, pp. 85-103.
(12) 박영무, 1991, “Lee-Kesler 상태식을 이용한 CFC/HCFC계열 혼합 냉매의 열역학적 물성치 계산에 관한 연구”, 대한기계학회 춘계학술대회논문집, pp. 73-76.
(13) 박영무, 1993, “대체냉매 R-32(Difluoromethane)의 열역학적 물 성과 R-22 대체냉매로서 열역학적 성능의 초기 평가”, 공기조 화 냉동공학 논문집, 제5권 제2호, pp. 141-155.
(14) 오재균, 함성훈, 홍재호, 곽호영, 1991, “Peng-Robinson 상태 방정식을 이용한 혼합 냉매의 상평형 예측”, 대한기계학회 추계학술대회논문집, pp. 506-509.
(15) 박영무, 이흥원, 1991, “R-134a의 열역학적 물성치 계산과 냉동 성능에 관한 연구”, 공기조화 냉동공학 논문집, 제3권 제4호, pp. 286-296.
(16) 김창년, 박영무, 1998, “HFC125/134a계의 기-액평형에 관한 연구”, 공기조화·냉동공학 논문집 제10권 제2호, pp.
238-250.
(17) 김창년, 박영무, 1999, “HFC-32/143a와 HFC-143a/134a계의 기-액평형 실험에 관한 연구” 공기조화·냉동공학 논문집 제11권 제1호, pp. 91-99.
(18) 강영복, 김민수, 김영일, 2000, “탄화수소 및 불화탄화수소의 기 상-액상 평형에 관한 실험적 연구”, 설비공학 논문집 제12권 제11호, pp.1031-1037.
(19) Abbott, M. M., 1979, "Cubic equations of state: An interpretive review," In Equations of State in Engineering Research (Edited by Chao, K. C. and Robinson, R. L.), Advances in Chemistry Series 182, American Chem. Soc., Washington, pp. 47-70.
(20) ASHRAE, 1997, ASHRAE Handbook Fundamentals, ASHRAE, Atlanta, Chap. 19.
(21) ASHRAE, 2001, ASHRAE Handbook Fundamentals, ASHRAE, Atlanta, Chap. 20.
(22) Salim, P. H. and Trebble, M. A., 1991, "Modified Trebble- Bishnoi equation of state. Thermodynamic consistency
revisited," Fluid Phase Equilibria, Vol. 65, pp. 59-71.
(23) Smith, J. M., Van Ness, H. C., Abbott, M. M., 1996, Introduction to Chemical Engineering Thermodynamics, 5th Ed., McGraw-Hill, pp. 334.
(24) Burton, S. G., Kenneth, E. H., Jorge, J. M., 1980,
"MINPACK", Argonne National Laboratory.
Abstract
Performance Comparison of Cubic Equations of State With Two Temperature Dependent Parameters
by Kwon, Young-Wook
Dept. of Mechanical Engineering Graduate School, Kookmin University.
Seoul, Korea
As it became known that CFCs used as refrigerants destory ozone layer, many countries adopted the Montreal Protocol which is the basic standard of law as for CFC usage restriction.
Therefore new refrigerants are needed with some favorable characteristics - zero ozone depletion potential, low global warming potential, no toxicity and no inflammability. Analyzing the system with a new substance as a working fluid requires knowledge of thermodynamic properties, which can be calculated by using equation of state. This is the motivation to modify the existing cubic equations of state in order to improve the performance of saturation property prediction.
In this study, nonpolar substances such as methane, propane, butane, isobutane, carbon dioxide and polar ones such as R-32, R-125, R-134a, R-143a, R-152a, H2O, ammonia are used to compare the performance of equations of state among Martin, Fuller, Harmens-Knapp and Schmidt-Wenzel equation of state.
These equations of state generally have only one temperature dependent parameter. In order to improve the performance, we however assume that two parameters are temperature dependent parameters. That is, a( T) = a0[ 1+a1τ], c( T) = c0[ 1+c1τ] for Martin, Fuller, Harmens-Knapp and d( T) = d0+ d1τ for Schmidt-Wenzel equation of state, where τ = 1/T - 1.
Among equations of state examined in this study, Schmidt-Wenzel equation appears to be the choice for calculation of saturation properties such as vapor pressures, saturated liquid volumes, and saturated vapor volumes with an average absolute deviation of about one percent over the entire region excluding the near critical.