1
REVIEW ARTICLE
비뇨기계의 정상발생
Normal Development of the Urinary System
Hongtae Kim
From the D epartm ent of Anatom y, Catholic U niversity of D aegu, School of M edicine, D aegu, K orea
김홍태
대구가톨릭대학교 의과대학 해부학교실
Congenital anomalies of the kidney and urinary tract (CAKUT) occur in 2.3 in 1,000 births and have a major role in pediatric renal failure. To understand the pathogenesis of human CAKUT, it is essential to consider how the kidneys and urinary tract develop. The urinary system develops from the intermediate mesoderm along the posterior embryonic wall.
Initially, the excretory ducts of this system enter the cloaca. The kidneys arise from the ureteric bud and metanephric mesenchyme via reciprocal inductive tissue interactions. These interactions along with subsequent formation of nephrons and collecting system are dependent on high- ly-regulated genetic programs. In this review, we discuss the morpho- logical and molecular steps required for urinary system development.
Key Words: Kidney development, Metanephric blastema, Metanephros, Ureteric bud, CAKUT
(Received: May 11, 2011, Accepted: June 11, 2011)
교신저자 김홍태
대구가톨릭대학교 의과대학 해부학교실
대구시 남구 대명4동 3056-6, 705-718
Tel: 053-650-4479 Fax: 053-652-2690 E-mail: htaekim@cu.ac.kr
서 론
비뇨계통은 혈액으로부터 수용성 노폐물을 여과하 여 소변을 만들고 저장하며 몸 밖으로 배출시킨다. 사 람을 포함한 척추동물에서 비뇨계통의 발생은 배아 초기에 시작된다. 비뇨계통은 복잡한 발생과정을 거 치므로, 비정상적인 발생의 확률이 높다. EUROCAT (European Surveillance of Congenital Anomalies)는 2003- 2007년 동안 유럽에서 보고된 주요 선천이상 중에서 비뇨계통이상이 1,000명당 2.3명으로 선천심장병과 팔다리이상 다음으로 발생 빈도가 높다고 발표하였 다.1 선천신장요로이상 (CAKUT)은 소아에서 가장 흔 한 신부전의 원인이다. 태어날때 신장단위 (nephron)의 수는 태아시기에 결정되며, 이것으로 신장 질환이나 고혈압의 위험도를 예측할 수 있다. 신장단위 수의가 감소된 경우 이들 질환에 대한 위험도가 상당히 높다 고 알려져 있다.2 신장과 요로의 선천기형은 해부와 조직학적으로 다양한 양상을 보이지만, 모두 정상적
인 비뇨계통발생과정의 결함에 의한 것이다. 선천신 장요로이상의 발생 기전을 이해하고, 이로 인한 이차 적인 신장과 심장혈관계통의 질환으로 진행을 늦추 고 새로운 치료 전략을 개발하기 위해서는 비뇨계통 의 정상 발생과정에 대한 형태 및 분자생물학적 이해 가 필요할 것이다.
본 론 1. 비뇨계통의 형태발생
비뇨계통은 배아의 중간중배엽 (intermediate meso- derm)에서 발생한다. 발생 4주 동안 편평한 배아의 양 쪽 가장자리 끝 부분이 몸통앞쪽으로 접히고 말리면 서 배아가 원통모양이 되는 과정에서 중간중배엽은 몸분절 (somite)과 분리되어 앞쪽으로 이동한다. 분화 중인 중간중배엽이 등쪽대동맥 양쪽에서 세로로 길 게 도드라진 비뇨생식능선 (urogenital ridge)을 형성한 다. 이 능선은 다시 바깥쪽의 신장형성삭 (nephrogenic cord)과 안쪽의 생식능선 (genital ridge)로 나뉜다. 신장
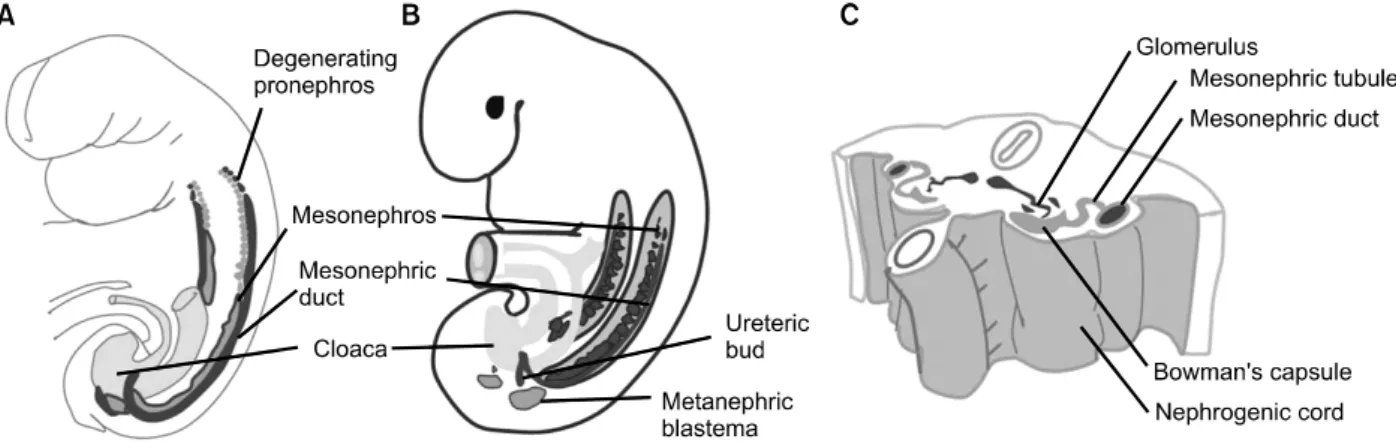
Fig. 1. The thress sets of excretory organs in an embryo. (A) Lateral view of a 25-day embryo, showing the degenerating pronephros and the extent of the mesonephros. (B) The developing utereric buds and metanephirc blastema. (C) Transverse section through the nephrogenic cord of a 5-week embryo showing formation of an excretory tubule of the mesonephric system.
형성삭에서 콩팥과 요관 구조가 기원한다. 방광과 요 도는 뒤창자 (hindgut)의 끝부분인 배설강 (cloaca)에서 기원한다.
1) 신장발생:
사람의 영구신장 (permanent kidney) 발 생 과정에는 세 쌍의 신장구조가 약간의 중복을 거치 면서 머리쪽에서 꼬리쪽으로 순차적으로 나타난다.첫 번째 신장인 전신 (앞콩팥, pronephros)은 사람에서 는 흔적뿐인 구조이며, 기능을 하지 않는다. 두 번째 신장인 중신 (중간콩팥, mesonephros)은 제대로 발달된 구조를 가지며, 일시적으로 소변을 만드는 기능을 한 다. 세 번째 신장인 후신 (뒤콩팥, metanephros)이 영구 신장이 된다. 앞선 두 신장은 영구신장 형성에 직접 관여하지는 않는다.3 하지만, 각 시기의 신장은 그 시 기에는 가장 효율적인 것이며, 다음 단계로 이행하는 데 필수적이다.4
전신은 척추동물에서 가장 단순한 구조의 신장이 다. 전신은 어류와 양서류의 유생 (larva) 시기에 신장 의 기능을 하며, 이들 동물의 성체에서는 중신으로 대 체된다. 사람과 고등 척추동물에서, 전신은 흔적 기관 으로만 발생되며 기능은 하지 않는다.5 사람에서는 전 신에 해당하는 구조가 발생 4주에 배아 목부위 중간 중배엽에 몇 개의 세포무리와 관 형태로 나타난다. 전 신관 (pronephric duct)은 꼬리쪽으로 뻗어 내려가 배설 강으로 열린다. 이 세포무리를 신장분절 (nephrotome) 이라고 하기도 한다. 전신은 발생 4주말에 퇴화되어 없어진다.
중신은 크고 길쭉한 모양으로 발생 4주 중간에 신 장발생삭에서 발생한다 (Fig. 1). 중신은 잘 발달된 구
조를 하며 영구신장이 발생할 때까지 4주 정도 신장 으로 기능한다. 신장발생삭에 중신소포 (mesonephric vesicle)가 먼저 만들어지고 소포는 길어져 중신세관이 되며 중신관 (mesonephric duct, Wolffian duct)에 연결된 다. 중신관은 나중에 방광을 형성하는 배설강 (cloaca) 으로 열린다. 중신세관은 곧 S자모양을 하게 되며, 세 부분 즉 피막부, 분비세관, 집합세관으로 분화된다.
세관의 안쪽 끝부분인 피막부위 주위에서 모세혈관 이 뭉친 사구체가 형성된다 (Fig. 1). 중신은 영구신장 보다는 다소 단순한 구조이지만, 사구체와 중신세관 으로 구성된 신장단위가 만들어지며 실제로 소변을 만들고 배설한다. 세로로 길쭉한 중신에는 약 40 개의 세관이 형성된다. 이 세관들은 모두 같은 시기에 만들 어지지 않으며 머리쪽 중신세관이 꼬리쪽 세관보다 먼저 발생하고 먼저 퇴화한다. 중신은 발생 2개월 말 에 퇴화한다. 남성에서는 중신세관과 중신관 일부는 퇴화되지 않고 남아 각각, 고환 수출세관 (efferent ductule)과 부고환, 정관, 사정관, 정낭을 포함하는 남 성생식관을 형성한다. 여성 중신관은 대부분 퇴화된 다.
영구신장을 형성하는 후신은 수정 후 5주초에 발생 이 시작되며 약 4주 후에 기능을 시작한다. 후신은 후 신발생모체 (metanephric blastema: 후신중간엽으로도 불 린다)와 요관싹 (ureteric bud)의 두 가지 배아조직으로 부터 기원한다. 요관싹은 중신관이 배설강으로 이어 지는 부위 근처 상피가 바깥으로 자라나온 것이다.
후신발생모체는 신장발생삭의 꼬리쪽부분에서 기원 하며, 오요관싹을 모자처럼 둘러싼다 (Fig. 1). 영구신
장 발생은 후신중간엽과 요관싹의 상호유도 작용에 의한 다음의 두 과정을 거쳐 형성된다. 1) 후신발생 모체의 중간엽세포들이 요관싹의 자극에 의해 집합 관 (collecting duct)을 제외한 모든 요세관과 사구체를 형성하는 과정인 신장단위발생 (nephrogenesis) 과정 과 2) 요관싹이 집합관, 신배, 신우, 요관으로 분화되 는 요관싹분지형태발생 (branching morphogenesis) 과 정이다. 요관싹은 후신중간엽으로 자라 들어가면서 점점 길어진다. 길어진 줄기 부분은 요관이 되며 끝 부분은 반복적인 분지형성과정을 거치면서 영구신 장의 집합관, 신배, 신우를 포함하는 집합관계통을 형성한다.6
후신중간엽은 요관싹 끝의 넓어진 부위인 팽대부 (ampulla) 주위에 2층의 세포집단을 형성한다. 팽대부 에 인접한 안쪽의 신장형성세포층 (nephorgenic layer) 은 신장소포 (renal vesicle)를 형성하며, 신장단위로 분 화한다. 바깥쪽 기질형성세포층 (stromatogenic layer)은 신장의 간질 (stroma)과 피막 (capsule)이 된다.7 영구신 장은 발생 12주 말에 기능을 나타내기 시작한다. 소 변은 양막공간으로 들어가 양수와 섞인다. 양수를 태 아가 삼켜서 소화관에서 혈액으로 흡수되면, 다시 신 장을 거쳐 양수로 배출된다. 발생과정 동안 콩팥은 노폐물의 배설에 관여하지 않고 태반이 이 기능을 담 당한다.
2) 신장 집합계통 발생:
요관싹은 주위 후신발생모체에서 만들어진 신호에 반응하여 발생된다. 사람 요관 싹의 형성은 발생 5주에 시작한다. 요관싹의 성장이 이루어지지 않으면 신장무발생 (renal agenesis)이 유발 된다. 요관싹이 두 개 이상 자라나오면, 중복집합계통 (doubule collectiong system)이나 중복요관 (ureteric dup- lication)이 생길 수 있다. 중신관에서 요관싹이 돋아나 는 위치는 요관싹과 후신발생모체와의 상호작용에 중요한 요소가 된다. 정해진 위치가 아닌 다른 곳에서 발생한 요관싹은 신장조직 형성이상 (dysplasia)을 유발 한다. 이러한 위치 이상은 요관방광접합부 (uretero- vesical junction)에도 영향을 미치며, 방광에서 비정상 적인 요관구멍의 위치는 방광요관역류 (vesicoureteral reflux)를 유발 하는 것으로 알려져 있다.8,9 요관싹의 분지형태발생 (branching morphogenesis)은 요관싹이 후 신발생모체로 침범해 들어가면 곧바로 시작된다. 요 관싹가지의 수는 최종 신장단위의 수의 주요 결정인 자이다. 요관싹가지 끝부분이 후신발생모체세포들의 신장단위발생 (nephrogenesis)을 유도하기 때문이다. 요
관싹의 분지는 둘씩 갈라지는 형식을 취한다. 분지하 며 성장하는 요관싹 가지의 팽대부 (ampulla) 주위의 후신중간엽에서 신장단위가 분화된다. 팽대부는 나중 에 신장단위와 연결된다.10 분지형성은 약 15세대 (generation) 정도 반복되며, 사람에서는 발생 15주 즈 음에 초기 9세대의 분지형성이 이루어진다. 발생 20-22주 사이에 요관싹분지형성은 끝난다. 이후 가장 자리 가지부분의 확장에 의해 집합관 형성이 시작된 다.11 요관싹의 첫 3-5세대 가지가 커지고 합쳐져 신우 가 되며 그 다음 세대 가지가 대신배 (major calyx)를 형성한다. 다음 3-5세대 가지가 합쳐져 소신배와 신유 두를 형성하며, 이후 6-8세대 가지들이 집합세관 (collecting tubule)으로 분화된다. 각 세관들은 분지가 진행되면서 점점 가늘고 길어진다.
발생 22-24주에 발생 중인 신장은 피질과 수질로 구분되기 시작하며, 각각의 집합관 형태의 차이가 나 타나기 시작한다. 출생직후 신장피질은 전체 신장 부 피의 70%를 차지한다.12 피질과 수질의 집합관 형태 의 차이가 나타나기 시작한다.
3) 신장단위 발생:
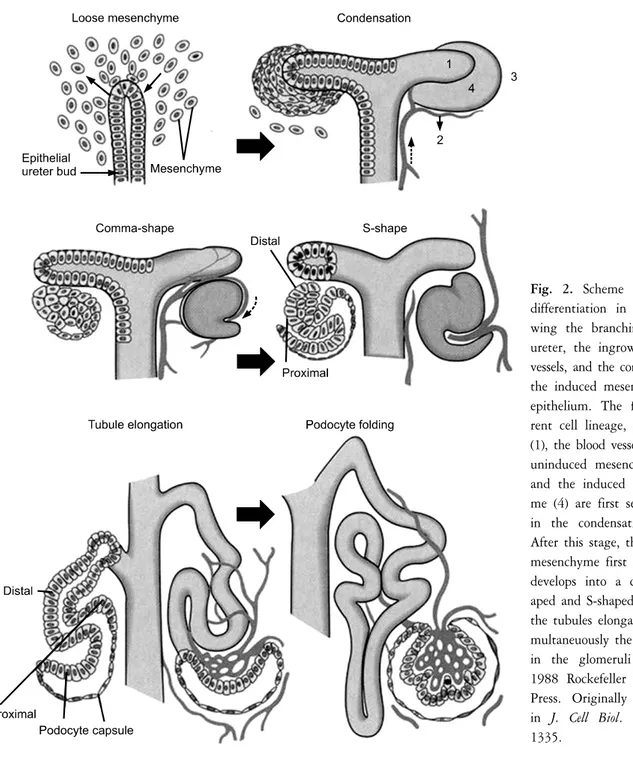
신장단위는 요관싹 주위 후신중간엽세포의 신장형성세포층에서 기원한다. 침범해오는 요관싹에 근접한 중간엽세포들은 요관싹과의 상호 유도작용에 의해 연속적인 형태 변화 과정을 거치며 신장단위를 형성한다. 후신중간엽이 성장 중인 요관 싹 끝 팽대부 주위를 모자모양으로 덮고 있는 모자세 포응집 (cap condensation)을 형성한다 (Fig. 2). 이후 세 포응집에서 분리된 세포집단이 요관싹의 가지에서 팽대부로 이어지는 경계, 즉 요관싹 가지 끝부위 아래 쪽에서 타원모양의 세포집합체인 세관앞응집 (pretu- bular aggregate)을 형성한다. 이 중간엽세포들은 중간 엽-상피전환 (mesenchymal-to-epithelial conversion)을 거 쳐 상피세포의 특징을 나타내게 된다. 이후 세관앞응 집 속에 공간이 형성되면 신장소포 (renal vesicle)가 된 다. 신장소포의 다능성전구세포들이 신장단위의 모든 종류의 상피세포들로 분화한다. 신장소포가 신장단위 의 신소체 (renal corpuscle)와 세관부위로 나뉘는 구역 화는 신장소포에 두개의 틈새 (cleft)가 형성되면서, 타 원모양의 신장소포가 쉼표모양 (comma shape), S모양 (S shape), 모세혈관고리 (capillary loop), 성숙기를 거치 는 형태변화과정에 의해 이루어진다 (Fig. 2).13,14 S모양 체는 전체적으로 세 부분으로 구분된다. 요관싹 팽대 부에서 가장 멀리 떨어져 있는 아래쪽에 신소체가 형 성된다. S모양체의 요관싹 팽대부에 가까운 중간과
Fig. 2. Scheme of kidney differentiation in vivo sho- wing the branching of the ureter, the ingrowth of the vessels, and the conversion of the induced mesenchyme to epithelium. The four diffe- rent cell lineage, the ureter (1), the blood vessels (2), the uninduced mesenchyme (3), and the induced mesenchy- me (4) are first seen clearly in the condensation stage.
After this stage, the induced mesenchyme first condenses, develops into a comma-sh- aped and S-shaped structure, the tubules elongate, and si- multaneuously the podocytes in the glomeruli fold. ⓒ 1988 Rockefeller University Press. Originally published in J. Cell Biol. 107:1325- 1335.
위쪽 끝은 요세관구역으로 점점 길어져 근위곡요세 관 (proximal convoluted tubule), 헨레고리 (콩팥세관고 리, loop of Henle), 원위곡요세관 (distal convoluted tubule) 순서로 분화된다. 가장 나중에 형성된 원위요 세관 부분이 요관싹에서 기원한 집합관과 연결된다.
태어나기 전, 이미 신장단위의 구역화가 완성되고 소 변 생성이 이루어지지만, 요세관의 성숙은 출생 후에 도 계속된다.15
4) 사구체발생: 사구체발생은 S모양체 아래쪽 혈관
틈새 (vascular cleft)로 사구체모세혈관 형성에 관여하 는 혈관모세포와 혈관사이세포 (mesasngial cell)의 전구 세포가 모여들어 이 틈새가 깊어지고 확장된 오목이 만들어지면서 시작된다. 이들 전구세포들의 기원은 명확히 밝혀져 있지 않지만, 상피나 간질로 분화되지 않은 후신중간엽에 한 부류일 것으로 추측된다.16-18 오목의 속벽을 형성하는 상피세포는 사구체주머니 (glomerular capsule, 보우만주머니 Bowman’s capsule)의 내장측상피 (visceral epithelim) 즉 발세포 (podocyte) 층
을 형성한다. 이 시기에 미성숙 발세포들이 증식하여 원주세포 (columnar cell) 모양을 하고 있으며, 바닥쪽은 미래의 사구체기저막 (glomerular basement membrane;
GBM) 위에 놓인다. 오목의 바깥벽을 덮는 세포는 사 구체주머니의 벽측상피 (parietal epithelium)가 된다 (Fig. 2). 사구체발생은 매우 역동적이며, 기존의 모세 혈관이 6-8개의 모세혈관고리 (capillary loop)로 이루어 진 혈관얼기 (vascular plexus)를 형성하며, 발세포가 모 세혈관고리 주위로 이동한다. 이 모세혈관고리시기에 모세혈관 내피세포에 창 (fenestra)이 형성되며, 발세포 는 세포분열능을 잃고 액틴에 의한 세포질확장 즉 발 돌기 (foot process)와 특수한 세포사이결합인 틈새막 (slit membrane)을 형성한다.19,20 혈관사이세포는 모세 혈관뭉치 속에 자리잡고, 세포외기질 (extracellular matrix)의 침착으로 모세혈관을 지지해 준다. 사람 태 아 신장의 사구체 전체 구성요소는 발생 32-34주에 완 성되며, 이 시기에 신장단위발생 (nephrogenesis)이 멈 춘다.
5) 후신간질세포 (metanephric stromal cell):
신장발생 에 관한 연구들은 대부분 후신발생모체와 요관싹 사 이의 상호유도작용 관한 것이었다. 하지만, 간질세포 들도 신장단위발생에 중요한 역할을 담당한다는 것 이 밝혀지고 있다. 간질세포는 발생 중인 신장단위와 요관싹가지 주위의 후신중간엽 간질형성세포에서 기 원하며, 요관싹의 유도작용에 의한 세포응집을 형성 하지는 않는다. 신장이 형태적으로 피질과 속질로 구 분됨에 따라 간질세포들도 분포하는 두 지역에 따라 구분된다. 피질간질 (cortical stroma) 세포는 신장피막 아래 얇은 층으로 있으며, 수질간질 (medullary stroma) 세포는 집합관과 요세관 사이 공간에 자리잡고 있다.피질간질세포는 후신중간엽 세포응집 주위에서 요관 싹분지형성과 발생 중인 신장의 패턴형성에 관여하 는 신호를 만든다. 간질세포의 요관싹분지형성 유도 가 제대로 이루어지지 않으면 신장단위의 수가 감소 한다. 신장발생 패턴형성의 장애가 있으면 피질-수질 경계 형성이 이루어지지 않는다.21 출생 때 많은 수질 간질세포들은 세포자멸사가 일어나며, 이 공간은 발 생 중인 헨레고리로 채워진다. 신장단위발생이 완료 되면서, 간질세포들은 섬유모세포 (fibroblast)와 혈관 리모델링에 관여하는 혈관주위세포 (pericyte) 같은 다 양한 세포집단으로 분화하며, 세포외기질을 생산한 다.22
6) 신장의 위치 이동과 혈관분포 변화:
신장은 원래발생 위치에서 위쪽으로 이동하여 자리잡게 된다. 처 음에, 후신은 골반부위에서 엉치뼈 (sacrum) 앞쪽에 서 로 가까이 자리잡고 있다. 배아가 성장하면서, 배아몸 통이 펴지고 배와 골반의 성장에 따라, 신장은 배안에 자리잡게 되고 서로 멀어지게 된다. 신장은 발생 9주 에, 부신과 만나게 되면 오름은 멈추고 성인에서와 같 은 위치에 자리잡게 된다. 신장의 오름은 신장 아래쪽 배아부분의 성장에 의한 것이다. 배아의 꼬리쪽이 성 장하여 신장으로부터 멀어짐에 따라 신장은 점차 더 머리쪽에 자리잡게 된다. 혈관과 신경이 드나드는 신 장문은 처음에는 앞쪽을 향하고 있지만, 신장이 이동 하면서 안쪽으로 90도 회전하여 발생 9주 경에 신장 문은 앞안쪽을 향하게 된다. 최종적으로 신장은 뒤배 벽에서 복막 바깥에 있는 복막뒤장기 (retroperitoneal organ)가 된다.
신장이 위로 이동하는 동안, 신장은 가까운 혈관으 로부터 혈액공급을 받는다. 처음, 신장동맥 (콩팥동 맥)은 온엉덩동맥 (총장골동맥, common iliac artery)의 가지였다. 이후 신장이 이동함에 따라 대동맥으로부 터 새로운 가지가 뻗어 나온다. 먼저 만들어진 아래쪽 가지들은 정상적으로 퇴화되어 없어진다. 신장이 제 자리를 잡으면 배대동맥으로부터 나온 가장 위쪽 가 지가 영구적인 신장동맥이 된다. 대체적으로 오른신 장동맥이 좀더 길고 더 위쪽에 위치한다. 이러한 혈관 형성 과정이 제대로 이루어지지 않으면, 덧신장동맥 (accessory renal artery)이 생길 수 있다.
2. 방광발생
하등 척추동물은 소화계통과 비뇨생식계통이 같이 연결된 내배엽성질의 공동 공간인 배설강 (cloaca)을 갖고 있으며, 배설물이 한꺼번에 외부로 배출된다. 하 지만 포유류의 배설강은 비뇨직장중격 (urorectal sep- tum)에 의해 앞쪽의 비뇨생식동 (urogenital sinus)과 뒤 쪽의 항문직장관 (anorectal canal)으로 나누어지며, 두 계통의 배설물이 따로 배출된다. 배설강은 배설강막 (cloacal membrane)으로 외부와 분리되어 있다. 발생 5 주에 발달하기 시작한 비뇨직장중격 (urorectal septum) 은 발생 7주말에 배설강막과 완전히 융합되어 배설강 을 두 부분으로 나눈다. 이로 인해 배설강막도 앞쪽의 비뇨생식막과 뒤쪽의 항문막으로 분리된다. 발생 7주 에 비뇨생식동은 중신관이 비뇨생식동에 연결되는 위치 따라 다시 세부분으로 나눈다. 중신관이 열리는 부위보다 머리쪽인 방광부분 (vesical part)은 나중에 방
광의 대부분을 형성하며, 그 위쪽은 요막 (allantois)으 로 이어진다. 이후 요막 내강이 없어지고 두꺼운 섬유 띠로 남게 되며 이것을 요막관 (urachus)이라고 한다.
요막관은 방광위쪽 꼭지에서 배꼽 사이에 위치하며, 출생 후에는 정중배꼽인대 (median umbilical ligament) 가 된다. 중신관이 연결되는 비뇨생식동 중간에 좁아 진 부위인 골반부위 (pelvic part)는 방광목에서 요도가 된다. 이 부위는 남성에서는 요도의 전립선부분과 막 부분이 되며, 여성에서는 요도 전체가 된다. 꼬리쪽 음경부분 (phallic part)은 바깥쪽으로 비뇨생식막으로 덮여 있고 요도의 주요 부분을 형성하며, 음경과 음핵 이 되는 생식결절 (genital tubercle)로 자라 들어간다.
성인의 방광에서 중신관에서 자라나온 요관이 중 신관에서 유래한 사정관과 분리되어 방광에 직접 연 결되어 있다. 이 과정은 방광삼각 (trigone of bladder) 형성과정에 의한 것이며, 이 과정의 이상은 요관역류 나 폐쇄를 일으킬 수 있다. Mackie와 Stephens23는 이 과정을 다음과 같이 정리하였다. 방광은 주로 비뇨생 식동의 방광부분에서 발생하지만, 방광삼각은 중신관 의 꼬리쪽 끝부분 즉, 중신관이 배설강에 연결된 부분 에서 요관싹이 자라나가는 부위 사이 부분에서 유래 한다. 방광이 늘어남에 따라, 중신관의 아래쪽 끝부분 은 방광 뒤벽에 합쳐져 방광삼각을 형성한다. 중신관 이 방광벽에 흡수되면, 중신관에서 자라나간 양쪽 요 관은 방광에 바로 연결된다. 신장의 이동과정에서 요 관구멍이 방광뒤벽에서 위쪽가쪽으로 부분적으로 당 겨지며, 요관은 방광벽을 비스듬히 지나게 된다. 양쪽 중신관구멍은 서로 가까워지며 요도 전립선부분으로 들어간다. 중신관 꼬리쪽 끝부분은 남성에서 사정관 (ejaculatory duct)이 되며, 여성에서는 퇴화되어 없어진 다. 최근까지 중신관에서 유래한 부분과 주위 방광조 직을 조직학적 혹은 형태적으로 구분하기 힘들어서 이 가설이 실험으로 검정되지는 않았다. 최근 새로운 생쥐모델을 대상으로 한 실험에서, 중신관 끝부분이 방광벽에 합쳐진 후 방광삼각으로 직접분화 되지 않 으며, 오히려 세포자멸사 (apoptosis)로 소실되고, 이로 인해 요관이 방광에 바로 연결된다는 결과가 발표되 었다.24 이 결과에 관련하여 향후 깊이 있는 검증이 필 요할 것으로 생각한다.
방광은 영아와 소아시기에는 복강에 위치하지만, 6 세 경에 큰 골반으로 이동해 들어가며, 사춘기에 작은 골반으로 들어가 자리잡게 된다.
3. 요도발생
남성요도의 대부분과 여성요도 전체 상피는 비뇨 생식동의 내배엽에서 기원한다. 남성에서 음경귀두의 요도는 외배엽세포들에서 기원한 것으로, 이들 세포 들은 귀두 속으로 자라들어가 요도해면체의 요도와 이어진다. 남성 요도는 여성보다 훨씬 길며, 발생이 복잡하다. 여성의 전체 요도에 해당하는 부분은 남성 에는 요도 전립샘부의 근위부로 되며, 비뇨생식동의 골반부는 요도 전립샘부와 막부분이 된다. 음경부는 요도 해면체부분으로 되며, 음경을 따라 연장된다.25
4. 신장과 요로 발생의 분자유전학적 기전 지난 20년간 비뇨계통 발생장애가 있는 환자에서 돌연변이 유전자를 찾는 연구와 특정 유전자에 돌연 변이를 유발한 실험동물에서 신장과 요로 발생에 관 한 연구를 통해, 비뇨계통 발생의 분자유전학적 기전 에 대한 많은 이해를 하게 되었다. 영구신장과 요로의 발생은 요관싹, 후신발생모체 (metanephric blastema), 간질세포, 혈관모세포 등에서 발현되는 전사인자 (transcription factor), 성장인자 (growth factor), 세포내신 호분자들의 복잡하지만 잘 조절된 신호전달체계에 의해 이루어진다.26,27
1) 집합관계통 형성 조절:
중신관으로부터 요관싹이자라나오는 과정은 영구신장발생의 첫 단계이다. 이 과정은 후신발생모체에서 발현되는 gial-derived neuro- trophic factor (GDNF)와 중신관에서 발현되는 GDNF의 수용체인 c-Ret receptor tyrosine kinase (RTK)의 상호작 용에 의해 이루어진다.28 Gdnf 또는 c-Ret 유전자 표적 돌연변이를 유발한 실험쥐에서 요관싹 성장 실패로 인한 양측신장무형성 (renal agenesis)이 발생하였다.29-31 요관싹이 중신관에서 돋아나는 위치 조절은 정상적 인 신장발생에 있어 매우 중요하고 결정적인 단계이 다. 요관싹이 정한 위치보다 위쪽 혹은 아래쪽으로 치 우치면, 요관이 방광에 제대로 연결되지 않으며, 요관 싹에 의한 후신발생모체에서 신장단위발생 유도가 제대로 이루어지지 않아 선천신장요로기형이 유발될 수 있다.32 GDNF의 수용체인 c-Ret은 처음에 중신관에 서 발현된다. 이것은 중신관 전체가 GDNF에 반응하 여 요관싹을 만들 수 있다는 것을 의미한 것으로, Gdnf 발현은 정상적인 요관싹 유도 부위 주위 중간중배엽 에서만 제한적으로 일어나도록 조절된다. 이후 c-Ret 은 요관싹 끝부분에서만 발현된다.27,33,34 GDNF 발현
정도와 발현위치는 다양한 전사인자와 성장인자에 의해 양성과 음성적으로 조절된다. 이들에는 paired box 2 (Pax2), eyes absent homolog 1 (Eya1), SIX homeobox 2 (Six2), forkhead/winged-helix transcription factor d1 (FoxC1), roundabout axon guidance receptor homolog 2 (Robo2), slit homolog 2 (Slit2), wingless-type MMTV integ- ration site family member (Wnt) 등이 있다. Eya1 발현부 위는 Gdnf 발현부위와 겹친다. Eya1 결빕 쥐에서 Gdnf 발현이 소실되고, 요관싹 성장이 일어나지 않으며, 신 장무발생이 생긴다.35 Pax2는 중간중배엽에서 발현되 면 직접 Gdnf 전사를 활성화 시킨다. c-Ret 발현과 신호 활성은 sprout homolog 1 (Spry1)에 의해 억제 되며, Pax2 나 retinoic acid에 의해 유도된다.36 전사인자인 Foxc1은 요관싹이 유도되는 위치가 아닌 곳에서 Eya1과 Gdnf 전사를 억제한다.37 Bone morphogenetic protein (BMP) 집단 일부도 GDNF 신호전달을 음성적으로 조절한 다. Bmp4는 중신관과 초기에 형성된 요관싹 바로 주위 간질세포에서 발현된다. BMP4는 중신관에서 GDNF- RET 신호전달에 국소적인 길항작용 (antagonist)으로 요관싹 성장 유도를 억제하는 것으로 생각된다. Bmp4 유전자의 돌연변이가 중신관에서 요관싹 위치이상과 방광요관역류를 유발하는 것으로 알려져 있다.38,39 발 생과정에 중요한 역할을 하는 호메오 유전자의 일종 인 Six2는 후신발생모체에서 발현되며, 후신중간엽세 포들이 비분화상태로 유지되도록 하여 계속적인 요 관싹분지형성과 신장단위형성이 진행되도록 한다.40
Pax2는 중신관, 요관싹과 요관싹 가지끝 부분의 신호
에 유도되는 후신발생모체에서 발현되며, 요관싹분지 형성을 유도한다. Pax2 돌연변이 쥐에서 요관싹 분지 형성과 신장형성저하증 (renal hypoplasia)이 관찰되었 으며, 이것은 요관세포의 세포자멸사 (apoptosis)에 의 한 것으로 생각한다.41 간질세포는 vitamin A, FGF7, BMP4, podocyte 1 (Pod1)을 통해 요관싹분지형성과 신 장단위발생을 자극한다.42 요관싹분지형성은 c-Ret 발 현을 촉진하는 비타민A와 이것의 수용체인 retinoic acid receptor (RAR)의 신호전달 작동체 (effector)에 의해 서도 양성적으로 조절된다.432) 신장단위형성 조절:
요세관발생 (tubulogenesis)은 후신중간엽세포가 요관싹 팽대부 주위에서 모자세포 응집 (cap aggregate)을 형성하고 곧이어 세관앞응집 (pretubular aggregate) 거쳐 신장소포 (renal vesicle)를 형 성하는 과정에 의해 시작된다. 요관싹은 용해성 성장 인자인 Wnt9b을 통해 후신중간엽에 신호는 보낸다.이 인자는 β-catenin을 통해 후신중간엽에서 FGF8, LIM homeobox 1 (Lhx1), Wnt4의 발현을 유도한다. Wnt4 는 모자세포응집에서 세관앞응집으로 전환을 유도하 며, 후신발생모체 세포가 중간엽-상피전환으로 신장 단위의 요세관 상피로 분화 되도록 유도한다.44,45 신 장단위 구역화에서 사구체와 근위 및 원위요세관 형 성은 이미 신장소포 단계에서 특수화되어 있다. 근위- 원위신장단위세포로 분화에 대한 유전적 조절은 신 장소포단계에서 발현되는 Lhx1과 Brn1 전사인자들이 관여한다고 알려져 있다.46 Notch2는 신장단위 근위부 발생을 조절한다. NOTCH 신호전달을 차단한 경우 사구체, 근위요세관, 헨레고리의 발달없이 원위세뇨 관만 있는 신장단위가 형성된다.47 초기 신장발생동 안, Pax2 발현은 근위와 원위요세관 상피 전구체 부위 에 제한적이며, 이후 분화된 요세관 상피에서는 억제
된다.48,49 발세포 분화는 전사인자인 Wilms tumor 1
(WT1), Pax2 등의 조절에 의한 것이다. Wt1 발현은 사 구체 발생에서 발세포로 분화되는 상피세포 전구체 에 제한적이다.50 발세포는 vascular endothelial growth factor (VEGF)를 분비하여 혈관내피세포가 S모양체의 혈관틈새로 이동하도록 한다. 혈관내피세포는 platelet derived growth factor (PDGF)를 생산하여 혈관사이세포 (mesangial cell)의 분화를 유도한다.51
결 론
사람 비뇨계통은 배아 뒤벽에 위치한 중간중배엽 에 기원한다. 영구신장 발생과정에 전신, 중신, 후신 이라는 세 쌍의 신장구조가 약간의 중복을 거치면서 순차적으로 나타난다. 앞선 두 신장은 영구신장 형성 에 직접 관여하지는 않지만, 각 시기의 신장은 그 시 기에는 가장 효율적인 것이며, 다음 단계로 이행하는 데 필수적이다. 신장의 두가지 주요 구성요소인 집합 관계통과 신장단위는 각각 두 가지 배아조직인 후신 발생모체와 요관싹 (ureteric bud)의 상호 유도작용에 의해 형성된다. 방광과 요도는 비뇨직장중격에 의해 나눠진 배설강의 앞부분인 비뇨생식동에서 기원한다.
신장과 요로의 형성과정 복잡하지만 잘 조절된 신호 전달체계에 의해 이루어진다. 이러한 과정을 조절하 는 유전자의 돌연변이는 신장과 요관의 기형을 유발 할 수 있다.
REFERENCES