석사학위 청구논문
Thermal Desorption Study of Alcohols on Clean Si(100)-(2×1)
국 민 대 학 교 대 학 원 화 학 과 물 리 화 학 전 공
윤 원 준
2002
석사학위 청구논문
Thermal Desorption Study of Alcohols on Clean Si(100)-(2×1)
지도교수 곽 현 태 성 명 모
이 논문을 이학 석사학위 청구논문으로 제출합니다.
2002년 12월 일
국 민 대 학 교 대 학 원 화 학 과 물 리 화 학 전 공
윤 원 준
2002
이 논문을 윤원준의 이학 석사학위 논문으로 인정함
2002년 12월 일
심사위원장 박 찬 량
심 사 위 원 박 규 순
심 사 위 원 성 명 모
감사의 글
부족하기 그지없는 졸업논문이지만 끝까지 잘 마무리 될 수 있도록 도와주신 여러분들에게 감사의 글을 올립니다.
많이 모자라는 저를 때로는 엄하게 꾸짖어 주시기도 하셨지만, 항상 따뜻한 눈 빛으로 지켜봐 주시며 이끌어 주신 곽현태 교수님, 성명모 교수님께 깊은 감사를 드립니다.
대학원생활 중 저희들을 따뜻하게 감싸주신 남궁해, 박찬량, 김석찬 교수님께도 감사의 말씀을 드립니다.
또한 박막연구실, SAMs 연구실이라는 이름으로 같이 생활했던 여러 형님들, 곁 에서 어려울 때 정겹게 도와줬던 동기들, 그리고 저보다 훨씬 열심히 생활해 줄것 이라고 믿어 의심치 않는 후배님들께도 고마움을 전합니다. 아직도 많이 부족하지 만 여러분들과 함께 생활했던 지난 몇 년간이 저에게는 많이 발전할 수 있었던 시간이 되었다고 생각합니다.
공부한다는 핑계로 예전처럼 많은 시간을 함께 할 수는 없었지만, 제게 자신감 을 심어주고 격려해 주었던 제가 사랑하고 저를 아껴주는 모든 친구들에게도 고 맙다고 전하고 싶습니다.
무엇보다도 못난 아들 언제나 응원해주시고 끝까지 믿어주신 사랑하는 부모님 께도 진심 어린 감사의 말을 드립니다.
지금껏 도와주신 많은 분들께 누가 되지 않도록 열심히 노력하는 사람이 되겠 습니다.
요 약
깨끗한 Si(100)-2×1 표면 위에 흡착된 alcohol들의 열에너지에 의한 거동을 TDS(Thermal Desorption Spectroscopy)와 IDMS(Integrate Desorption Mass Spectroscopy), 그리고 LEED(Low Energy Electron Diffraction)를 이용해 실험을 수행하였다.
이미 alcohol들의 흡착에 관해서는 T. Bitzer와 그의 연구진에 의해 이미 밝혀 졌다. 그는 alcohol들이 Si(100)표면에 화학흡착을 이룰 때 alkoxy species와 silicon hydride로 형성된다는 연구를 HREELS(High Resolution Electron Energy Loss Spectroscopy)와 LEED(Low Energy Electron Diffraction)를 이용해 연구해 서 발표했다.
흡착된 alcohol들이 열에너지에 의해 탈착이 이루어질 때, 1-pentanol과 2-methyl -1-butanol은 γ위치의 hydrogen이 떨어지면서 1-pentene과 2-methyl -1-butene으로 520K과 515K에서 각각 탈착되는 것을 확인할 수 있었다.
Neopentanol은 480K 이상에서 주 탈착물인 isobutene이 neopentane과 경쟁적으 로 탈착되는 것을 확인할 수 있었다.
그리고 benzyl alcohol은 377K에서 표면의 수소를 받아 toluene으로 탈착하는 것을 확인할 수 있었다.
Methanol의 경우 510K에서 주 탈착물인 formaldehyde와 methane이 경쟁적으 로 탈착되는 것을 확인할 수 있었다.
표면에 남아있던 수소는 H2로 790K에서 탈착되는 것을 확인할 수 있었다.
목 차
Ⅰ. 서 론 ……… 1
Ⅱ. 이 론 ……… 6
1. UHV system ……… 6
2. TDS(Thermal Desorption Spectroscopy) ……… 9
2. 1. TDS의 원리 ……… 9
2. 2 여러 가지 TDS 분석 방법 ……… 13
2. 2. 1. Redhead's method ……… 13
2. 2. 2. Complete analysis ……… 14
2. 2. 3. Leading edge analysis (HK method) ……… 14
2. 2. 4. Heating Rate Variation method ……… 15
2. 2. 5. Isotherms method ……… 16
2. 2. 6. Peak width analysis(CAW method) ……… 17
2. 2. 7. Area method ……… 18
3. LEED(Low Energy Electron Diffraction) ……… 20
3. 1. 서 론 ……… 20
3. 2. LEED의 원리 ……… 20
3. 3. 실격자와 역격자와의 관계 ……… 23
Ⅲ. 실 험 ……… 28
1. Clean Si(100) substrate 준비 ……… 28
2. Precursor cleaning ……… 28
3. Adsorption ……… 29
4. Desorption ……… 29
Ⅳ. 결과 및 논의 ……… 30
1. 1-Pentanol ……… 30
1. 1. IDMS( Integrate Desorption Mass Spectrum) 결과 ……… 30
1. 2. TDS( Thermal Desorption Spectroscopy) 결과 ……… 32
1. 3. LEED(Low Energy Electron Diffraction) 결과 ……… 33
1. 4. Coverage Test 결과 ……… 35
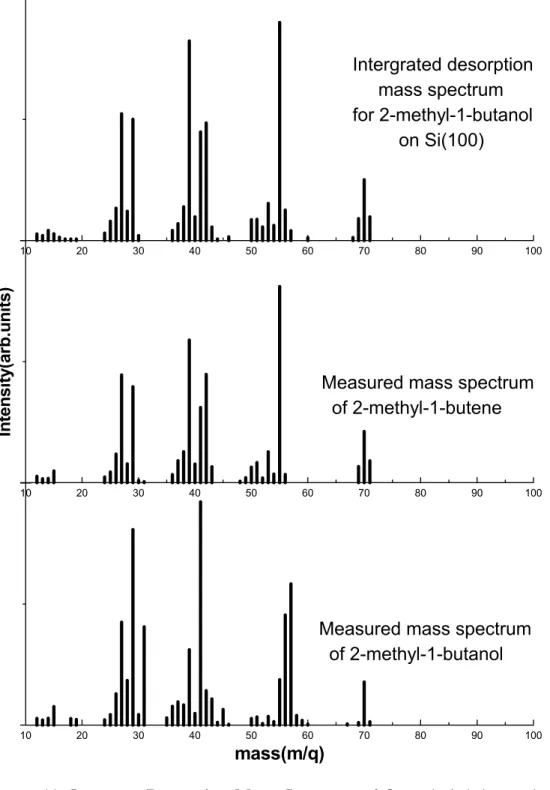
2. 2-Methyl-1-butanol ……… 37
2. 1. IDMS(Integrate Desorption Mass Spectrum) 결과 ……… 37
2. 2. TDS(Thermal Desorption Spectroscopy) 결과 ……… 39
2. 3. LEED(Low Energy Electron Diffraction) 결과 ……… 40
2. 4. Coverage Test 결과 ……… 42
3. Neopentanol ……… 44
3. 1. IDMS(Integrate Desorption Mass Spectrum) 결과 ……… 44
3. 2. TDS(Thermal Desorption Spectroscopy) 결과 ……… 46
3. 3. Isotopic labeling experiment 결과 ……… 47
3. 4. LEED(Low Energy Electron Diffraction) 결과 ……… 49
3. 5. Coverage Test 결과 ……… 51
4. Benzyl alcohol ……… 53
4. 1. IDMS(Integrate Desorption Mass Spectrum) 결과 ……… 53
4. 2. TDS(Thermal Desorption Spectroscopy) 결과 ……… 55
4. 3. Isotopic labeling experiment 결과 ……… 56
4. 4. LEED(Low Energy Electron Diffraction) 결과 ……… 58
4. 5. Coverage Test 결과 ……… 60
5. Methanol ……… 62
5. 1. IDMS(Integrate Desorption Mass Spectrum) 결과 ……… 62
5. 2. TDS(Thermal Desorption Spectroscopy) 결과 ……… 64
5. 3. LEED(Low Energy Electron Diffraction) 결과 ……… 65
5. 4. Coverage Test 결과 ……… 67
6. 결과요약 ……… 69
Ⅴ. 참 고 문 헌 ……… 72
Table 및 Figure 목차
Table 1. 표면분석에 널리 이용되고 있는 분석기술/장비와 특성 ………… 3
Table 2. 진공도(眞空度)에 따른 분류 ……… 3
Figure 1. UHV diagram ……… 8
Figure 2. The positions of peak temperature, peak amplitude, half-width, three-quarter width for TDS curve. ……… 14
Figure 3. Ewald sphere construction in reciprocal space. ……… 25
Figure 4. A two-dimensional real lattice, described by a1, a2(dark circles), and its reciprocal lattice a1*, a2*(open circles). ……… 26
Figure 5. LEED diagram ……… 27
Figure 6. Integrate desorption mass spectrum of 1-pentanol ……… 31
Figure 7. Thermal desorption spectrum of 1-pentanol ……… 32
Figure 8. LEED pattern of 1-pentanol ……… 34
Figure 9. Coverage of 1-pentanol ……… 35
Figure 10. Coverage curve of 1-pentanol ……… 36
Figure 11. Integrate desorption mass spectrum of 2-methyl-1-butanol … 38 Figure 12. Thermal desorption spectrum of 2-methyl-1-butanol ………… 39
Figure 13. LEED pattern of 2-methyl-1-butanol ……… 41
Figure 14. Coverage of 2-methyl-1-butanol ……… 42
Figure 15. Coverage curve of 2-methyl-1-butanol ……… 43
Figure 16. Integrate desorption mass spectrum of neopentanol ……… 45
Figure 17. Thermal desorption spectrum of neopentanol ……… 46
Figure 18. Integrate desorption mass spectrum of neopentanol-d ………… 48
Figure 19. Thermal desorption spectrum of neopentanol-d ……… 48
Figure 20. LEED pattern of neopentanol ……… 50
Figure 21. Coverage of neopentanol ……… 51
Figure 22. Coverage curve of neopentanol ……… 52
Figure 23. Integrate desorption mass spectrum of benzyl alcohol ………… 54
Figure 24. Thermal desorption spectrum of benzyl alcohol ……… 55
Figure 25. Integrate desorption mass spectrum of benzyl alcohol-d ……… 57
Figure 26. Thermal desorption spectrum of benzyl alcohol-d ……… 57
Figure 27. LEED pattern of benzyl alcohol ……… 59
Figure 28. Coverage of benzyl alcohol ……… 60
Figure 29. Coverage curve of benzyl alcohol ……… 61
Figure 30. Integrate desorption mass spectrum of methanol ……… 63
Figure 31. Thermal desorption spectrum of methanol ……… 64
Figure 32. LEED pattern of methanol ……… 66
Figure 33. Coverage of methanol ……… 67
Figure 34. Coverage curve of methanol ……… 68
Figure 35. Desorption mechanism of 1-pentanol and 2-methyl-1-butanol … 69 Figure 36. Desorption mechanism of neopentanol ……… 70
Figure 37. Desorption mechanism of benzyl alcohol ……… 70
Figure 38. Desorption mechanism of methanol ……… 71
Ⅰ. 서 론
70년대 이후부터 대두되어 과학의 한 영역을 차지하고 있는 표면과학(surface science)은 표면화학(surface chemistry)과 표면물리(surface physics)로 이루어지 는 학문분야로, 표면 상태에서 일어나는 여러 가지 현상을 연구하는 과학이다.
표면(surface) 또는 계면(interface)은 일반적으로 한 상(phase)이 다른 상과 맞 닿은 면을 의미한다. 이 중에서도 표면 과학에서는 특히 고체-기체상(solid-gas phase)사이에 존재하는 표면 상호작용(surface interaction)에 많은 관심을 가지는 데, 이는 고체의 표면이 물질의 일반적인 내부 성질(bulk property)과는 다른 성질 을 나타내기 때문이다. 표면은 내부 원자들과 달리 표면 위쪽 원자의 부재(不在) 로 인하여 내부로 끌어당겨지는 순힘(net force)이 작용하게 된다. 이 순힘에 의하 여 표면 원자들은 내부 원자들과는 다른 여러 가지 성질들을 보이게 된다. 그 중 가장 대표적인 것이 백금(Pt), 팔라듐(Pd), 텅스텐(W)등의 금속 표면에서 활성을 보인다는 것이다.
또한 표면에서는 구조적으로 순힘을 최소화시키면서 안정화하기 위해 표면 원 자들이 완화(relaxation), 재구성(reconstruction)등의 원자 재배열을 통하여 내부원 자(bulk atom)들과는 다른 기하학적 배열과 물리화학적 성질을 나타낸다.
이러한 표면을 연구하는 표면과학은 표면에서 일어나는 여러 가지 현상들, 즉 부식 반응, 촉매 작용 등의 밑바닥을 이루는 원자 및 분자들의 반응과정과 세부 내용을 연구하는 것이다.
연구의 결과는 정밀 화학의 발전과 신소재 및 반도체의 개발에 크게 기여하며, 이러한 표면 화학 연구를 위해서는 여러 가지 표면 분석(surface analysis)기기가 필요하다. 현재도 표면 화학의 발전과 함께 계속 새로운 표면 분석 기기 및 분석 방법의 개발이 함께 이루어지고 있다.
표면 화학의 연구 대상은 궁극적으로 물질의 최외각 원자층 즉, 표면 원자층 (surface atom layer)이지만, 표면분석은 표면 원자층 근처의 내부 원자(bulk atom)들도 포함하여 그 대상으로 삼는다. 따라서 표면 분석은 표면으로부터 대략
1nm깊이(depth)의 영역의 원자들까지 포함하며, 표면 분석으로 얻어내는 정보는 표면 자체의 기하학적 구조와 배열, 정량 및 정성분석, 전자의 상태와 상태 에너 지 밀도, 고체-기체의 상호작용에 의한 결합, 흡착 및 탈착 에너지, 흡착질 (adsorbate)의 반응속도, 흡착질에 의한 표면 원자의 전자 상태 변화 등 매우 다양 하고 방대하다. 이런 정보들은 표면에서 일어나는 표면 현상을 원자 및 분자 수준 에서 이해할 수 있는 단서와 정보를 제공한다.
표면 현상을 연구하기 위해서는 표면의 기하학적 구조와 배열을 분석할 수 있 는 저에너지 전자 회절법(Low Energy Electron Diffraction, LEED), 주사식 터널 링 현미경(Scanning Tunnelling Microscopy, STM), 이차 전자 현미경(Secondary Electron Microscopy, SEM)등이, 표면과 흡착질의 정성/정량 분석에 Auger 전자 분광법(Auger Electron Spectroscopy, AES), 이차 이온 질량 분광법(Secondary Ion Mass Spectroscopy, SIMS)등이, 표면 원자와 흡착질의 전자 상태와 상태 에 너지 밀도 연구에 X-선 광전자 분광법(X-ray Photoelectron Spectroscopy, XPS), 자외선 광전자 분광법(Ultraviolet Photoelectron Spectroscopy, UPS)등이, 고체-기 체의 상호작용에 의한 결합 및 흡착 분자 구조 분석 연구에 반사-흡수 적외선분 광법(Reflection-Absorption Infrared Spectroscopy, RAIRS), 핵자기 공명법 (Nuclear Magnetic Resonance, NMR), 표면 증강 Raman 분광법(Surface Enhanced Raman Spectrometry, SERS), 고분해능 전자 에너지 손실 분광법 (High- Resolution Electron Energy Loss Spectroscopy, HREELS)등이, 조성 (composition)과 깊이 분석에 Rutherford 역산란법(Rutherford BackScattering Spectroscopy, RBS)등이, 흡착/탈착 에너지, 반응 속도 연구를 위해서 열 탈착 분 광법(Thermal Desorption Spectroscopy, TDS)등이 널리 사용된다.
다음 Table 1.에 표면분석에 널리 이용되고 있는 분석기술/장비와 특성에 대해 간략히 기술해 놓았다.
Table 1. 표면분석에 널리 이용되고 있는 분석기술/장비와 특성 기술
/ 장비 자극원 관찰대상 원 리 취득정보
XPS 특성
X-선 광전자 광전자의 측정으로 에너지 준위 결정 화학결합상태, 원소분석
UPS 자외선 광전자 광전자의 측정으로 에너지 준위 결정 진동주파수,
화학결합상태 AES 전자 Auger 전자 Auger 전자의 측정에 의한 원소 분석 표면원소분석
SIMS 이온 2차이온 2차이온에 의한 질량분석 미량 원소분석
ISS 이온 산란이온 일정각도로 산란된 이온의 측정 표면원소분석
SEM 전자 2차전자, X-선 가속전자에 대한 2차전자나 X-선 표면의 형상, 원소조성
TEM 전자 투과전자 투과전자의 세기에 따른 명암 영상 격자구조, 결함의 관찰
STEM 전자 투과전자,
X-선 투과전자와 방출 X-선의 영상 미소영역의 화학조성
RBS He, H입자 산란이온 후방산란된 이온의 세기 측정 정성, 정량 분석
LEED 전자 산란전자 표면 2차원 격자에 의한 산란 표면구조, 흡착원자 배열
EPMA 전자 X-선 특성 X-선에 의한 원소 분포 원소 정량
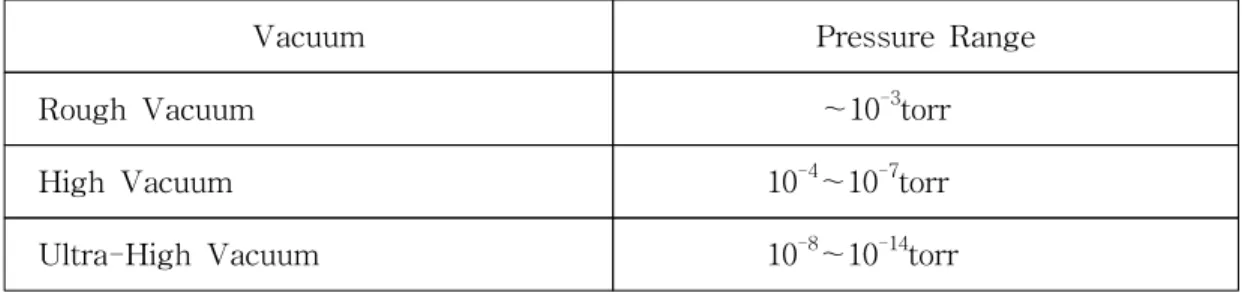
SAM 전자 Auger 전자 방출된 Auger 전자로 영상구성 화학성분의 분포 측정 표면연구를 하는데 있어서 연구에 사용되는 깨끗한 표면(clean surface)이 반응 시키고자 하는 기체이외의 다른 기체들의 영향을 받지 않게 하기 위해서 표면 화 학 연구는 일반적으로 진공용기(vacuum chamber)를 사용한다. 진공(vacuum)의 정의에 따르면 일정 공간 내에 2.5×1019molecule/cm3이하의 밀도를 가지면 진공으 로 정의하고 있다. 또한 진공도(眞空度)에 따라서 각각을 분류하고 있는데, 이것은 다음의 Table 2.와 같다.
Table 2. 진공도(眞空度)에 따른 분류
Vacuum Pressure Range
Rough Vacuum ∼10-3torr High Vacuum 10-4∼10-7torr Ultra-High Vacuum 10-8∼10-14torr
표면 분석을 진공용기 내에서 수행하는 이유는 우선 준비된 진공도가 좋을수록 (낮은 압력일수록)진공 용기 내부에 기체 분자들이 적어지기 때문에 준비된 시료 가 불순한 기체 분자들에 의한 오염(contamination)으로 단분자층(monolayer)이 형성되어 실험을 방해하는 것을 줄일 수 있어, 진공도가 좋을수록 표면을 깨끗한 (오염이 적은) 상태를 유지할 수 있는 시간이 길어져 실험을 하기에 충분한 시간 을 확보할 수 있기 때문이기도 하다.
흡착(adsorption)이란, 기체 분자가 고체 표면에 충돌했을 때 결합을 이루어, 그 결과 분자 한 개 또는 몇 개 정도의 두께가 되는 층을 형성하는 것이다. 이러한 흡착은 보통 물리흡착(physisorption)과 화학흡착(chemisorption)의 두 가지 형태 가 있는데, 먼저 물리흡착은 흡착질과 흡착제(absorbent)사이에 전자 전달이 없이 van der Waals 힘의 형태로 인력이 존재해 흡착질과 흡착제가 붙어 있는 경우를 말하며, 화학 흡착은 흡착질과 흡착제 사이에 화학 반응과 같은 전자 전달, 즉, 둘 사이의 오비탈 중첩(orbital overlap)에 의한 것이며, 따라서 화학흡착의 인력은 적 절한 화학결합에서 기인되는 형태이다. 화학흡착은 일반적으로 높은 활성화 에너 지(40∼800eV)를 필요로 하고, 이 때문에 상대적으로 낮은 온도보다는 높은 온도 에서 흡착이 잘 일어나는 특성이 있다. 이와는 반대로 물리흡착(5∼40eV)은 낮은 온도에서 일어난다. 화학흡착은 기체 분자들과 표면의 기하학적, 전자 구조적 특 성에 의해서 흡착자리(absorption site)가 정해지며 이 배열에 따라 흡착이 일어나 지만, 이에 반하여 물리 흡착은 일반적으로 흡착자리 배열에 거의 의존하지 않는 경우도 있다. 따라서 화학흡착의 흡착 계수(absorption coefficient)는 표면 원자 배 열(surface atom array) 및 흡착율(coverage, θ)과 같은 환경의 영향을 많이 받는 다고 할 수 있다.
초기의 표면에 관한 연구는 촉매 활성을 나타내는 금속 표면위에 일산화탄소 (CO), 일산화질소(NO), 수소(H2) 등의 간단한 기체(simple gas)를 흡착시켜 연구 가 진행되었고, 관심 대상도 주로 표면의 기하학적 구조 분석과 촉매 활성 금속 표면에서의 기체의 반응에 머물렀었다. 그러나, 진공 기술의 발전, 표면 분석 기술 의 발전 등으로 보다 다양한 고체 표면에 대해서 연구할 수 있게 되고, 흡착질의 경우에도 간단한 기체에서 실온에서 액체 또는 고체인 물질 뿐 아니라 유기 화합 물처럼 복잡하고 큰 분자도 화학 증착법(chemical Vapor Deposition, CVD)등을
이용하게 됨으로써 고체 표면에 흡착시켜 연구할 수 있게 되어 초기의 연구보다 정보의 양이 많아지고 정확도 및 정밀도가 높아지고 있다. 따라서 현재는 반도체 특성 연구, 신소재개발, 정밀 화학 등 그 영역이 영향을 끼치지 않는 곳이 없다고 해도 과언이 아니다.
반도체 산업에 이용됨에 있어서 실험에 사용한 silicon(Si)은 다른 반도체 물질 보다 자원이 풍부하고 반도체로서의 좋은 특성을 지니고 있어 가장 많이 사용된 다.
또한 유기화합물은 현재 반도체 제조공정에서 PR(photoresist) 등으로 실제 사 용되고 있지만, 열 안정성과 같은 단점으로 인해 그 이용범위가 한정적이다. 그럼 에도 불구하고 표면성질의 변화를 유도해 원하는 표면성질을 부여할 수 있고, 표 면반응을 제어하는데 있어 그 응용성이 매우 커 이에 대한 보다 자세하고 많은 연구가 진행되어야 할 것이다.
본 실험에서는 자기 조립 단분자막(Self Assembled Monolayers : SAMs)과 같 이 표면성질을 제어하는데 사용될 수 있는 alcohol들의 열적인 행동(Thermal behavior)들에 대해 저에너지 전자회절(Low Energy Electron Diffraction : LEED)과 열 탈착 분광법(Thermal Desorption Spectroscopy : TDS)을 이용해 그 열에너지에 의한 탈착 메커니즘을 연구했고, 이 연구 결과는 silicon에 흡착된 alcohol들의 열에너지에 대한 안정성을 높이는 연구 등에 많은 도움이 될 수 있을 것이라고 기대된다. [1-7, 39, 40]
Ⅱ. 이 론
1. UHV system
깨끗한 표면은 위쪽 원자의 부재(不在)로 인하여 다소간의 불포화 원자가를 가 지고 있어 기체상으로부터 충돌해 오는 알맹이들에 대하여 매우 큰 반응성을 가 지고 있다. 따라서 깨끗한 표면의 조건을 유지시키기 위해서는 표면에 도달하는 기체 분자의 속도를 감소시켜서 흡착되는 기체가 표면을 완전히 덮는데 필요한 시간이 실험하는데 필요한 시간보다 충분히 길게 해 주어야 한다. 1s(second) 동 안에 1cm2의 표면을 때리는 알맹이 수 ns는 기체분자 운동론에 따라 다음과 같이 주어진다.
n s=
(
14)
N gν여기서 Ng는 cm3당의 기체 분자수이며, ν는 평균열운동 속도이다. 이 식으로부 터 다음과 같은 관계를 얻을 수 있다.
ns = Ng
(
2πMRT)
1
2 ≈ 3.5 × 1022 p (MT)
1 2
[cm-2s-1]
여기서 R은 기체상수, T는 절대온도, M은 분자량, 그리고 p는 기체압력으로서 torr로 주어진다.
단분자층의 용량을 3×1014particles/cm2, 평균분자량을 M = 28, 그리고 T를 300K로 취하면
ns = 106 × p [monolayers/s]
가 된다. 다시 말해서 10-6torr(표준 고진공 조건)의 압력 하에서는 단분자층을 형 성하는 데 필요한 수만큼의 분자가 매 초마다 표면에 공급된다는 것을 의미한다.
그런데 덮임시간 τ는 다음과 같이 표면에 충돌하는 분자가 흡착되는 확률, 즉 점착률 s에 의존한다.
τ = 1
( nss) ≈ 10- 6 (sp)
s는 1에 가까울 때가 많다. τ의 값을 1시간(깨끗한 표면을 가지고 실험하는데 필요한 시간)으로 해주기 위해서는 잔류기체의 압력이 10-10torr이하여야 하고 따 라서 표면연구를 위해서는 초고진공의 압력이 반드시 필요하다고 볼 수 있다.
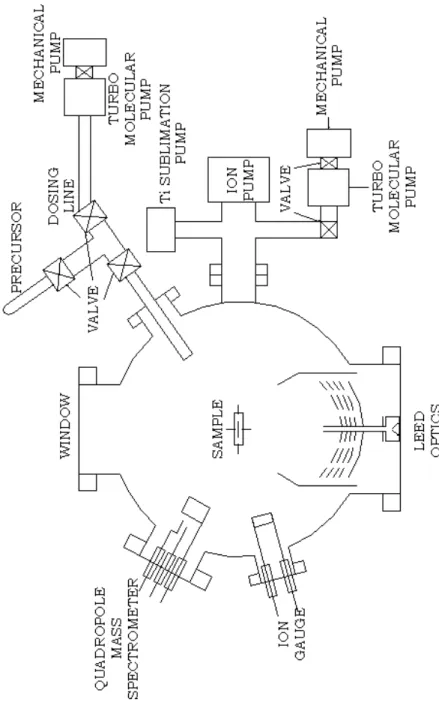
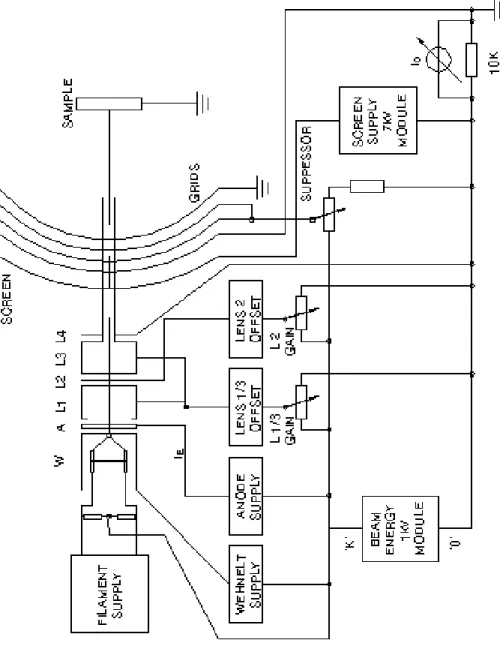
따라서 본 연구를 위해 제작된 초고진공 실험장비는 초고진공용 용기의 재료로 는 초고진공 하에서 재질 자체 가스 방출이 적으면서도 표면분석 등에 이용하기 위한 재질의 특성이 이미 잘 알려진 스테인리스-304로 이루어 졌고, 초고진공 봉 입은 무산소 구리로 만들어진 conflat 형태의 Cu-gasket을 사용하였다. 또한 초고 진공의 압력을 얻기 위해 rotary pump, turbo molecular pump, ion pump, titanium sublimation pump를 조합하였고, 진공용기 내의 압력을 측정하기 위한 ion gauge와 시료의 이동을 위한 시료이동장치가 부착되어 있고, 또한 진공용기내 의 잔류기체의 부분압력을 측정할 수 있는 quadrupole mass spectrometer, LEED pattern을 확인하기 위한 LEED optics, 그리고 기체주입장치가 부착되어 있다.
Figure 1.은 분석장비가 부착된 실제 실험에 이용된 UHV장비의 도식도이다. [8]
Figure 1. UHV diagram
2. TDS(Thermal Desorption Spectroscopy)
2. 1. TDS의 원리
TDS란 Thermal desorption spectroscopy(열탈착 분광학)의 약자로서, 여기서 탈착(desorption)이라는 말은 화학종이 고체 표면에 흡착되었을 때, 어떤 자극에 의해 흡착 결합이 끊어져서 흡착종이 표면으로부터 떨어져 나가는 것을 말한다.
이러한 자극의 종류에는 전자, 이온, 전자기장, 빛 등 여러 가지가 있으며, 특히 열에너지를 가지고 자극했을 때를 열탈착(thermal desorption)이라고 한다. 기체/
금속 시스템의 온도를 증가시키면 열에너지가 흡착종들과 기질간의 진동에너지보 다 클 때 탈착이 일어난다. 따라서 이러한 탈착현상으로부터 우리는 탈착에너지, 탈착 반응차수, 흡착 종들간의 흡착 상태 및 이들 종들의 농도 등에 관한 정보를 얻을 수 있다. 이와 같은 표면분석 방법을 열탈착 분광법이라 한다. 이러한 열탈 착 분광법의 원리와 해석방법 및 응용에 관해서는 이미 많은 논저 또는 논문에 상세히 설명되어져 있다.
일정한 속도로 펌프하고 있는 진공용기 안에서 흡착질이 흡착된 시료를 시간에 따라 일정한 속도로 가열시켜 온도를 증가시키면 분석실 내의 압력이 증가할 것 이다. 이 때 질량분석계를 이용하여 온도증가에 따른 탈착 화학종의 부분압력을 기록하면 탈착스펙트럼이 얻어지게 된다. 이 때 탈착되는 흡착종이 다시 시료 표 면에 흡착이 일어나지 않을 만큼 빠른 속도로 진공용기를 pumping해야 한다. 이 러한 탈착과정 동안 분석실 내의 시간에 따른 압력(부분압)의 증가는 pumping되 는 표면으로부터 탈착하는 화학종의 양과 pumping되는 양의 차에 의한 것이므로 다음과 같은 식으로 나타낼 수 있다.
dP
dt =
(
kTV) (
dNdt)
- SPV (1)여기서 P는 계의 압력, V는 계의 부피이며, N은 탈착 화학종의 수, k는 Boltzmann 상수이고 S는 pumping속도이다. 그리고 단위면적당 탈착속도는
Rd = dN
Adt =
(
kTV) (
dPdt)
+ SPkT (2)우리의 진공용기에 사용된 펌프의 pumping속도는 대단히 크므로 첫째항은 무 시될 수 있다. 따라서 탈착속도는 압력에 비례한다는 것을 알 수 있다. 즉,
Rd = dN
Adt ≅ SP
kT (3)
(3)식을 시간에 대해서 적분하면 다음과 같이 나타낼 수 있다.
N = S
( AkT)
⌠⌡
∞
0 Pdt (4)
이 (4)식에 의하면 열탈착 스펙트럼의 면적은 단위면적당 탈착하는 화학종의 수 에 비례함을 의미한다.
일반적으로 화학반응 속도록에서 단위면적과 단위시간당 탈착되는 입자들의 속 도(Rd)는 단위면적당 흡착된 입자들의 농도(N)와 온도(T)에 각각 의존한다.
따라서 이들의 관계는 다음과 같은 식으로 나타낼 수 있다.
Rd = - dN
dt = f(T,N) (5)
그런데 이 식은 다음과 같은 Polanyi-Wigner 식으로 나타낼 수 있다.
Rd = kmNm = Nmkm0exp
(
- ERTm)
(6)여기서 N는 단위 면적당 흡착된 입자들의 농도이고, km는 속도 상수이며, m은 반응차수, km0
는 선지수 인자(pre-exponential factor) 그리고 Em은 활성화 에너지 이다.
이때 이 식은 다음과 같은 가정에 근거를 둔 식이다.
첫째, 덮힘율 항(Nm-term)은 탈착반응에 관여하는 흡착종의 수에 의존한다.
둘째, 선지수 인자는 탈착 방향의 진동수이며, 또한 이것은 온도에 무관하다.
셋째, 지수항(온도 의존항)은 탈착 가능한 흡착종 중에 최소의 탈착에너지를 가지는 흡착종의 수만이 탈착한다고 가정한 것이다.
기질의 온도가 선형적으로 증가한다고 가정하면, 온도는 다음과 같이 시간의 함 수로 나타낼 수 있다.
T = T0 + βt (7)
여기서 β = dT
dt 이며 가열속도를 의미한다. 그리하여 탈착속도는 다음과 같 은 식으로 변형된다.
- dNdt = Rd(t) = Nm(t)km0
exp
[
R( T- E0+ βt)m]
(8)만약 Em와 km0가 덮힘율 N에 독립적이라고 가정하면 최대 탈착온도 Tp에서 dN
dt = 0 가 되므로 (8)식은 다음과 같은 식으로 된다.
즉,
E 1
R T 2p =
(
kβ01)
exp(
- ER Tp1)
for m = 1 (9) E 2R T 2p =
(
2 Nβpk 02)
(2Npk20/β)exp(
- ER Tp2)
for m = 2 (10) 따라서 이 식을 다시 쓰면 다음과 같이 나타낼 수 있다.ln
(
Tβ2p)
= R TE 1p+ ln
(
kE01R1)
for m = 1 (11) ln(
T 2βpN p)
= R TE 2p+ ln
(
kE02R2)
for m = 2 (12)여기서 Np는 최대속도에서의 덮힘율이고, m = 2 일때는 2Np≈N0이다.
그러므로 윗 식으로부터 β값을 변화시키면서 T 2p
β 대 1
Tp 그래프를 그리면 기울기로부터 E를 구할 수 있고, 절편으로부터는 k0를 구할 수 있다. 그리고 1차 탈착은 덮힘율에 독립적이고 2차 탈착은 덮힘율에 의존하고 있음을 알 수 있다.
2. 2 여러 가지 TDS 분석 방법
2. 2. 1. Redhead's method
Redhead는 선지수 인자(km0
)를 가정하고 단지 최대 탈착온도 Tp를 측정해서 탈 착차수가 1차인 탈착 활성화 에너지는 다음과 같은 식으로 구할 수 있다고 제안 하였다.
E1 = RTp
[
ln(
k mβT p)
- 3.46]
(13)여기서 β
(
= dTdt)
는 가열속도(heating rate)이다.이러한 방법은 단지 1차인 single TPD(Temperature-Programmed Desorption) 곡선에 대해 아주 쉽게 적용시킬 수 있다. 또한 Redhead는 이미 Ed를 알고 있을 경우 Zero-order 이상에 대해 km0
를 구하는 식을 다음과 같이 나타내었다.
km0
=
(
R TE2pNdβm - 1o)
exp(
R TE dp)
, m>0 (14)여기서 No는 초기 덮힘율(intial coverage)이다.
따라서 Redhead가 제안한 desorption trace에서 Ed를 구하는 방법은 아주 간단 한 방법이지만 km0
를 적당한 값(보통 1013sec-1)으로 가정함으로써 구하는 것으로 써 만일 이러한 가정이 틀렸을 경우 많은 오차가 발생될 수 있고 또한 덮힘율에 무관한 탈착인자를 갖기 때문에 매우 근사적인 방법이다.
2. 2. 2. Complete analysis
이 방법은 km0
와 Ed가 덮힘율(coverage)에 무관하다고 가정하지 않는다. 2.1.
TDS원리에서 언급한 바와 같이 단일 흡착상태에 대하여 속도 방정식은 다음과 같이 간단하게 나타낼 수 있다.
- dNdt = km0
(N)Nmexp
(
-E ( N)RT)
(15)그리고 탈착하는 화학종의 수는 다음과 같이 주어진다.
N = S ( AkT)
⌠⌡
∞
0 Pdt (16)
앞의 식을 사용하면 t 함수로써의 N을 구할 수 있고 또한 구해진 값 N에 대하 여 흡착제의 온도 T에 일치하는 값을 얻을 수 있다. 왜냐하면 탈착 속도는 이미 알고 있는 탈착 곡선으로부터의 N과 T의 각각의 조합(combination)이기 때문이 다.
그러므로 ln(rate)와 1
T 을 도시하면 그 기울기로부터 덮힘율의 함수로서의 E(N)을 구할 수 있고, 절편 mlnN + lnkm0(N)으로부터 반응차수를 알고 있으면 0.1이상의 덮힘율에 대하여 mlnN항은 lnkm0
(N)항에 비해 대단히 작으므로 무시하 고서 km0
값을 찾을 수 있다. 하지만 이 방법은 km0
(N)의 온도 의존성을 포함하고 있지 않다.
2. 2. 3. Leading edge analysis (HK method)
이 방법은 온도에 의존하는 km0
(N)에 대한 정보를 주며 선지수 인자(pre -exponential factor)의 가정없이 TDS로부터 Ed를 구할 수 있는 방법이다. 낮은 온도에서 상대적으로 적은 온도 간격을 선택하여 Arrhenius 도시를 해주면 직선
의 기울기 - E( N)
R 과 절편 mlnN + lnkm0
ν(N,T)를 구할 수 있다.
이러한 방법의 장점은 우선 가정이 적다는 것과 온도에 의존하는 탈착인자를 고려한다는 것이다. 하지만 탈착 스펙트럼에서 초기의 leading edge(<5%)를 사용 함으로써 탈착속도가 작고 또한 본질적으로 정확성이 떨어진다고 볼 수 있는데, 이것은 신호 대 잡음의 비율(signal to noise ratio)이 나쁘기 때문이다. 또한 이 방법은 반응차수에 대한 정보를 제공하지 못한다.
2. 2. 4. Heating Rate Variation method
이러한 방법은 가열속도가 증가함에 따라 높은 온도로 탈착 봉우리가 이동하고 더 큰 진폭(amplitude)을 갖는다는 사실을 이용하는 것으로써 nonnegative-order curve에 적용할 수 있다. 만일 덮힘율에 따라 Ed가 변한다면 다음 두 가지 방법에 의해 Ed를 구할 수 있다.
하나의 방법은 가열속도 변화에 따른 탈착 봉우리의 온도 이동에 대한 관계를 적용하는 것이고, 다른 하나의 방법은 봉우리 진폭(peak amplitude)을 고려하는 것이다.
ln
(
Tβ2p)
= ln(
R k 0mEN m - 1p)
- ER(
T1)
(17)ln(Np) = ln(km0
(Np)) - E
R
(
T1)
(18)위 식에서 알 수 있듯이 봉우리 크기(peak height) Np와 β T 2p
에 ln을 취하고
1
T 에 대해 도시하면 그 기울기 - Ed
R 로부터 Ed를 구할 수 있다. 이러한 방법 은 선지수 인자, 반응차수, 탈착곡선의 모양에 대한 가정없이 각 탈착곡선에 대해 Tp와 Np를 측정함으로써 Ed를 구할 수 있다는 점에서 유용하다. 하지만 정확한
Ed를 구하기 위해서는 적어도 2자리 정도의 대단히 빠른 가열속도 변화가 요구되 는데 이러한 것은 실험적으로 어렵다. 또한 낮은 가열속도에서는 신호(signal)를 관측할 수 없으므로 낮은 포화 덮힘율에 적용시키기 어렵다. 또 한가지 단점으로 는 반응차수를 결정할 수 없다는 것을 들 수 있다.
2. 2. 5. Isotherms method
이 방법은 어떤 선택된 여러 온도에서 탈착 속도와 덮힘율
(
⌠⌡TNdT)
를 측정하여 탈착속도 등온곡선을 얻는 것인데, 그 각각의 등온선에 대해 주어진 온도에서 ln(rate)와 ln(coverage)를 도시하여 그 기울기로부터 반응차수를 구하고 그 등온 선 series에서 ln(rate)를 1
T 에 대해 도시해주면 그 기울기
(
- ERd)
로부터 덮힘율 함수로서의 Ed를 구할 수 있다.
한편 Tokoro 등은 다른 초기 덮힘율 대신에 서로 다른 가열속도를 사용하여 한 단계(one-step) 탈착과정에 있어 더 정확한 덮힘율(coverage)의존 km0
와 Ed를 구 하였다. 또한 Falconer 등은 다음과 같은 식을 제안하였다.
lnN =
(
ln k om- RTE d)
+ mln(N) (19) lnN = ln(km0Nm) - Ed
R
(
T1)
(20)이러한 방법을 쓰면 반응차수와 N에 의존하는 Ed를 구할 수 있는데 하지만 반 응차수를 구함에 있어 정확성을 기대하기가 힘들다. 왜냐하면 낮은 덮힘율의 데이 터들이 기울기에 크게 영향을 주기 때문이다. 또한 이 방법은 중복(overlapping)된 탈착곡선의 경우 탈착 변수(kinetic parameter)를 구하기 힘들다. 그리고 정확한 덮힘율 및 충분히 큰 배기속도(pumping speed)를 얻을 수 있는 초고진공 시스템 이 요구된다.
2. 2. 6. Peak width analysis(CAW method)
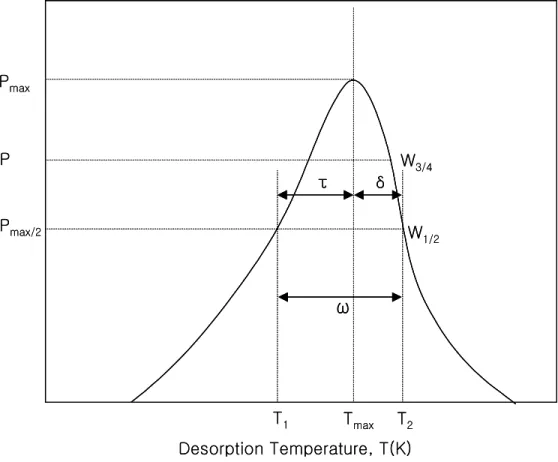
또 다른 일반적인 방법은 Chan-Aris-Weinberg에 의해 제안된 탈착온도와 탈착 봉우리의 나비(peak width)를 측정함으로써 단일 탈착 곡선을 분석하는 방법이다.
봉우리 나비는 두 가지로 분류할 수 있는데, 하나는 반높이 나비(half-width) W1/2
이고 다른 하나는 three-quarter width W3/4이다(Figure 2.).
이 방법은 Ed를 계산하는데 가열속도를 알 필요가 없으며 단지 하나의 탈착곡 선을 가지고 서로 다른 두 개의 Ed값을 얻을 수 있다.
First-order E1 = RTp
[
-1 + ( Y1/2Y)2+5.8321/2 1/2]
(21)E1 = RTp
[
-1 + ( Y3/4Y)2+2.3533/4 1/2]
(22)Second-order E2 = 2RTp
[
-1 +(
( Y1/2Y)21/2+3.117)
1/2]
(23)E2 = 2RTp
[
-1 +(
( Y3/4Y)23/4+1.209)
1/2]
(24)Y1/2 = W 1/2
T p , Y3/4 = W 3/4 T p km0
= Eβ
R Tp exp
(
R TE p)
for m = 1 (25) km0= β E 2
(
R TE p +2)
N o R 2T 3p exp(
R TE p)
for m = 2 (26)그러나 이 방법은 봉우리가 중복되는 탈착과정에서는 사용할 수 없고 또한 초 기 덮힘율 N0(t=0)에서 얻어진 것이므로 실질적인 덮힘율이 아니라는 문제가 있 다. 따라서 물리적 명백성을 띠기가 어렵다. 그러나 Ed, km0가 덮힘율(N)에 의존하 지 않는다고 가정했을 때 CAW방법은 보다 정확한 값을 가질 수 있을 것이다. 하 지만 불행하게도 많은 overlayer에 대해 Ed와 km0
는 덮힘율 N에 의존한다. 그러므
로 zero-coverage의 경우에 한해서 상당히 정확한 Ed와 km0
값을 예측하는 데 사 용할 수 있다.
2. 2. 7. Area method
이 방법은 탈착곡선의 면적 적분(area integration)에 기초를 두고 분석하는 것 이다. 탈착 활성화된 과정에 있어서 탈착속도는 탈착 곡선 각각의 세기(intensity) 와 면적으로부터 구할 수 있다. 또한 속도 데이터의 Arrhenius 도시로부터 Ed와 탈착을 위한 적절한 진동수(선지수 인자)값을 알 수 있으며, 탈착 과정의 반응차 수는 Arrhenius 도시의 linear fit를 찾음으로써 구할 수 있다. 이 경우 속도상수는 다음과 같은 식으로 주어진다.
km = A
m - 1
o β i(T)
[ Ao-A(T)]m (27)
여기서 A0는 탈착곡선 아래의 총면적이고, i(T)는 그 온도에서의 탈착곡선의 세 기값이며, A(T)는 그 온도까지의 면적, β는 가열속도이다.
lnkm와 1
T 의 도시로부터 Ed와 km0
를 구할 수 있는 이 방법은 단일 탈착봉우리 에 적용시킬 수 있으며, 복잡하게 deconvolut된 봉우리에 대해서는 사용하기 힘들 다. 하지만 이러한 방법은 간단하며 사용한 기술에 관계없이 탈착곡선으로부터 탈 착변수(kinetic parameter)를 구하는데 사용할 수 있다. [9-16, 39]
T1 Tmax T2
ω
τ δ
W1/2 W3/4 Pmax
P
Pmax/2
Desorption Temperature, T(K) T1 Tmax T2
ω
τ δ
W1/2 W3/4 Pmax
P
Pmax/2
Desorption Temperature, T(K)
Figure 2. The positions of peak temperature, peak amplitude, half-width, three-quarter width for TDS curve.
3. LEED(Low Energy Electron Diffraction)
3. 1. 서 론
전자회절은 1927년 Davission과 Germer에 의해 발견된 이래 많은 연구와 발전 을 거듭해 왔다. 에너지 영역은 수십 eV에서 수십 keV까지 사용하며, 에너지의 크기에 따라 LEED(1eV∼1keV), MEED(1keV∼5keV), HEED(5keV∼100keV) 등 으로 구분된다. 이러한 전자회절 현상을 이용한 고체 표면의 연구는 Germer 및 그의 동료들이 LEED 장치를 만든 이래 깨끗한 표면 구조의 2차원 주기성의 관점 으로부터 관측되고 논의되었다. 그러나 표면에 대한 구체적인 구조분석은 강도계 산이 완전하지 않기 때문에 아직까지 매우 어려운 문제로 남아있다.
LEED는 Low Energy Electron Diffraction의 약자로서 표면 연구에 적당한 4 0∼1000eV 범위의 저에너지 전자를 사용한다. 이 에너지에 대응하는 드브로이(de Broglie)파장은 1.94Å에서 0.388Å이며, 이 파장은 원자사이의 거리와 일치한다.
따라서 이러한 에너지를 갖는 전자를 단결정에 충돌시켰을 때 주기적으로 원자 가 배열된 표면에 의한 간섭 현상에 의해서 회절현상이 일어난다. 이 현상을 저에 너지 전자회절(LEED)이라고 한다. 그러므로 LEED를 이용하면 고체 표면의 기하 학적 구조에 관한 정보를 얻을 수 있다.
3. 2. LEED의 원리
고체 내에서의 전자선의 회절은 전자선회절 이론에 따라 산란 벡터 g와 결정축 의 실격자 기준 벡터 →
a 1 ,
→ a2 ,
→
a3 가 Laue조건
(
→g ⋅ →a 1)
=2πh,(
→g ⋅ →a 2)
=2πk,(
→g ⋅ →a3)
=2πl:h,k,l은 정수) (28)을 만족하면
→
a 1 ⋅ →
a *1 = 2π, →
a2 ⋅ →
a *2 = 2π, →
a 3 ⋅ →
a *3 = 2π (29)
와 같은 관계가 성립한다.
(28)식의 Laue 조건은 h, k, l이 정수인 경우 산란벡터 → g 가
→
g = h →
a *1 + k →
a *2 + l →
a *3 (30)
이면 만족된다. 즉, 산란벡터 →
g 가 역격자 점에서 끝점을 가질 때 Laue 조건이 만족되어 회절파를 일으킨다.
또한 산란벡터 →
g 가 역격자 벡터와 일치하게 되어 Bragg 반사조건도 만족하 게 된다.
→ a , →
b , →
c 를 기준 벡터로 하는 실격자에서 어떤 격자면이 → a , →
b , → c 축과 교차하는 점이 →
a h
, → b k
, → c l
인 경우에는 그의 격자면이 면지수(miller
indices)는 (hkl)로 표시한다. (30)식으로 표현된 역격자의 원점과 (hkl)면에 수직이 됨이 기하학적으로 증명되어 있다. 또한 밀러지수 (hkl)를 가지는 면은 등간격으 로 많이 존재하게 되는데 그들의 면간 간격을 dhkl이라 하며,
|
→g|
= d1hkl(31)
인 관계가 있다. 고체 표면과 같은 2차원적인 구조의 경우에는 역격자가 표면에 수직한 방향으로 늘어난 막대(rod)군으로 되며,
→ a *i
→
a j = 2πδij
δij = 1, i = j
δij = 0, i ≠ j (32)
의 관계가 성립한다. 한쪽 방향으로의 주기성이 없기 때문에 역격자 막대는 2개의 밀러지수 h, k로 표시될 수 있고, 역격자 벡터 g는 표면에 놓이게 되며
→
ghk = h →
a *1 + k →
a *2 (33)
로 주어진다. 전자선의 회절방향을 결정하는 직관적인 방법으로는 Ewald 구의 작 도가 있다.
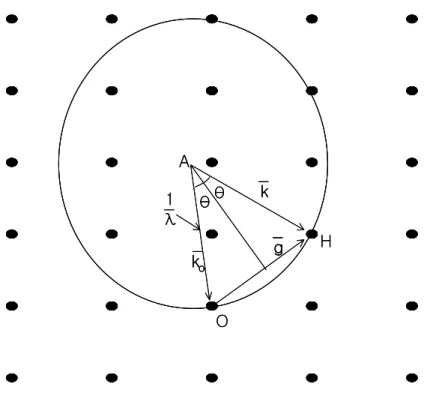
그림의 역격자에서 전자선의 입사벡터 →
ko 의 끝점을 역격자의 원점으로 하고, 시작점을 A를 중심으로 하는 반경이 1/λ=
(|
→ko|)
인 Ewald구를 그려서, 이것과 교차하는 역격자점을 H라 하면 →AH 의 방향으로 전자선의 회절이 일어나게 된 다. Figure 3.과 (31)식으로부터
|
→g|
= d1hkl= 2
(
1λ)
sinθ2dhklsinθ = λ (34)
이 되어, n=1인 경우의 Bragg 반사조건이 된다. 이와 같이 역격자 막대와 Ewald 구와의 관계를 작도하면, 전자선의 방향이나 가속 전압을 변화시키는 경우 어떤 방향으로 전자선이 회절을 일으키는가를 매우 직관적으로 파악할 수 있다.
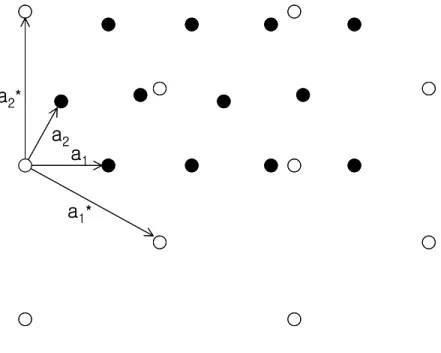
3. 3. 실격자와 역격자와의 관계
표면구조의 단위세포(unit cell)를 유도하는 데는 역격자의 개념을 이용하는 것이 편리하다. 다음과 같은 식을 만족시키는 기본벡터(basis vector) a1*, a2*를 역격자(reciprocal lattice)라고 정의한다.
ai aj*
= 2πδij(i, j = 1, 2) (35)
여기서 Kronecker 기호 δij는 i ≠ j일 경우 0이고, i = j일 경우 1이다. 즉, a1
⊥ a2*
이고, a2 ⊥ a1*
이다(Figure 4.).
그리고 a1과 a2 사이의 각도를 γ라고 할 경우, a1a1*
= 1/cos(π/2 - γ) 또는 a1* = 1/(a1sinγ)이며 마찬가지로, a2* = 1/(a2sinγ)이며, a1 ⊥ a2*이다.
한편 a1*
과 a2*
사이의 각도 γ*는 γ* = γ + 2(π/2 - γ) = π - γ 로 주어지며, 따라서 sinγ* = sinγ이 된다.
실격자(real lattice)의 기본세포(elementary cell)의 넓이는 다음과 같이 주어진다.
A = a1a2sinγ = | a 1× a 2|
역격자의 경우는 다음과 같으며
A* = a1*a2*sinγ* =
|
a *1× a *1|
= 1/A (36)만일, 기질격자 a1, a2 위에 기본벡터 b1과 b2를 가진 표면구조가 포개져 있을 때에는 두 격자 a와 b 사이에 b = ma인 관계가 성립한다. 즉,
b1 = m11a1 + m12a2
b2 = m21a1 + m22a2 (37)
역격자 a*와 b*사이에서도 이와 비슷한 관계가 성립한다.
b1*
= m11*
a1*
+ m12*
a2*
b2*
= m21*
a1*
+ m22*
a2*
(38)
mij*
는 회절 무늬로부터 얻을 수 있다.
m*는 m의 inverse transposed matrix이므로 m* = m-1과 m = m*-1이다.
따라서 다음과 같은 관계를 얻을 수 있다.
m11 = (1/det m*)m22*
m12 = (1/det m*)m21*
m21 = (1/det m*)m12*
m22 = (1/det m*)m11*
(39)
여기서 det m* = m11*m22* - m21*m12*이다.
따라서 위의 식들을 이용하면 실표면 격자를 해당하는 역격자로부터 간단하게 이끌어 낼 수 있다.
Figure 5.는 본 실험에 사용된 LEED의 도식도이다. [17-18, 41]
A
O
H ko
1 k λ θθ
g A
O
H ko
ko
k 1 k
λ θθ
g g
Figure 3. Ewald sphere construction in reciprocal space.
→
k o : incident beam wave vector.
→
k : diffraction beam wave vector →
g : reciprocal wave vector O : origin of reciprocal space
H : diffraction point of reciprocal space
a
2*a
1*a
2a
1a
2*a
1*a
2a
1Figure 4. A two-dimensional real lattice, described by a1, a2(dark circles), and its reciprocal lattice a1*
, a2*
(open circles).
Figure 5. LEED diagram
Ⅲ. 실험
1. Clean Si(100) substrate 준비
실험에 사용된 단결정 실리콘은 인(phosphorus)이 doping된 n-type Si(100) wafer이며, 25×8mm2 크기로 절단해 사용하였다. 시료는 진공용기에 설치하기 전 에 piranha 용액을 사용해 표면에 산화막을 형성 시켰다. 산화막을 형성시키는 과 정은 다음과 같다.
Si(100) substrate를 3차 증류수에서 표면 위의 불순물을 제거한 후 H2SO4 : H2O2가 3 : 1 비율로 섞여 있는 piranha 용액에 약 10분 정도 담근다. 이 과정에 서 규소 표면은 식각과정과 산소층의 형성이 동시에 일어나며 마지막엔 산소층이 형성된다. 그 후 시료를 N2 가스로 불어 제거한 후 HF 용액에 약 5분간 식각하여 표면 위에 수소층이 형성되도록 한다. 이 과정을 반복하여 표면 위에 균일하고 얇 은 산화층을 만들어 보호막의 역할을 하도록 한다. 이러한 산화층을 형성하는 과 정에서 표면의 평탄화가 일어난다.
이 시료를 진공용기에 장착하고, 진공 용기의 압력을 1.0×10-10torr의 압력을 유 지시킨 후 시료에 붙어있는 불순물을 제거하기 위해 750℃에서 약 5시간동안 시 료를 가열해 충분히 불순물을 제거하고, Si 기질 표면이 온도에 의한 손상을 받지 않는 낮은 온도에서 annealing(850℃)-flashing(1250℃)법을 이용하여 산화막과 오 염물을 제거했을 때 깨끗한 Si(100)표면을 준비할 수 있었다. 위의 annealing -flashing법은 모든 실험전후 그리고 실험중간에도 필요에 따라 이 과정을 반복하 여 항상 깨끗한 표면을 유지하였다. 표면의 깨끗함은 LEED를 이용해 깨끗한 Si(100)표면의 pattern인 2×1의 pattern이 형성되는 것으로 확인하였다. [6, 19]
2. Precursor Cleaning
실험에 Precursor로 사용된 시료들은 neopentanol을 제외하고는 상온에서 모두
liquid상으로 존재한다. 이러한 시료들은 초고진공 하에서 사용되기 때문에 증착시 키기 전에 불순물과의 혼합을 막고 순도를 유지하는 것이 매우 중요하다. 따라서 별도의 gas handling system에서 dry ice와 liquid N2를 이용해 freeze -pump-thaw과정을 10여 차례이상 반복함으로써 불순물을 제거하였다. 이 방법의 정제 원리는 물질이 얼 때 같은 원소끼리 모이는 성질이 있어 불순물을 바깥으로 배척하고, 밀려난 불순물은 진공 중으로 기화하여 펌프를 통해 방출되는 것이다.
또한 이렇게 불순물을 제거한 시료는 quadrupole mass spectrometer를 이용해 시료의 고유한 cracking pattern과 reference와 비교함으로써 확인할 수 있었다.
3. Adsorption
각 alcohol의 흡착과정은 앞(Ⅲ. 1)에서 말한 Si cleaning 방법을 통해 깨끗해진 Si(100)표면을 leak valve에 수직이 되도록 sample manipulator의 방향을 조정한 후 실온에서 각 실험에 사용한 순수한 alcohol을 leak valve를 이용해 gas 형태로 Si(100) 표면에 노출시켰으며, 1.0×10-6torr의 압력을 유지하면서 시간을 제어해 각 실험에 필요한 노출량을 조절하였다.
4. Desorption
시료에 흡착된 alcohol들의 탈착은 시료에 직접가열(direct resistive heating)방 법으로 시료를 가열해 탈착시키면서 특정온도에서의 LEED pattern의 변화와 TDS (Thermal Desorption Spectroscopy) spectrum, 그리고 IDMS (Integration Desorption Mass spectroscopy)로써 탈착에 관여된 여러 정보를 얻어낼 수 있었 다. [9, 20-22]
Ⅳ. 결과 및 논의
1. 1-Pentanol
1. 1. IDMS(Integrate Desorption Mass Spectrum) 결과
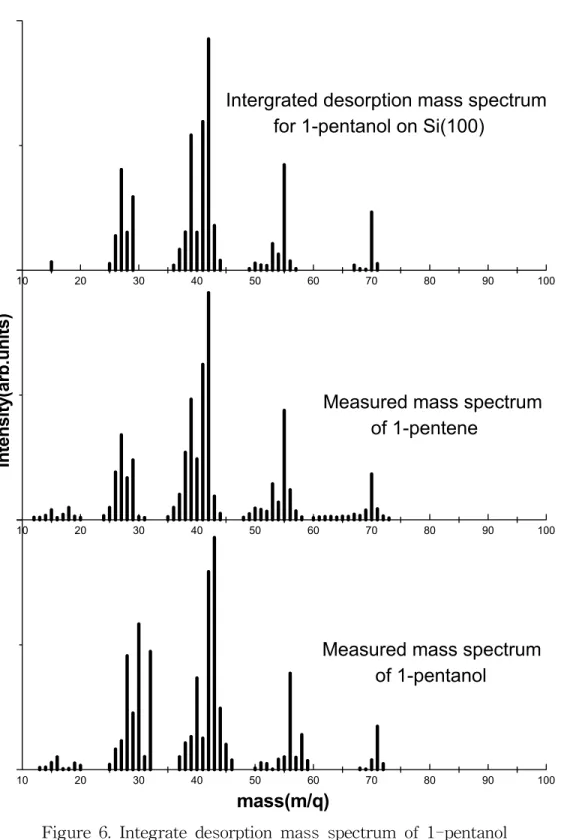
먼저 시료에 흡착시키기 전에 확인한 pentanol의 quadrupole mass spectrum을 보면 alcohol이 quadrupole mass spectrometer의 이온충격에 의해 cracking될 때 특징적으로 발생하는 m/q(질량 대 전하비)=31(CH2OH)의 fragment가 pentanol에 서도 역시 나타나는 것을 확인할 수 있고, pentanol의 전체적인 cracking pattern 이 reference와 잘 일치하는 것을 확인할 수 있었다.
시료의 온도를 일정한 속도(1K/s)로 증가시키면서 시료에서 탈착되어 나오는 화학종을 확인하기 위해 모든 가능한 각각의 m/q를 온도에 따라 분압의 변화를 측정하고, 그렇게 해서 얻은 TDS spectrum을 적분해 IDMS을 얻었고, 이 IDMS 와 일치하는 화학종을 찾기 위해 reference를 조사해 본 결과 1-pentene의 cracking pattern과 잘 일치하는 것을 확인할 수 있었다. 따라서 실제 1-pentene이 본 실험장비에서 어떤 cracking pattern을 가지는지 알기 위해 직접 1-pentene의 quadrupole mass spectrum을 확인한 결과 reference와 잘 일치하는 것을 확인할 수 있었고, 따라서 탈착되는 종이 1-Pentene이라는 결론을 얻었다(Figure 6.).
이 결과에서 Si(100)표면에서도 Cu, Au 등의 금속에서와 마찬가지로 alcohol의 탈착이 hydrogen elimination 반응경로에 따라 alkene으로 탈착되는 mechanism을 따른다는 것을 알 수 있었다. [7, 20]
10 20 30 40 50 60 70 80 90 100
Intergrated desorption mass spectrum for 1-pentanol on Si(100)
mass(m/q)
10 20 30 40 50 60 70 80 90 100
Measured mass spectrum of 1-pentene
Intensity(arb.units)
10 20 30 40 50 60 70 80 90 100
Measured mass spectrum of 1-pentanol
Figure 6. Integrate desorption mass spectrum of 1-pentanol
300 400 500 600 700 800 900
H2(m/q=2)
1-pentanol TDS
1-pentanol (m/q=31) 1-pentene (m/q=70)
Intensity(arb.units)
Temperature(K)
1. 2. TDS(Thermal Desorption Spectroscopy) 결과
IDMS를 얻기 위해 확인한 TDS 실험의 결과를 살펴보면 1-pentanol을 흡착시 켰을 때 탈착되는 화학종에서는 1-pentanol에서 나타나는 alcohol의 특징적인 m/q=31(CH2OH)의 fragment가 시료의 가열에 따라 증감없이 일정한 것을 확인할 수 있었다. 따라서 1-pentanol이 분자상태 그대로 탈착되는 것은 아님을 알 수 있 다.
또한 1-pentene의 molecular peak인 m/q=70(C5H10)은 약 520K의 온도에서 최대 탈착을 보이는 것을 확인할 수 있었다.
그리고 silicon 표면의 수소(m/q=2 ; H2)는 monohydride 상태로 Si(100)에 흡착 되어 있던 수소가 탈착하는 온도인 약 790K에서 최대탈착을 보이는 것으로 보아 Si 표면에 monohydride 상태로 존재했던 것을 확인할 수 있다(Figure 7.). [23]
Figure 7. Thermal desorption spectrum of 1-pentanol