대한소화기학회지 2008;52:1-8 □ REVIEW □
연락처: 이강문, 442-723, 경기도 수원시 팔달구 지동 93-6 가톨릭대학교 성빈센트병원 소화기내과
Tel: (031) 249-8151, Fax: (031) 253-8898 E-mail: drmaloman@catholic.ac.kr
Correspondence to: Kang Moon Lee, M.D.
Department of Internal Medicine, The Catholic University of Korea, St. Vincent Hospital, 93-6, Ji-dong, Paldal-gu, Suwon 442-723, Korea
Tel: +82-31-249-8151, Fax: +82-31-253-8898 E-mail: drmaloman@catholic.ac.kr
염증성 장질환과 영양
가톨릭대학교 의과대학 내과학교실, 성빈센트병원 소화기내과
이 강 문
Nutrition in Inflammatory Bowel Disease Kang Moon Lee, M.D.
Department of Internal Medicine, The Catholic University of Korea College of Medicine, Suwon, Korea
Nutrition, as a definite environmental factor, has been implicated in the pathogenesis of inflammatory bowel dis- ease (IBD). Although low-fiber, high-sugar, and high-animal fat diets have been proposed as a risk factor, the role of nutrition in IBD still needs more conclusive evidence. Nutritional deficiency is a common problem in IBD patients. The goals of nutritional intervention are the prevention and correction of malnutrition, the pre- vention of osteoporosis, and the promotion of optimal growth and development in childhood. Enteral nutrition is effective in induction and maintenance of the clinical remission in adults and promoting growth in children with Crohn's disease. The n-3 polyunsaturated fatty acids contained in fish oil may provide short-term benefit to pa- tients with IBD. (Korean J Gastroenterol 2008;52:1-8)
Key Words: Inflammatory bowel disease; Crohn's disease; Nutrition
서 론
염증성 장질환에서 영양 결핍은 매우 흔하면서도 심각한 문제이며, 질병 자체의 활성 및 합병증으로 인한 음식섭취 감소, 흡수장애, 영양소 소실 증가 및 요구량 증가, 약물과 영양소의 상호작용 등에 의해 초래된다.1 적절한 영양요법 을 통해 이러한 영양 결핍을 교정하고 장관의 염증을 감소 시킴으로써 질병의 활동도를 낮출 수 있다는 여러 보고들은 영양이 염증성 장질환의 관리 및 치료에 있어 매우 중요한 역할을 담당함을 보여준다.2 본고에서는 영양과 염증성 장 질환과의 관계를 ① 영양(식이)이 염증성 장질환의 발생에 미치는 영향, ② 염증성 장질환이 영양 상태에 미치는 영향,
③ 염증성 장질환에서 영양요법(nutritional therapy) 효과 등
으로 나누어 살펴보고자 한다.
식이(diet)와 염증성 장질환의 병인
염증성 장질환의 병인은 아직 명확히 밝혀지지 않았으나 유전적인 감수성을 갖는 숙주에서 장내세균 및 다양한 환경 요인들의 상호작용으로 인해 장점막의 비정상적인 면역반 응이 초래됨으로써 질병이 발생한다고 알려져 있다.3 최근 우리나라를 비롯한 아시아 국가들에서 서구화, 산업화가 진 행되면서 염증성 장질환이 급격히 증가하고 있으며, 유병률 이 낮은 지역에서 높은 지역으로 이주한 사람들의 자녀 세 대에서 염증성 장질환의 발생이 증가한다는 보고들은 환경 요인이 질환의 발생에 중요한 역할을 한다는 것을 보여준
2 대한소화기학회지: 제52권 제1호, 2008
Table 1. Causes of Malnutrition in Inflammatory Bowel Disease
Contribution factors
Poor oral intake Abdominal pain, anorexia, nausea, vomiting, fasting for tests Increased nutrient losses Diarrhea, bleeding, vomiting, intestinal protein loss, fistula Increased nutrient requirements Growth period, acute inflammation, sepsis, fever, disease activity
Nutrient malabsorption Extensive intestinal disease, surgical resection, bile salt deficiency, bacterial overgrowth Medications Corticosteroids, drug-nutrient interactions
다.4-6
식이는 명백한 환경요인 중 하나로 장내세균의 구성 및 대사에 중요한 영향을 미치며 숙주의 면역조절에 관여한다.
염증성 장질환 환자의 발병 전 식이습관에 대한 연구에서 고당질, 고지방 식이가 질병과 연관이 있었던 반면, 야채 및 과일, 섬유소의 섭취는 예방 효과가 있었으며,7,8 많은 역학 조사에서도 정제설탕, 패스트푸드, 마가린, 낙농제품 등의 연관성이 보고되었다.9 동물실험에서도 고당질, 고지방 식이 는 정상 혹은 고섬유질 식이에 비해 interleukin (IL)-10 knockout 생쥐에서 장염 발생을 촉진하였고,10,11 영양소 외에 철분, 알루미늄 같은 미네랄도 장내 세균의 증식을 촉진하 고 T 세포-매개 면역 반응을 증강시킴으로써 장염 발생을 촉진하였다.12,13 그러나 염증성 장질환의 발생과 식이와의 연관성에 대한 더 많은 연구가 필요하며, 현재까지는 균형 잡힌 식단과 생활습관의 변화 외에 질병 발생의 위험을 낮 추기 위한 특별한 식이요법이 추천되지는 않는다.
염증성 장질환에서 영양불량
염증성 장질환 환자들은 복통, 설사, 구역, 구토, 식욕부진 등의 증상을 흔히 호소하며, 장기간의 약물치료 및 수술이 필요한 경우가 많고, 장점막의 염증으로 인한 흡수장애가 초래되어 쉽게 영양불량 상태에 빠지게 된다. 체중감소, 저 알부민혈증, 빈혈 등이 가장 흔한 영양 결핍의 양상이며, 적 게는 외래환자의 23%, 많게는 입원환자의 85%에서 질병과 연관된 영양불량이 보고되었다.14,15
1. 영양불량의 원인
염증성 장질환에서 영양불량의 원인은 매우 다양하다 (Table 1). 음식 섭취의 감소가 영양불량의 주된 원인인데, 식사로 인한 복통의 악화 및 설사에 대한 두려움으로 인해 음식을 제한하게 되고 IL-1이나 TNF-α 같은 사이토카인에 의해 식욕부진이 초래된다.16 영양불량은 염증의 정도, 범위, 위치에 영향을 받는데 소장을 침범한 크론병의 경우 대장에 국한된 경우에 비해 영양 결핍이 더 흔하게 나타난다. 상부 및 중부 소장에서 흡수되는 대부분의 영양소와 달리 담즙산
염(bile salt)과 비타민 B12는 크론병의 호발부위인 말단회장 에서 흡수되므로 이 부위의 심한 염증이나 수술로 인한 절 제는 담즙산염과 비타민 B12의 결핍을 가져와 지방 및 지 용비타민의 흡수장애나 빈혈을 초래할 수 있다. 영국소화기 학회에서는 말단회장의 크론병 환자에서 매년 혈청 B12 수 치를 측정할 것을 권고하고 있다.17 치료를 위해 사용되는 각종 약제도 영양결핍을 초래할 수 있는데 스테로이드는 칼 슘, sulfasalazine은 엽산의 흡수를 저해하며, sulfasalazine, 5-aminosalicylic acid (ASA) 제제, metronidazole 등은 구역, 구토, 입맛 변화 등과 같은 증상을 유발할 수 있다.
2. 골다공증
골다공증과 골감소증은 염증성 장질환에서 흔히 나타나 는 영양의 문제로, 스테로이드 사용, 흡수장애, 비타민 D와 칼슘의 결핍, 전신적인 염증 등이 골다공증의 위험인자로 알려져 있다.18 영국소화기학회의 지침에 따르면 염증성 장 질환 환자들은 하루 1,500 mg의 칼슘을 섭취해야 하며 스테 로이드 치료를 받는 경우엔 비타민 D 800 단위를 함께 복용 할 것을 권고하고 있다.19 그러나 스테로이드 치료를 받는 경우엔 칼슘과 비타민 D의 복용만으론 예방에 한계가 있으 며, alendronate 혹은 risedronate 같은 bisphosphonate제제가 예방 및 치료에 효과적인 것으로 알려져 있다.20
3. 소아에서 성장과 발달
염증성 장질환 환자의 1/4이 성장과 발달에 중요한 시기 인 소아청소년기에 발병을 하므로 이 시기의 영양 결핍은 임상적으로 매우 중요한 의미를 갖는다. 처음 진단된 739명 의 소아 염증성 장질환 환자를 대상으로 한 연구에서 크론 병 환아들은 저신장과 저체중을 보였으며, 궤양성 대장염 환아에서는 저체중이 관찰되었다.21 성장 장애의 원인은 영 양 결핍, 염증, 스테로이드 사용, 유전 요인 등 다양하며, 이 런 원인들이 상호작용을 통해 성장 장애를 초래할 것으로 생각하고 있다. 특히 소아에서는 스테로이드 같은 고식적인 염증성 장질환의 치료가 영양 결핍과 더불어 성장 장애에 직접적인 영향을 미친다. 영양요법은 질병의 활동도를 감소 시키는 효과와 함께 기존의 약제들과는 달리 영양 상태를
이강문. 염증성 장질환과 영양 3
회복시켜 소아의 성장과 발달에도 도움을 준다는 점에서 주 목 받고 있다.2 항 TNF-α 항체인 infliximab 등 생물학 치료 제가 성장 및 영양 상태를 호전시키는 데 효과적임이 입증 되고 있다. 최근 infliximab에 반응을 보인 소아 크론병 환자 에서 체중 및 체질량지수가 유의하게 증가되고, 사춘기 이 전에 치료받은 경우엔 성장 속도의 정상화 및 신장 백분위 수의 증가가 동반되었으며22 향후 이에 대한 연구가 필요하 다.
염증성 장질환에서 영양요법
염증성 장질환 치료에서 영양은 매우 중요한 역할을 하지 만 크론병 식이요법, 궤양성 대장염 식이요법과 같은 특별 한 식이 프로토콜은 존재하지 않는다. 대부분의 외래환자들 은 체질량을 유지하고 소아청소년기의 성장과 발달을 촉진 하는데 충분한 열량과 단백질을 포함한 자유로운 음식섭취 로 잘 유지되므로, 몇몇 경우를 제외하곤 대부분의 염증성 장질환 환자에게 정상적인 식생활을 권유하는 것이 좋다.23 그러나 유당불내증(lactose intolerance)이 있는 환자에겐 유 당을 제한함으로써 복부팽만감 및 설사를 줄일 수 있고, 장 협착이 있는 환자에서는 곡류, 과일, 야채 등 섬유질이 많은 음식을 제한한다. 회장의 크론병 혹은 회장 절제술을 받은 환자에서는 저지방식이 요구되며, 지방변이 있을 경우엔 일 반적인 지방을 중쇄지방(medium chain triglyceride, MCT)으 로 대체하는 것이 필요하다. 담즙산염 및 지방 흡수장애로 인해 대장에서 옥살산염(oxalate)의 흡수가 증가하면 요로결 석 발생위험이 높아지므로24 일부 환자에서는 옥살산염 섭 취를 제한해야 한다. 철분, 칼슘, 코발라민(비타민 B12) 등 미량영양소의 결핍에도 주의를 기울여야 한다. 증상이 있는 크론병 환자들은 비타민과 미네랄 보충제를 복용해야 하는 데 지속적인 설사로 인한 아연 결핍은 하루 20-50 mg의 아 연 섭취로 교정이 가능하며, 앞서 언급했듯이 골다공증 예 방을 위해 칼슘 및 비타민 D 복용이 필요하다.19,23 식사를 통해 체질량 유지 및 소아청소년기의 성장과 발달 을 위해 필요한 열량과 단백질을 섭취하는 것이 불가능할 경우, 즉 영양불량 위험이 높은 경우에 경장 혹은 경정맥 영 양요법을 고려해야 한다.
1. 영양요법의 목표, 적응증
염증성 장질환 치료에 있어 스테로이드, 면역조절제, 5-ASA 제제 등 고식적인 약제의 효과는 이미 입증되어 있다.25 그 러나 이들 약제의 부작용 및 환자의 삶의 질에 미치는 영향 을 고려할 때 염증조절과 함께 영양 문제를 해결할 수 있는 치료법에 대한 요구가 있어 왔고 따라서 영양요법 효과에 대한 연구들이 이루어지고 있다.
영양요법의 목표는 첫째, 영양 상태를 유지, 개선하고, 둘 째, 질병의 활성을 완화시키며, 셋째, 수술적응증 및 수술 후 합병증을 감소시키는 것이다. 일반적인 적응증은 중증 혹은 재발 환자, 영양 상태가 나쁜 환자의 수술 전 준비, 누 공이나 단장증후군, 성장 지연 등이다. 그러나 영양요법의 시행 여부를 결정하는 가장 중요한 요소는 임상적인 경험에 기반한 의사의 결정이며, 따라서 적절한 영양요법의 시행을 위해서는 환자의 영양 상태, 질병 활성도, 소화관 기능 및 수술 필요성 등에 대한 통합적인 평가가 요구된다.
2. 영양요법의 종류
영양요법은 크게 전비경구영양법(total parenteral nutrition, TPN)과 경구영양법(enteral nutrition, EN)으로 나누어지며, 사용되는 식이는 성분식이(elemental diet), 중합체식이 (polymeric diet), 배제식이(exclusion diet) 등이 있다. 성분식 이는 각각 영양소의 최소 구성요소로 이루어진 식이로서 단 백질은 아미노산으로, 탄수화물은 포도당으로, 지방은 단쇄 지방(short chain triglyceride)의 형태로 포함되어 있어 항원성 이 전혀 없다. 그러나 맛이 없고 가격이 비싸다는 단점이 있 다. 중합체식이는 우유, 육류, 달걀, 콩에서 얻은 전단백질 (whole protein)을 포함하고 있는 식이로서 맛이 좋고 가격이 저렴하다. 이론적으론 성분식이가 장점막에 대한 항원 노출 을 줄일 수 있어 중합체식이에 비해 효과적일 것으로 생각 되었으나26 크론병 환자를 대상으로 한 여러 연구에서 두 식 이 간에 치료 효과 차이는 관찰되지 않았다.27-29
전비경구영양법(total parenteral nutrition, TPN)
TPN의 이론적인 배경은 금식을 통해 염증이 있는 장을 쉬게 하고, 항원 자극을 줄임으로써 음식에 대한 면역반응 을 가라앉히려는 것이다. 과거 TPN 및 장휴식이 크론병의 1 차적 치료로 제안되기도 하였다. 실제로 고식적인 치료에 반응하지 않는 크론병 환자에서 TPN을 통해 63-89%의 관해 율을 얻을 수 있었다.30 그러나 장휴식 자체만으로는 질병 활성도를 낮추는 효과가 없다는 것이 밝혀진 이후31 TPN의 효과는 장휴식에 의한 것이 아니라 영양소 공급에 의한 것 으로 생각하고 있다. 따라서 현재 TPN은 수술 전후 영양 공 급, 위장관 출혈이나 폐쇄, 독성 거대결장, 단장증후군 등 경구섭취가 금기시되거나 어려운 경우에 한해 영양 공급을 위한 목적으로 이용되고 있다.
경구영양법(enteral nutrition, EN)
EN은 성분식이 혹은 중합체식이를 공급함으로써 장점막 이 잠재적으로 해로운 식이요소 및 항원에 노출되는 것을4 The Korean Journal of Gastroenterology: Vol. 52, No. 1, 2008
막아준다. EN은 TPN과 유사한 효과를 나타내면서도 더 간 단하고, 패혈증이나 담증정체와 같은 합병증이 없으며, 동 물실험에서 장기간의 TPN 시에 관찰되는 소장점막의 위축 이나 췌장중량의 감소 등이 예방되므로 TPN에 비해 선호된 다. EN은 활동 크론병의 치료에 이용되며 궤양성 대장염에 서의 효과는 미미하다.
1. 크론병의 관해유도에 있어서 EN의 효과
1970년대 초 성분식이를 이용한 EN이 염증성 장질환의 일차치료로서 효과적임이 알려진 이후32 여러 연구를 통해 EN은 염증성 장질환의 일차치료로 인정되고 있다. 기존 크 론병의 일차치료제인 스테로이드와 EN을 비교한 최초의 대 조 연구(controlled trial)에서 EN은 치료 4주 및 12주에 prednisolone 0.75 mg/kg/day와 대등한 치료 효과를 나타냈으 며,33 다른 연구들에서도 스테로이드와 유사한 효과를 보였
다.34,35 그러나 EN에 비해 스테로이드가 더 높은 관해율을
나타냈다는 여러 보고들이 있으며,36-39 최근의 Cochrane review에서도 스테로이드의 효과가 EN에 비해 우월하였 다.40 그러나 맛이 없거나 경비관을 통한 주입을 견디지 못 해 EN을 중단함으로써 중도 탈락한 환자들을 제외하고 치 료를 완료한 환자들만을 분석한 경우에는 스테로이드와 EN 의 치료효과가 유사하였고36,38,39 EN은 스테로이드와 같은 부작용이 없다는 점, 그리고 일본에서는 현재도 EN이 크론 병의 일차치료로 널리 이용되고 있는 점을 고려할 때 향후 좀 더 많은 연구가 필요하다.
2. 크론병의 관해유지에 있어서 EN의 효과
하루 칼로리 요구량의 약 50% 정도를 성분식이로 공급하 는 EN이 크론병의 관해유지에 효과적임이 인정되고 있다.41 EN을 시행한 경우 자유식이군에 비해 12개월 후 관해유지 율이 높았으며(48% vs. 22%)42 평균 11.9개월을 추적관찰 하 였을 때 낮은 재발률을 보였다(34.6% vs. 64.0%).43 또한 스 테로이드 의존을 보이는 크론병 환자의 43%가 EN 시행 1 년 후 스테로이드를 중단한 상태에서 관해를 유지하여 스테 로이드 절약 효과를 나타냈다.29 EN은 크론병 환자에서 수 술 후 관해 유지에도 효과적이며44 크론병 환자의 장점막에 서 IL-1β, IL-6, TNF-α 등 염증 사이토카인의 감소를 초래 하였다.45 최근 EN을 이용한 유지 치료에서 표현형이 관통 형(penetrating type)인 경우, 대장을 침범한 경우, 수술력이 있는 경우에 재발율이 높다고 보고되어46 이러한 환자군에 서는 EN 단독으론 관해유지가 어려울 것으로 생각한다.
3. 소아에서 EN의 효과
성인에서와는 달리 소아에서는 EN이 크론병의 일차치료 로서 스테로이드보다 우월한 효과가 보고되고 있다. EN은
스테로이드에 비해 대등한 관해율을 보이면서 점막치유가 더 우수하고 영양상태 및 성장 회복 효과가 뛰어났다.47,48 TPN으로 관해유도 후 정상식이를 하면서 야간에 경비관을 통한 EN을 한 경우, EN을 하지 않은 경우에 비해 관해기간 이 길었으며 사춘기 전에 치료를 시작한 경우 성장 속도가 호전되었다.49 성장 및 영양 상태의 개선 효과 및 스테로이 드 절약효과 등을 고려할 때 EN은 소아에서 크론병의 관해 유도 및 유지에 일차적인 치료법으로 이용될 수 있을 것이 다.
4. 부작용
EN의 부작용은 거의 없다고 할 수 있다. 사용 초기 구역, 두통 등이 있을 수 있으나 곧 가라앉으며, 서서히 용량을 증 가시킴으로써 설사를 줄일 수 있다. 가장 중요한 문제는 EN 제제가 맛이 없어 입으로 마시기가 힘들고, 경비관 삽입의 불편감 등으로 인해 환자의 순응도가 낮다는 점이다. 앞서 언급했듯이 낮은 순응도로 인한 EN의 중단이 스테로이드에 비해 EN의 치료효과를 떨어뜨리는 주요 요인이다. 의료진 및 가족들의 적극적인 지지와 교육, 좀 더 맛이 좋은 EN 제 제의 개발 등으로 환자의 순응도를 높이려는 노력이 요구된 다.
5. Fat composition in EN
크론병에서 EN의 작용기전은 아직 알려져 있지 않다. 초 기엔 단백 항원이 장관의 염증을 초래한다고 생각했기 때문 에 항원성이 없는 성분식이를 사용하였으나 이후 여러 연구 에서 성분식이와 종합체식이 간에 치료효과의 차이가 없음 이 밝혀지면서 단백보다는 음식 내의 지방 조성(fat com- position)이 주목 받게 되었다.50 여러 연구에서 지방 함량이 매우 낮은 EN은 좋은 효과를 보였던 반면, 지방 함량이 높 은 EN은 효과가 낮았는데, 특히 linoleic acid가 많이 포함되 어 있는 경우에 결과가 나빴다. 그러나 지방 함량이 높더라 도 단일불포화지방산(monounsaturated fatty acid, MUFA)이 많이 포함되어 있는 경우엔 더 나은 결과를 보였다.50 장쇄 지방(long chain triglyceride, LCT)의 경우, LCT의 함량이 높 을수록 EN의 치료효과가 감소한다고 알려졌으나51,52 LCT 함량에 따른 관해율의 차이가 없었다는 상반된 보고53도 있 어 논란이 있다. 하지만 최근 Cochrane review40에서는 EN 내의 지방 함량 및 LCT 함량의 차이에 따른 크론병 관해율 의 차이는 없었다.
6. 적응증
최근 infliximab과 같은 생물학 제제의 등장 이후 영양요 법의 역할에 대해선 향후 많은 연구가 필요할 것이나, 현재 영양요법은 염증성 장질환의 관해유도 및 유지에 있어 스테
Lee KM. Nutrition in Inflammatory Bowel Disease 5
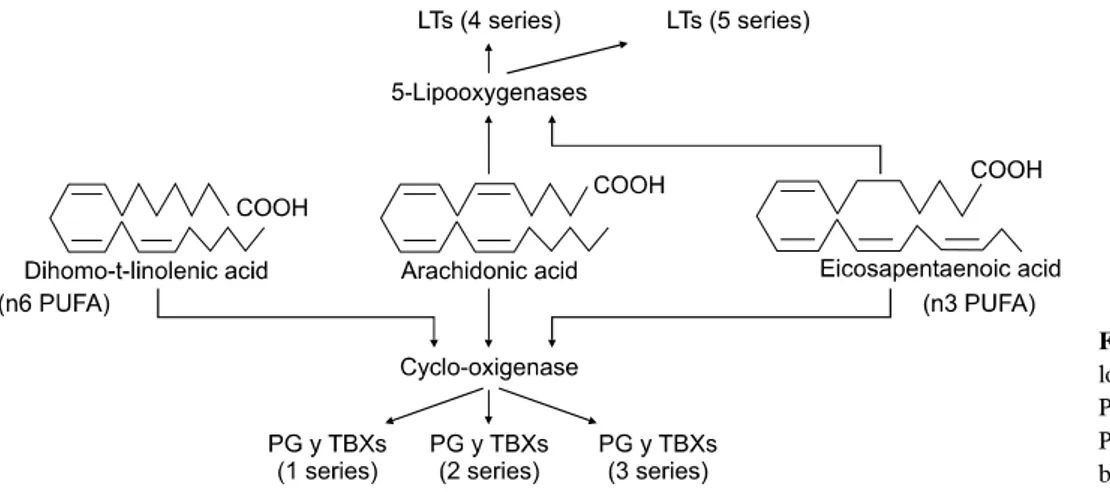
Fig. 1. Eicosanoid synthesis from
long chain n6 and n3 PUFA.PUFA, polyunsaturated fatty acid;
PG, prostaglandin; TBX, throm- boxane; LT, leukotriene.
로이드와 비교할 만한 효과를 나타내며 부작용은 거의 없는 좋은 치료법이다. 특히 성장 장애가 있는 소아 혹은 청소년 환자, 소장을 침범한 크론병 환자 등에서 일차치료로 추천 되며 기존의 치료에 반응이 없거나 스테로이드 금기인 환자 등에서 일차치료로 고려할 수 있다. 또한 영양불량 상태이 거나 정상적인 영양 상태를 유지하기 힘든 모든 환자에서 보조치료로 이용될 수 있다.54
Fatty acids, Glutamine
지방은 eicosanoid 및 사이토카인의 합성에 관여하여 염증 반응에 영향을 미치는데, n3 다중불포화지방산(polyunsatu- rated fatty acid, PUFA)을 포함하는 fish oil, MCT를 포함하는 coconut oil 등은 항염증효과를, linoleic acid (n6 PUFA)를 포 함하는 safflower oil은 염증유발효과를 나타내는 것으로 알 려져 있다.55 n3 지방산은 eicosanoid 합성의 전구물질로서 n6 지방산과 경쟁하며, n3 지방산의 산물인 series 5 leuko- triene은 arachidonic acid에서 유래한 series 4 leukotriene에 비 해 활성도가 낮다(Fig. 1). 이러한 이유로 fish oil이 항염효과 를 나타내는 것으로 생각된다.2,50
실제로 궤양성 대장염 환자에서 fish oil을 1년간 투여하였 을 때, 위약군(olive oil)에 비해 직장점막의 eicosapentaenoic acid 양이 증가하였으며, leukotriene B5 생산은 증가한 반면 leukotriene B4의 생산은 53%나 감소하였다. 그러나 이러한 변화에도 불구하고 임상적으로는 관해유도를 촉진하는 경향 을 보였을 뿐 통계적인 유의성은 없었으며, 재발 방지의 효 과도 없었다.56 궤양성 대장염의 재발 방지를 위해 n3 지방산 (5.1 g/day)을 투여하였을 때 3개월까지는 위약에 비해 효과 가 있었으나 2년까지의 누적재발률에는 차이가 없었으며,57 크론병 환자에서 장용 코팅이 된 fish oil (2.7 g of n3 fatty acid/day)을 1년간 투여한 결과, 관해유지율이 59%로 위약군
의 26%에 비해 유의하게 높아 재발 방지에 효과적이었다.58 단쇄지방산(short chain fatty acid, SCFA)은 섭취된 다당체 가 대장의 혐기 세균에 의해 발효됨으로써 만들어지는 물질 로서 대장세포의 에너지원으로 이용된다. 특히 butyrate는 NF-κB 활성화를 차단함으로써 TNF-α와 같은 염증 사이 토카인의 생산을 억제하며, TNBS 유발 장염의 발생을 억제 하였다.59 또한 좌측 대장을 침범한 궤양성 대장염 환자에서 butyrate 관장은 스테로이드나 메살라민 관장과 대등한 관해 율을 나타냈다.60
Glutamine은 장세포의 주요한 에너지원으로서 단백 합성 을 증가시켜 소장에 영양효과(trophic effect)를 나타내므로, 염증성 장질환의 치료에 시도되었으나 실제 임상에서는 별 다른 효과가 없었다.61,62
결 론
진료실을 찾는 환자들이 가장 많이 하는 질문 중 하나는
“제가 어떤 음식을 먹어야 병에 도움이 될까요?”가 아닐까 한다. 하지만 현대의 의사들은 약물을 이용한 염증성 장질 환의 치료에는 익숙해져 있으나 식이 및 영양요법에 대해서 는 무관심한 경우가 대부분이다. 잘못된 상식을 바탕으로 환자 스스로 우유 등 유제품을 금한다면 칼슘 등 필수 영양 소의 결핍을 초래하여 골다공증 등 합병증을 초래할 수 도 있으며, 반대로 입증되지 않은 대체 요법을 시도하다가 질 병을 악화시키거나 경제적인 소모를 할 수 도 있다. 아직도 밝혀져야 할 부분이 많지만, 염증성 장질환을 치료하는 의 사들은 식이와 질병의 관계에 대해 관심을 가져야 하며 환 자에게 적절한 조언을 하기 위해 노력해야 할 것이다. 또한 염증성 장질환 환자에서 존재할 수 있는 영양의 문제들을 인지하고 주의 깊게 돌보아야 할 것이다.
6 대한소화기학회지: 제52권 제1호, 2008
참고문헌
1. Dieleman LA, Heizer WD. Nutritional issues in inflammatory bowel disease. Gastroenterol Clin North Am 1998;27:435-451.
2. Wild GE, Drozdowski L, Tartaglia C, Clandinin MT, Thom- son AB. Nutritional modulation of the inflammatory response in inflammatory bowel disease-from the molecular to the in- tegrative to the clinical. World J Gastroenterol 2007;7:1-7.
3. Sartor RB. Current concepts of the etiology and pathogenesis of ulcerative colitis and Crohn's disease. Gastroenterol Clin North Am 1995;24:475-507.
4. Ouyang Q, Tandon R, Goh KL, Ooi CJ, Ogata H, Fiocchi C.
The emergence of inflammatory bowel disease in the Asian- Pacific region. Curr Opin Gastroenterol 2005;21:408-413.
5. Yang SK, Loftus EV Jr, Sandborn WJ. Epidemiology of in- flammatory bowel disease in Asia. Inflamm Bowel Dis 2001;
7:260-270.
6. Probert CS, Jayanthi V, Pinder D, Wicks AC, Mayberry JF.
Epidemiological study of ulcerative proctocolitis in Indian mi- grants and the indigenous population of Leicestershire. Gut 1992;33:687-693.
7. Reif S, Klein I, Lubin F, Farbstein M, Hallak A, Gilat T.
Pre-illness dietary factors in inflammatory bowel disease. Gut 1997;40:754-760.
8. Sakamoto N, Kono S, Wakai K, et al; Epidemiology Group of the Research Committee on Inflammatory Bowel Disease in Japan. Dietary risk factors for inflammatory bowel disease:
a multicenter case-control study in Japan. Inflamm Bowel Dis 2005;11:154-163.
9. O'Sullivan M, O'Morain C. Nutrition in inflammatory bowel disease. Best Pract Res Clin Gastroenterol 2006;20:561-573.
10. Tsang J, Sartor RB. Effect of diet on colitis in IL-10−/−
mice. Gastroenterology 2005;128:A210.
11. Lee KM, Sartor RB. A high sucrose diet exacerbates im- mune-mediated colitis in IL-10 deficient mice. Gastroenterol- ogy 2006;130:A350.
12. Lerner A, Eluri S, Perl D, et al. Bacterial-aluminum interac- tions. The role of aluminum in bacterial-induced colitis in IL-10 deficient mice. Gastroenterology 2006;130:A362.
13. Lee KM, Sartor RB. Oral iron potentiates immune-mediated colitis in il-10 deficient mice. Gastroenterology 2007;132:
A701.
14. Gassull MA, Abad A, Cabre E, Gonzalez-Huix F, Gine JJ, Dolz C. Enteral nutrition in inflammatory bowel disease. Gut 1986;27(suppl 1):76-80.
15. Han PD, Burke A, Baldassano RN, Rombeau JL, Lichtenstein GR. Nutrition and inflammatory bowel disease. Gastroenterol
Clin North Am 1999;28:423-443.
16. Grimble RF. Nutritional modulation of cytokine biology.
Nutrition 1998;14:634-640.
17. Carter MJ, Lobo AJ, Travis SP. Guidelines for the manage- ment of inflammatory bowel disease in adults. Gut 2004;
53(suppl 5): V1-V16.
18. Sapone N, Pellicano R, Simondi D, et al. A 2008 panorama on osteoporosis and inflammatory bowel disease. Minerva Med 2008;99:65-71.
19. Scott EM, Gaywood I, Scott BB. Guidelines for osteoporosis in coeliac disease and inflammatory bowel disease. Gut 2000;46(suppl 1):I1-I8.
20. Lichtenstein GR, Sands BE, Pazianas M. Prevention and treatment of osteoporosis in inflammatory bowel disease.
Inflamm Bowel Dis 2006;12:797-813.
21. Sawczenko A, Sandhu BK. Presenting features of inflam- matory bowel disease in Great Britain and Ireland. Arch Dis Child 2003;88:995-1000.
22. Walters TD, Gilman AR, Griffiths AM. Linear growth im- proves during infliximab therapy in children with chronically active severe Crohn's disease. Inflamm Bowel Dis 2007;13:
424-430.
23. Campos FG, Waitzberg DL, Teixeira MG, Mucerino DR, Habr-Gama A, Kiss DR. Inflammatory bowel diseases: princi- ples of nutritional therapy. Rev Hosp Clin Fac Med Sao Paulo 2002;57:187-198.
24. Pardi DS, Tremaine WJ, Sandborn WJ, McCarthy JT. Renal and urologic complications of inflammatory bowel disease.
Am J Gastroenterol 1998;93:504-514.
25. Kozuch PL, Hanauer SB. Treatment of inflammatory bowel disease: a review of medical therapy. World J Gastroenterol 2008;14:354-377.
26. Giaffer MH, North G, Holdsworth CD. Controlled trial of polymeric versus elemental diet in treatment of active Crohn's disease. Lancet 1990;335:816-819.
27. Raouff AH, Hildrey V, Daniel J, et al. Enteral feeding as sole treatment for Crohn's disease: controlled trial of whole protein v amino acid based feed and a case study of dietary challenge. Gut 1991;32:702-707.
28. Rigaud D, Cosnes J, Le Quintrec Y, Rene E, Gendre JP, Mignon M. Controlled trial comparing two types of enteral nutrition in treatment of active Crohn's disease: elemental versus polymeric diet. Gut 1991;32:1492-1497.
29. Verma S, Holdsworth CD, Giaffer MH. Does adjuvant nutri- tional support diminish steroid dependency in Crohn disease?
Scand J Gastroenterol 2001;36:383-388.
30. Ostro MJ, Greenberg GR, Jeejeebhoy KN. Total parenteral
이강문. 염증성 장질환과 영양 7
nutrition and complete bowel rest in the management of Crohn's disease. J Parenter Enteral Nutr 1985;9:280-287.
31. Greenberg GR, Fleming CR, Jeejeebhoy KN, Rosenberg IH, Sales D, Tremaine WJ. Controlled trial of bowel rest and nu- tritional support in the management of Crohn's disease. Gut 1988;29:1309-1315.
32. Voitk AJ, Echave V, Feller JH, Brown RA, Gurd FN.
Experience with elemental diet in the treatment of in- flammatory bowel disease. Is this primary therapy? Arch Surg 1973;107:329-333.
33. O'Morain C, Segal AW, Levi AJ. Elemental diet as primary treatment of acute Crohn's disease: a controlled trial. Br Med J 1984;288:1859-1862.
34. Okada M, Yao T, Yamamoto T, et al. Controlled trial com- paring an elemental diet with prednisolone in the treatment of active Crohn's disease. Hepatogastroenterology 1990;37:72-80.
35. Gonzales-Huix F, de Leon R, Fernandez-Banares F, et al.
Polymeric enteral diets as primary treatment of active Crohn's disease: a prospective steroid controlled trial. Gut 1993;34:
778-782.
36. Malchow H, Steinhardt HJ, Lorenz-Meyer H, et al. Feasibility and effectiveness of a defined-formula diet regimen in treat- ing active Crohn's disease. European Cooperative Crohn's Diseases Study III. Scand J Gastroenterol 1990;25:235-244.
37. Lochs H, Steinhardt HJ, Klaus-Wentz B, et al. Comparison of enteral nutrition and drug treatment in active Crohn's disease.
Results of the European Cooperative Crohn's Disease Study IV. Gastroenterology 1991;101:881-888.
38. Lindor KD, Fleming CR, Burnes JU, Nelson JK, Ilstrup DM.
A randomized prospective trial comparing a defined formula diet, corticosteroids, and a defined formula diet plus cortico- steroids in active Crohn's disease. Mayo Clin Proc 1992;67:
328-333.
39. Gassull MA, Fernandez-Banares F, Cabre E, et al. Fat com- position may be a clue to explain the primary therapeutic ef- fect of enteral nutrition in Crohn's disease: results of a dou- ble blind randomized multicentre European trial. Gut 2002;51:
164-168.
40. Zachos M, Tondeur M, Griffiths AM. Enteral nutritional ther- apy for induction of remission in Crohn's disease. Cochrane Database Syst Rev 2007:CD000542.
41. Akobeng AK, Thomas AG. Enteral nutrition for maintenance of remission in Crohn's disease. Cochrane Database Syst Rev 2007:CD005984.
42. Verma S, Kirkwood B, Brown S, Giaffer MH. Oral nutri- tional supplementation is effective in the maintenance of re- mission in Crohn's disease. Dig Liver Dis 2000;32:769-774.
43. Takagi S, Utsunomiya K, Kuriyama S, et al. Effectiveness of an ‘half elemental diet' as maintenance therapy for Crohn's disease: a randomized-controlled trial. Aliment Pharmacol Ther 2006;24:1333-1340.
44. Yamamoto T, Nakahigashi M, Umegae S, Kitagawa T, Matsumoto K. Impact of long-term enteral nutrition on clin- ical and endoscopic recurrence after resection for Crohn's dis- ease: a prospective, non-randomized, parallel, controlled study. Aliment Pharmacol Ther 2007;25:67-72.
45. Yamamoto T, Nakahigashi M, Saniabadi AR, et al. Impacts of long-term enteral nutrition on clinical and endoscopic dis- ease activities and mucosal cytokines during remission in pa- tients with Crohn's disease: a prospective study. Inflamm Bowel Dis 2007;13:1493-1501.
46. Esaki M, Matsumoto T, Nakamura S, et al. Factors affecting recurrence in patients with Crohn's disease under nutritional therapy. Dis Colon Rectum 2006;49(suppl 10):S68-S74.
47. Berni Canani R, Terrin G, Borrelli O, et al. Short- and long-term therapeutic efficacy of nutritional therapy and corti- costeroids in paediatric Crohn's disease. Dig Liver Dis 2006;38:381-387.
48. Borrelli O, Cordischi L, Cirulli M, et al. Polymeric diet alone versus corticosteroids in the treatment of active pediatric Crohn's disease: a randomized controlled open-label trial.
Clin Gastroenterol Hepatol 2006;4:744-753.
49. Wilschanski M, Sherman P, Pencharz P, Davis L, Corey M, Griffiths A. Supplementary enteral nutrition maintains re- mission in paediatric Crohn's disease. Gut 1996;38:543-548.
50. Fernandez-Banares F, Cabre E, Gonzalez-Huix F, Gassull MA. Enteral nutrition as primary therapy in Crohn's disease.
Gut 1994;35(suppl 1):S55-S59.
51. Middleton SJ, Rucker JT, Kirby GA, Riordan AM, Hunter JO. Long-chain triglycerides reduce the efficacy of enteral feeds in patients with active Crohn's disease. Clin Nutr 1995;14:229-236.
52. Bamba T, Shimoyama T, Sasaki M, et al. Dietary fat attenu- ates the benefits of an elemental diet in active Crohn's dis- ease: a randomized, controlled trial. Eur J Gastroenterol Hepatol 2003;15:151-157.
53. Leiper K, Woolner J, Mullan MM, et al. A randomised con- trolled trial of high versus low long chain triglyceride whole protein feed in active Crohn's disease. Gut 2001;49:790-794.
54. Carter MJ, Lobo AJ, Travis SPL. Guidelines for the manage- ment of inflammatory bowel disease in adults. Gut 2004;
53(suppl 5):V1-V16.
55. Sadeghi S, Wallace FA, Calder PC. Dietary lipids modify the cytokine response to bacterial lipopolysaccharide in mice.
8 The Korean Journal of Gastroenterology: Vol. 52, No. 1, 2008
Immunology 1999;96:404-410.
56. Hawthorne AB, Daneshmend TK, Hawkey CJ, et al.
Treatment of ulcerative colitis with fish oil supplementation:
a prospective 12 month randomised controlled trial. Gut 1992;33:922-928.
57. Loeschke K, Ueberschaer B, Pietsch A, et al. n-3 fatty acids only delay early relapse of ulcerative colitis in remission. Dig Dis Sci 1996;41:2087-2094.
58. Belluzzi A, Brignola C, Campieri M, Pera A, Boschi S, Miglioli M. Effect of an enteric-coated fish-oil preparation on relapses in Crohn's disease. N Engl J Med 1996;334:1557- 1560.
59. Segain JP, Raingeard de la Bletiere D, Bourreille A, et al.
Butyrate inhibits inflammatory responses through NF-κB in-
hibition: implications for Crohn's disease. Gut 2000;47:397- 403.
60. Senagore AJ, MacKeigan JM, Scheider M, Ebrom JS.
Short-chain fatty acid enemas: a cost-effective alternative in the treatment of nonspecific proctosigmoiditis. Dis Colon Rectum 1992;35:923-927.
61. Den Hond E, Hiele M, Peeters M, Ghoos Y, Rutgeerts P.
Effect of long-term glutamine supplements on small intestinal permeability in patients with Crohn's disease. J Parenter Enteral Nutr 1999;23:7-11.
62. Akobeng AK, Miller V, Stanton J, Elbadri AM, Thomas AG.
Double-blind randomized controlled trial of glutamine-enri- ched polymeric diet in the treatment of active Crohn's disease. J Pediatr Gastroenterol Nutr 2000;30:78-84.