Volume 18, Number 1, June, 2015
서 론
국소적인 관절연골의 손상은 추후 주변 관절연 골의 변성 및 퇴행성 변화를 일으키고, 이것이 진 행되면서 연골하골(subchondral bone)까지 침 범하여 골관절염을 일으킬 수 있다1). 이러한 현상 은 관절연골의 재생능력이 다른 조직에 비해서 떨 어져서, 혈액, 골수 또는 다른 구역들로부터의 전 구세포(progenitor cell)들이 결손부위로 들어오 는 것이 제한되고, 주변의 기질(matrix)로 둘러 싸인 관절 연골세포들이 병변으로 이동하여 기질
(reparative matrix)을 분비하는 것이 가능하지 않다는 점이 원인이 될 수 있다2).
관절연골 손상을 치료하는 기존의 수술법들은 주로 관절경하에 치료하는 것인데, 변연절제술 (debridement), 골수 자극술(marrow-stimu- lating procedures), 그리고 자기유래 연골세포 이식술(ACI: autologous chondrocyte implan- tation)과 같이 관절의 기능을 향상시켜 인공관절 치환술의 수술 시기를 늦춰주는 것들이다. 최근 중 간엽 줄기세포(MSC: mesenchymal stem cell) 를 이용한 치료는 중간엽 줄기세포가 연골, 골조
※ 통신저자: 김석중
경기도 의정부시 금오동 65-1 가톨릭대학교 의정부성모병원 정형외과
TEL: 031) 820-3066 FAX: 031) 847-3671 E-mail: peter@catholic.ac.kr 접수일: 2015년 5월 17일, 게재 확정일: 2015년 5월 24일
중간엽 줄기세포를 이용한 관절연골 손상의 치료
가톨릭대학교 의과대학 정형외과학교실 박성렬∙김석중
= Abstract =
Treatment of Articular Cartilage Injury Using Mesenchymal Stem Cells
Sung-Ryeoll Park, M.D., Seok Jung Kim, M.D.
Department of Orthopedic Surgery, College of Medicine, The Catholic University of Korea
Articular cartilage lesions can be a debilitating disease resulting in the development of osteoarthritis (OA). In recent years, mesenchymal stem cell (MSC) strategies combined with the microfracture technique are emerging as a powerful tool for cartilage repair. Even though there are some successful reports of MSCs treatments, many aspects have to be optimized such as best cell source and application method. The interest in this field is growing and randomized controlled trials are needed to show the potential of MSC treatment.
Key Words: Mesenchymal stem cell, Cartilage, Repair
직, 지방, 건, 인대, 골수기질(marrow stroma) 등 다양한 결합조직으로 분화할 수 있는 능력을 가지고 있다는 점에 힘입어 연골 재생에 있어 강 력한 도구로 부상하고 있다3). 중간엽 줄기세포는 구조적 지지뿐만 아니라, 세포와 세포간의 상호작 용(cell-cell interaction) 또는 bioactive fac- tor들의 분비를 통해서 면역조절기능 및 항염 기 능을 통해서 조직 재생에 기여한다4).
중간엽 줄기세포는 자기재생능력(self-renew- al)과 줄기세포능(stemness maintenance)을 유지하고 다양한 간엽 조직으로 분화할 수 있는 능력(plasticity)이 있다5). 이들은 손상 조직으로 이동하여 증식하고 조직 재생을 위한 물질을 합성 한다. 특히 주목할 점은, 중간엽 줄기세포가 면역 체계의 일부를 억제함으로써 면역 조절능력을 보 이는데, T 및 B 림프구의 활성 및 증식을 억제하 고, NK cell의 활성을 막으며 CTL-mediated lysis를 피하고, 수지상 세포(dendritic cell)나 대식세포(macrophage)가 분비하는 물질들을 조 율하는 능력이 있어, 동종이식(allotransplanta- tion)이나 이종이식(xenotransplantation)을 가 능하게 할 수 있다6).
국제 줄기세포 위원회(The Mesenchymal
and Tissue Stem Cell Committee of the International Society for Cellular Therapy) 에서는 이러한 세포들을 특징지을 수 있는 최소한 의 기준 틀을 제시하였는데 다음과 같다7). (1) 이 들은 표준 배양 조건에서 반드시 plastic-adher- ent 하여야 하고, (2) CD105, CD 73, CD90을 발 현 하 지 만 , CD45, CD34, CD14(또 는 CD11b), CD79a (또는 CD19), 그리고 HLA- DR의 발현은 없어야 하며, (3) in vitro에서 연 골세포, 골모세포, 그리고 지방세포로 분화가 가 능해야 한다.
중간엽 줄기세포는 1966년 Friedenstein 등에 의해 골수에서 처음 밝혀졌으며, 뒤이어 1970년 에, Caplan등이 세포가 연골세포, 골세포, 근육 세포로의 분화가 가능하다는 증거를 처음 제시하 였고8), 1990년대 초에 중간엽 줄기세포(mes- enchymal stem cell)란 용어가 사용되기 시작 했다9).
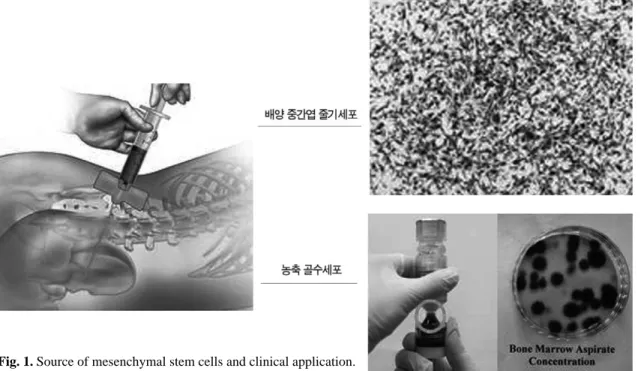
현재 중간엽 줄기세포는 골수 외에 지방조직, 탯줄혈액(umbilical cord blood), 활막(syn- ovial membrane), 활액(synovial fluid), 골 막(periosteum), 진피(dermis), 골조직(tra- becular bone), 슬개건하 지방부(infrapatellar
Fig. 1. Source of mesenchymal stem cells and clinical application.
fat pad), 그리고 근육 등에서도 추출이 가능하 고, 각각은 비슷한 표현형(phenotype)을 가지고 있으나 증식 및 분화 잠재력에 있어는 차이를 보 인다(Fig. 1)10).
이러한 다양한 잠재능력이 있는 중간엽 줄기세 포를 이용해서 아직까지도 그 해결책을 찾기 어려 운 관절 연골 재생을 위한 많은 연구들이 시행되 고 있다. 여기서는 이러한 연구 중 임상적으로 적 용이 되고 있는 부분들을 살펴보고, 이를 요약 정 리하여 중간엽 줄기세포를 이용한 관절 연골 재생 의 현주소를 알아보고자 한다.
골수유래 중간엽 줄기세포(BMSC: Bone Mar- row-derived mesenchymal Stem Cells)
골수유래 중간엽 줄기세포는 중간엽 줄기세포들 중 첫번째로 사용되었는데, 채취하기 쉽고 많은 양을 얻을 수가 있어서 현재까지도 골수는 중간엽 줄기세포를 얻기 위해 가장 선호되는 조직이다.
중간엽 줄기세포는 배양을 통해 세포현탁액 상태 (cell suspension)로 사용되거나 또는 단지 골수 의 농축형태(bone marrow concentrate)로 쓰 이기도 한다(Fig. 2). 구성에 따라 이들은 큰 차 이를 보인다는 점이 밝혀져 있다. 대부분의 성인 골수는 다양한 분화도의 혈액세포들을 함유하고 있다. 이들의 구성은 혈장(plasma), 적혈구(red blood cells), 혈소판(platelets), 그리고 유핵세
포(nucleated cells)로 나뉠 수 있다. 성인 중간 엽 줄기세포는 골수의 유핵세포에서 발견할 수 있 고, 이들의 수는 배양된 중간엽 줄기세포와 비교하 였을 때 매우 제한되어 있지만, 다양한 형태의 전 구세포(cell progenitor type)의 존재는 조직재생 에 있어 긍정적인 영향을 줄 가능성이 있다11). 배 양을 통해서 세포를 증식시킬 때는 세균오염(bac- terial contamination), 이종 위험(xenogenic risk), 또는 세포 변형(cellular transformation) 의 위험에서 자유로울 수 없고, 중간엽 줄기세포의 분화능에 영향을 줄 수 있는 있음을 반드시 숙지 하여야 한다12).
나아가서, 몇몇 실험적인 중간엽 줄기세포 기반 연골재생 모델에서 보인 세포 비후(hypertro- phy)는 예상치 못한 조기 노화관련(premature terminal MSC) 분화인데 중간엽 줄기세포를 실 제 임상에 사용하기 위해서는 이러한 부분을 명확 히 해야 한다13). 하지만 이러한 제한점들을 해결 하기 위해 많은 연구들이 활발히 이루어지고 있 고, 분열촉진인자(mitogenic factor)인 FGF-2 를 이용할 때 유전자 도입(gene transfer)을 이 용한 중간엽 줄기세포의 유전적 조작(genetic modification)은 매우 가능성이 높은 해결책이 며, SOX9등을 이용하는 것은 분화된 세포의 비 후현상(hypertrophy)을 방지하는 데 좋은 방법 이 될 수 있다.
Fig. 2. Implantation of mesenchymal stem cells by culture or bone marrow concentrate.
배양 골수유래 중간엽 줄기세포(Cultured bone marrow derived mesenchymal stem cell)
골수유래 중간엽 줄기세포를 배양해서 사용하는 것은 법적 관점에서 보았을 때 다소 다루기 어려 울 수 있는데, 이들 세포들이 하나의 약제로 간주 되어 법적 제한을 받을 수 있기 때문이다. 그럼에 도 불구하고 많은 동물 및 실제 임상 실험에서 긍 정적인 결과를 보이고 있다14). 2002년 Wakitani 등은 12예의 무릎 관절염에 대해서 근위 경골 절 골술(high tibial osteotomy)을 시행한 후 골수 유래 중간엽 줄기세포를 콜라겐 젤에 섞어 연골 병 변에 주입한 후 골막으로 덮었으며, 다른 12명의 환자를 중간엽 줄기세포 치료를 시행하지 않은 대 조군으로 하여 연구를 진행하였다15). 16개월 후, 두 군에서 비슷한 임상적 호전을 보였는데, 세포를 이용하여 치료한 군에서 관절경 소견이나 조직학 적 검사에서 더 양호한 결과를 보였다. 2년 후 이 연구자들은 이전에 보고한 기법을 이용하여 전층 관절연골 결손을 보이는 두 명의 환자를 치료하여 5년 추시에서도 성공적인 결과를 보였다.
2010년 Nejadnik 등은 코호트 연구(evidence level III)를 통해 골막을 사용한 자기유래 연골세 포이식술(ACI)을 시행할 때, 골막 안쪽으로 넣어 주는 세포로서 기존의 자기유래 연골 세포를 이용 한 방법과 골수유래 중간엽 줄기세포를 이용한 방 법을 비교하였다. 이 연구에서는 나이와 병변을 어느 정도 동일하게 한 72명의 전층 연골 결손 (full-thickness knee cartilage defect) 환자 들을 대상으로 하여 그 중 36명은 자기유래 연골 세포를 이용하였고 나머지 36명은 골수유래 중간 엽 줄기세포를 이용하여 치료하였다16). 수술 2년 후까지 비슷한 임상적, 주관적 호전을 보였으며, 남성이 여성에 비해 유의한 수준으로 더 나은 호 전을 보였다. 자기유래 연골세표를 이용한 군에서 는 45세 이하의 환자들이 45세 이상의 환자들에 비해 더 나은 점수를 보였으나 골수유래 중간엽 줄기세포를 이용한 군에서는 나이가 결과에 영향 을 미치지 않았다. 저자들은 골수유래 중간엽 줄 기세포를 이용한 방법이 자기유래 연골세포를 이 용하는 것과 비슷한 효과를 보이면서 연골조직 채
취를 위한 시술이 필요 없고, 더 적은 비용이 들 며, 최소한의 공여부 이환(donor-site morbidi- ty)을 보이는 등의 장점을 강조하였다. 2011년 Kasemkijwattana 등은 배양된 골수유래 중간엽 줄기세포를 콜라겐에 섞어 두 명의 무릎 관절염 환자에게 적용하여 양호한 결과를 보고하였다17). 2008년 Centeno 등은 골수유래 중간엽 줄기세포 를 관절 내 주입하여 무릎 관절연골 손상의 치료 에 효과가 있음을 증례보고 하였다18). 여기서는 치료 후 6개월 자기공명영상 검사상 관절 연골 및 반월상 연골의 부피가 증가하고 관절 운동 영역이 나 통증이 향상됨을 보고하였다.
2011년 Davatchi 등은 4예의 무릎 관절염 환 자들에게 한번의 골수유래 중간엽 줄기세포 치료 후 활동 지표에서는(계단 올라가는 숫자, 걷는 시 간 등)약간의 호전을 보였지만 주관적인 지표에서 뚜렷이 호전이 되었다고 보고하였다19). 최근에 Emadedin등의 보고에 따르면, 6명의 관절염 환 자에게 한번의 골수유래 중간엽 줄기세포의 주입 후에 슬관절의 기능 및 보행 거리가 6개월까지 호 전되는 양상을 보였으며, 주입 전, 후의 자기 공 명영상 검사상 3명에서 연골 두께의 증가 및 골 부종의 감소소견을 보였다20).
농축 골수를 이용한 치료 (BMC: Bone mar- row concentrate)
2009년 Giannini 등은 농축 골수와 콜라겐 파 우더 혹은 농축 골수와 히알루론산을 48명의 거 골 관절연골 결손 환자에게 적용 후 2년 추시 결 과를 발표하였다21). 모든 환자들에서 재생 조직이 주변 조직과 잘 연계된 새로운 조직의 형성을 보 였고, 오직 2명의 환자에서만 조직 비후(carti- lage hypertrophy)가 관찰되었다. 2011년 Gigante 등은 대퇴골의 내과 관절연골 병변 (medial femoral condyle lesion)이 있는 5명 의 환자에게 농축골수를 주입하고 콜라겐막으로 병변을 덮어주는 시술을 시행 후 결과로 거의 정 상적인 관절경 사진(arthroscopic appearance) 을 보여주었는데, 초자연골양 기질형성(hyaline- like matrix)의 증거는 오직 1예에서만 발견되었 다22).
Varma 등은 경증 및 중등도의 무릎 관절염 환 자 50명에게 농축골수를 관절 내에 주입 후 좋은 결과를 보고하였는데, 그 중 25명은 변연절제술 (debridement)과 추가적으로 농축골수를 주사하 였으며, 다른 25명은 변연절제술만 시행하였다.
추시 기간 중 농축골수를 이용하여 치료한 군에서 보다 나은 증상의 호전과 입원 기간의 단축, 만족 도의 향상이 관찰되었다23).
지방유래 중간엽 줄기세포(ADMSCs: Adi- pose-derived mesenchymal stem cells)
지방 흡입으로 얻어진 지방유래 중간엽 줄기세 포는 연골 재생을 위해서 많은 장점이 있다. 충분 한 양을 얻을 수 있고, 쉽게 사용이 가능하며, 여 기서 얻어진 세포가 연골, 뼈, 인대, 근육, 지방 으로 분화할 수 있기 때문이다. 2011년 Pak 등 은 2명의 무릎 관절염 환자를 치료하기 위해 히알 루론산, dexamethasone, 자가농축혈장(PRP) 과 혼합된 농축된 지방유래 중간엽 줄기세포를 관 절 내 주사하여, 좋은 결과를 보고하였는데, 3개 월 후, 통증 및 기능 점수가 향상되었고. 자기공 명 영상검사상 관절연골의 두께가 증가됨이 관찰 되었다24). 최근 Koh 등은 case-control study에 서 슬개건하 지방부(intrapatellar fat pad)에서 얻은 농축된 지방유래 중간엽 줄기세포를 사용하 였는데, 25명의 환자를 대상으로 변연절제술 후에 농축된 지방유래 중간엽 줄기세포와 PRP를 차례 로 관절 내에 주사 하였고, 추가적으로 2주 동안 2번의 주사를 하였다. 대조군은 변연절제술과 PRP주입만을 하였으며, 지방유래 중간엽 줄기세 포 시술 후에는 별다른 이상반응은 보고되지 않았 다. 평균 16개월의 최종 추시에서 두 군은 임상적 으로 비슷한 결과를 보였으나 지방유래 중간엽 줄 기세포를 사용한 군에서 더 큰 호전을 가지는 경 향이 있었다25).
활막 유래 중간엽 줄기세포(SDMSCs: Syn- ovial-derived mesencymal stem cells)
활막 유래 중간엽 줄기세포는 골수나 골막에서 얻은 중간엽 줄기세포보다 더 큰 연골 형성능 (chondrogenic potential)을 갖기 때문에 관절 연골 재생을 위해서 더 유망한 줄기세포의 원천
(stem cell source)으로 여겨진다. 그러나 이러 한 연골 형성능은 주로 전임상 연구(preclinical study)에서만 보고되고 있다26).
요 약
중간엽 줄기세포는 연골재생 측면에서는 국소적 인 연골 손상에서 관절염에 이르기까지 널리 적용 이 가능하지만 실제 임상에 활발히 적용하기에는 아직 명확한 근거가 빈약하고 많은 이견이 있다.
첫째로 이상적인 중간엽 줄기세포의 원천(MSC source)이 아직 밝혀지지 않았다는 점이다. 중간 엽 줄기세포는 지방조직, 탯줄 혈액, 활막, 활액, 골막 등 여러 조직에서 분리될 수 있는데, 다양한 분화를 나타낸다. 이러한 세포 특성뿐 아니라, 추 출을 통해 얻어지는 세포의 수확량은 제한적인 요 소가 될 수 있고 임상 적용을 위해 어떤 조직을 중간엽 줄기세포의 원천으로 선택할지에 영향을 준다.
또 다른 점은 중간엽 줄기세포의 사용에 대한 잠재적인 위험이다. 암발생이나 면역질환 외에도 주입된 중간엽 줄기세포는 원치 않는 방향으로 분 화할 수 있다. 쥐의 심장에 중간엽 줄기세포를 주 입한 후 석회화가 관찰되었다는 보고에서처럼, 이 세포들의 분화가 원하지 않는 방향으로 갈 수 있 다27). 이것은 관절 연골의 결손에 대한 치료를 위 해 주입된 중간엽 줄기세포가 연골내 골화(endo- chondral ossification)와 연계 되어 재생 조직 의 몇몇 부분에서 이러한 골화가 일어난다는 이론 을 뒷받침한다. 이는 치료의 임상결과 및 조직학 적 결과를 나쁘게 만든다.
연골 재생에 대한 줄기세포 치료는 아직도 초창 기 단계고 많은 것들이 밝혀지고 개선될 필요가 있다. 이 중 가장 필요한 요소 중 하나는 적절한 주입세포의 양(cell dose)에 대한 지식이다. 임상 적으로 실제 연골 재생에서 중간엽 줄기세포를 이 식할 때, 주입량과 반응(dose-response)과의 관 계는 아직 밝혀 지지 않았다. 현재의 연구에서는 다양한 양의 세포가 결손 부위로 이식되어 다양한 임상결과를 보여주고 있는데 이러한 사실은 임상 연구 결과를 비교하기 어렵게 만들고 있다. 성공 적인 관절 연골 재생을 위한 세포의 양과 결손부
위의 크기와의 관계는 불확실하기 때문에, 재생을 위한 효과적인 중간엽 줄기세포의 양을 알아내는 것이 또 다른 주요 포인트이다.
마지막으로 중간엽 줄기세포 치료의 효과 향상 은 성장인자나 전사인자(transcription factor), 혹은 신호인자(signaling factors)와 같은 치료 인자들을 사용함으로써 가능하다. 현재까지 시도 된 많은 임상 시험과 기술적인 도전은 그간 여러 시행착오를 거쳐 얻어진 경험과 지식을 토대로 향 후 임상적용이 가능한 새로운 시스템을 만들게 한 다. 과거 20년의 자기유래 연골세포 이식술의 영 역에서 보듯이 세포를 사용하거나 실제 환자에 적 용하기 위한 술기적인 향상은 언제나 가능하고, 중간엽 줄기세포 연구의 발전과 함께 관절연골 재 생을 위해서 효과적인 중간엽 줄기세포의 이식이 가능한 발전된 시스템의 구축도 가능할 것이다.
연골 재생에 대한 생물학적 접근 방법에 대한 관심이 나날이 커져가고 있지만, 이 주제에 대한 지식은 주로 전임상 연구 및 증례 보고나 신뢰도 가 낮은 임상 연구가 대부분을 차지 하고 있다.
최근 중간엽 줄기 세포가 관절연골 재생을 위한 돌파구로 떠오르면서 많은 임상 연구가 진행되고 있으며, 비록 그 수준은 아직 초보단계라 할지라 도 많은 가능성을 제시하고 있다. 따라서 무작위 대조군 연구(randomized controlled trial)와 같은 신뢰도 높은 연구가 필요하며, 이를 위해 적 응증, 금기증, 위험도 등 각각 중요한 이슈에 대 한 집중적인 연구가 필요하다.
REFERENCES
1) Engelhart L, Nelson L, Lewis S, et al: Valida- tion of the Knee Injury and Osteoarthritis Out- come Score subscales for patients with articular cartilage lesions of the knee. Am J Sports Med, 40:2264-2272, 2012.
2) Vinatier C, Mrugala D, Jorgensen C, Guicheux J, Noël D: Cartilage engineering: a crucial combination of cells, biomaterials and biofactors. Trends Biotechnol, 27:307-314, 2009.
3) Lodi D, Iannitti T, Palmieri B: Stem cells in clinical practice: applications and warnings. J
Exp Clin Cancer Res, 17;30:39, 2011.
4) Caplan AI: Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. J Cell Physiol, 213:341-347, 2007.
5) Mackenzie TC, Flake AW: Human mesenchy- mal stem cells persist, demonstrate site-specific multipotential differentiation, and are present in sites of wound healing and tissue regeneration after transplantation into fetal sheep. Blood Cells Mol Dis, 27:601-604, 2001.
6) Liechty KW, MacKenzie TC, Shaaban AF, et al: Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat Med, 6:1282- 1286, 2000.
7) Horwitz EM, Le Blanc K, Dominici M, et al:
Clarification of the nomenclature for MSC: The International Society for Cellular Therapy posi- tion statement. Cytotherapy, 7:393-395, 2005.
8) Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV: Osteogenesis in transplants of bone marrow cells. J Embryol Exp Morphol, 16:381-390, 1966.
9) Spencer ND, Gimble JM, Lopez MJ: Mes- enchymal stromal cells: past, present, and future.
Vet Surg, 40:129-139, 2011.
10) Prósper F, Gavira JJ, Herreros J, et al: Cell transplant and regenerative therapy with stem cells. An Sist Sanit Navar, 29 Suppl 2:219-234, 2006.
11) Centeno CJ, Busse D, Kisiday J, Keohan C, Freeman M, Karli D: Regeneration of meniscus cartilage in a knee treated with percutaneously implanted autologous mesenchymal stem cells.
Med Hypotheses, 71:900-908, 2008.
12) Sensebé L, Krampera M, Schrezenmeier H, Bourin P, Giordano R: Mesenchymal stem cells for clinical application. Vox Sang, 98:93- 107, 2010.
13) Mayer-Wagner S, Hammerschmid F, Redeker JI, et al: Simulated microgravity affects chon- drogenesis and hypertrophy of human mesenchy-
mal stem cells. Int Orthop, 38:2615-2621, 2014.
14) Marquass B, Schulz R, Hepp P, et al: Matrix- associated implantation of predifferentiated mes- enchymal stem cells versus articular chondro- cytes: in vivo results of cartilage repair after 1 year. Am J Sports Med, 39:1401-1412, 2011.
15) Wakitani S, Imoto K, Yamamoto T, et al:
Human autologous culture expanded bone mar- row mesenchymal cell transplantation for repair of cartilage defects in osteoarthritic knees.
Osteoarthritis Cartilage, 10:199-206, 2002.
16) Nejadnik H, Hui JH, Feng Choong EP, Tai BC, Lee EH: Autologous bone marrow-derived mesenchymal stem cells versus autologous chon- drocyte implantation: an observational cohort study. Am J Sports Med, 38:1110-1116, 2010.
17) Kasemkijwattana C, Hongeng S, Kesprayura S, Rungsinaporn V, Chaipinyo K, Chansiri K:
Autologous bone marrow mesenchymal stem cells implantation for cartilage defects: two cases report. J Med Assoc Thai, 94:395-400, 2011.
18) Centeno CJ1, Busse D, Kisiday J, Keohan C, Freeman M, Karli D: Increased knee cartilage volume in degenerative joint disease using percu- taneously implanted, autologous mesenchymal stem cells. Pain Physician, 11:343-353, 2008.
19) Davatchi F, Abdollahi BS, Mohyeddin M, Shahram F, Nikbin B: Mesenchymal stem cell therapy for knee osteoarthritis. Preliminary report of four patients. Int J Rheum Dis, 14:211- 215, 2011.
20) Emadedin M, Aghdami N, Taghiyar L, et al:
Intra-articular injection of autologous mesenchy- mal stem cells in six patients with knee
osteoarthritis. Arch Iran Med, 15:422-428, 2012.
21) Giannini S, Buda R, Vannini F, Cavallo M, Grigolo B: One-step bone marrow-derived cell transplantation in talar osteochondral lesions.
Clin Orthop Relat Res, 467:3307-3320, 2009.
22) Gigante A, Calcagno S, Cecconi S, Ramazzotti D, Manzotti S, Enea D: Use of collagen scaf- fold and autologous bone marrow concentrate as a one-step cartilage repair in the knee: histologi- cal results of second-look biopsies at 1 year fol- low-up. Int J Immunopathol Pharmacol, 24(1 Suppl 2):69-72, 2011.
23) Varma HS, Dadarya B, Vidyarthi A: The new avenues in the management of osteo-arthritis of knee--stem cells. J Indian Med Assoc, 108:583- 585, 2010.
24) Pak J: Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue- derived stem cells: a case series. J Med Case Rep, 7;5:296, 2011.
25) Koh YG, Choi YJ: Infrapatellar fat pad-derived mesenchymal stem cell therapy for knee osteoarthritis. Knee, 19:902-907, 2012.
26) Gullo F, De Bari C: Prospective purification of a subpopulation of human synovial mesenchymal stem cells with enhanced chondro-osteogenic potency. Rheumatology (Oxford), 52:1758-1768, 2013.
27) Breitbach M, Bostani T, Roell W: Potential risks of bone marrow cell transplantation into infarcted hearts. Blood. Aug, 15;110:1362-1369, 2007.