Abstract : Background : Roflumilast is a selective phosphodiesterase (PDE)-4 inhibitor approved for treatment of severe chronic obstructive pulmonary disease (COPD) associated with chronic bron- chitis and patients with a history of exacerbation. It improves lung function and reduces the fre- quency of exacerbation in patients with severe COPD. However, high rates of adverse events such as diarrhea and nausea have been reported in clinical trials. The purpose of this study was to investi- gate the pattern of roflumilast usage, tolerability, and adverse events in clinical practice.
Methods : We retrospectively analyzed the medical records of patients who received roflumilast
회원학술보고
투고일자 2015.11.6; 심사완료일자 2015.11.18; 게재확정일자 2015.11.23
�교신저자 나현오 Tel:02-2258-7853 E-mail:hola@catholic.ac.kr
만성 폐쇄성 폐질환 환자에서 Roflumilast 약물 사용 평가
박유경
a, 위완주
a, 한영현
a, 한옥연
a, 나현오
b,�가톨릭대학교 서울성모병원 약제부
a, 가톨릭대학교 의과대학 약리학교실
bClinical Use of Roflumilast in Chronic Obstructive Pulmonary Disease
You Kyung Park
a, Wan Joo Wee
a, Young Hyun Han
a, Ok Yeon Han
a, Hyen Oh La
a,b,�Department of Pharmacy, Seoul St. Mary’ s Hospital, The Catholic University of Korea
aDepartment of Pharmacology, College of Medicine, The Catholic University of Korea
b505 Banpo-dong, Seocho-gu, Seoul, 137-701, Korea
연구 배경 및 목적
만성 폐쇄성 폐질환(Chronic Obstructive Pulmonary Disease, COPD)은 비가역적인 기류제한이 특징인 폐 질환으로서 만성염증에 의한 기도 및 폐실질의 파괴(폐 기종)로 인해 발생한다.
1),2)전 세계적으로 유병률과 사 망률이 매우 높은 질환 중 하나이며 사회 경제적인 부 담이 계속 증가되는 추세이고 위험인자에 대한 노출 증 가와 인구 고령화로 인해 2030년에는 전세계 사망원
인 4위를 차지할 것으로 예측되고 있다.
3),4)COPD의 가 장 큰 원인은 흡연이며, 실내 외 대기오염, 호흡기 감 염, 유전자, 연령, 성별 등의 인자가 관여하여
1),2)만성적 인 기관지 염증과 개형(remodeling)을 일으키며 점차 폐기능이 감소하게 된다.
5)COPD의 치료목표는 증상 완화 및 운동능력 향상을 통해 삶의 질을 개선하고, 질 병진행 예방, 급성악화 및 사망률을 감소시키는 것이 다.
1),2)COPD의 중증도는 환자의 폐기능, 악화빈도를 나타 between December 2012 and September 2013.
Results : Roflumilast was prescribed for 88 COPD patients. Initially, 49 patients (55.7%) received 500 mcg and 39 patients (44.3%) received 250 mcg once daily. For 64 patients, roflumilast was prescribed for maintenance of severe COPD (post-bronchodilation forced expiratory volume (FEV 1 ) ≤50%), which is associated with chronic bronchitis in adult patients with a history of exacerbations as an add-on to bronchodilator treatment. Roflumilast-related adverse events were observed in 47.73%
(40/88) of the overall population (62 cases). The most common adverse events were gastrointestinal issues, including diarrhea, nausea, GI trouble, and decrease in appetite. Other adverse events includ- ed weight loss, skin reactions, headaches, and insomnia. Only 38 patients (43.18%) completed 1 year of roflumilast therapy and treatment discontinuation occurred in 50 patients (56.82%). Adverse events are the leading cause of treatment discontinuation.
Conclusions : Roflumilast, in conjunction with standard therapy, caused more adverse events than has previously been reported. The long-term safety and efficacy of roflumilast has not been evaluat- ed fully, and serious adverse events should be closely monitored.
[Key words] Roflumilast, Phosphodiesterase-4 inhibitor, Adverse events, COPD exacerbation
내는 잠재적 위험 및 현재 증상을 나타내는 호흡곤란 지수와 COPD assessment test(CAT) 등의 포괄적인 평가에 의하여 분류된다.
1),2)치료약물은 먼저 속효성 베 타-2 작용제(Short-acting beta 2-agonists, SABAs)가 필요 시 사용되며, 유지요법에서는 흡입 24 시간 지속성 베타-2 작용제(Long-acting beta ago- nists, LABAs) 또는 흡입 지속성 항콜린제(Long- acting muscarinic antagonists, LAMAs), methylxanthines 등 기관지 확장제가 단독 혹은 병용 으로 사용된다. 중증이거나 악화 위험이 있는 경우에는 흡입용 스테로이드(Inhaled corticosteroid, ICS)를 병용하게 된다.
1),2),5)Roflumilast는 최초로 승인된 선택적 Phopho- diesterase 4 (PDE4) 억제제로서, COPD 유지요법에 사용되는 항염증제이다. COPD는 중증일수록, 만성으 로 진행될수록 염증반응이 악화되어 기도와 폐에 neutrophil, machrophage, CD 8+ T cell 등의 염증 세포가 증가하는데,
6)PDE4는 염증세포 및 구조세포 (structural cell)에 발현되는 cyclic adenosine monophosphate(cAMP)의 주요 대사효소로서 특이적 으로 3’ , 5’ -cAMP를 5’ -AMP로 가수분해하여 불활 성화시킨다. PDE4가 억제되면 세포 내에서 3’ , 5’ - cAMP가 증가하고 protein kinase A (PKA)가 활성화 되어 protein을 인산화시킴으로써 염증세포의 활성 저 하, 섬유화(fibrosis) 억제 및 평활근 이완작용을 나타
낸다.
7),8)이러한 작용기전을 가진 roflumilast는 임상
연구에서 중증 COPD 환자의 폐기능과 삶의 질을 향상 시키며, 급성악화의 빈도를 감소시키는 효과를 나타내
었다.
8),9)그리하여 2010년 독일에 이어 2011년 3월 미
국 FDA에서도 승인되었으며, “Global Initiative for Chronic Obstructive Lung Disease (GOLD) 가이드 라인” (2013)에 추가되었다.
10),11)국내에서는 2011년 5월 식품의약품안전처 승인
12)이후, 2012년 2월에 발매되 었고, 연구기관에서는 2012년 12월부터 사용되고 있다.
Roflumilast는 비선택성 PDE 억제제인 theo- phylline과는 다르게 혈중약물농도 모니터링이 필요 없으며 1일 1회 복용의 장점이 있지만, 증상악화의 병 력이 있고 만성기관지염을 수반한 중증 COPD 환자 (Forced expiratory volume in 1 second, FEV 1 ≤ 50%)에서 기관지 확장제와 병용하는 경우에만 제한적
으로 사용이 승인되었다.
11),12)이는 roflumilast 투여로 인하여 COPD 중증도, 폐기능 및 삶의 질은 향상되었 지만, 급성악화 발생 감소는 중증환자에서만 입증되었 기 때문이다.
8),9),13)-15)다빈도 약물이상반응은 경증~중 등증의 설사, 체중 감소, 구역, 두통 등이며 치료 초기 에 발생하여 치료 지속 시 소실되는 것으로 나타났다.
그러나 입원치료가 필요한 설사, 10% 이상 체중 감소, 급성 췌장염, 암 발생, 자살 관념 등의 중대한 이상반응 이 보고되어 안전성에 문제가 제기되었다.
12),16),17)Munoz-Esquerree M. 등에 의한 시판 후 사용조사에 서는 이상반응으로 인해 투여가 중단된 환자 비율이 이 전의 허가용 임상연구에 비교해서 높게 보고되었다.
18)연구기관에서도 사용 후 6개월에 신약모니터링을 실 시하였는데 설사, 구역 등의 부작용이 다수 보고되었 다. 그리하여 본 연구진은 roflumilast의 안전한 사용 을 위하여 처방현황 및 내약성, 이상반응, 급성악화 빈 도 등의 조사를 통한 roflumilast의 사용평가를 진행 하였다.
연구방법
1. 대상환자 및 조사항목
2012년 12월 1일부터 2013년 8월 31일까지 연구기관 에서 roflumilast를 1회 이상 처방받은 COPD 환자를 대상으로, 전자의무기록(Electronic medical record, EMR) 검토를 통해 후향적인 방법으로 조사하였다.
Roflumilast 초회 처방을 기준으로 1일 투여용량, 성 별, 연령, 흡연 유무, 기관지 확장제 투여 후 예상 FEV 1
값(%), LABA 또는 LAMA, ICS 및 corticosteroids (systemic), antibiotics (systemic) 병용 유무, 이 약 투여와 연관된 약물이상반응의 종류 및 빈도, 투여 중 단사유를 확인하였다. 52주 시점에 이 약을 복용중인 환자를 대상으로 유지 용량 및 이 약 투여 전, 후 1년간 발생한 급성악화의 빈도와 중증도를 조사하였다.
2. 평가항목 및 평가기준 1) 적응증에 따른 사용현황 조사
~
Roflumilast 첫 투여 시점에 허가 적응증을 기준으
로
11),12)FEV 1 (%) ≤ 50%이며, LABA, LAMA 병용 및
최근 1년 이내 급성악화 병력이 있는 환자의 비율을 확 인하였다.
급성 악화의 정의는 미국 국립 심폐혈액기구(National Heart, Lung, and Blood Institute, NHLBI)와 세계 보건기구(World Health Organization, WHO)가 주 도하는 GOLD (Global Initiative for chronic obstructive lung disease) 위원회에서 발표하는 GOLD guideline (2015)과 대한결핵 및 호흡기학회에 서 개정되는 국내 COPD 진료지침에 따라, 호흡곤란 의 악화, 기침 증가, 가래량의 증가 또는 색변화 등의 주관적 증상 악화 호소로 외래 방문 시 약물치료가 시 행된 경우를 경증악화로 정의하였고, 응급실 방문 또 는 입원 치료를 요하는 급성악화로 약물 또는 비약물 치료가 시행된 경우를 중등증~중증악화로 정의하였 다. COPD 급성악화의 약물치료는 속효성 기관지확장 제, 전신 스테로이드, 항생제가 추가 또는 증량된 경우 로 확인하였고, 비약물 치료는 산소요법, 환기보조, 비 침습적 또는 침습적 기계환기의 시행 여부로 확인하였 다.
1),2)2) 내약성 및 이상반응 조사
내약성은 약물이상반응이 복용 초기 수주 이내 주로 나타나며, 치료 지속 시 소실되었다는 선행연구에 따
라
8),9)이 약의 투여가 52주 이내에 중지된 환자를 대상
으로, 복용 시작시점을 기준하여 12주 이내 조기 중단 된 경우와 투여 12~52주 사이에 중단된 경우로 나누 어 확인하였고, 치료 중단사유를 조사하였다. 약물이 상반응 조사는 처방의가 이 약으로 인한 이상반응으로 판단하여 EMR에 기록을 남긴 경우 해당 증상과 빈도 를 확인하였다.
3) 52주간 악화빈도 조사
이 약 복용 시작 후 52주(1년) 시점의 유지 용량에 따 라 250 mcg 또는 500 mcg 군으로 나누고, 각 군에서 roflumilast 투여 이전과 이후 각각 52주간 급성 악화 의 빈도와 중증도를 비교하였다. 급성악화의 정의는
처방현황 분석 시와 동일하게 하였다.
3. 결과 분석방법
연구 대상자의 기본 특성은 빈도 및 비율로 나타내었 고, FEV 1 (%) 값은 평균±표준편차로 나타내었고, 52 주간 악화빈도 비교는 Wilcoxon signed rank test를 사용하였다. 자료의 분석은 IBM SPSS 22.0 ver.
(SPSS Inc., Chicago, IL, USA) 프로그램을 사용하 였으며, p value가 0.05 미만인 경우 통계적으로 유의 하다고 판단하였다.
4. 피험자 보호
본 연구는 가톨릭대학교 서울성모병원에서 수행된 단일기관 후향적 연구로, 본원의 기관윤리심의위원회 (Institusional Review Board, IRB)의 승인을 받아 진행하였다(과제번호: KC13RISI0669).
연구결과
1. 연구 대상의 특성 및 처방 현황
연구 기간 중 본원에서 roflumilast를 1회 이상 처방 받은 COPD 환자는 88명으로, 모두 45세 이상이었다.
남성이 85명(96.59%)에 해당하였고, 평균 연령은 70
±9세, 현재 흡연자는 20명(22.73%), 과거 흡연자 65 명(73.86%), 비흡연자 3명(3.41%)이었다. 이 약 투여 이전 가장 최근에 측정된 기관지 확장제 투여 후 예상 FEV 1 (%) 값은 평균 43.43±13.68이었고, 1년 이전에 급성 악화를 1회 이상 경험한 환자는 총 84명(95.45%) 에 해당하였다. 이 약 사용 시 병용된 흡입용 기관지 확장제와 전신작용 스테로이드 및 항생제를 조사한 결 과, 각각 86명(97.73%), 32명(36.36%), 25명(28.41%) 에서 병용되었으며, 모든 조사항목에서 두 용량군간 유의한 차이는 없었다.
국내 허가 적응증에 해당하는 FEV 1 (%) 값 50% 이하,
이전에 급성악화 병력이 있으며 1종 이상의 기관지 확
장제 병용의 조건을 동시에 만족하는 환자는 64명
(72.73%)에 해당하였다(Table 1).
2. 내약성 및 이상반응
Roflumilast 투여 시작 후 52주 시점을 기준으로 이 전에 투여가 중단된 환자는 50명(56.82%), 복용이 유 지된 환자는 38명(43.18%)에 해당하였다. 투여가 중단 된 환자 중 복용 시작 후 12주 이내 조기 중단된 환자는 31명으로 전체 환자(N=88)의 35.23%에 해당하였고, 이후 12~52주 사이에 중단된 환자는 19명(21.59%)이 었다. 투여 중단 사유는 약물이상반응으로 인한 중단이 23명(26.14%)으로 가장 높았고, 약물이상반응으로 인 해 조기 중단된 경우는 15명, 12~52주 사이에 투여 중 단된 환자는 8명이었다. 또한, 이 약 유지 중 follow up이 중단된 환자, 즉, 외국 생활자, 치료 중 호흡기질 환 또는 기타 기저질환으로 인한 사망, 타병원으로 전 원 등의 경우가 20명(22.73%)이었다. 그 외 동반질환 또는 효과미비 등 의학적 판단에 의한 투여 중단이 6명 (6.82%), 비용부담으로 인한 투여중단이 1명(1.14%)으 로 나타났다(Table 2).
약물이상반응이 1건 이상 나타난 환자는 42명으로 47.73%에 해당하였으며, 총 62건이었다. 다빈도 약물 이상반응은 설사 11명(12.50%), 구역 8명(9.09%), 위 장 장애 7명(7.95%), 소화불량과 식욕감퇴 각각 5명 (5.68%)으로 나타났으며, 위장관 관련 이상반응을 경 험한 환자가 40명으로 45.45%에 해당하였다. 그 외 피부반응 6명(6.82%), 체중 감소 5명(5.68%), 두통 3 명(3.41%) 등이 주요 이상반응으로 나타났고, 불면 2명
GenderMale 85(96.59)
Female 3(3.41)
Smoking
Current smoker 20(22.73)
Ex smoker 65(73.86)
Non smoker 3(3.41)
Daily dose
250 mcg/day 39(44.32)
500 mcg/day 49(55.68)
History of AE (previous 1 year)b) 84(95.45) Combined medication
Long acting bronchodilatorc) 86(97.73)
LAMA only 7(7.95)
LABA+LAMA 7(7.95)
ICS+LABA 13(14.77)
ICS+LAMA 2(2.27)
ICS+LAMA+LABA 57(64.77)
Corticosteroids(systemic) 32(36.36) Antibiotics(systemic) 25(28.41) Indications compliancea)+b)+c) 64(72.73)
FEV1(%) ≤50%a) 66(75.00)
FEV1(%) >50% 22(25.00)
Age 70±9
;72(45-86)
Total (N=88) Table 1. Baseline characteristics at roflumilast initiation
FEV1(%), post BD predicted 43.43±13.68
;42.5(17-92)
Data are presented as mean ±SD;median(min-max) and n(%).
FEV1=Forced expired volume in 1 second; BD=Bronchodilator;
AE=Acute exacerbation; LAMA=Long-acting muscarinic antagonists;
LABA=Long-acting beta agonists; ICS=Inhaled corticosteroids
Treatment tolerability (≥52wks) 38 43.18 Treatment discontinuation (<52wks) 50 56.82
Early (<12wks) 31 35.23
Late (12-52wks) 19 21.59
Reasons for discontinuation
Adverse events 23 26.14
Loss to follow up 20 22.73
By physician decision 6 6.82
High cost 1 1.14
백분율[%]
명수[명]
Table 2 . Treatment tolerability
(2.27%), 불안 1명(1.14%) 등도 보고되었다(Table 3).
3. 52주간 악화빈도 조사
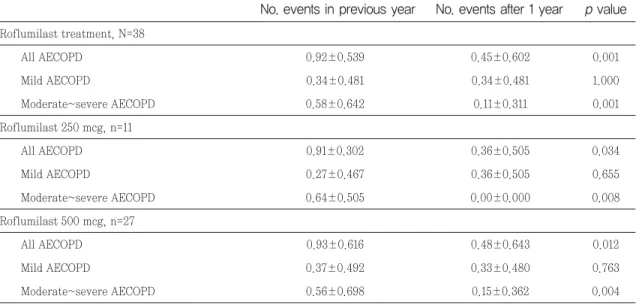
Roflumilast 투여 시작 후 52주 시점에 복용이 유지 된 환자는 38명이었고, 유지용량을 기준으로 250 mcg 복용군은 11명, 500 mcg 복용군은 27명이었다. 용량 군별 이 약 투여 전, 후 각 52주간의 급성악화 빈도와 중증도를 조사한 결과 전체 환자 및 각 복용군에서 전 체 급성악화의 빈도를 낮추었고, 특히 중등도~중증의 급성악화가 유의하게 감소한 결과를 보였다(Table 4).
이 약 복용 중 용량변경이 있었던 환자는 52주 시점의 유지용량을 기준으로 분석하였는데, 250 mcg 복용군 에는 500 mcg에서 250 mcg으로 감량한 환자 4명이 포함되었고, 500 mcg 군에는 250 mcg에서 500 mcg 으로 증량하여 유지한 환자 11명이 포함되었다.
고찰 및 결론
Roflumilast의 허가 상용량은 1일 500 mcg인데, 초 회 처방 시 1일 250 mcg이 처방된 경우가 전체 처방의
Diarrhea 11 12.5
Nausea 8 9.09
GI trouble 7 7.95
Skin reaction 6 6.82
Weight decreased 5 5.68
Indigestion 5 5.68
Decrease in appetite 5 5.68
Poor oral intake 3 3.41
Headache 3 3.41
Insomnia 2 2.27
Flushing 2 2.27
Hematochezia 1 1.14
Weakness 1 1.14
Anxiety 1 1.14
Unknown 2 2.27
백분율[%]
건수[건]
Adverse events
Table 3. Adverse events related to roflumilast therapy
*Percentage of the total number of patients included in the analysis.
AECOPD=Acute exacerbation of COPD Roflumilast treatment, N=38
All AECOPD 0.92±0.539 0.45±0.602 0.001
Mild AECOPD 0.34±0.481 0.34±0.481 1.000
Moderate~severe AECOPD 0.58±0.642 0.11±0.311 0.001
Roflumilast 250 mcg, n=11
All AECOPD 0.91±0.302 0.36±0.505 0.034
Mild AECOPD 0.27±0.467 0.36±0.505 0.655
Moderate~severe AECOPD 0.64±0.505 0.00±0.000 0.008
Roflumilast 500 mcg, n=27
All AECOPD 0.93±0.616 0.48±0.643 0.012
Mild AECOPD 0.37±0.492 0.33±0.480 0.763
Moderate~severe AECOPD 0.56±0.698 0.15±0.362 0.004
p value No. events after 1 year
No. events in previous year
Table 4. Effectiveness analysis within groups, comparing number of events during the previous year to
number of events in the 1 year of follow-up
44.3%(39/88) 이었다. 250 mcg으로 투여를 시작하여 1주~5개월 이내 500 mcg으로 증량한 환자 11명, 500 mcg 복용 중 250 mcg으로 감량하여 유지한 경우가 4 명이 있었다. 용량의 증감은 약물이상반응 등의 내약성 에 따라 조절되었지만, 이러한 용량 조절 시 효과를 확 인한 연구는 현재까지 없다. 이 약의 상용량 결정을 위 해 수행된 선행연구에서 위약 대비 평균 COPD 악화율 은 250 mcg 투여 시 8~9%, 500 mcg 투여 시 34~
48% 감소하여,
19)500 mcg 투여 시 저용량보다 이상반 응의 발현 빈도가 높음에도 불구하고
20)위험 대비 효과 를 고려하여 상용량은 500 mcg으로 결정되었다.
8),13)-15)그러나, 설사, 두통, 오심 등의 이상반응은 용량 의존적 반응이며 치료를 지속하는 경우 수주 이내 소실되는 것 을 고려할 때,
8),9),20),21)1일 250 mcg로 투여를 시작하여 500 mcg으로 증량하는 up-titration regimen은 임 상적으로 유용성이 있을 것으로 생각된다. 현재 rof- lumilast를 첫 4주간 250 mcg 투여하고 이후에 500 mcg으로 up-titration하는 경우의 투여 중단율 확인 및 500 mcg에 불내약성을 나타낸 환자에 250 mcg 투 여시의 효과 및 안전성을 평가하기 위한 3상 연구가 진 행 중이다.
22)본 연구에서 1회 이상 약물이상반응을 경험한 환자는 42명(47.73%), 총 62건이었고, 52주간 roflumilast 복용이 유지된 환자는 38명(43.2%)에 그쳤다. 약물이 상반응은 주된 투여 중단 사유로 나타났다. 선행된 연 구들에서 이 약은 중등도~중증의 COPD 환자에서 전 반적으로 좋은 내약성을 보였으나,
13),14),25)-27)14.8%의 환 자가 이상반응으로 인해 투여를 중단한 것으로 나타났 다(위약군 중단율 9.9%).
11)또한, 이 약 시판 후에 스페 인의 한 대학병원에서 시행한 연구에서는 연구 대상자 (n=55) 중 50.9%(n=28)만이 1년 투여를 완료하였으 며, 69.1%에 해당하는 환자가 이상반응을 경험한 것으 로 나타났다.
18)Roflumilast로 인한 흔한 이상반응은 설사, 오심, 두 통 등이며 정신 신경계 이상반응의 위험을 높이거나, 체중 감소가 나타날 수 있다고 알려져 있는데,
11)본 연 구에서도 유사한 이상반응의 종류와 양상을 나타내어 위장관계 이상반응이 40명(45.45%)의 환자에서 가장 다빈도로 나타났다. 불면, 불안, 우울, 자살관념, 자살 기도 등 정신 신경계 이상반응은 이전 연구에서 약
5.9%로 보고되었는데(위약 3.3%),
11)본 연구에서도 불 면, 불안 등의 이상반응이 3건(3.41%) 나타났다. 체중 감소 이상반응은 이전 연구에서 1년 투여 후 초기 체중 의 5~10%가 감소하는 중등도 반응은 20%, 초기 체중 의 10% 이상 감소하는 중증은 7% 보고되었으며, 이 경 우에 대부분 투여 중단 후 3개월 이내에 초기 체중으로 회복하였다.
11)본 연구에서도 체중 감소 이상반응은 5 명(5.68%)에서 보고되었는데, EMR 기록 상 체중 감소 정도를 확인할 수는 없었으나 4명에서 52주간 투여가 지속되어 중증의 체중 감소를 보이지 않은 것으로 해석 되었다. Roflumilast의 체중 감소 기전은 명확히 밝혀 지지 않았으나, PDE4 억제로 인해 세포 내 cAMP가 증가하게 되면 AMP activated protein kinase (AMPK)가 활성화되고 지방분해가 증가할 것으로 추 측되며,
8)구역과 설사가 체중 감소에 영향을 줄 것이라 는 의견도 제시되었다.
28)52주간 투여가 지속된 환자를 대상으로, 투여 전, 후 악화 빈도를 조사한 결과, 용량에 관계없이 악화의 빈 도가 감소한 것으로 나타났는데, 특히 중등도~중증의 악화가 감소하였다. 그러나 본 연구는 환자의 상태에 따라 COPD 치료 과정에 roflumilast를 추가로 사용 하고, 질병의 경과 중 악화의 빈도를 단순 비교한 결과 이기 때문에 roflumilast 외의 약물 및 비약물 치료로 인한 영향을 배제할 수 없다. 또한 비교적 안정적인 상 태의 외래환자들이 일부 포함되었으며, 약물이상반응 이나 기저질환의 동반, 입원치료가 필요한 고도 중증 환자, 사망 등의 환자들은 투여가 중단되어 분석에 포 함되지 않았고, 급성악화 발생 빈도 및 연구 대상이 적 은 것을 고려할 때 자료의 해석에 한계가 있다.
Roflumilast는 만성기관지염을 수반하며, 증상 악화
병력이 있는 중증 COPD 환자에서 급성악화의 감소가
입증되었기 때문에 이러한 조건을 동시에 만족하는 경
우에만 사용이 제한적으로 허가되었고, FEV 1 값도
GOLD 가이드라인에 따라 중증 기준인 50% 이하로 제
한되었다.
2)하지만 roflumilast의 다수 임상연구에는
FEV 1 30~70%의 환자들이 포함되어 있었고, 국내 진
료지침은 COPD의 중증 기준을 국내 연구자료에 근거
하여 FEV 1 60% 이하로 정의하고 있다.
1)본 연구에서
환자의 평균 FEV 1 값은 43.43±13.68[17-92] 이었고,
FEV 1 50% 미만인 환자는 66명(75%)으로 나타났는데
이를 국내지침에 따라 FEV 1 60% 이하로 적용하면 환 자의 91%가 해당된다. 한편, 유사한 중증 COPD 치료 제 중 하나인 ICS/LABA 복합제의 국내 급여 인정 기 준이 FEV 1 (%) 50% 미만에서 60% 미만으로 국내 진료 지침에 가깝게 변경된 사례도 있었다.
23),24)그리하여 roflumilast의 사용이 필요한 국내 환자의 적용 기준 및 적절한 FEV 1 값에 대한 추가적인 연구 및 재검토가 필요하다고 사료된다.
또한 중증 COPD의 치료에 LABA 또는 LAMA와 같 은 기관지 확장제가 우선 사용되며 치료의 근간을 이루 고 있지만, 발병 기전을 고려할 때 근본적으로는 만성 염증에 대한 치료가 중요하며 강력한 항염증제인 스테 로이드가 흡입용 제제로 사용되고 있다. Roflumilast 은 허가 시, 지속형 기관지 확장제와 병용하여 사용하 도록 허가되었고, ICS와 병용 시 유용성에 관한 임상 연구 결과가 최근에 발표되었는데,
27)본 연구에서도 초 기에 ICS를 병용한 환자가 81.82%(72/88)나 되었다.
국외의 COPD 진료지침 뿐만 아니라 국내 진료지침에 서도 FEV 1 < 60% 또는 이전 1년간 2회 이상의 급성악 화 또는 입원을 요하는 정도의 심한 악화가 1회 이상 있었던 경우 ICS/LABA 사용을 추천하고 있다.
1),2)그러 나 이러한 ICS는 천식치료에서 비교적 좋은 효과와 반 응을 보이지만, 폐기능 개선 또는 COPD 환자의 만성 염증 조절에는 효과가 떨어지는 것으로 알려져 있
다.
29),30)이는 COPD 환자의 스테로이드 저항성 때문으
로, COPD 환자에서 발현되는 폐포 대식 세포의 염증 강화(proinflammatory) cytokine 생성을 억제하는 주요 분자인 histone deacetylase (HDAC)의 감소, glucocorticoid receptor β발현 등으로 설명할 수 있 다.
31)최근 Milara J. 등에 의한 in vivo 연구는, COPD 환자의 호중구에서 roflumilast의 활성 대사체인 rof- lumilast N-oxide(RNO)가 corticosteroid 저항성을 역전시키면서 항염증 효과를 유의하게 증가시켰고, dexamethasone과 병용 시 시너지 효과가 있다고 밝 혔다.
32)이는 ICS와 병용 시 스테로이드 저항성 개선에 임상적 유용성이 있음을 시사하는 연구로서 최근 ICS/LABA를 투여하는 환자를 대상으로 진행된 임상 연구의 결과에서도 그 유용성이 입증된 바 있다.
27)본 연구는 한 상급 종합병원에서 roflumilast의 처방 현황을 확인하고 내약성 및 안전성을 확인하고자
EMR 기록을 통해 후향적으로 진행되어 여러 한계점 을 포함한다. 먼저 roflumilast가 처방된 환자에서만 조사되어 전체 COPD 환자의 치료에 있어 roflumi- last의 역할에 대한 조명은 이루어지지 않았고, 많은 환자들이 다른 치료를 병용하고 있었으므로 이로 인한 효과를 배제할 수 없으며, 약물이상반응의 중증도 및 발현 시점, 증상 소실 여부 등을 자세하게 조사하지 못 한 점 등이 있다.
그러나 roflumilast는 약물이상반응의 발현 빈도 및 이로 인한 투약 중단율이 높고, 심각한 이상반응의 가 능성이 있으므로 이에 대한 지속적인 모니터링이 필요 함을 확인할 수 있었다. 또한, 초기 용량을 up-titra- tion하는 경우의 유용성과 내약성에 따른 감량의 효과, 한국인에게 적절한 FEV 1 (%) 값의 적용기준 필요성, 장 기간 사용 시 약물이상반응을 상회하는 치료상 이익에 대한 참고 자료가 될 수 있을 것으로 사료된다.
참고문헌
1) The Korean Academy of Tuberculosis and Respiratory Diseases; COPD Guideline Revision Committee. COPD Guideline:
updated in 2014. 1st ed. Seoul: The Korean Academy of Tuberculosis and Respiratory Diseases (2014)
2) Global Initiative for Chronic Obstructive Lung Disease(GOLD): Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease.
www.goldcopd.org, Updated 2015.
3) Mathers C.D., Loncar D.: Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 3, e442 (2006) 4) Bousquet J., Kiley J., Bateman E.D., Viegi
G., Cruz A.A., Khaltaev N., Ait Khaled N., Baena-Cagnani C.E., Barreto M.L., Billo N., Canonica G.W., Carlsen K.H., Chavannes N., Chuchalin A., Drazen J., Fabbri L.M., Gerbase M.W., Humbert M., Joos G., Masjedi M.R., Makino S., Rabe K., To T., Zhi L.:
..
Prioritised research agenda for prevention and control of chronic respiratory diseases.
Eur Respir J, 36, 995-1001 (2010)
5) Milara J., Morell A., Ballester B., Sanz C., Freire J., Qian X., Alonso-Garcia, Morcillo E., Cortijo J.: Roflumilast improves corticos- teroid resistance COPD bronchial epithelial cells stimulated with toll like receptor 3 ago- nist. Respir Res, Feb 5, 16, 12 (2015)
6) Hogg J.C., Chu F., Utokaparch S., Woods R., Elliott W.M., Buzatu L., Cherniack R.M., Rogers R.M., Sciurba F.C., Coxson H.O., Pare P.D.: The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med, Jun 24, 350(26), 2645-53 (2004)
7) Jeffery P.: Phosphodiesterase 4-selective inhibition: novel therapy for the inflamma- tion of COPD. Pulm Pharmacol Ther, 18(1), 9-17 (2005)
8) Rabe K.F.: Update on roflumilast, a phos- phodiesterase 4 inhibitor for the treatment of chronic obstructive pulmonary disease. Br J Pharmacol, May, 163(1), 53-67 (2011) 9) Calverley P.M., Rabe K.F., Goehring U.M.,
Kristiansen S., Fabbri L.M., Martinez F.J.;
M2-124 and M2-125 study groups.: Roflu- milast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet, 374, 685-94 (2009)
10) Global Initiative for Chronic Obstructive Lung Disease: Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Updated 2013. www.goldcopd.org, Accessed on November 08, 2013
11) Product Information: DALIRESP(TM) oral tablets, roflumilast oral tablets. Forest Laboratories, Inc., St. Louis, MO, 2011 12) 닥사스정™허가사항, http://ezdrug.mfds.go.kr
13) Rabe K.F., Bateman E.D., O’ Donnell D., Witte S., Bredenbroker D., Bethke T.D.:
Roflumilast--an oral anti-inflammatory treatment for chronic obstructive pul- monary disease: a randomised controlled trial. Lancet, 366, 563-71 (2005)
14) Calverley P.M., Sanchez-Toril F., McIvor A., Teichmann P., Bredenbroeker D., Fabbri L.M.: Effect of 1-year treatment with rof- lumilast in severe chronic obstructive pul- monary disease. Am J Respir Crit Care Med, 176, 154-161 (2007)
15) Pulmonary-allergy drugs advisory commit- tee meeting. NDA 22-522: Daxas (roflumi- last 500 mcg tablets) for the maintenance treatment of chronic obstructive pulmonary disease(COPD) associated with chronic bronchitis in patients at risk of exacerba- tion. April 7,2010. Food and Drug Admini- stration. Disponible en: http://www.fda.gov /downloads/AdvisoryCommittees/Committees MeetingMaterials/Drugs/PulmonaryAllergy DrugsAdvisoryCommittee/UCM207377.pdf, consultado 30 Apr 2013
16) US Department of Health and Human Services. Food and Drug Administration.
Pulmonary-Allergy Drugs Advisory Com- mittee meeting on roflumilast. http://
www.fda.gov/downloads/Advisory Committees/CommitteesMeetingMaterials/D rugs/Pulmonary-AllergyDrugsAdvisory Committee/UCM212606.pdf. held on 7 Apr 2010
17) Gupta S.: Side-effects of roflumilast.
Lancet, 379, 710-1 (2012)
18) Munoz-Esquerre M., Diez-Ferrer M., Monton C., Pomares X., Lopez-Sanchez M., Huertas D., Manresa F., Dorca J., Santos S.
: Roflumilast added to triple therapy in patients with severe COPD: a real life
′
..
~
′ ′ ′
study. Pulm Pharmacol Ther, Feb, 30, 16-21 (2015)
19) Wagner L.T., Kenreigh C.A.: Roflumilast:
the evidence for its clinical potential in the treatment of chronic obstructive pulmonary disease. Core Evid, 1(1), 23-33 (2005) 20) Lahu G., Facius A.: Application of popula-
tion pharmacokinetic modeling to explore the impact of alternative roflumilast dosing regimens on tolerability. Int J Clin Pharmacol Ther, Nov, 51(11), 832-6 (2013) 21) Lee S.D., Hui D.S., Mahayiddin A.A. et al.:
Roflumilast in Asian patients with COPD: A randomized placebo-controlled trial.
Respirology, 16, 1249-1257 (2011)
22) Evaluation of Tolerability and Pharma- cokinetics of Roflumilast, 250μ g and 500μ g, as add-on to Standard COPD Treatment to Treat Severe COPD (OPTIMIZE) is available at https://www.clinicaltrials.gov/ct2/
show/study/NCT02165826?term=roflumi- last&rank=3 accessed on 26 Oct 2015 23) Salmeterol xinafoate + Fluticasone propi-
onate 흡입제 약제비 심사지침 상세내역 (고시 제 2015-51호)
24) Formoterol fumarate + (Micronized) Budesonide 흡입제 약제비 심사지침 상세내역 (고시 제 2015-154호)
25) Calverley P.M., Rabe K.F., Goehring U.M., Kristiansen S., Fabbri L.M., Martinez FJ;
M2-124 and M2-125 study groups.: Roflu milast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet, Aug 29, 374(9691), 685-94 (2009)
26) Fabbri L.M., Calverley P.M., Izquierdo- Alonso J.L., Bundschuh D.S., Brose M., Martinez F.J., Rabe K.F.; M2-127 and M2- 128 study groups.: Roflumilast in moder- ate-to-severe chronic obstructive pul-
monary disease treated with longacting bronchodilators: two randomised clinical trials. Lancet, Aug 29, 374(9691), 695-703 (2009)
27) Martinez F.J., Calverley P.M., Goehring U.M., Brose M., Fabbri L.M., Rabe K.F.:
Effect of roflumilast on exacerbations in patients with severe chronic obstructive pulmonary disease uncontrolled by combi- nation therapy(REACT): a multicentre ran- domised controlled trial. Lancet, Mar 7, 385(9971), 857-66 (2015)
28) Chong J., Poole P., Leung B., Black P.N.:
Phosphodiesterase 4 inhibitors for chronic obstructive pulmonary disease. Cochrane Database Syst Rev, CD002309 (2011) 29) Roche N., Marthan R., Berger P.,
Chambellan A., Chanez P., Aguilaniu B., Brillet P.Y., Burgel P.R., Chaouat A., Devillier P., Escamilla R., Louis R., Mal H., Muir J.F., Perez T., Similowski T., Wallaert B., Aubier M.: Beyond corticosteroids:
future prospects in the management of inflammation in COPD. Eur Respir Rev, Sep 1, 20(121), 175-82 (2011)
30) Barnes P.J., Adcock I.M.: Glucocorticoid resistance in inflammatory diseases.
Lancet, May 30, 373(9678), 1905-17 (2009) 31) Barnes P.J.: Mechanisms and resistance in
glucocorticoid control of inflammation. J Steroid Biochem Mol Biol, May 31, 120(2-3), 76-85 (2010)
32) Milara J., Lluch J., Almudever P., Freire J., Xiaozhong Q., Cortijo J.: Roflumilast N- oxide reverses corticosteroid resistance in neutrophils from patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol, Aug, 134(2), 314-22 (2014)
′