세포 사멸과 면역 반응의 관계 임기홍 Page 1 / 36 BRIC View 2018-T30
세포 사멸과 면역 반응의 관계
임 기 홍
로체스터 대학
E-mail: Kihong_Lim@urmc.rochester.edu
요약문
다세포 생물은 병원체에 감염된 세포를 의도적으로 죽게 함으로써 병원체의 증식과 확산을
방지한다. 고등동물은 병원체와의 경쟁을 통해서 다양한 세포 사멸 양식을 고안해내었는데
각각의 세포 사멸은 서로 보완적이며 면역과 유기적으로 연결되어있다. 또한 다세포 생물은
사멸된 세포를 안전하고 정확하게 제거함으로써 부적절한 염증과 면역 반응이 유도되지
않도록 한다. 세포 사멸과 사멸 세포 처리에 관련된 유전자의 결함은 염증성 질환, 자가면역
질환, 암의 발생과 진행에 밀접하게 관련되어 있다.
Key Words:
선천성 면역, 대식세포, 수지상세포, 세포 사멸, Apoptosis, Caspase, Efferocytosis,
Necroptosis, Phosphatidylserine, Pyroptosis
목 차
1. 서론
2. 본론
2.1 Apoptosis와 면역
2.2 Necroptosis와 면역
2.3 Pyroptosis와 면역
2.4 Apoptosis, Necroptosis, Pyroptosis, Innate signaling의 Crosstalk
2.5 Efferocytosis와 면역
3. 결론
4. 참고문헌
세포 사멸과 면역 반응의 관계 임기홍 Page 2 / 36
1. 서론
세포의 죽음은 크게 두 가지 관점에서 분류하는데, 메커니즘의 측면에서 의도된 죽음인지
(Programmed death; Apoptosis, Necroptosis, Pyroptosis) 아닌지로(Accidental necrosis), 또한 죽음의
형태학적 양상에 따라 세포 용혈(lysis)이 수반되는지(Necrosis, Necroptosis, Pyroptosis)
아닌지로(Apoptosis) 나뉠 수 있다 (그림 1). 의도된 세포의 사멸(Programmed cell death)은 다세포
생물의 개체발생과 조직(tissue)의 항상성(homeostasis)을 위해 필수적이며 동시에 병원체 감염에
대한 매우 중요한 선천성 면역(innate immunity) 방어 전략이기도 하다. Apoptosis는 하등한 다세포
생물에서부터 고등생물에 걸쳐 넓게 관찰되며 척추동물은 이에 더하여 더욱 다양한 죽음의
메커니즘을 보유하고 있는데 오랜 기간 진화를 거치며 병원체와의 전쟁에서 획득한 형질이다. 세포
사멸은 주위 조직에 다양한 면역적 영향력을 행사하는데, 본 동향리포트에서는 상이한 세포 사멸이
어떻게 면역 반응을 유도하는지 그리고 이들 세포 사멸과 선천성 면역이 어떻게 상호작용하는지에
대하여 논하고자 한다. 세포 사멸에 수반되어 필수적으로 이루어져야 하는 사멸 세포의
제거(Efferocytosis)는 주로 전문적인 포식세포(Professional phagocyte)가 담당하는데 병원체 포식과
유사한 방식으로 이루어진다. 어떤 양상으로 진행되는지, 면역과 어떤 관계에 있는지, 그리고 세포
사멸과 사멸 세포 포식이 질병과 어떻게 연관되어 있는지 논하고자 한다.
그림 1. 세가지 세포 사멸의 개요. Caspase가 매개하는 apoptosis는 DNA분절, 세포막의 blebbing, PtdSer의
노출을 수반한다. 세포막은 온전하게 유지되어 세포 내용물이 외부로 유출되지 않는다. RIPK1, RIPK3, MLKL가 매개하는 necroptosis와 inflammatory caspase, GSDMD가 매개하는 pyroptosis는 세포 용혈을 수반하여 다량의 DAMPs(damage-associated molecular patterns)가 세포 외부로 유출된다. Pyroptosis의 과정에서는 pro-IL1β, pro-IL18이 IL1β, IL18로 절단/활성화되고 GSDMD pore를 통하여 외부로 분비된다. C1q, Complement 1q; GSDMD, Gasdermin D; MLKL, Mixed lineage kinase domain-like; PtdSer, phosphatidylserine; RIPK1, Receptor interacting protein kinase 1, RIPK3, Receptor interacting protein kinase 3; Xkr8, Xk-related protein 8.
세포 사멸과 면역 반응의 관계 임기홍 Page 3 / 36
2. 본론
2.1 Apoptosis와 면역
Apoptosis는 다세포 생물 진화의 사다리에서 매우 오래 전에 채택된 병원체에 대한 방어
수단이었던 것 같다. 왜냐하면 식물이나 nematode에서도 동물의 감염체 감지 메커니즘인
TLR(Toll-like receptor)과 비슷한 형태의 PRR(Pattern recognition receptor)이 존재하고 그로부터 촉발되는
감염 세포의 자살 현상이 관찰되기 때문이다 [75, 122]. 동물은 염증 반응을 통하여 병원체의 공격에
대항함과 동시에 감염된 세포를 제거하여 병원체의 증식과 확산을 억제하는데, 감염된 숙주세포의
자살은 숙주세포에서 내재적(intrinsic)으로 유도되거나 면역세포가 감염 세포의 자살을 촉발하는 두
가지 방식이 있다 [64, 96, 115, 165, 189].
2.1.1 Apoptosis의 과정
Apoptosis는 여러 caspase(cysteine protease의 일종)들이 순서대로 절단되어 활성화되는
신호 전달 과정을 거쳐 최종적으로 chromatin의 절단, 세포막 bleb의 형성, apoptotic body 형성
등의 형태학적 특징을 보이며 세포가 사멸하는 현상이다. 내재적(intrinsic), 외재적(extrinsic) 두 가지
다른 양상의 apoptosis가 있다 (그림 2).
내재적 apoptosis는 미토콘드리아를 매개로 caspase-9이 활성화됨으로써 유도되며 이
경로의 주된 조절자는 BCL-2 family 단백질이다. BCL-2 family는 BH3-only 단백질(Bim, Bid, Noxa 등),
BCL-2(혹은 BCL-xL, MCL1), 미토콘드리아 pore(MOMP, mitochondria outermembrane pore)를
생성하는 BAX와 BAK으로 나뉜다. 정상적인 상태에서는 BCL-2가 BAX/BAK의 pore형성을 억제하는데,
내재적 apoptosis를 자극하는 신호에 따라 BH3-only 단백질이 증가하고 활성화되면 이들이 BCL-2를
저해하거나 BAX/BAK을 활성화함으로써 MOMP가 형성된다. Cytochrome c가 MOMP를 통하여
세포질로 유출되면 Apaf-1의 거대 복합체인 apoptosome이 형성된다. Apoptosome은
pro-caspase-9을 활성화하고 caspase-9이 다시 caspase-3나 -7과 같은 executor caspase를 활성화함으로써
apoptosis가 개시된다.
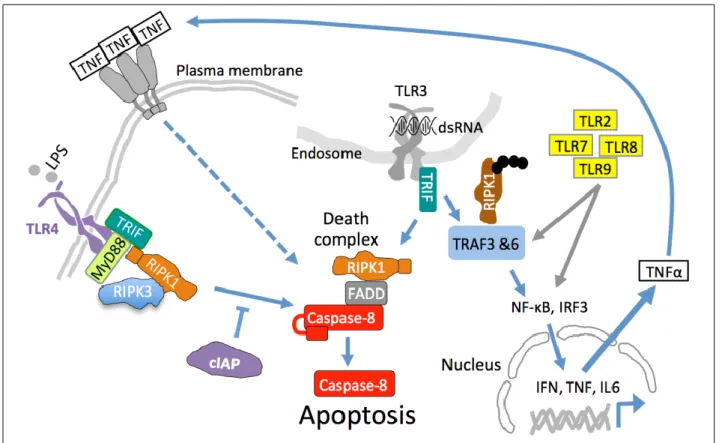
세포 사멸과 면역 반응의 관계 임기홍 Page 4 / 36 그림 2. Apoptosis와 necroptosis의 경로. 1) 내재적 apoptosis: apoptosis를 유발하는 자극에 의하여 BH-3 only 단백질이 생성/활성화되면 BAK과 BAX로 이루어진 MOMP(mitochondria outermembrane pore)의 형성이 유도되고 MOMP를 통하여 미토콘드리아로부터 cytochrome c가 유출된다. 이어 cytochrome c는 다수의 Apaf-1분자로 이루어지는 apoptosome 형성을 유도하고, 이로 인해 pro-caspase-9이 활성화되며 caspase-9이 pro-caspase-3, -7과 같은 executor caspase를 다시 활성화함으로써 apoptosis가 시작된다. 2) 외재적 apoptosis: TNF 수용체와 같은 death 수용체가 활성화되면 수용체 말단에 complex I이 형성된다. Complex I의 형성은 DD(death domain)간의 친화력에 의하여 TRADD와 RIPK1이 수용체 말단에 모집됨으로써 시작되고 TRADD는 다시 TRAF2/cIAP를 모집한다. cIAP는 E3 ubiquitin ligase로서 RIPK1을 K63 polyubiquitin(그림에서 black circle)으로 수식(modification)한다. 이 ubiquitin 사슬에는 TAB2/3과 TAK1 복합체가 모집된다. TAK1은 MAP kinase경로(JNK, p38 등)를 자극하여 AP1 등의 전사 촉진 인자를 활성화한다. K63 polyubiquitin은 또한 LUBAC(Linear ubiquitination assembly complex; HOIL-1, HOIP, SHARPIN으로 구성된 복합체)을 모집하는데 LUBAC은 RIPK1을 M1 polyubiquitin으로 수식한다. 이어 NEMO/IKK복합체가 모집되어 NF-κB를 활성화한다. AP1나 NF-κB 등의 전사 인자들은 염증에 관여하는 유전자의 발현을 유도한다. LUBAC의 모집은 deubiquitinase 복합체인 CYLD/SPATA2의 모집을 병행하는데 CYLD/SPATA2는 TNF 수용체로부터의 사이토카인 생성을 위한 신호 전달을 저해하고 세포 사멸을 유도한다. TNF 신호 전달 경로가 활성화되면 또 하나의 deubiquitinase 복합체인 ABIN/A20가 complex I에 모집되는데 ABIN/A20 역시 TNF 신호 전달을 억제하고 세포 사멸을 유도한다. 세포가 건강하지 못하여 유전자 발현 및 단백질 생성 능력이 저하된 상황이 되면 complex I이 와해되고 대신 complex II가 형성되어 apoptosis의 경로가 시작된다. Complex II는 RIPK1-FADD-pro-caspase-8으로 구성되는데 cFLIP은 caspase-8 활성화를 저해하는 조절자의 역할을 한다. cFLIP은 TNF 신호 경로에 의해 급속히 증가하며, cFLIP과 pro-caspase-8의 농도 비율이 caspase-8의 활성화를 결정 짓는 것으로 알려져 있다. 만약 caspase-8이 억제되는 상황이라면 complex II 대신 RIPK1-RIPK3-MLKL로 구성되는 necrosome이 형성되고 RIPK3에 의하여 MLKL이 활성화된다. 활성화된 MLKL은 세포막에 pore를 만들어 용혈성 세포 사멸인 necroptosis를 유도한다. ABIN, A20 binding inhibitor of NF-kB; cFLIP, cellular FLICE inhibitory protein; cIAP, cellular inhibitor of apoptosis protein; FADD, Fas-associated death domain; HOIL-1, heme-oxidized IRP2 ubiquitin ligase 1; HOIP, HOIL interacting protein; IKK, IkB kinase; MLKL, Mixed lineage kinase domain-like; NEMO, NF-kB essential modulator; RIPK1, Receptor interacting protein kinase 1; RIPK3, Receptor interacting protein kinase 3; SHAPIN, Shank-associated RH domain-interacting protein; TAB2/3, TAK1 binding 2/3; TAK1, TGFβ-activated kinase 1; TNF, Tumor necrosis factor; TRADD, TNF receptor type-1-associated death domain; TRAF2, TNF receptor-associated factor 2 .
세포 사멸과 면역 반응의 관계 임기홍 Page 5 / 36
외재적 apoptosis는 death 수용체(TNF 수용체, Fas, Trail 수용체)에 각각의 ligand(TNFα, FasL,
Trail)가 결합하여 수용체를 활성화함으로써 촉발된다. 이때 수용체의 세포질 방향 말단에 여러
단백질이 모여 복합체를 형성하는데, 이로부터 세포의 생존과 사멸의 결정이 이루어진다. Complex
I이 형성되고 유지되면 세포가 생존과 염증 반응을 위한 유전자 발현 프로그램을 가동한다. Complex
I의 형성이 저해되거나 혹은 해체되면 complex II가 형성되고 이로부터 pro-caspase-8이
활성화됨으로써 apoptosis가 시작된다 (그림 2). Complex I의 형성과 유지는 구성체 단백질의
수식(modification)에 의하여 조절되는데, 특히 RIPK1의 ubiquitination이 핵심적인 역할을 한다.
흥미롭게도 complex I을 구성하는 단백질의 ubiquitination에 관련된 인간 유전자의 결실이 면역
질환의 원인이 된다는 직간접적인 증거들이 제시되었다. LUBAC 복합체는 E3 ubiquitin ligase로서
complex I의 형성에 필수적인데, LUBAC 복합체의 구성 요소인 HOIL-1의 결실은 치명적인 만성
자가면역 질환과 면역결핍을 일으킨다 [24]. Deubiquitinase인 A20와 A20의 adaptor 단백질인
ABIN-1의 유전자 변이도 면역 질환 발생과 밀접한 관련이 있음이 밝혀졌다 [227]. Complex I의
형성으로부터 NF-κB 활성화에 이르는 과정에서 결정적인 신호 전달자 역할을 하는 NEMO의 유전적
결실(deletion)은 일반적으로 면역결핍 증후군의 원인이 되는 것으로 알려져 있다 [171]. 그런데
이와는 다르게 NEMO는 NF-κB 경로 의존적으로 혹은 비의존적으로 세포 사멸을 억제할 수 있으며,
이런 메커니즘로 인하여 NEMO의 유전적 결실이 간경변과 간암(hepatocellular carcinoma)의 원인이
될 수 있음이 보고되었다 [5, 112, 127, 226].
2.1.2 PRR에 의한 apoptosis 유도
선천성 면역은 PRR이 병원체를 감지함으로써 촉발되는데 여러 종류의 집단으로 구성된 PRR
중에서 특히 Toll-like receptor(TLR)와 RIG-1 like receptor(RLR)가 apoptosis와 밀접한 관계에 있다.
PRR signaling과 그에 따르는 면역반응은 매우 크고 복잡한 주제로서 세포 사멸과의 상관관계를
설명하기 위한 간략한 설명과 그림만을 덧붙인다 [106, 135, 242] (그림 3). TLR이 apoptosis를
유발한다는 증거는 정상 세포나 생쥐에서 관찰되는 병원체 감염에 의한 apoptosis가 TLR이
결실되는 경우 관찰되지 않는다든지 혹은 TLR에 특이적으로 결합하는 리간드의 처리가 apoptosis를
촉발한다든지 등의 몇 가지 기초적인 개념의 실험으로 확인할 수 있었다. 이를 통하여 오랫동안
알려져 왔던 LPS (lipopolysaccharide)처리에 의한 apoptosis가 실제로 TLR-4에 의해 촉발된다는
사실이 확립되었고 다른 TLR에 의한 병원체 감지도 상황에 따라 apoptosis를 유발할 수 있음이
확인되었다 [12, 91, 189].
세포 사멸과 면역 반응의 관계 임기홍 Page 6 / 36 그림 3. TLR과 RLR의 신호 전달 경로. TLR은 선천성 면역세포에서 많이 발현되며 fibroblast, epithelial, 그리고
endothelial 세포에서도 발현된다. 세포막에 위치하는 TLR1,2,4,5,6는 homodimer 혹은 heterodimer를 형성하여 세균이나 효모, 곰팡이 등에서 유래하는 물질(소위 PAMPs, Pathogen-associated molecular patterns)을, 그리고 endosome에 위치하는 TLR3,7,9은 바이러스의 핵산을 감지한다. TLR에서 시작된 신호는 MyD88 혹은 TRIF 등의 신호 전달 분자를 거쳐 IRF나 NF-κB와 같은 전사 촉진 인자를 활성화하는데 이들 인자는 type-1 IFN(interferon)이나 TNF와 같은 염증 사이토카인의 유전자 발현을 유도한다. RIG-1과 MDA5 같은 RLR 계열의 수용체는 세포질 내에서 바이러스의 RNA를 감지하여 MAVS를 활성화하는데 이때 MAVS 분자는 서로 결합하여 미토콘드리아 막에 거대 분자 구조를 형성한다. 이 구조물에서 또 다시 시작된 신호 전달은 TANK/NEMO/TBK1/IKKε와 NEMO/IKKα/IKKβ을 거쳐 IRF와 NF-κB의 활성화에 이른다. IKK, IκB kinase; IRF, Interferon regulatory factor; MAVS, Mitochondrial antiviral-signaling protein; MDA5, Melanoma differentiation-associated protein 5; MyD88, Myeloid differentiation primary response 88; NEMO, NF-κB essential modulator; RLR, RIG-1 like receptor; TANK, TRAF family member-associated NF-κB activator; TBK1, TANK binding kinase 1; TLR, Toll-like receptor.
TLR 활성화에 따른 apoptosis의 유도에 관한 연구는 더욱 심화되어 TLR 세포 신호 전달계를
구성하는 단백질의 존재와 활성이 apoptosis에 필수적이라는 사실이 확인되었고 TLR 활성화에 따른
death 복합체 형성과 caspase의 활성화에 대한 메커니즘이 규명되었다. Poly (I:C)나 LPS 처리에 따른
apoptosis는 TRIF(Toll/IL-1R domain-containing adapter-inducing interferon-β; TLR-3와 -4의 핵심적인
신호 전달 단백질)의 과잉발현으로 증가하였고 TRIF의 결실에 의해서는 저해되었다 [91, 184].
TLR-3/-4의 활성화는 TRIF, FADD(Fas-associated protein with death domain), RIPK1(Receptor-interacting
protein kinase 1), pro-caspase-8으로 구성되는 death 복합체의 형성으로 이어지고, pro-caspase-8이
자가활성(autoactivation)됨으로써 apoptosis가 시작된다 [59, 124] (그림 4). 하지만 TLR에 의한
apoptosis는 TLR 신호 전달계에 의한 caspase-8의 직접적인 활성화에 의한 것일 뿐만 아니라
세포 사멸과 면역 반응의 관계 임기홍 Page 7 / 36
간접적인 효과일 수 있다. TLR 활성화에 의해 분비되는 TNF나 type-1 IFN(interferon)이
autocrine/paracrine의 방법으로 apoptosis를 촉발하거나 sensitize 할 수 있다 [85]. 또한 TLR
활성화에 수반되는 ROS 과량 생성, FasL의 발현, 내재적 apoptosis를 촉발하는 p53과 BAX의 과발현
등에 의하여 apoptosis가 일어날 수 도 있다 [2, 10, 162].
그림 4. TLR에 의한 apoptosis 유도. TLR3 혹은 TLR4는 강한 염증 반응을 유도하는데 apoptosis를 유발할
수도 있다. TNF 수용체 경로와 마찬가지로 RIPK1-FADD-8의 death 복합체를 통하여 pro-caspase-8을 활성함으로써 apoptosis를 유도하는데 cIAP(E3 ubiquitin ligase)가 이 경로의 중요한 조절기능을 한다. TLR의 활성화로 대량 분비된 TNFα가 TNF 수용체를 자극함으로써 apoptosis가 유도될 수도 있다.
RLR에 속하는 RIG-1이나 MDA5 단백질은 RNA 바이러스를 인식하여 염증 사이토카인과
항바이러스 단백질의 발현을 유도하는데 [135] (그림 3), 또 다른 한편 RIG-1과 IRF-3(RLR등에 의하여
활성화되는 전사 조절 인자)는 apoptosis를 유도하기도 한다 (소위 RLR-induced IRF-3-mediated
pathway of apoptosis). 한 연구진은 최근 일련의 논문을 통하여 RLR 경로에 의해 활성화된 IRF-3이
전사 촉진 기능과 별개로 BAX와 복합체를 이루어 미토콘드리아 의존적 apoptosis를 유도한다는
메커니즘을 규명하였다 [36-38].
2.1.3 Protective apoptosis에 대한 감염체의 저항 메커니즘
흥미로운 사실은 수많은 감염체(주로 바이러스와 세포 내 감염 세균)가 숙주세포의
apoptosis를 무력화하는 메커니즘을 보유한다는 점이다. 이 사실은 숙주세포 자살이 감염에
대항하는 중요한 방어적 수단임을 방증하기도 한다. 이에 관련한 몇 가지 예를 제시한다.
Legionella
세포 사멸과 면역 반응의 관계 임기홍 Page 8 / 36
pneumophila
나
Chlamydia trachomatis
는 BH3-only factor를 저해하는 메커니즘을 발동하여 내재적
apoptosis를 억제한다 [15, 66]. 또한 baculovirus와 Kaposi’s sarcoma associated herpesvirus는 각각
XIAP (X-linked inhibitor of apoptosis)와 v-FLIP(viral FLICE inhibitory protein)을 발현하여 apoptotic
caspase 를 저해한다 [22,49].
Rickettsia rickettsia, Coxiella burneltii, Chlamydia trachomatis
와 같은
세균 역시 증식을 계속하기 위하여 숙주세포의 apoptosis를 억제한다 [45, 62, 137]. 그러나 일부의
병원체는 오히려 세포 사멸을 조장하고 이용한다. Human immunodeficiency virus(HIV)는 T 림프구의
자살을,
Leishmania
나
Legionella
는 대식세포의 세포 사멸을 조장하는데 [3, 154, 180],
숙주세포에서의 성공적인 복제(replication) 후 세포로부터 탈출하거나 혹은 감염되지 않은 다른
세포를 감염하는 경로로 이용하는 것으로 보인다.
위에서 언급한 바와 같이 세포는 세포 내외로 바이러스 RNA와 DNA의 존재를 탐색하는데,
세포질에는 DNA를 감지하여 type 1 IFN 반응을 개시하는 cGAS/STING 신호 전달 경로가 DNA
바이러스에 대한 방어 전선을 구축하고 있다 [41]. 그런데, 미토콘드리아 DNA가 세포질로 유출되어
cGAS/STING을 자극함으로써 염증 반응을 촉발할 수 있음이 알려져 있으며, 내재적 apoptosis의
핵심인 MOMP가 미토콘드리아의 DNA를 유출하는 통로라는 사실이 최근 확인되었다 [138, 183,
236]. 이 현상은 caspase 저해를 통하여 복제를 유리하게 끌어가려는 바이러스에 대하여 척추동물이
고안한 맞대응의 전략이라고 생각된다.
2.1.4 면역세포에 의한 감염 세포의 apoptosis 유도
병원체에 감염된 숙주세포가 스스로 사멸하는 것을 선천성 면역에 속하는 일차
방어선이라고 한다면 「면역세포에 의한 감염 세포의 선택적 파괴」는 일차 방어선을 돌파하고
잠입한 적을 잡아 제거하는 이차 방어선이라 비유할 수 있다. 바이러스 감염과 종양에 대응하여
비슷한 방식으로 세포를 사멸하여 형제로 비유되는 Natural killer(NK) 세포와 cytotoxic T 림프구가
바로 이러한 중요한 임무를 맡고 있는 면역세포이다 [18, 207, 243]. 바이러스에 감염된 환자는 대개
감염 후 약 일주일 정도 되는 시기에 매우 격정적인 적응성 면역 반응(adaptive immune
response)을 겪는데 그것이 바로 바이러스에 감염된 숙주세포를 파괴하기 위해 감염 부위로
몰려드는 cytotoxic T 림프구이다. 이들은 세포 표면에 CD8 단백질을 달고 있는 CD8+ 림프구
계열의 세포로서 감염 조직 부근의 림프절에서 바이러스 항원을 제시하는 수지상세포에 의해
활성화되고 대량 증식한 후 감염 부위로 모여든다. 이들은 바이러스 감염 세포 표면의 MHC class
I에 실려있는 바이러스 항원을 감지하면 perforin을 분비하여 감염 세포 표면에 구멍을 내고
granzyme B를 세포 내부로 주입한다. Granzyme B는 감염 세포 내부의 caspase를 직접 활성화하고
또한 BH-3 only 단백질인 Bid를 활성화하는 등 다각적으로 apoptosis를 촉발함으로써 감염 세포를
효율적으로 사멸시킨다 (그림 5). 하지만 바이러스 혹은 종양 세포는 MHC class I의 발현을 억제하여
cytotoxic T 림프구의 공격을 회피하는 전략을 쓸 수 있다. 이에 대해 NK 세포는 비정상적으로 낮은
수준의 MHC class I을 발현하는 세포를 감지하여 cytotoxic T 림프구와 같은 방식으로 감염세포를
파괴한다.
세포 사멸과 면역 반응의 관계 임기홍 Page 9 / 36 그림 5. Cytotoxic T 림프구에 의한 세포의 파괴. 바이러스 감염 세포는 바이러스 항원을 MHC class I에 실어
세포막에 전시(presentation)한다. 바이러스 항원을 특이적으로 인식하는 TCR(T cell receptor)를 보유한 CD8+ T 림프구는 감염 세포와 시냅스를 형성한다. 시냅스에서는 림프구의 αLβ2(integrin의 일종)이 감염 세포의 ICAM-1에 결합하고 동시에 CD8 복합체가 MHC class I의 항원을 인식하고 활성화한다. TCR-CD3-CD8로부터의 신호는 림프구 granule의 exocytosis를 유도하는데, granule에 포함된 perforin은 감염 세포의 세포막에 pore를 형성하고 granzyme B는 pore를 통하여 감염된 세포 내부로 침투하여 apoptosis를 촉발한다.
2.1.5 Apoptotic 세포에 의한 기타 면역 조절 메커니즘
Apoptotic 세포는 주변 조직의 면역 환경을 직접 조절할 수 있는 여타의 메커니즘을 가지고
있다. Apoptotic T 림프구는 TGFβ를 분비하여 면역 억제적 조직 환경을 조성하며 [39], 인간
혈액에서 분리한 단핵구(monocyte)와 호중구(neutrophil)는 apoptosis 과정에서 IL38를 분비함으로써
대식세포를 면역 억제적 표현형으로 변화시킬 수 있다 [155]. 또 한편 apoptotic 호중구와 apoptotic
T 림프구는 CCR5 chemokine 수용체를 세포 표면에 발현하여 CCL3나 CCL5와 같은 chemokine을
포집하여 격리함으로써 조직의 염증 반응을 종료하는데 공헌한다 [13].
Apoptosis는 같은 조직에 위치한 다른 세포의 apoptosis를 유도할 수도 있다 (소위
apoptosis-induced apoptosis) [177]. 이 현상은 apoptotic 세포에서 분비되는 TNFα가 직접적인
apoptotic 자극을 받지 않은 세포의 apoptosis를 유도함에 의한 것으로 보인다. 개체발생에서
필요한 빠르고 동기화된 세포 사멸을 위한 메커니즘으로 생각되며, 동시에 퇴행성 신경 질환이나
심근경색 등에서 관찰되는 병리학적 세포 사멸의 원인일 수도 있을 것으로 추정하고 있다.
2.2 Necroptosis와 면역
세포 사멸과 면역 반응의 관계 임기홍 Page 10 / 36
thawing, 강산/강염기)에 의하여 일어나는 용혈을 동반한 제어되지 않는 세포의 죽음으로 정의할 수
있다. 또 다른 형태의 necrosis인 necroptosis는 apoptosis와 그 신호 전달계가 얽혀있는 계획된
죽음으로서, apoptosis와 달리 세포 사멸의 진행이 caspase에 의존하지 않으며 다량의 DAMPs
(damage-associated molecular patterns)를 유출하여 염증 반응이 동반되는 「프로그램에 의해
진행되는 능동적인 형태의 necrosis」이다 [31, 100, 133, 191, 198] (그림 1,2).
2.2.1 Necroptosis의 과정
Necroptosis의 최초 기술은 caspase를 저해한 상태에서 일어나는 TNF에 의한 용혈성 세포
사멸을 관찰한 것이다 [225]. 그 이후 많은 연구에 의해 necroptosis의 구체적인 분자생물학적
landscape이 밝혀졌다. TNF 수용체가 활성화하면 수용체의 세포질 방향 말단에 TRADD, RIPK-1, cIAP,
LUBAC, TAB2/3, NEMO, IKK, SPATA2-CYLD 등으로 구성되는 단백질 복합체 complex I이 형성되고
(그림 2), ubiquitination이나 인산화를 포함한 다양한 단백질 수식이 일어난다. 생존의 경로를
이탈하여 TNF 매개 세포 사멸이 촉발되는 시점은 complex I을 벗어난 RIPK1이 FADD,
pro-caspase-8과 함께 complex II를 형성하고, 이어서 pro-caspase-8이 caspase-8으로 활성화되면서부터이다
[216]. 이때 만약 caspase-8의 활성이 충분하지 못한 경우 apoptosis를 대체하는 죽음인
necroptosis로의 경로가 활성화한다.
Necroptosis의
경로는
necrosome
(RIPK1-RIPK3-MLKL)
형성으로부터
시작되는데,
necrosome의 형성은 RHIM(RIP homotypic interaction motif) 도메인 간의 친화력에 의거한 다수
분자의 RIPK1과 RIPK3의 결합에 의해 매개된다 [43, 153, 172, 245]. 이를 위해서 RIPK1과 RIPK3의
인산화(auto- or cross-phosphorylation)와 PELI1 E3 ubiquitin ligase에 의한 RIPK1의 ubiquitination이
필요한데 이러한 단백질 수식이 RIPK의 구조적 변화를 통해 RHIM 도메인의 노출을 유도하는
것으로 추정된다 [21, 231]. Necrosome에서 RIPK1은 RIPK3를 활성화하고 RIPK3는 다시 MLKL(mixed
lineage kinase-like)을 인산화한다. 인산화된 MLKL은 구조적 변화를 겪으며 세포막으로 이동하여
복합체를 형성한다. MLKL 복합체는 물분자와 이온의 세포막 간 이동을 허용하는 pore로 작용하여
결국 세포 전체의 삼투압적 용혈을 유발한다 [134, 230, 239].
RIPK3 결실 혹은 MLKL 결실 생쥐는 necroptosis의
in vivo
연구를 위한 중요한 유전학적
모델이다. RIPK3가 결실된 생쥐에서는 TNF 신호에 의한 necroptosis가 억제되었고, 급성췌장염에서
수반되는 necroptotic 세포 사멸도 제한적으로 관찰되었다 [86]. MLKL 결실 생쥐는 정상적으로
개체발생하였다 [238]. 그러나 RIPK3 결실의 경우와 마찬가지로 LPS와 caspase 저해제의 동시처리에
의한 necroptotic 세포 사멸에 분명한 결함이 있었고 급성췌장염을 유발하는 Cerulean의 처리에도
necroptosis가 억제되었다. 다만 RIPK3는 MLKL을 활성화하여 necroptosis을 유도하는 것 이외의
다양한 기능도 수행한다는 사실을 염두에 두고 RIPK3 결실에 의한 결과를 해석해야 한다 [124, 144,
167, 203]. 그 외에도 TNF 수용체 활성화에 따른 complex I을 형성하는 구성체(cIAP, CYLD, SPATA2,
A20 등)가 apoptosis/necroptosis를 아우르는 세포 사멸 경로에 필수적이라는 사실도 유전자 결실을
통한 생쥐 모델로서 증명되었다 [90, 160, 164, 170, 232].
세포 사멸과 면역 반응의 관계 임기홍 Page 11 / 36
TLR4는 TRIF 를 모집하고, RHIM을 보유한 TRIF는 RHIM 간의 친화력에 의거하여 RIPK3와 결합할 수
있는데 아직은 알려져 있지 않은 메커니즘에 의하여 RIPK3를 활성화하여 necroptosis를 유도한다
[43, 87, 102]. DAI(ZBP1)는 세포질에 존재하여 바이러스를 감지하는 선천성 면역 기구이다. DAI는
RHIM을 보유한 단백질로서 바이러스의 zDNA/RNA를 감지하면 RIPK3를 활성화하여 necroptosis를
유발한다 [139, 217].
2.2.2 Necroptosis의 생리적 기능과 병리적 기능
위에서 살펴보았듯이 apoptosis와 necroptosis는 상당한 신호 전달 과정을 서로 공유하며
병원체 복제에 이용당하고 있는 숙주세포를 파괴하는 동일한 목적을 위한 현상인데 굳이
apoptosis에 더하여 necroptosis가 존재하는 이유는 무엇일까? 가장 일반적으로 받아들여지는
가설은 「다수의 바이러스가 지속적 복제를 위하여 숙주세포의 caspase를 저해하는데 이에 대한
이차 방어적 세포 사멸」이라는 주장이다. Apoptosis는 하위의 다세포 생물에서도 발견되는 데
반하여 necroptosis는 척추동물 이상에서만 발견된다.
Necroptosis가 병원체 감염에 대한 방어 전략이라는 증거는 RIPK3 혹은 DAI가 결실된
생쥐를 통한 연구에서 확인되었는데 이들 돌연변이 생쥐는 정상적인 생쥐에 비하여 천연두
바이러스와 인플루엔자 바이러스 감염에 취약하였다 [43, 169, 217]. Necroptosis가 병원체의 공격에
대한 방어 수단이라는 증거는 necroptosis를 저해하는 바이러스의 존재에서 간접적으로 찾을 수도
있다. 생쥐를 감염시키는 cytomegalovirus(mCMV)는 내재적/외재적 apoptosis 를 모두 무력화하는데
이뿐만 아니라 necroptosis까지도 저해한다 [220-222]. RHIM 도메인을 보유한 바이러스 단백질
M45는 RHIM 간의 친화도에 의거하여 생성되는 RIPK1-RIPK3-MLKL 혹은 DAI-RIPK3-MLKL 복합체
형성을 간섭함으로써 necroptosis를 저해하는데, M45에서 RHIM을 제거하면 mCMV는 RIPK3를
발현하는 세포에서 증식하지 못하였다. Herpes 바이러스도 U39 바이러스 단백질을 발현하여 RHIM
단백질 간의 결합을 방해함으로써 necroptosis를 억제한다 [80]. 천연두 바이러스 역시 necroptosis를
무력화하는 메커니즘을 발동하는데, 바이러스 E3 단백질은 zRNA/DNA에 결합하는 능력을 가지고
있어서 DAI의 활동을 경쟁적으로 억제한다 [113].
그러나, 이러한 병원체에 대한 보호 기능에 반하여 necroptosis가 질병의 원인이라는 많은
증거도 존재한다. Necroptosis가 병리학적 원인이 되는 주된 이유 중 하나는 다량의 DAMPs를
유출하여 과도한 염증 반응을 유발한다는데 있다 [100, 191]. 정상 생쥐에 LPS 혹은 poly (I:C)와 함께
caspase저해제를 동시에 주입하는 경우 대식세포의 necroptosis가 유발되고 염증 사이토카인도 크게
증가하였다. 그러나 RIPK3 결실 생쥐에 같은 처리를 하는 경우 대식세포의 죽음과 사이토카인의
증가는 관찰되지 않았다 [87]. FADD나 caspase-8의 결실은 necrotic 세포 사멸을 유발하고 이로부터
DAMP의 유출로 인한 심각한 염증 반응이 일어나는데, 이들 유전자와 RIPK3를 동시에 결실시키면
세포 사멸과 염증 반응이 약화되었다 [26, 79, 235]. 결핵균은 대식세포의 숙주세포를 벗어나
확산하기위하여 necroptosis를 이용하며 [212],
Staphylococcus aureus
감염에 의한 폐손상의
원인으로 necroptosis가 지목되었다 [110]. Cerulein 처리에 의해 유도되는 췌장염은 인간
급성췌장염의 생쥐 모델로 많이 쓰이는데 수반되는 세포 사멸이 necroptosis임이 MLKL 결실 생쥐를
세포 사멸과 면역 반응의 관계 임기홍 Page 12 / 36
이용하여 증명되었고 [238], RIPK1-RIPK3-MLKL에 의한 necroptosis가 수컷 생쥐 생식기관의 노화를
불러일으키는 메커니즘임이 확인되기도 하였다 [129]. 생쥐 모델뿐 아니라 실제 인간에 있어서
necroptosis가 질병의 원인일 수 있음을 보고하는 연구도 있다. Crohn병 환자의 말단 회장(terminal
ileum) 시료에서 necroptosis의 병리적 소견이 발견되었는데 특히 Paneth 세포에서 RIPK3의 발현이
높았다 [79]. A20는 necroptosis의 중요한 조절자인데 [250], A20 유전자 이상은 여러
면역질환(Crohn병, 류마티스관절염, SLE−Systemic lupus erythematosus)이 발병하기 쉬운 유전적
소인으로 추측되었고 Crohn병 환자의 시료에서 A20 단백질이 제대로 발현되지 않는 사실도
확인되었다. 실제로 생쥐에서 A20을 결실하면 SLE와 유사한 병리 현상이 유발됨을 확인하였다 [14,
55, 227]. Optineurin (OPTN)은 complex I에 모집되어 NF-κB로의 신호 전달을 촉진하고 RIPK1에
의한 세포 사멸을 억제하는 기능을 하는데, OPTN의 기능적 결실은 운동 신경 세포(motor neuron)의
necroptosis를 유발하여 치명적인 유전병인 sporadic amyotrophic lateral sclerosis(ALS)의 원인이
된다 [93, 206].
2.3 Pyroptosis와 면역
Pyroptosis는 위에서 언급한 두 가지 세포의 죽음과 비교하여 더욱 강력한 염증 반응을
수반하는 세포 사멸이다. Inflammasome의 활성화에 의하여 IL1β과 IL18이 생성(maturation)되고
gasdermin D (GSDMD)에 의해 매개되는 세포 용혈로 인하여 DAMPs가 유출된다. Necroptosis와는
달리 caspase의 작용이 필수적인데 병원체를 감지하여 형성된 inflammasome이 caspase를
활성화한다 (그림 6). Pyroptosis 역시 다른 세포 사멸과 마찬가지로 「세포 내에서 증식하는
감염체의 복제 공간 제거」가 주요 목적인데 다른 세포의 죽음과 가장 다른 점은 죽음의 과정에서
사이토카인이 능동적으로 생성/분비되어 조직 혹은 전신 염증을 유도한다는 점이며 따라서
병원체에 대한 보다 적극적인 방어 전략이라고 생각할 수 있다 [6, 96, 143, 201, 208].
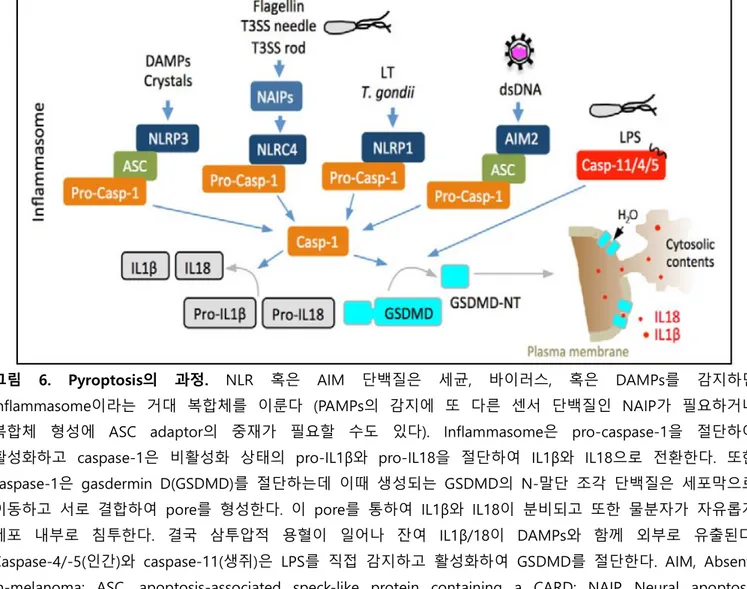
2.3.1 Pyroptosis의 과정
NAIP 단백질은 병원성 세균에서 유래하는 특징적인 단백질인 flagella, T3SS (type III
secretion system) rod, T3SS needle을 감지하고 NLRC4 inflammasome 형성을 유도한다. AIM2 (IFI16)
단백질은 바이러스나 박테리아의 DNA를 감지하여, 그리고 NLRP3는 DAMPs를 감지하여 ASC
adaptor와 함께 inflammasome을 형성한다. NLRP1 inflammasome은
Bacillus anthracis
혹은
Toxoplasma gondii
를 인식하여 형성된다 (그림 6). 이렇게 형성된 inflammasome은 pro-caspase-1을
활성화하는데 caspase-1은 첫째로 pro-IL1β와 pro-IL18을 절단하여 matured IL1β와 IL18을 생성하고,
둘째로 GSDMD를 절단하여 GSDMD N-말단 조각 단백질에 의한 세포 용혈을 유도한다 [161].
특이하게도 caspase-11(인간의 경우는 caspase-4/-5)은 LPS를 직접 감지하고 활성화되어 GSDMD을
절단함으로써 pyroptosis를 유발한다 [81, 107]. 세포질에 존재하는 AIM2 inflammasome이나
caspase-11은 vacuole에서 증식하는 박테리아의 LPS나 DNA도 감지하여 pyroptosis를 유발하는데
이는 vacuole속의 내용물을 세포질로 유출하는 기구의 작용 때문이다. GBPs (65-kDa
guanylate-세포 사멸과 면역 반응의 관계 임기홍 Page 13 / 36
binding proteins)는 병원체를 포함하는 vacuole을 분해하여 박테리아와 LPS가 세포질로 흘러들도록
하고 [150], 세포질에 노출된 박테리아는 IRGB1(immunity-related GTPase family member b10)에
의하여 더욱 분해되어 AIM2와 caspase-11이 LPS와 박테리아 DNA를 쉽게 감지하도록 돕는다 [142].
그림 6. Pyroptosis의 과정. NLR 혹은 AIM 단백질은 세균, 바이러스, 혹은 DAMPs를 감지하면
inflammasome이라는 거대 복합체를 이룬다 (PAMPs의 감지에 또 다른 센서 단백질인 NAIP가 필요하거나 복합체 형성에 ASC adaptor의 중재가 필요할 수도 있다). Inflammasome은 pro-caspase-1을 절단하여 활성화하고 caspase-1은 비활성화 상태의 pro-IL1β와 pro-IL18을 절단하여 IL1β와 IL18으로 전환한다. 또한 caspase-1은 gasdermin D(GSDMD)를 절단하는데 이때 생성되는 GSDMD의 N-말단 조각 단백질은 세포막으로 이동하고 서로 결합하여 pore를 형성한다. 이 pore를 통하여 IL1β와 IL18이 분비되고 또한 물분자가 자유롭게 세포 내부로 침투한다. 결국 삼투압적 용혈이 일어나 잔여 IL1β/18이 DAMPs와 함께 외부로 유출된다. Caspase-4/-5(인간)와 caspase-11(생쥐)은 LPS를 직접 감지하고 활성화하여 GSDMD를 절단한다. AIM, Absent-in-melanoma; ASC, apoptosis-associated speck-like protein containing a CARD; NAIP, Neural apoptosis inhibitory protein; NLR, Nucleotide-binding and oligomerization domain (NOD)-like receptor.
Pyroptosis 과정에서 병원균이 어떻게 처리/제거되는지에 대한 메커니즘도 규명되었다.
Pyroptotic 세포에서 유리된 감염균은 호중구에 의하여 포식되고 호중구 내부에서 활성 산소 등에
의해 분해된다 [151]. 그러나 또 다른 연구는 pyroptotic 세포의 세균은 외부로 유리되지 않고
pyroptotic 세포에 붙잡혀 있다가 (소위 pore-induced intracellular trap) 호중구 등에 의해 세포
부스러기와 함께 처리/제거될 수 있음을 증명하기도 하였다 [97].
Pyroptosis와 관련된
in vivo
연구에서의 어려움은 IL1β/IL18에 의한 영향과 세포 죽음에 의한
영향을 명확하게 구분할 수 없다는 점이다. GSDMD pore는 세포 용혈뿐 아니라 사이토카인의
분비도 담당하므로 GSDMD 결실 생쥐를 이용한 pyrotosis의 연구는 이점에서 한계가 있다. 그래서
자주 쓰여 온 방법은 caspase-1 결실 생쥐와 IL1β, IL18 이중결실 생쥐를 비교하거나 caspase-11
결실 생쥐를 이용하는 것이다. 그런데 IL1β/IL18 maturation에 관여하지 않는 것으로 알려진
세포 사멸과 면역 반응의 관계 임기홍 Page 14 / 36
caspase-11도 간접적으로 NLRP3 inflammasome을 활성화함으로써 IL1β/IL18 분비를 유도한다는
사실이 확인됨에 따라 caspase-11 유전자 결실 생쥐를 통한 연구 결과는 정확히 해석하기 더욱
힘들어졌다 [108, 185]. 더욱이 GSDMD의 작용이 필요 없는 secondary pyroptosis의 존재도
확인되었는데, 이 새로운 세포 용혈 방식의 메커니즘과 구체적인 생리적 기능은 아직 밝혀지지
않았다 [193].
2.3.2 Pyroptosis의 생리적 기능과 병리적 기능
S. Typhimurium
과
L. monocytogens
은 숙주세포에 침입하면 flagellin 발현을 억제하는데,
flagellin을 상시 발현(constitutive expression)하도록 변형된
S. Typhimurium
과
L. monocytogens
은
생쥐 모델에서 정상적인 세균보다 더욱 쉽게 제거되었다. 이들 세균의 제거는 NLRC4
inflammasome의 작용에 의한 결과인데 흥미롭게도 이들 세균에 대항하는 능력에 있어서 IL1β, IL18
이중결실 생쥐는 정상 생쥐와 차이가 없었다. 따라서 flagellin을 감지하여 병원체를 제거하는
inflammasome의 효과는 사이토카인의 분비보다는 pyroptosis와 관련이 있었다 [151, 192].
Francisella tularensis
는 대식세포의 세포질에서 증식하는 병원성 세균인데,
Francisella
의 침투에 대해
정상 대식세포는 사멸하나 caspase-1이 결실된 대식세포는 사멸하지 않았다. 정상적인 생쥐에
비하여 Asc나 caspase-1 결실 생쥐는
Francisella
에 더욱 취약하였는데, IL1β과 IL-18 사이토카인을
결핍시킨 생쥐는 Asc, caspase-1 결실 생쥐에 비하여 비교적
Francisella
감염에 잘 견디었다 [145].
Chromobacterium violaceum
이 비장이나 간을 감염하면 이에 대항하여
NLRC4−caspase-1−pyroptosis경로가 중요한 역할을 한다는 사실이 다양한 유전자 결실 생쥐 모델을 이용하여
증명되었다 [141]. 수족구병(hand-foot-mouth disease)을 일으키는 바이러스인 Enterovirus 71은
GSDMD를 절단하여 불활성화함으로써 pyroptosis를 억제하고 자신의 복제를 유도한다는 사실이
최근 밝혀졌다 [128].
Salmonella enterocolitis
과
Salmonella Typhimurium
은 생쥐 내장의 상피세포를
감염하는데 이에 대해 상피세포가 사멸함으로써 세균의 증식과 확산을 억제하였다. 이 현상은
caspase-11 혹은 NLRC4에 의하여 매개됨이 확인되었으며 IL1β/18 생성보다는 pyroptosis와 관련된
것으로 추정되었다 [111, 196]. 따라서 이와 같은 결과는 pyroptosis가 일부 감염체의 성공적인
제거에 필수적임을 증명한다.
IFN 수용체로부터의 신호 전달은 병원체 감염에 대한 가장 중요한 방어 메커니즘 중의
하나이다. 그런데 IFN 수용체 신호가 세포의 pyroptosis를 촉진하는 역할을 한다는 사실이
확인되었다. IFN 신호 전달에 의해 발현이 유도되는 유전자 중에는 pyroptosis에 관여하는 여러
유전자(예를 들어 caspase-11, GBPs, IRGB10등)가 포함된다. 숙주세포의 세포질에서 증식하는
Burkholeria thailandensis
의 감염 모델에서 caspase-11에 의존적인 pyroptosis가 효율적으로
일어나기 위해서는 IFNγ에 의한 priming이 중요함이 확인되었고,
Francisella novicida
에 대항하는
AIM2 inflammasome−pyroptosis 경로의 효율적인 유도를 위해서도 type-1 IFN 신호가 중요함이
밝혀졌다 [1, 95, 211].
패혈증(sepsis)은 세균 감염이 전신에 걸친 과도한 염증 반응으로 이어지고 이로 인해
나타나는 병리적 현상인데, 미국 CDC(Centers for Disease Control and Prevention)에 의하면
세포 사멸과 면역 반응의 관계 임기홍 Page 15 / 36
미국에서만 매년 150만 명의 환자가 발생하고 그 중에 25만 명이 죽음에 이를 정도로 암, 심혈관,
뇌혈관
질환에
버금가는
사회적
부담이
큰
질병이다
(Website
of
CDC,
https://www.cdc.gov/sepsis/index.html). 그런데 pyroptosis가 패혈증의 주요 병리 현상 유발원으로
의심받고 있다. Caspase-11이나 GSDMD가 결실된 생쥐는 LPS로 유도되는 패혈증(endotoxemia)에
강한 저항성을 보인다 [81, 108, 200]. Endotoxemia에 의한 폐손상의 주요 원인이 caspase-11이
매개하는 endothelial cell의 pyroptosis 때문일 수 있음이 밝혀졌다 [42]. 인간의 caspase-4는 생쥐의
caspase-11이 감지하지 못하는 under-acylated LPS와 이런 종류의 LPS를 많이 가지고 있는
Francisella
세균에 반응하여 염증 반응을 유발한다는 사실이 확인되었는데 생쥐에 비해 인간이 LPS
매개 패혈증에 보다 민감한 이유를 설명할 수도 있는 결과이다 [121]. HIV-1은 CD4+ T 림프구가
림프절에서 pyroptosis로 죽게 함으로써 HIV의 세포 간 전파를 도모한다 [154]. 이외에도
pyroptosis가 인간 질병에 관련됨을 암시하는 많은 증거가 존재한다 [56, 61, 68].
2.4 Apoptosis, Necroptosis, Pyroptosis, Innate signaling의 Crosstalk
위에서 언급했듯이 숙주는 병원체를 제거하기 위해 계획된 세포 사멸을 고안해 내었고
병원체는 그 사멸을 저해하거나 혹은 유리하게 이용하는 방법을 만들었으며 또 다시 숙주는 다른
형태의 세포 사멸을 찾아 내었다. 결국 고등 동물은 세포 사멸과 선천성 면역 과정을 서로
유기적으로 엮어 병원체와의 전쟁을 위한 고도의 전략을 창출하였다 (그림 7).
Necroptosis는 apoptosis에 문제가 생겼을 때 이를 보완하는 Guard 메커니즘(혹은 백업
메커니즘)이다. Caspase를 억제하는 능력을 가지는 바이러스의 감염으로 apoptosis가 작동하지
않을때 caspase 없이 작동하는 또 다른 사멸 현상인 necroptosis가 이를 보완한다. Caspase-8 결실
생쥐는 배아 발생 단계에서 죽는데 RIPK3나 MLKL를 동시에 결실하는 경우 발생과정을 완결하고
살아남았다. 이들 연구는 necroptosis가 apoptosis의 백업 메커니즘임을 증명한다 [11, 101].
흥미롭게도 RIPK3가 저해되면 necroptosis 경로가 저해될 뿐 아니라 대신 apoptotic 경로가
활성화될 수 있다는 증거도 제시되었다 [51, 102, 144, 159, 166, 181]. 즉, necroptosis와 apoptosis는
서로가 서로의 백업 메커니즘이다.
위에서 언급했듯이 내재적 apoptosis가 caspase의 불능으로 더 이상 진행되지 않는 경우
MOMP를 통하여 미토콘드리아 DNA가 세포질로 유출되어 cGAS/STING 경로를 자극할 수 있다.
내재적 apoptosis를 작동하여 바이러스 증식과 확산을 멈추려는 숙주세포에 대항하여 일부
바이러스는 caspase를 저해함으로써 apoptosis를 멈추게 할 수 있다. 그러나 바이러스는 대신
MOMP−cGAS/STING 경로를 활성화하게 되고 그 결과 IFN에 의한 강력한 항바이러스 면역에
직면할 수 있다. cGAS/STING은 apoptosis의 Guard 메커니즘이다. 이와는 반대 방향으로서 염증
사이토카인 생성에 의한 항바이러스 면역에 대한 Guard 메커니즘으로 apoptosis가 발동할 수도
있다 [36-38].
세포 사멸과 면역 반응의 관계 임기홍 Page 16 / 36 그림 7. Crosstalk of cell death pathways and innate immune pathways. 검정색 줄, Guard/백업 메커니즘;
파란색 줄, 경로진행; 빨간색 줄, 경로저해.
외재적 apoptosis의 실질적 개시는 caspase-8의 활성화이다. 그런데 caspase-8의 작용은
이에 그치지 않는다. 우선 활성화된 caspase-8은 necroptosis를 억제하여 apoptosis 주도의 세포
사멸이 지속되도록 한다. 그 메커니즘은 caspase-8이 RIPK1과 RIPK3를 절단하여 불활성화함에 의한
것으로 추정된다 [130]. Caspase-8은 TNF 수용체나 TLR의 활성화에 따른 염증 사이토카인 유전자의
전사 활성화에도 관여한다 [213]. 그 메커니즘은 caspase-8의 protease 효소 활성과는 관계없이
RIPK1-cIAP-TRAF2-NEMO 등으로 구성되는 FADDosome 형성에 scaffold의 역할을 하거나 [89],
caspase-8이 자신과 결합하는 단백질인 cFLIP을 절단하고 절단된 cFLIP이 전사 활성화를 위한 신호
전달계에 공헌하는 방식으로 추정된다 [74, 105]. 또한 caspase-8은 TLR, TNF 수용체, C-type lectin
등 inflammasome 활성화와 관련이 없는 신호 경로에 반응하여 직접 pro-IL1β/IL18의 maturation을
수행하고 NLRP3 inflammasome도 활성화할 수 있다 [28, 71, 157, 240]. 이 결과는 caspase-8이
inflammasome의 Guard 메커니즘임을 제시하는데, 즉 caspase-8은 apoptosis를 매개할 뿐만 아니라
염증 반응 발현에 공헌하는 등 다층적인 기능의 수행자이다.
Inflammasome은 caspase-1의 활성화를 통하여 세포를 사멸(Pyroptosis)에 이르게 하는데
만약 caspase-1이 불활성화 되어 있는 경우, 대신 caspase-8이 Asc와 복합체를 이룸으로써
활성화되어 apoptosis를 유도할 수 있다 [178, 188]. 그런데 caspase-8이 관여하는 또 다른
pyroptosis가 존재할 수 있음이 보고되기도 하였다. GSDMD가 결실된 세포에서도 inflammasome에
의한 pyroptosis가 유도될 수 있는데, 자극 후 세포 사멸 개시까지 시간이 걸리며 caspase-1이 아닌
caspase-8에 의하여 매개됨이 확인되었다. 이 세포 사멸은 apoptosis에서 보이는 특징이 관찰되지
세포 사멸과 면역 반응의 관계 임기홍 Page 17 / 36
않았으므로 secondary pyroptosis로 정의되었다 [193]. Apoptosis와 secondary pyroptosis는 GSDMD
매개 primary pyroptosis에 대한 백업 메커니즘으로 작용할 수 있다.
또한 염증 반응과 세포 사멸, 혹은 상이한 세포 사멸 사이에는 선순환적 연결고리도
존재한다. 물론 necroptosis나 pyroptosis에서 유래하는 다량의 DAMPs에 의한 염증 반응은 대표적인
예이다. 그러나 다른 측면에서의 연결 고리도 존재한다. 대체적으로 NLRP3나 caspase-11 단백질은
평상시 낮은 수준으로 존재하는데 사이토카인 수용체나 TLR의 자극에 따라 그 유전자의 전사
활성화가 일어나 단백질 농도가 급격히 증가한다. 즉 NLRP3 inflammasome이나 caspase-11 매개
pyroptosis는 효율적인 작동을 위해서 염증 신호 경로에 의한 priming이 필요하다 [1, 81].
Caspase-11에 의한 non-canonical inflammasome은 pro-IL1β/18 maturation에 관여하지 않는다. 그러나,
caspase-11에 의해 형성된 GSDMD pore는 세포 내 칼륨 소실을 유발하고 이에 반응하여 아직은
확실히 알려지지 않은 메커니즘을 통하여 NLRP3 inflammasome이 형성되어 IL1β와 IL18이
생성된다는 사실이 확인되었다 [185]. 즉, non-canonical inflammasome은 GSDMD에 의한 세포
용혈을 매개로 canonical inflammasome과 연결되어 있다. 마찬가지로, 활성화된 MLKL은 NLRP3
inflammasome 형성을 유도한다 [47]. Necroptosis와 Inflammasome 매개 염증 반응도 연결되어
있는 것이다.
RIPK1과 RIPK3는 apoptosis/necroptosis 세포 사멸 이외의 방법으로도 면역 반응을 끌어낸다.
앞서 언급하였듯이 RIPK1은 NF-κB 경로의 활성화에 필수적으로 관여한다 (그림 2). 이때 RIPK1은
인산화 효소로서의 역할 대신 복합체 형성의 scaffold로서 작용한다. RIPK1과 RIPK3는 TLR4
활성화에 따라 기존의 TLR 신호 경로도 아니고 세포 사멸 경로도 아닌 새로운 방법으로 염증
반응을 촉발할 수 있음이 확인되었다 [164]. TLR4에 의해 모집된 TRIF는 RIPK1/3 복합체 형성을
유도하고 이 복합체는 다시 Erk1/2를 활성화함으로써 사이토카인 유전자의 전사를 촉진하는데,
이때는 RIPK1의 인산화 효소 활성이 필수적이었다. West Nile 바이러스 감염에 대하여 RIPK1과
RIPK3는 뇌세포의 염증성 chemokine 발현을 유도함으로써 바이러스 퇴치에 공헌하는데 역시
RIPK의 인산화 효소 기능이 중요하였다 [50]. RIPK3는 RLR 경로의 신호 전달자인 MAVS와
상호작용함으로써 necroptosis와는 관련 없는 경로를 통하여 type-1 IFN 생성을 촉발할 수 있다 [52].
2.5 Efferocytosis와 면역
개체발생과 조직 항상성 유지, 그리고 병원체에 대한 방어 수단으로서 계획된 세포 사멸은
다세포 생물에게 필수적인 현상이다. 그런데 세포 사멸에 이어 또 하나 남아있는 매우 중요한
과정이 있는데, 바로 사멸된 세포의 제거(Efferocytosis) 과정이다. Efferocytosis는 면역계에 중대한
영향을 미치는데, 사멸의 양상과 포식세포의 종류에 따라 염증 유발적인지 아닌지 그리고 면역
관용적인지 면역 유발적인지의 서로 다른 면역학적 결정이 이루어진다. 불완전한 사멸 세포 제거와
이에 따른 사멸 세포의 축적은 염증성 질병과 자가면역 질환의 원인이 된다 [17, 58, 77, 98, 163, 179,
219].
2.5.1 Efferocytosis의 과정
세포 사멸과 면역 반응의 관계 임기홍 Page 18 / 36
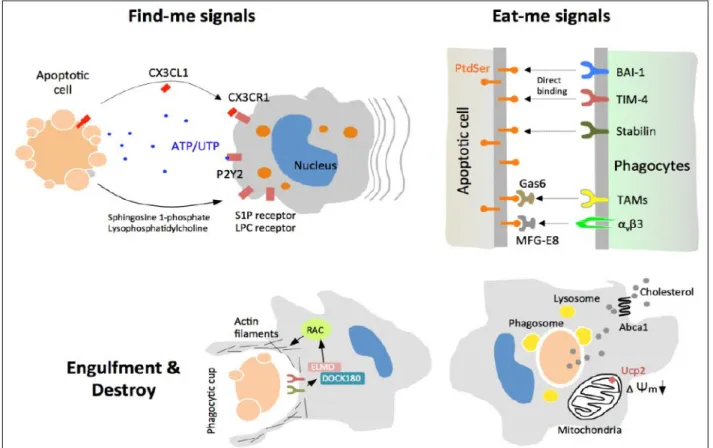
• 사멸 세포의 인지
면역세포는 자아(self)와 비자아(non-self)를 구별하듯이 살아있는 건강한 세포와 죽어가는
세포를 구분한다. 이 과정은 원거리에 있는 포식세포가 사멸 세포의 근방으로 찾아가는 첫 번째
단계와 직접 접촉하여 사멸 세포인지를 확인하는 두 번째 단계로 구성되어있다 (그림 8). Apoptotic
세포는
죽음의
과정에서
포식세포를
유인하는
물질(find-me-signals)을
분비하는데,
lysophosphatidylcholin(LPC), sphingosine-1-phosphate(S1P), CX3CL1, nucleotide(ATP or UTP) 등이
확인되었으며 이들의 분비는 caspase 활성화와 연관되어있다. 예를 들어 apoptotic 세포에서
ATP/UTP는 pannexin-1 채널을 통하여 유출되는데 caspase가 pannexin-1의 일부를 절단하면 채널이
개방된다 [40]. 이들 유인 물질을 따라 위에 언급한 물질에 대한 수용체(LPC 수용체, S1P수용체,
CX3CR1, P2Y2)를 보유한 대식세포가 사멸 세포에 접근할 수 있다.
그림 8. Efferocytosis의 과정. Apoptotic 세포는 CX3CL1, nucleotide, S1P 등의 세포 유인
물질(find-me-signals)을 분비하여 포식세포를 자신에게 불러들인다. 이어 포식세포는 apoptotic 세포 표면에 드러난 eat-me-signal인 PtdSer을 PtdSer 수용체를 통하여 인지하고 결합한다. 활성화된 PtdSer 수용체로부터의 신호는 ELMO/DOCK180−Rac 경로를 통해 actin 사슬 형성을 촉진함으로써 사멸 세포의 포식을 유도한다. 포식된 세포를 포함한 phagosome은 lysosome과 융합함으로써 내용물을 분해하는데 동시에 이로 인하여 유발되는 대사 스트레스를 해소하는 메커니즘을 발동한다. Abca1, ATP-binding cassette transporter 1; BAI-1, Brain-specific angiogenesis inhibitor 1; DOCK, Dedicator of cytokinesis; ELMO, Engulfment and cell motility; Gas6, growth-arrest-specific 6; MFG-E8, Milk fat globule-EGF factor 8; P2Y2, Purinergic 2Y receptor 2; TAM, Tyro3, Axl, MerTK; TIM-4, T cell/transmembrane, immunoglobulin, and mucin 4; Ucp2, Uncoupling protein 2.
세포 사멸과 면역 반응의 관계 임기홍 Page 19 / 36
PtdSer(phosphatidylserine)은 가장 대표적인 사멸 세포의 표식이다(eat-me-signal). Fadok과
Krahling 등의 연구자들은 PtdSer을 보유한 리포좀과 PtdSer에 결합하는 Annexin V 단백질이
대식세포의 사멸 세포 포식을 방해한다는 결과를 얻음으로써 PtdSer이 사멸 세포의 제거에
결정적인 인자임을 처음으로 밝혔다 [60, 118]. 정상 세포의 이중 세포막은 외막(outer leaflet)과
내막(inner leaflet)의 지질 성분이 다른데, 이는 비대칭성을 유지하는 효소(flippase: 지질 분자를
외막에서 내막으로 이동, floppase: 내막에서 외막으로 이동, scramblase: 외막과 내막 지질분자를
뒤섞음)들의 상호 작용에 의거한다. 활성화된 caspase-3와 -7은 ATPase11C(flippase)를 절단하여
불활성화하고 반대로 XKR8(scramblase)을 절단하여 활성화함으로써 내막에 제한적으로 존재하던
PtdSer을 외막에 노출시킨다 [195, 214, 215].
• 사멸 세포의 포식
포식세포는 PtdSer에 특이적으로 결합하는 다양한 수용체를 발현하는데, PtdSer를 인지하는
방법은 두 가지가 있다. 첫째, 포식세포는 PtdSer에 직접 결합하는 수용체(BAI-1, TIM-4, Stabilin-2)를
통하여 사멸 세포에 접촉할 수 있다. 둘째, Gas6, MFG-E8(Milk fat globulin-E8) 등의 수용성 단백질이
PtdSer에 먼저 결합하고 포식세포는 다시 이 단백질에 결합함으로써 사멸 세포에 접촉할 수 있다.
대식세포에서 많이 발현되는 TAM family(Tyro3, Axl, MerTK) 수용체는 Gas6와, αvβ3(integrin의
일종)는 MFG-E8과 결합한다. PtdSer 수용체가 리간드와 결합하면 일련의 세포 신호 전달계가
활성화되어 사멸 세포의 포식이 진행된다. 예를 들어 TAM family 단백질이 리간드에 결합하면
세포질 방향에 위치한 tyrosine kinase가 활성화되고 결과적으로 ELMO/Dock180(ELMO: Engulfment
and cell motility, Rac GEF(Rac guanine exchange factor)의 일종; DOCK180, Dedicator of cytokinesis
180)가 모집되어 활성화된다 [57]. 다시 ELMO는 cytoskeleton 재배열에 핵심적인 역할을 하는 Rac
단백질을 활성화한다. Rac은 국부적인 actin 사슬 형성(polymerization)을 유도하는데, 이를 통하여
사멸 세포와의 접촉면에 phagocytic cup을 형성함으로써 포식세포가 사멸 세포를 세포 내부로 집어
삼킨다. Rac은 GTP 혹은 GDP와 결합하는 Rho family GTPase의 한 종류인데, ELMO는 Rac의 GDP를
GTP로 치환하여 Rac을 활성화한다.
사멸 세포가 인지/포식되는 분자적 진행 과정은 수용체의 종류에 따라 다르다. 예를 들어
조직 상주(tissue resident) 대식세포에서 많이 발현되는 TIM-4의 경우 PtdSer에 강하게 결합하지만
세포 내부로 신호를 전달하는 기능이 없다. 따라서 TIM-4는 신호를 전달할 수 있는 BAI-1이나
MerTK와 공조할 때만 효율적인 efferocytosis를 수행할 수 있다 (소위 tether and tickle; tethered by
TIM-4 and tickled by MerTK) [147, 218]. 그러나 MerTK는 그 자신이 tether와 tickle 모든 과정을 다
수행할 수 있기도 하다 [58]. Stabilin-2는 다른 수용체와 다르게 ELMO 대신 GULF를 신호 전달자로
모집하고 활성화한다 [175].
노출된 PtdSer은 건강한 세포와 제거될 세포를 구분 짓는 결정적인 표식이지만, 이런 구분은
매우 정밀하게 이루어져야 한다. 따라서 이를 보완하는 또 하나의 장치가 있는데 건강한 세포
표면에 존재하는 Don’t-eat-me 분자이다. 이 부류에 속하는 CD47은 포식세포의 SIRP1a를
자극하는데 SIRP1a는 다시 SHIP-1/-2를 활성화한다. SHIP-1/-2는 탈인산화 효소로서 세포막
세포 사멸과 면역 반응의 관계 임기홍 Page 20 / 36
인근에서 일어나는 인산화에 의해 매개되는 신호 전달을 저해하여 포식이 일어나지 않도록 한다
[16].
Efferocytosis의 최종 단계는 포식한 세포의 분해이다. 포식된 세포를 담고 있는
phagosome은 lysozome과 융합하고 lysozome에 포함된 각종 분해 효소가 작용하여 세포를
분해한다. 분해된 물질은 포식세포가 이용할 수 있으나, 너무 많은 양의 세포 분해 물질은 대사
스트레스(metabolic stress)로 작용하므로 대식세포는 잉여의 대사물(metabolite)을 해소하기 위한
전략을 보유하고 있다. 예를 들어 대식세포는 지질 과잉에 대한 대응 메커니즘을 발동한다.
Efferocytosis는 대식세포의 nuclear factor family(LXRα/β, PPARγ 등의 전사 촉진 단백질)를
증가시키는데 이들은 특히 지질의 대사에 핵심적인 역할을 한다. 그 하나의 결과로써 콜레스테롤의
세포막 채널인 Abca1 단백질이 증가하고 Abca1은 흡수된 콜레스테롤을 세포 외부로 배출하여
콜레스테롤 과잉을 해소한다 [82, 109]. 또한 사멸 세포를 포식한 대식세포는 미토콘드리아 내막에
위치하여 membrane potential을 감소시키는 uncoupling 단백질인 UCP2를 발현하는데, UCP2 결실은
대식세포의 efferocytosis를 크게 저해하였다 [174]. 대식세포는 포식된 세포의 소화로 인한 과잉의
에너지를 UCP2를 통하여 소멸함으로써 대사 스트레스를 해소하고 다수의 사멸 세포를 포식할 수
있다.
2.5.2 Efferocytosis의 면역 조절
• Efferocytosis의 면역세포 조절
Find-me-signal은 포식세포의 유인만이 아니라 포식세포의 질적인 변화도 유도한다. 분비된
nucleotide는 nucleoside로 분해될 수 있는데 adenosine은 대식세포의 수용체(A2a/A2b adenosine
receptor)에 결합하여 CXCL1, CXCL2와 같은 호중구 유인 물질의 발현을 억제하고 대신 염증
해소(resolution)에 관련된 조절 물질 생성을 촉진한다 [233, 234]. 마찬 가지로 S1P는 S1P 수용체를
자극하여 포식세포의 염증 유도 물질 발현을 억제하고 항염증 물질(IL10, VEGF, PGE2) 생성을
촉진한다 [233, 234]
PtdSer 수용체로부터의 신호는 포식세포의 성질을 극적으로 변화시킨다. BAI-1이 결실된
생쥐에서는 장 염증과 조직 손상이 관찰되는데, 대식세포 혹은 장 내피유래 세포 특이적으로
BAI-1을 결실시키는 경우 이들 세포는 많은 양의 염증 물질(TNF, IL1, IL6)을 분비하였다 [125]. TAM
family에 속하는 Axl과 MerTK는 수지상세포와 대식세포에서 많이 발현되는데 생쥐에서 이들
단백질을 결실하면 apoptotic세포가 제거되지 않고 축적되며 동시에 염증 반응이 크게 증가하였다
[186, 194]. 대식세포가 조직 손상을 수리하는 표현형으로 전환하기 위해서는 IL4/13과 같은
사이토카인 뿐 아니라 MerTK와 Axl의 활성화가 필수적임이 확인되었다 [29]. 또한 TAM 수용체가
수지상세포의 TNF 발현과 type-I IFN 신호 전달 과정을 억제한다는 사실도 밝혀졌다 [186, 197].
위에서 언급했듯이 efferocytosis는 포식세포의 대사에 커다란 변화를 불러일으키는데 이때
이런 대사체 변화를 감지하는 기구가 작동하여 포식세포의 생리를 조절한다. 대사물질의 변화를
감지하여 활성화되는 (예를 들어, cholesterol 대사 물질은 LXR을 활성화한다) LXRα/β, PPARγ는 특히
세포 사멸과 면역 반응의 관계 임기홍 Page 21 / 36