절제 불가능한 췌장암에서 수술중 방사선치료의 적용
Intraoperative Radiation Therapy for Unresectable Pancreatic Cancer
Purpose: We wanted to evaluate the clinical effectiveness of intraoperative radiation therapy (IORT) in combination with external beam radiation therapy (EBRT) for treating unresectable or metastatic pancreatic cancer.Methods: From August 1993 to July 2007, 28 patients with unresectable or metastatic pancreatic cancer received IORT (median: 20 Gy) combined with or without EBRT (median: 50.4 Gy).
Eighteen patients were treated with IORT followed by EBRT, and 10 patients were treated by IORT alone. Eighteen patients underwent explolaparotomy and 10 patients underwent bypass surgery.
Results: The 1-year overall survival rate (OS) and the median survival time of all 28 patients were 21.4% and 7.5 months, respectively. The 1-year OS and median survival time for the clinical stage III patients were 33.3% and 10.2 months, respectively, and they were 7.7% and 5.1 months for the clinical stage IV patients, respectively (p=0.007). Univariate analyses revealed that the stage, chemotherapy and tumor volume were the significant prognostic factors for OS.
The patients treated with IORT combined with EBRT had a more favorable 1-year local control rate than that of those patients treated with IORT alone (88.9% vs. 50.0, respectively, p=0.009).
But the significant improvement in local control did not translate into a survival benefit. The addition of EBRT was an independent prognostic factor for improving the local control rate.
The operative mortality was 0%.
Conclusion: IORT combined with EBRT is considered to be effective in achieving local control and palliation for patients with unresectable or metastatic pancreatic cancer. Further, IORT seems to be safe and it does not increase the mortality or the incidence of surgical wound infection.
이남권, 김철용, 박영제, 이 석 고려대학교 의과대학 방사선종양학교실
Nam Kwon Lee, M.D., Chul Yong Kim, M.D., Young Je Park, M.D., Suk Lee, M.D., Ph.D.
Department of Radiation Oncology, Korea University College of Medicine
책임저자 김 철 용
서울시 성북구 안암동 5가
고려대학교 의과대학 방사선종양학교실 우편번호 136-705
Tel: 02-920-5516 Fax: 02-927-1419 E-mail: kcyro@korea.ac.kr
Key Words : Pancreatic cancer, Radiation therapy 중심단어 : 췌장암, 방사선치료
Received: 2010. 9. 29.
Accepted: 2010. 10. 11.
서 론
2009년 발표된 보건복지가족부 중앙암등록본부 발표에 의 하면 우리나라에서 췌장암 발생분율은 2.4%로 전체 암종 중 9위에 해당되며 5년 생존율은 7.6% 정도로 보고되었다.1 췌장 암의 중앙 생존기간은 수술적 절제가 가능한 경우 12∼20개월 이나 절제가 불가능한 경우는 6∼10개월이며, 진단 당시 40∼
50%의 빈도로 전신 전이가 발견되는데 이 경우 중앙 생존기 간은 3∼6개월로 예후가 매우 불량하다.2,3
현재 췌장암의 치료는 수술적 완전 절제가 완치를 목적으로 하는 유일한 치료방법이나 불행하게도 수술적 절제가 가능한
경우는 5∼25%에 지나지 않으며 이 경우 환자의 전신 수행 능력에 따라 gemcitabine을 기본으로 하는 전신 항암화학치 료 또는 추가로 방사선치료를 병행할 수 있고, 전신 전이가 있는 경우 환자의 상태에 따라서 항암화학치료 또는 보존적 치료를 하게 된다.4 그러나 National cancer database의 자료 분석 결과에 의하면 절제 불가능한 병기 III 환자의 1년 및 2년 생존율은 각각 27%, 7.3%이며 병기 IV 환자의 경우 1년 생존율이 8.3%이며 2년 생존율은 2.3%밖에 되지 않는다.2 따 라서 절제 불가능한 췌장암에서 항암화학방사선치료(chemo- radiation therapy, CRT)와 같은 적극적인 치료를 함에도 불구 하고 여명이 길지 않다는 점을 고려했을 때 고식적인 목적으 로 효과적인 치료방법을 연구하는 것이 환자에게 도움이 될
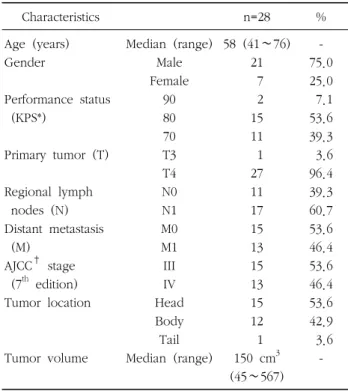
Table 1. Patients characteristics
Characteristics n=28 %
Age (years) Gender
Performance status (KPS*)
Primary tumor (T)
Regional lymph nodes (N) Distant metastasis (M)
AJCC† stage (7th edition) Tumor location
Tumor volume
Median (range) Male Female
90 80 70 T3 T4 N0 N1 M0 M1 III IV Head Body Tail Median (range)
58 (41∼76) 21 7 2 15 11 1 27 11 17 15 13 15 13 15 12 1 150 cm3 (45∼567)
- 75.0 25.0 7.1 53.6 39.3 3.6 96.4 39.3 60.7 53.6 46.4 53.6 46.4 53.6 42.9 3.6 -
*Karnofsky performance scale; †American joint committee on cancer
Table 2. Treatment characteristics
n=28 %
Treatment modality IORT*
IORT+Chemotherapy IORT+EBRT†
IORT+EBRT+Chemotherapy Surgery
Explolaparotomy Bypass surgery
8 2 11 7
18 10
28.6 7.1 39.3 25.0
64.3 35.7
*Intraoperative radiation therapy; †External-beam radiation therapy
수 있을 것이다.
췌장암은 절제가 불가능한 경우 완치가 어려우며 주로 담도 폐쇄, 십이지장 폐쇄 및 통증 등에 대한 고식적인 증상 완화가 필요한 질환이다.5 폐쇄 증상에 대해서는 우회로조성술, 스텐 트 삽입술 등을 방사선치료와 병용할 수 있고 통증 경감 효과 에 대해서는 여러 연구에서 방사선치료의 유용성이 입증되었 다.6-8 그러나 외부방사선치료(EBRT)는 방사선에 민감한 주변 정상조직들로 인하여 총 조사 선량 및 선량 증가에 제한이 있 기 때문에 대체적인 치료방법으로 수술중방사선치료(intrao- perative radiation therapy, IORT)가 고려될 수 있겠다. IORT 는 절제가 불가능한 췌장암에서 국소제어율을 향상시킬 뿐만 아니라 절제가 가능한 췌장암에서는 수술 후 재발율을 낮출 수 있는 치료이며 EBRT와 비교하여 인접한 정상 조직들을 보 호하면서 고선량을 조사할 수 있는 이상적인 치료방법이다.9 본 연구에서는 시험적 개복술(explolaparotomy) 또는 우회 로조성술(bypass surgery) 시 IORT를 시행한 환자들을 후향 적으로 분석하여 고식적 목적의 치료로써 IORT와 EBRT 병용 의 임상적 유용성 대하여 알아보고자 하였다.
방 법
1993년 8월부터 2007년 7월까지 총 40명의 환자에게 IORT 를 시행하였다. 이 중 수술적 절제가 가능했었던 환자 7명, 신경내분비암종 1명, 뇌혈관 및 심혈관 질환으로 조기 사망한 2명 및 추적관찰이 불가능하였던 환자 2명은 분석대상에서 제 외하고 총 28명의 환자를 대상으로 후향적 분석을 시행하였 다. 분석대상 포함 기준은 췌장 선암으로 한정하며 병기 III, IV로 수술적 절제가 불가능하다고 판단되는 환자로 정하였다.
환자의 성별은 대상환자의 연령 분포는 41∼76세였고 중앙값 은 58세였다. 성별은 남자가 21명, 여자가 7명이었다. 전신수 행능력상태는 KPS (Karnofsky Performance Status) 척도로 모두 70 이상이었다. 병기 분류는 2010년 개정된 미국암합동 위원회(American Joint Committee on Cancer, 7th edition)의 TNM분류에 따라 재분류하였으며 병기 III이 15명(53.6%), IV 기가 13명(46.4%)이었다. 종양의 위치는 췌장 두부 15명 (53.6%), 체부 12명(42.9%), 미부 1명(3.6%)이었으며 종양의 부피는 영상학적으로 45∼567 cm3 (중앙값 150 cm3)로 측정 되었다(Table 1).
고식적인 목적으로 우회로조성술을 계획하고 IORT를 시행 한 환자가 10명이었고, 진단과정의 일환으로 시험적 개복술을 시행한 결과 절제가 불가능하다고 판단되어 IORT 후 수술을 종료한 환자가 18명이었다. IORT만 시행한 환자가 10명, 외부 방사선치료(external beam radiation therapy, EBRT)를 추가 로 시행한 경우가 18명이었고 9명의 환자는 추가로 항암화학 치료를 시행하였다(Table 2).
Table 3. Results of overall survival rate Median (months)
1-year (%)
18-month (%) p-value All stage
Stage III (n=15) Stage IV (n=13) With chemotherapy (n=9)
Without chemotherapy (n=19)
7.0 10.2 5.1 10.2
6.6
21.4 33.3 7.7 44.4
10.5
7.1 13.3 0.0 22.2
5.3
0.007
0.030 Fig. 1. Overall survival rate. Kaplan–Meier plot of overall
survival rate for all patients (n=28). The 1-year and 18-month overall survival rates were 21.4% and 7.1%, respectively.
저자들의 병원에서는 2007년 말까지 방사선종양학과 내에 수술실을 운용하였으며 IORT의 개략적인 과정은 다음과 같 다. 외과의사의 집도로 개복 후 수술장에서 병변을 확인한 다 음 미로입구(maze entranceway)를 통해 방사선치료실로 환 자를 이송한다. 방사선종양학과의사는 병변의 크기, 모양 및 깊이를 판단하여 cylindric applicator의 크기, 모양, 각도 및 전자선의 에너지를 결정한다. 선형가속기의 갠트리(gantry)에 applicator를 결합시킨 후 전자선을 조사한다. 이때, cylindric applicator는 종양을 충분히 포함할 수 있는 크기로 보통 1 cm 정도 여유를 두고 직경 5∼9 cm의 원형 조사통(circular cone)을 사용하였고 방사선에 민감한 주변 정상 조직(간, 위, 소장, 십이지장, 가로창자 등)을 보호하기 위해 Kocher maneuver와 당김기(retractor)를 사용하였으며 필요한 경우 정상조직을 납으로 차폐한 후 치료하였다. 전자선은 종양의 두께에 따라 12∼20 MeV의 에너지를 사용하였으며 조사선량 은 중앙값 20 Gy (범위 16∼30 Gy)였다.
EBRT를 추가로 시행한 경우 종양과 주변 영역림프절을 포 함하여 삼차원입체조형방사선치료(three-dimensional confo- rmal radiation therapy)를 시행하였다. EBRT 조사선량은 중 앙값 50.4 Gy (범위 27∼50.4 Gy)였다. 추가로 시행한 항암 화학치료는 5-FU 또는 경구 5-FU 제제를 주로 사용하였으며 일부 gemcitabine 제제를 사용하였다.
통계분석은 PASW Statistics 18 (SPSS Inc., Chicago, IL) 프 로그램을 이용하였다. 생존분석은 Kaplan-Meier법을 이용하 고, 생존곡선 간 차이의 통계적 유의성은 Log-rank법으로 분
석하였다. 단변량(univariate analysis) 및 다변량분석(multi- variate analysis)은 Cox proportional hazard model을 이용하 였다.
p
-value는 0.05 미만인 경우를 통계적으로 유의한 것으 로 판단하였다. 생존기간은 치료시작 시점을 기준으로 각각 사망이 발생한 시점까지로 정의하였으며, 영상학적으로 종양 의 크기가 증가하였거나 임상적으로 종괴 효과(mass effect)로 인한 임상증상 발현 또는 악화소견을 보이는 경우 국소제어실 패로 판단하였다.결 과
1. 생존율 및 중앙생존기간
전체 대상 환자의 중앙생존기간은 7개월, 1년 생존율은 21.4%이었다(Fig. 1, Table 3). 병기 III기와 IV기의 중앙생존 기간은 각각 10.2개월, 5.1개월이었으며, 병기 III기의 1년 생 존율 및 18개월 생존율은 각각 33.3%, 13.3%였고 병기 IV기 의 1년 생존율 및 18개월 생존율은 각각 7.7%, 0%로 병기에 따라 생존율에 통계적으로 유의한 차이가 있었다(
p
=0.007, Fig. 2, Table 3). IORT후 EBRT를 시행한 경우 생존율 향상을 보이지는 못했으나(p
=0.340), 추가적으로 항암화학치료를 한 경우 중앙생존기간과 1년 및 18개월 생존율이 각각 10.2개월, 44.4%, 22.2%로 항암화학치료를 하지 않은 경우(중앙생존기 간 6.6개월, 1년 생존율 10.5%, 18개월 생존율 5.3%)와 비교 하여 통계적으로 유의한 생존율 이득을 보였다(p
=0.030, Fig.3, Table 3). 단변량분석 결과 병기와 종양의 부피가 전체 생 존율에 영향을 미치는 인자로 분석되었다. 항암화학치료의 경 우
p
-value가 0.054였지만 비교 위험도(odd ratio)가 2.407이 었으며, Log-rank 분석에서는 생존곡선 간 통계적으로 유의한 차이를 보였다(Table 4).Fig. 2. Overall survival rate (Stage III vs. IV) (p=0.007).
Comparison of overall survival rate between stage III and IV.
The 1-year and 18-month overall survival rates for 15 patients with stage III disease were 33.3% and 13.3%, respectively and for 13 patients with stage IV disease were 7.7% and 0%, respectively (p=0.007).
Fig. 3. Overall survival rate (with Chemotherapy vs. without Chemotherapy) (p=0.030). Comparison of overall survival rate between the patients treated with and without chemotherapy.
The 1-year and 18-month overall survival rates for 9 patients treated with chemotherapy were 44.4% and 22.2%, respectively and for 19 patients treated without chemotherapy were 10.5%
and 5.3%, respectively (p=0.030).
Fig. 4. Local relapse-free survival rate. Kaplan–Meier plot of local relapse-free survival rate for all patients (n=28). The 1-year and 18-month local relapse-free survival rates were 75.0% and 25.0%, respectively.
Table 4. Results of univariate analysis
Variables Odds
ratio 95% CI* p-value Overall
survival
Local relapse-free survival
Stage III Chemotherapy Smaller tumor volume With EBRT†
2.801 2.407 1.004
5.950
0.153∼0.833 1.270∼6.400 1.000∼1.007
1.197∼29.57 0.017 0.054 0.027
0.029
*Confidential Index; †External-beam radiation therapy
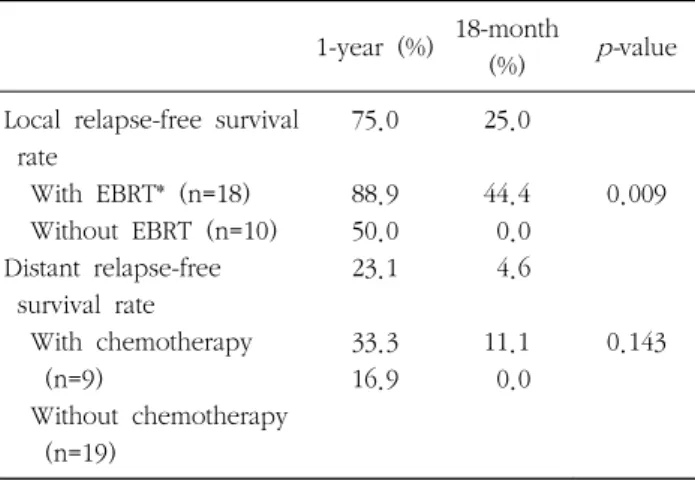
2. 국소제어율
전체 대상 환자의 1년 및 1년 6개월 국소제어율은 각각 75.0%, 25.0%이었다(Fig. 4, Table 5). IORT 후 EBRT를 시행 한 환자들의 국소제어율은 1년 88.9%, 18개월 44.4%였고, IORT만 시행한 환자들의 국소제어율은 1년 50.0%, 18개월
0.0%로 EBRT의 시행여부가 국소제어율에 영향을 미치는 인 자로 분석되었다(
p
=0.009, Fig. 5, Table 5). 단변량분석에서 EBRT 시행 여부가 유일하게 국소제어율과 통계적 유의성을 보였다(Table 4).3. 치료실패양상
병기 III 환자들 중에서 국소제어가 된 상태에서 첫 치료 실패로 원격전이가 발생한 환자가 9명(60%)이었고, 치료 종료 후 점진적으로 병이 진행하여 사망에 이른 환자가 3명(20%) 이었다. 나머지 3명의 환자는 사망시점까지 추적관찰이 되지 않아 실패양상 판단이 불가능하였다. 병기 IV환자들의 실패양 상으로는 국소제어가 된 상태에서 전이 병변이 악화되거나 다 른 부위에 새롭게 전이가 발생한 경우가 9명(69.2%)이었고 국
Fig. 5. Local relapse-free survival rate (with EBRT vs. without EBRT) (p=0.009). Comparison of local relapse-free survival rates between the patients treated with and without EBRT. The 1-year and 18-month overall survival rates for 18 patients treated with IORT+EBRT were 88.9% and 44.4%, respectively and for 10 patients treated with IORT alone were 50.0% and 0%, respectively (p=0.009).
Table 5. Results of failure-free survival rate
1-year (%) 18-month
(%) p-value
Local relapse-free survival rate
With EBRT* (n=18) Without EBRT (n=10) Distant relapse-free survival rate
With chemotherapy (n=9)
Without chemotherapy (n=19)
75.0
88.9 50.0 23.1
33.3 16.9
25.0
44.4 0.0 4.6
11.1 0.0
0.009
0.143
*External-beam radiation therapy
소제어실패가 4명(30.8%)이었다. 전체적으로 사망확인 시점 까지 추적관찰이 가능했었던 25명의 환자 중 원격전이가 첫 실패양상이었던 환자가 18명(72.0%)으로 원격전이가 주된 실 패양상이었다. 이 중 12명(병기 III기 6명, IV기 6명)은 항암화 학치료를 받지 않은 환자였고 국소 실패가 있었던 환자 7명 (28.0%) 중 4명이 외부방사선치료를 시행하지 않은 환자였다.
4. 부작용
수술 관련 사망률은 0%였다. 수술부위 감염은 예방적 항생 제 사용으로 잘 조절되었으며 IORT와 관련하여 감염률이 증가 하지는 않았다. 수술부위 감염 치료로 인하여 재원일수가 증가 되거나 수술부위 유출 또는 창상치유 지연으로 인하여 수술 후 시행한 EBRT 및 항암화학치료가 연기된 환자는 보고되지 않았다. 2명의 환자가 IORT 후 각각 8개월, 5개월에 상부 위장 관 출혈이 발생하였는데 2명 모두 우회로조성술을 시행한 병 기 III기 환자였으며 진단 당시 십이지장 제 2부위에 심한 유착 이 있었던 환자로 종양의 직접 침윤 또는 침습으로 인한 출혈 과 만성 부작용으로 인한 출혈의 감별이 불가능하였다.
고 찰
현재까지 종양학 분야에 있어서 많은 발전과 진보가 있어왔 지만 췌장암의 경우 과거와 비교하여 뚜렷한 생존율 증가를 보이지 못하고 있다. 서론에서 언급했던 바와 같이 췌장암은 약 80%의 환자가 국소 진행된 상태 또는 전신 전이가 있는
상태로 진단된다.10 이와 같이 절제 불가능한 췌장암에서 현재 gemcitabine을 기본으로 하는 CRT가 일반적인 치료로 사용되 고 있으며 방사선치료의 필요성에 대해서는 논쟁의 여지가 있 다.
1960년대 후반 Mayo clinic11의 연구 및 1980년대 GITSG (The Gastrointestinal Tumor Study Group)12의 연구에서 방 사선치료 단독요법 보다는 CRT를 함으로써 생존율을 향상시 킬 수 있음이 보고되었고 1990년대 후반 gemcitabine 제제를 사용했을 때 기존의 5-FU 제제와 비교하여 보다 향상된 생존 율이 보고되면서부터, 국소 진행된 췌장암 및 전신 전이가 있 는 췌장암에서 gemcitabine이 기본 약제로 사용되었다.13,14 이 후 CRT와 항암화학치료 단독요법을 비교하는 연구들이 진행 되었다.
Chauffert 등15은 국소 진행된 췌장암 환자 119명을 무작위 할당하여 항암화학치료(5-FU, cisplatin)와 방사선치료(60 Gy) 의 병용 치료를 시행한 군과 항암화학치료(gemcitabine) 단독 요법을 시행한 군을 비교하였다. 두 군 모두 유지치료로 gemcitabine을 투약하였다. 연구 결과 항암화학치료 단독요 법을 시행한 군에서 생존율(53% vs. 32%)과 중앙생존기간(13 vs. 8.6 months,
p
=0.03)이 높게 나타났다. 그러나 cisplatin은 췌장암에서 사용되는 기본 약제가 아니며, CRT군에서 사용한 항암제 독성으로 인하여 83%의 환자만이 계획된 방사선 선량의 75% 이상을 조사받아 조사선량이 적절하지 못했기 때문에 이 연구의 결과로부터 방사선치료의 효과를 판단할 수는 없을 것이다.
Loehrer 등16은 절제가 불가능한 췌장암 환자 74명에 대하 여 무작위 3상 연구를 진행하였다. gemcitabine 단독요법으로 치료한 환자가 38명이었고 gemcitabine과 방사선치료 병용 치료를 한 환자는 36명이었으며 병소조사영역 방사선치료 (involved field radiation therapy)로 50.4 Gy를 조사하였다.
치료 결과 CRT를 시행한 환자들의 생존율이 의미 있게 향상 되었고(1년 50% vs. 32%, 18개월 29% vs. 11%, 2년 12% vs.
4%) 중앙생존기간(11 vs. 9 months;
p
=0.034)이 증가하였으 며 국소재발율(23 vs. 41%)은 낮게 보고되었다. 그러나 4등급 의 위장관계 부작용 및 혈액학적 부작용이 CRT를 시행한 환 자들에서 증가하였다(41.2% vs. 5.7%;p
<0.0001).본 연구에서는 추가적으로 항암화학치료를 시행한 경우 생 존율 증가와 함께 중앙생존기간이 증가함을 알 수 있었다 (Fig. 3, Table 3). 그러나 EBRT의 추가 시행 여부는 생존율에 영향을 미치지 않는 것으로 분석되었다(
p
=0.340). 앞서 인용 한 연구결과와 비교하였을 때 치료 성적이 유사하거나 다소 낮은 수준을 보인 것은 진단 당시 전신전이가 있었던 병기 IV 기 환자들을 분석 대상환자에 포함시켰기 때문인 것으로 생각 하며 항암제를 동시병용이 아닌 유지치료의 개념으로 투여하 였기 때문에 직접적인 비교는 어렵다고 판단된다. 항암제의 투여기간, 용량 및 약제가 일관적이지 못했다는 것은 본 연구 의 제한점이었다.췌장암의 낮은 생존율은 높은 원격전이율과 일부 낮은 국소 제어율에 기인한다고 볼 수 있다. 방사선치료 측면에서 국소 제어율을 높이기 위한 시도로 선량 증가를 들 수 있으나 췌장 은 해부학적으로 주변 중요 장기와 근접하여 위치하기 때문에 통상적인 방사선치료 방법으로는 선량 증가에 제한이 있으며 췌장암의 방사선치료에 있어서 선량을 제한하는 장기로는 소 장, 위, 간, 신장, 척추신경 등이 있다. Fowler 등17은 국소제어 율이 90% 이상 되기 위해서 적어도 100 Gy의 생물학적 유효 선량(Biologically effective dose, BED)이 필요하다고 하였다.
췌장암의 방사선치료시 대부분의 기관에서 통상적인 분할 조 사 방법으로 50∼55 Gy 정도를 조사하며 이에 상응하는 BED 는 알파베타비(α/β ratio)를 10으로 가정했을 때 약 60∼66 Gy 정도이기 때문에 국소제어율을 향상시키기 위해서 정상조 직에는 최대로 수용할만한 부작용 발생 확률을 유지하면서 종
양에 조사되는 선량을 높여야 할 필요가 있다. Sindelar와 Kinsella과 Kinsella18는 IORT에서 방사선유발 독성(radiation- induced toxicity)에 대한 견딤 선량(tolerance dose)은 조직에 따라 상당한 차이가 있으나 일반적으로 25 Gy까지는 심각한 독성 없이 견딜만하다고 보고하였다. 본 연구에서는 IORT로 중앙값 20 Gy (BED10=60 Gy)를 조사하였으며 EBRT에서 중 앙값 50.4 Gy (BED10=59.472 Gy)를 조사하였다. IORT 후 EBRT를 추가 조사한 환자들의 총 BED10는 중앙값 119.472 Gy로 결과적으로 EBRT를 추가 시행하지 않은 환자들과 비교 하여 높은 국소제어율(Table 5)을 얻을 수 있었던 것으로 생 각된다. 통상적인 분할 조사 방법인 일선량 1.8/2.0 Gy로 119.472 Gy의 BED10를 얻기 위해서 필요한 총선량은 약 100 Gy이며 이는 복부 병변을 EBRT만으로 치료하기에는 현실상 불가능한 선량이다. 따라서 종양제어확율(tumor control probability, TCP)과 정상조직합병증확율(normal tissue complication probability, NTCP) 사이의 치료효율비 (therapeutic ratio)를 향상시키기 위한 방법으로 IORT는 주변 정상조직을 보호하면서 고선량을 종양 부위에 전달할 수 있는 장점이 있어 이론적으로 방사선 조사로 인한 합병증 발생 확 률을 줄이며 BED를 증가시킬 수 있는 이상적인 치료방법이라 할 수 있겠다.
Willet 등19은 진단 당시 전이가 없는, 절제가 불가능한 췌장 암 환자 150명에 대하여 IORT와 EBRT 및 항암화학치료 (5-FU)를 병용하여 치료한 결과를 보고하였다. 이 연구는 25 년간 진행되어 IORT 및 EBRT 조사선량이 시기별로 상이하였 지만, 3년 이상 생존자가 3명, 5년 이상 생존자가 5명으로 절 제가 불가능한 췌장암 환자에서 장기 생존이 가능함을 처음으 로 보여준 연구였다. 전체 대상 환자의 3년 및 5년 생존율은 각각 7%, 4%이었으나 IORT에서 사용한 applicator의 지름이 5∼6 cm로 종양의 크기가 작았던 25명의 환자들의 경우 2년 및 3년 생존율이 각각 27%, 17%로 절제 불가능한 췌장암 환 자에서 종양의 크기가 작은 경우에 한해서 IORT의 적용에 따 른 생존율의 이득을 보여주었다. 수술 관련 사망률은 0.6%, 수술 후 급성 부작용은 20%, 만성 부작용은 15% 정도로 수용 할 만 했다고 보고하였다.
Mohiuddin 등20은 절제가 불가능한 췌장암 환자 49명(병기 II기 30명, III기 19명)에 대하여 IORT (10∼20 Gy) 후 항암화 학치료(5-FU + leukovorin)를 시행한 다음 CCRT (55 Gy)와 유지항암화학치료를 시행하였다. 수술관련 사망률을 0%였고
3, 4 등급의 급성 부작용 14%, 만성부작용은 19%였다. 중앙생 존기간은 16개월, 생존율은 1년, 2년, 4년이 각각 55%, 22%, 7%이었으며 국소제어율은 71%이었다.
Ogawa 등21은 다기관 후향적 연구에서 144명의 절제 불가 능한 췌장암 환자를 분석하였다. IORT+EBRT로 치료한 환자 가 113명(78.5%), IORT 단독으로 치료한 환자가 30명이었고 114명은 항암화학치료를 받았다. IORT와 EBRT의 선량은 각 각 중앙값 25 Gy, 45 Gy였다. 전체 대상 환자의 2년 국소제어 율은 44.6%이었고 IORT 단독치료에 비해 IORT+EBRT로 치 료한 환자들의 2년 국소제어율이 50.9%로 통계적으로 유의한 차이를 보였다(
p
=0.0004). 2년 생존율과 중앙생존기간은 각 각 14.7%, 10.5개월이었다. 항암화학치료 시행여부가 단변량 및 다변량분석 결과 생존율에 영향을 미치는 독립적인 예후 인자로 분석되었다. 위장관계통의 만성 부작용은 국립암연구 소(National Cancer Institute) 분류상 3등급이 2명(1.4%)이었 다.Eduardo와 David22는 암환자의 고식적, 보존적 치료에 관 한 논문에서 진행된 암 환자의 사망에 이르기까지의 과정을 자동차 여행으로 비유하였다. 목적지는 같다 하더라도 불편하 고 고통스러운 여행보다는 편안하고 안락한 여행이 되어야 함 을 주장하며 고식적, 보존적 치료에 대하여 강조하였다. 고식 적 치료에 대한 WHO의 정의23는 다음과 같다. “고식적 치료 는 통증과 육체적, 사회적, 정신적인 문제들을 조기에 확인하 고 완벽히 평가하며 치료하여 고통을 예방하고 완화시킴으로 써 생명을 위협하는 질병에 관련된 문제와 직면하고 있는 환 자와 환자 가족들의 삶의 질을 향상시키는 치료이다”. 따라서 IORT와 같이 상대적으로 부작용 발생 빈도가 낮고 고식적인 목적으로 효과가 있는 치료 방법에 대한 추가적인 연구가 필 요할 것으로 생각된다.
결 론
결론적으로 본 연구에서는 병기 III기 환자, 추가로 항암화 학치료를 시행한 환자 및 종양의 체적이 작았던 환자에서 생 존율의 향상을 보였고, IORT후 EBRT를 추가 시행한 환자들의 국소제어율이 향상되는 것을 알 수 있었다. 비록 국소제어율 의 향상이 생존율 향상으로 반영되지는 않았으나, 절제가 불 가능한 췌장암 환자에서 고식적인 목적의 우회로조성술 또는 진단적 개복술을 시행할 때 IORT를 적용함으로써 EBRT를 추
가 시행하더라도 부작용의 심각한 증가 없이 종양에 조사되는 유효선량을 증가시킬 수 있었다. 따라서 IORT와 EBRT의 병 용 치료는 고식적인 목적의 치료로써 증상완화 및 무진행생존 기간을 연장시켜줄 수 있는 치료로 의미가 있다고 판단된다.
참 고 문 헌
1. Ministry for Heath, Welfare and Family Affairs. Annual Report of cancer incidence (2007) and survival (1993-2007) in Korea.
2009.
2. Bilimoria KY, Bentrem DJ, Ko CY, et al. Validation of the 6th edition AJCC Pancreatic Cancer Staging System: report from the National Cancer Database. Cancer 2007;110:
738-744.
3. Evans D, Abbruzzese J, Willett C. Cancer of the pancreas.
6th ed. Philadelphia: Lippincott Williams & Wilkins; 2001.
4. Willett CG, Czito BG, Bendell JC. Cancer of the Pancreas.
In: Perez CA, Brady LW, editors. Principles and Practice of Radiation oncology. 5th ed. Philadelphia, PA: Lippincott Co.;
2009.1336-1346.
5. Kruse EJ. Palliation in pancreatic cancer. Surg Clin North Am 2010;90:355-364.
6. Haslam JB, Cavanaugh PJ, Stroup SL. Radiation therapy in the treatment of irresectable adenocarcinoma of the pancreas. Cancer 1973;32:1341-1345.
7. Minsky BD, Hilaris B, Fuks Z. The role of radiation therapy in the control of pain from pancreatic carcinoma. J Pain Symptom Manage 1988;3:199-205.
8. Ryu MR, Yoon SC, Kim YS, Chung SM. The results of palliative radiation therapy in patients with unresectable advanced pancreatic cancer. J Korean Soc Ther Radiol Oncol 2006;24:243-247.
9. Ruano-Ravina A, Almazán Ortega R, Guedea F. Intraoperative radiotherapy in pancreatic cancer: a systematic review.
Radiother Oncol 2008;87:318-325.
10. Sener SF, Fremgen A, Menck HR, Winchester DP. Pancreatic cancer: a report of treatment and survival trends for 100,313 patients diagnosed from 1985-1995, using the National Cancer Database. J Am Coll Surg 1999;189:1-7.
11. Moertel CG, Childs DS Jr, Reitemeier RJ, Colby MY Jr, Holbrook MA. Combined 5-fluorouracil and supervoltage radiation therapy of locally unresectable gastrointestinal cancer. Lancet 1969;2:865-867.
12. Moertel CG, Frytak S, Hahn RG, et al. Therapy of locally unresectable pancreatic carcinoma: a randomized comparison of high dose (6000 rads) radiation alone, moderate dose radiation (4000 rads+5-fluorouracil), and high dose radiation
+5-fluorouracil: The Gastrointestinal Tumor Study Group.
Cancer 1981;48:1705-1710.
13. Li CP, Chao Y, Chi KH, et al. Concurrent chemoradiotherapy treatment of locally advanced pancreatic cancer: gemcitabine versus 5-fluorouracil, a randomized controlled study. Int J Radiat Oncol Biol Phys 2003;57:98-104.
14. Kim TY. Chemotherapy for advanced pancreatic cancer.
Korean J Hepatobiliary Pancreat Surg 2004;8:147-151.
15. Chauffert B, Mornex F, Bonnetain F, et al. Phase III trial comparing intensive induction chemoradiotherapy (60 Gy, infusional 5-FU and intermittent cisplatin) followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer. Definitive results of the 2000-01 FFCD/SFRO study. Ann Oncol 2008;19:
1592-1599.
16. Loehrer PJ, Powell ME, Cardenes HR, et al. A randomized phase III study of gemcitabine in combination with radiation therapy versus gemcitabine alone in patients with localized, unresectable pancreatic cancer: E4201. J Clin Oncol 2008:26 (Suppl; abstr 4506).
17. Fowler JF, Tomé WA, Fenwick JD, Mehta MP. A challenge to traditional radiation oncology. Int J Radiat Oncol Biol Phys
2004;60:1241-1256.
18. Sindelar WF, Kinsella TJ. Normal tissue tolerance to intrao- perative radiotherapy. Surg Oncol Clin N Am 2003;12:
925-942.
19. Willett CG, Czito BG, Bendell JC, Ryan DP. Locally advanced pancreatic cancer. J Clin Oncol 2005;23:4538-4544.
20. Mohiuddin M, Regine WF, Stevens J, et al. Combined intraoperative radiation and perioperative chemotherapy for unresectable cancers of the pancreas. J Clin Oncol 1995;13:2764-2768.
21. Ogawa K, Karasawa K, Ito Y, et al. Intraoperative radio- therapy for unresectable pancreatic cancer: a multi-institu- tional retrospective analysis of 144 patients. Int J Radiat Oncol Biol Phys 2010. [Epub ahead of print].
22. Bruera E, Hui D. Integrating supportive and palliative care in the trajectory of cancer: establishing goals and models of care. J Clin Oncol 2010;28:4013-4017.
23. World Health Organization. National Cancer Control Prog- rammes: policies and managerial guidelines. http://www.
who.int/cancer/palliative/definition/en/.