수막구균(Neisseria meningitidis) 감염
이 환 종
서울대학교 의과대학 소아과학교실
Table 1. Infectious Syndromes Associated with Meningococcal Disease*
Meningococcal meningiits Meningococcal bacteremia
Meningococcemia(purpura fulminans and the Waterhouse-Fridrichsen syndrome
Respiratory tract infections Pneumonia
Epiglottitis Otitis media Focal infections Conjunctivitis Septic arthritis Urethritis
Purelent pericarditis Chronic meningococcemia
*More than one syndrome may be present in an individual patients
수막구균은 소아 및 성인에서 폐혈증, 수막염 등 침습성 질환의 중요한 원인의 하나이다. 수막구균 감염은 주로 산발적으로 발생하지만 유행성을 발생 할 수 있다. 우리나라에서 1970~80년대에는 수막 구균은 소아 및 성인의 세균성 수막염의 중요한 원 인의 하나이었으며 수막구균 혈증도 자주 관찰되었 으나, 1990년대에는 수막구균 감염예가 현저히 감 소하였다. 그러나 2002년부터 국내에서 수막구균 감염예가 증가하는 경향을 보이고 있는 바, 향후 이에 대한 감시와 대책이 필요하다. 이 지면에서는 수막구균 감염의 역학 및 예방을 중심으로 수막구 균 감염에 관해 기술하고자 한다.
1. 임상상
잠재성 균혈증으로부터 패혈증, 숔 및 사망에 이 르기까지 다양한 질병을 일으킨다(Table 1). 발열이 있는 소아에서 잠재성 균혈증이 있는 수가 있다. 상 기도 또는 위장관 증상, 반점상 구진성 발진이 동반 될 수 있다. 항생제 치료를 하지 않는 경우, 일부는 저절로 좋아지며, 일부에서는 뇌막염이 속발한다.
침습성 질환의 가장 흔한 양상은 수막구균 혈증 (meningococcemia)과 수막염(meningitis)이며 두 가 지가 같이 나타날 수 있다. 급성 수막구균 혈증은 수막구균 감염의 5~20%에서 발생한다1, 2). 급성 수 막구균혈증은 발열, 오한, 권태감, 쇠약(prostration) 과 발진 등이 갑자기 나타나며, 발진은 처음에는 두드러기, 반점상 구진 또는 점상 출혈 등의 형태 로 발현할 수 있다. 전격성 경과를 밟는 경우에는, 항생제 치료를 하더라도, 자반, 범발성 혈관 내 응 고, 숔, 혼수 등이 급속히 진행되어 발병 후 수 시 간 내에 사망할 수 있다. 수막구균에 의한 패혈증 환자에서 부신으로 출혈이 생기고 숔에 빠지는 것 을 Waterhouse-Friderichsen 증후군이라고 한다2). 수 막구균 혈증 환자의 일부에서는 수막염이 생긴다.
수막염은 수막구균 혈증보다 빈도가 더 높다. 수 막구균 감염의 약 50%에서 수막염이 발생하며1), 수막구균은 큰 소아들 및 성인의 수막염의 주요 원 인균의 하나이다. 수막구균에 의한 수막염의 임상 증상은 폐구균 등의 다른 세균에 의한 수막염의 임 상 증상과 차이가 없으며, 뇌 전체를 침범하여 뇌 염으로 발현할 수 있다. 침습성 수막구균 감염증에 서는 관절염, 심근염, 심낭염, 안구내염 및 폐렴 등 이 합병될 수 있으며,
폐렴은 침습성 수막구균 감염의 5~15%를 차지
한다3, 4). 폐렴의 15%에서는 늑막 삼출 또는 농흉이
동반된다. 수막구균 폐렴은 객담에서 균이 분리되 는 경우에 비인두에 집락화된 균과 구별할 수 없기 때문에 원인적 진단이 안 될 수 있다. 그 외에 수 막구균에 의해 결막염, 안와 주위 봉와직염, 중이 염, 부비동염, 후두개염, 심내막염, 심낭염, 관절염, 안구염, 골수염 등으로 발현하거나 침습성 질환에
Table 2. Function and Classification of the Outer-Membrane Components of N. meningitidis
Components Function Classification
Capsule Protects against host-mediated, complement 13 serogroups(A, B, C, E-29.
dependent bacteriolysis and phagocytosis H, I, K, L, M, W-135, S, Y, Z Outer-membrane
proteins
Porins Creates pores through which small hydrophilic solutes pass, cation-selective or anion-selective
PorA Class 1 outer-membrane
protein(serosubtyping)
PorA Class 2 or 3 outer-membrane
protein(serotyping) Opacity-associated
proteins
Opa Promotes adherence to host cells and leukocytes Class 5 outer-membrane proteins Opc Promotes adherence to host cells and leukocytes
Reduction-modi- Unknown Class 4 outer-membrane protein fiable protein
Lipopolysaccharide Has potent endotoxic activity 13 immunotype* Pili Promote initial adherence to epithelial Class I and II*
and endothelial cells and erythrocytes
*The classification is based on differences in antigenicity Fig. 1. Drawing of the surface structures of N.
meningitidis. Inset, electron micrograph of the bacterial surface.
동반될 수 있다. 흔하지는 않으나 만성 수막구균 혈증으로 발현할 수도 있다. 만성 수막구균혈증은 항생제 치료를 하지 않은 상태에서 열이 1주 이상 지속되고 수막염의 증상은 없는 수막구균 패혈증을
말한다2, 5, 6). 소아에서는 드물며, 장기간의 간헐적인
발열, 반점상 구진, 관절통 및 관절염, 식욕부진, 체 중감소, 오한 등이 특징이다. 치료하지 않으면 뇌막
염이 발생할 수 있다. 수막구균 감염증의 회복기에 면역 복합체에 의한 관절염, 혈관염 등이 발생할 수 있으며. 이때의 관절액은 무균성이다.
2. 원인균 및 발병 기전
수막구균(Neisseria meningitidis)은 그람 염색 음 성의 쌍구균으로서, 피막 다당질의 항원성에 의해 A, B, C, D, 29E, H, I, K, L, W-135, X, Y 및 Z 등의 13가지 혈청군으로 나누어진다. 전신성 질병 은 주로 혈청형 A, C, B, W-135, Y 등에 의해 발 생하며, 이들의 상대적인 빈도는 시기와 장소에 따 라 다소 차이가 있다.
피막은 outer membrane과 outer membrane pro- teins를 둘러싸고 있으며, outer membrane proteins는 숙수의 면역 반응에 관여하며 세포질(cytoplasm)과 외부 환경간에 화학물질들의 교류에 관여한다7)(Fig.
1). outer membrane과 세포막(cytoplamic membrane) 사이에 peptidoglycan cell wall이 있다. 수막구균은 outer membrane protein인 PorA(serosubtype)과 PorB (serotype)의 항원성에 따라 세분화된다(Table 2). 그
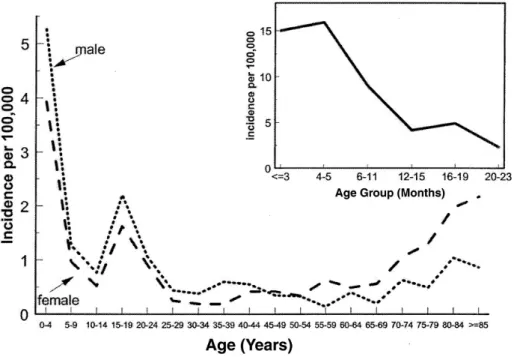
Fig. 2. Race-adjusted rates of meningococcal disease by age group and sex, based on active surveillance in 7 geographic areas(California, Georgia, Maryland, Tennes- see, Connecticut, Minnesota, and Oregon) in collaboration with the CDC, 1992~
1996.
외에 여러 가지의 다른 outer membrane protein들이 알려져 있으며, 이들이 항원성이 임상적 의미가 있 을 것으로 생각된다. Outer membrane에 있는 lipo- polysaccharide에 의해 11가지의 immunotype이 알려 져 있다. 최근에는 이러한 혈청학적 분류를 유전자 의 염기 서열에 의해 분자생물학적으로 분류하려는 노력을 하고 있다. 수막구균은 피낭 다당질 생산과 관련이 있는 유전자를 균주 간에 교환할 수 있어서 혈청군 B에서 C로 변하는 것과 같이 혈청군이 바 뀔 수 있다.
사람이 유일한 병소(reservoir)이며 비인두에서 생 성되는 aerosol이나 분비물을 통해 다른 사람에게 전염된다. 수막구균은 숙주의 면역 기전을 피해서 비인두의 non-ciliated columnar epithelium 표면에 부착하여 증식하며 집락화된다. Pili가 주된 adhe- sins로 작용하며 CD46 receptor에 결합한다. 이후 outer membrane protein의 한 종류인 opacity asso- ciated protein들 중 Opa와 Opc가 각각 CD66와 he- paran sulfate proteoglycan receptor에 결합한다8). 상 피 세포의 표면에 부착하면 상피세포가 세균을 삼
키도록(engulf) 자극하며 phagocytic vacuole 상태로 상피세포를 투과하게 된다. 상피 세포 내에서 IgA1 protease와 porB에 의해 생존한다. 성인의 5~10%
는 비인두에 수막구균을 보유하고 있으며 이들 균 주의 대부분은 병원성을 가지고 있지 않다. 일부에 서만 수막구균이 점막을 투과하여 혈액내로 들어가 서 질병을 일으키며, 대부분에서는 집락화되면 예 방력이 있는 항체를 유발하게 된다.
3. 역 학
수막구균 질환은 3~5개월의 영아에서 발생 빈 도가 가장 높으며, 이후에 연령이 증가함에 따라 빈도가 다소 감소한다. 청소년기와 젊은 성인에서 빈도가 증가하다가1). 이후에 다시 감소하고 노인층 에서 다시 증가한다(Fig. 2). 수막구균 감염은 연중 발생하지만 대부분은 겨울과 초봄에 발생한다1). 주 로 산발적으로 발생하지만 유행성으로 발생할 수 있다. 미국의 경우 연간 인구 10만명당 0.9~1.5명 의 빈도로 발생한다8).
미국과 유럽 지역에서는 B군과 C군이 가장 흔한
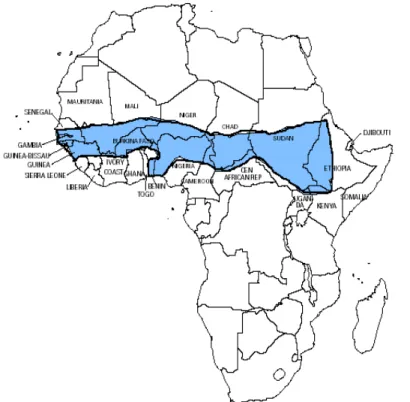
Fig. 3. Sub-Saharan meningitis belt.
원인이 되며, 아시아와 아프리카 지역에서는 A군과 C군이 주된 원인이 된다9~11). 미국, 스웨덴, 이스라 엘 등지에서는 Y군에 의한 질병의 빈도가 증가하 였다10). Y군은 B 및 C군에 비해 폐렴과 관련된 경 우가 많다.
B군 수막구균 감염이 1993~1996년간 유럽에서 는 전체의 68%를 차지하였으며10), 일부 지역에서는 10만명당 5~50례의 빈도로 발생하였다12). 1970년 대에 ET-5 clone이 출현하여 북유럽과 카나다에서 유행하였다12). 같은 clone이 1990년대 초에 미국 Oregon 및 Washington 지역에서 유행하여 1994년 에는 10만명당 4.6명의 빈도로 발생하였으며13, 14), 최근에는 그 빈도가 감소하고 있다15). 미국에서는 1991년부터 국소적인 유행의 빈도가 증가하였으며, 이는 대부분 C군에 속하는 서로 연관된 비슷한 균 주들에 의해 일어났으며 새로운 균주의 출현에 기 인한 것으로 추측된다16~18). 미국에서 지난 5년간에 는 Y군 수막구균의 소규모의 유행이 빈발하였다.
이러한 유행들은 공중 보건에 큰 문제로 대두되지 만 미국 전체 발생예의 2~3%를 차지한다. 1992~
1996년간 미국 CDC의 7개의 감시지역에서는 C군 이 32%, B군이 32%, Y군이 26%를 차지하였다1). 2 세 이하의 소아에서는 B군이 차지하는 비율이 높 았고 큰 소아, 청소년 및 성인에서는 C군이 차지하 는 비율이 높았다.
A군은 흔히 유행성 질환을 일으키며, 특히 아프 리카의 사하라 사막 이남에 서쪽의 Senegal에서 동 쪽으로 Ethiopia에 이르는 meningitis belt 지역에서 는 8~12년을 주기로 A군에 의한 큰 유행이 발생 한다19)(Fig. 3). 유행시 10만명당 500~1,000명의 빈 도로 발생한다11). 이 지역에서 수막구균 질환 발생 빈도는 선진국의 수배이며, 사망률은 약 10%로 선 진국과 비슷하지만 많은 환자들이 의료 기관에 도 착하기 전에 사망하기 때문에 실제 사망률은 더 높 을 것으로 추측된다. 1996년의 유행시에는 152,813 예가 발생하여 15,783명이 사망하였다고 WHO에 보고되었다20). A군 수막구균의 유행이 선진국에서 도 20세기 초에는 흔히 발생하였으나, 2차 대전 후 에는 산발적인 예 및 유행성 발생예가 드물어 졌 다. 이러한 변화의 이유는 알 수 없으나, 각 집단들
에서의 면역학적인 변화, 수막구균의 새로운 균주 들의 출현(introduction of new strains of N. meningi- tidis into population), 또는 비슷한 구조을 가진 세 균(예, Bacillus pumilus)에 노출됨으로써 교차 반응 하는 항체로 인한 예방21) 등이 관여할 것으로 추측 된다.
수막구균은 2~5%의 건강한 소아의 비인두에서 발견되며 청소년기에는 집락화율이 30%까지 증가 하며 성인의 10%에서 발견된다. 균의 집락화를 통 해 면역을 획득하게 된다. 성인에서 집락화는 일시 적이나 일부에서는 오랫동안 보균상태로 있을 수 있다. 사람간에는 호흡기 분비물을 통해 전염된다.
비인두에 집락화된 균이 전신으로 파급되어 질병이 발생하며, 집락화되는 균의 일부만 침습성 질환을 일으킨다. 감수성이 있는 사람에게 병독성 균주가 집락화되면 대개 10일 이내에 발병한다. 침습성 질 환을 일으키는 균주들은 피막(capsule)을 생산하며 피막은 전파 과정에 건조를 막고 숙주의 면역 체계 를 피해 가는데 도움을 준다. Pili 같은 adhesions나 lactoferrin, transferin 및 혈색소(hemoglibin) 등으로 부터 철분을 획득하는 기전같이 영양소를 획득하는 요소들(nutrition-acquiring factors)은 병독성을 증가 시킨다8). Lipopolysaccharide, outer membrane pro- tein, phospholipids 및 capsular polysaccharide로 구 성된 outer membrane vesicles을 유리하는 것이 중 요한 병독성 인자로 작용한다. 일부 clone들이 침습 성 질환을 잘 일으키는 이유는 아직 잘 밝혀지지 않았으나, 특정한 병독성 인자를 가지고 있거나 면 역 기전을 피해갈 수 있는 항원성을 가지고 있을 가능성이 있다.
Antibody-dependent, complement mediated immune lysis(bactericidal activity)의 장애가 있는 환자들이 수막구균 감염의 위험이 가장 높다22, 23). 연령이 증 가함에 따라 serum bactericidal activity가 증가하고 발병 빈도가 감소한다는 연구 결과와 군대에 입대 하는 신병들에서 혈청내에 bactericical antibody가 있으면 수막구균이 집락화되더라도 질병이 잘 발생 하지 않는다23)는 사실에서 항체의 중요성을 알 수 있다.
침습성 수막구균 감염의 위험이 높은 기저 질환 에는 기능적 또는 해부학적 무비증(asplenia), pro-
perdin 결핍증, 원발성 또는 2차적으로(전신성 홍반 성 낭창, 신증후군, 간부전 등) 말기에 작용하는 보 체(terminal complement component; C5~9) 결핍증 등이 있다24, 25). 이들에서는 침습성 및 반복성 수막 구균 감염의 위험이 높다. 이러한 환자들은 수막구 균 감염의 위험이 높지만 이러한 사람들에서 발생 예는 수막구균 감염예의 소수를 차지한다. 인면역 결핍증 바이러스(human immunodificiency virus)에 감염된 경우에도 수막구균 감염의 위험이 높다. 그 러나 폐구균 같은 다른 피낭을 가진 균에 대한 위 험만큼은 높지 않다. Mannose-binding lectin과 tu- mor necrosis factor-alpha 유전자의 polymorphism 같 이 수막구균 감염에 대한 감수성에 영향을 줄 수 있는 유전적 결함의 역할은 아직 확실하지 않다8).
미국에서 흑인과 사회경제적 지위가 낮은 사람 들은 백인과 사회경제적 지위가 높은 사람들에 비 해 위험이 높다1, 26). 흑인과 사회경제적 지위가 낮 은 사람들은 흔히 가족간 밀집된 생활(household crowding), 도시 내 거주, 및 흡연에 대한 노출 등 의 빈도가 상대적으로 높다. 직접 또는 간접 흡연 및 바이러스성 상기도 감염은 호흡기 droplet의 생 성과 확산을 증가시키고 세균의 침입을 방지하는데 있어서 호흡기 점막의 기능 및 구조적 결함을 일으 켜 수막구균 감염의 위험을 증가시킨다8, 27).
감염이 발생할 위험은 병독성을 가진 균주에 노 출되는 빈도에 의해 결정된다. 집단 발생은 가족, 학교, 신병 훈련소같이 균의 전파가 잘 일어나는 조건에서 잘 일어난다. 최근까지 균의 집락율(col- onization rate)이 인구의 20% 이상이면 유행이 발 생할 위험이 높다고 생각하였다. 그러나 최근 연구 에 의하면 보균자와 환자의 분리균주의 분자 역학 적 연구에 의하면 병독성이 있는 clone은 집락화된 환자의 일부에서만 발견되며, 질병은 이러한 병독 성이 있는 균주로 집락화된 사람에서만 발생한다는 것이 밝혀졌다. 그러므로, 집락화율이 높다는 것은 단지 병독성이 있는 clone이 확산될 조건이 갖추어 졌다는 것을 의미한다50).
수막구균 질환 환자와 긴밀한 접촉을 한 사람들 에서는 발병 빈도가 증가하여, 유아원, 학교, 군대 등 단체 생활을 하는 사람들에서 다발할 수 있다.
그렇지만 대부분의 환자들은 산발적으로 발생한 예
Table 3. Case Definitions for Invasive Meningococcal Diseases Confirmed
- Isolation of N. meningitidis from a usually sterile site, e.g., Blood, Cerebrospinal fluid, Synovial fluid, Pleural fluid, Pericardial fluid, Petechial or Purpuric lesion
Presumptive
- Gram-negative diplococci in any sterile fluid, such as cerebrospinal fluid, synovial fluid, or aspirate from a petechial or purpuric lesion
Probable
- A positive antigen test for N. meningitidis in cerabrospinal fluidn in the absence of a positive sterile site culture in the setting of a clinical illness consistent with meningococcal disease or clinical purpura fulminans in the absence of a positive blood culture
들이며, 다발한 예들은 전체 환자의 5% 미만을 차 지한다. 소아에서 수막구균 질환이 발생할 경우 형 제 중에 발생할 위험은 2~3%이며 가족 중에 발생 할 위험은 1,000명당 2~4명으로서 일반 인구에서 발생할 위험의 400~800배이다28). 집단으로 발생할 경우에는 첫 노출 및 집락화 후 2주내에 집중적으 로 발생한다. 집락화가 일종의 면역 과정이기 때문 에 2주 이후에는 항체가 생겨서 질병이 예방될 것 으로 추측된다. 수막구균 감염예가 학교에서 발생 할 경우에 다른 학생에서 발생할 위험이 0.04~2.5
%이며, 초등학교 학생보다 고학년 학교 학생에서 더 높다50). 학교에 따라 발생률이 다른 것은, 예방 조치에도 어느 정도 기인하지만, 같은 clone이 각 학교에 유입되었을 때 발생률이 다른 점으로 보아 아직 알려지지 않은 세균, 환경 및 숙주와 관련된 요인에 기인할 것으로 추측된다. 군대에 입대하는 신병들은 다른 군인들이나 일반인들에 비해 산발적 및 집단적으로 발생하는 수막구균 감염의 위험이 높다. 이러한 위험은 다양한 종류의 수막구균 균주 를 가지고 여러 지역에서 모인 사람들이 밀집된 생 활을 하기 때문일 것으로 추정된다. 최근 미국 및 영국의 연구에서는 기숙사에 거주하는 대학 신입생 들에서 같은 연령의 다른 대학생이나 일반인들에 비해 수막구균 감염의 위험이 높으며 이는 군 신병 들과 같은 이유일 것으로 추정된다29).
적절한 치료를 시작한 후 24시간까지는 전염성 이 있다고 간주한다. 잠복기는 1~10일이며, 대부 분 4일 미만이다.
4. 진 단
혈액, 뇌척수액, 관절액, 피부 및 기타 감염 부위 에서 균을 분리함으로써 진단이 가능하다(Table 3).
뇌막염 환자의 뇌척수액에서는 대부분 균이 분리되 나, 파종성 질환의 약 반수에서 혈액에서 균을 분 리할 수 있다. 침습성 수막구균 감염이 의심되면 혈액 및 뇌척수액의 배양을 실시하여야 한다. 일부 환자에서는 출혈성 피부 병변 부위를 긁은 검체 (scraping), 활액(synovial fluid), 객담 및 다른 체액 에서 균이 분리될 수 있다. 수막구균은 비인두에서 정상 균총(normal flora)으로 분리될 수 있기 때문에 비인두에서 분리되더라도 진단에는 도움이 되지 않 는다. 수막구균 감염이 의심되는 환자의 뇌척수액 에서 라텍스 응집 검사 등의 항원 검출법으로 수막 구균의 다당질 항원이 검출되면 잠정적인 진단을 내릴 수 있으나 위음성이 많으며, B군 수막구균의 항원은 검출되더라도 신뢰할 수 없다30). 혈청, 뇨 등에서 라텍스 응집 검사법으로 세균의 항원을 검 출하는 것은 도움이 되지 않는다. 임상 검체에서 중합효소 연쇄반응으로 B군 수막구균을 검출하는 방법이 연구되었으며, 영국에서는 이 방법이 상용 되고 있다.
뇌막염이 있을 때는 뇌척수액 검사상 다핵구, 단 백의 증가 및 당의 감소를 보인다. 그밖에 혈침치 와 C-반응성 단백의 증가, 백혈구의 감소 또는 증 가, 혈소판 감소증, 단백뇨, 혈뇨 등의 전신성 세균 감염의 증거를 보일 수 있고, 범발성 혈관 내 응고 증이 있는 경우에는 prothrombin, 응고인자 V, VIII, fibrinogen 등이 감소한다. 수막구균 감염이 확인되
면, 보체 결핍이 있는지 검사해야 한다.
여러 가지 그람 양성 및 음성균에 의한 패혈증, 세균성 심내막염, 6, 9, 16형의 Echo virus, A-2, A- 4, A-9, A-16 등의 Coxsackie virus 감염증 등에서 도 수막구균 혈증에서와 비슷한 출혈성 병변은 볼 수 있다.
5. 치 료
페니실린에 내성인 균주가 스페인, 이태리, 아프 리카 등지에서 흔히 분리된다. 지난 수년간 국내에 서 분리되는 수막구균의 항생제 감수성에 관한 보 고가 없으며, 향후 이에 대한 연구가 필요하다. 현 재까지 보고된 내성 균주들 대부분은 penicillin- binding protein의 변화에 의해 페니실린에 대한 최 소억제농도가 0.12~1.0 µg/mL인 중등도 내성 균주 들이다. β-lactamase 생산에 의해 페니실린에 고도 내성 균주의 보고도 있다. 중등도 내성 균주에 의 한 감염은 고용량의 페니실린으로 치료할 수 있다.
cefotaxime과 ceftriaxone은 페니실린에 내성인 균주 에 대하여 매우 효과적이다.
침습성 감염의 치료에는 수용성 penicillin G (120,000~400,000 µ/kg/일)를 6회에 나누어 정주한 다. Cefotaxime이나 ceftriaxone을 사용할 수도 있다.
페니실린에 아나필락시스양 부작용이 있는 환자에 게는 chloramphenicol(75~100 mg/kg/일, 분 4회, 정 주)을 사용한다. 대부분의 침습성 수막구균 감염의 치료에는 항생제를 5~7일간 투여하면 충분하다.
국소 감염증시에는 경과에 따라 더 오래 사용할 수 도 있다. 스페인, 이태리, 아프리카 일부 지역 등지 의 여행객에는 cefotaxime, ceftriaxone 또는 chlor- amphenicol 등이 추천된다.
페니실린에 중등도 내성인 균주에 의한 감염을 페니실린으로 성공적으로 치료하였다는 보고31)와 실패하였다는 보고들32)이 있으나, 실제 수막구균 감염의 치료 초기에는 원인을 알 수 없기 때문에 비슷한 증상을 일으킬 수 있는 다른 균에도 유효한 광범위 항생제를 투여하기 때문33)에 치료 실패의 예가 거의 없다.
숔이나 DIC가 있는 경우에는 vasoactive amines, heparin등을 투여한다. b형 Haemophilus influenzae 에 의한 수막염의 치료에는 치료 초기에 dexameth-
sone을 투여하면 청각장애의 빈도를 감소시킬 수 있으나, 수막구균 수막염에는 아직 그러한 증거가 없으며 추가 여부는 아직 논란의 여지가 있다.
적절한 항생제 치료를 하더라도, 급성 수막구균 혈증에 의한 사망률이 8~12%에 달하며, 뇌막염의 경우 3% 이하이다.
6. 예방과 관리
수막구균 감염이 집단적으로 발생할 수 있지만 미국 및 다른 선진국에서는 발생예의 95%는 산발 적인 발생예이며 대부분의 경우에 두 번째 환자가 발생하지 않는다. 그러므로, 미국 CDC에서는 학생 에서 환자 발생 후 두 번째 예가 발생하지 않으면 예방 요법을 가족에게만 추천하고 다른 학생들에게 는 추천하지 않는다. 그렇지만 2례 이상이 발생하 면 또 다른 예가 발생할 가능성이 있기 때문에 예 방 요법이 추천될 수 있다. 의료인의 경우에는 환 자의 분비물에 노출되지 않으면 발병 위험이 높지 않다.
1) 수막구균 감염 환자와 접촉한 사람에 대한 항생제 예방 요법
수막구균 감염 환자와 긴밀한 접촉을 한 사람들 은 수막구균 감염의 위험이 높기 때문에 항생제 예 방 요법이 필요하다. 다음의 경우에 해당하는 사람 들은 긴밀한 접촉을 한 사람으로 간주한다. 가족으 로서 접촉한 경우(특히 어린 소아인 경우), 지난 7 일 이내에 같은 유아원(child care)에서 접촉한 경 우, 지난 7일 이내에 입을 맞추거나(kissing) 칫솔이 나 식기를 같이 사용함으로서 환자와 긴밀한 접촉 을 한 경우, 환자와 같이 거주하면서 자주 같이 자 거나 식사를 한 경우와, 의료인으로서 환자가 발병 하기 7일 이내에 보호 장구를 착용하지 않고 환자 에게 구강대 구강 소생술을 시행하였거나 suction이 나 기관내 삽관을 시행한 경우 등이다34)(Table 4) 이들에서는 발병률이 일반 인구에서의 발병률의 300배 이상이다. 특히 가족 내 접촉의 경우에는 1,000명당 4명으로 전체 인구 발병율의 500~800배 이다35). 이들에게는 지침 증례가 진단된 후 24시간 내에 예방 요법을 시행하여야 하며, 지침예가 진단 된 후 14일이 경과한 이후에는 예방 요법의 효과가 없다18). 그 외에 환자의 구강 분비물과 접촉하지
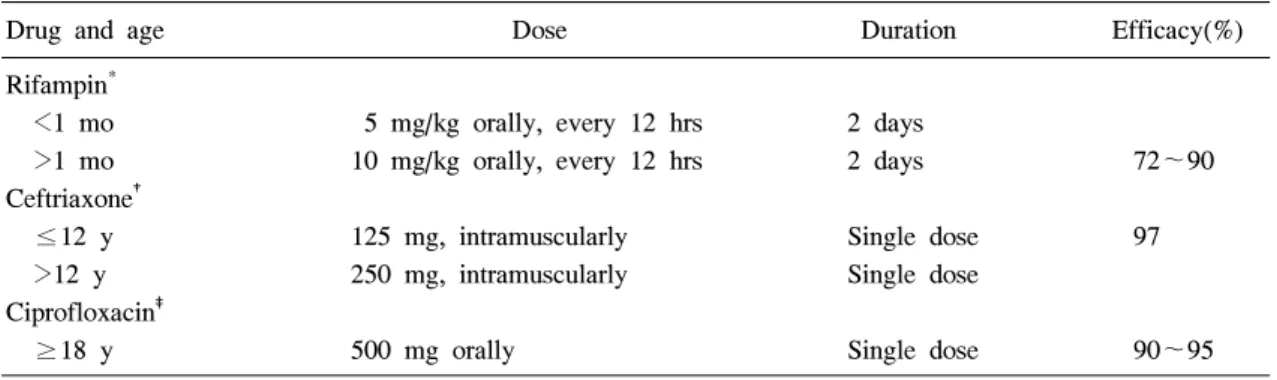
Table 5. Recommended Chemorophylaxis Regimens for High Risk Contacts and Index Cases of In- vasive Meningococcal Disease
Drug and age Dose Duration Efficacy(%) Rifampin*
<1 mo 5 mg/kg orally, every 12 hrs 2 days
>1 mo 10 mg/kg orally, every 12 hrs 2 days 72~90 Ceftriaxone†
≤12 y 125 mg, intramuscularly Single dose 97 >12 y 250 mg, intramuscularly Single dose
Ciprofloxacin‡
≥18 y 500 mg orally Single dose 90~95
*Rifampin is not recommended for pregnant women because the drug is teratogenic in laboratory animals.
Rifampin may interfere with efficacy of oral contraceptives and some seizure prevention and anticoagulant medications; may stain some contact lenses
†To decrease pain at injection site, dilute with 1% procaine
‡Ciprofloxacin is not recommended for use in persons <18 years of age and pregnant women Table 4. Disease Risk for Contacts of Index Cases of Invasive Meningococcal Disease* High risk : chemoprophylaxis recommended(close contact)
- Household contact : especially young children
- Child care or nursery school contact during previous 7 days
- Direct exposure to index patient's secretions through kissing or sharing toothbrushes or eating utensils, markers of close social contact
- Mouth-to-mouth resuscitation, unprotected contact during endotracheal intubation during 7 days before onset of the illness
- Frequently sleeps or eats in same dwelling as index patient Low risk : chemoprophylaxis is not recommended
- Casual contact : no history of direct exposure to index patient's oral secretions, eg, school or work mate
- Indirect contact : only contact is with a high risk contact, no direct contact without the index patient - Health care personnel without direct exposure to patient's oral secretions
In outbreak or cluster
- Chemoprophylaxis for persons other than those at high risk should be given after consultation with the local public health authorities
*Nasopharyngeal aspirate throat swab cultures are not useful for determining risk
않은 학교나 직장의 동료들, 환자와 직접 접촉은 하지 않고 긴밀한 접촉을 한 사람과 접촉한 사람 들, 의료인으로서 환자의 구강 분비물과 직접 접촉 을 하지 않은 사람들에게는 예방 요법을 시행할 필 요가 없다.
항생제 예방 요법에는 rifampicin, ceftriaxone 및 ciprofloxacin 등이 사용되며, rifampicin이 가장 흔히 이용된다. 이들 약제가 비인두 수막구균 보균을 줄 이는 효과는 90~95%이며36, 37), 각 항생제의 투여
방법은 Table 5와 같다. Cefotaxime이나 ceftriaxone 으로 치료받지 않은 경우에는 환자의 비인두에 수 막구균이 집락화되는 것을 방지하지 못한다38). 그 러므로 cefotaxime이나 ceftriaxone 이외에 penicillin 등으로 치료한 경우에는, 환자 자신도 퇴원 전에 항생제 예방 요법을 받아야 한다.
2) 수막구균 백신
A, C, Y, W-135 혈청군을 포함하는 4가 다당질 백신이 개발되어 사용되고 있다. 아직 우리나라에
는 도입되어 있지 않다. 4가 다당질 백신에는 각 혈청군의 정제된 피낭 다당질 50 µg씩이 포함되어 있다. 다당질 백신이기 때문에 일부 혈청군은 2세 이하의 소아에서는 면역원성이 낮다. 이러한 문제 점을 해결하기 위하여, 피막 다당질과 운반체 단백 을 결합시킨 다당질-단백 결합 백신이 개발되고 있 다. 영국에서는 진행되는 수막구균의 유행을 차단 하기 위해 1999년부터 C형에 대한 단백 결합 백신 을 모든 영아에게 접종하였으며 그 효과는 매우 우 수하였다39). 수년 내에 다가의 단백 결합이 실용화 될 것으로 기대된다. B군은 침습성 수막구균 질환 의 중요한 부분을 차지한다. 그러나, B형에 대한 다당질 백신은 B군의 피막 다당질의 구성 성분이 사람의 신경 조직에 분포하는 adhesion molecule의 구성 성분과 유사하며, 이로 인해 면역원성이 매우 낮기 때문에 다당질 백신이 아직 개발되지 않았다.
이러한 문제점으로 인해, B군 수막구균의 다당질의 구조를 변형시킨 후에 단백과 결합시킨 백신, 수막 구균의 외막에 포함된 단백(outer membrane pro- teins; porins, Tbps, Opc, NspA) 또는 lipopolysac- charide를 이용하는 백신들이 개발되고 있다. 이중 외막 단백들을 포함하는 phospholipids membrane으 로 만들어진 vesicle(outer membrane vesicle) 백신들 이 Cuba를 포함한 일부 국가에서 사용되고 있다.
이러한 외막 단백을 이용한 백신들에서는 외막 단 백들도 균주에 따라 항원성에 차이가 있다는 문제 점이 있다. B군 다당질을 단백에 결합시키고 alumi- num에 흡착시키면 실험동물에서 면역원성이 증가 한다40). 그러나 이러한 B군 다당질 백신은 면역 관 용을 극복하여 자가면역성 질환을 유발할 수 있는 이론적인 위험이 있기 때문에 개발에 주의를 요한 다.
(1) 면역원성과 효과
A군과 C군 다당질 백신의 면역원성과 예방 효 과는 잘 알려져 있다. A군 다당질은 연령 3개월의 영아에서도 일부에서는 항체 반응을 유발한다. 그 러나 성인과 비슷한 정도의 반응은 4~5세가 되어 야 일어난다. C군의 다당질은 <18~24개월의 어린 소아에서는 항체 반응이 불량하다41, 42). A군과 C군 백신은 학동기 소아와 성인 연령에서 수막구균 감 염의 예방 효과가 85% 이상이며, 질병의 유행을
차단하는데 효과적이었다43). Y와 W-135군 다당질 은 2세 이상의 소아 및 성인에서 안전하고 면역원 성이 우수하며44), 질병 예방 효과가 증명되지 않았 지만, 이들 백신에 의해 유발되는 항체는 살균력이 있다44). 4가 백신에 포함된 각 혈청군의 다당질에 대한 항체 반응은 혈청군-특이적이며(serogroup-spe- cific) 서로간에 교차 반응이 없다. 백신을 반복해서 접종받은 사람에서 예방 효과가 감소한다는 사실이 입증되지는 않았다. 그러나 최근의 혈청학적 연구 보고들에서는 C군 다당질 백신을 반복 접종하면 C 군 다당질에 대한 관용(tolerance)이 생길 가능성이 있음을 시사하였다45).
(2) 효과의 지속 기간
영아 및 5세 이하의 소아에서는 다당질 백신 1 회 접종 후 생성되는 A군과 C군 다당질에 대한 항 체가가 이후 3년간 상당히 감소한다. 건강한 성인 에서도 항체가가 감소하지만, 백신 접종 10년 후에 도 항체가 검출된다42, 46). 마찬가지로, 백신의 예방 효과가 학동기 소아와 성인에서 최소한 3년 이상 지속될 것으로 예상되지만, 5세 이하 소아에서는 A 군 백신의 효과가 이 기간동안 현저히 감소할 가능 성이 있다. 한 연구에서는 접종시 연령이 4세 미만 이었던 소아에서는 예방 효과가 90%에서 3년 후에 10%로 감소하였으며, 접종시 연령이 4세 이상이었 던 소아에서는 67%이었다47).
(3) 다당질 백신의 접종 대상
미국의 소아과학회 및 ACIP 등에서는 현재 사용 중인 4가 다당질 백신은 일반적으로 질병의 빈도가 높지 않고, 질병의 위험이 가장 큰 2세 미만의 소 아에서 효과가 적으며 또 효과의 지속 기간이 비교 적 짧다는 점에서, 소아를 포함한 일반인에게 정기 접종으로 추천되지는 않는다. 그러나 2세 이상으로 서 질병의 위험이 높은 사람들에게는 접종을 추천 한다34, 48, 49)
. 이에는 ① 해부학적 또는 기능적 무비 증 환자, ② 보체 또는 properdin 결핍증 환자 등이 포함된다. ③ 백신에 포함된 혈청군에 의한 수막구 균 감염의 빈도가 높은 지역 또는 수막구균이 유행 하는 지역으로 여행하는 사람에게도 접종을 추천할 수 있다. ④ 미국의 ACIP에서는 백신에 포함된 C 군 수막구균 감염이 다발할(outbreak) 때, 이의 중단 을 위해 대상 집단에게 백신 접종을 추천한다. 다
발한다고 함은 3개월 이내에 3례 이상의 확진 또는 거의 확실한 예가 발생하여 결과적으로 지침이 되 는 예의 빈도가 10만명당 10례 이상의 빈도로 발 생하는 것을 말한다. 이 지침은 C군 수막구균의 다 발예를 중지시키기 위하여 개발되었으나, 백신에 포함된 다른 혈청군에 대하여도 적용할 수 있다.
⑤ 미국에서는 군훈련소에 입대하는 모든 신병에게 접종하고 있다. ⑥ 최근 미국에서는 대학 신입생에 서(특히 기숙사 생활을 하는) 침습성 폐구균의 빈 도가 증가하여 대학 신입생들에게 폐구균 백신의 접종을 추천하고 있다29, 49).
(4) 접종 방법
접종 대상이 되는 소아 및 성인에게는 백신 0.5 mL을 피하 주사한다. 다른 백신들과 같이 접종할 수 있으며, 이 때에는 다른 부위에 접종한다. 접종 후 7~10일이 지나면 예방력이 있는 항체가가 형 성된다.
(5) 재접종
수막구균 감염의 위험이 높은 사람들에게는(예, 수막구균 감염이 유행하는 지역에 거주하는 사람) 재접종이 필요할 수 있다. 이는 특히 첫 접종을 4세 이전에 시행한 경우에 필요하며, 이러한 경우에 여 전히 감염의 위험이 높으면 2~3년 후에 재접종을 고려할 수 있다. 4세 이후의 연장아 및 성인에서 재접종의 필요에 대한 충분한 연구가 시행되지는 않았지만, 항체가는 2~3년에 걸쳐서 감소하기 때 문에, 계속해서 백신 접종이 필요하다고 판단되면 첫 접종 후 3~5년에 재접종을 고려할 수 있다29).
(6) 이상 반응과 주의 사항
수막구균 다당질 백신은 미국에서 군대와 외국 여행객에 대한 접종 및 유행을 차단하기 위한 일시 접종 등으로 매우 많은 양이 사용되었다. 수막구균 다당질 백신에 대한 이상 반응은 대체로 가볍다.
가장 흔한 반응은 접종 부위의 발적과 동통으로서 1~2일간 지속된다. 연구에 따라 4~56%에서 보고 되었다34). 일시적인 발열이 접종자의 5%에서까지 보고되었으며 영아에서 흔히 발생한다. 수막구균 다당질 백신에 대한 심한 이상 반응은 흔하지 않 다. 대부분의 연구에서 전신적인 알레르기 반응이 (예, 두드러기, 천명 및 발진) 100,000회 접종당 0.0~0.1회의 빈도로 보고되었다. 아나필락시스 반
응은 100,000회 접종당 <0.1회의 빈도로 발생하였 다. 경련, 감각 이상(paresthesia), 무감각증(anesthe- sia) 등의 신경학적 반응도 매우 드물게 관찰된다.
임시 중에 접종받더라도 산모 또는 신생아에게 특별한 이상 반응은 발견되지 않았다. 그러므로, 임 신으로 인해 수막구균 다당질 백신의 접종 원칙을 바꿀 필요는 없다.
6. 결 론
수막구균 감염의 역학, 발병 기전, 위험인자에 대한 이해와 진단과 치료가 진전되었음에도 불구하 고 수막구균 감염은 아직 건강을 위협하는 중요한 원인의 하나가 되고 있다. 고위험군에 대한 에방접 종이 수막구균 감염을 관리하는 중요한 수단이 될 수 있으나 4가 다당질 백신의 한계로 인해 사용에 제한을 받고 있다. 새로운 B군 백신이 개발되고 있 으며, 향후 수년내에 사용될 수 있을 것으로 기대 된다. 단백 결합 백신의 예방 효과의 지속 기간, 군 집 면역에 대한 효과 등은 아직 알 수 없으며, 적 정한 제제 및 접종 대상 등이 향후 결정되어야 하 는 등 향후 해결되어야 할 문제점들이 많이 있으 나, 단백 결합 백신이 수막구균 질환의 예방 및 관 리의 중요한 수단이 될 것으로 예상된다. 수막구균 감염은 유행성으로 발생할 수 있으며 최근 국내에 서 발생예의 증가가 예상되므로 수막구균 질환의 발생 양상에 대한 지속적인 감시가 필요하다고 생 각된다.
참 고 문 헌
1) Rosenstein NE, Perkins BA, Stephens DS, et al. The changing epidemiology of meningo- coccal disease in the United States, 1992~
1996. J Infect Dis 1999;180:1894-901.
2) Gold R. Clinical aspects of meningococcal dis- ease. In : Vedros NA, ed. Evolution of menin- gococcal disease. Vol. 2. Boca Raton, Fla. : CRC Press, 1987:69-97.
3) Racoosin JA, Whitney CG, Conover C, Diaz PS. Serogroup Y meningococcal disease in Chicago, 1991~1997. JAMA 1998;280:2094-8.
4) Griffiss JM, Yamasaki R, Estabrook M, Kim
JJ. Meningococcal molecular mimicry and the search for an ideal vaccine. Trans R Soc Trop Med Hyg 1991;85:Suppl 1:S32-S36.
5) Dock W. Intermittent fever of seven months duration due to meningococcemia. JAMA 1924;
83:31-3.
6) Ognibene AJ, Dito WR. Chronic meningococ- cemia. Arch Intern Med 1064;114:29-32.
7) Pollard AJ, Levin M. Vaccines for prevention of meningococcal disease. Pediatr Infect Dis J 2000;19:333-44.
8) Rosenstein NE, Perkins BA, Stephens DS, Po- povic T, Hughes JM. Meningococcal disease. N Engl J Med 2001;344:1378-88.
9) Schwartz B, Moore PS, Broome CV. Global epidemiology of meningococcal disease. Clin Microbiol Rev 1989;2:Suppl:S118-S124.
10) Connolly M, Noah N. Is group C meningo- coccal disease increasing in Europe? A report of surveillance of meningococcal infection in Europe 1993~6. Epidemiol Infect 1999;122:41- 9.
11) World Health Organization Working Group.
Control of epidemic meningococcal diseases : WHO practical guidelines. Lyon, France : Edi- tion Foundation Marcel Merieux, 1995.
12) Fischer M, Perkins BA. Neisseria meningitidis serogroup B : emergence of the ET-5 complex.
Semin Pediatr Infect Dis 1997;8:50-6.
13) Diermayer M, Hedberg K, Hoesly FC, et al.
Epidemic serogroup B meningococcal disease in Oregon : the evolving epidemiology of the ET-5 strain. JAMA 1999;281:1493-7.
14) Serogroup B meningococcal disease - Oregon, 1994. MMWR Morb Mortal Wkly Rep 1995;
44:121-4.
15) Sullivan A, Hedberg K, Reeves M, et al. Na- tural history of epidemic serogroup B meningo- coccal disease, Oregon 1998 and 1999. In : Abstracts of the International Conference on Emerging Infectious Diseases, Atlanta, July 16- 19, 2000:143. abstract.
16) Jackson LA, Schuchat A, Reeves MW, Wenger JD. Serogroup C meningococcal outbreaks in
the United States : an emerging threat. JAMA 1995;273:383-9.
17) Woods CR, Rosenstein N, Perkins BA. Neis- seria meningitidis outbreaks in the United States, 1994~97. In : Abstracts of the 38th An- nual Meeting of the Infectious Diseases Society of America, Denver, November 12-15, 1998:99.
abstract.
18) Control and prevention of serogroup C menin- gococcal disease : evaluation and management of suspected outbreaks : recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 1997;
46:13-21.
19) Greenwood BM, Bradley AK, Wall RA. Menin- gococcal disease and season in sub-Saharan Af- rica. Lancet 1985;2:829-30.
20) Response to epidemic meningitis in Africa, 1997. Wkly Epidemiol Rec 1997;42:313-8.
21) Filice GA, Hayes PS, Counts GW, Griffiss JM, Fraser DW. Risk of group A meningococcal disease : bacterial interference and cross-reactive bacteria among mucosal flora. J Clin Microbiol 1985;22:152-6.
22) Goldschneider I, Gotschlich EC, Artenstein MS.
Human immunity to the meningococcus. I. The role of humoral antibodies. J Exp Med 1969;
129:1307-26.
23) Goldschneider I, Gotschlich EC, Artenstein MS.
Human immunity to the meningococcus. II. De- velopment of natural immunity. J Exp Med 1969;129:1327-1348.
24) Figueroa JE, Densen P. Infectious diseases as- sociated with complement deficiencies. Clin Mi- crobiol Rev 1991;4:359-95.
25) Francke EL, Neu HC. Postsplenectomy infec- tion. Surg Clin North Am 1981;61:135-55.
26) Jackson LA, Wenger JD. Laboratory-based sur- veillance for meningococcal disease in selected areas, United States, 1989~1991. Mor Mortal Wkly Rep CDC Surveill Summ 1993;42:21-30.
27) Moore PS, Hierholzer J, DeWitt W, et al. Res- piratory viruses and mycoplasma as cofactors for epidemic group A meningococcal menin-
gitis. JAMA 1990;264:1271-5.
28) Analysis of endemic meningococcal disease by serogroup and evaluation of chemoprophylaxis.
J Infect Dis 1976;134:201-4.
29) Meningococcal disease and college students.
Recommendations of the advisory committee on immunization practices(ACIP). MMWR Morb Mortal Wkly Rep 2000;49(RR-7):11-20.
30) Zollinger WD, Boslego J. Immunologic meth- ods for diagnosis of infections by gram-nega- tive cocci. In : Rose NR, Conway de Macario E, Folds JD, Lane HC, Nakamura RM, eds.
Manual of clinical laboratory immunology. 5th ed. Washington, D.C. : ASM Press, 1997:473- 83.
31) Woods CR, Smith AL, Wasilauskas BL, Cam- pos J, Givner LB. Invasive disease caused by Neisseria meningitidis relatively resistant to penicillin in North Carolina. J Infect Dis 1994;
170:453-6.
32) Casado-Flores J, Osona B, Domingo P, Barquet N. Meningococcal meningitis during penicillin therapy for meningococcemia. Clin Infect Dis 1997;25:1479-9.
33) Quagliarello VJ, Scheld WM. Treatment of bacterial meningitis. N Engl J Med 1997;336:
708-16.
34) Prevention and control of meningococcal dis- ease. Recommendations of the advisory commit- tee on immunization practices(ACIP). MMWR Morb Mortal Wkly Rep 2000;49(RR-7):1-10.
35) The meningococcal disease surveillance group.
Analysis of endemic meningococcal disease by serogroup and evaluation of chemoprophylaxis.
J Infect Dis 1976;134:201-4.
36) Dworzack DL, Sanders CC, Horowitz EA, et al. Evaluation of single-dose ciprofloxacin in the eradication of Neisseria meningitidis from nasopharyngeal carriers. Antimicrob Agents Chemother 1988;32:1740-1.
37) Schwartz B, Al-Tobaiqi A, Al-Ruwais A, et al.
Comparative efficacy of ceftriaxone and rifam- pin in eradicating pharyngeal carriage of group A Neisseria meningitidis. Lancet 1988;2:1239-
42.
38) Abramson JS, Spika JS. Persistance of Neis- seria meningitidis in the upper respiratory tract after intravenous antibiotic therapy for systemic meningococcal disease. J Infect Dis 1985;151:
370-1.
39) Ramsay ME, Andrews N, Kaczmarski EB, Miller E. Efficacy of meningococcal serogroup C conjugate vaccine in teenagers and toddlers in England. Lancet 2001;357:195-6.
40) Frasch CE. Vaccines for prevention of men- ingococcal disease. Clin Microbiol Rev 1989;2:
Suppl:S134-S138.
41) Peltola H, Kayhty H, Kuronen T, Haque N, Sarna S, Makela PH. Meningococcus group A vaccine in children three months to five years of age: adverse reactions and immunogenicity related to endotoxin content and molecular weight of the polysaccharide. J Pediatr 1978;
92:818-22.
42) Gold R, Lepow ML, Goldschneider I, Draper TF, Gotschlich EC. Kinetics of antibody pro- duction to group A and group C meningococ- cal polysaccharide vaccines administered during the first six years of life: prospects for routine immunization of infants and children. J Infect Dis 1979;140:690-7.
43) Rosenstein N, Levine O, Taylor J, et al. Effi- cacy of meningococcal vaccine and barriers to vaccination. JAMA 1998;279:435-9.
44) Ambrosch F, Wiedermann G, Crooy P, George AM. Immunogenicity and side-effects of a new tetravalent meningococcal polysaccharide vac- cine. Bull World Health Organ 1983;61:317-9.
45) Granoff DM, Gupta RK, Belshe RB, Anderson EL. Induction of immunologic refractoriness in adults by meningococcal C polysaccharide vac- cination. J Infect Dis 1998;178:870-4.
46) Zangwill KM, Stout RW, Carlone GM, et al.
Duration of antibody response after meningo- coccal polysaccharide vaccination in U.S. Air Force personnel. J Infect Dis 1994;169:847-52.
47) Reingold AL, Broome CV, Hightower AW, et al. Age-specific differences in duration of clini-
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ cal protection after vaccination with meningo-
coccal polysaccharide A vaccine. Lancet 1985;
2:114-8.
48) Committee on Infectious Diseases, American Academy of Pediatrics, Infectious Diseases and Immunization Committee, Canadian Paediatric Society. Meningococcal disease prevention and control strategies for practice-based physicians.
Pediatrics 1996;97:404-12.
49) Committee on Infectious Diseases, American Academy of Pediatrics. Meningococcal Disease Prevention and Control Strategies for Practice- Based Physicians(Addendum : Recommendations for College Students). Pediatrics 2000;106:
1500-4.
50) Musher DM. How contagious are common res- piratory tract infections? N Engl J Med 2003;
348:1256-66.