접수일:2010년 3월 23일, 수정일:2010년 4월 19일, 승인일:2010년 4월 21일
책임저자:조 남 선 139-831 서울시 노원구 상계6동 764 대한적십자사 혈액수혈연구원
HCV 핵산증폭검사 비교검사의 불일치 결과에 대한 원인 조사
조현진1ㆍ이재숙1ㆍ김명한1ㆍ허 광2ㆍ박규은3ㆍ조남선1
대한적십자사 중앙혈액검사센터1, 중부혈액검사센터2, 혈액관리본부3
= Abstract =
Determining the Cause of Discrepant Results in HCV NAT Comparative Tests
Hyun Jin Cho1, Jae Sook Lee1, Myung Han Kim1, Kwang Huh2, Quehn Park3, Nam-Sun Cho1
Central Blood Laboratory Center1, Jungbu Blood Laboratory Center2, Blood Services Headquarter3, The Republic of Korean Red Cross, Seoul, Korea
Background: The Korean Red Cross blood laboratory centers have been performing comparative tests for NAT reactive specimens since February 2005. However, five discrepant specimens were found in HCV-diluted specimens between 2007 and 2008 and the reasons for this has been investigated.
Methods: For the five discrepant specimens, the HCV RNA concentration was measured in 5 tubes for each speciment. Subsequently, in order to compare the sensitivity of the low titer specimens measured by RT-PCR and TMA, comparative tests of diluted samples were examined six times per sample. Finally, the genotype was tested in order to determine the characteristics of the discrepant samples.
Results: Result of the quantitative tests for HCV RNA demonstrated that aliquots of the plasma bag were homogenous in term of viral load quantitation. As a result of the comparative test, all samples were found to contain over 1.0×101 IU/mL as detected by the two analytical systems. In contrast, those less than 1.0×
101 IU/mL were not entirely detected by the two systems.
Conclusion: It was impossible to completely detect using the two NAT system and the detection rates for both systems were equivalent for the samples examined. In particular, with respect to HCV, it may be undetectable on the NAT test because viral load decreases rapidly before and after sero-conversion. This result indicates that anti-HCV and NAT should be performed together as an HCV screening test prior to blood donation. (Korean J Blood Transfus 2010;21:36-42)
Key words: NAT, HCV, Comparative test
서 론
1997년부터 일본을 비롯한 선진국에서는 헌혈 혈액에 대한 안전성 강화를 위해 헌혈 혈액 선별 검사로 핵산증폭검사를 실시해오고 있다.1) 한편 우리나라에서도 2003년 발생한 HIV수혈감염사 건 이후 보다 전문적이고 체계적인 혈액안전관리 시스템 구축의 필요성이 대두되어 대한적십자사 에서는 2005년 2월부터 모든 헌혈혈액에 대하여 HCV 및 HIV에 대한 핵산증폭검사를 실시하고 있다. 핵산증폭검사는 혈액 내 바이러스에서 직 접 핵산을 분리, 증폭하여 감염여부를 확인하는 방법으로, 혈청학적 검사보다 혈청전환 전의 잠 복기를 단축하여 조기에 바이러스 감염여부를 진 단할 수 있는 검사법이다. HCV의 경우 기존의 효 소면역측정법보다 약 60일 정도의 혈청전환 전의 잠복기를 단축하는 것으로 보고되고 있다. 현재 는 서울, 대전, 부산 3곳의 혈액검사센터에서 모 든 헌혈자에 대한 핵산증폭검사를 수행하고 있는 데, 서울과 부산에 위치한 중앙과 남부혈액검사 센터에서는 로슈(Roche)사의 역전사 중합효소 연 쇄반응(reverse transcriptase polymerase chain re- action, RT-PCR)을 이용한 방법을, 대전의 중부혈 액검사센터에서는 카이론(Chiron)사의 전사매개 증폭(transcription mediated amplification, TMA)법 을 이용하여 검사하고 있다.
또한 대한적십자사 혈액검사센터에서는 핵산 증폭검사 선별검사 최종양성인 혈액에 대하여 서 로 다른 검사 시스템간의 교차 시험을 통해 양성 결과에 대한 최종적인 확인과 함께 현재 사용중 인 시스템에 대한 성능을 검증하고자 2005년 2월 부터 비교검사를 실시하고 있고, 2006년 6월부터 는 비교검사의 정도관리 차원에서 음성 혈장을 무작위로 섞어 검사하고 있으며, 같은 해 7월부 터는 두 시스템의 혼합검체(pooling)제조의 희석
배수를 감안하여 검체를 희석제조하여 카이론 시 스템은 16배, 로슈시스템은 24배로 희석한 비교 검사를 추가하여 실시하고 있다. 비교검사용 희 석검체 준비 및 검체 발송 업무는 중앙혈액검사 센터 품질관리과가 주관하여 매월 실시하고 있 다. 그런데 2007년과 2008년에 실시한 비교검사 에서 HCV희석검체에 대하여 5건의 불일치 결과 가 발생하여 해당 제조사와 공동으로 그 원인을 조사하고자 본 연구를 실시하였다.
대상 및 방법
1. 대상
2007년과 2008년에 실시한 비교검사에서 HCV 희석검체에 대하여 불일치 결과가 발생한 5개 혈 액을 대상으로 하였다. 이 혈액은 대한적십자사 핵산증폭검사 양성관리지침에 의하여 중앙혈액 검사센터에 소분되어 보관 중이었으며 대한적십 자사 혈액관리본부 연구윤리심의 위원회에서 심 의ㆍ승인 후 사용하였다.
2. HCV RNA 정량분석
소분되어 보관 중인 혈액의 균질성을 검증하기 위해 불일치 혈액 5개에 대하여 각 혈액에 대해 5개씩 정량 분석하여 HCV RNA를 확인하였다.
HCV RNA 정량은 COBAS TaqMAN HCV TEST (Roche molecular systems Branchburg NJ, USA)를 사용하였으며 시약사용설명서에 명시된 검출한 계는 12.6 IU/mL이다.
3. 시스템별 희석배수 비교검사
검체희석은 중부혈액검사센터에서 노바티스 측의 카이론 시스템 담당자가 직접 시행하였으며 5개의 불일치에 대하여 검체 당 6개씩 카이론 시
Table 1. The results of HCV RNA quantification for five discrepant specimens
1 2 3 4 5 Average N
3.3E+01 4E+01 5.5E+01 4.6E+01 4E+01 4.3E+01
<15 <15 <15 <15 <15 <15
2.92E+03 3.45E+03 2.96E+03 3.07E+03 3.16E+03 3.1E+03
2.1E+01 6.4E+01 6.6E+01 9.8E+01 9.8E+01 6.1E+01
9E+01 1.69E+02 1.61E+02 2E+02 1.72E+02 1.6E+02
Table 2. The comparison of the sensitivity of low titer specimens measured by two test systems & the result of genotypes in five discrepant specimens
TMA RT-PCR Genotype
4/6 4/6 1b
1/6 3/6 2a/2c
6/6 6/6 2a/2c
6/6 5/6 Indeterminate
6/6 5/6 1b
23/30 23/30
스템은 16배, 로슈시스템은 24배로 희석검체를 준비하였고 총 30건을 중부 및 중앙혈액검사센터 에서 검사를 실시하였다. 검체 희석은 혈액검사 센터 표준업무절차서 NAT 양성혈장관리에 따라 실시하였고 희석시 음성혈장은 Basematrix 53 (BBI, USA)을 사용하였다. 또한 핵산증폭검사 시약은 COBAS Ampliscreen HCV 2.0 (Roche Diagnostic, Mannheim, Germany)와 Procleix HIV-1/HCV mul- tiplex assay (Chiron Cooperation. Emeryville CA, USA)를 이용하였다.
4. HCV 유전자형 분석
바이러스 유전자형 분석에는 VERSANT HCV genotype kit (Bayer Heathcare, Yarrytown NY, USA)를 이용하였다.
결 과
1. HCV RNA 정량분석 결과
HCV RNA에 대한 정량검사 결과는 Table 1과 같이 동일 혈액에서 모두 균일한 결과를 보였다.
정량검사 결과는 평균 1.5×101 IU/mL∼3.1×103 IU/mL까지의 분포를 보여 저역가임을 확인하였 다.
2. 시스템별 희석배수 비교검사
희석혈액에 대한 비교검사 결과는 1.0×103 IU/mL 이상의 정량수치를 보이는 혈액에서는 두 시스템 모두 100% 검출을 하였고, 그 이하의 정 량수치를 보이는 혈액에 대해서는 두 시스템 모 두 100% 완벽한 검출을 보이지 않았으나 전체 검 출률은 두 시스템이 동일하였다(Table 2).
3. HCV 유전자형 분석
5개의 검체로 유전자형 분석을 실시한 결과 1b 2예와 2a/2c예로 확인되었다. 나머지 1건은 증폭 이 되지 않아 유전자형 분석을 시행할 수 없었다 (Table 2).
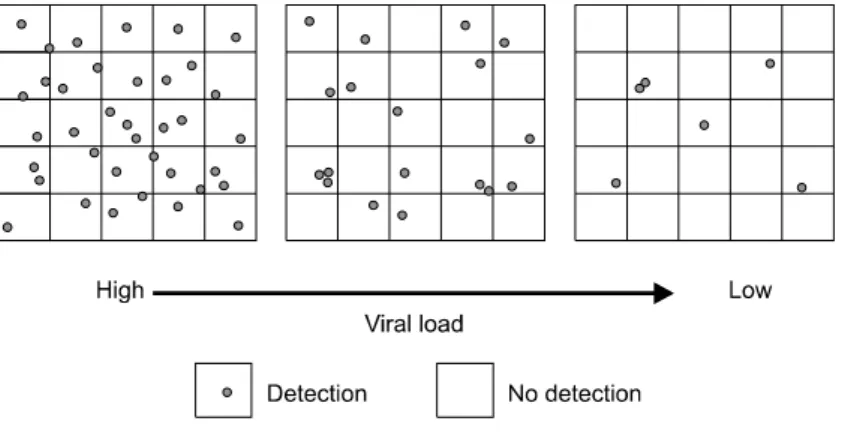
Fig. 1. Poisson distribution. Proba- bility of detection in a positive sample.
고 찰
미국혈액은행협회(AABB)의 2000년 Report of the interorganizational Task Force on Nucleic Acid Amplification Testing of Blood Donors에 의하면 핵산증폭검사 양성(NAT positive)의 정의를, 선별 검사 양성(NAT reactive)인 경우 다른 방법의 핵 산증폭검사 시스템으로 추가 검사하여 확인하거 나 혈청학적 검사의 양성 전환으로 확인(confirm) 하는 것이라고 명시하였다.2) 이에 따라 대한적십 자사 혈액검사센터에서는 핵산증폭검사 선별검 사 최종양성인 검체에 대하여 2005년 2월 핵산증 폭검사 전면실시 때부터 양성반응을 보이는 검체 에 대하여 두 시스템간에 월 1회 비교검사를 실 시하였으며, 2006년 7월부터는 두 시스템의 혼합 검체(pooling) 제조의 희석배수를 감안하여 카이 론 시스템은 16배로 로슈 시스템은 24배로 희석 한 검체에 대해서도 추가로 비교검사를 실시해왔 다. 그 결과 2005년 261건, 2006년 255건에 대하 여 비교검사를 실시하여 양성임을 확인하였다.
한편 의료기관 혈액원의 양성 검체는 혈액을 얻 기가 용이하지 않아 비교검사에서 제외되었다.
그런데 2006년에 실시한 핵산증폭검사 비교검사 에서 희석검체에 대한 비교검사결과 3개 검사센
터에서 모두 검출하지 못한 결과가 발생하였으나 이 경우는 정량이 불가능한 정도의 바이러스 양 임이 확인되었다. 그러나 2007년과 2008년에 실 시한 비교검사에서 HCV 희석검체에 대한 비교 검사에서 불일치 결과가 5건이 발생하여 원인을 분석하고자 연구를 실시하였다.
비교검사 불일치 검체에 대한 본 조사 이전에 실시한 정량분석과 본 조사에서의 정량분석 결과 는 검사방법상의 차이로 정량수치상 차이를 보였 으나(data not shown), 본 조사에서의 정량분석결 과 같은 방법의 동일 검체에서는 모두 균일한 결 과를 보였다(ABI vs. real-time PCR). 이것으로 혈 액백 내에서의 검체소분은 균질함을 증명하였다.
두 번째로 실시한 저역가 희석검체에서의 비교검 사에서는 두 핵산증폭검사 시스템에서 동일한 검 출률을 보였고 일부에서는 음성 결과를 보였는 데, 이는 저역가 검체에서는 검체채취 부위에 따 라 포와송 분포(Poisson distribution)에 의해 양성 또는 음성 결과가 나올 수 있기 때문이다(Fig. 1).
즉 저역가 검체에서는 검체 채취시 포함된 바이 러스의 농도가 해당 혈액 전체의 평균 바이러스 농도와 항상 같다고 보기는 어렵다. 또한 유전자 형과 아형이 핵산증폭검사의 검출한계에 영향을 미칠 수 있으므로 불일치 검체에 대한 유전자형
분석을 실시한 결과, 증폭이 되지 않은 한 예를 제외하면 1b와 2a/2c가 각각 2예로 특이한 점은 발견되지 않았다. 현재까지 HCV는 적어도 6가지 이상의 유전자형으로 분류되고 있고, 국내에는 1b 및 2a형이 HCV 유전자형의 대부분인 것으로 알려져 있어, 이번 결과도 기존의 일반인에 대한 국내 보고와 크게 차이를 보이지 않았다.3) 또한 카이론 시스템에서는 냉동 검체 처리에 있어 시 약제조사 설명서에 따라 원심분리가 필요함을 알 게 되어 검체 취급 및 보관의 중요성을 재차 확인 하였다.
대한적십자사에서 수행하고 있는 핵산증폭검 사의 95% 검출한계는 로슈 시스템은 21.0 IU/mL 이고, 카이론 시스템은 1.9 IU/mL이다.4,5) 지금까 지 보고 되어진 95% 검출한계는 HCV 유전자형 1a에 기초한 자료이다. 하지만 유전자형 2b에 대 한 연구 결과들에 의해 HCV는 유전자형에 따라 분석민감도가 다르다는 보고가 있었다. 따라서 HCV 유전자형을 반영하는 국제표준물질이 필요 하다고 논의되어지고 있다.6)
Anti-HCV가 양성으로 나오는 경우는 C형간염 의 현재 감염 상태, 과거에 감염된 적이 있는 경 우 또는 위양성의 경우이고, 초기 급성기인 경우 에는 음성으로 나오기도 한다.7) C형간염 바이러 스는 감염 후 체내에서 매우 빠르게 증식해 (doubling time 17시간), 혈청전환 전 거의 2달간 지속되는 고역가의 바이러스혈증(ramp-up phase) 을 갖는다. Fang 등8)은 HCV 감염 환자 일부에서 항체 양성 전환 직전과 직후에 HCV RNA가 일정 기간 저역가 상태로 존재하는 기간이 다양한 빈 도 즉 검사 결과의 fluctuation을 보였다고 보고하 였다. 특히 이런 fluctuation을 보이는 검체 대부분 이 높은 ALT 수치를 보였고, 이것은 아마도 면역 반응의 결과를 반영한다고 하였다. 또한 항체 양 성 전환 이전의 neat NAT에서는 양성 결과를 보
였지만, diluted NAT에서는 음성 결과를 보인 외 국의 보고도 있었다. 이런 결과는 초기의 ramp-up phase에서는 minipool NAT 검사가 위음성이 나올 수 있어, minipool NAT 검사로도 HCV 감염을 완 벽하게 검출할 수 없음을 의미한다. 또한 HCV는 다른 바이러스에 비하여 혈청내 항체나 RNA농 도가 동일인에서도 수년에 걸쳐 심한 변동율(11∼
141배)을 보이거나 일시적으로 검출한계 이하로 까지 감소할 수 있다고 보고되고 있다. 이와 유사 한 연구로 Operskalski 등9)은 핵산증폭검사에서 검출한계 이하의 혈청학적 음성과 양성 혈액으로 인한 HCV 감염을 보고하였는데, 즉 HCV 감염은 가장 예민도 높은 RNA 검사법으로도 검출한계 이하에서 발생할 수 있다는 것이다. 이런 결과는 HIV-1에서도 나타났는데, 이 결과도 현재의 mini- pool NAT에서의 희석에 의한 것으로 결과적으로 HCV감염을 최적으로 예방할 수 없음을 말한다.
또한 minipool NAT로 검출이 안되었지만 indi- vidual NAT에서 검출이 된 매우 드문 증례도 보 고되고 있지만 낮은 yield와 고비용으로 인해 in- dividual NAT의 도입은 숙고되어져 왔다. 그러나 대형혈액원에 적합한 처리량을 갖춘 자동화된 individual NAT가 필요하다는 의견도 제시되었 다. 하지만 individual NAT로도 검출이 불가능했 던 anti-HCV 양성, HCV RNA 음성 헌혈혈액에 의 해서도 수혈감염을 일으킬 수 있다는 보고도 있 었다. 또한 저역가의 HCV RNA의 잠복기 감염의 경우는 가장 민감도가 높은 individual NAT로도 일정하지 않게 검출되어 HCV 감염을 완전히 예 방할 수 없다고 하는 보고도 있었다.10) 따라서 기 존에 보고되었던 것처럼11) 현재의 핵산증폭검사 가 혈청학적 검사를 완전히 대신할 수 없고 보완 의 효과가 있으므로 헌혈자에 대한 HCV 선별검 사로서 항체검사와 핵산증폭검사가 병행되어야 함을 보여주는 또 하나의 사례이다. 또한 검출률
을 높이기 위해서는 향후 차세대 NAT는 자동화 된 minipool 또는 individual NAT가 검토되어야 한 다고 사료된다. 그런데 최근 자동화된 minipool 또는 individual NAT로 기존의 HCV/HIV RNA NAT에 HBV DNA를 동시에 검출할 수 있는 mul- tiplex assay가 개발되어져 있고, 여기에는 real- time PCR을 이용한 로슈사의 modular automated cobas S201 system과 카이론사의 Tigris Procleix system이 있어서 민감도가 더욱 향상되어 헌혈 혈액의 안전성이 더욱 강화되었다.
요 약
배경: 대한적십자사 혈액검사센터에서는 핵산 증폭검사 선별검사 최종양성인 검체에 대하여 2005년 2월부터 비교검사를 실시하고 있다. 그런 데 2007년과 2008년에 실시한 비교검사에서 HCV 희석검체에 대하여 5건의 불일치 결과가 발생하 여 그 원인을 조사하였다.
방법: 불일치 검체 5건에 대해 각 검체당 5개씩 정량 분석하여 HCV RNA양을 확인하였고, 희석 검체에 대한 비교검사를 6회 반복검사하여 두 시 스템에 대한 저역가 검체의 민감도를 비교하였 다. 또한 추가로 불일치 검체에 대한 특징을 검토 하고자 유전자형 분석을 실시하였다.
결과: HCV RNA에 대한 정량검사결과 같은 방 법의 동일 검체에서는 모두 균일한 결과를 보였 다. 정량검사 결과는 평균 1.5E+01 IU/mL∼3.1E+
03 IU/mL까지의 분포를 보여 모두 저역가임을 확 인하였다. 비교검사 결과 1.0E+03 IU/mL 이상의 검체에서는 두 시스템 모두 100% 검출을 하였고, 그 이하의 정량수치를 보이는 검체에 대해서는 두 시스템 모두 100% 완벽한 검출을 보이지 않았 다. 5개의 검체로 유전자형 분석을 실시한 결과 증폭이 되지 않는 한 건을 제외하고는 모두 국내
에서 보고되는 1b와 2a/2c로 문헌상의 특징과 유 사하였다.
결론: 저역가 검체에서는 두 핵산증폭검사 시 스템 모두 100% 완벽한 검출이 불가능하였고, 모 두 동일한 검출률을 보였다. 특히 HCV의 경우 항 체 생성 시기 전후에 급격히 viral load가 떨어져 저역가 상태에 놓일 수 있으며, 이러한 경우 핵산 증폭검사에서 검출되지 않을 수 있다. 이는 헌혈 자에 대한 HCV 선별검사로서 항체검사와 핵산 증폭검사가 병행되어야 함을 보여주는 사례이다.
또한 향후 핵산증폭검사는 pool수를 더 축소한 자동화된 장비의 도입이 고려되어져야 한다.
감사의 글
본 연구에 도움을 주신 노바티스 카이론사와 다이아텍 코리아에 깊이 감사드립니다.
참고문헌
1. Coste J, Reesink HW, Engelriet CP, Laperche S, Brown S, Busch MP, et al. Implementation of donor screening for infectious agents trans- mitted by blood by nucleic acid technology:
update to 2003. Vox Sang 2005;88:289-303 2. Busch MP, Kleinman SH, Jackson B, Stramer
SL, Preston S. Nucleic acid amplification tes- ting of blood donors for transfusion-transmitted infectious diseases: report of the interorgani- zational task force on nucleic acid amplifi- cation testing of blood donors. Transfusion 2000;40:143-59
3. Sung HS, Oh HB, Lee EH. Genotypes of he- patisis C virus amplified from sera non-reactive to anti-HCV enzyme immunoassay. Korean J Clin Pathol 2001;21:141-6
4. Package Insert: COBAS Ampliscreen HCV
Test, version 2.0 03577139001-03. New Jersey:
Roche Molecular Systems, Inc., 2005:6 5. Package Insert: Procleix HIV-1/HCV Assay.
IN0065 Rev. B. San Diego: Gen-Probe, Inc., c2002-05.
6. Krtzschmar E, Chudy M, Nubling CM, Ross RS, Kruse F, Trobisch H. First case of hepatitis C virus transmission by a red blood cell concentrate after introduction of nucleic acid amplification technique screening in Germany:
a comparative study with various assays. Vox Sang 2007;92:297-301
7. Kim MH, Lee HJ, Park SY, Lee YS, Suh JT.
Usefulness of anti-HCV ELISA test and HCV reverse transcriptase-PCR for the diagnosis of hepatitis C viral infection. Korean J Lab Med 2006;26:418-23
8. Fang CT, Tobler LH, Haesche C, Busch MP,
Phelps B, Leparc G. Fluctuation of HCV viral load before seroconversion in a healthy volun- teer blood donor. Transfusion 2003;43:541-4 9. Operskalski EA, Mosley JW, Tobler LH, Fiebig
EW, Nowicki MJ, Mimms LT, et al. HCV viral load in anti-HCV reactive donors and infectivity for their recipients. Transfusion 2003;43:1433- 41
10. Busch MP, Tobler LH, Gerlich WH, Schaefer S, Giachetti C, Smith R. Very low level viremia in HCV infectious unit missed by NAT. Trans- fusion 2003;43:1173-4
11. Kang JW, Lee JS, Seo DH, Huh K, Wee JH, Park Q. Characteristics and follow-up results of the window period blood donors for hepa- titis C virus. Korean J Blood Transfus 2007;
18:15-22