감마선 조사 세리신의 p38/MITF 기전을 통한 멜라닌 생성 억제효과
박현지1, 권미진2, 이계원3*, 조영호3*
Anti-melanogenic Effect of Gamma-irradiated Sericin via p38/MITF Pathway in Melan-a Cell
Hyun-Ji Park1, Mi-Jin Kwon2, Gye Won Lee1,3*, and Young Ho Cho1,3*
Received: 4 July 2019 / Revised: 20 August 2019 / Accepted: 21 August 2019
© 2019 The Korean Society for Biotechnology and Bioengineering
Abstract: Silk sericin is a water-soluble protein, which derived from silkworm Bombyx mori. Recently, several studies have recognized the various biological activities of sericin. How- ever, studies on the structural changes and physiological activ- ities of silk sericin using the gamma irradiation had not been well addressed. In this study, we evaluated the anti-melano- genic effects of gamma-irradiated sericin by using Melan-a cells. First, both sericin without gamma irradiation and gamma- irradiated sericin treatment at 100 µg/mL significantly decreased melanin content more than 20%, compared to negative con- trol and especially, 25 kGy gamma-irradiated sericin (GIS) decreased melanin content by 40%, compared to negative con- trol. And 25 kGy GIS significantly decreased microphthal- mia-associated transcription factor (MITF) and tyrosinase related protein (TRP)-2 protein expression, compared to neg- ative control, which was similar to the expression of arbutin.
Also, in the mitogen-activated protein kinase (MAPK) path-
way, which is upstream pathway of MITF, 25 kGy GIS decreased the expression of phosphorylated p38. Taken together, GIS showed anti-melanogenic effect in Melan-a cells by inhi- bition of p38-dependent MITF pathway.
Keywords: sericin, gamma irradiation, anti-melanogenic effect, Melan-a cells
1. INTRODUCTION
인간 피부의 색소 침착은 자외선 (UV)조사와 환경 스트레스와 같은 외부 자극 외에도 호르몬, 염증 등의 다양한 자극에 의해 조절된다 [1,2]. Melanogenesis는 피부와 머리카락, 눈의 색을 결정하는 멜라닌 형성의 핵심 과정이며, 햇빛 및 화학물질의 유해한 영향으로부터 피부를 보호하는 역할을 한다 [3-5]. 하지 만 과도한 멜라닌 생성 및 축적은 과색소침착, melasma 등의 피부 질환을 일으킨다 [6]. 멜라닌 생합성은 다양한 전사인자 와 효소에 의해 조절되는데, 특히 Microphthalmia-associated transcription factor (MITF) 는 멜라닌 생성 효소의 전사에 결정 적인 역할을 한다 [7,8]. MITF에 의해 전사된 효소 중 tyrosinase 는 멜라닌 합성의 초기 두 개의 반응, 즉 L-tyrosine의 L-3,4- dihydroxyphenylalanine (L-DOPA)로의 hydroxylation과 L- DOPA의 L-dopaquinone으로의 산화를 촉매한다. Tyrosinase related protein (TRP)-1, -2 는 그 후의 산화과정을 촉매함으로 써 최종적으로 멜라닌이 형성되는 데 관여하는 것으로 알려 져 있다 [9-10]. 따라서 tyrosinase와 같은 멜라닌 생성효소를 억제하여 멜라닌 생성을 조절하는 것이 피부 관련 질환이나 외 관 유지에 중요하므로 이와 관련된 연구가 계속 이루어지고 있
1건양대학교 의료공학과
1Department of Medical Engineering & Science, Konyang University, Daejeon 35365, Korea
2피에스에이 R&D센터
2R&D center, PSA Co., Ltd, Daejeon 35365, Korea
3건양대학교 의료공학과 & 제약생명공학과
3Department of Medical Engineering & Science and Pharmaceutics and Biotechnology, Konyang University, Daejeon 35365, Korea
Tel: +82-42-600-8502, Fax: +82-42-600-8502 e-mail: pckmon@konyang.ac.kr
Tel: +82-42-600-8503, Fax: +82-42-600-8503 e-mail: micael@konyang.ac.kr
Research Paper
다. 최근에는 멜라닌 생성 기전을 밝혀 멜라닌 합성 전의 전사 체의 형성을 억제하거나 멜라노좀의 각질형성세포로의 이동 을 억제하는 등의 다양한 기전 연구가 이루어지고 있다 [11].
실크 (silk)는 누에 Bombyx mori에서 생산되는 섬유형 단백 질이다. 실크는 쌍실형태의 섬유질 단백질인 피브로인과 피 브로인을 둘러싸고 있는 세리신의 두 가지 단백질로 구성되 어 있다 [12-14]. 그 중 실크 세리신 (silk sericin)은 18개의 다 양한 아미노산으로 구성되어 있으며 10~400 kDa의 분자량을 가지고 있다. 또한 사람 피부의 천연보습인자 (nature moisture factor)와 유사한 조성을 가지고 있어 피부 보습 [15] 및 주름 개선 [16] 등 의약 및 화장품 분야에서 잠재적으로 유용한 것 으로 알려져 있다 [17-19]. 그러나 세리신은 주로 고분자의 형태로 존재하므로 열에 대한 안정성이 떨어지고 용해도가 낮기 때문에 제형화 하는데 한계가 있다 [20,21]. 이 등 [22]
은 실크 세리신에 식용효소인 Flavourzyme을 처리하여 얻은 저분자 세리신이 혈당과 중금속 함량을 감소시킨다고 보고 하였다. 이러한 사실은 고분자량의 아미노산의 구조를 저분 자량의 아미노산 구조로 분해시키는 공정을 적용하면 다양 한 산업에 효과적으로 적용할 수 있음을 의미한다.
감마선 조사는 최근 식품의 보관 및 위생 개선에 유용하게 사용되며 의료 및 화장품 산업에서도 중요성이 있는 것으로 밝혀졌다 [23]. 이는 감마선 조사는 화학 첨가제에 의한 반응 과 같이 촉매제가 필요 없이 저온에서도 화학 반응을 일으킬 수 있고, 단시간에 처리가 가능하기 때문에 에너지 소비가 적다는 장점이 있기 때문이다 [13]. 하지만 감마선 조사에 의 한 단백질의 분자량 변화에 따른 생리활성이나 피부 친화성 소재 적용에 관해서는 아직까지 충분한 연구가 이루어지지 않고 있는 실정이다.
따라서 본 연구에서는 감마선 조사를 한 세리신의 선량 별 항산화 효과 및 멜라닌 합성에 미치는 영향을 확인하고 미백 작용 기전을 알아보고자 하였다.
2. MATERIAL AND METHOD
2.1. 시약
RPMI 1640 과 Fetal bovine serum (FBS)는 Welgene (Daegu, Korea)에서 구입하였으며, Penicillin-streptomycin은 GibcoBRL (Eggenstein, Germany)에서 구입하였다. Phorbol 12-myristate 13-acetate (TPA)와 2, 2-diphenyl-1-picrylhydrazyl (DPPH), Griess reagent, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), 2,2’-azino-bis 3-ethylbenzenothiazolin-6-sulfonic acid (ABTS)는 Sigma Chemical (St. Louis, MO, USA)에서 각 각 구입하여 사용하였다. 그 외에 실험에 사용된 모든 시약 들은 일급 및 특급 시약을 구입하여 사용하였다.
2.2. 세리신 추출
완전히 건조시킨 세리신 분말에 5% 탄산나트륨 용액을 가하 고 80
oC에서 12시간 방치한 후 100
oC의 수욕에서 1시간 가열
시켰다. 실온으로 식힌 후 여과지를 사용하여 용해된 세리신 을 여과하였다. 그 후 황산 암모늄을 60%의 농도로 교반시 키면서 천천히 첨가하여 세리신 단백질을 염장시키고 원심 분리 (4
oC, 12,000 rpm, 20 분)하여 염장된 단백질을 분리하였 다. 그 후 1,000 Da cut-off 투석 파우치 (Spectum chemical Mfg. corp., NJ, USA)에 녹인 후 증류수에서 24시간 투석하 여 탈염을 시켰다. 탈염된 세리신 용액은 동결 건조하여 분 말로 제조하고 후속실험에 사용하였다.
2.3. 감마선 조사 세리신 제조
세리신 분말을 1.0 mg/mL의 농도로 증류수에 용해시키고 0.20 µL 여과필터 (Satorius, Göttingen, Germany)를 사용하여 여과한 다음 감마선을 조사하였다. 이때, 조사 선량은 5 kGy 단위로 0~40 kGy의 범위로 조사하였고, 조사온도는 25
oC였 다. 감마선 조사 후 세리신 용액을 4
oC에서 10,000 rpm으로 20분 동안 원심분리하고, 0.20 µL 여과필터를 통해 여과한 후 4
oC 에 냉장 보관하면서 후속 실험을 수행하였다.
2.4. 감마선 조사 세리신 단백질의 구조변화
감마선 조사 선량에 따른 세리신 단백질의 구조 변화를 파악 하기 위해 각 선량 별 동량의 단백질을 가진 세리신을 SDS- PAGE 로 분리한 후 silver staining kit (Silver Quest kit, Invitrogen, USA)를 이용하여 단백질 구조 변화를 확인하였 다. 또한 선량별 세리신 단백질의 흡광도의 변화는 microplate reader (Molecular device, CA, USA)를 사용하여 200~800 nm 범위에서 측정하여 구조 변화를 확인하였다.
2.5. 항산화 활성 측정
DPPH 라디칼 소거활성은 Blois 방법 [24]에 따라 96 well plate에 시료를 농도 별로 첨가한 다음 실험군에는 DPPH 시약 을, 대조군에는 메탄올을 첨가하여 microplate reader (Molecular device, CA, USA) 를 사용하여 560 nm에서 흡광도를 측정하 였다.
ABTS 라디칼 소거활성은 Re 등의 방법 [25]을 변형하여 사용하였다. 7 mM ABTS와 2.45 mM potassium persulfate를 암소에서 24시간 반응하여 라디칼을 형성시킨 후 증류수로 희석시키고 시료를 첨가하여 10분간 반응시킨 후 415 nm에 서 흡광도를 측정하였다. Superoxide anion 라디칼 소거활성 은 nitro blue tetrazolium (NBT) 환원법 [26]으로 측정하였다.
3 mM xanthine sodium salt와 0.6 mM NBT 용액, 15 mM Na
2- EDTA용액, 50 mM sodium phosphate buffer (pH 7.4)를 각각 혼합하고, 50 mM xanthine oxidase (0.1 units/mL)를 첨가하 였다. 5분간 차광한 후 37
oC에서 15분간 반응시켜 560 nm에 서 흡광도를 측정하였다.
2.6. 세포배양 및 세포생존율 측정
Melan-a cell 은 RPMI 1640에 10% FBS와 1% penicillin-
streptomycin, 200 nM TPA가 함유된 배지를 사용하여 37
oC,
5% CO
2incubator에서 배양하였다.
감마선 조사 세리신이 Melan-a 세포의 생존에 영향을 미치 는지 측정하기 위해 배양된 세포를 96 well plate에 각각 1×10
4cells/mL의 농도로 분주하고 감마선 조사량에 따른 시 료를 첨가한 후 CO
2incubator 에 배양하였다. 그 후 MTT 용 액 (5 mg/mL)을 첨가하여 반응시킨 뒤 dimethyl sulfoxide (DMSO)를 첨가하여 생성된 formazane의 흡광도를 540 nm 에서 측정하였다.
2.7. 멜라닌 합성 저해활성
감마선 조사 세리신이 멜라닌 합성에 미치는 영향을 측정하 기 위해 세포를 6 well plate에 5×10
4cells/mL의 농도로 분주 한 후 37
oC, 5% CO
2하에서 24시간 동안 배양하고 감마선 조 사량에 따른 시료를 처리해 72시간동안 재배양하였다. 그 후 1% triton-X 100이 들어있는 PBS용액으로 세포를 용해시켜 E-tube에 옮겨 담고 4
oC, 13,000 rpm에서 15분간 원심분리하 였다. 이때 상등액을 제거하고 cell pellet에 10% DMSO가 들 어있는 1 N NaOH 수용액을 첨가하여 65
oC 에서 1시간 동안 반응시킨 후 405 nm에서 흡광도를 측정하였다.
2.8. 세포 내 Tyrosinase 저해활성
세포 내 tyrosinase 저해활성을 측정하기 위해 상기 멜라닌 합성 저해활성 실험에서 제조된 상등액을 사용하였다. BCA protein assay kit (Thermo scientific, Waltham, MA, USA)로 동량의 단백질을 만든 후 96 well plate에 시료와 2 mg/mL의 L-3,4-dihydroxyphenylalanine (L-DOPA)를 넣고 37
oC에서 1 시간 동안 반응시킨 후 405 nm에서 흡광도를 측정하였다.
2.9. 멜라닌 합성 관련 단백질 발현 측정
감마선 조사 세리신이 멜라닌 합성 관련 단백질의 발현에 미 치는 영향을 측정하기 위해 tyrosinase, TRP-1, TRP-2, 이 효 소들의 전사인자인 MITF의 발현량 변화 및 시간별 발현량 변화를 western blot으로 분석하였다. 먼저 선량 별 시료를 처 리해 72시간동안 배양한 후 세포 내 단백질을 passive lysis buffer로 추출하고 세포용해물의 단백질 농도는 BCA protein assay kit를 사용하여 측정하였다. 단백질 (30 µg)을 10% sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) 로 분리한 후, nitrocellulose membrane에 분리된 단백질을 transfer하였다. 그 후 membrane를 1차 항체와 4
oC에서 12시 간 동안 반응시키고, membrane을 세척하고 HRP로 컨쥬게이 션된 2차 항체와 1시간 동안 실온에서 반응시켰다. 단백질 발현은 enhanced chemiluminescence (ECL) detection system (AI680, GE healthcare, Uppsala, Sweden)을 이용하여 분석하 였다.
2.10. 통계 처리
모든 실험결과는 평균 ± 표준편차로 표기하였으며, 각 군 간 의 통계적 유의성 검증은 SPSS 18.0 (SPSS Inc., IL, USA)을
이용한 Student’s t-test 및 SAS package를 사용하였으며, p값 이 0.05 미만일 때 통계적으로 유의하다고 판단하였다.
3. RESULTS AND DISCUSSION
3.1. 감마선 조사 세리신의 구조변화
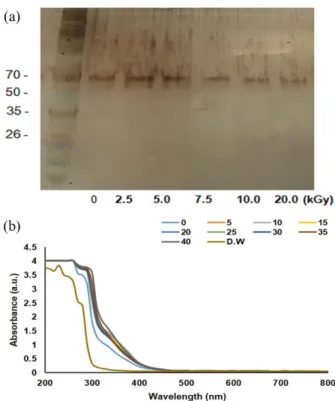
감마선 조사 선량에 따른 세리신의 분자적인 구조변화를 전 기영동 및 UV 스펙트럼으로 분석하였으며, 그 결과를 Fig. 1 에 나타내었다. 먼저 Fig. 1(a)에 나타낸 바와 같이 전기영동 패턴을 확인해본 결과 본 연구에 사용된 세리신은 70 kDa으 로 확인되었으며, 5 kGy이상의 감마선 조사 시 70 kDa 부근 의 패턴이 다소 감소하는 경향을 나타내었다. 뿐만 아니라 10 kGy 이상 조사한 세리신에서는 50~60 kDa 부근의 희미한 밴드가 사라지는 것을 확인하였다. 또한 UV 스펙트럼 결과 에서 5 kGy 이상의 감마선 조사 시 280 nm 부터 330 nm 영역 에서 최대의 흡광도를 나타내었다 (Fig. 1(b)). 보통 아미노산 은 200 nm범위에서 높은 흡광도를 나타내고, 트립토판, 티로 신, 페놀과 같은 방향족 아미노산은 280 nm에서 높은 흡광도 를 나타낸다고 알려져 있다 [27]. 따라서 감마선을 조사한 세 리신이 280 nm대에서 흡광도가 증가했다는 것은 감마선 조 사에 의해 단백질 구조의 분열이 일어나 방향족 아미노산 잔 기들이 바깥으로 노출되었을 것으로 사료된다. 상기 두 결과 를 통하여 세리신 단백질이 감마선 조사에 의해 구조적인 변 형이 일어났을 것으로 추론하였다.
Fig. 1. Effect of gamma-irradiated sericin protein on electrophoretic
pattern (a) and absorbance spectrum (b).
3.2. 감마선 조사 세리신의 항산화 활성
감마선 조사 세리신의 항산화 활성 변화를 측정하기 위하여 DPPH, ABTS 및 superoxide anion 라디칼 소거활성을 평가하 였으며, 각 조사 선량 별 세리신의 항산화 활성 (SC
50) 은 Table 1에 나타내었다. 선량별 라디칼 소거활성을 측정한 결과 DPPH 라디칼 소거활성은 감마선 조사 전후 큰 차이를 보이 지 않았으나 조사 선량이 30 kGy이상 높아질 경우 DPPH 라 디칼 소거활성이 오히려 낮아지는 것으로 확인되었다. 이때, 양성대조군인 L-ascorbic acid의 SC
50값은 2.81 µg/mL로 나타 났다. 또한 ABTS 라디칼 소거활성의 경우 감마선을 조사하 지 않은 세리신의 SC
50값이 56 µg/mL으로 나타난 것에 비해 감마선 조사 후 세리신의 SC
50값은 70 µg/mL이상으로 나타 나 DPPH 라디칼 소거활성 결과와 동일하게 선량이 증가할 수록 라디칼 소거활성은 낮아지는 것으로 나타났다. 이는 선 량에 따른 단백질의 3차원 구조변화에 의해 라디칼 소거활 성이 감소하는 것으로 사료된다. 이때 양성대조군인 butylated hydroxy anisole (BHA) 의 SC
50값은 3.26 µg/mL로 나타났다. Superoxide anion 라디칼 활성 또한 감마선 조사 후 오히려 감소하는 것으로 보아 감마선 조사가 세리신의 항 산화 활성에는 큰 영향을 주지 않는 것으로 사료된다.
3.3. 감마선 조사 세리신의 세포독성
감마선 조사 세리신의 Melan-a의 세포생존에 미치는 영향을 Fig. 2에 나타내었다. Melan-a 세포에 감마선 조사 세리신을 선량 별 100 µg/mL의 농도로 24시간, 48시간 동안 처리하였 을 때, 모두 90%이상의 생존율을 나타내어 세포에 미치는 독성은 없는 것으로 확인되었다. 따라서 멜라닌 합성 및 tyrosinase 저해활성 등의 세포실험에서 세리신의 처리 농도 는 100 µg/mL으로 결정하여 수행하였다.
3.4. 멜라닌 합성 및 Tyrosinase 저해활성
감마선 조사를 통해 구조가 변화된 세리신 단백질의 선량별 Melan-a 세포에서 멜라닌 합성과 멜라닌 합성의 주요 핵심 효소인 tyrosinase 활성에 미치는 영향을 측정하여 그 결과를 Fig. 3과 Fig. 4에 각각 나타내었다. 먼저 조사 선량 별 세리
Table 1. Effect of gamma-irradiated sericin protein on DPPH, ABTS, and superoxide anion radical scavenging
Dose of irradiated gamma
ray (kGy)
Antioxidant activity of sericin (SC50= μg/mL)
DPPH ABTS Superoxide
anion 0 49.07 ± 0.90e
056.28 ± 0.27
e048.17 ± 2.17
e 5 50.21 ± 3.58de079.62 ± 0.27
c055.97 ± 0.43
de 10 51.72 ± 1.19cd075.83 ± 0.24
d060.45 ± 0.56
c 15 44.14 ± 0.97f081.09 ± 0.32
c055.97 ± 5.75
d 20 52.73 ± 0.37cd091.76 ± 0.63
b085.61 ± 1.61
b 25 50.98 ± 0.37cd093.64 ± 1.32
b 109.53 ± 1.61b 30 58.30 ± 0.77c094.51 ± 0.74
b078.28 ± 1.95
b 35 59.23 ± 0.28b 100.11 ± 1.10a083.45 ± 0.66
b 40 76.13 ± 0.42a079.39 ± 0.16
c 109.37 ± 2.92aL-ascrobic acid
02.81 ± 0.01
f - -BHA -
003.61 ± 0.01
f -Quercetin - -
002.92 ± 0.01
fValues are the mean ± S.D. of triplicate experiments.
a-g
Means in the same column followed by different letters represent significant differences by dose of irradiated gamma ray (p<0.05)
Fig. 2. Effect of gamma-irradiated sericin protein on cell viability in Melan-a cells. Values are the mean ± S.D. of triplicate experiments (*p<0.05, ***p<0.001 compared with control).
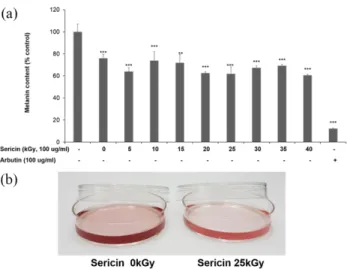
Fig. 3. Effect of gamma-irradiated sericin protein on melanogenesis in Melan-a cells. Intracellular melanin content (A) and containing culture samples (B). Cells were cultured with sericin and arbutin for 72 h. Values are the mean ± S.D. of triplicate experiments (*p<0.05, **p<0.01, ***p<0.001 compared with control).
Fig. 4. Effect of gamma-irradiated sericin protein on intracellular
tyrosinase activity in Melan-a cells. Cells were cultured with sericin
and arbutin for 72 h. Values are the mean ± S.D. of triplicate
experiments (*p<0.05, **p<0.01, ***p<0.001 compared with control).
신의 멜라닌 합성 변화를 측정한 결과 Fig. 3 (a)에 나타낸 바 와 같이 감마선 조사하지 않은 세리신은 대조군에 비해 약 25%정도 저해되었지만, 감마선 조사 후의 세리신은 대조군 에 비해 30% 이상 멜라닌 합성이 억제되는 것으로 나타났다.
특히, 25 kGy 조사 세리신은 대조군에 비해 약 40% 정도 저 해하여 가장 높은 멜라닌 합성 저해활성을 나타내었다. 또한 감마선 조사하지 않은 세리신과 25 kGy의 선량으로 조사한 세리신을 처리한 세포에서 배양액의 색을 비교하였을 때, Fig. 3 (b) 에서 나타낸 바와 같이 감마선 조사하지 않은 세리 신에 비해 25 kGy 조사 세리신의 배양액이 확연하게 연해져 멜라닌 생성이 감소되는 것을 시각적으로 확인하였다. 이들 결과는 Melan-a 세포에서 당삼 열수 추출물을 100 µg/mL의 농도를 처리했을 경우 대조군에 비해 멜라닌 합성을 약 33%
저해하였다는 이전 연구 [28]와 비교할 때, 감마선 조사 세리 신의 멜라닌 합성 저해 활성이 더 높은 것으로 판단된다.
Tyrosinase는 멜라닌 합성의 초기 경로를 담당하는 주된 효 소로 잠재적인 멜라닌 생성 억제제의 스크리닝을 위한 효소 로 널리 사용되어왔다 [29]. 조사 선량 별 세리신의 세포내 tyrosinase 활성을 측정한 결과 감마선을 조사하지 않은 세리 신과 조사를 한 세리신 모두 대조군에 비해 활성이 약 10%
가량 감소를 하였지만, 조사 선량 별 유의한 차이는 보이지 않았다 (Fig. 4). 따라서 Melan-a 세포에서 감마선 조사 세리 신의 멜라닌 합성 저해에는 tyrosinase 활성이 주된 영향을 미치지 않은 것으로 사료된다. 이는 B16F10 melanoma 세포 에서 곰보배추 에탄올 추출물을 처리하였을 때 tyrosinase 활 성에는 직접적인 억제작용을 보이지 않았으나 세포내 멜라 닌 생성을 대조군에 비해 약 30%억제하여 미백효과를 보인 연구와 매우 유사한 결과를 나타내었다 [30].
3.5. 멜라닌 합성 관련 단백질 발현
MITF는 melanocyte의 증식과 분화에 관여하며 멜라닌 합성 관련 효소인 tyrosinase와 TRP-1, TRP-2의 발현을 높이거나 낮춤으로써 멜라닌 합성 기전에 중요한 조절인자로 작용하 고 있다 [31]. 감마선 조사 세리신이 멜라닌 합성을 저해하는 것으로 나타났기 때문에 멜라닌 합성 기전과 관련된 단백질 의 발현 변화를 살펴보기 위해 Melan-a 세포에 조사 선량 별 세리신을 72시간 동안 처리한 후 단백질 발현을 확인하였으 며 그 결과를 Fig. 5 (a)에 나타내었다. 그 결과 25 kGy 조사 세리신의 경우 MITF 발현을 대조군에 비해 유의적인 수준 으로 감소시켰으며, 그 타겟 단백질인 TRP-2의 발현 또한 대 조군보다 더 낮게 감소되는 것으로 나타났으나 TRP-1에는 영향이 없는 것으로 나타났다 (Fig. 5(a)). 또한, 25 kGy 조사 세리신에 대하여 각 인자들의 단백질 발현을 시간별로 확인 하였을 때 MITF와 TRP-2의 발현은 시료의 처리시간이 증가 됨에 따라 효과적으로 감소되었으나 TRP-1에는 영향이 없 는 것으로 나타났다 (Fig. 5(b)). Alam 등 [29]은 Scolopendra subspinipes mutilans에서 분리한 Jineol을 melan-a 세포에 처 리 후 MITF와 그 하위 유전자의 발현을 관찰한 연구에서 MITF 및 Tyrosinase, TRP-1, TRP-2의 단백질 수준을 대조군
에 비해 유의적으로 감소시키는 것으로 나타났고, 시간별로 관찰했을 때 시료 처리 후 24시간에서 MITF의 발현을 효과 적으로 감소시켜 멜라닌 생성을 억제한다고 보고하였다. 따 라서 본 연구의 결과는 감마선 조사 세리신이 MITF와 TRP- 2 단백질의 발현을 억제하여 멜라닌 생성을 저해하는 것으 로 사료된다.
3.6. p38 및 MAPK 신호전달 경로에 미치는 영향
MITF는 다양한 신호전달 경로에 의해 조절되는데, 그 중
cyclic adenosine monophosphate (cAMP)-protein kinase A
(PKA)-cAMP responsive element binding (CREB) protein-CREB
binding protein (CBP) 기전이 MITF의 발현을 증가시키는 주
된 경로 중 하나이다 [32]. 또한 extracellular signal-regulated
kinase (ERK), c-Jun NH
2-terminal kinase (JNK), p38을 포함
하는 mitogen-activated protein kinase (MAPK) 경로는 인산
화를 통해 MITF를 증가시켜 멜라닌 생성을 상향 조절할 수
있다 [32,33]. 본 연구에서는 감마선 조사 세리신의 MITF 발
현 억제가 MAPK 신호전달 경로를 통해 이루어지는지 알아
보기 위해 p38/MAPK 단백질의 인산화를 통해 확인하였고
그 결과를 Fig. 6에 나타내었다. Fig. 6에 나타난 바와 같이
Fig. 5. Effect of gamma-irradiated sericin on melanogenesis
protein expression (a) and expression for the indicated times (0, 6,
12, 24 hrs) (b) in Melan-a cells. Western blot analysis was
performed to detect the protein levels of microphthalmia-
associated transcription factor (MITF), Tyrosinase related protein-
1 (TRP-1), TRP-2 and phosphorylated p38 in Melan-a cells after
treatment with GIS for 72h or indicated times.
25 kGy 조사 세리신을 제외한 나머지 세리신 처리군에서는 p38/MAPK 단백질의 인산화와 멜라닌 생성 관련 효소인 TRP-1 및 TRP-2의 발현과는 상호 연관성이 없는 것으로 나 타난 반면에 25 kGy 조사 세리신은 p38의 인산화가 대조군 에 비해서도 낮은 것으로 나타났다. 이러한 결과는 25 kGy 감마선 조사 세리신의 경우 p38/MAPK 인산화 저해를 통한 TRP-2/MITF 발현 억제 경로에 의해 멜라닌 합성을 저해하 는 것으로 사료된다. 이와 같은 결과는 이 등 [34]이 보고한 Beauvericin 의 멜라닌 생성억제에 MAPKs 기전이 관여하는 지 여부를 조사한 연구에서 ERK 및 JNK의 인산화 수준에는 영향을 미치지 않았지만 p38의 인산화 수준을 감소시켜 beauvericin 이 p38/MAPK 신호전달 경로를 억제함으로써 멜 라닌 생성을 억제한다는 결과와 유사한 결과로 사료된다.
4. CONCLUSION
본 연구에서는 감마선 조사 선량 별 세리신 단백질의 구조변 화 및 항산화 활성과 Melan-a 세포에서 미백효과를 알아봄 으로써 기능성 미백 화장품 소재로서의 활용가능성을 확인 하였다.
먼저, 세리신의 조사 선량 별 구조변화를 전기영동 패턴과 흡광도 변화로 확인하였다. 그 결과 5 kGy 이상의 감마선 조 사시 70 kDa 부근의 밴드가 감소하는 경향을 보였고, 280~
300 nm영역에서 흡광도가 최대로 증가하였다. 이를 통해 세 리신 단백질이 감마선 조사에 의해 구조적인 변형이 일어난 것으로 사료된다.
세리신의 조사 선량 별 항산화 활성은 감마선 조사 전 보다 감마선 조사 후 오히려 소거활성이 낮아지는 것으로 나타나 감마선 조사가 세리신 단백질의 항산화 활성에는 영향을 미 치지 않은 것으로 확인되었다.
또한, 감마선 조사 세리신의 미백활성을 알아보기 위해 Melan-a 세포에서 멜라닌 합성 및 tyrosinase 활성을 측정하 였고, 멜라닌 생성에 관련된 단백질 발현 여부를 측정하였
다. 그 결과, 멜라닌 합성은 감마선 조사 유무와 상관없이 100 µg/mL의 농도에서 대조군에 비해 20% 이상 저해되었다.
특히, 25 kGy 조사한 세리신은 대조군에 비해 약 40%정도 저해되어 가장 높은 멜라닌 합성 저해활성을 나타내었으며, 이는 배양액 색으로도 뚜렷하게 관찰되었다. Tyrosinase 저 해활성은 멜라닌 합성 저해 패턴과는 달리 유의적인 차이를 나타내지 않았으며, 이는 감마선 조사 세리신의 멜라닌 합성 저해활성에 tyrosinase 활성이 직접적인 영향은 주지 않는 것 으로 사료된다.
감마선 조사 세리신의 멜라닌 합성 저해에 대한 기전을 알 아보기 위해 멜라닌 합성 관련 인자들의 단백질 발현을 살펴 본 결과, MITF는 25 kGy 조사한 세리신에서 다른 시료들에 비해 대조군 수준으로 감소하였고, TRP-2의 발현은 25 kGy 조사한 세리신이 대조군보다 낮은 발현을 보였다. 이와 관련 해 25 kGy 조사 세리신의 처리 시간별 인자들의 단백질 발현 을 측정하였을 때, MITF와 TRP-2 발현이 처리시간이 증가 함에 따라 효과적으로 감소한 것을 확인하였다. 또한, MITF 의 상위인자인 MAPK 기전을 조사 선량 별로 관찰한 결과 25 kGy 감마선 조사 세리신이 인산화된 p38의 발현을 억제 하는 것으로 확인되었다.
따라서 감마선 조사 세리신은 p38/MAPK 기전의 저해를 통해 TRP-2/MITF 발현을 억제함으로써 멜라닌 합성을 저해 하는 미백효과를 나타내므로 천연 미백 기능성 소재로서의 활용가능성이 있을 것으로 사료된다.
ACKNOWLEDGEMENTS
This research was supported by Radiation Technology Development (No. HI14C0368) of National Research Foundation of Korea (NRF) funded by the Ministry of Science and ICT.
REFERENCES
1. Ebanks, J. P., R. R. Wickett, and R. E. Boissy (2009) Mechanisms regulating skin pigmentation: the rise and fall of complexion color- ation. Int. J. Mol. Sci. 10: 4066-4087.
2. Gillbro, J. M. and M. J. Olsson (2011) The melanogenesis and mechanisms of skin-lightening agents-existing and new approaches.
Int. J. Cosmet. Sci. 33: 210-221.
3. Lin, J. Y. and D. E. Fisher (2007) Melanocyte biology and skin pigmentation. Nature 445: 843-850.
4. Park, H. Y., M. Kosmadaki, M. Yaar, and B. A. Gilchrest (2009) Cellular mechanisms regulating human melanogenesis. Cell Mol.
Life Sci. 66: 1493-1506.
5. Costin, G. E. and V. J. Hearing (2007) Human skin pigmentation:
melanocyte modulate skin color in response to stress. FASEB J. 21:
976-994.
6. Kan, H. Y., T. J. Yoon, and G. J. Lee (2011) Whitening effects of maring Pesudomonas extract. Ann. Dermatol. 23: 144-149.
Fig. 6. Effect of gamma-irradiated sericin on protein expression of
phosphorylation MAPK/p38 in Melan-a cells. Western blot was
carried out to detect the protein levels of phosphorylated p38 and
mitogen-activated protein kinase (MAPK) in Melan-a cells after
treatment with gamma-irradiated sericin (GIS) for 72 h.
7. Cheli, Y., M. Ohanna, R. Ballotti, and C. Bertolotto (2010) Fifteen- yeer quest for microphtalmia-associated transcription factor target genes. Pigment Cell Melanoma Res. 23: 27-40.
8. Hsiao, J. J. and D. E. Fisher (2014) The roles of microphtha-asso- ciated transcription factor and pigmentation in melanoma. Arch.
Biochem. Biophys. 563: 28-34.
9. Malick, S., S. K. Singh, C. Sarkar, B. Saha, and R. Bhadra (2005) Human placental lipid induces melanogenesis by increasing the expression of tyrosinase and its related proteins in vitro. Pigment Cell Res. 18: 25-33.
10. Cooksey, C. J., P. J. Garratt, E. J. Land, C. A. Ramsden, and P. A.
Riley (1998) Tyrosinase kinetics: failure of the auto-activation mechanism of monohydric phenol oxidation by rapid formation of a quinomethane intermediate. J. Biochem. 333: 685-691.
11. Briganti, S., E. Camera, and M. Picardo (2003) Chemical and instrumental approaches to treat hyperpigmentation. Pigment Cell Res. 16: 101-110.
12. Byun, E. B., N. Y. Sung, S. K. Kwon, B. S. Song, J. H. Kim, et al.
(2009) In vitro and in vivo studies on the cytotoxicity of irradiated silk fibroin against mouse melanoma tumor cell. Radiat. Phys.
Chem. 78: 429-431.
13. Kim, M. H. (2015) Preparation and Characterization of silk fibroin hydrogel by irradiation. Master’s degree. Thesis. Chun- gnam National University, Daejeon, Korea.
14. Aramwit, P., T. Sirtientong, and T. Srichana (2012) Potential appli- cations of silk sericin, a natural protein from textile industry by- products. Waste Manag. Res. 30: 217-224.
15. Vogeli, R., J. Meier, and R. Blust (1993) Sericin silk protein, unique structure and properties. Cosmetics Toilerties. 108: 101-108.
16. Engel, W., U. Hoppe, U. W. Pape, and G. Sauermann (1987) Eigenschaften eines sericin haltigen puffernden shampoos. Arztl Kosmetal. 17: 91-110.
17. Gregory, H. A., F. Diaz, J. Caroline, C. Tora, L. H. Rebecca, et al.
(2003) Silk based biomaterials. Biomaterials 24: 401-416.
18. Oh, H., J. Y. Lee, A. Kim, C. S. Ki, J. W. Park, et al. (2007) Prepa- ration of silk sericin beads using LiCl/DMSO solvent and their potential as a drug carrier for oral administration. Fiber polym. 8:
470-476.
19. Kundu, S. C., B. C. Dash, R. Dash, and D. L. Kaplan (2008) Natu- ral protective glue protein, sericin bioengineered by silkworms:
potential for biomedical and biotechnological applications. Prog- ress in Polymer Science 33: 998-1012.
20. Oh, H., J. Y. Lee, M. K. Kim, I. C. Um, and K. H. Lee (2011) Refining hot-water extracted silk sericin by ethanol-induced pre- cipitation. Int. J. Biol. Marcomol. 48: 32-37.
21. Kim, M. K., H. W. Kwak, J. Y. Lee, H. Yun, M. H. Kim, and K. H.
Lee (2012) Effect of lyoprotectant on the solubility and structure of
silk sericin. Int. J. Indust. Entomol. 25: 133-137.
22. Lee, K. G., J. H. Yeo, Y. W. Lee, H. Y. Kweon, and J. H. Kim (2001) Bioactive and skin-compatible properties of silk sericin.
Korean J. Seric. Sci. 43: 109-115.
23. Byun, M. W. (1994) Application of irradiation techniques to food industry. Radioisotope News 9: 32-37.
24. Blois, M. S. (1958) Antioxidant determinations by the use of a sta- ble free radical. Nature 29: 1199-1200.
25. Re, R., N. Pellegrini, A. Proteggente, A. Pannala, M. Yang, and C.
Rice-Evans (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med.
26: 1231-1237.
26. Richmond, R., B. Haliwell, J. Chauhan, and A. Dabre (1981) Superoxide-dependent formation of hydroxyl radicals: Detection of hydroxyl radicals by the hydroxylation of aromatic compound.
Anal. Biochem. 118: 328-330.
27. Kumari, M., U. K. Singh, I. Beg, A. M. Alanazi, A. A. Khan, and R. Patel (2018) Effect of cations and anions of ionic liquids on the stability and activity of lysozyme: Concentration and temperature effect. J. Mol. Liq. 272: 253-263.
28. Park, H. J., S. H. Ahn, W. Y. Choi, G. W. Lee, M. J. Kwon, and Y.
H. Cho (2019) Changes in whitening activity of Codonopsis pilo- sula extracts according to extraction solvents. KSBB J. 34: 1-9.
29. Alam, M. B., V. K. Bajpai, J. I. Lee, P. Zhao, J. H. Byeon, et al.
(2017) Inhibition of melanogenesis by jineol from Scolopendra subspinipes multilans via MAP-Kinase mediated MITF downreg- ulation and the proteasomal degradation of tyrosinase. Sci. Rep. 7:
45858, DOI: 10.1038/srep15858.
30. Lim, H. N. (2015) Whitening effect of salvia plebeia Herb ethanol extracts. Master’s degree. Thesis. Chung-ang University, Seoul, Korea.
31. Choe, Y. S. and T. B. Choe (2014) Melanogenesis inhibitory effects of Allium hookeri extract in B16F10 mouse melanoma cell.
Kor. J. Aesthet. Cosmetol. 12: 163-168.
32. Hwang, Y. S., Y. J. Kim, M. O. Kim, M. Kang, S. W. Oh, et al.
(2017) Cannabidiol upregulates melanogenesis through CB1 dependent pathway by activating p38 MAPK and p42/44 MAPK.
Chem. Biol. Interact. 273: 107-114.
33. Cheon, S. Y., K. S. Chung, E. Jeon, A. Nugroho, H. J. Park, and H.
J. An (2015) Anti-inflammatory activity of Saxifragin via inhibi- tion of NF-kB involves caspase-1 activation. J. Nat. Prod. 78:
1579-1585.
34. Lee, S. E., S. H. Park, S. W. Oh, J. A. Yoo, K. Kwon, et al. (2018) Beauvericin inhibits melanogenesis by regulating cAMP/PKA/
CREB and LXR-α/p38 MAPK-mediated pathways. Sci Rep. 8:
14958, DOI: 10.1038/s41598-018-33352-8.