서 론
호산구증가증(eosinophilia)은 말초혈액의 호산구가 500/μL 이상으로 증가된 경우로[1], 대부분 기생충감염, 알레르기질환, 각종 약물에 대한 알레르기반응, 교원성질환, 암 및 내분비질환 등에 의해 이차적으로 발생한다[2]. 호산구증가증은 크게 이차적 호산구증가증, 골수의 클론성질환과 동반된 호산구증가증 및 과 다호산구증가증후군(hypereosinophilic syndrome)의 3가지
185 DOI 10.3343/kjlm.2009.29.3.185
185 185 185 Received :October 30, 2008 Manuscript No :KJLM2188 Revision received :May 24, 2009
Accepted :May 26, 2009
Corresponding author :Dong-Wook Ryang, M.D.
Department of Laboratory Medicine, Chonnam National University Medical School, 8 Hak 1-dong, Dong-gu, Gwangju 501-757, Korea
Tel : +82-62-220-5340, Fax : +82-62-224-2518 E-mail : dwryang@jnu.ac.kr
*This work was supported by the Korea Science and Engineering Foundation (KOSEF) grant funded by Korea government (MEST) (No. R01-2008-000- 10620-0).
일개 대학병원 환자에서 과다호산구증가증의 빈도 및 원인 분석
Incidence and Causes of Hypereosinophilia in the Patients of a University Hospital
Da-Woon Kim, M.D., Myung-Geun Shin, M.D., Hyeong-Kee Yun, M.D., Soo-Hyun Kim, M.D., Jong-Hee Shin, M.D., Soon-Pal Suh, M.D., and Dong-Wook Ryang, M.D.
Department of Laboratory Medicine, Chonnam National University Medical School, Gwangju, Korea 김다운∙신명근∙윤형기∙김수현∙신종희∙서순팔∙양동욱
전남대학교 의과대학 진단검사의학교실
Background : Eosinophilia may be associated with various primary and reactive conditions. The incidence and the causes of eosinophilia might have been changed according to the changes in the incidence of diseases such as cancer, chronic degenerative diseases, etc. We have conduct- ed a retrospective study to investigate the incidence and causes of eosinophilia.
Methods : Eosinophilia and hypereosinophilia were defined when absolute eosinophil count was greater than 500/μL and 1,500/μL, respectively. Patient’s clinical records were reviewed to find out the underlying clinical conditions responsible for causes of hypereosinophilia. Conventional chro- mosomal analysis, reverse transcriptase PCR and FISH for gene rearrangement were performed to check the presence of clonal eosinophilia.
Results : Out of 41,137 patients who had a hematology profile performed, 5,019 (12.2%) and 373 patients (0.9%) were found to have eosinophilia and hypereosinophilia, respectively. Among patients with hypereosinophilia, 227 patients (60.9%) had identifiable and/or possible causes. The major causes of hypereosinophilia were malignancy (35.2%), allergy and skin diseases (18.1%), infec- tious diseases (15.4%), hepatobiliary diseases (7.5%), bone marrow clonal diseases (6.6%) and parasite infections (6.6%). We also found a rare case of FIP1L1-PDGFRαpositive chronic eosinophilic leukemia combined with light chain multiple myeloma.
Conclusions : We found a difference in the distribution of causes of hypereosinophilia in compar- ison with previous Korean studies, and the most common cause of hypereosinophilia in the current study was malignancy. A rare case of clonal eosinophilia (chronic eosinophilic leukemia) associated with multiple myeloma was confirmed using molecular studies. (Korean J Lab Med 2009;29:185-93)
Key Words : Incidence, Cause, Eosinophilia, Hypereosinophilia
범주로 나뉘어지는데[3], 다양한 원인에 의해 발생할 수 있기 때 문에 임상적으로 그 원인을 밝히기 어려운 경우가 많다.
호산구증가증의 원인의 분포양상은 대상군 및 시기에 따라 다 름이 보고되었다. 1988년 정 등[4]에 따르면 주로 세균감염 및 기생충질환이 원인이었는데 반해, 1996년 신 등[5]은 알레르기 질환이 가장 많다고 보고하였다. 한편, 최근 암 유병률의 급증과 다양한 식품 및 약제복용이 증가함에 따라 국내 호산구증가증의 빈도 및 원인 또한 과거와는 다른 양상을 보일 것으로 생각된다.
이에 저자들은 일정기간 대학병원의 외래 및 입원환자를 대상 으로 호산구증가증의 빈도 및 추정원인을 분석하고 각 원인 질 환별로 호산구증가증의 정도를 비교하고자 하였다. 또한, 본 연 구와 연관되어 검출된 희귀한 다발성골수종과 함께 병발한 만성 호산구백혈병의 분자유전학적 소견을 보고하는 바이다.
대상 및 방법
1. 대상2007년 1월부터 동년 6월까지 전남대학교병원 및 화순전남 대학교병원에 내원하여 일반혈액검사를 시행한 환자를 대상으 로 하였다. 호산구증가증은 자동혈액분석기를 이용하여 측정한 말초혈액 호산구 수가 500/μL 이상인 경우로 정의하였다. 말초 혈액 호산구 수에 따라 500-1,500/μL인 경우를 경도, 1,500- 5,000/μL을 중등도, 5,000/μL 이상을 중증 호산구증가증으로 각각 구분하였고[3], 중등도 및 중증 호산구증가증을 보이는 환 자군을 대상으로 의무기록을 통해 임상적 특성을 후향적으로 조 사하여 가능한 원인질환으로 악성종양, 알레르기 및 피부질환, 세균 및 기생충감염증, 간담췌질환, 호산구증가증이 동반되는 폐질환 및 골수의 클론성질환 등이 있는지를 확인하였다. 호산 구증가증의 원인을 알기 위해 일반혈액검사, 대변 충란검사, 혈 청 IgE, 간흡충, 폐흡충, 스파르가눔 및 유구낭미충에 대한 혈청 항체검사 및 골수검사와 방사선검사 등의 결과를 검토하였다.
2. 진단세포분자유전학적 검사
임상적으로 클론성 호산구증가증이 강력하게 의심된 34예에 서 골수검체에서 염색체 검사 및FIP1L1-PDGFRα(FIP1-like- 1-platelet-derived growth factor receptor-α) 유전자재배 열을 확인하기 위한 형광제자리부합법(FISH) 및 역전사중합효 소연쇄반응(reverse transcriptase PCR, RT-PCR) 검사를 시 행하였다. 이 검사들에서FIP1L1-PDGFRα유전자재배열이 양
성으로 검출된 1예에서 직접염기서열분석을 시행하여 최종 확진 하였다.
1) 염색체 검사
골수 염색체 검사는 골수세포를 48시간 배양하여 콜세미드 처 리 후 G-분염법으로 염색하여 관찰하였다. 핵형분석은 인체세 포유전학명명법에 관한 국제규약(International Systems for Human Cytogenetic Nomenclature, ISCN) 2005 [6]를 따랐다.
2) FIP1L1-PDGFRα유전자재배열 분자유전학 검사
환자의 간기세포를 대상으로 LSI 4q12 Tricolor, Rearrange- ment Probe (Vysis, Downers Grove, IL, USA)를 이용하여 FISH를 시행하였다. 염색체 슬라이드와 탐색자(probe)의 DNA 변성 및 보합 결합과정을 거친 뒤 검출은 형광현미경으로 300개 의 세포를 분석하였고, 각 세포당 나타나는 형광 신호(signal) 수 를 분석하였다.
RT-PCR을 시행하여FIP1L1-PDGFRα융합유전자를 확인 하였다. 1차 PCR은 FIP1L1-F1 (5′ACCTGGTGCTGATCT- TTCTGAT)와 PDGFRα-R1 (5′TGAGAGCTTGTTTTCACT- GGA)를 이용하였고, 2차 PCR을 위해 FIP1L1-F2 (5′AAAG- AGGATACGAATGGGACTTG)와 PDGFRα-R2 (5′GGGAC- CGGCTTAATCCATAG)를 사용하였다.
융합유전자의 융합부위를 확인하기 위하여 RT-PCR에서 얻 어진 융합유전자를 ABI Prism 3100 genetic Analyzer (Applied Biosystems, Foster City, CA, USA) 및 BigDye terminator v3.1 ready reaction kit (Applied Biosystems, Foster City, CA, USA)를 이용하여 분석하였다. 직접염기서열분석에 사용 한 시발체는 nested RT-PCR에서 사용된 2차 PCR에서 사용 된 시발체를 이용하였다.
결 과
1. 호산구증가증의 빈도연구 기간 중 일반혈액검사를 시행한 환자는 모두 41,137명이 었다. 이 중 호산구증가증을 보인 환자는 5,019명(12.2%)이었다.
전체 호산구증가증 환자 중 1,500/μL 미만의 경도의 호산구증 가증을 보인 환자는 92.5%이었고, 1,500/μL 이상 5,000/μL 미 만의 증등도 호산구증가증이 6.8%, 그리고 5,000/μL 이상의 중 증 호산구증가증이 0.7%였다.
2. 중등도 및 중증 호산구증가증의 원인분석
중등도 및 중증 호산구증가증 환자는 모두 373명으로 전체 외 래 및 입원 환자의 0.9%였고, 평균나이 52세(범위: 0-87세), 남 녀 비는 약 2.51:1이었다.
1) 원인을 추정할 수 있었던 경우
전체 374예 중 227예(60.9%)에서 원인을 추정할 수 있었는 데, 악성종양 80예(35.2%), 알레르기, 약물반응 및 피부질환 41 예(18.1%), 감염증 35예(15.4%), 간담췌 질환 17예(7.5%), 골수 의 클론성질환 15예(6.6%) 및 기생충감염 15예(6.6%)로서 이들 6종류가 추측 가능한 원인의 89.4%를 차지하였다. 그 외 폐질환 13예(5.7%), 혈액투석 및 복막투석을 시행하는 말기신부전 8예
(3.5%), 과민성대장증후군 2예 및 크론병 1예가 있었다(Table 1).
악성종양은 대장암 12예, 위암 10예 등 위장관계 악성종양이 25예였으며, 폐암 14예, 갑상선암 5예, 유방암 5예, 간암 4예, 신 장암 3예, 방광암 3예, 담낭암 2예 등 80예의 악성종양에서 중등 도 이상의 호산구증가증을 보였다. 감염증에는 폐렴 12예, 폐결 핵 4예를 포함한 결핵성 및 비결핵성 미코박테륨 감염이 7예 포 함되었고, 조직학적으로 확진된 폐아스페르길루스증 1예, 급성 췌장염 1예, 봉소염 1예, 기타 감염이 동반되었을 것으로 추정되 는 질환이 9예 포함되었다. 알레르기질환은 기관지천식과 알레 르기비염이 각각 13예 및 7예로 대부분을 차지하고 있었고 그 외 아토피피부염 5예, 접촉성피부염이 2예 있었으며, 약물과 관련 된 호산구증가증이 7예였다. 간담도계질환으로는 만성간염 5예, 간경변 2예, 알코올성간염 2예, 담관염 2예, 독성간염 2예, 호산
Causes N of patients Causes N of patients
1. Malignant diseases 80 (35.2%)
GI tract 25
Lung 14
Breast 5
Thyroid gland 5
Lymphoma 5
Liver 4
Bladder 3
Head and neck 3
Kidney 3
Gallbladder cancer 2
Genital malignancy 2
Musculoskeletal malignancy 2
Nasal cavity 2
Adrenal gland 1
Brain 1
Ovary 1
Thymus 1
Uterine cervix 1
2. Allergy and skin diseases 41 (18.1%)
Bronchial asthma 13
Allergic rhinitis 7
Drug reaction 7
Atopic dermatitis 5
Other skin disease 5
Contact dermatitis 2
Angioedema 1
Other 1
3. Infections 35 (15.4%)
Pneumonia 12
Mycobacterium infection 7
Enteritis 2
Septic arthritis 2
Others 12
4. Hepatobiliary diseases 17 (7.5%)
Chronic hepatitis 5
Alcoholic hepatitis 2
Cholangitis 2
Eosinophilic abscess 2
Liver cirrhosis 2
Toxic liver disease 2
Acute viral hepatitis 1
Gallbladder empyema 1
5. Hematologic malignancies (clonal) 15 (6.6%)
Acute myeloid leukemia 4
Chronic myelogenous leukemia 4
Essential thrombocythemia 2
Myelodysplastic syndrome 2
Chromic eosinophilic leukemia with multiple myelooma 1
Atypical CML 1
Polycythemia vera 1
6. Parasite infections 15 (6.6%)
Clonorchis sinensis 10
Paragonimiasis 4
Sparganum 1
7. Lung diseases 13 (5.7%)
COPD 6
Pulmonary eosinophilia 3
Churg-strauss syndrome 3
Reumatoid lung disease 1
8. ESRD with dialysis 8 (3.5%)
Hemodialysis 4
Peritoneal dialysis 4
9. Irritable bowel syndrome 2 (0.9%)
10. Crohn’s disease 1 (0.4%)
Total 227
Table 1. Identifiable and/or possible causes of eosinophilia
Abbreviations: GI, gastrointestinal; COPD, chronic obstructive pulmonary disease; ESRD, end stage renal disease.
구성간농양 2예 있었으며, 급성간염 및 담낭농양이 각각 1예였 다. 골수의 클론성질환은 급성골수구성백혈병 및 만성골수구성 백혈병이 각각 4예, 골수형성이상증후군 2예, 진성혈소판증가 증 2예, 진성적혈구증가증 1예, 비정형만성골수구성백혈병 1예, 다발성골수종이 동반된 만성호산구백혈병이 1예였다. 기생충감 염은 간흡충 10예, 폐흡충 4예, 스파르가눔 1예로 호산구증가증 의 6.6%를 차지하였다. 폐질환은 만성폐쇄성폐질환 6예, 추적 관찰에서 호산구 수가 정상화되고 폐병변이 호전되었던 폐호산 구증가증(pulmonary eosinophilia) 3예, 조직학적으로 확진된 Churg-strauss 증후군 3예 및 류마토이드폐질환 1예였다.
원인 진단군의 혈액학적 소견은 평균 혈색소치는 12.9 g/dL, 평균 혈소판 수 290,000/μL, 평균 백혈구 수 14,871/μL, 평균 호 산구백분율 24.0%, 평균 호산구 수 3,120/μL이었다. 각 원인별 호산구 수는 악성종양이 3,218/μL, 감염증 2,759/μL, 알레르기질 환 3,102/μL, 간담췌질환 1,971/μL, 골수의 클론성질환 4,074/
μL, 기생충감염이 5,064/μL로 기생충감염에서 가장 높은 수치를 보였고 간담췌질환에서 가장 낮은 수치를 보였다(Table 2).
2) 원인을 알 수 없었던 경우
원인을 알 수 없었던 경우는 전체 373예 중 146예(39.1%)이었 다. 일반혈액검사 소견은 평균 혈색소 13.8 g/dL, 평균 혈소판 수 270,000/μL, 평균 백혈구 수 10,772/μL, 평균 호산구백분율 23.1%, 평균 호산구 수 2,563/μL이었다.
원인불명군 146예 중 87.0%에 해당하는 127예는 일반혈액검 사를 재검하거나 호산구증가증에 대한 원인분석을 위한 검사를 시행하지 않았다. 146예 중에 19예는 알레르기질환, 기생충감염 및 기타 감염성질환에 대한 광범위한 검사를 시행하였으나 특정
한 원인을 찾지 못하고, 과다호산구증가증후군 의심하에 골수 검사와 장기침범 여부를 방사선검사로 확인하고 혈액종양내과 에서 추적관찰 중이다.
3. 클론성 호산구증가증
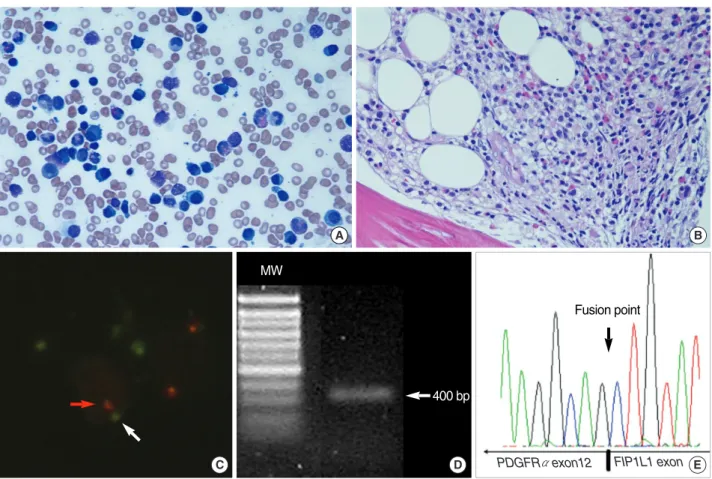
클론성 호산구증가증이 의심되었던 환자 34예 중 1예에서 FIP1L1-PDGFRα유전자재배열이 FISH 및 RT-PCR로 확인 되었으며, 이를 직접염기서열분석으로 확진하였다(고찰참조, Fig. 1).
고 찰
말초혈액의 호산구 수는 개인에 따라 차이가 있지만, 정상성인 의 경우 일반적으로 400/μL을 넘지 않고 신생아의 경우 성인보 다 좀 더 높다[2]. 또한 호산구 수는 나이뿐 아니라 운동이나 여러 질병상태 등에 의해서도 변화가 심하고, 호르몬 변화, 스테로이 드, 베타 교감신경 자극 물질에 의해 감소한다. 생리적으로 일중 변화가 커서 오전 중에 높고, 오후에 가장 낮은 수치를 보이는데, 이는 스테로이드의 일중 농도와 관련이 있다[2]. 건강한 성인에서 호산구의 절대수는 보고자마다 다양하여, Whitby 및 Britton [7]
은 0-400/μL, Wintrobe [8]는 0-570/μL, Orfanakis 등[9]은 0-700/μL, Zacharski 등[10]은 0-492/μL로 각각 보고하였다.
호산구 증가의 정의는 Toe 등[11]이 400/μL 이상, Wykoff [12]
는 500/μL 이상을 호산구증가증으로 정의하였고, 본 연구에서는 500/μL 이상을 호산구증가증으로 하였다.
호산구증가증의 원인으로는 크게 특발성 호산구증가증과 비 특발성 호산구증가증으로 구분되고 비특발성 호산구증가증은 클론성 호산구증가증과 이차적 호산구증가증으로 구분할 수 있 다[3]. 특히 젊은 환자에서의 클론성 호산구증가증은 골수이식 및 조혈모세포이식 등의 치료로 완치를 꾀할 수 있기 때문에, 클 론성을 증명하여 클론성 호산구증가증을 진단하기 위한 새로운 검사들이 개발되고 있다.
이차적 호산구증가증을 유발하는 질환으로는 기생충질환과 알레르기질환이 가장 흔하며 그 외 악성종양, 세균 및 진균, 바 이러스감염 등이 있다. 전 세계적으로 가장 흔한 이차적인 호산 구증가증은 회충류(선충류), 촌충류 및 흡충류 등의 기생충이 조 직에 침범하였을 때이다[13]. 일반적으로 조직침습을 하지 않고 낭이 파열되지 않아 장관 내나 완전한 낭에 고립되어 있는 기생 충은 말초혈액의 호산구증가증을 일으키지 않는다[14]. 본 연구 에서 원인을 알 수 있었던 127예 중 15예가 기생충 감염과 관련
Disease entities N (%) of
patients
Eosinophil count (mean,
/μL)
Malignant diseases 80 (35.2) 3,218
Allergy and skin diseases 41 (18.1) 3,000
Infections 35 (15.4) 2,762
Hepatobiliary diseases 17 (7.5) 1,971
Hematologic malignancies (clonal) 16 (6.6) 4,074
Parasite infections 15 (6.6) 5,064
Lung diseases 13 (5.7) 3,147
ESRD with dialysis 8 (3.5) 3,150
Irritable bowel syndrome 2 (0.9) 1,800
Crohn’s disease 1 (0.4) 1,900
Total 227 (100)
Table 2. Comparison of mean eosinophil count in different clini- cal entities with moderate to severe eosinophilia
Abbreviations: See Table 1.
이 있었음을 확인하였으며, 15예 모두 기생충 피부반응검사를 시 행하지 못하였으나 혈청 항체검사가 양성이었다. Leder 등[14]
에 의하면 한 번의 대변검사에서 충란이 관찰되지 않는다고 해서 기생충감염이 없다고 결론을 내려서는 안되며 반복적인 대변검 사와 함께 십이지장 흡인액 및 필요하다면 객담에서의 기생충검 사가 필요하다고 하였다. 최근 시약의 절판으로 기생충의 피부 반응검사가 불가능하게 되면서 기생충검사를 혈청 항체검사와 대변 충란검사에 의존하게 되었으나 대부분의 환자들에서 한 번 의 대변검사에서 충란이 보이지 않았을 때 더 이상 검사를 하지 않았고 특히 호산구증가증이 있는데도 아예 검사를 하지 않은 경우가 많았다. 이러한 이유로 기생충 질환이 기존의 조사보다 더 낮은 빈도로 조사되었을 것으로 판단되었다.
본 연구에서 악성종양과 관련된 호산구증가증이 80예(35.2%)
로 가장 높은 빈도를 보였다. 악성종양에서 호산구증가의 기전 은 종양세포에서 호산구 생성을 자극하는 요소와 호산구 주성 요소를 분비하여 조직이나 말초혈액에서 호산구증가증을 일으 킨다고 알려져 있다[15, 16]. 본 연구에서 위장관계 악성종양 25 예를 포함하여 다양한 악성종양에서 호산구증가증이 발견되었 다. 특히 비강과 두경부 악성종양 각각 1예에서는 방사선치료 후 에도 중등도의 호산구증가증을 보이고 있으면서 종양의 크기가 감소하지 않았다. 중증의 말초혈액 호산구증가가 종양의 광범위 한 전이와 관련이 있고, 혈액 내 지속적인 호산구증가는 방사선 치료 후 종양이 계속 존재하는 유용한 지표가 될 수 있다는 보고 도 있다[17].
호산구증가증의 원인으로 간담도계질환은 17예였는데 이는 만성간염에서 호산구증가증이 약 1/3에서 동반되며, 우리나라가
A B
D E
C
Fig. 1. Morphology and the FIP1L1-PDGFRαrearrangement in a patient with clonal eosinophilia associated with multiple myeloma. (A) The BM aspiration smear shows diffuse plasma cell infiltration (27%) and increased number of mature eosinophils and eosinophil precur- sors (10%) (Wright stain, 400). (B) The BM section biopsy shows a hypercellular marrow with plasma cell clusters (H&E stain, ×100). (C) Abnormal nucleus showed one fusion signal (red arrow) and deleted orange signal (white arrow) which indicates the 4q12 using LSI 4q12 tricolor rearrangement probe (Vysis). (D) Reverse transcriptase-polymerase chain reaction (RT-PCR) analysis of RNA isolated from the bone marrow of the patient. The amplified band for FIP1L1-PDGFRαtranscripts is shown on the right side of the figure. (E) The detection of FIP1L1-PDGFRαusing PCR-direct sequencing analysis in the patient. The sequence trace (reverse chromatogram) result shows the break and fusion point (indicated by the arrow) in exon 12 of PDGFRαand exon 12 of FIP1L1 based on the RT-PCR results. Abbreviation:
MW, molecular weight marker (Boehringer, Ingelheim, Germany).
MW
400 bp
Fusion point
PDGFRαexon12 FIP1L1 exon
비교적 간담도계질환의 이환율이 높기 때문일 것이다.
비기생충성감염 중 진균감염, 특히 콕시디오이데스진균증이 나 아스페르길루스증 등에서 호산구증가증이 자주 동반된다. 일 반적으로 세균감염이나 바이러스감염 시에는 호산구수가 감소 하나, 예외적인 경우도 있고 성홍열, 브루셀라증, 항산균감염, 묘 소열 및 클라미디아폐렴 등에서 호산구증가증이 잘 동반된다. 그 외 폐렴이나 늑막삼출액, 급성췌장염에서도 호산구증가증이 동 반될 수 있다[13].
알레르기질환은 기관지천식, 알레르기비염, 아토피피부염, 두 드러기 등에서 호산구증가증이 동반될 수 있다. 또한 여러 가지 약제의 남용으로 인하여 과민반응이나 알레르기로 호산구증가 가 보이는 경우가 있는데 비스테로이드성항염증약물, 세포독성 약물, 항생제, 항정신병약물, 항경련제 등에 의해 호산구증가를 보인 예가 보고되고 있다[13].
이외에 이차적 호산구증가증의 드문 원인으로 투석, 신장 동종 이식거부, interleukin-2 투여, toxic oil 증후군, HIV 및 HTLV- II 감염, 고IgM 증후군 등이 있다[3, 18].
클론성 호산구증가증은 중증도 및 중증의 호산구증가증의 0.9%를 차지한다는 보고가 있다[3]. 골수의 클론성 장애인 급성 호산구백혈병, 만성호산구백혈병, 만성골수성백혈병, 진성적혈 구증가증, 진성혈소판증가증, 급성골수성백혈병, 비정상 T세포 질환, 급성림프모세포백혈병, 비만세포증 등이 이에 속한다[19].
본 연구에서는 클론성 호산구증가증을 보이는 골수질환이 15예 로 중등도 및 중증 호산구증가증의 6.6%를 차지하였다. FISH와 RT-PCR을 통해FIP1L1/PDGFRα융합유전자를 확인하여 만 성호산구백혈병으로 진단된 환자는 매우 흥미롭게도 다발성골 수종과 병발되어 발생하였다. 이 환자는 49세 여자 환자로 심한 단백뇨(2.94 g/일), 전신부종, 고혈압(180/120)을 주소로 내원 하였다. 기관지천식, 아토피 등의 과거력은 없었으며, 대변 충란 검사와 간흡충, 폐흡충, 스파르가눔 및 유구낭미충에 대한 혈청 항체검사는 음성이었다. 말초혈액검사에서 백혈구 16.4×109/L (호산구 17.2%), 혈색소 10.0 g/dL, 혈소판 237×109/L였으며, 혈액요소질소 13.7 mg/dL, 크레아티닌 1.2 mg/dL였다. 총단 백 6.4 g/dL, 알부민 4.1 g/dL로 알부민/글로불린 비는 정상이 었으며, 혈청 및 소변 단백전기영동에서 단클론성 단백은 관찰 되지 않았다. 혈청면역글로불린은 IgG 669 mg/dL, IgM 27.4 mg/dL, IgA 72.4 mg/dL, IgD 0.23 mg/dL로 약간 감소되었 다. 단순 방사선 사진에서 척추 및 늑골골절을 포함한 골용해성 병변이 관찰되었고, 흉부 전산화단층촬영검사에서 양쪽 폐에 호 산구 침윤으로 의심되는 1 mm 미만의 다수의 작은 결절이 관찰 되었다. 말초혈액도말에서 세포질 내 과립형성이상과 핵의 다분
엽이 관찰되는 호산구의 증가와 함께 1-2%의 형질량 세포들이 관찰되었다. 골수천자 및 생검에서 호산구전구세포가 10% 정도 로 증가되었고, 형질세포가 27.6%정도 관찰되었으며, 세포충실 도는 70%정도로 증가하였다(Fig. 1). 혈청 유리형 경쇄 kappa 가 1,800 mg/mL (3.3-19.4 mg/dL)였고, k/λ비는 92.3 (0.26- 1.65)로 상승하여 경쇄골수종으로 진단되었다. 염색체 검사에서 46,XX의 정상핵형을 보였고, RT-PCR에서 BCR-ABL 유전자 재배열은 음성이었다. FISH, RT-PCR 및 직접염기서열분석을 이용하여FIP1L1-PDGFRα유전자재배열을 확인하여FIP1L1- PDGFRα양성 만성호산구백혈병으로 진단하였다(Fig. 1). Bor- tezomib-TCD 복합화학요법과 함께 imatinib mesylate 100 mg/day를 복용하였고, 1개월 후 혈청 유리형 경쇄 kappa는 141 mg/dL (k/λ비=3.2)로, 말초혈액 호산구 수는 2.5%, 0.16×109/ L까지 감소하였다. 최근 소개된 FISH, RT-PCR 및 직접염기서 열 등의 검사방법 등을 이용한FIP1L1-PDGFRα유전자재배열 의 검출은 과다호산구증가증후군의 클론성을 확인하여FIP1L1- PDGFRα유전자재배열 양성 만성호산구백혈병으로 재분류를 가능하게 하였다[20]. FIP1L1-PDGFRα융합유전자는 염색체 4q12의 약 800 kb의 결손에 의해 일어나며, 만성호산구백혈병 의 병인론과 관련있는 것으로 알려져 있다[20, 21]. 이 외에도 PDGFRb, FGFR1등의 유전자가 만성호산구백혈병의 클론성 세포유전학이상으로 밝혀지고 있어, 2008년 WHO 분류에는 호 산구증가증과PDGFRα, PDGFRb또는FGFR1유전자재배열 을 동반한 골수구계 및 림프구계 종양의 새로운 범주로 분류되 었다[22]. PDGFRα유전자재배열을 동반한 골수구계 및 림프 구계 종양이나PDGFRb유전자재배열을 동반한 골수구계 종양 은 저용량의 imatinib mesylate에 잘 반응하여 분자유전학적 관해에 도달할 수 있다[21, 22].
1988년 정 등[4]의 연구에서는 호산구증가증의 원인으로 세 균감염, 기생충 감염이 가장 많았고, 1996년 신 등[5]의 연구에 서는 알레르기질환, 감염증, 간담도계질환, 기생충질환 및 악성 종양 순이었다. 본 연구에서는 악성종양이 가장 많았으며 기생 충감염은 이전의 연구 결과보다 더 감소하였다(Table 3). 이는 악성종양의 유병률 증가 및 공중 보건의 향상으로 인한 기생충 질환의 감소와 관련이 있을 것으로 추정되나 추가적인 역학조사 가 필요할 것으로 사료된다.
특정질환과 말초혈액 호산구 수의 관계에 대해서 정 등[4]의 연구에서는 세균감염, 기생충감염, 간담도계질환, 알레르기 및 악성종양에서의 혈중 호산구 수가 각각 4,000/μL, 6,950/μL, 2,210/μL, 3,570/μL, 4,460/μL로 기생충 감염에서 높은 수치를 보였고, 신 등[5]의 연구에서는 각각 2,941/μL, 2,519/μL, 2,666/
μL, 1,918/μL, 3,942/μL로 악성종양에서 가장 높은 수치를 보 이고 알레르기질환에서 가장 낮은 수치를 보였다. 본 연구에서 는 악성종양이 3,218/μL, 알레르기 및 피부질환 3,000/μL, 감염 증 2,762/μL, 간담췌질환 1,971/μL, 골수의 클론성질환 4,074/
μL, 기생충감염이 5,064/μL로 기생충감염에서 가장 높은 수치를 보였고, 간담췌질환에서 가장 낮은 수치를 보였다(Table 2).
광범위한 원인조사에도 불구하고 원인을 밝힐 수 없는 호산 구증가증이 있는데, 1968년 Hardy와 Anderson [23]은 원인 없이 6개월 이상 1,500/μL 이상 호산구가 증가해 있고, 심장이 나 폐 등과 같은 장기의 침범하는 환자군을 특발성 과다호산구 증가증후군(idiopathic hypereosinophilic syndrome, HES)으 로 정의하였다. 1975년 Chusid 등[24]에 의한 HES의 진단기준 은 1,500/μL 이상의 호산구증가증이 6개월 이상 지속되거나, 6 개월 미만이라도 호산구증가증과 관련하여 사망한 경우, 기생충 감염, 알레르기질환, 악성종양 등의 다른 원인이 없으면서, 간 및 비종대, 심잡음, 심부전, 중추신경계이상 등의 장기를 침범한 증상 및 징후가 있을 때 등의 3가지이며, 2008년 Bain 등[25]에 의한 WHO 정의에는 시토카인을 분비하는 T세포 클론증식이 없어야 하는 것이 추가되었다. HES와 감별해야 할 가장 중요한 질환은 만성호산구백혈병으로 골수에서 아세포가 증가하고 세 포유전학적으로 이상이 있어 클론성을 확인하거나, 클론성을 확 인하지 못하였어도 골수에 미성숙조혈세포의 비정상위치나 심 한 골수섬유화가 있거나 말초혈액 및 골수에서 세 계열의 세포 이상, 낮은 백혈구알칼리성인산분해효소 활성도, eosinopoi-
etins (IL-3, IL-5, GM-CSF)의 정상 수치 등이 보이는 경우 HES보다는 클론성 호산구증가증을 의심할 수 있다[3]. 본 연구 에서는 광범위한 원인조사와 골수검사 및 염색체검사를 시행하 였으나 원인을 확인할 수 없었던 호산구증가증이 19예가 있었으 며 HES 의심하에 지속적인 추적 관찰 중이었다. 나머지 127예 는 중등도 이상의 호산구증가증이 있었으나 추가적인 검사 및 추적검사를 시행하지 않아 원인을 알 수 없었다. 호산구증가증 은 다양한 가능성에 의해 발생할 수 있으므로 그 원인을 알기 위 해서 적극적인 검사 및 지속적인 추적관찰이 필요할 것으로 생 각된다.
결론적으로, 과다호산구증가증의 원인질환은 악성종양이 가 장 많았고, 알레르기질환 및 피부질환, 감염증, 간담도계질환 및 골수 클론성질환순으로 기존의 보고와 차이를 보였다. 클론성 호산구증가증을 확인하기 위한 분자유전학적 검사에서 다발성 골수종 환자에서 병발한FIP1L1/PDGFRα유전자재배열을 갖 는 만성호산구백혈병 1예를 확인하여 간단한 문헌고찰과 함께 보고하는 바이다.
요 약
배경 : 호산구증가증은 다양한 원발성 또는 이차적 원인으로 발생하는 것으로 알려져있다. 최근 악성종양이나 만성퇴행성질 환 등의 유병률 변화에 따라 호산구증가증의 빈도 및 원인의 변 화가 예상된다. 본 연구는 호산구증가증의 빈도 및 원인을 후향 Chung, et al. 1988[4] Shin, et al. 1996[5] Brigden and Graydon 1997[26] Present study
Jan. 1976-Aug. 1986 Jan.-Sep. 1995 12-month period Jan.-Apr. 2007
Eosinophilia cutoff >400/μL >20% >700/μL >500/μL
Incidence of eosinophilia - - 225/195,300 (0.1%) 5,019/41,137 (12.2%)
N of Patients 54 71 225 373
Patient age (range) 17-69 13-83 1-103 0-87
(mean) 40 52 44 52
Patient sex ratio (M:F) 2.55:1 2:1 1.2:1 2.51:1
Etiologic factors Unknown 26.00 Unknown 36.6 Unknown 36 Unknown 39.1
(%) Infections 30.00 Allergic diseases 29.0 Seasonal allergy/ 29 Malignant diseases 35.2
Parasite infections 25.00 Infections 20.0 allergic rhinitis Allergy and skin diseases 18.1 Hepatobiliary diseases 18.50 Hepatobiliary diseases 17.8 Asthma 14 Infections 15.4 Allergic diseases 10.00 Parasite infections 11.0 Eczema/dermatitis 9 Hepatobiliary diseases 7.5 Malignant diseases 7.50 Malignant diseases 11.0 Cancer 4 Hematologic malignancies 6.6
Kimura’s disese 5.00 Enteritis 1.0 Drug allergies 3 Parasite infections 6.6
Enteritis 0.25 Ulcerative colitis 1.0 Collagen diseases 3 Lung diseases 5.7
Chronic 0.25 Parasite diseases 2 ESRD with dialysis 3.5
glomerulonephritis Irritable bowel syndrome 0.9
Crohn’s disease 0.4 Table 3. Comparison of incidence, number of patients, patient age, sex and etiologies in the previous studies and the present study
Abbreviations: See Table 1.
적으로 분석하고, 각 원인 질환별로 호산구증가증의 정도를 비 교하였다.
대상 및 방법 : 호산구증가증은 말초혈액 호산구 수가 500/μL 이상인 경우로 정의하였고, 이 중에서 특히 호산구 수가 1,500/
μL 이상인 경우를 과다호산구증가증으로 정의하고 원인을 분석 하였다. 클론성 호산구증가증의 확진을 위해 FISH, RT-PCR 및 직접엽기서열분석을 실시하였다.
결과 : 전체 41,137명 중 호산구증가증을 보인 환자는 5,019 명(12.2%)이었고, 과다호산구증가증환자는 373명으로 전체 환 자의 0.9%였다. 이 중 원인을 추정하거나 확인할 수 있었던 경 우는 227예(60.9%)였다. 과다호산구증가증의 주요 원인은 악성 종양 80예(35.2%), 알레르기 및 피부질환 41예(18.1%), 감염증 35예(15.4%), 간담췌질환 17예(7.5%), 골수의 클론성질환과 기 생충감염이 각각 15예(6.6%) 순이었다. 또한, 다발성골수종 환 자에서 병발한FIP1L1/PDGFRα유전자재배열을 갖는 만성호 산구백혈병 1예를 관찰하였다.
결론 : 과다호산구증가증의 원인이 기존의 국내 보고와 차이 가 있었고, 악성종양이 주요한 원인임을 알 수 있었다. 한편, 다 발성골수종과 함께 병발한 분자유전학적검사로 확진된 만성호 산구백혈병을 보고하는 바이다.
참고문헌
1. Brito-Babapulle F. Clonal eosinophilic disorders and the hypereosi- nophilic syndrome. Blood Rev 1997;1:129-45.
2. Wardlaw A. Eosinophils and their disorders. In: Lichtman MA, Beut- ler E, et al., eds. Williams hematology. 7th ed. New York, NY: Mc Graw-Hill, 2006:863-78.
3. Brito-Babapulle F. The eosinophilias, including the idiopathic hyper- eosinophilic syndrome. Br J Haematol 2003;121:203-23.
4. Chung JP, Nam DK, Lee SJ, Lee EK, Hahn JS, Ko YW. A clinical study on eosinophilia; with a report of 5 cases of hypersoinophilic syn- drome. Korean J Hematol 1988;23:127-37. (정준표, 남동기, 이선주, 이은경, 한지숙, 고윤웅. 호산구증가증 및 과호산구 과다증후군에 대한 임상적고찰. 대한혈액학회지 1988;23:127-37.)
5. Shin KS, Choi YM, Chae SA, Hyung SM. A clinical study of cause of Eosinophilia. Chungbuk Med J 1996;6:105-14. (신경섭, 최윤미, 채 수안, 형성민. 호산구증다증에대한임상적고찰. 충북의대학술지 1996;
6:105-14.)
6. Shaffer LG and Tommerup N, eds. ISCN 2005: an international sys- tem for human cytogenetic nomenclature. 1st ed. Basel: Karger, 2005.
7. Whitby LE, Britton CJC, et al., eds. Disorder of the blood. Diagno- sis: Pathology: Treatment: Technique. 9th ed. New York: Grune &
Stratton Inc., 1968;15.
8. Wintrobe MM, ed. Clinical hematology. 6th ed. Philadelphia: Lea &
Febiger, 1967;260.
9. Orfanakis NG, Ostlund RE, Bishop CR, Athens JW. Normal blood leukocyte concentration values. Am J Clin Pathol 1970;53:647-51.
10. Zacharski LR, Elveback LR, Kinman JW. Leukocyte counts in healthy adults. Am J Clin Pathol 1971;56:148-50.
11. Teo CG, Singh M, Ting WC, Ho LC, Ong YW, Seet LC. Evaluation of the common conditions associated with eosinophilia. J Clin Pathol 1985;38:305-8.
12. Wykoff RF. Eosinophilia. South Med J 1986;79:608-12.
13. Tefferi A, Patnaik MM, Pardanani A. Eosinophilia: secondary, clon- al and idiopathic. Br J Hematol 2006;133:468-92.
14. Leder K and Weller PF. Eosinophilia and helminthic infections. Bail- lieres Best Pract Res Clin Haematol 2000;13:301-17.
15. Slugaard A, Ascensao J, Zanjani E, Jacob HS. Pulmonary carcinoma with eosinophilia. Demonstration of a tumor-derived eosinophilo- poietic factor. N Engl J Med 1983;309:778-81.
16. Anagnostopoulos GK, Sakorafas GH, Kostopoulos P, Margantinis G, Tsiakos S, Terpos E, et al. Disseminated colon cancer with severe peripheral blood eosinophilia and elevated serum levels of interleu- kine-2, interleukine-3, interleukine-5, and GM-CSF. J Surg Oncol 2005;89:273-5.
17. Dellon AL, Hume RB, Chretien PB. Letter: eosinophilia in bron- chogenic carcinoma. N Engl J Med 1974;291:207-8.
18. Backenroth R, Spinowitz BS, Galler M, Golden RA, Rascoff JH, Chary- tan C. Comparison of eosinophilia in patients undergoing peritoneal dialysis and hemodialysis. Am J Kidney Dis 1986;8:186-91.
19. Bain B. Eosinophilic leukaemias and the idiopathic hypereosino- philic syndrome. Br J Haematol 1996;95:2-9.
20. Cools J, DeAngelo DJ, Gotlib J, Stover EH, Legare RD, Cortes J, et al. A tyrosine kinase created by fusion of the PDGFRA and FIP1L1 genes as a therapeutic target of imatinib in idiopathic hypereosino- philic syndrome. N Engl J Med 2003;348:1201-14.
21. Gotlib J. Molecular classification and pathogenesis of eosinophilic disorders: 2005 update. Acta Haematol 2005;114:7-25.
22. Bain BJ, Gilliland DG, Horny HP, Vardiman JW. Myeloid and lym- phoid neoplasms with eosinophilia and abnormalities of PDGFRA, PDGFRB or FGFR1. In: Swerdlow S, Harris NL, et al., eds. World
Health Organization Classification of tumours. Pathology and genet- ics of tumours of haematopoietic and lymphoid tissues. 4th ed. Lyon:
IARC Press, 2008;68-73.
23. Hardy WR and Anderson RE. The hypereosinophilic syndrome.
Ann Intern Med 1968;68:1220-9.
24. Chusid MJ, Dale DC, West BC, Wolf SM. The hypereosinophilic syn- drome; analysis of fourteen cases with review of the literature. Me- dicine 1975;54:1-27.
25. Bain BJ, Gilliland DG, Horny HP, Vardiman JW. Chronic eosino- philic leukaemia, not otherwise specified. In: Swerdlow S, Harris NL, et al., eds. World Health Organization Classification of tumours.
Pathology and genetics of tumours of haematopoietic and lymphoid tissues. 4th ed. Lyon: IARC Press, 2008;51-3.
26. Brigden M and Graydon C. Eosinophilia detected by automated blood cell counting in ambulatory North American outpatients. In- cidence and clinical significance. Arch Pathol Lab Med 1997;121:963-7.