접수: 2018년 6월 30일, 승인: 2018년 7월 27일 연락처: 김건희, 서울시 중구 을지로 245
국립중앙의료원 마취통증의학과, 지역의약품안전센터 Tel: (02) 2226-7368, Fax: (02) 2262-4766
E-mail: gunnhee.kim@nmc.or.kr
Correspondence to: Gunn Hee Kim, MD, PhD
Department of Anesthesiology and Pain Medicine, Drug Safety Monitoring Center, National Medical Center, 245 Eulji-ro, Jung-gu, Seoul 04564, Korea
Tel: +82-2-2226-7368, Fax: +82-2-2262-4766 E-mail: gunnhee.kim@nmc.or.kr
단일기관에서 자발적 부작용 신고제도를 통해 수집된 Tramadol 성분제제 약물유해반응의 보고 사례 분석
국립중앙의료원 마취통증의학과1, 지역의약품안전센터2, 약제부3, 알레르기내과4
김병욱1ㆍ박지예2ㆍ강리현2ㆍ강지은2,3ㆍ김유영2,4ㆍ김건희1,2
Analysis of Tramadol Induced Adverse Drug Reaction on a Spontaneous Reporting System in a Single Hospital
Byunguk Kim, MD
1, Jiyea Park, BS
2, Ri Hyeon Kang, BS
2, Ji Eun Kang, PhD
2,3, You Young Kim, MD, PhD
2,4and Gunn Hee Kim, MD, PhD
1,21
Department of Anesthesia and Pain Medicine,
2Drug Safety Monitoring Center,
3Department of Pharmacy,
4
Division of Allergy and Clinical Immunology, Department of Internal Medicine, National Medical Center, Seoul, Korea
Objective: The purpose of the present study is to highlight the seriousness of tramadol-induced adverse events as
well as the possibility of drug abuse or misuse to the healthcare providers and patients, thereby emphasize the need for a more stringent drug management system in Korea in line with the worldwide trend. Methods: We an- alyzed 421 reported cases with 634 symptoms that were voluntarily reported to the Drug Safety Monitoring Center of National Medical Center between January 2013 and August 2017 and deemed significant adverse event on drug-related adverse events causality evaluation by the Drug adverse reaction monitoring center. Results: Of the 421 reported cases, 290 cases were female and 131 cases were male. Patients in their 70s showed the highest frequency of reported cases at 233 cases. Analysis of frequency by drug formulation showed the highest fre- quency at 171 cases with Ultracet ER tablet, a tramadol/acetaminophen combination, and with Sinpoong Tramadol HCl injection, an injectable tramadol monotherapy, at 136 cases. The most frequently reported drug-related ad- verse events were chills (285 cases, 45%), vomiting (152 cases, 24%), dizziness (92 cases, 15%). Conclusion:Tramadol is not well managed in Korea, as it is categorized under antipyretic/analgesic/anti-inflammatory drugs and is easy to prescribe with relatively few limitations. There is also a possibility of various drug-related adverse events. Therefore, stricter patient monitoring and drug management as well as general investigation on the misuse or abuse of tramadol are necessary. (JPERM 2018;10:77-83)
Key Words: Tramadol; Drug-related side effects and adverse reactions
서 론
국립중앙의료원 지역의약품안전센터는 우리나라 공공보 건의료의 중심으로서 안전한 의약품 사용에 대해서 많은 관 심을 기울이고 있다. 2011년 약물유해반응 위원회를 구성하 여 적극적인 원내 약물유해반응(adverse drug reaction, ADR) 감시활동을 하고 있으며 그 성과로 2014년부터 2017년까지 한국의약품안전관리원으로부터 지역의약품안전센터 ‘중앙 센터’로 지정되었다. 따라서 전국의 지방의료원과 보건소를 포함한 전국 공공보건의료기관의 약물유해반응 관리체계를 구축하고 지원하고 있다.
국립중앙의료원 지역의약품안전센터에서는 원내, 지방의 료원 및 일부 보건소로부터 약물유해반응을 신고받고 있다.
이 중에서 국립중앙의료원의 신고가 가장 많은데, 저자들은 그동안의 약물유해반응 신고내용을 평가, 분석하여 정리해 보는 과정이 필요하다고 판단하였다. 이 과정에서 약물유해 반응의 가장 큰 비율을 차지하는 것이 해열 진통소염제 부 류라는 것을 알게 되었고, 이 중에서 트라마돌(tramadol) 성 분제제가 차지하는 비중이 압도적으로 많다는 것을 확인할 수 있었다.
저자들은 국립중앙의료원 소속 여러 분야의 전문가들에 게 트라마돌의 구조와 성분에 대해 문의하였지만 구체적인 답변을 얻기 어려웠다. 또한 임상에서 빈번한 처방이 이루 어짐에도 불구하고 해당 약제에 의한 유해 반응에 대해 인 지가 낮음을 확인할 수 있었다. 이에 트라마돌 성분제제가 어떤 환자에게 어떠한 방식으로 사용되고 있는지, 주로 어 떤 부작용을 유발할 수 있는지, 트라마돌 사용에 대한 세계 적 추세는 어떠한지 등을 살펴보기로 하였다.
국립중앙의료원은 공공보건의료기관으로서의 역할을 수 행하고 있으며, 전체 환자 중 의료급여환자의 비율은 25.1%
(2017년 10월 기준)로 타 의료기관에 비해 상대적으로 높은 편이다. 이에 따라 의료급여환자의 전체 약물유해반응 비율 과 트라마돌 제제에 의한 약물유해반응 비율을 비교 분석함 으로써 취약계층 환자에서의 트라마돌 제제 처방시 집중 감 시의 필요성을 확인하고자 하였다.
저자들은 약물유해반응 신고가 활발히 이루어지기 시작 하던 2013년부터 2017년 8월까지 국립중앙의료원 내에서 신고된 부작용 케이스들을 분석하고, 특히 트라마돌과 관련 된 내용을 집중 분석하고자 한다.
대상 및 방법
1. 연구기간 및 연구대상
본 연구는 2013년 1월부터 2017년 8월까지 국립중앙의료 원 지역의약품안전센터를 통해 자발적 신고제도를 통해 신
고 접수된 부작용 중 트라마돌 성분 제제에 의해 유발된 경 우로 한정하였고, 이 중 국립중앙의료원 약물유해 위원회의 1차, 2차 적정성 평가에서 의미 있는 약물유해반응으로 규 정된 보고건수를 대상으로 하였다.
2. 분석방법
본 연구는 연구기간 내 신고 접수된 약물 부작용을 후향 적 검토를 통하여 수집하였다. 트라마돌 성분 제제는 트라 마돌 단일 성분 제제와 트라마돌 성분이 포함된 복합제제로 구분하여 분석하였다. 부작용을 증상별로 분류할 때 동일 환자에서 두 가지 이상의 약물유해반응이 보고된 경우에는 각각의 유해반응을 한 개로 간주하여 처리하였다. 약물 부 작용 인과성 평가 기준 및 도구로는 World Health Organi- zation-Uppsala Monitoring Centre (WHO-UMC) 기준을 이용하 였고, 이 중 ‘가능성 있음(possible)’, ‘가능성 높음(probable)’
그리고 ‘확실함(certain)’으로 평가받은 보고건수만을 대상으 로 하였다(표 1).
보고된 환자의 정보에 대해 통계를 실시하였고 분석하였 다. 환자를 성별에 따라 분류하고 환자의 나이는 보고된 시 점을 기준으로 하여 만 나이로 적용하여 분석하였으며 10세 간격으로 분류하였다. 환자의 진료과목은 환자의 약물 유해 반응을 일차적으로 본 센터에 보고한 진료과를 기준으로 하 였다. 또한 약물유해반응과 의료취약계층에 대한 상관 관계 를 분석하기 위해 전체 환자 중 의료급여환자군의 비율 및 전체 약물유해반응 보고 건수 중 의료급여환자가 차지하는 비율을 분석하였다.
해당 기간 동안 국립중앙의료원에서 처방된 트라마돌 성 분 제제를 제형에 따라 분류하였고 각각의 처방 건수를 연 도별로 수집하였다. 약물유해반응을 유발한 트라마돌 성분 제제 또한 제형에 따라 분류한 후 연도별 신고 건수를 조사 하였다.
3. 연구대상자 보호
본 연구는 한국의약품안전관리원에서 제공받은 데이터를 활용하여 개인정보를 보호하였고, 이를 통해 국립중앙의료 원의 의학연구윤리심의위원회에서 심의면제로 승인 받았다 (H-1804-089-001).
결 과
2013년 1월부터 2017년 8월까지 국립중앙의료원 지역의
약품안전센터에 보고된 약물유해반응 중 1차, 2차 평가에서
가능성 있음(possible), 가능성 높음(probable), 또는 확실함
(certain)으로 분류된 건수는 총 5,543건이었다. 이 중 트라마
돌 성분 제제에 의한 보고건수는 421건, 증상별로는 634건
Classification Criteria of evaluation
Certain (확실함) 의약품 등의 투여․사용과의 전후 관계가 타당하고 다른 의약품이나 화학물질 또는 수반하 는 질환으로 설명되지 아니하며, 그 의약품 등의 투여 중단 시 임상적으로 타당한 반응 을 보이고, 필요에 따른 그 의약품 등의 재 투여 시, 약물학적 또는 현상학적으로 결정적 인 경우
Probable (가능성 높음) 의약품 등의 투여․사용과의 시간적 관계가 합당하고 다른 의약품이나 화학물질 또는 수반 하는 질환에 따른 것으로 보이지 아니하며, 그 의약품 등의 투여 중단 시 임상적으로 합 당한 반응을 보이는 경우(재 투여 정보 없음)
Possible (가능성 있음) 의약품 등의 투여․사용과의 시간적 관계가 합당하나 다른 의약품이나 화학물질 또는 수반 하는 질환에 따른 것으로도 설명되며, 그 의약품 등의 투여 중단에 관한 정보가 부족하 거나 불명확한 경우
Unlikely (가능성 희박함) 의약품 등의 투여․사용과 인과관계가 있을 것 같지 않은 일시적 사례이고, 다른 의약품이 나 화학물질 또는 잠재된 질환에 따른 것으로도 타당한 설명이 가능한 경우
Conditional/unclassified (자료 보완/분류 보류)
적정한 평가를 위해 더 많은 자료가 필요하거나 추가 자료를 검토 중인 경우
Unassessible/unclassifiable (평가 및 분류 불가)
정보가 불충분하거나 상충되어 판단할 수 없고 이를 보완하거나 확인할 수 없는 경우 Table 1. WHO-UMC assessment algorithm
Figure 1. Frequency of tramadol induced adverse drug reactions according to age group (n=421).
이었다.
여성(290건, 69%)이 남성(131건, 31%)에 비해 상대적으로 보고건수가 많았고 연령에 따른 분류에서는 233건으로 70 대(71-80세)가 가장 높은 비중을 나타냈다. 또한 65세 이상 환자가 56%(235건)를 차지하여 64세 이하보다 많았다(그림 1). 약물유해반응 보고가 가장 많은 진료과목은 정형외과로 185건(43%)을 차지하였다. 전체 약물유해반응 신고 건수 중 의료급여환자의 비율은 22.8%였으며, 그 중 트라마돌 제제 에 의한 보고건수는 25.2%로 보다 높게 나타났다.
보고된 634개 증상 중 가장 많은 계통은 위장관계(464건, 73%)였고 중추신경계(116건, 18%)가 두 번째를 차지하였다.
단일 증상으로는 오심(285건, 45%), 구토(152건, 24%), 어지 럼증(92건, 15%) 등 경한 부작용이 대다수를 차지하였지만, 환각(hallucination)이나 진전(tremor) 같은 심각한 부작용도 발생한 것으로 조사되었다(표 2).
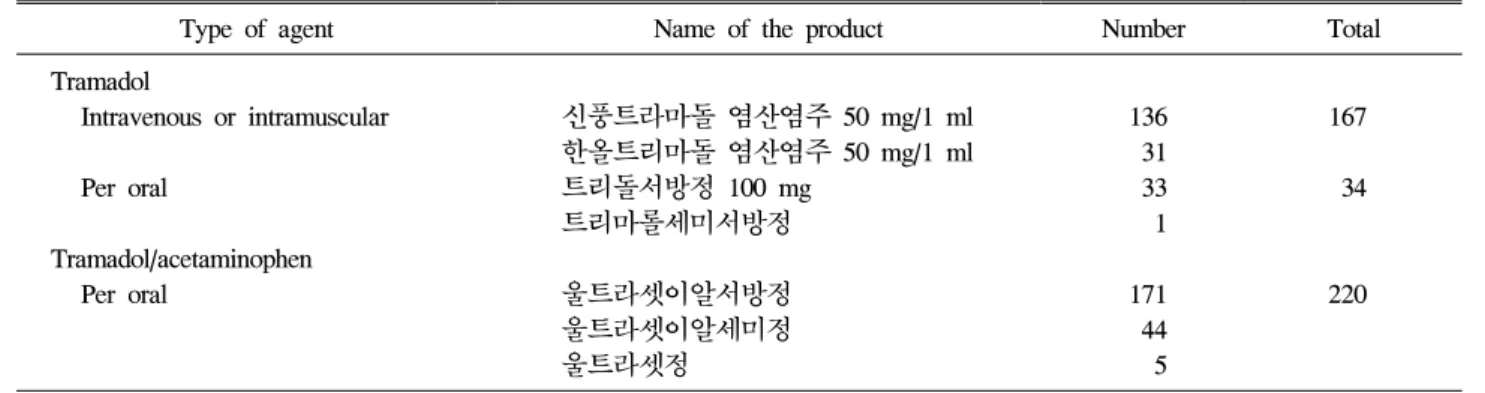
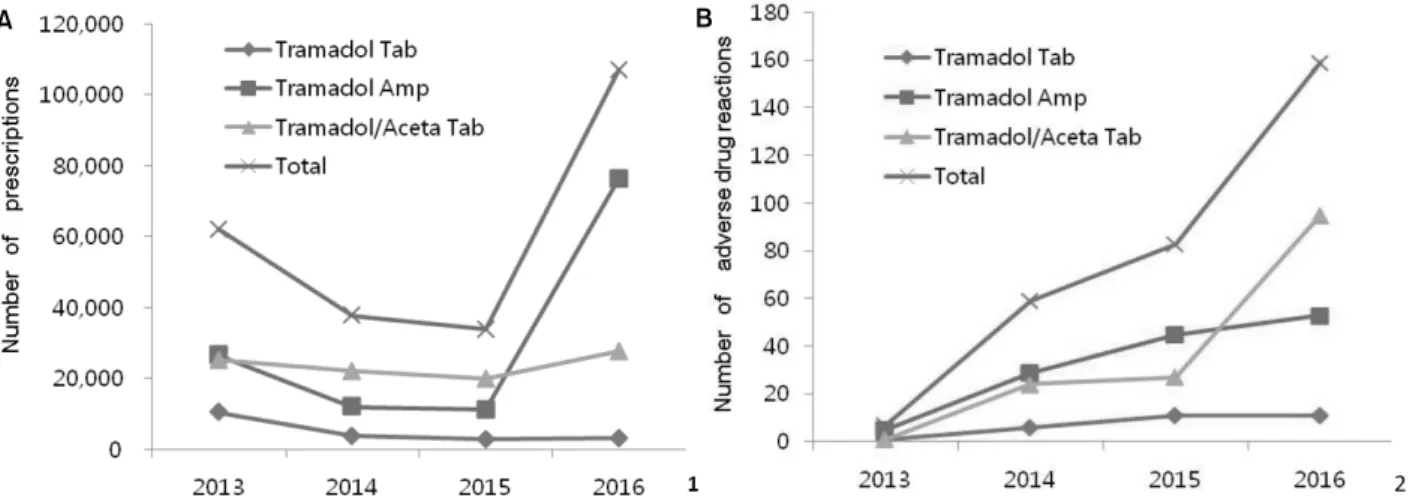
약물의 제형에 따른 호발 빈도에서는 트라마돌/아세트아 미노펜 복합제제가 220건으로 가장 많았고, 트라마돌 단일 주사제제는 167건, 트라마돌 단일 경구제제는 34건 순으로 접수되었다. 트라마돌/아세트아미노펜 복합제제인 울트라셋 이알서방정(한국얀센, 미국)가 171건(41%)으로 가장 많았고, 트라마돌 단일 성분의 주사제인 신풍트라마돌 염산염주 50 mg/1 ml (신풍제약, 한국)가 136건(32%)으로 두 번째로 많았 다(표 3). 각각의 약물에 의해 유발된 약물유해반응의 증상 중에서는 공통적으로 오심의 비율이 가장 높았고, 구토와 어지럼증 순으로 나타났다(표 4). 국립중앙의료원에서 처방 되는 트라마돌 제제는 12종류이며 단일 성분 주사제제, 단 일 성분 경구제제 및 경구용 트라마돌/아세트아미노펜 복합 제제의 형태로 처방되고 있었다. 트라마돌 성분제제는 2013
년부터 2016년까지 총 240,536건이 처방되었고 각각 트라마
돌 성분 주사제제는 125,894건, 단일 경구제제는 19,914건,
트라마돌/아세트아미노펜 복합제제는 94,728건이 처방되었
다. 이 중 트라마돌 단일 경구제제는 2013년의 10,413건에서
2106년의 3,098건으로 감소 추세를 보였고, 트라마돌/아세트
아미노펜 복합 경구제제는 2013년의 25,204 건에서 2016년
의 27,596건으로 처방건수의 큰 차이는 없었다. 트라마돌 주
사제제는 2013년의 26,493건에서 2016년의 76,352건으로 처
방건수가 증가함을 보였다(그림 2A). 트라마돌 단일 경구제
제에 의해 유발된 약물유해반응은 2013년의 1건에서 2016
년의 11건으로 증가 양상을 보였고, 트라마돌 주사제제에
의한 약물유해반응은 2013년에는 5건에서 2016년에 53건으
로 증가하였다. 또한 트라마돌/아세트아미노펜 복합 경구제
제에 의해 유발된 약물유해반응은 2013년의 1건에서 2016
년의 95건으로 증가하였다(그림 2B). 트라마돌 성분 제제의
System-organ class (%) Symptom (number)
Cardiovascular (3) Sweating(8) hypotension (5) flushing (3) palpitation (3) Nervous system (18.3) Dizziness (92) headache (8)
Agitation (7) drowsy (5) paresthesia (2) hallucination (1) tremor (1)
Skin and appendages (2.7) Pruritus (11) rash (3) urticarial (3)
Gastro-intestinal system (73.2) Nausea (285) vomiting (152) constipation (10) AST/ALT elevation (7) dry mouth (5) Heartburn (4) diarrhea (1)
Respiratory system (1.7) Chest tightness (6) dyspnea (5) Urinary system (0.8) Urinary retention (5)
Musculo-skeletal system (0.3) Muscular pain (2) Table 2. Reported adverse reactions induced by tramadol (N=634)
Type of agent Name of the product Number Total Tramadol
Intravenous or intramuscular 신풍트라마돌 염산염주 50 mg/1 ml 136 167 한올트리마돌 염산염주 50 mg/1 ml 31
Per oral 트리돌서방정 100 mg 33 34
트리마롤세미서방정 1
Tramadol/acetaminophen
Per oral 울트라셋이알서방정 171 220
울트라셋이알세미정 44
울트라셋정 5
Table 3. Drug formula of reported tramadol-induced adverse reactions
Symptom
Incidence rate by the product (%) 신풍트라마
돌염산염주
한올트라마
돌염산염주 트리돌서방정 울트라셋
이알서방정
울트라셋 이알세미정
Nausea 72 74.2 87.9 62.6 59.1
Vomiting 40 35.5 39.4 33.9 31.8
Dizziness 16 19.4 24.2 24 29.5
Agitation 1.5 6.5 0 1.8 0
Pruritus 0 3.2 0 5.3 2.3
Sweating 4.4 3.2 0 0.6 0
Constipation 0 0 0 4.7 2.3
Hypotension 0.7 3.2 3 0 4.5
Stomachache 0 0 3 1.2 0
AST/ALT elevation 0 0 0 3.5 2.3
Dry mouth 0 0 0 2.9 0
Dyspnea 2.9 0 0 0.6 0
Chest tightness 2.9 3.2 0 0.6 0
Table 4. Incidence rate of tramadol induced ADRs depending on the product type
전체 처방량이 2013년의 62,110건에서 2016년의 107,046건 으로 증가함에 따라 약물유해반응의 발생건수는 7건에서 159건으로 22.7배 증가하는 양상을 보였다.
고 찰
트라마돌은 1977년 독일에서 처음 시판되었고, 현재는 점
안액, 경구약, 좌약, 근육주사, 정맥주사, 피하주사 등의 여
A B
Figure 2. Changes in (A) prescription volume of tramadol and (B) number of tramadol induced adverse drug reactions in recent years.
러 가지 제형으로 전 세계 75개국 이상에서 시판되고 있 다.
1)미국에서는 2007년에서 2011년 사이 트라마돌 성분 제 제의 사용량이 65% 이상 증가하였고, 2013년 미국의 아편 유사진통제 시장의 14.7%를 차지하여 점유율 2위를 차지하 였다.
2)트라마돌은 기존의 진통제에 반응하지 않는 중등도 이상 의 통증을 호소하는 환자에서 주로 사용되고 있다. 또한 비 스테로이드소염제가 가지는 위장관 천공 및 출혈의 위험성 에서 상대적으로 자유롭다고 알려져 있다.
3-6)또한 의료진들 은 보편적으로 아편유사진통제에 비해 약물 오남용 가능성 이 적고, 호흡 억제가 적으며 위장관 운동 기능에 미치는 영 향이 적다고 믿기 때문에 지속적으로 처방이 증가하는 추세 이다.
7)트라마돌은 구조적으로 codeine이나 morphine과 유사한 합성 4-phenyl-piperidine으로서, 각각 다른 작용기전을 가진 두 개의 광학이성체로 구성되어 있다.
2,8)(+)-Tramadol과 그 대사물인 O-desmethyl-tramadol (M1)은 선택적 μ 수용체 작 용제로 작용하며 또한 세로토닌 재흡수를 억제한다.
(–)-tramadol은 노르에피네프린과 세로토닌의 재흡수를 억제 한다. 이러한 노르에피네프린과 세로토닌의 재흡수의 억제 는 중추신경계에서 통증 전달과 관련된 억제내림경로를 강 화하는 작용을 한다.
2,8)본 연구에 앞서 트라마돌 성분 제제로 인한 약물유해반응 에 대한 연구가 두 차례 보고 되었다. Kwon 등
9)의 연구에서 는 원내에서 보고 받은 진통제 약물에 대한 이상반응을 연 령, 성분, 부작용 별로 분석하였고, 이는 트라마돌 성분 제 제만을 대상으로 한 본 연구와는 차이가 있었다. 또 다른 연 구에서는 한 기관에서 2년간 보고된 트라마돌 제제에 의한 약물유해반응을 대조군 과의 비교를 통해 트라마돌의 부작 용에 영향을 미치는 요인을 알아보고자 하였다.
10)이에 본
연구에서는 트라마돌 제제의 전반적인 부작용 빈도 및 종류 뿐 아니라 유형별, 연도별 처방건수와 부작용건수 및 부작 용종류를 비교 분석하였다.
약물유해반응 보고가 본격적으로 시작된 2013년 1월부터 2017년 8월까지 국립중앙의료원을 통해 보고된 약물유해반 응의 총 보고건수는 5,543건이었고, 이중 트라마돌 단일제 제와 트라마돌/아세트아미노펜 복합제제에 부작용으로 신 고된 건은 421건으로 전체 약물유해반응 보고건수 중 약 7.6%를 차지하였다. 2013년부터 2016년까지 트라마돌 성분 제제의 처방건수는 62,110건에서 107,046 건으로 증가하였 고 이에 따라 약물유해반응 보고건수도 7건에서 159건으로 증가하였다. 주사제제의 처방이 증가하였으나 약물유해반 응 보고는 경구용 트라마돌/아세트아미노펜 복합제제에서 증가하는 양상을 보였다. 이는 자발적 부작용 신고 제도 (spontaneous reporting system)에 따른 한계로 정확한 환자 수 의 반영이 어려웠기 때문으로 판단된다.
본 연구결과 트라마돌 제제에 의한 부작용 발생은 여성이 290건(69%)으로 남성의 131건(31%)에 비해 높게 나타났다.
일반적으로 약물유해반응의 발생은 여성에서 빈도가 높은 것으로 알려져 있는데 이는 호르몬의 영향, 여성의 상대적 으로 높은 의료 이용률, 높은 체지방에 따른 혈장 내 약물 농도의 차이 등의 다양한 요인이 작용하였기 때문으로 보고 되고 있다.
11)이는 트라마돌 제제에서도 동일하게 적용될 것이라 생각된다.
연령대에 따른 분류에서는 70대(71-80세)에서 122건으로
가장 많았으며 다음으로 60대(61-70세)에서 85건이 접수되
었다. 이는 상대적으로 고령층에서 처방빈도가 높고 다수의
병용 약제, 신장 기능의 저하에 따른 약물 배출 지연, 불량
한 영양 상태 등의 위험인자가 많기 때문에 약물유해반응
보고 건수 또한 많았다고 판단된다.
12)트라마돌 제제에 대
해 부작용을 호소한 환자들의 43%는 정형외과에서 처방을 받은 경우였다. 이는 골관절염을 호소하는 환자에서 높은 빈도로 트라마돌 처방이 이루어지기 때문으로 생각된다.
약물유해반응 보고 건수 중 의료급여환자가 차지하는 비 율은 22.8%였으나 트라마돌 제제에 의한 약물유해반응은 의료급여환자가 차지하는 비율이 25.2%로 다소 높게 나타 났다. 이 수치만으로 트라마돌 제제에서 의료취약계층의 약 물유해반응 비율이 더 높다고 단정지을 수는 없으나 취약계 층환자의 약물유해반응관리에 있어서 트라마돌 제제도 예 외는 아니라고 생각된다.
보고된 증상 중에서는 위장관 계통의 부작용인 오심과 구 토가 가장 많았다. 전체 643건의 증상 중 오심은 285건 (67.7%)이었고, 구토는 152건(36.1%)이 접수되었다. 이는 트 라마돌이 가지는 마약유사구조로 인한 것으로 다른 아편유 사진통제와 마찬가지로 다양한 경로의 자극을 통해 오심 및 구토가 발생하기 때문이다.
13)중추신경계 부작용 중 가장 높은 빈도를 보인 것은 어지 럼증으로써 92건(21.9%)에서 나타났다.
14)한 조사에서 트라 마돌의 사용기간이 7일, 30일, 90일에서 어지럼증의 발생률 이 각각 23%, 31%, 33%로 보고되었다.
15)어지럼증의 유병 률이 약물의 사용 기간과 밀접한 관계임을 알 수 있는데, 본 연구에서는 투약기간에 대한 정보 부족으로 이러한 연관성 을 밝혀내진 못하였다.
본 연구에서 보고된 증상 중 대부분은 경미한 증상이었지 만 환각, 진전, 호흡곤란 등과 같은 다소 심각한 증상도 보 고된 것을 알 수 있었다. 본 기관을 통해 접수되지는 않았지 만 치료적 용량 내에서 발작의 발생률은 약 1% 미만으로 보고되고 있다.
16)특히 알코올 의존증의 과거력이 있거나 간질 유발 약물 복용자 또는 트라마돌 남용 환자에서는 높 은 빈도로 트라마돌 유발 발작이 발생할 수 있다.
17,18)따라 서 의료인은 트라마돌의 남용은 발작의 발생을 유발할 수 있고 또한 다른 향정신성의약품이나 아편유사진통제 및 알 코올에 의해서 발생률이 더욱 증가함을 유의하여야 한다.
19)그리고 트라마돌 성분 제제의 장기 복용은 잠재적으로 생명 을 위협할 수 있는 세로토닌 증후군을 유발할 수 있기에 주 의가 필요하다.
20,21)트라마돌 제제의 장기 복용은 약물중독을 초래할 수 있으 며 처방환자 100,000명당 약 0.5-1.0명에서 중독 현상이 관찰 되었다는 보고가 있다.
22,23)이는 기존의 아편유사진통제에 비해 처방이 용이하고 비스테로이드소염제에 비해 효과가 좋기 때문에 처방 빈도가 증가함에서 기인된다고 판단된다.
트라마돌 성분제제는 본 기관에 접수된 약물유해반응 중 가장 높은 빈도를 보인 약물로서, 이는 국내뿐만 아니라 전 세계적으로 판매 및 사용처가 증가하고 있기 때문으로 보인 다. 현재 우리나라의 트라마돌 성분 제제의 전체 처방량과
그에 따른 처방량의 추이는 관련 기관의 공개 거부로 알 수 없었으나, 1년에 약 4억정 정도가 판매된다고 알려져 있다.
미국의 Drug enforcement administration (DEA)에서는 트라마 돌 성분 제제를 alprazolam이나 lorazepam 등과 같은 schedule
Ⅳ substance로 분류하고 있다.
2)Schedule Ⅳ substance는 낮 은 약물 오남용 가능성이나 의존성을 갖는 약물류이지만 관 리가 필요한 약물을 의미한다. 국내에서 alprazolam과 lorazepam은 향정신성의약품으로 분류되어 관리가 이루어지 지만 트라마돌 성분제제는 해열진통소염제로 분류되어 관 리가 소홀한 현실이다.
트라마돌 성분 제제는 자체에 의한 약물 중독의 가능성이 존재하며 발작의 역치를 낮추고 세로토닌 증후군 등의 심각 한 부작용을 초래할 수 있으므로 보다 엄격한 환자 모니터 링 및 약제 관리가 필요하다. 처방의는 환자들에게 발생할 수 있는 불필요한 부작용을 예방하기 위해 트라마돌의 대사 및 배출 등의 약리학적 특성을 잘 파악하고 있어야 하며 보 다 신중한 처방이 이루어져야 할 것으로 판단된다. 또한 세 계적 추세로 볼 때 트라마돌 성분 제제의 오남용 증가가 명 백하니 우리나라에서는 전반적인 실태 조사가 이루어져야 할 것이다.
REFERENCES
1. Pergolizzi JJV, Taylor JR, Raffa RB. Extended-release for- mulations of tramadol in the treatment of chronic pain. Expert Opin Pharmacother 2011;12:1757-68.
2. Miotto K, Cho AK, Khalil MA, Blanco K, Sasaki JD, Rawson R. Trends in tramadol: pharmacology, metabolism, and misuse. Anesth Analg 2017;124:44-51.
3. Andrew MR, Phillips CJ. Cost of NSAID adverse effects to the UK National Health Service. J Med Econ 1999;2:45-55.
4. Pettitt D. The effect of nonsteroidal anti-inflammatory drugs on the use of gastroprotective medication in people with arthritis. Am J Manag Care 2001;7:402-8.
5. Delcò F, Michetti P, Beglinger C, Fried M, Szucs TD. Health care resource utilization and costs of NSAID-induced gastro- intestinal toxicity. Digestion 2004;69:10-19.
6. Mazer M, Perrone J. Acetaminophen-induced nephrotoxicity:
pathophysiology, clinical manifestations, and management. J Med Toxicol 2008;4:2-6.
7. Ricardo BM, Rajive M, Nalini M. Opioid complications and side effects. Pain physician 2008;11:105-20.
8. Grond S, Sablotzki A. Clinical pharmacology of tramadol.
Clin Pharmacokinet 2004;43:879-923.
9. 권지선 외. 원내 자발적 감시프로그램으로 수집한 진통제 약물유해반응 사례 분석. 약물역학위해관리학회지 2017;9:
18-26.
10. 차은혜. 트라마돌 제제의 약물유해반응 관련요인 : 일개 지역의약품안전센터 자발적 보고를 중심으로. 연세대학교 보건대학원 석사 논문 2016.
11. Tran C, Knowles SR, Liu BA, Shear NH. Gender differences in adverse drug reactions. J Clin Pharmacol 1998;38:1003-9.
12. Caamaño F, Pedone C, Zuccalà G, Carbonin P. Socio-demo- graphic factors related to the prevalence of adverse drug re- action at hospital admission in an elderly population. Arch Gerontol Geriatr 2005;40:45-52.
13. Coluzzi F, Rocco A, Mandatori I, Mattia C. Non-analgesic effects of opioids: opioid-induced nausea and vomiting: mech- anisms and strategies for their limitation. Curr Pharm Des 2012;18:6043-52.
14. Ng KFJ, Tsui SL, Yang JCS, Ho ETF. Increased nausea and dizziness when using tramadol for post-operative patient-con- trolled analgesia (PCA) compared with morphine after intra- operative loading with morphine. Eur J Anaesthesiol 1998;15:565-70.
15. American Society of Health-System Pharmacists. AHFS Drug Information. American Society of Health-System Pharmacists.
Printed in the United States of America 2004;2064-7.
16. Gardner JS, Blough D, Drinkard CR, Shatin D, Anderson G,
Graham D, Alderfer R. Tramadol and seizures: a surveillance study in a managed care population. Pharmacotherapy 2000;20:1423-31.
17. Tobias JD. Seizure after overdose of tramadol. South Med J 1997;90:826-7.
18. Alderfer RJ, Graham DJ. Seizures reported with tramadol.
JAMA 1997;278:1661.
19. Jick H, Derby LE, Vasilakis C, Fife D. The risk of seizures associated with tramadol. Pharmacotherapy 1998;18:607-11.
20. Kaye AD. Tramadol, pharmacology, side effects, and seroto- nin syndrome: a review. Pain Physician 2015;18:395-400.
21. Volpi-Abadie J, Kaye AM, Kaye AD. Serotonin syndrome.
Ochsner J 2013;13:533-40.
22. Cicero TJ, Adams EH, Geller A, Inciardi JA, Muñoz A, Schnoll SH, Woody GE. A postmarketing surveillance pro- gram to monitor Ultram®(tramadol hydrochloride) abuse in the United States. Drug Alcohol Depend 1999;57:7-22.
23. Senay EC, Adams EH, Geller A, Inciardi JA, Munoz A, Schnoll SH, Cicero TJ. Physical dependence on Ultram® (tramadol hydrochloride): Both opioid-like and atypical with- drawal symptoms occur. Drug Alcohol Depend 2003;69:233-41.