의학 석사학위 논문
하인두암에서 간세포성장인자와
E-cadher
i
n의 발현에 관한 연구
아 주 대 학 교
대 학 원
의 학 과
이 장 우
하인두암에서 간세포성장인자와
E-cadher
i
n의 발현에 관한 연구
지도교수
김 철 호
이 논문을 의학 석사학위 논문으로 제출함.
2006년
2월
아 주 대 학 교
대 학 원
의 학 과
이 장 우
이장우의 의학 석사학위 논문을 인준함.
심사위원장
박
기
현
인
심 사 위 원
정
연
훈
인
심 사 위 원
김
철
호
인
아 주 대 학 교
대 학 원
2005년 12월 22일
감사의 글
부족한 제가 미진하나마 학위 논문을 완성할 수 있도록 도와주신 여러 선생님들께 먼저 감 사의 말씀을 드립니다.특히 미숙한 저를 끝까지 이비인후과의로 수련시키기 위해 깊은 노 고와 진심어린 질타를 아끼지 않아 주셨고,석사학위까지 이끌어 주신 존경하는 은사이신 김철호 지도교수님께 고개숙여 감사드립니다.또한 미천한 제가 이비인후과의 길에 들어설 수 있도록 허락해 주시고 바쁘신 가운데에도 늘 격려해 주셨던 박기현 교수님께도 깊은 감 사를 드리며,바쁜 전공의 기간동안 지켜봐 주신 정연훈 교수님,김현준 교수님께도 감사 드 립니다. 또한 슬라이드 판독을 선뜻 맡아주신 병리과 김장희 선배님과 실험에 큰 도움을 주었던 고 연아 연구원,지난 4년간 동고동락하며 정들었던 모정윤 선생을 비롯한 의국원들에게도 감 사의 말을 전하고 싶습니다. 늘 바쁘다는 핑계로 자주 찾아뵙지 못했음에도 꾸짖지 않고 이해해주신 양가 부모님께 죄 송함과 감사함을 함께 전하고 싶고,그 누구보다도,모두가 등을 돌린 순간에조차 끝까지 곁 에 남아 함께했던,조강지처이자 평생의 반려자인 아내에게 깊고 깊은 사랑과 감사의 마음 을 전하고 싶습니다.-국문요약-
하인두암에서
간세포성장인자와 E-cadherin 의 발현에 관한 연구
연구목적 : 하인두암은 빠른 증식과 침습적인 성향 및 전이를 잘 하는 특성에 의해 예후가 나쁜 암으로 알려져 있다. 간세포성장인자(Hepatocyte Growth Factor, 이하 HGF)는 간세포 뿐 아니라 체내의 다양한 세포와 종양에서 증식, 분산, 이동 및 침습에 관여하며 종양주위의 신생혈관을 생성하는 것으로 알려져 있고, E-cadherin 은 세포 표면에 존재하는 칼슘 의존형 세포 유착물질(Calcium dependent intercelluar Adhesion Molecule, CAM)의 일종으로서, 세포의 골격을 유지하며, 세포간의 유착을 매개하고 조직의 구조를 형성하게 하는 역할을 하고, 종양세포의 E-cadherin 은 종양의 침윤을 억제하는 기능이 있는 것으로 알려져 있으며, 양자에 관한 많은 연구가 진행되고 있다. 본 연구는 두경부 종양 중 주변조직으로의 침습과 전이를 잘 하는 하인두암에서 E-cadherin 의 발현에 따른 임상적인 의의를 알아보고 하인두암세포주에서 HGF 가 E-cadherin 의 발현에 어떠한 역할을 하는지를 알아보고자 하였다. 재료 및 방법 : 하인두암으로 수술받은 40 예의 시료를 이용하여 E-cadherin 의 면역조직화학적 염색을 시행하였고 하인두암 세포주인 FaDu(ATCC)을 이용하여 HGF 의 농도(10, 30ng/ml)에 따른 E-cadherin 의 발현을 보고자 RT-PCR 과 Western blotting 을 시행하였다. 결과 : 면역조직화학적 염색상 E-cadherin 의 발현정도는 하인두암의 임상양상과 통계적으로 유의한 관계를 보이지 못했으나, E-cadherin 의재발과도 상당한 관련성(p=0.072)이 의심되었다. 하인두암 세포주의 RT-PCR 과 Western blotting 결과, HGF 를 처리한 경우가 대조군에 비해 E-cadherin 발현이 감소하였고 이는 HGF 의 농도에 비례하였다. 결론 : 하인두암 조직에서 E-cadherin 의 발현위치가 하인두암의 림프절 전이와 관련이 있으며, 하인두암의 E-cadherin 발현의 감소에 HGF 가 관여함으로써 하인두암의 침습에 HGF 가 일부 영향을 주는 것을 알 수 있었다. 핵심어: E-cadherin, 간세포성장인자, 하인두암, 침습, 전이
차
례
국문요약 ··· i 차례 ··· iii 그림 차례 ··· v 표 차례 ··· vi Ⅰ. 서론 ··· 1 Ⅱ. 재료 및 방법 ··· 6 A. 하인두암 환자의 조직을 통한 연구 ··· 6 1. 대상 환자 ··· 6 2. E-cadherin 에 대한 면역조직화학적 염색 ··· 6 B. 하인두암 세포주를 이용한 연구 ··· 7 1. 세포배양 ··· 7 2. RT-PCR 에 의한 E-cadherin 의 mRNA 측정 ··· 83. Western blotting 을 이용한 E-cadherin 발현 검색 ··· 8
C. 통계적 분석 ··· 9 Ⅲ. 결과 ··· 10 A. 하인두암 조직에서 E-cadherin 의 발현정도(intensity)와 임상 양상 과의 관계··· 10 B. 하인두암 조직에서 E-cadherin 의 발현위치(location)와 임상 양상 과의 관계··· 13 C. 하인두암 세포주에서 RT-PCR 을 이용하여 HGF 의 농도에 따른 E-cadherin 의 mRNA 발현 측정 ··· 17 D. 하인두암 세포주에서 Western blotting 을 이용하여 HGF 의 농도에 따른 E-cadherin 의 발현 검색 ··· 18
Ⅳ. 고찰 ··· 19
Ⅴ. 결론 ··· 24
참고문헌 ··· 25
그
림 차 례
Fig. 1. Classification of immunohistochemical stains according to the intensity of E-cadherin expression in hypopharyngeal squamous cell cancer
tissue ··· 11 Fig. 2. Survival curves of hypopharyngeal carcinoma patients according to the
intensity of E-cadherin expression ··· 13 Fig. 3. Classification of immunohistochemical stains according to the location of
E-cadherin expression in hypopharyngeal squamous cell cancer tissue ··· 15 Fig. 4. Survival curves of hypopharyngeal carcinoma patients according to the
location of E-cadherin expression ··· 17 Fig. 5. RT-PCR of E-cadherin expression in FaDu cells ··· 18 Fig. 6. Western Blot of E-cadherin expression in FaDu cells ··· 18
표
차 례
Table 1. Correlation between the intensity of E-cadherin expression and the
clinicopathologic factors ··· 12 Table 2. Correlation between the location of E-cadherin expression and the
Ⅰ
. 서 론
악성 종양의 치료 방침 결정과 예후 판정을 위해 종양의 생물학적 특성을 알아내기 위한 많은 연구가 행하여져 왔고 현재까지 가장 흔히 사용되고 있는 것은 형태학적 접근에 의한 결과물인 종양의 크기, 림프절전이, 원격전이 등으로 구성된 임상병기와 병리적 세포 분화도 등이다(구영아 등, 2000). 한편, 암이 발생하여 원격전이에 이르기까지, 암세포가 주변조직으로 침윤하기 위해서 세포간의 결합이 소실되어야 하고 이동하기 위해서 주변조직을 분해해야 하며 림프절이나 혈관으로 전이하기 위해서 신생혈관이 생성되어야 하는 등 여러 복잡한 단계를 거쳐야 하고, 이러한 일련의 과정은 어느 한가지 물질만이 관여하는 것이 아니라 복잡하고 다양한 과정을 거쳐 진행되는 것이다. 이러한 과정에서 중요한 역할을 하는 물질들과 이들을 조절하는 인자들의 상호관계를 설명함으로써 예후인자의 개발과 암치료의 개선에 중요한 정보를 얻어내기 위해, 최근에는 형태학적 접근에서 한 단계 나아가 분자생물학적인 접근을 통한 종양의 연구가 급격하게 이루어지고 있다. 하인두암은 상부 호흡소화기계에 발생하는 암 중 10%를 차지하며 다른 두경부의 암과 마찬가지로 흡연과 음주와 밀접한 관계가 있는 것으로 알려져 있다. 하인두암은 위치적으로 구인두, 후두와 식도 상부 사이에 존재하여 암 발생시 주변의 구조물을 쉽게 침습하여 수술시 후두를 포함한 광범위한 절제가 필요한 경우가 많다. 하인두암은 두경부에 발생하는 암종 중 예후가 가장 나쁜 암에 속하는데, 그 이유는 대부분의 하인두암은 진행된 후에야 진단되는 경우가 많고, 주변의 중요구조물-후두, 내경동맥, 내경정맥, 뇌신경으로의 침습이 초기에 잘 일어나며, 종양이 점막하 전파(submucosal spread)로 확장이 되는 경우가 있어 수술시 적절한 안전거리를 두기 어려운 경우가 많기 때문이다. 또한 조기에 림프절로의 전이가 많이 나타나고, 기관식도 림프절,종격동 림프절, 후인두림프절 등 치료가 쉽지 않은 곳으로의 전이가 많으며, 다른 두경부 종양에 비해 원격전이를 잘하는 특성이 있고, 이차암(second primary tumor)의 발병율이 높다. 이러한 이유로 다양한 치료법에 대한 연구와 시도에도 불구하고 지난 20 년간 그 어떤 치료에도 예후가 크게 개선되지 못하고 있다(김철호 등, 2004). 타 두경부암과는 다른 이러한 하인두암의 빠른 증식과 침습적인 성향 및 전이를 잘 하는 특성에 대해 분자생물학적인 접근을 도입하여 연구를 한다면 하인두암을 이해하고 치료하는데 도움이 되리라 생각되며, 궁극적으로 환자의 치료율과 생존율을 높이는데도 기여할 수 있을 것으로 사료된다. 일반적으로 종양의 침습과 전이의 과정에는 종양과 숙주사이의 여러
반응(tumor and host interaction)이 필요한데 이에는 간질 변화(stromal
alterations)가 종양의 악성화에 앞서 선행되고, 이어 종양세포와
섬유모세포(fibroblast), 대식세포(macrophage), 중성구(neutrophils), 내피세포(endothelial cells) 및 림프구(lymphocyte) 등과 같은 간질세포간의
반응을 통해 세포외 기질의 변화, 신생혈관생성, 종양의 전이 및 침습에
관여한다는 것이 알려졌다(Matsumoto 등, 1994). 이러한 과정에서 가장 초기에
발생하는 현상은 원발 병소에 존재하는 암세포간의 결합이 소실되는
과정으로서, 상호 결합이 소실된 암세포는 이동을 하게되고 주변조직으로의 침윤을 거쳐 원격전이를 하게 된다(김철호 등, 2005). 이때 관여하는 물질 가운데 하나가 간세포성장인자 (hepatocyte growth factor, 이하 HGF)로 이는 peptide growth factor 인데 최초 발견시에는 주로 간세포(hepatocyte)의 성장에 관여하는 것으로만 알려졌으나 이후에 간세포뿐만 아니라 위장관 상피세포,
각질세포 등을 위시한 여러 상피세포의 증식을 촉진하는 능력이 있음이
알려졌으며, 일부 암세포에 있어서는 protease 의 분비를 통해 종양의
신생혈관의 생성(angiogenesis)에 관여한다고 알려지게 되었다(Weidner 등, 1990; Grant 등, 1993). HGF 의 최초의 발견은 1984 년에 거의 동시에 3 군데 실험실에서 이루어졌고(Nakamura 등, 1984; Michalopoulos 등, 1984; Russell 등, 1984), 1989 년에는 그 분자구조가 밝혀졌다(Nakamura 등, 1989). 1991 년에는 세포의 유리과정에 작용하는 scatter factor 가 HGF 와 동일한 물질임이 밝혀져 간세포 성장인자를 HGF/SF 로 부르기도 한다(Weidner 등, 1991). HGF 는 섬유모세포, 상피세포, 내피세포, Kupffer cell 등에서 생산되며 폐암, 췌장암,
백혈병, 유방암 등의 세포주에서도 생산이 된다고 알려져 있다(Boros 등, 1995;
Montesano 등, 1991; Wang 등, 1994; Yanagita 등, 1992).
인체의 각 조직의 발달 및 분화를 이루는 과정으로 상피와 중간엽간의 상호작용(epithelial-mesenchymal interaction)이 있으며 신장, 폐, 사지, 치아, 유방 등은 모두 이러한 상피와 중간엽간의 상호작용에 의해 발달과 분화를 이루는데 이러한 상호작용에 있어서 중요한 역할을 하는 것이 HGF 라는 것이 최근의 연구에서 증명되었다(Matsumoto 등, 1996). 실제로 인체에서 HGF 가 하는 역할에 대해서는 아직 확실한 해답은 찾지 못했으나 내피세포의 증식, 세포유리의 촉진, 혈관 형성의 유발 등의 기능이 알려져 있다(Boros 등, 1995). 이러한 HGF 의 정상세포에서의 역할을 근거로 하여 종양세포의 성장, 침윤, 전이과정에서도 HGF 가 관여할 것이라는 추측을 할 수 있는데 실제 다음과 같은 많은 실험에서 이러한 추측이 증명되었다. Bellusci 등은 HGF 유전자를 암세포에 transfection 시켰을 때 암세포의 운동성과 침윤성을 증가시키는 현상을 관찰하였고 최근에는 간질 섬유아세포(stromal fibroblast)에서 분비하는 HGF 를 유도하는 인자가 암세포에서 분비한다는 사실도 보고 되었다(Bellusci 등, 1994). 이는 HGF 가 간질에서 분비되어 암세포의 침윤을 촉진시키는 작용을 하고 이 HGF 의 분비를 유도하는 물질이 암세포에서 분비된다는 것을 의미한다. 즉 정상조직에서 뿐만 아니라 암조직에서도 위에서 말한 상피와
중간엽간의 상호작용이 성립한다는 것을 의미한다. 분비된 HGF 는 표적세포의 수용체에 결합하여 tyrosine kinase 를 활성화하여 작용이 일어나는데 이 수용체는 proto-oncogene 으로 잘 알려진 c-met gene 이 생산하는 분자량 170 kd 인 c-Met 으로 밝혀졌고(Bottaro 등, 1991; Naldini 등, 1991; Rubin 등, 1993), 그 수용체를 지닌 세포는 간세포, 섬유모세포, 각질세포, 멜라닌 세포 등과 신장, 폐, 비장, 조혈 세포, 난소 등으로 알려져 있다(Boros 등, 1995). HGF 와 c-Met 은 paracrine 기전으로 서로 상호작용하여 암의 진행을 촉진하다는 증거가 실험세포에서 증명이 되었으며, 최근 하인두암 조직을 이용한 실험에서 HGF 와 c-Met 이 하인두암의 림프절 전이 및 환자의 예후와 유의한 관련성이 있음이 밝혀졌다(김철호 등, 2004; 김철호 등, 2005). E-cadherin 은 세포 표면에 존재하는 칼슘 의존형 세포 유착물질(Calcium dependent intercelluar Adhesion Molecule, CAM)의 일종인데, 분자량이 120 kd 으로 거의 대부분의 상피세포에서 정상적으로 발현되며, 세포내의 catenin 들과 복합체를 형성하여 세포내의 actin 과 결합하므로써 세포의 골격을 유지하며, 세포간의 유착을 매개하고 조직의 구조를 형성하게 하는 역할을 하고(Takeichi, 1991), 종양세포의 E-cadherin 은 종양의 침윤을 억제하는 기능이 있다(Berhens 등, 1989). 여러 실험에서 항체의 처리에 의해 E-cadherin 을 파괴시키고 나면 세포의 형태가 섬유아세포 모양으로 변하고 세포간의 유착력이 약화되어 침습력이 증대된다고 보고되었고(Berhens 등, 1992), 여러 연구에서 E-cadherin 의 상실이 인체의 각종 악성 종양(위암, 전립선암, 유방암, 자궁경부암, 설암 등)에서 나타난다는 것이 밝혀졌으며 임상적인 예후와도 연관된다는 보고가 많다(Mialhe 등, 1997; Lui 등, 1997). 한편, HGF 가 E-cadherin 의 발현을 조절하는 기능이 있음이 밝혀진 바 있는데, HGF 에 의한 β-catenin 의 tyrosine phosphorylation 이 E-cadherin 의 기능을 억제하여 암세포의 침윤성이 높아졌다는 보고가 있다(Shibamoto 등, 1994).
본 연구는 두경부암 중 가장 예후가 나쁜 암의 하나인 하인두암 조직을 이용하여 면역조직화학적 염색을 통해 E-cadherin 의 발현정도와 하인두암의 진행과의 상관관계를 확인하고, 하인두암세포주에서 HGF 가 E-cadherin 의 발현에 어떤 영향을 미치는지 알아보고자 하였다.
.
Ⅱ 재료
및 방법
A. 하인두암 환자의 조직을 통한 연구 1. 대상 환자 면역조직화학적 염색을 위해서 아주대학교와 연세대학교 이비인후과학 교실에서 1994 년 3 월부터 1998 년 12 월까지 하인두암으로 수술받은 환자 중 Hematoxylin-eosin 염색 표본을 검토하여 파라핀 포매조직의 보관 상태가 양호한 40 예를 선정하여 대상으로 하였다. 이들의 평균 나이는 61.2±8.4 (평균± 표준편차)세로서 46 세에서 76 세까지 분포하였으며 남자는 38 명 여자는 2 명이었다. 대상 조직들은 모두 하인두암의 편평세포암으로 이상와암이 25 예(62.5%), 인두후벽암이 13 예(32.5%) 및 후윤상암이 2 예(5%)였다. 수술적 치료로서 전인두절제술 혹은 부분인두절제술을 시행받은 환자가 8 명, 전후두절제술 및 부분인두절제술을 시행받은 환자가 7 명, 전인후두절제술을 시행받은 환자가 18 명, 전인후두절제술 및 식도전절제술을 시행받은 환자가 7 명이었다. AJCC(2002)의 규정에 따라 병기를 분류하였을 때 I 기와 II 기는 각각 3 명(7.5%), III 기는 4 명(10%), IV 기는 30 명(75%)이었다. 조직의 분화도는 병리조직학적 소견에 따라 well(9 예, 22.5%), moderate(20 예, 50%) 및 poor(11 예, 27.5%) differentiation 으로 구분하였다. 환자들의 생존 여부는 진료기록부 및 전화상담을 통하여 모두 확인할 수 있었으며 평균 추적 기간은 65.4 개월이었다. 2. E-cadherin 에 대한 면역조직화학적 염색면역조직화학적 염색은 labelled streptoavidin biotin kit(LSAB; DAKO Co., CA. USA)를 이용하였고, E-cadherin 에 대한 일차항체는 상품화된 monoclonal mouse
anti-E-cadherin(zymed Lab., Inc., San Francisco, CA)를 이용하였다. 파라핀 블록을 5 ㎛ 두께로 박절하여 슬라이드에 부착시킨후 조직 슬라이드는 xylene 으로 탈파라핀 과정을 거친 후 계열별 ethanol 에 처리한 후 증류수로 5 분간 함수시켰다. 10mM citrate buffer(pH 6)에서 10 분간 micorwave 에서 끓여
항원을 노출시킨 후 내인성 과산화 효소의 활동을 억제시키기 위해 3% H2O2가
포함된 100% methanol 액으로 10 분간 처리하였다. 일차항체는 1:100 으로 희석하여 4℃에서 하루 밤동안 반응시킨 후 biotinylated anti-mouse IgG 와 avidin-biotin-peroxidase conjugate 로 상온에서 각각 20 분간 처리하여 이차항체염색 및 표지항체염색을 하였다. 발색제인 DAB(DAKO)로 약 5 분간 반응시키고, 10 초 동안 Hematoxylin 으로 대조염색하였다. Semisynthetic crystal mount(DAKO)로 mounting 한 후, cover glass 로 덮어서 광학현미경으로 관찰하였다. E-cadherin 발현정도의 평가는 Han 등(한상욱 등, 1998)이 제안한 기준에 따라 모든 조직에 대하여 동일한 1 인의 병리학 전문의가 염색의 양성율에 따라 나누었는데 전체 암세포 중 양성으로 염색된 암세포가 전혀 없는 경우를 음성, 염색되는 암세포의 숫자가 전체 암세포의 20% 이하인 경우를 +, 20 이상 60% 미만인 경우를 ++, 60% 이상인 경우를 +++라고 정의하였다. 또한 염색이 되는 발현위치의 평가는 E-cadherin 발현형태가 세포막에 명확히 선상으로 염색이 되는 경우를 세포막형(membranous type), 세포질내에 주로 염색이 되거나 전혀 염색이 되지 않아 세포막을 따라 선상으로 나타나지 않는 경우를 비세포막형(non-membranous type)이라고 정의하였다. B. 하인두암 세포주를 이용한 연구 1. 세포배양
American Type Culture Collection(ATCC)으로부터 구입한 하인두암 세포주 FaDu(HTB-43, ATCC)를 EMEM(10% FBS) 배지에서 5% CO2, 37°C 에서 배양하였다.
2. RT-PCR 에 의한 E-cadherin 의 mRNA 측정
HGF 의 농도에 따른 E-cadherin 의 발현 정도를 평가하기 위해 HGF 0(control), 10ng/㎖와 30ng/㎖로 처리한 하인두암 세포주 FaDu 를 5 일간 배양하고 배양된 조직을 1ml 의 TRIzol® (GIBCOBRL, Grand Island, NY, USA) 시약에 균질화시킨 후, 총 RNA 를 추출하였다. 하인두암 세포주에서 추출된 총 RNA 2 ㎍을 각각 Omniscript Reverse Transcriptase kit(20511, Qiagen Germany)의 반응혼합물{10X Buffer RT 2.0 ㎕, dNTP Mix(5mM each dNTP) 2.0 ㎕, Oligo-dT primer(10µM) 2.0 ㎕, RNase inhibitor(10units/µl) 1.0 ㎕, Omniscript Reverse Transcriptase 2units, RNase-free water} 20 ㎕에 넣고 37℃에서 60 분, 94℃에서 5 분간 역전사하여 cDNA 를 합성하였다. PCR 은 MinicyclerTM(MJ research, USA)를 사용하였고 합성된 cDNA 를 Taq DNA polymerase 1 unit(Roche Diagnostics Co, Indianapolis, USA)과 각각의 primer 를 넣어 증폭시켰다. 이 실험에서 사용된 E-cadherin primer 의 염기배열 순서는 다음과 같다.
human E-cadherin ;
sense: 5′-AGC CAT GGG CCC TTG GAG -3′ antisense: 5′-CCA GAG GCT CTG TCA CCT TC -3′
PCR 과정은 초기 변성을 94℃에서 3 분간 실시한 후, 94℃에서 30 초, 59℃에서 30 초, 72℃에서 30 초간을 총 36 cycles 을 실시하였고 신전(extension)은 72℃에서 5 분간 시행하였다.
HGF 의 농도에 따른 E-cadherin 의 발현 정도를 평가하기 위해 HGF 0(control), 10ng/㎖와 30ng/㎖로 처리한 하인두암 세포주 FaDu 를 5 일간 배양하고 배양된 세포주를 phosphate buffered saline (PBS)으로 세척한 다음 단백질분해 억제제(100 ㎍/㎖ phenylmethylsulfonyl fluoride, 1 ㎍/㎖ leupeptin)가 첨가된 RIPA(RadioImmunoPrecipitation) buffer 1 ㎖ {150mM NaCl, 1% NP-40, 50 mM Tris(pH 8.0), 1 mM EDTA, 0.5% Deoxycholate}에 넣고 균질화 하였다. 이 균질액을 15,000 rpm 에서 10 분간 원심분리 후 상층액을 Western blot analysis 에 이용하였는데 단백질의 양은 Bio-Rad protein assay (Bio-Rad, Hercules, CA USA)를 이용하여 측정하였다. Well 당 20 ㎍의 단백질을 분리하기 위해 sodium dodesyl sulfate (SDS)-polyacrylamide gel electrophoresis (PAGE)를 사용하여 분리한 후 nitrocellulose filter (Amersham, Arlington Heights, IL. USA)에 옮긴 다음 4℃에서 48 시간 동안 항 E-cadherin 항체를 반응시켰다. 이후 filter 를 0.1% Tween-20 이 함유된 Tris buffered saline(TBS) 용액으로 세척한 후 peroxidase-conjugated donkey rabbit antibody (Amersham)와 donkey anti-mouse antibody (Amersham)로 각각 반응시킨 후 enhanced chemiluminescence detection system (ECL, Amersham)을 이용하여 X-ray film 으로 확인하였다.
C. 통계적 분석
면역조직화학적 염색결과는 Chi-squared test, Mentel-Henzel trend test 를 시행하였으며, 생존분석은 Kaplan-Meier 법을 이용하였고 그 의의는 Log-rank test 로 평가하였다. 모든 통계는 p 값이 0.05 이하인 경우를 통계학적으로 유의한 것으로 판정하였다.
.
Ⅲ 결
과
A. 하인두암 조직에서 E-cadherin 의 발현정도(intensity)와 임상 양상과의 관계 cadherin 에 대한 면역조직화학염색을 시행한 후, 염색의 양성율에 따라 E-cadherin 발현정도를 평가하였는데 전체 암세포 중 양성으로 염색된 암세포가 전혀 없는 음성은 없었으며, 40 예 모두 에서 양성을 보였는데, 대부분의 하인두암세포의 암세포에서의 E-cadherin 의 발현은 주로 암세포의 세포질내에 미만성으로 진하게 염색이 되었고 일부 세포막을 따라 염색되기도 하였으며 암세포 주변의 기질세포(stromal cell)에서도 염색이 되었다. 일부 종양 주변의 정상세포에서도 상피세포의 기저층에서 약하게 염색이 되었다. 염색되는 암세포의 숫자가 전체 암세포의 20% 이하인 +가 10 예(25%), 20% 이상 60% 미만인 ++가 22 예(55%), 60% 이상인 +++가 8 예(20%) 로서(Fig. 1), +군을 발현감소군(reduced group)으로 ++군과 +++군을 발현증가군(increased group)으로 분류하여 임상양상과의 관계를 살폈다(Table 1). 종양의 크기에 따른 E-cadherin 의 염색양상을 보면 원발종양의 크기가 4cm 이하인 T1 과 T2 에서는 E-cadherin 의 발현감소군이 10%, 종양의 크기가 4cm 이상인 T3 와 T4 에서는 발현감소군이 30%로 종양의 크기가 큰 경우에 E-cadherin 의 발현이 감소되는 경향을 보였으나 통계적인 의의는 없었으며(p=0.206), 림프절 전이가 없는 경우 E-cadherin 의 발현감소군이 14.2%였으나 림프절 전이가 있는 경우 발현감소군이 30.8%로 나타나 림프절 전이가 있는 경우 발현이 감소되는 경향을 보였으나 역시 통계적인 의의는 없었다(p=0.251). 전신전이의 경우 전이가 없는 경우과 있는 경우 모두 E-cadherin 의 발현감소군이 25%로 경향성이 없었고, 병기에 따른 분류에서는 조기암에 속하는 I, II 기에서는 E-cadherin 의 발현감소군이 16.7%였으나 진행암에 속하는 III, IV 기에서는발현감소군이 26.4%로 나타나 병기가 진행할수록 E-cadherin 의 발현이 감소되는 경향을 보였으나 통계적인 의의는 없었다(p=0.609). 병리학적인 분화도에 따른 E-cadherin 의 발현 및 재발여부에 따른 분석에서도 특별한 경향성을 찾을 수 없었다.
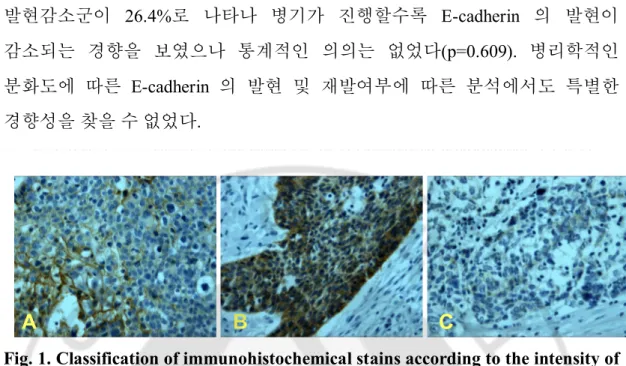
Fig. 1. Classification of immunohistochemical stains according to the intensity of E-cadherin expression in hypopharyngeal SCC tissue. All tissues were positive
for the immunohistochemical staining of E-cadherin. A is an one positive(+) group(positive staining cancer cells are less than 20% of all cancer cells) and 25%(n=10) of all stains. B is a two positive(++) group(positive staining cancer cells are between 20% and 60% of all cancer cells) and 55%(n=22) of all stains. C is a three positive(+++) group (positive staining cancer cells are not less than 60% of all cancer cells) and 20%(n=8) of all stains(× 400).
Table 1. Correlation between the intensity of E-cadherin expression and the clinicopathologic factors.
Variables Intensity of E-cadherin(%) p-value
Increased(+++/++ 75%) Reduced(+/- 25%) T 1, 2(n=10) 9(90) 1(10) 0.206 3, 4(n=30) 21(70) 9(30) N -(n=14) 12(85.8) 2(14.2) 0.251 +(n=26) 18(69.2) 8(30.8) M -(n=32) 24(75) 8(25) 1.000 +(n=8) 6(75) 2(25) Pathologic stage I, II(n=6) 5(83.3) 1(16.7) 0.609 III, IV(n=34) 25(73.6) 9(26.4) Pathologic grade well(n=9) 5(55.6) 4(44.4) 0.540 moderate(n=20) 16(80) 4(20) poor(n=11) 9(81.8) 2(18.2) Recurrence -(n=37) 27(73) 10(27) 0.298 +(n=3) 3(100) 0(0)
The intensity of E-cadherin was not statistically correlated with any factor.
추적기간 중 전체 40 예의 환자중 14 예가 사망하여 65%의 생존율을 보였는데 이중 8 예는 국소재발에 의해서 사망하였고 4 예는 전신전이에 의해, 2 예는
국소재발과 전신전이에 의해 사망하였다. E-cadherin 의 발현증가군은
생존율이 70%, 발현감소군은 생존율이 50%로 차이가 있었으나 생존분석은
Kaplan-Meier 법을 이용하였고 그 의의는 Log-rank test 로 평가하였을 때 p-value 가 0.251 로 통계적인 유의성은 없었다(Fig. 2).
Fig. 2. Survival curves of hypopharyngeal carcinoma patients according to the intensity of E-cadherin expression. No correlation was found between the survival
and the intensity of E-cadherin expression.
B. 하인두암 조직에서 E-cadherin 의 발현위치(location)와 임상 양상과의 관계 E-cadherin 에 대한 면역조직화학염색을 시행한 후, 염색이 되는 발현형태에 따라 E-cadherin 발현위치를 평가하였는데 E-cadherin 발현형태가 세포막에 명확히 선상으로 염색이 되는 세포막형(membranous type)이 20 예(50%), 세포질내에 주로 염색이 되거나 전혀 염색이 되지 않아 세포막을 따라 선상으로 나타나지 않는 비세포막형(non-membranous type)이 20 예(50%)였고(Fig. 3), 이 두 군과 임상양상과의 관계를 살폈다(Table 2). 종양의 크기에 따른 E-cadherin 의 염색양상을 보면 원발종양의 크기가 4cm 이하인 T1 과 T2 에서는 비세포막형군이 30%, 종양의 크기가 4cm 이상인 T3 와 T4 에서는 비세포막형군이 56.7%로 종양의 크기가 큰 경우에 Increased (n=30) Red uc ed (n =10) (S urviva l % ) (M onths) 10 20 30 40 50 60 100 80 60 40 20 ( P = 0.251 )
비세포막형군이 증가되는 경향을 보였으나 통계적인 의의는 없었다(p=0.144). 림프절 전이가 없는 경우에는 세포막형군이 78.6%, 비세포막형군이 21.4%였으나 림프절 전이가 있는 경우에는 세포막형군이 34.6%로 감소하고, 비세포막형군이 65.4%로 증가하는 역전이 명확하게 나타나면서, 림프절 전이가 있는 경우 통계적으로 유의하게 비세포막형군이 증가되는 경향을 보였다(p=0.008). 전신전이의 경우 전이가 없는 경우에 비세포막형군이 43.7%, 전이가 있는 경우에 비세포막형군이 75%로 후자의 경우에 비세포막형군이 증가되는 경향을 보였으나 통계적인 의의는 없었으며(p=0.144), 병기에 따른 분류에서는 조기암에 속하는 I, II 기에서와 진행암에 속하는 III, IV 기 모두에서 비세포막형군이 50%로서 경향성이 없었다. 병리학적인 분화도에 따른
분석에서는 고분화군(well differentiated group), 중분화군(moderate differentiated group) 및 저분화군(poor differentiated group)에서 비세포막형군이 각각 22.5%, 55% 및 63.6%의 비율을 보여 병리학적 분화도가 나쁠수록 비세포막형군이 증가되는 경향을 보였으나 통계적인 의의가 없었으며(p=0.288), 재발여부에 따른 분석에서는 재발이 없는 경우에는 세포막형군이 54%, 비세포막형군이 46%였으나 재발이 있는 경우에는 세포막형군이 0%로 감소하고, 비세포막형군이 100%로 증가하는 역전이 명확하게 나타났으나 통계적으로는 유의한 경향성을 찾을 수 없었는데(p=0.072), 아마도 재발군의 집단수가 3 예로 작은 것이 작용한 것으로 사료된다.
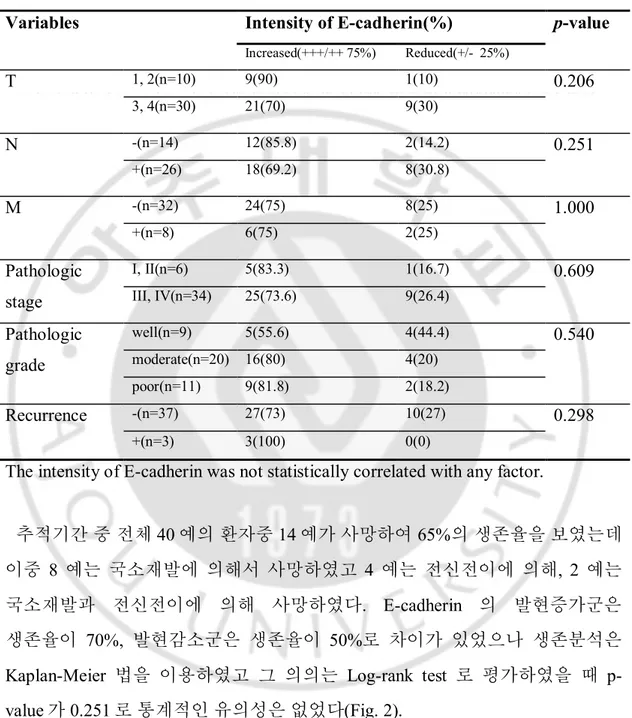
Fig. 3. Classification of immunohistochemical stains according to the location of E-cadherin expression in hypopharyngeal SCC tissue. A is a membranous
group(50%, n=20) which has the membraneous expression of E-cadherin along the cell-cell boundaries. B is a non-membranous groups(50%, n=20) which has the reduced membraneous expression of E-cadherin along the cell-cell boundaries and shows the cytoplasmic expression.(× 400).
Table 2. Correlation between the location of E-cadherin expression and the clinicopathologic factors.
Variables Location of E-cadherin(%) p-value
Membranous(50%) Non-membranous(50%) T 1, 2(n=10) 7(70) 3(30) 0.144 3, 4(n=30) 13(43.3) 17(56.7) N -(n=14) 11(78.6) 3(21.4) 0.008 +(n=26) 9(34.6) 17(65.4) M -(n=32) 18(56.3) 14(43.7) 0.144 +(n=8) 2(25) 6(75) Pathologic stage I, II(n=6) 3(50) 3(50) 1.000 III, IV(n=34) 17(50) 17(50) Pathologic grade well(n=9) 7(77.8) 2(22.2) 0.288 moderate(n=20) 9(45) 11(55) poor(n=11) 4(36.4) 7(63.6) Recurrence -(n=37) 20(54) 17(46) 0.072 +(n=3) 0(0) 3(100)
The location of E-cadherin was siginificantly correlated with lymph node metastasis(p<0.05).
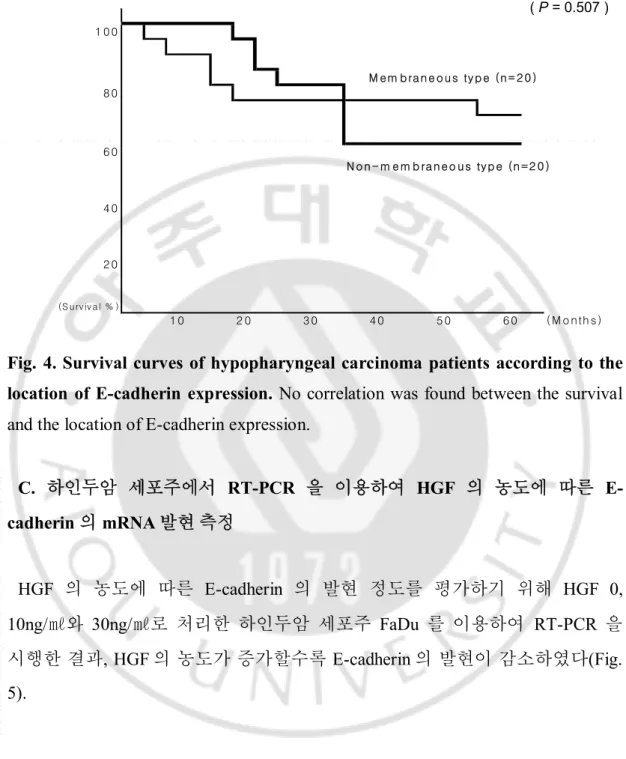
추적기간 중 세포막형군은 생존율이 70%, 비세포막형군은 생존율이 60%로
차이가 있었으나 생존분석은 Kaplan-Meier 법을 이용하였고 그 의의는 Log-rank test 로 평가하였을 때 p-value 가 0.507 로 통계적인 유의성은 없었다(Fig. 4).
Fig. 4. Survival curves of hypopharyngeal carcinoma patients according to the location of E-cadherin expression. No correlation was found between the survival
and the location of E-cadherin expression.
C. 하인두암 세포주에서 RT-PCR 을 이용하여 HGF 의 농도에 따른 E-cadherin 의 mRNA 발현 측정 HGF 의 농도에 따른 E-cadherin 의 발현 정도를 평가하기 위해 HGF 0, 10ng/㎖와 30ng/㎖로 처리한 하인두암 세포주 FaDu 를 이용하여 RT-PCR 을 시행한 결과, HGF 의 농도가 증가할수록 E-cadherin 의 발현이 감소하였다(Fig. 5). 1 0 0 M e m b ra n e o u s ty p e (n = 2 0 ) 8 0 6 0 N o n - m e m b ra n e o u s ty p e (n = 2 0 ) 4 0 2 0 (S u rv iv a l % ) 1 0 2 0 3 0 4 0 5 0 6 0 (M o nth s) ( P = 0.507 )
Fig. 5. RT-PCR of E-cadherin expression in FaDu cells. According to the
concentration of HGF, the decreased expression of E-cadherin mRNA was detected.
D. 하인두암 세포주에서 Western blotting 을 이용하여 HGF 의 농도에 따른 E-cadherin 의 발현 검색 HGF 의 농도에 따른 E-cadherin 의 발현 정도를 평가하기 위해 HGF 0, 10ng/㎖와 30ng/㎖로 처리한 하인두암 세포주 FaDu 를 이용하여 Western blotting 을 시행한 결과, HGF 의 농도가 증가할수록 E-cadherin 의 발현이 감소하였다 (Fig. 6).
Fig. 6. Western Blot of E-cadherin expression in FaDu cells. According to the
concentration of HGF, the decreased expression of E-cadherin protein was detected.
Control 10ng/ml 30ng/ml
.
Ⅳ 고
찰
종양의 침투와 전이의 복잡한 단계에 있어서 중요한 첫 단계는 암세포간의 이탈로 알려져 있지만(Coman 등, 1994; Nicolson 등, 1988) 이러한 세포간의 유착이 소실되는 기전에 관한 설명은 아직 밝혀지지 못한 상태이다. 최근까지 세포간의 유착에 관련된 물질로 알려진 주된 분자들은 크게 칼슘 의존형 분자(calcium-dependent molecule)와 칼슘 비의존형분자(calcium-independent molecule)로 나눌 수 있고(Takeichi, 1977) calcium-dependent adhesion molecule(cadherin)이 세포간 유착에 가장 중요한 역할을 한다고 추측하고 있는데(Shirayoshi 등, 1983) 이는 cadherin 에 대한 항체로 세포를 처리하면 세포간의 결합이 소실되고(Yoshida 등, 1984), 내인성 cadherin 의 활성이 없는 세포에 cadherin cDNA 를 transfection 시켰을 때 유착능을 갖게하는 실험(Nagafuchi 등, 1987)들을 통해 알 수 있다. Cadherin 을 발현되는 조직의 장소에 따라 분류하여 보면 상피세포에서 표현되는 E-cadherin, 신경조직에서 분포하는 N-cadherin, 태반에서 분포하는 P-cadherin 등 세가지 유형으로 나눌 수 있는데(Yoshida 등, 1984) 그 중 E-cadherin 은 catenin 복합체와 결합하고 살아있는 세포층 어디에서도 발현되며(Williams 등, 1998; Bagutti 등, 1998) zonula adherens 에 위치하고 세포벽을 통해 actin bundle 과 연결되어 있다(Hirano 등, 1987). Cadherin 은 120 KDa 의 당단백으로 세포외 영역(extracelluar domain)과 세포막 영역(transmembrane domain)으로 구성되어 있다. 세포외 영역은 칼슘으로 결합된 다섯 개의 직렬로 반복되는 domain 으로 구성되며, 인접한 세포의 cadherin 의 세포외 영역과 결합한다. 세포내 영역은 여러가지 catenin 인 α-(102 KDa), β-(88 KDa), γ-(82 KDa) catenin 과 p120cat을 통하여 actin 세포골격과 결합한다. 상피세포의 세포유착은 주로 E-cadherin 에 의해 이루어지며, 이는 대부분 zonula adherens junction 에 위치한다. E-cadherin복합체는 동일한 세포에서 두 가지 형태가 발견되는데 한 가지는 E-cadherin 과 α-, β-catenin 으로 구성되어 있고, 다른 한 가지는 E-cadherin 과 α-, γ-catenin 으로 구성된다(Lo 등, 2002; Chow 등, 2001). E-cadherin 은 cytoplasmic tail 에 적어도 두 개의 특징적인 단백결합영역(protein binding epitopes)을 가지고 있다. 하나는 catenin-binding domain(CBD, C-terminal domain)으로 β- 또는 γ-catenin 이 서로 경쟁적으로 결합을 하여 α-catenin 을 통해 actin cytoskeleton 에 cadherin 이 부착되게 한다. 다른 한 가지는 cadherin 의 juxtamembrane domain(JMD)으로서 이는 p120cat 와 연관이 있으며 α-catenin 과는 결합하지 않는다(Lo 등, 2002; Anastasiadis 등, 2000). p120cat 은 비특이적인 신호에 반응하여 cadherin-mediated
adhesion 을 증가시키거나 억제시키는 switch 로 작용하는 것으로 추정된다(Anastasiadis 등, 2000). E-cadherin 발현에 관한 문헌들을 고찰하여 보면 그 결과가 상당히 다양한데 이는 발현의 평가 기준이 각기 달랐고 사용한 일차 항체가 달랐기 때문일 것이나, 대부분의 결론은 악성종양의 분화도가 나빠질수록 유의하게 E-cadherin 의 발현이 소실된다는 것으로서(한상욱 등, 1998) 이러한 상관성은 위암(Gabbert 등, 1996), 유방암(Moll 등, 1993), 대장암(Van de Wurrf 등, 1992), 방광암(Bringuier 등, 1993) 등 여러 장기의
종양에 대한 연구에서도 미분화암으로 갈수록 발현이 약해졌다는 공통된 결과를 보고하고 있다. 특히 위암조직을 이용하였던 한 등은 분화도 뿐 아니라 림프절 전이, 복강내 전이 및 병기 역시 E-cadherin 발현의 소실과 유의한 관련이 있다고 보고하였다(한상욱 등, 1998). 두경부암 영역에서 Bowie(Bowie 등, 1993), Downer(Downer 등, 1993), 이(이수진 등, 2003), 심(심우영 등, 2004) 등은 분화도와 E-cadherin 의 발현과는 통계학적 연관관계가 없다고 보고하였으나, Sorscher(Sorscher 등, 1995), 전(전진하 등, 2001) 등은 분화도가 낮을수록 E-cadherin 의 발현 정도가 감소하는 상관관계를 보인다고 하였고, 그 밖에 Schipper(Schipper 등, 1994) 등은 E-cadherin 의 발현이 림프절 전이여부와
연관이 있는 것으로 보고하였다. 본 연구에서는 E-cadherin 의 발현정도(intensity)와 임상 양상과의 관계에서는 통계적으로 유의한 결과가 나오지는 않았지만, 종양의 크기에 따른 E-cadherin 의 염색양상에서는 원발종양의 크기가 큰 경우에 E-cadherin 의 발현이 감소되는 경향성을 의심해볼 수 있었다(p=0.206). E-cadherin 의 발현정도 뿐만 아니라 세포내에서 E-cadherin 의 발현위치도 중요한데, Gabbert 등 (Gabbert 등, 1996)은 E-cadherin 의 이러한 세포질내 발현을 “plaque-like” expression 이라고 명칭하였는데 이러한 발현은 주로 미분화암이나 인환세포암에서 빈발하다고 하였다. 암세포 고유의 분화가 파괴되기 위해서는 세포들의 극성(polarization)이 상실되고 세포간의 결합이 소실되어야 한다. 이때 세포막 밖에 존재하는 E-cadherin 은 세포내의 actin 과 결합하여 분화를 유지할 수 있는데 이러한 결합이 E-cadherin 의 소실로 말미암아 상실되므로 분화도가 나빠진다고 할 수 있다. 또한 세포질내 발현의 기전은 E-cadherin 유전자의 돌연변이에 의해 결함을 지닌 E-cadherin 이 세포막까지 수송이 되지 못하여 나타난 현상이거나(Becker 등, 1993) 세포간의 결합이 소실되면서 세포결합 물질의 endocytotic internalization 으로 설명되고 있다(Kartenbeck 등, 1991). 본 연구의 결과에서도 E-cadherin 의 발현위치 (location)와 임상 양상과의 관계에서 림프절 전이가 있는 경우 비세포막형군이 증가되는 통계적으로 유의한 연관성을 보였고(p=0.008), 재발여부에 따른 분석에서는 재발군의 집단수가 3 예로 작아 비록 통계적으로 유의하지는 않았으나 재발이 있는 경우에는 비세포막형군이 증가하는 경향성을 찾아볼 수 있었으므로, E-cadherin 이 하인두암의 림프절전이를 조절하는 중요한 인자라고 강력하게 사료되며, 재발을 조절하는 인자로서는 향후 추가적인 연구가 필요할 것으로 생각된다.
HGF 는 정상적인 상태에서 세포의 증식, 이동, 침습, 관(tube)형성과 혈관형성에 관여하여 상처의 치유나 몸의 기관을 형성하는데 매우 중요한 역할을 하는 것으로 알려져 있다(Weidner 등, 1990; Grant 등, 1993). 이러한 생리적이고 발생학적으로 중요한 기능 외에 종양 등의 병적인 상태에서도 이와 유사한 기능을 하는 것이 알려지면서 종양의 침습이나 전이에 있어 HGF 의 역할에 대한 연구가 위장관암, 폐암, 췌장암, 백혈병, 유방암 등의 다양한 암종에서 진행되어 왔으며(Boros 등, 1995; Montesano 등, 1991; Wang 등, 1994; Yanagita 등, 1992), 이러한 연구의 결과 HGF 가 종양주변의 섬유아세포에서 분비되어 암세포의 주변 기질로의 침습을 돕는 역할을 하는 것으로 알려지게 되었다. HGF 는 HGF 수용체를 갖고 있는 상피세포 혹은 내피세포의 강력한 세포증식과 운동능력을 유발하며 세포의 형태학적인 변형을 초래한다. 이러한 세포의 운동능력과 형태학적인 변형에 있어서 세포내 actin 과 같은 세포골격의 변형과 상피세포간의 해리현상이 중요하다(Trusolino 등, 2000). HGF 는 세포간극에 존재하는 주요 간극 단백질(major tight junction protein)인 zonula occludens-1 를 크게 감소시키고(Grisendi 등, 1998) β-catenin 을 인산화시켜 E-cadherin 과 β-catenin 에 의해 형성되는 세포간극을 소실시키는 것으로 알려져 있다(Shibamoto 등, 1994; Potempa 등, 1998). Tanafel 등(Tannapfel 등, 1994)은 HGF 의 자극으로 위암세포주의 분산이 초래되고 이때 Ecadherin 의 감소가 동반됨을 관찰하였고, Balkovetz 등(Balkovetz 등, 1997)은 Madin-Darby canine kidney(MDCK) 세포주를 HGF 로 처리한 결과 세포의 극성(polarity)이 소실되면서 E-cadherin 이 세포막에서 세포질로 이동하고 또한 E-cadherin 의 생산 감소가 동반함을 관찰하였으며 이러한 변화는 cadherin 과 관련된 단백질들의 tyrosine phosphorylation 을 통해 발생한다고 하였다. 이러한 과정을 통해 떨어진 세포는 섬유아세포 형태로 변하면서 세포의 표면에 lamellae 나 lamellipodia 등을 형성하는데 이러한 현상이 세포의 운동성을 증가시킨다
(Warn 등, 2001). 따라서 HGF 는 E-cadherin 의 변화에 직접 또는 간접적인 영향을 미쳐 세포간의 유착을 소실시킴을 유추할 수 있으며, 한 등은 위선암 환자들의 혈청이나 암조직의 HGF 농도가 높다는 것을 관찰한 후(한상욱 등, 1997) 위암세포주를 이용하여 HGF 가 E-cadherin 의 발현 장소를 세포막에서 세포질로 이동하게 하고 세포막의 기능성 E-cadherin 을 감소시키는 역할을 함을 보고하였고(한상욱 등, 2000), 김 등은 하인두암세포주를 이용하여 하인두암의 증식과 전이에 종양주변의 섬유아세포에서 분비되는 HGF 가 관여함을 보고하였다(김철호 등, 2005). 본 연구에서 저자는 E-cadherin 의 발현에 미치는 HGF 의 영향을 하인두암세포주를 이용하여 확인하여 보았으며, 그 결과 FaDu 의 단층배양에서 외인성 HGF 의 농도가 증가함에 따라 E-cadherin 의 mRNA 및 protein 발현이 감소하는 것을 확인하였다.
Ⅴ.
결 론
본 연구를 요약하면 E-cadherin 의 발현정도(intensity)와 임상 양상과의 관계에서는 통계적으로 유의한 결과가 나오지는 않았지만, E-cadherin 의 발현위치(location)와 임상 양상과의 관계에서는 림프절 전이가 있는 경우 비세포막형군(non-membranous group)이 증가되는 통계적으로 유의한 연관성을 보였다(p=0.008). 한편, 하인두암세포주(FaDu cell)에서의 RT-PCR 결과와 Western blot 결과를 통해 HGF 의 농도가 증가할수록 E-cadherin 의 mRNA 및protein 발현이 감소하는 것을 확인할 수 있었다. 즉 하인두암조직의 면역조직화학적 염색상 E-cadherin 의 이상발현이 하인두암의 림프절 전이와 진행에 관련이 있으며, 하인두암에서 이러한 E-cadherin 의 이상발현에 HGF 가 영향을 미침으로써 하인두암의 증식, 분산, 이동과 침습에 관여할 것으로 추정할 수 있다. 비록 통계적으로 유의하지는 않았으나, 종양의 크기에 따른 E-cadherin 의 염색양상에서는 원발종양의 크기가 큰 경우에 E-E-cadherin 의 발현이 감소되는 경향성을 의심해볼 수 있었고, 재발여부에 따른 발현위치 (location)와의 관계분석에서 재발이 있는 경우에는 비세포막형군이 증가하는 경향성을 찾아볼 수 있었으므로, 향후 추가적인 연구가 필요할 것으로 사료된다. 본 연구의 결과를 임상적으로 응용한다면 향후 E-cadherin 을 암환자의 예후판정 요소로 이용할 수 있으리라 생각되며, 하인두암에서 E-cadherin 의 이상발현에 영향을 미치는 HGF 에 대하여 이를 억제하는 HGF 의 길항제가 새로이 치료에 이용될 수 있으리라 생각된다.
참고문헌
1. 구영아, 나경섭, 박명근, 한광식, 박영민, 심정원: 두경부편평세포암종에서 Ecadherin 발현양상과 임상병기, 세포 분화도의 연관성에 대한 연구. 대한이비인후과학회지 43: 967-971, 2000 2. 김철호, 문성균, 배준호, 이재호, 최은창: 간세포성장인자가 하인두 편평세포암 세포주의 증식, 분산과 이동에 미치는 영향.대한이비인후과학회지 48: 208-215, 2005 3. 김철호, 문성균, 배준호, 이재호, 한재호, 최은창: 하인두 편평세포암에서 간세포성장인자와 그 수영체인 c-Met 의 발현. 대한이비인후과학회지 47: 1135-1141, 2004 4. 심우영, 왕수건, 이병주, 노환중, 고의경, 전경명 등: 설편평세포암종에서 E- cadherin 및 Catenins(α, β, γ, p120cat)의 발현과 임상병리소견과의 연관성 대이비인후과학회지 47: 1004-1012, 2004
5. 이수진, 김민식, 선동일, 조승호, 이근석: 구강설 편평세포암종에서 E-cadherin 과 Matrix Metalloproteinase-2 의 발현. 대한이비인후과학회지 46: 686- 691, 2003
6. 전진하, 김민식, 황성재, 정상희, 이종우, 조승호 등: 설 편평세포암종에서 E- cadherin 과 β- catenin 의 발현. 대이비인후과학회지. 44: 1177-1182, 2001
7. 한상욱, 이원홍, 김욱환, 김명욱, 이재호, 송상요 등: 위암세포주에서 간세포성장인자가 E-cadherin 의 발현에 미치는 영향. 대한암학회지 32: 852-862, 2000 8. 한상욱, 이재호, 김욱환, 왕희정, 조용관, 김명욱: 위선암의 진행과 간세포성장인자와의 관계. 대한암학회지 29: 367-374, 1997 9. 한상욱, 주희재, 이재호, 김욱환, 조용관, 김명욱: 위암으 진행과 간세포성장인자(HGF), Met 그리고 E-cadherin 발현간의 상호관계. 대한외과학회지 55: 53-64, 1998
10. Anastasiadis PZ, Reynolds AB: The p120 catenin family: Complex role in adhesion, signaling and cancer. J Cell Sci 113: 1319-1334, 2000
11. Bagutti C, Speight PM, Watt FM: Comparison of intergin, cadherin and catenin expression in squamous cell carcinoma of the oral cavity. J Pathol 186: 8-16, 1998 12. Balkovetz DF, Pollack AL, Mostov KE: Hepatocyte growth factor alters the polarity of Madin-Darbycanine kidney cell monolayers. J Biol Chem 272: 3471-3477, 1997
13. Becker KF, Atkinson MJ, Reich U, Huang HH, Nekarda H, Siewert JR, Hofler H: Exon skipping in the E-cadherin gene transcript in metastatic human gastric carcinomas. Hum Mol Gene. 2: 803, 1993
14. Bellusci S, Moens G, Gaudino G, Comoglio P, Nakamura T, Thiery JP, et al: Creation of an hepatocyte growth factor/scatter factor autocrine loop in carcinoma
cells induces invasive properties associated with increased tumorigenicity. Oncogene 9: 1091-1099, 1994
15. Berhens J, Frixen U, Schipper J, Weidner M, Virchmeier W: Cell adhesion in invasion and metastasis. Semin Cell Biol 3: 169-178, 1992
16. Berhens J, Mareel MM, Van Roy FM, Virchmeier W: Dissecting tumor cell invasion: epithelial cells acquire invasive properties after loss of uvomorulin-mediated cell-cell adhesion. J Cell Biol 108: 2435-2440, 1989
17. Boros P, Miller CM: Hepatocyte growth factor: a multifunctional cytokine.
Lancet 345: 293-5, 1995
18. Bottaro DP, Rubin JS, Faletto DL, Chan AML, Kmiecik TE, Vande Woude GF, et al: Identification of the hepatocyte growth factor receptor as the c-met proto-oncogene product. Science 251: 802-804, 1991
19. Bowie GL, Caslin AW, Roland NJ, Field JK, Jones AS, Kinsella AR: Expression of the cell-cell adhesion molecule E-cadherin in squamous cell carcinoma of the head and neck. Clin Otolaryngol 18: 196-201, 1993
20. Bringuier PP, Umbas R, Schaafsma E, Karthaus HFM, Debruyne FMJ, Schalken JA: Decreased E-cadherin immunoreactivity correlates with poor survival in patients with bladder tumors. Cancer Res 53: 3241, 1993
21. Chow V, Yuen AP, Lam KY, Tsao GS, Ho WK, Wei WI: A comparative study of the clinicopathological significance of E-cadherin and catenins (α, β, γ) expression in the surgical management of oral tongue carcinomas. J Cancer Res Clin Oncol 127:
22. Coman DR: Decreased mutual adhesiveness, a property of cells from squamous cell carcinomas. Cancer Res 4: 625, 1994
23. Downer CS. Speight PM: E-cadherin expression in normal, hyperplastic and malignant oral epithelium. Eur J Cancer B Oral Oncol 29B: 303-305, 1993
24. Gabbert HE, Mueller W, Schneiders A, Meier S, Moll R, Birchmeier W, Hommel G: Prognostic value of E-cadherin expression in 413 gastric carcinomas. Int
J Cancer 69: 184, 1996
25. Grant DS, Kleinman HK, Goldberg ID, Bhargava MM, Nichkoloff BJ, Kinsella JL et al: Scatter factor induces blood vessel formation in vivo. Proc Natl Acad Sci US. 90: 1937-1941, 1993
26. Grisendi. S., Arpin, M., Crepaldi T: Effect of hepatocyte growth factor on assembly of zonula occludens-1 protein at the plasma membrane. J Cell Physiol 176: 465-471, 1998
27. Hirano S, Nose A, Hatta K, Kawakami A, Takeichi M: Cadherin: subclass specificities and possible involvement of actin bundles. J Cell Biol 105: 501, 1987 28. Kartenbeck J, Schmelz M, Franke WW, Geiger B: Endocytosis of junctional cadherins in bovine kidney epithelial(MDCK) cells cultured in low Ca2+ ion medium.
J Cell Biol 113: 881, 1991
29. Lo L, Pannone G, Staibano S, Mignogna MD, Serpico R, Fanali S, et al: p120cat delocalization in cell lines of oral cancer. Oral Oncol 38: 64-72, 2002
30. Lui M, Lawson G, Delos M, Jamart J, Remacle M: Expression of E-cadherin adhesion molecule in vocal cord carcinomas. Eur Arch Otorhinolaryngol 254: 417-421, 1997
31. Matsumoto K, Nakamura T: Emerging multipotent aspects of hepatocyte growth factor. J Biochem 119: 591-600, 1996
32. Matsumoto K, Nakamura T, Kramer RH. Hepatocyte Growth Factor/Scatter Factor Induces Tyrosine Phosphorylation of Focal Adhesion Kinase(p125FAK) and Promotes Migration and Invasion by Oral Squamous Cell Carcinoma Cells: J Biol
Chem 269: 31807-31813, 1994
33. Mialhe A, Louis J, Montlevier S, Peoch M, Pasquier D, Bosson JL, et al: Expression of E-cadherin and α, β and γ-catenins in human bladder carcinomas: Are they good prognostic factor? Invasion Metastasis. 17: 124-137, 1997
34. Michalopoulos G, Houck KA, Dolan ML, Leutteke NC: Control of hepatocyte replication by two serum factors. Cancer Res 44: 4414-4419, 1984
35. Moll R, Mitze M, Frixen UW, Birchmeier W: Diffferential loss of E-cadherin expression in infiltrating ductal and lobular breast carcinomas. Am J Pathol 143: 1731, 1993
36. Montesano R, Matsumoto K, Nakamura T, Orci L: Identification of a fibroblast-derived epithelial morphogen as hepatocyte growth factor. Cell 67: 901-908, 1991 37. Nagafuchi A, Ahirayshi Y, Okazaki K, Yosuda K, Takeichi M: Transformation of cell adhesion properties by exogenously introduced E-cadherin cDNA. Nature
38. Nakamura T, Nawa K, Ichihara A. Partial purification and characterization of hepatocyte growth factor from serum of hepatectomized rats: Biochem Biophys
ResCommon 122: 1450-1459, 1984
39. Nakamura T, Nishizawa T, Hagiya M, Seki T, Shimonishi M, Sugimura A, et al : Molecular cloning and expression of human hepatocyte growth factor. Nature 342: 440-443, 1989
40. Naldini L, Vigna E, Narsimhan RP, Gaudino G, Zarnegar R, Michalopoulos GK, et al: Hepatocyte growth factor (HGF) stimulates the tyrosine kinase activity of the receptor encoded by the proto-oncogene c-MET. Oncogene 6: 501-504, 1991
41. Nicolson GL: Cancer metastasis: tumor cell and host organ properties important in metastasis to specific secondary sites. Biochim Biophys Acta 948: 175, 1988 42. Potempa S, Ridley AJ: Activation of both MAP kinase and phosphatidylinositide 3-kinase by Ras is required for hepatocyte growth factor/scatter factor-induced adherens junction disassembly. Mol Biol Cell 9: 2185-2200, 1998
43. Rubin JS, Bottaro DP, Aaronson SA: Hepatocyte growth factor/scatter factor and its receptor, the c-met proto-oncogene product. Biochim Biophys Acta 1155:357-371, 1993
44. Russell WE, McGowan JA, Bucher NL: Partial characterization of a hepatocyte growth factor from rat platelets. J Cell Physiol 119: 183-192, 1984
45. Schipper JH, Unger A, Jahnke K: E-cadherin as a functional marker of the differentiation and invasiveness of squamous cell carcinoma of the head and neck. Clin. Otolaryngol. 19: 381-384, 1994
46. Shibamoto S, Hayakawa M, Takeuchi K, Hori T, Oku N, Miyazawa K, et al: Tyrosine phosphorylation of β-catenin and plako-globin enhanced by hepatocyte growth factor andepidermal growth factor in human carcinoma cells. Cell Adhes
Common 1: 295-305, 1994
47. Shirayoshi Y, Okada TS, Takeichi M: The calcium-dependent cell-cell adhesion system regulates inner cell mass formation and cell surface polarization in early mouse development. Cell 35: 631, 1983
48. Sorscher SM, Russack V, Cagle M, Feramisco JR, Green MR: Immuno-localization of E-cadherin in human head and neck cancer. Arch Pathol Lab Med 119: 82-84, 1995
49. Takeichi M: Functional correlation between cell adhesive properties and some cell surface proteins. J Cell Biol 75: 464, 1977
50. Takeichi M: Cadherin cell adhesion receptor as a morphogenetic regulator.
Science 251: 1451-1453, 1991
51. Tannapfel A, Yasui W, Yokozaki H, Wittekind C, Tahara E: Effect of hepatocyte growth factor on the expression of E- and P-cadherin in gastric carcinoma cell lines.
52. Trusolino L, Cavassa S, Angelini P, Ando M, Bertotti A, Comoglio PM, et al: HGF/scatter factor selectively promotes cell invasion by increasing integrin avidity.
Faseb J 14: 1629-40, 2000
53. Van de Wurrf AAM, Kate JT, Van cer Linden EPM, Dinjens WNM, Arends JW, Bosman FR: L-CAM expression in normal, premalignant and malignant colon mucosa. J Pathol 168: 287, 1992
54. Wang Y, Selden AC, Morgan N, Stamp GW, Hodgson HJ: Hepatocyte growth factor/scatter factor expression in human mammary epithelium. Am J Pathol 144: 675-682, 1994
55. Warn R, Harvey P, Warn A, Foley-Comer A, Heldin P, Versnel M, et al: HGF/SF induces mesothelial cell migration and proliferation by autocrine and paracrine pathways. Exp Cell Res 267: 258-266, 2001
56. Weidner KM, Arakaki N, Hartmann G, Vandekerckhove J, Weingart S, Rieder H, et al: Evidence for the identity of human scatter factor and human hepatocyte growth factor. Proc Natl Acad Sci U S A 88: 7001-7005, 1991
57. Weidner KM, Behrens 1, Vandekerckhove J, Birchmeimer W. Scatter factor. Molecular characteristics and effect on the invasiveness of epithelial cells: J CellBio. 111: 2097-2105, 1990
58. Williams HK, Sanders DS, Jankowski JA, Landini G, Brrown AM: Expression of cadherins and catenins in oral epithelial dysplasia and squamous cell carcinoma. J
59. Yanagita K, Nagaike M, Ishibashi H, Niho Y, Matsumoto K, Nakamura T: Lung may have an endocrine function producing hepatocyte growth factor in response to injury of distal organs. Biochem Biophys Res Commun 182: 802-809, 1992
60. Yoshida NC, Suzuki N, Takeichi M: Molecular nature of the calcium-dependent cell-cell adhesion system in mouse teratocarcinoma and embryonic cells studied with monoclonal antibody. Dev Biol 101: 19, 1984
-ABSTRACT-
Expression of E-cadherin and HGF in Hypopharyngeal Cancer
Jang Woo Lee
Department of Medical Sciences The Graduate School, Ajou University (Supervised by Assistant Professor Chul-Ho Kim)
Background and Objectives: Head and neck squamous cell carcinoma (HNSCC)
results from a multistep carcinogenesis process in which increasing degrees of mucosal changes and cellular atypia occur over large areas of epithelium. Hypopharyngeal squamous cell carcinoma(SCC) is well known as a aggressive cancer which has relatively poor prognosis. E-cadherin is a large family of Calcium dependent intercelluar Adhesion Molecule(CAM) whose functions are essential for the induction and maintenance of intercellular cohesion and hepatocyte growth factor(HGF), a potent stimulator of hepatocyte growth, stimulates motility, invasiveness, proliferation, and morphogenesis of epithelium, and also may be involved in tumor invasion. So we examined the role of the E-cadherin/HGF on invasion and metastasis of hypopharyngeal squamous cell carcinoma(SCC).
Materials and Method: We performed immunohistochemical stains on 40 tissues
of hypopharyngeal cancer patients who were admitted to Ajou University Hospital & Severance Hospital between Mar. 1994 and Dec. 2003 with E-cadherin antibody. We classified the stains according to the intensity and location of E-cadherin expression, and analysis the correlation between the intensity or location of E-cadherin
expression and the many clinicopathologic factors. To find the effect of HGF for the E-cadherin expression in the progression of hypopharyngeal cancer, RT-PCR and Western blot in hypopharyngeal cell line(FaDu) were performed according to the concentration of HGF(0, 10, 30 ng/ml). Hypopharyngeal cancer cell line
Results: All tissues were positive for the immunohistochemical staining of
E-cadherin. According to the intensity +, ++ and +++ group were 25%, 55% and 20% respectively and according to the location membranous and non-membranous group were 50% respectively. Although the intensity of E-cadherin was not correlate with any clinical factor, the location of E-cadherin was siginificantly correlated with lymph node metastasis(p<0.05). Analyze for RT-PCR and Western Blot of E-cadherin expression in FaDu cells revealed the decreased expression of E-E-cadherin in proportion to the concentration of HGF.
Conclusion: These results suggest that non-membranous expression of E-cadherin
in hypopharyngeal cancer was significantly correlated with lymph node metastasis and that HGF may plays an important role in progression of hypopharyngeal cancer through significantly reducing the expression of E-cadherin.
Key words: E-cadherin, HGF(Hepatocyte Growth Factor), Hypopharyngeal cancer,