저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
- 국문요약 -
전자의무기록을 이용한 약물 감시 연구
약물과 유해반응 사이의 인과 관계 탐지를 위해 가장 많이 사용되고 있는 자발적 보고 시스템(SRS, spontaneous reporting system) 데이터는 실제 발생하는 약물 유해반응의 극히 일부분만이 보고되고 전체발생건수를 알 수 없으며, 자료를 모으기 위해 노력과 시간 및 비용이 많이 소모된다는 단점이 있다. 반면 전자의무기록 데이터(EMR, electronic medical record)는 진료과정의 산물로 발생하는 원천 자료이므로 상시 발생하며, 사람에 의한 의사결정을 필요로 하지 않기 때문에 그로 인한 비뚤림이 발생하지 않으며, 자료수집과 분석에 드는 시간과 비용을 획기적으로 줄일 수 있다.
본 연구는, SRS 데이터 분석에 사용되어 왔던 불균형분석 기반의 정량적 약물감시 방법들(Quantitative pharmacovigilance method based on disproportionality analysis, 이하 DA)을 EMR 데이터에 적용하는 연구 방법론을 제시하고, 본 연구 방법론이 약물 유해반응의 실마리 정보를 산출할 수 있는지를 확인하며, EMR 을 이용한 DA 분석을 자동으로 수행할 수 있는 시스템을 구축하는 것을 목적으로 한다. EMR 데이터에 대한 DA 의 적용을 위해 다음과 같은 연구 방법을 설계하였다. 첫째, 연구에 필요한 데이터를 EMR 로부터 추출한 후, 연구 대상 약물 및 비교 약물을 투여한 환자들을 추출하여 나열한다. 둘째, 약물 첫 투여 후 12 주 내 새로 부여된 진단명들을 이용하여 약물-진단명 조합을 생성한다. 마지막으로, 생성된 약물-진단명 조합 데이터를 이용하여 DA 분석을 수행한다.
본 연구 방법론의 유용성을 증명하고자 고지혈증 치료제인 rosuvastatin 을 예로 약물 감시 연구를 수행하였다. 연구 대상은 한 3 차 의료기관에서 2001 년 1 월 1 일부터 2009 년 12 월 31 사이에 rosuvastatin 을 처방 받은 40 세 이상의 환자들로 선정하였다. 평가는 탐지된 실마리의 민감도와 양성 예측도를 통해 이루어 졌다. DA 방법에 따라 민감도는 14.3 ~ 61.9% 였으며, 양성 예측도는 19.0 ~ 36.7% 였다. 제안된 연구 방법론을 이용하여 자동으로 약물 감시 연구를 수행할 수 있는 ‘전자의무기록을 이용한 불균형분석기반의 정량적 약물 감시 시스템’을 개발하였다. 사용자는 사용자 인터페이스를 통해 시스템에게 명령을 내리고, 명령을 받은 시스템이 자동적으로 모든 연구를 수행한 후 결과를 사용자에게 보여준다 본 연구를 통해 전통적인 DA 방법을 EMR 에 적용하는 연구 방법론을 제시하였다. 실험적 약물 감시 연구를 수행하여 신뢰할 수 있는 실마리들을 생성한다는 것을 확인하여, 본 연구 방법론을 이용한 약물 감시 연구의 실현 가능성을 보여주었다. 또한 이러한 연구 방법론을 실제 구현시킬 수 있는 시스템 구조와 이를 이용한 자동화 시스템을 개발하였다. 핵심어 : Postmarketing drug surveillance, Electronic medical record, Automatic data processing, Reporting odds ratio, Proportional reporting ratio, Bayesian confidence propagation neural network, Gamma poisson shrinkage
차 례
국문요약 ··· ⅰ 차례 ··· ⅲ 그림차례 ··· ⅳ 표차례 ··· ⅴ 약어 ··· ⅶ . Ⅰ 서론 ··· 1 . Ⅱ 연구대상 및 방법 ··· 8 A. 불균형분석 기반의 정량적 약물감시 방법 ··· 8 B. 연구 방법론 ··· 14 C. 전자의무기록을 이용한 약물 감시 시스템 ··· 16 D. 시스템 구조 및 개발 환경 ··· 21 E. 성능 평가 ··· 25 . Ⅲ 결과 ··· 27 A. 성능 평가 결과 ··· 27 B. 전자의무기록을 이용한 불균형분석기반의 정량적 약물 감시 시스템 ··· 43 . Ⅳ 고찰 ··· 46 . Ⅴ 결론 ··· 51 참고문헌 ··· 52 ABSTRACT ··· 56그림 차례
Fig. 1. 약물-유해반응 조합 선정 기준 ··· 14 Fig. 2. 전자의무기록을 이용한 약물 감시 시스템의 연구 수행 단계 ··· 16 Fig. 3. 약물-유해반응 조합 생성 방법 ··· 18 Fig. 4. 전체 약물-유해반응 조합 테이블 구조 ··· 19 Fig. 5. 특정 약물-유해반응 조합 테이블 구조 ··· 19 Fig. 6. EMR 을 이용한 DA 분석 시스템 구조 ··· 21 Fig. 7. PMS 데이터 웨어하우스 구축을 위한 ETL 과정 ··· 23 Fig. 8. EMR 데이터에서의 DA 방법 별 민감도와 양성 예측도 ··· 42 Fig. 9. 사용자 인터페이스의 조건 선택 화면 ··· 43 Fig. 10. 사용자 인터페이스의 결과 보고 화면 ··· 45표 차례
Table 1. DA 를 위한 자료 구조 ··· 8 Table 2. DA 방법들의 정의 ··· 9 Table 3. DA 방법들의 판단기준 ··· 10 Table 4. 반복적으로 통계 분석된 가설들의 분류 ··· 12 Table 5. ICD-10 코드 체계 ··· 15Table 6. Gold standard 목록 ··· 25
Table 7. 연구대상자의 일반적 특성 ··· 27
Table 8. ROR 로 감지된 실마리 ··· 28
Table 9. ROR 로 감지된 실마리 중 유해반응 목록과 일치하는 실마리 ··· 32
Table 11. PRR 로 감지된 실마리 중 유해반응 목록과 일치하는 실마리 ··· 36 Table 12. BCPNN 으로 감지된 실마리 ··· 37 Table 13. BCPNN 으로 감지된 실마리 중 유해반응 목록과 일치하는 실마리 ··· 39 Table 14. GPS 로 감지된 실마리 ··· 40 Table 15. GPS 로 감지된 실마리 중 유해반응 목록과 일치하는 실마리 ··· 41
약 어
BCPNN: Bayesian confidence propagation neural network DA: Disproportionality analysis
EMR: Electronic medical record ETL: Extract, Transform, Load FDR: False discovery rate GPS: Gamma poisson shrinkage IC: Information component
ICD-10: International Statistical Classification of Disease and Related Health Problems 10th Revision
PMS: Postmarketing surveillance PRR: Proportional reporting ratio ROR: Reporting odds ratio RR: Relative risk
I.
서 론
A. 연구의 배경
약물 유해반응(adverse drug reaction)은 약물을 질병의 예방, 진단, 치료 또는 생리작용의 조절을 위하여 인체에 정상 용량을 투여하였을 때 발생하는 바람직하지 않고 의도되지 않은 징후, 증상 또는 질병을 의미한다(Nebeker 등, 2004). 입원 환자를 대상으로 한 연구에서, 입원 환자 중 1.3% ~ 37.3%가 약물 유해반응을 경험하였다고 보고되고 있다(van den Bemt 등, 2000). 또한 전체 입원 환자의 약 5.3%가 약물 유해반응으로 인한 입원으로 조사되었고, 특히 노인 환자에서는 10.7%나 차지하는 것으로 나타났다(Kongkaew 등, 2008). 응급실 내원 환자 중에서도 약 12%가 약물과 관련된 내원이었으며, 그 중 48%가 약물 유해반응으로 인한 내원이었고, 5%는 심각한 약물유해반응으로 인한 내원이었다(Zed 등, 2008). 약물유해반응으로 인한 피해를 예방하기 위하여 약물 시판 전후로 다양한 조사가 수행된다. 약물 시판 전에는 동물 실험 및 임상 시험을 통하여 약물의 위험도를 살펴보고 발생 가능한 유해반응들을 조사하는 시판 전 조사를 수행한다. 시판 전 약물 감시를 통한 예방이 강조되고 있지만, 시판 전에는 짧은 기간 동안에 특정 연구 대상 집단에게만 임상시험이 이루어질 수 밖에 없다는 한계점이 있기 때문에, 모든 유해반응을 조사할 수 없으며 실제로 시판 후 새로운 유해반응들이 지속적으로 발생하고 있다. 따라서, 약품이 시판된 후에도
지속적인 약물 감시가 이루어질 것이 요구되고 있으며, 이러한 활동을 시판 후 약물 감시(PMS, Postmarketing surveillance)라고 한다(Vlug 등, 1999).
PMS 는 새로운 유해반응에 대한 가설 수립 단계와 이를 증명하는 단계로 이루어진다. 가설 수립 단계에서 가장 중요한 것은 ‘이전에 알려져 있지 않거나 완전히 기술된 적이 없지만, 약물과 유해반응 사이에 인과 관계가 있을 가능성이 있음을 시사하는 정보’로 정의 되는 실마리를 찾아내는 것이다(Stahl 등, 2003; Trifiro 등, 2009). 실마리 탐지를 위해서 자발적 보고 시스템 자료, 보험 청구 자료 등이 사용되어 왔다. 자발적 보고 시스템(SRS, spontaneous reporting system)은 약물유해반응 의심 사례 발생시 의사, 약사, 간호사 등의 의료인이나 환자, 보호자 등이 해당 사례를 보고하고 이들 데이터를 모아 놓는 시스템이다. SRS 데이터는, 약물 부작용 연구를 위해 전통적으로 수집되어 온 자료이므로, 분석 방법에 대한 다양한 연구가 진행되어 왔으며, 이들 자료를 이용한 분석이 활발히 진행되어 왔기 때문에 시판 후 약물 감시 연구에서 가장 신뢰 받고 있는 자료이다. 따라서 다양한 기관에서 SRS 을 구축하여 약물 유해반응 탐지에 사용하고 있다. 대표적인 SRS 들로는 World Health Organization 의 Uppsala Monitoring Center 에서 운영중인 the international pharmacovigilance programme, 미국 FDA 의 Adverse Event Reporting System (AERS), 그리고 the Medicine and Healthcare Products Regulatory Agency (MHRA)에서 운영하는 Yellow Card Scheme 등이 있다. 하지만 자료를 보고하거나 수집하는 과정에서 의사나 환자에 의해 비뚤림이 발생할 수 있고, 수집을 위하여 시간과 비용이 많이 발생한다는 단점이 있다(Hinrichsen 등, 2007; Stephenson 와 Hauben, 2007).
또 다른 자료원인 보험 청구 자료는 전국 모든 병원에서 보험료 청구를 위해 정부 차원에서 수집되는 자료로, 국가 단위의 자료가 모인다는 점이 가장 큰 장점이지만, 목적이 보험 청구로 제한된 자료이기 때문에, 보험 청구와 관련 없는 자세한 정보는 포함되어 있지 않아서, 심도 있는 약물 유해반응 연구를 수행하는 데에는 제한이 있고, 보험 적용이 되지 않는 약품에 대해서는 정보가 전혀 없다는 것이 단점이다. 이러한 자발적 보고 데이터 혹은 보험 청구 자료를 분석하여, 약물유해반응일 가능성이 높은 약물과 유해반응의 조합, 혹은 실마리를 찾아내고자 다양한 불균형분석 기반의 정량적 약물감시 방법들(Quantitative pharmacovigilance method based on disproportionality analysis, 이하 DA)이 개발되었다. 가장 널리 쓰이고 있는 DA 는 reporting odds ratio (ROR), proportional reporting ratio (PRR), Bayesian confidence propagation neural network (BCPNN), gamma poisson shrinkage (GPS) 등이다. 이들은 모두 유해반응의 발생량을 기반으로 분석하는 정량적 분석 방법이며, 크게 발생빈도를 분석하는 방법, Bayesian 접근법을 이용한 방법으로 나뉜다. PRR 과 ROR 은 발생 빈도에 기반한 분석 방법으로 이해하기 쉽고 사용하기 간편하며 민감하지만 상대적으로 양성 예측도는 낮은 것으로 알려져 있다. 반면 BCPNN 과 GPS 는 Bayesian 접근법에 기초하여 계산과정이 복잡하여 사용하기 어렵고, 민감도가 낮지만, 양성 예측도가 높은 것이 특징이다(Almenoff 등, 2006; Kubota 등, 2004). 이러한 DA 방법들은 SRS 의 자료나 보험 청구 자료를 이용하기 때문에, 이들 분석 방법의 결과 역시 자발적 보고 자료와 보험 청구 자료의 한계를 벗어날 수 없다. 자발적 보고는 실제 발생하는 약물 유해반응의 일부분만 보고되며, 자료들이 모이기까지 시간과 비용이 많이 발생하며, 전체 약물 사용
환자의 수를 파악할 수 없어 발생률을 계산할 수 없다는 한계를 가지고 있다. 또한 약물 부작용 이외에는 추가적인 임상 자료가 부족하다. 보험 청구 자료 역시 보험 청구 관련 정보 이외의 다양한 환자 정보는 포함하고 있지 않다. 그리고 두 자료 모두 공식적으로 공개되지 않는 자료이기 때문에, 약물 감시 연구를 활발히 수행하는데 많은 제약이 따르게 된다.
전자의무기록(EMR, electronic medical record) 데이터는 환자 진료의 부산물로 의사 처방, 검사 결과, 진단명 등 자세한 정보들이 그대로 저장되어 있는 원천 자료이므로, 별도의 보고절차가 없어도, 누락되는 자료가 발생하지 않으며, 환자와 관련된 모든 정보를 저장하고 있다. 따라서, 약물유해반응의 발생률 계산도 가능하게 되며, 풍부한 자료를 이용해 다각적인 연구가 가능하다. 또한 이미 존재하며, 상시 발생하는 자료이기 때문에 자료수집에 드는 시간과 비용을 획기적으로 줄일 수 있을 것이다. 또한 EMR 이 도입된 모든 병원에서는 해당 병원 데이터에 접근 가능하므로 기존의 자료들에 비해 접근이 용이하다. 따라서, DA 방법들을 EMR 과 같은 1 차 자료에 적용할 수 있다면, 위에서 언급한 자발적 보고 자료와 보험 청구 자료 이용에 따른 한계를 극복하여, 빠르고 효과적인 PMS 수행이 가능할 것이다. EMR 을 이용하여 정량적 PMS 연구를 수행하려는 시도가 일부 있었다. Brownstein 등은 EMR 데이터를 이용하여 혈당 강하제인 sulfonylurea, metformin, rosiglitazone, pioglitazone 을 복용한 환자들의 심근경색 발생 위험도를 분석하는 후향적 코호트 연구를 수행하였다(Brownstein 등, 2010). 이 연구를 통하여, 다른 혈당강하제에 비하여 rosiglitazone 이 심근 경색 발생의 위험도를 높일 수 있다는 근거를 제시하였고, 빠른 유해반응 탐지에 EMR 데이터가 유용함을 제시하였다. Mera 등은 EMR 데이터를 이용하여 quinolone 처방 후 발생되는 clostridium
difficile colitis 관련 진단명의 발생 빈도를 macrolide 처방 후 발생되는 빈도와 비교 분석하는 반자동 시스템을 구축하였다(Mera 등, 2010). 이 시스템을 이용하여 기존에 밝혀진 바와 마찬가지로 quinolone 이 clostridium difficile associated diarrhea 를 유발한다는 사실을 밝혔고, 이를 통하여 유해반응을 탐지하는데 EMR 데이터가 유용하게 이용될 수 있음을 발표하였다. Wang 의 연구에서는, 자연어처리(natural language processing)를 이용하여 EMR 데이터 중 퇴원 요약지로부터 약물과 진단명을 찾아낸 후 그들의 co-occurrence 를 통계적으로 분석하여 실마리를 찾는 방법을 제안하였다(Wang 등, 2009). 하지만, 지금까지 EMR 을 PMS 연구에 이용하였던 방법은 각 연구 환경에 맞는 새로운 판단 방법과 기준을 적용하였던 연구였고, SRS 데이터에 적용되었던 기존 DA 방법의 EMR 데이터에 대한 적용 가능성 연구는 시도되지 않았었다. 원천 분석 자료의 종류 (SRS 데이터와 같은 2 차 자료, 혹은 EMR 자료와 같은 1 차 자료)에 따라 기존에 사용되는 DA 의 성능이 어떻게 변화하는지에 대한 객관적인 분석 결과가 없기 때문에, 정량적 PMS 연구에 EMR 데이터를 이용하는 것이 가능한지에 대한 근거가 부족한 상태이다. SRS 데이터와 EMR 데이터에 따른 DA 방법들의 약물유해반응 실마리 감지능력을 객관적으로 비교하기 위해서는, DA 방법을 EMR 데이터에 적용할 수 있는 연구 방법론이 필요하다. 따라서, 본 연구에서는 전통적인 DA 방법을 EMR 데이터에 적용할 수 있는 연구 방법론을 제시하고, 제시한 방법론을 예시적 약물에 적용한 결과를 문헌상의 SRS 를 이용한 DA 방법의 성능과 비교하고자 한다. 이를 위하여 EMR 에 포함된 다양한 데이터 중 DA 분석에 필요한 데이터들을 선정 및 추출하고, 이들 데이터를 DA 분석을 위해 요구되는 형식으로 변환하였다.
통계분석에 널리 사용되는 R 프로그램과 연동하여 자동으로 DA 분석을 수행하였다. 제시한 연구 방법론을 실제 시스템으로 구현하기 위해 필요한 시스템 구조를 부수적으로 제시하였다. 제시된 연구 방법론을 검증하기 위하여 고지혈증 약물 중 하나인 rosuvastatin 을 대상으로 PMS 연구를 수행하고, 산출되는 결과를 문헌상의 SRS 기반 DA 분석결과와 비교하였다.
B. 연구목적 본 연구는, 1 차 자료인 EMR 자료를 대상으로 DA 방법을 적용하여 약물유해반응의 실마리 정보를 산출할 수 있는지를 확인하고, 다수의 이용자가 동시에 이용할 수 있는 인터넷 기반의 ‘전자의무기록을 이용한 불균형분석기반의 정량적 약물 감시 시스템’을 구축하는 것을 목적으로 한다. 구체적인 세부 목적은 다음과 같다. 첫째, EMR 데이터베이스에 저장되어 있는 다양한 정보를 대상으로 전통적인 DA 방법을 적용할 수 있는 연구 방법론을 제시한다. 둘째, 제시한 연구 방법론을 실현할 수 있는 시스템 구조를 제시한다. 셋째, 제시한 연구방법론을 예시적 약물에 적용한 실험적 PMS 연구를 수행하고, SRS 데이터를 이용한 기존의 연구결과와 비교 분석함으로써, DA 기반의 정량적 PMS 연구에서 있어서 EMR 자료의 이용 가능성을 제시한다. 넷째, 제시한 연구 방법론과 시스템 구조를 이용하여 다수의 이용자가 인터넷 상에서 동시에 사용할 수 있는 ‘전자의무기록을 이용한 불균형분석기반의 정량적 약물 감시 시스템’을 구축한다.
II.
연구대상 및 방법
A. 불균형분석 기반의 정량적 약물감시 방법 ROR, PRR, BCPNN, GPS 모두 특정 연구 대상 복용 여부의 비율과 연구 대상 유해반응의 발현 유무의 비율을 이용하여 분석한다. 즉, Table 1 과 같은 테이블의 형태로 데이터를 정리한 후 Table 2 에 정리된 정의에 의해 분석이 진행된다(Wilson 등, 2004). Table 1. DA를 위한 자료 구조 특정 대상 유해반응 다른 모든 유해반응 합계 연구 대상 약물 A B A+B 다른 모든 약물 C D C+D 합계 A+C B+D A+B+C+D A: 연구 대상 약물을 복용하고 특정 대상 유해반응이 보고된 사례 수, B: 연구 대상 약물을 복용하고 특정 대상 유해반응 이외의 다른 유해반응이 보고된 사례 수, C: 연구 대상 약물 이외의 약물을 복용하고 특정 대상 유해반응이 보고된 사례 수, 연구 대상 약물 이외의 약물을 복용하고 특정 대상 유해반응 이외의 다른 유해반응이 보고된 사례 수Table 2. DA 방법들의 정의
DA 방법 정의
ROR (A/B)/(C/D)
PRR {A/(A+B)}/{C/(C+D)}
BCPNN(IC) Log2[{A*(A+B+C+D)}/{(A+B)*(A+C)}]
GPS(RR) {A*(A+B+C+D)}/{(A+B)*(A+C)}
ROR: Reporting odds ratio, PRR: Proportional reporting ratio, BCPNN: Bayesian confidence propagation neural network, IC: Information component, GPS: Gamma poisson shrinkage, RR: Relative risk, A-D: Table 1 과 동일
ROR 의 경우 특정 약물에 의한 특정 유해반응의 발생 위험도를 다른 약물에 의한 특정 유해반응의 발생 위험도로 나눈 값으로 다른 약물에 비해 특정 약물에 의한 특정 유해반응의 오즈비가 얼마인지를 나타낸다(Pariente 등, 2007). PRR 은 특정 약물로 인한 유해반응 발생 비율을 다른 약물로 인한 유해반응 발생 비율로 나눈 것으로 다른 약물에 비해 발생 비율이 얼마나 되는지를 의미하는 값이다(Evans 등, 2001). BCPNN 는 다른 약물의 유해반응 발생 빈도에 근거하여 특정 약물을 복용 후 특정 유해반응의 발생이 기대되는 확률을 계산한 후, 그 값으로 실제 특정 유해반응이 발생한 수를 나누어, 일반적으로 기대되는 확률보다 실제로 얼마나 많이 발생하는지를 나타내 주는 정보성분(IC, Information component)으로 의미 있는 실마리를 찾아낸다(Bate 등, 1998).
GPS 는 BCPNN 과 비슷한 개념으로, 2IC 으로 계산되는 상대위험도(RR,
relative risk)를 기반으로 한다. BCPNN 과 마찬가지로 특정 유해반응의 기대발생 확률보다 실제 발생 수가 많은지를 판단한다. 의미 있는 실마리는 모수가 포아송
분포(Poisson distribution)를 따른다는 가정하에 RR 을 shrinkage 한 값인 EBGM(the geometric mean of empirical Bayesian)을 기준으로 판단한다(Hochberg 등, 2009).
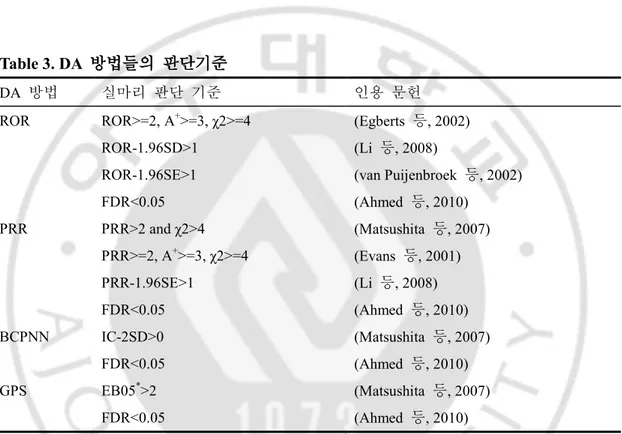
모든 약물-유해반응 조합에 대해 각 방법을 적용하여 ROR, PRR, IC, EBGM 값을 계산한 후, 특정 조건을 만족시키면 의미 있는 실마리로 판단하게 되는데, 각 방법을 사용하는 기관, 연구자에 따라 다양한 기준이 사용되고 있다. 각 판단 기준은 Table 3 에 나열되어 있다.
Table 3. DA 방법들의 판단기준
DA 방법 실마리 판단 기준 인용 문헌
ROR ROR>=2, A+>=3, χ2>=4 (Egberts 등, 2002)
ROR-1.96SD>1 (Li 등, 2008)
ROR-1.96SE>1 (van Puijenbroek 등, 2002)
FDR<0.05 (Ahmed 등, 2010) PRR PRR>2 and χ2>4 (Matsushita 등, 2007) PRR>=2, A+>=3, χ2>=4 (Evans 등, 2001) PRR-1.96SE>1 (Li 등, 2008) FDR<0.05 (Ahmed 등, 2010) BCPNN IC-2SD>0 (Matsushita 등, 2007) FDR<0.05 (Ahmed 등, 2010) GPS EB05*>2 (Matsushita 등, 2007) FDR<0.05 (Ahmed 등, 2010)
+A: the number of combinations between a specific drug and a suspected adverse drug
reaction, *EB05: lower 5th percentile of the posterior distribution of EBGM
이렇게 다양한 판단 기준이 존재하는 이유는 각 사용자가 이용하는 데이터베이스가 모두 다르기 때문에, 각 데이터베이스에 최적화된 기준을 사용하기 때문이다. 이러한 이유로 인하여 최근 DA 분석 방법에서 실마리를 판단하는 기준에 False discovery rate (FDR)을 적용한 연구들이 발표되고
있다(Ahmed 등, 2009; Ahmed 등, 2010). FDR 방법이 실마리 탐색에 사용되는 이유는 실마리 탐색을 위해 통계 분석을 하게 될 경우, 반복적인 통계 분석 수행으로 인한 오류의 증가를 예방하기 위해서이다. 실마리 탐색을 위해 통계 분석을 사용할 경우, 약물 하나와 유해반응 하나의 조합마다 분석하게 되므로, 분석해야 하는 조합의 수는 (분석 대상 데이터베이스에 존재하는 약품의 종류 수) X (유해반응 종류의 수) 만큼 존재하게 되고, 각 경우마다 통계 분석을 반복적으로 수행해야 한다. 하지만, 통계 분석이 반복적으로 진행하게 될 경우, type I 오류 (false positive) 또한 같이 증가하기 때문에 이를 보정하기 위한 과정이 필요하다. 만약 하나의 통계 분석에서 유의수준이 α 인 분석을 반복적으로 k 번 진행하게 되면 영가설을 기각하지 않을 확률이 (1-α)k가 되어 전체적인 type I 오류는 α 보다 커지게 되기 때문이다. 예를 들어, 유의확률 0.05 인 통계 분석을 4 번 반복하게 되면, (1-0.05)4 = (0.95)4 = 0.8145 = 1-0.1855 가 되어 전체 type I 오류는 0.1855 가 된다. 따라서 수천에서 수만 번의 통계 분석이 반복되는 분석에서는 매우 큰 type I 오류가 발생하게 된다. FDR 은 주로 microarray 분석과 같이 통계 분석을 대량으로 반복하는 경우에 적용되는 방법으로, ‘통계분석 결과가 차이가 나는 것으로 판단하였는데, 실제로는 차이가 나지 않을 확률’을 의미한다. 즉, 반복적인 통계 분석을 한 결과들을 Table 4 와 같이 정리하였을 때, FDR 은 V/(V+S) 를 의미한다. FDR 은
이렇게 각 통계분석을 type I 오류에 따라 판단하는 것이 아니고 전체적인 오류를 기준으로 판단 하므로, 반복측정으로 인한 오류의 증가를 보정할 수 있다. Table 4. 반복적으로 통계 분석된 가설들의 분류 통계적 차이 없다고 판단 통계적 차이 있다고 판단 영가설이 참인 경우 (실제로 통계적 차이가 없는 경우) U V 영가설이 거짓인 경우 (실제로 통계적 차이가 있는 경우) T S U: 실제 통계적 차이가 없고 분석에서도 통계적 차이가 없다고 판단한 분석의 수, V: 실제 통계적 차이가 없으나 분석에서는 통계적 차이가 있다고 판단한 분석의 수, T: 실제 통계적 차이가 있으나 분석에서는 통계적 차이가 없다고 판단한 분석의 수, S: 실제 통계적 차이가 있고 분석에서도 통계적 차이가 있다고 판단한 분석의 수 FDR 을 이용하여 오류를 보정하는 방법은 Simes procedure 를 따른다(Benjamini 와 Hochberg, 1995). 서로 독립적인 가설이 H1, H2, …, Hm이고 각 가설의 p-value 값이 P1, P2, ..., Pm이라고 가정하였을 때, p-value 를 오름차순으로 정렬하면, P(1), P(2), …, P(m)으로 나열되며, 가설들도 H(1), H(2), …, H(m)와 같이 나열 할 수 있다. FDR 을 α 미만을 통제하고 싶을 때, 다음 식을 만족하는 k 의 최대값을 찾아낸다. P(k)≤ k mα 위의 식을 만족하는 P(1), P(2), …, P(k)에 해당하는 H(1), H(2), …, H(k)에 해당하는 가설들 기각하여 통계적으로 차이가 있는 가설들로 판단한다. 위와 같이 FDR 은 반복 측정이 많은 본 분석에 적합한 방법으로 판단되며, 또한 FDR 을 이용한 실마리 탐색은 서로 다른 데이터베이스에서도 비슷한 성능과 특징을 나타내기 때문에(Ahmed 등, 2010), 본 연구에서는 실마리 판단
기준으로 FDR 을 사용하였다. 본 연구에서는 FDR 0.10 미만을 실마리 판단 기준으로 하였으며, ROR, PRR 경우는 PRR 값과 ROR 의 값이 1 보다 큰 경우만을 실마리로 판단하였다. FDR 판단 기준을 0.05 가 아닌 0.10 으로 한 이유는, EMR 데이터가 자발적 보고 데이터와는 달리 약물 유해반응을 위해 수집된 데이터가 아니므로, EMR 데이터에서는 약물과 유해반응 조합의 관계 강도가 약할 것이기 때문이다.
B. 연구 방법론 본 연구는 EMR 데이터 베이스로부터 필요한 데이터를 추출한 후 각 분석 방법을 적용하여 약물 유해반응 실마리를 찾아낸다. EMR 데이터로부터 추출하는 자료는 환자의 기본 정보(환자의 아이디, 입원 혹은 내원일, 생일 등), 처방 정보(처방 내역, 처방 코드, 처방 시간 등), 진단명 정보(진단명 내역, 진단명 수정일 등) 이다. 추출된 데이터를 이용하여 환자가 특정 약물을 투여 받은 후 12 주 이내에 새로 추가되는 진단명들을 해당 약물과 유해반응 조합으로 생성한다(Fig. 1). 즉, 약물 첫 투여 후 새로 추가된 진단명을 유해반응으로 가정하였다. 이러한 방법으로 생성된 약물-유해반응 조합과 각 조합이 생성된 수를 이용하여 ROR, PRR, BCPNN, GPS 등으로 분석을 수행 한다. Fig. 1. 약물-유해반응 조합 선정 기준. 환자가 입원 하거나 외래 방문 후 분석 대 상 약물의 첫 투여 시점을 계산하고, 그로부터 12주 이내에 새로 추가된 진단명 들을 분석 대상 약물과 짝지어 약물-유해반응 조합으로 선정한다.
진단명의 경우, 병원 EMR 시스템에서 ICD-10 (International Statistical Classification of Disease and Related Health Problems 10th Revision)을 기준으로 기록되기 때문에, 본 연구도 ICD-10 기준의 진단명을 사용하였다. ICD-10 은 진단명, 증상, 징후, 주 호소 등에 코드를 부여하여 구분한 체계로 WHO 에 의해 개발되었다. 코드의 구조는 총 5 자리로 되어 있으며, 첫 이니셜에 의해 Table
5 과 같이 구분되고, 이후 숫자 두 자리와 소수점 두 자리, 총 4 개의 숫자에 의해 해당 영역을 더 세분화한다.
Table 5. ICD-10 코드 체계
ICD-10 코드 관련 영역
A00-B99 Certain infectious and parasitic diseases C00-D48 Neoplasms
D50-D89 Diseases of the blood and blood-forming organs and certain disorders involving the immune mechanism
E00-E90 Endocrine, nutritional and metabolic diseases F00-F99 Mental and behavioural disorders
G00-G99 Diseases of the nervous system H00-H59 Diseases of the eye and adnexa
H60-H95 Diseases of the ear and mastoid process I00-I99 Diseases of the circulatory system J00-J99 Diseases of the respiratory system K00-K93 Diseases of the digestive system
L00-L99 Diseases of the skin and subcutaneous tissue
M00-M99 Diseases of the musculoskeletal system and connective tissue N00-N99 Diseases of the genitourinary system
O00-O99 Pregnancy, childbirth and the puerperium
P00-P96 Certain conditions originating in the perinatal period
Q00-Q99 Congenital malformations, deformations and chromosomal abnormalities R00-R99 Symptoms, signs and abnormal clinical and laboratory findings, not elsewhere
classified
S00-T98 Injury, poisoning and certain other consequences of external causes V01-Y98 External causes of morbidity and mortality
Z00-Z99 Factors influencing health status and contact with health services U00-U99 Codes for special purposes
ICD-10 코드는 관련 영역에 따라 코드명이 부여되며, 각 영역은 이니셜과 숫자들에 의해 세분화 된다.
C. 전자의무기록을 이용한 약물 감시 시스템 본 연구에서 제안하는 연구 방법을 이용하여 약물 유해반응 분석을 자동으로 빠른 시간 내에 할 수 있는 ‘전자의무기록을 이용한 약물 감시 시스템’을 개발하였고, 웹 기반의 사용자 인터페이스를 제공함으로써 다수의 연구자들이 손쉽게 본 시스템을 이용하여 PMS 연구를 수행할 수 있도록 하였다. 본 시스템을 이용한 연구수행 단계는 1) 분석 조건을 선택하는 단계, 2) 연구 조건에 맞는 데이터를 추출하는 단계, 3) DA 분석을 수행하는 단계, 4) 결과를 보고하는 단계로 구성된다(Fig.2). Fig. 2. 전자의무기록을 이용한 약물 감시 시스템의 연구 수행 단계. 연구 수행 단 계는 ‘연구 조건 선택’ 단계, ‘데이터 추출’ 단계, ‘DA 분석’ 단계, ‘결과 보고’ 단계 로 이루어진다. 1) 분석 조건을 선택하는 단계 이 단계는 분석의 첫 번째 단계로서, 연구자가 연구에 필요한 기본 조건을 선택하는 단계이다. 선택할 수 있는 조건은 연구 대상 환자의 연령과 성별, 과거력 그리고 연구대상 약물, 비교 약물, 연구 대상 처방일, 분석 방법 등이다. DA 방법 특성 상 비교 약물을 선택하는 것이 필수적이며, 비교 약물을 어떻게 선택하느냐에 따라 연구 설계가 달라진다. 비교 약물을 하나만 선택할 경우,
비교 약물에 비해 연구 대상 약물에서 발생 위험이 높은 약물을 찾는 연구가 되며, 비교 약물로 한 클래스의 약물들을 선택하게 되면 해당 클래스와 구분되는 연구 대상 약물의 유해반응을 찾아내는 연구가 된다. 또한 비교 약물로 연구 대상 약물 이외의 전체 약물을 선택할 경우, 연구 대상 약물의 일반적인 유해반응을 찾아내는 연구가 된다. 사용자는 현재 가장 대표적으로 사용되는 DA 방법인 ROR, PRR, BCPNN, GPS 중 한가지를 선택할 수 있다. 2) 연구 조건에 맞는 데이터를 추출하는 단계 연구자가 연구 조건 선택을 완료하면 본 시스템이 연구 조건에 맞게 필요한 데이터를 추출한다(Fig. 3). 우선 연구 대상 약물 및 비교 약물을 복용한 환자들을 추출하여 나열한다(Fig. 3A). 만약 같은 환자이지만 입원 일이 다른 경우, 즉 한 사람이 두 번 이상 입원한 경우는 각 입원마다 하나의 케이스로 처리하였다(Fig. 3B). 그 후, 각 케이스들마다 연구대상 약물 및 비교 약물의 첫 복용 일을 계산해낸다(Fig. 3C). 그리고 각 케이스들의 진단명과 진단명 수정 일을 추출한 후 첫 복용일과 비교하여, 첫 약물 복용 후 12 주 이내에 새로 부여된 진단명들을 추출해 낸다(Fig. 3D). 케이스들이 복용한 약물과 첫 복용 후 12 주 내 부여된 진단명들은 약물-유해반응 조합으로 선정되어 이후 DA 분석 단계에 이용된다.
Fig. 3. 약물-유해반응 조합 생성 방법. A: 연구 대상 약물 및 비교 약물을 복용 한 환자 추출, B: 입원 일에 따른 케이스 구분, C: 연구 대상 약물의 첫 복용일 계산, D: 연구 대상 약물 복용 후 첫 12주 이내 새로 부여된 진단명 추출. 3) DA 분석을 수행하는 단계 그 다음 단계는 추출된 약물-유해반응 조합 데이터를 이용하여 선택된 DA 방법으로 DA 분석을 수행하는 단계이다. 선택 가능한 4 가지 DA 분석법 모두는 분석을 위해서 Table 1 과 같은 2 행 2 열 형태의 데이터가 필요하다. 연구 대상 약물 혹은 비교 약물들은 모두 다양한 진단명들을 조합으로 갖게 된다(Fig. 4). 따라서 모든 약물-유해반응 조합에 포함되어 있는 진단명들 중 하나가 특정 유해반응으로 우선 선택되고 나머지는 모두 다른 유해반응으로 구분하여 분석한 후(Fig. 5), 이와 같은 방법을 모든 진단명마다 반복하게 된다.
Fig. 4. 전체 약물-유해반응 조합 테이블 구조. 열은 약물의 종류, 행은 유해반응의 종류에 따라 구분되며, 각 칸의 숫자는 해당 약물과 유해반응 조합이 생성된 횟 수를 의미한다. Fig. 5. 특정 약물-유해반응 조합 테이블 구조. DA 분석을 위하여 Fig. 4 형태의 데 이터를 특정 약물과 특정 유해반응 기준으로 데이터를 정리한 테이블. : 약물j 이외의 다른 약물을 복용한 경우; : 유해반응i 이외의 다른 유해반응이 나타난 경우 4) 결과를 보고하는 단계 DA 분석 단계에서 분석된 여러 약물-유해반응 조합 중 약물 유해반응 판단 기준에 따라 의미 있다고 판단된 진단명만이 선택되어 사용자에게 보고된다. ROR, PRR 의 경우 의미 있다고 판단된 진단명의 코드, 진단명, ROR 혹은 PRR 값, FDR 값을 보여준다. BCPNN 과 GPS 의 경우에는, 의미 있다고 판단된 진단명의 코드, 진단명과 해당 조합의 실제 count, 기대된 count, FDR 값을 보여준다.
본 시스템은 사용자에게 쉽고 편안한 분석 환경을 제공하기 위하여 웹 기반의 사용자 인터페이스를 제공한다. 사용자가 자신의 연구 목적에 적합한 연구 조건을 수행하면, 자료 추출에서부터 분석, 결과 보고에 이르기 까지 전 과정이 자동으로 진행된다. 따라서 연구자는 DA 방법들의 계산 방법, EMR 데이터의 관리 및 추출 등 많은 시간과 노력이 소모되는 단계를 고려하지 않아도 빠르고 간단하게 약물 역학 연구를 수행할 수 있다.
D. 시스템 구조 및 개발환경
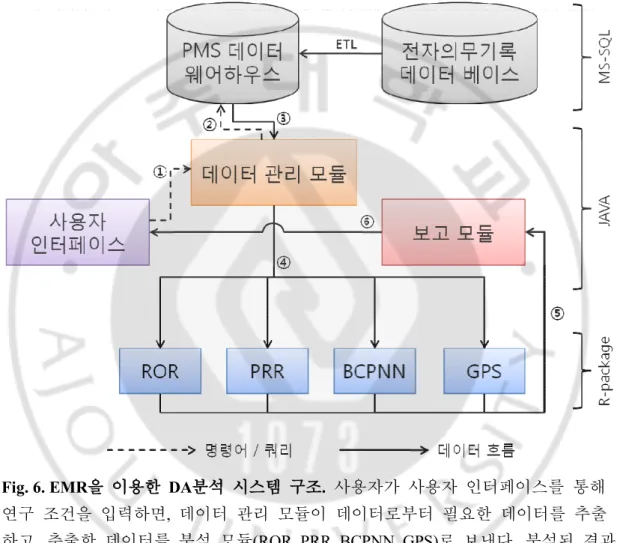
본 시스템은 데이터를 저장하고 관리하는 데이터 베이스와 사용자 인터페이스, 데이터 관리, 결과 보고 등을 하는 데이터 관리 프로그램, 그리고 DA 분석을 수행하는 DA 분석 프로그램으로 되어 있다(Fig. 6).
Fig. 6. EMR을 이용한 DA분석 시스템 구조. 사용자가 사용자 인터페이스를 통해 연구 조건을 입력하면, 데이터 관리 모듈이 데이터로부터 필요한 데이터를 추출 하고, 추출한 데이터를 분석 모듈(ROR, PRR, BCPNN, GPS)로 보낸다. 분석된 결과 는 보고 모듈과 사용자 인터페이스를 통하여 사용자에게 보여진다.
병원의 EMR 데이터베이스 중 분석에 필요한 데이터만을 복사해 놓은 PMS 데이터 웨어하우스를 이용하여 분석을 수행하도록 하였다. 원천 데이터베이스가
아닌 데이터 웨어하우스를 구축한 데에는 다음과 같은 이유가 있다. 첫째, 병원 업무와 본 시스템이 독립적으로 운영되게 하여 서로 영향을 주지 않기 위해서이다. 본 시스템이 약물 분석을 수행하기 위해서는 상당량의 계산이 필요한데, 이러한 분석을 병원 업무용 데이터 베이스에서 실행 시킬 경우, 의사 처방, 원무 작업 등의 속도가 늦춰질 수 있다. 하지만, 복사본인 데이터 웨어하우스를 사용함으로써 병원 업무에 전혀 지장을 주지 않을 수 있게 된다. 이는 또한 병원 업무가 본 시스템에 영향을 주지 않게도 하여 데이터 분석 시간도 줄이는데 기여하게 된다. 두 번째 이유는 정보 보호를 위해서 이다. 원본 데이터베이스에는 환자의 개인 신상 정보와 병력 등 공개되어서는 안될 중요한 데이터들이 많이 들어가 있다. 데이터 복제 과정에서 본 연구에 필요한 데이터만을 복제하며, 익명화 과정을 거치기 때문에, 정보 유출을 방지하고, 만약 유출되더라도 누구의 정보인지 알 수 없도록 하였다.
데이터 웨어하우스 구축을 위해 ETL (ETL: Extract, Transform, Load) 과정을 수행하였다(Fig.7). ETL 과정이란, 데이터 웨어하우스에 필요한 자료를 추출, 변형,
적재하는 과정을 말하며 데이터를 정화하는 과정도 포함된다. 원천
데이터베이스로부터 데이터를 추출한 후, 분석에 요구되는 사항에 적합하도록 변환하여 궁극적으로 타겟 시스템에 적재하는 일련의 과정을 일컫는다. 최종 데이터 웨어하우스는 MS-SQL 2000 을 이용하여 구축되었다.
Fig. 7. PMS 데이터 웨어하우스 구축을 위한 ETL 과정. Extract: 전자의무기록 데이 터베이스로부터 데이터를 읽어내는 과정, Transform: 추출된 데이터를 PMS 데이 터 웨어하우스의 데이터 구성 및 형태로 변형시키는 과정, Cleansing: 데이터를 정 제하고 전처리하는 과정(주로 Extract 단계 후 바로 수행됨), Load: PMS 데이터 웨 어하우스에 데이터를 저장하는 과정 사용자로부터 조건을 입력 받아 조건에 맞게 데이터를 입력 받고 분석을 명령하며 분석 결과를 처리하는 등의 데이터 조작을 위해 데이터 관리 프로그램을 개발하였다. 이 프로그램은 데이터 베이스 언어인 MS-SQL, 그리고 통계 프로그램인 R-package 와 연동 해야 하므로 유연성이 높은 JAVA 프로그램을 이용하여 개발되었고 사용자 인터페이스 개발에는 Dreamweaver 8 과 JSP 를 사용하였다. 데이터 관리 프로그램과 데이터 베이스는 JDBC 를 통하여
연동하였고(Fig. 6- , ② ②), R-package 와는 rJAVA 를 이용하여 연동하였다(Fig. 6- , ④
).
⑤ 이를 통해 데이터 관리 프로그램은 분석에 필요한 모든 프로그램들을
연결해주며 분석이 진행되도록 하는 데이터 관리 역할을 하게 된다.
데이터 관리 프로그램을 통해 분석에 알맞게 변형된 데이터는 R-package (R Development Core Team(2010). R: A language and environment for statistical computing R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.project.org)의 PhViD 패키지를 이용하여 DA 분석이 수행되었다. R-package는 통계 분석에 특화된 프로그램이며, PhViD는 R-package 환경에서
pharmacovigilance 연구를 수행할 수 있도록 ROR, PRR, BCPNN, GPS 등의 DA 분석 방법들을 제공해 준다. 분석 후 결과는 rJAVA를 통하여 데이터 관리 프로그램의 보고 모듈로 전송 된다(Fig. 6-⑤).
D. 성능 평가 제시된 연구 방법론의 유용성을 증명하고자 고지혈증 치료제 중 하나인 rosuvastatin 에 대한 실험적 PMS 연구를 수행하였다. 연구 대상은 2001 년 1 월 1 일에서 2009 년 12 월 31 사이에 한국의 한 3 차 의료기관(아주대병원)에서 약을 처방 받은 환자이며, 고지혈증 약을 주로 사용하는 40 세 이상의 환자들만을 대상으로 하였다. 분석 약물은 rosuvastatin, 비교 약물은 rosuvastatin 을 제외한 모든 약물로 하여, rosuvastatin 의 일반적인 유해반응을 살펴보는 연구를 수행하였다. DA 분석 기법은 ROR, PRR, BCPNN, GPS 를 모두 이용하여 결과를 살펴본 후, 각 결과를 비교 분석하였다. 성능 평가는 탐지된 실마리의 민감도와 양성 예측도를 통해 이루어 졌다.
민감도와 양성 예측도를 측정하기 위한 gold standard 는
2010 UpToDate ® Drug
Information Database (UpToDate, Waltham, MA, 이하 UpToDate)
를 참고하여선정하였다. UpTodate 에서 제공하는 rosuvastatin 의 약물 정보 중 유해반응 목록과 statin 계열 약물의 일반적인 유해반응 목록에 기록되어 있는 유해반응들을 gold standard 로 선정하였다(Table 6). ALT, AST, bilirubin 상승 등의 항목은 본 시스템이 유해반응으로 보고하는 진단명으로는 찾을 수 없는 항목이어서 Hepatic dysfunction 이라는 항목으로 묶어 평가하였다. UpToDate 에 기록 되어 있는 유해반응들의 표현 방법이 ICD-10 의 진단명과는 표현 양식이 다르기 때문에, ICD-10 기준으로 찾아진 실마리 중 gold standard 목록과 일치하는 것을 연구자가 찾아내어 true positive 로 간주하였다.
Table 6. Gold standard 목록 Rosuvastatin 의 유해반응 Headache Dizziness Nausea Abdominal pain Constipation Arthralgia Muscle injury Hematuria (microscopic) Hypersensitivity reactions
Memory deficits/Cognitive dysfunction Pancreatitis
Proteinuria (dose related) Renal failure
Thyroid function test abnormalities Hyperglycemia (Diabetes mellitus) Hepatic dysfunction
일반적 statin 의 유해반응+ Increased suicide/depression Irritability and aggression Cataract
Neuropathy Lupus
III.
결과
A. 성능 평가 결과 2001 년 1 월 1 일부터 2009 년 12 월 31 일 사이의 한 3 차 의료기관에서 입원하거나 외래 방문하여 약을 처방 받은 40 세 이상 환자들을 대상으로 분석한 결과 총 케이스 수는 17,040,204 건이었고, Rosuvastatin 을 복용한 케이스는 45,146 건, Rosuvastatin 이외의 약을 복용한 케이스는 16,995,058 건이었다(Table 7). 평균 나이는 59.34±11.82 세였고, 여자의 비율이 50.73% 였다. Rosuvastatin 의 처방 비율은 전체 처방의 0.26% 였다. Table 7. 연구대상자의 일반적 특성 특성 N % 나이(mean±SD) 59.34±11.82 40-49 4,402,276 25.83 50-59 4,259,500 25.00 60-69 4,611,665 27.06 70-79 3,007,667 17.65 80 이상 759,096 4.45 성별 남자 8,394,950 49.26 여자 8,645,254 50.73 약물 Rosuvastatin 45,146 0.26 다른 모든 약물 16,995,058 99.74 합계 17,040,204의미 있다고 감지된 실마리의 수는 ROR 을 통해서는 90 건, PRR 을 이용한 경우 42 건, BCPNN 을 이용한 경우 21 건, GSP 를 통해서는 14 건이었다.
본 시스템이 ROR 을 이용하여 분석한 결과 민감도는 61.9%, 양성 예측도는 36.6% 였다. Gold standard 로 선정된 21 가지 유해반응 중 13 가지의 유해반응을 찾아내었다. 전체 유해반응 리스트와 해당 유해반응을 찾아낸 실마리가 Table 8 에 나열되어 있다. 또한 감지된 90 건의 signal 중 33 건이 Gold standard 로 선정된 유해반응 목록과 연관 있는 것으로 판단되었다(Table 9).
Table 8. ROR로 감지된 실마리
ICD 코드 감지된 실마리(진단명) ROR FDR 알려진
유해반응 E14.9 Unspecified diabetes mellitus without complications 128.67 <0.01 √
M25.52 Pain in joint, upper arm 105.28 <0.01 √
B15 Acute hepatitis A 60.95 <0.01 √
I65.1 Occlusion and stenosis of basilar artery 60.95 <0.01
H35.6 Retinal hemorrhage 57.90 <0.01
I49.5 Sick sinus syndrome 52.64 <0.01
M25.45 Effusion of joint, pelvic region and thigh 52.64 <0.01 √ J44 Other chronic obstructive pulmonary diseases 42.89 <0.01 I11G Heart failure due to hypertension 38.60 <0.01
E78.5 Hyperlipidemia, unspecified 37.35 <0.01
K80.8 Other cholelithiasis 36.19 <0.01 √
I64 Stroke, not specified as hemorrhage or infarction 33.08 <0.01
E11.1B Non-Insulin dependent diabetic ketoacidosis without
mention of coma 30.47 <0.01
√
I63.8 Other cerebral infarction 30.47 <0.01
I25.2 Old myocardial infarction 28.95 <0.01
M51.2D Herniated neucleus pulposus, lumbar 28.24 <0.01
M13.96A Arthropathy NOS, lower leg 27.57 <0.01 √
E10.2 Insulin dependent diabetes mellitus with renal
complications 24.64 <0.01
√
E78.2 Mixed hyperlipidemia 24.64 <0.01
M80.9A Osteoporotic compression fracture 23.63 <0.01
G40.1B Simple partial seizures developing into secondarily
generalized seizures 23.16 <0.01
G91 Hydrocephalus 22.82 <0.01
E24 Cushing's syndrome 22.27 <0.01
I63.9F Ischemic stroke 18.92 <0.01
L03.1F Other cellulitis of leg, except foot 18.67 <0.01
E16.2 Hypoglycemia, unspecified 17.28 <0.01
H36.0 Diabetic retinopathy 17.03 <0.01 √
R47.1 Dysarthria and anarthria 16.78 <0.01
K93.8C Diabetes mellitus gastropathy 15.23 <0.01 √
G12.2 Motor neuron disease 14.46 <0.01 √
G04B Meningoencephalitis 14.12 <0.01
M81.9 Osteoporosis, unspecified 13.94 <0.01
K27.0 Acute peptic ulcer, site unspecified with hemorrhage 13.15 <0.01 √
G12.2B Amyotrophic lateral sclerosis 12.58 <0.01 √
N18.8 Other chronic renal failure 12.25 <0.01 √
G40 Epilepsy 11.58 <0.01
E11.3 Non-Insulin dependent diabetes mellitus with
ophthalmic complications 11.46 <0.01
√
I44.2A Complete heart block NOS 11.02 <0.01
S33.5 Sprain and strain of lumbar spine 10.52 <0.01 √
A16.9 Respiratory tuberculosis unspecified, without mention
of bacteriological or histological confirmation 10.24 <0.01 R50 Fever of other and unknown origin 10.12 <0.01
I63 Cerebral infarction 9.92 <0.01
K85.9E Acute (recurrent) pancreatitis 9.73 <0.01 √
E11.5 Non-Insulin dependent diabetes mellitus with
peripheral circulatory complications 9.04 <0.01 √
I20.9C Ischemic chest pain 9.03 <0.01
E13.5C Other specified diabetic ulcer 8.51 <0.01 √
I20 Angina pectoris 8.27 <0.01
C34.3 Malignant neoplasm of lower lobe, bronchus or lung 8.09 <0.01
R42 Dizziness and giddiness 7.97 <0.01 √
I63.9D Cerebellar infarction 7.61 <0.01
M80 Osteoporosis with pathological fracture 7.37 <0.01
R07.3A Anterior chest wall pain NOS 6.93 <0.01
I20.0 Unstable angina 6.86 <0.01
R94.3A Abnormal electrocardiogram [ECG][EKG] 6.77 <0.01 C25.9 Malignant neoplasm of pancreas, unspecified 6.73 <0.01 √
R07.3 Other chest pain 6.61 <0.01
G21.1 Other drug induced secondary parkinsonism 6.50 <0.01
J32 Chronic sinusitis 6.43 <0.01
R91 Abnormal findings on diagnostic imaging of lung 6.39 <0.01
I21 Acute myocardial infarction 6.21 <0.01
E11.4 Non-insulin dependent diabetes mellitus with
neurological complications 6.03 <0.01
√
I10 Essential(primary) hypertension 5.97 <0.01
E11.2 Non-Insulin dependent diabetes mellitus with renal
complication 5.43 <0.01
√
I71 Aortic aneurysm and dissection 5.36 <0.01
N08.3 Glomerular disorders in diabetes mellitus 5.05 <0.01 √
R07.4 Chest pain, unspecified 4.88 <0.01
F32.9A Depression NOS 4.71 <0.01 √
J45.0 Predominantly allergic asthma 4.68 <0.01 √
C25.0 Malignant neoplasm of head of pancreas 4.65 <0.01 √
K92.2C Hematochezia 4.47 <0.01 √
R47.0 Dysphasia and aphasia 4.05 <0.01
J81 Pulmonary edema 3.91 <0.01 √
M43.1 Spondylolisthesis 3.82 <0.01
R06.0 Dyspnea 3.77 <0.01
R56.8B Seizure (convulsive) NOS 3.74 <0.01
I50.0 Congestive heart failure 3.61 <0.01 √
B02 Zoster[herpes zoster] 3.38 <0.01
I25.9A Coronary heart disease 3.33 <0.01
K29.7 Gastritis, unspecified 3.33 <0.01 √
M80.98A Compression fracture of spine with osteoporosis 3.27 <0.01
G81 Hemiplegia 3.01 <0.01
E11 Non-insulin dependent diabetes mellitus
(non-obese)(obese) 2.92 <0.01
√
I20.9 Angina pectoris, unspecified 2.73 <0.01
N18 Chronic renal failure 2.50 <0.01 √
M51.9 Intervertebral disc disorder, unspecified 2.15 <0.01 Z50 Care involving use of rehabilitation procedures 2.05 <0.01 J44.9 Chronic obstructive pulmonary disease, unspecified 2.04 <0.01
Table 9. ROR로 감지된 실마리 중 유해반응 목록과 일치하는 실마리
Rosuvastatin 유해반응 각 유해반응에 해당하는 실마리
Headache None
Dizziness Dizziness and giddiness
Nausea None
Abdominal pain Diabetes mellitus gastropathy
Acute peptic ulcer, site unspecified with hemorrhage Other specified diabetic ulcer
Hematochezia
Constipation None
Arthralgia Pain in joint, upper arm
Effusion of joint, pelvic region and thigh Arthropathy NOS, lower leg
Muscle injury Sprain and strain of lumbar spine
Hematuria (microscopic) Insulin dependent diabetes mellitus with renal complications
Glomerular disorders in diabetes mellitus Hypersensitivity reactions Predominantly allergic asthma
Memory deficits/Cognitive dysfunction
None
Pancreatitis Acute (recurrent) pancreatitis
Malignant neoplasm of pancreas, unspecified Malignant neoplasm of head of pancreas
Proteinuria (dose related) Insulin dependent diabetes mellitus with renal complications Glomerular disorders in diabetes mellitu
Renal failure Other chronic renal failure
Insulin dependent diabetes mellitus with renal complications Non-Insulin dependent diabetes mellitus with renal complication
Glomerular disorders in diabetes mellitus Pulmonary edema
Congestive heart failure Thyroid function test
abnormalities
None
Hyperglycemia (Diabetes mellitus)
Unspecified diabetes mellitus without complications Non-Insulin dependent diabetes mellitus with ophthalmic
complications
Non-Insulin dependent diabetic ketoacidosis without mention of coma
Non-Insulin dependent diabetic ketoacidosis without mention of coma
Diabetic retinopathy
Diabetes mellitus gastropathy
Non-Insulin dependent diabetes mellitus with peripheral circulatory complications
Other specified diabetic ulcer
Non-insulin dependent diabetes mellitus with neurological complications
Non-Insulin dependent diabetes mellitus with renal complication
Glomerular disorders in diabetes mellitus Non-insulin dependent diabetes mellitus (non-obese)(obese)
Chronic renal failure Hepatic dysfunction Acute hepatitis A
Other cholelithiasis Increased suicide/depression Depression NOS Irritability and aggression None
Cataract None
Neuropathy Motor neuron disease
Amyotrophic lateral sclerosis
Non-insulin dependent diabetes mellitus with neurological complications
PRR 을 이용하여 분석한 결과는 민감도 28.6%, 양성 예측도 31.7% 였다. Gold standard 로 선정된 21 가지 유해반응 중 6 가지의 유해반응을 찾아내었다. 전체 유해반응 리스트와 해당 유해반응을 찾아낸 실마리가 Table 10 에 나열되어 있다. 또한 감지된 41 건의 signal 중 13 건이 Gold standard 로 선정된 유해반응 목록과 연관 있는 것으로 판단되었다 (Table 11).
Table 10. PRR로 감지된 실마리
ICD 코드 감지된 실마리(진단명) PRR FDR 알려진
유해반응 E14.9 Unspecified diabetes mellitus without complications 115.91 <0.01 √
M25.52 Pain in joint, upper arm 96.59 <0.01 √
B15 Acute hepatitis A 57.95 0.01 √
I65.1 Occlusion and stenosis of basilar artery 57.95 <0.01
H35.6 Retinal hemorrhage 55.19 <0.01
I49.5 Sick sinus syndrome 50.39 0.01
M25.45 Effusion of joint, pelvic region and thigh 50.39 0.01 √ J44 Other chronic obstructive pulmonary diseases 41.39 0.01
I11G Heart failure due to hypertension 37.39 0.01
E78.5 Hyperlipidemia, unspecified 36.22 0.02
K80.8 Other cholelithiasis 35.12 0.02 √
I64 Stroke, not specified as hemorrhage or infarction 32.19 0.02
E11.1B Non-Insulin dependent diabetic ketoacidosis without
mention of coma 29.72 0.02
√
I63.8 Other cerebral infarction 29.72 0.02
I25.2 Old myocardial infarction 28.27 0.03
M51.2D Herniated neucleus pulposus, lumbar 27.59 0.03 M13.96
A Arthropathy NOS, lower leg 26.95 0.03
√
I21.9A Non-ST elevation myocardial infarction 24.92 <0.01
E10.2 Insulin dependent diabetes mellitus with renal
complications 24.14 0.04
E78.2 Mixed hyperlipidemia 24.14 0.04 M80.9A Osteoporotic compression fracture 23.18 0.04
G40.1B Simple partial seizures developing into secondarily
generalized seizures 22.72 0.04
G91 Hydrocephalus 22.40 <0.01
E24 Cushing's syndrome 21.86 0.05
I63.9F Ischemic stroke 18.64 <0.01
L03.1F Other cellulitis of leg, except foot 18.39 0.08
E16.2 Hypoglycemia, unspecified 17.04 0.09
H36.0 Diabetic retinopathy 16.79 0.10 √
R47.1 Dysarthria and anarthria 16.55 0.10
G12.2 Motor neuron disease 14.29 0.01 √
M81.9 Osteoporosis, unspecified 13.78 0.01
N18.8 Other chronic renal failure 12.13 0.02 √
E11.3 Non-Insulin dependent diabetes mellitus with ophthalmic
complications 11.36 0.02
√
R50 Fever of other and unknown origin 10.04 0.03
I63 Cerebral infarction 9.86 <0.01
I20.9C Ischemic chest pain 8.97 <0.01
R42 Dizziness and giddiness 7.92 0.07 √
I20.0 Unstable angina 6.82 <0.01
I21 Acute myocardial infarction 6.18 <0.01
I10 Essential(primary) hypertension 5.95 0.01
R07.4 Chest pain, unspecified 4.86 <0.01
Table 11. PRR로 감지된 실마리 중 유해반응 목록과 일치하는 실마리
Rosuvastatin 유해반응 각 유해반응에 해당하는 실마리
Headache None
Dizziness Dizziness and giddiness
Nausea None
Abdominal pain None
Constipation None
Arthralgia Pain in joint, upper arm
Effusion of joint, pelvic region and thigh Arthropathy NOS, lower leg
Muscle injury None
Hematuria (microscopic) None Hypersensitivity reactions None Memory deficits/Cognitive
dysfunction
None
Pancreatitis None
Proteinuria (dose related) None
Renal failure Other chronic renal failure
Insulin dependent diabetes mellitus with renal complications Thyroid function test abnormalities None
Hyperglycemia (Diabetes mellitus)
Unspecified diabetes mellitus without complications Non-Insulin dependent diabetes mellitus with ophthalmic complications
Non-Insulin dependent diabetic ketoacidosis without mention of coma
Insulin dependent diabetes mellitus with renal complications Diabetic retinopathy
Hepatic dysfunction Acute hepatitis A Other cholelithiasis Increased suicide/depression None
Irritability and aggression None
Cataract None
Neuropathy Motor neuron disease
BCPNN 을 이용하여 분석한 결과, 민감도 19.0%, 양성 예측도 19.0% 였다. Gold standard 로 선정된 21 가지 유해반응 중 4 가지의 유해반응을 찾아내었다. 전체 유해반응 리스트와 해당 유해반응을 찾아낸 실마리가 Table 12 에 나열되어 있다. 또한 감지된 21 건의 signal 중 4 건이 Gold standard 로 선정된 유해반응 목록과 연관 있는 것으로 판단되었다 (Table 13). Table 12. BCPNN으로 감지된 실마리 ICD 코드 감지된 실마리(진단명) Count Expected Count FDR 알려진 유해반응
I63 Cerebral infarction 26 3.03 <0.01
R07.4 Chest pain, unspecified 10 2.15 <0.01
I21 Acute myocardial infarction 6 1.00 <0.01
I20.9C Ischemic chest pain 5 0.57 <0.01
I20.0 Unstable angina 5 0.75 <0.01
I10 Essential(primary) hypertension 5 0.86 <0.01
R06.0 Dyspnea 6 1.63 <0.01
I21.9A Non-ST elevation myocardial infarction 3 0.12 0.01
G91 Hydrocephalus 2 0.09 0.02
I63.9F Ischemic stroke 2 0.11 0.02
G12.2 Motor neuron disease 2 0.14 0.03 √
M81.9 Osteoporosis, unspecified 2 0.15 0.04
N18.8 Other chronic renal failure 2 0.17 0.04 √
E11.3 Non-Insulin dependent diabetes mellitus with
ophthalmic complications 2 0.18 0.05
√
R50 Fever of other and unknown origin 2 0.20 0.05
R42 Dizziness and giddiness 2 0.26 0.06 √
I71 Aortic aneurysm and dissection 2 0.38 0.07
F32.9A Depression NOS 2 0.43 0.07
I50 Heart failure 2 0.58 0.09
Table 13. BCPNN으로 감지된 실마리 중 유해반응 목록과 일치하는 실마리
Rosuvastatin 유해반응 각 유해반응에 해당하는 실마리
Headache None
Dizziness Dizziness and giddiness
Nausea None
Abdominal pain None
Constipation None
Arthralgia None
Muscle injury None
Hematuria (microscopic) None Hypersensitivity reactions None Memory deficits/Cognitive
dysfunction
None
Pancreatitis None
Proteinuria (dose related) None
Renal failure Other chronic renal failure Thyroid function test abnormalities None
Hyperglycemia (Diabetes mellitus)
Non-Insulin dependent diabetes mellitus with ophthalmic complications
Hepatic dysfunction None
Increased suicide/depression None Irritability and aggression None
Cataract None
Neuropathy Motor neuron disease
GPS 를 이용하여 분석한 결과, 민감도 14.3%, 양성 예측도 21.4% 였다. Gold standard 로 선정된 21 가지 유해반응 중 3 가지의 유해반응을 찾아내었다. 전체 유해반응 리스트와 해당 유해반응을 찾아낸 실마리가 Table 14 에 나열되어 있다. 또한 감지된 14 건의 signal 중 3 건이 Gold standard 로 선정된 유해반응 목록과 연관 있는 것으로 판단되었다 (Table 15). Table 14. GPS로 감지된 실마리 ICD 코드 감지된 실마리(진단명) Count Expected Count FDR 알려진 유해반응
I63 Cerebral infarction 26 3.03 <0.01
R07.4 Chest pain, unspecified 10 2.15 <0.01
I21 Acute myocardial infarction 6 1.00 <0.01
I20.9C Ischemic chest pain 5 0.57 0.01
I20.0 Unstable angina 5 0.75 0.01
I10 Essential(primary) hypertension 5 0.86 0.02
R06.0 Dyspnea 6 1.63 0.02
I21.9A Non-ST elevation myocardial infarction 3 0.12 0.03
G91 Hydrocephalus 2 0.09 0.04
I63.9F Ischemic stroke 2 0.11 0.06
G12.2 Motor neuron disease 2 0.14 0.07 √
M81.9 Osteoporosis, unspecified 2 0.15 0.08
N18.8 Other chronic renal failure 2 0.17 0.09 √
E11.3 Non-Insulin dependent diabetes mellitus with
Table 15. GPS로 감지된 실마리 중 유해반응 목록과 일치하는 실마리
Rosuvastatin 유해반응 각 유해반응에 해당하는 실마리
Headache None
Dizziness None
Nausea None
Abdominal pain None
Constipation None
Arthralgia None
Muscle injury None
Hematuria (microscopic) None Hypersensitivity reactions None Memory deficits/Cognitive
dysfunction
None
Pancreatitis None
Proteinuria (dose related) None
Renal failure Other chronic renal failure Thyroid function test abnormalities None
Hyperglycemia (Diabetes mellitus)
Non-Insulin dependent diabetes mellitus with ophthalmic complications
Hepatic dysfunction None
Increased suicide/depression None Irritability and aggression None
Cataract None
Neuropathy Motor neuron disease
Rosuvastatin 에 대한 ROR, PRR, BCPNN, GPS 의 성능을 각 방법 별로 비교해 보면, 민감도는 각각 61.9%, 28.6%, 19.0%, 14.3% 였으며, 양성 예측도는 각각 36.7%, 31.7%, 19.0%, 21.4% 였다(Fig. 8). Fig. 8. EMR 데이터에서의 DA 방법 별 민감도와 양성 예측도. 가로 축은 사용된 DA 방법을, 세로 축은 민감도 혹은 양성예측도를 나타냄. ROR: 민감도 61.9%, 양 성예측도36.7%, PRR: 민감도 28.6%, 양성예측도 31.7%, BCPNN: 민감도 19.0%, 양 성예측도19.0%, GPS: 민감도 14.3%, 양성예측도 21.4%
B. 전자의무기록을 이용한 불균형분석기반의 정량적 약물 감시 시스템 제안된 시스템 구조를 적용하여 ‘전자의무기록을 이용한 불균형분석기반의 정량적 약물 감시 시스템’을 개발하였다. 사용자는 사용자 인터페이스를 통해 시스템에게 명령을 내리고 결과를 보고 받는다. 로그인 과정을 통해 승인을 받은 연구자는 첫 화면에서 연구 조건들을 선택하게 된다(Fig. 9). Fig. 9. 사용자 인터페이스의 조건 선택 화면. ‘전자의무기록을 이용한 불균형분석 기반의 정량적 약물 감시 시스템’의 첫 화면으로 연령, 성별, 과거력, 연구 대상 약물, 비교 약물, 연구 대상 처방일, 분석 방법 등의 연구 조건을 선택할 수 있다. 연령 조건 항목에서는 ‘이상’, ‘이하’ 혹은 둘 모두를 선택하고 제한 연령을 직접 입력할 수 있다(Fig. 10A). 두 번째 항목인 성별 조건에서는 ‘제한 없음’, ‘남자’, ‘여자’를 선택할 수 있다(Fig. 10B). 과거력 또한 ‘제한 없음’이나 ICD-10
코드에 따라 특정 과거 진단명을 선택할 수 있다(Fig. 10C). 연구대상 약물의 경우 성분명을 입력하고 ‘검색’을 클릭하면(Fig. 10D) 아래 해당하는 성분명을 갖는 약품 목록이 표시되며, 이중 연구 대상으로 포함시킬 약품을 클릭하여 선택할 수 있다(Fig. 10E). 비교 약물 역시 검색을 통하여 선택할 수 있으며, 연구대상 이외의 모든 약물을 연구대상으로 할 경우에는 ‘다른 모든 약물’을 선택한다(Fig. 10F, G). 분석 대상 기간은 처방된 날짜를 기준으로 하여 ‘연구 대상 처방일’ 항목에 직접 입력한다(Fig. 10H). 마지막으로 ROR, PRR, BCPNN, GPS 중 연구 방법을 선택한다(Fig. 10I). 모든 조건 선택을 완료한 후 ‘분석 시작’을 클릭하면(Fig. 10J), 자동적으로 모든 연구를 수행한 후 결과를 사용자에게 보여준다(Fig. 10K). ROR 과 PRR 분석을 한 경우 찾아진 실마리들의 ICD-10 코드, 진단명, ROR 혹은 PRR 값, FDR 값이 출력되며, BCPNN 과 GPS 분석을 한 경우에는 찾아진 실마리들의 ICD-10 코드, 진단명, 약물-유해반응 조합이 생성된 횟수, 예측된 조합의 생성 횟수, FDR 값들이 결과로 출력된다. 한 3 차 의료기관의 9 년치 데이터를 이용하여 rosuvastatin 의 약물 유해반응 연구를 수행하는 데에 약 107 분이 소요되었다.
Fig. 10. 사용자 인터페이스의 결과 보고 화면. 연구 조건을 선택하고(A-I) 분석 시 작 명령을 내리면(J) 조건에 맞춰 PMS 연구를 수행한 후 결과를 보여준다(K).