서론
약물은 체내에 존재하는 특정 작용 부위에 반응하여 약리 작용을 나타내는데, 약리활성을 가진 모든 물질은 우리가 원 하는 치료(또는 진단, 예방)효과 외에 원치 않는 유해한 반응
(약물이상반응, adverse drug reaction)을 일으킬 수 있다. 적절한 용법과 경로로 약물을 투여하여도 의도하지 않은 약 물이상반응이 발생할 수 있으며 약제의 종류 및 나이, 성별, 유전적 소인, 기저질환 등에 따라 다양한 빈도로 나타난다. 일부 약물이상반응은 치료를 위해 감수하기도 하지만, 약물 이상반응의 위험이 이익을 상회하는 경우 약물투여를 중단 해야 하는 경우가 생기기도 한다. 의약학의 발달에 따라 약물사용이 증가하고 약물개발 이 확대됨에 따라 약물이상반응은 세계적으로 중요한 보건 문제로 떠오르고 있다. 시판 후 약물감시(postmarketing surveillance)의 중요성은 1950년대 독일에서 임신부에 투여 된 탈리도마이드(thalidomide)로 인해 태아에 양측 팔이 없
약물 이상반응
조 민 경1·강 동 윤1·강 혜 련1-3 | 1 서울대학교병원 약물안전센터, 2 서울대학교의학연구원 알레르기 및 임상면역학연구소, 3 서울대학교병원 알레르기내과Adverse drug reactions
Min-Kyung Cho, MD1·Dong Yoon Kang, MD1·Hye-Ryun Kang, MD1-3
1Drug Safety Center, Seoul National University Hospital, 2Institute of Allergy and Clinical Immunology, Seoul National University Medical Research Center, 3Division of Allergy and Clinical Immunology, Seoul National University Hospital, Seoul, Korea
Received: June 19, 2019 Accepted: July 29, 2019 Corresponding author: Hye-Ryun Kang
E-mail: helenmed@snu.ac.kr © Korean Medical Association
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons. org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
There are no drugs without the risk of potential adverse reactions. All pharmacologically active substances can cause adverse drug reactions (ADRs). This paper aims at introducing recent trends in pharmacosurveillance systems for ADRs, which can be broadly classified into type A and B reactions. Since type A reactions are associated with drug pharmacology, they are usually dose-dependent and predictable. Whereas, type B reactions occur in some susceptible individuals, regardless of the pharmacological action of drug. Drug hypersensitivity reactions are typical examples of type B reactions and are subclassified according to the underlying pathomechanism. Recent advancements in pharmacogenomics have enlightened the understanding of individual differences in drug efficacy and susceptibility to ADRs. Therefore, expectations for safe personalized medicines are higher than ever before. However, premarketing clinical trials are too small and too short to uncover rare but serious ADRs and detect long-standing ADRs. In the past, post-marketing surveillance systems mainly focused on passive ADR monitoring systems, based on spontaneous reports. Recently, the importance of active pharmacovigilance systems, which use big data, is growing with recent advancements in medical informatics. Thus, regarding ADRs, suspecting and detecting the causative drug using causality assessment based on data science may contribute to decrease suffering induced by ADRs.
Key Words: Drug-related side effects and adverse reactions; Pharmacovigilance;
거나 짧은 해표상지증이 발생한 사건을 계기로 대두되었고, 1968년 세계보건기구에서 국제약물모니터링 프로그램이 구 축되면서 본격적인 약물감시가 시작되었다. 그 후 1978년에 세계보건기구의 후원 하에 스웨덴 웁살라에 세계보건기구-웁살라모니터링센터(World Health Organization-Uppsala Monitoring Center, WHO-UMC)가 설립되었고 우리나라 는 1992년에 WHO-UMC 회원국으로 가입하였다[1]. 약물감시(pharmacovigillance) 분야는 지난 수십 년간 자발신고를 기반으로 한 수동적 이상사례 수집에 근간을 두고 성장해왔으나, 최근 정보의학의 발달과 함께 빅데이 터 기반의 능동적 약물감시로의 전환을 앞두고 있다. 최근 수십 년간 이루어진 유전체학의 발전은 약물 분야에도 영 향을 미쳐 약물유전체학 분야에서 큰 진보를 이루었으며, 이를 기반으로 개인별 약물에 대한 효과나 부작용의 차이 에 대한 이해의 폭이 넓어졌고 개인 맞춤 약물치료에 대한 기대가 그 어느 때보다도 높아졌다. 이에 약물이상반응에 관해 임상의가 알아두어야 할 최신 동향과 약물감시체계 현황에 대해 소개하고자 한다.
약물이상반응의 정의 및 개념
이상사례(adverse event)는 의약품 등의 투여·사용 중 발 생한 바람직하지 않고 의도되지 않은 징후, 증상 또는 질병 을 말한다. 이러한 이상사례 중 의약품과의 인과관계를 배제 할 수 없는 경우 약물이상반응으로 분류하며, 이는 정상적인 용법에 따라 의약품을 투여, 사용 중 발생한 유해하고 의도 하지 않은 반응이다. 반면 부작용(side effect)은 의약품 등을 정상적인 용량에 따라 투여한 경우 발생하는 모든 의도되지 않은 작용을 말하며, 유해한 효과뿐만 아니라 긍정적인 작용 도 포함한다[2]. 약물감시는 약물의 이상작용 또는 약물 관련 문제의 탐 지·평가·해석·예방에 관한 과학적 연구 및 활동을 말하 며 의약품의 안전성정보 수집에서부터 위해관리에 이르기까 지 의약품의 전 주기에 거쳐서 이어지는 활동이다. 적극적인 약물감시를 통해 인과관계가 알려지지 않았거나 입증자료가 불충분하지만 인과관계를 배제할 수 없어 지속적인 관찰이 요구되는 실마리정보를 생성할 수 있다[3].약물이상반응의 분류
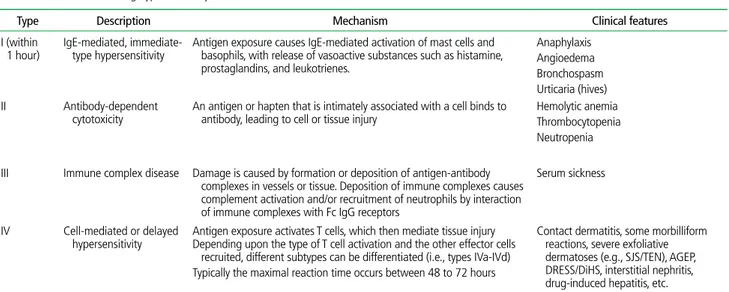
약물이상반응은 전통적으로 약리학적 작용과 관련된 A형 반응과 약리학적 작용과 무관하게 특정 소인을 가진 사람에서 발생하는 B형 반응으로 구분된다[4]. A형 반응 은 약을 복용하는 모든 사람에게서 나타날 수 있으며, 과 용량, 부작용, 이차 또는 간접효과, 약물 상호작용이 포함 된다[5]. B형 반응에는 약물불내성, 특이반응, 약물알레르 기, 가성알레르기 등이 포함된다. 전통적인 A형, B형 반응 분류 외 용량과 시간이 관련된 만성 반응을 C형 반응(예: corticosteroid 복용으로 인한 골다공증), 지연성 반응을 D형 반응(예: 앤지오텐신 전환효소 억제제의 최기형성)이라고 하며, 약물의 중단과 관련된 금단증상인 E형 반응과 치료 실패로 인한 F형 반응을 약물이상반응에 포함시키기도 한 다(Table 1) [6,7]. 약물과민반응은 약물에 의해 면역학적 기전이 활성화 되어 발생하며 I, II, III, IV형 과민반응이 있다(Table 2) [8]. I형 과민반응은 IgE 항체, 비만세포 등에 의한 즉시 형 면역반응이며 주로 두드러기성 발진, 가려움증, 혈관 부종, 기도부종, 위장관 증상, 저혈압, 아나필락시스 등의 증상으로 나타난다. 이에 반해 가성알레르기반응은 과민 반응과 유사하지만 면역반응이 형성되지 않는 것으로 감 작(sensitization)과 같은 면역반응 없이 비만세포 탈과립 으로 인한 두드러기, 혈관부종, 아나필락시스가 나타날 수 있어 I형 과민반응과 정확한 구분이 어려울 때가 많다[9]. II형 과민반응은 IgG 항체에 의한 세포독성에 의해 발생하 며 약물이 특정세포 표면에 부착되어 항원으로 작용하고 세 포표면에 IgG 항체가 붙으면 대식세포, 보체가 활성화되 어 세포가 파괴되며 용혈성 빈혈, 혈소판감소증 등의 증상 으로 나타난다. III형 과민반응은 면역복합체에 의해 발생 하며, 약물이 IgG 항체에 결합되어 면역복합체를 형성하 여 혈관, 관절, 사구체 등 여러 조직에 침착되고 보체가 활성화되어 혈청병, 혈관염, 약물열 등의 증상을 유발한다. IV형 과민반응은 T세포의 활성화에 의해 발생하며 보 통 항원 노출 후 48-72시간이 지나서 발생하며 수일에서 수주 후에 발생하기도 한다. IV형 반응은 다시 네 가지 아 형으로 나뉠 수 있다. IVa형은 대식세포 활성화와 관련이 있으며, 대표적인 예인 접촉피부염은 국소적으로 적용한
Table 1. Classification of adverse drug reactions
Type Mnemonic Features Examples Management
A: Dose-related Augmented Common Predictable
Related to a pharmacological action of the drug Low mortality
Toxic effects: digoxin toxicity; serotonin syndrome with SSRIs
Side effects: anticholinergic effects of tricyclic antidepressants
Secondary or indirect effects: gastrointestinal bacterial alteration after antibiotics use
Drug interactions: erythromycin increasing theophylline/ digoxin blood levels
Reduce dose or withhold Consider effects of concomitant therapy
B: Non-dose-related Bizarre Uncommon Unpredictable
Not related to a pharmacological action of the drug
High mortality
Immunological reactions: penicillin hypersensitivity Idiosyncratic reactions: acute porphyria
Malignant hyperthermia Pseudoallergy (e.g., ampicillin rash)
Intolerance: tinnitus after taking a single aspirin tablet
Withhold and avoid in future
C: Dose- and
time-related Chronic UncommonRelated to the cumulative dose Hypothalamic-pituitary-adrenal axis suppression by corticosteroids Reduce dose or withhold; withdrawal may have to be prolonged
D: Time-related Delayed Uncommon Usually dose-related
Occurs sometime after the use of the drug
Teratogenesis (e.g., vaginal adenocarcinoma with diethylstilbestrol)
Carcinogenesis Tardive dyskinesia
Often intractable
E: Withdrawal End of use Uncommon
Occurs soon after withdrawal of the drug
Opiate withdrawal syndrome
Myocardial ischemia (β-blocker withdrawal)
Reintroduce and withdraw slowly
F: Unexpected
failure of therapy Failure CommonDose-related
Often caused by drug interactions
Inadequate dosage of an oral contraceptive, particularly
when used with specific enzyme inducers Increase dosageConsider effects of concomitant therapy
Adapted from Edwards IR et al. Lancet 2000;356:1255-1259 [6]. SSRI, serotonin-selective reuptake inhibitor.
Table 2. Classification of drug hypersensitivity reactions
Type Description Mechanism Clinical features
I (within
1 hour) IgE-mediated, immediate- type hypersensitivity Antigen exposure causes IgE-mediated activation of mast cells and basophils, with release of vasoactive substances such as histamine, prostaglandins, and leukotrienes.
Anaphylaxis Angioedema Bronchospasm Urticaria (hives) II Antibody-dependent
cytotoxicity An antigen or hapten that is intimately associated with a cell binds to antibody, leading to cell or tissue injury Hemolytic anemiaThrombocytopenia Neutropenia
III Immune complex disease Damage is caused by formation or deposition of antigen-antibody complexes in vessels or tissue. Deposition of immune complexes causes
complement activation and/or recruitment of neutrophils by interaction of immune complexes with Fc IgG receptors
Serum sickness
IV Cell-mediated or delayed
hypersensitivity Antigen exposure activates T cells, which then mediate tissue injury Depending upon the type of T cell activation and the other effector cells recruited, different subtypes can be differentiated (i.e., types IVa-IVd) Typically the maximal reaction time occurs between 48 to 72 hours
Contact dermatitis, some morbilliform reactions, severe exfoliative
dermatoses (e.g., SJS/TEN), AGEP, DRESS/DiHS, interstitial nephritis, drug-induced hepatitis, etc.
Adapted from Weiss ME et al. Clin Allergy 1988;18:515-540 [8].
SJS, Steven-Johnson syndrome; TEN, toxic epidermal necrosis; AGEP, acute generalized exanthematous pustulosis; DRESS, drug reaction with eosinophilia and systemic symp-toms; DiHS, drug-induced hypersensitivity syndrome.
약에 대한 반응으로 발생하며 홍반, 부종, 수포 등이 나타 나며 가피를 남긴다. 반구진성 발진은 IVb형 반응으로 IV 형 과민반응 중 가장 흔하다. 보통 원인 약물 노출 4-10일 경에 발생하며 주로 몸통에서 시작되어 사지 부위로 확대 될 수 있다[10]. 이와 유사하지만 보다 중증인 IVb형 반응으 로 호산구증가와 전신반응을 동반한 약발진(drug reaction with eosinophilia and systemic symptoms, DRESS)이 있다. 약인성 과민반응증후군이라고도 불리며, 발진, 발열 등의 증상으로 시작되어 고열과 함께 호산구증가증, 림프 절 종대가 특징적이며 간, 신장 등 내부장기 침범이 특징적 이다. 보통 일반 발진보다 긴 잠복기를 가져 약물 노출 2- 6주 후 비로소 증상이 시작된다. 약물에 의한 세포독성 림프 구(cytotoxic T cell) 활성화를 주된 기전으로 하는 IVc형 반 응인 스티븐슨존슨증후군(Stevens-Johnson syndrome, SJS), 독성표피괴사용해(toxic epidermal necrolysis, TEN)는 피부반점과 함께 기저층의 손상으로 특징적인 표 피 분리가 일어나 광범위한 피부박리를 유발할 수 있다. 피 부와 함께 점막 침범이 흔히 나타나며 점막 침범은 주로 입 술, 구강, 결막, 성기에서 관찰된다. 체표면적을 기준으로 피부박리가 10% 미만이면 SJS, 30% 이상이면 TEN으로 진단한다. DRESS, SJS, TEN을 중증피부유해반응(severe cutaneous adverse reaction, SCAR)이라고 하며, 전신에 농포가 생기는 급성전신발진성농포증(acute generalized exanthematous pustulosis, AGEP)을 SCAR에 포함시키 기도 하지만 AGEP은 임상경과가 상대적으로 양호한 편이 다[11].
약물유전체학과 약물이상반응
약물유전체학은 전통적으로는 약물의 작용에 영향을 주는 유전적 요인에 대한 연구로 시작하였으나 유전적 요인에 따 른 약물대사, 특이반응 외 약물과 관련된 면역반응의 차이도 활발하게 연구되어 왔으며, 치료효과뿐만 아니라 이상반응 발생과 관련된 연구들에서 많은 발전을 보였다. 약물대사는 크게 산화, 환원, 가수분해 반응의 phase I 반응 과, 주로 글루콘산화(glucuronidation), 설폰화(sulfonation), 아세틸화(acetylation) 등의 phase II 반응으로 나눠진다. 시토 크롬 P450 일산화효소(cytochrome p450 monooxygenase, CYP)는 약물대사를 촉매하는 효소복합체로, phase I 대사의 대부분을 차지한다. 시토크롬 P450의 활성은 여러 약물 또는 음식물에 의해 활성화되거나 억제 될 수 있으며 약물을 복용 하지 않은 건강한 사람에서 시토크롬 P450에 의한 약물대사 속도는 주로 유전적 요인에 의해 결정된다[12]. 시토크롬 P450에는 여러 동종 효소가 존재하며 그 중 가 장 높은 비중을 차지하는 것은 CYP3A4로 산화과정을 겪는 약물의 50%의 대사에 관여한다[13]. CYP3A4는 효소활성 분포가 연속적이고 단봉형으로 여러 유전자가 관여하고 개 개의 유전자의 역할이 크지 않으며 여러 요인에 의해 영향 을 받는다. CYP2D6, CYP2C9 등은 효소활성의 분포가 빠 른 대사자, 느린 대사자, 초신속대사자 등의 다봉형으로 분 포하며, 여러 대립유전자에 의해 효소활성이 결정되는 유전 적 다형성을 보인다. 두 개의 야생형 대립유전자를 가져 정 상대사속도를 가진 사람을 빠른 대사자라고 하며 결함이 있 는 대립유전자를 가져서 효소활성이 저하된 사람을 느린 대 사자라 한다. 초신속대사자는 유전자 중복이나 증폭으로 야 생형 대립유전자를 두 개보다 많이 가지고 있는 사람을 말한 다. CYP2D6 느린 대사자는 삼환계항우울제 복용 시 부작용 을 빈번하게 경험할 수 있다. 코데인의 경우 CYP2D6의 느 린 대사자에서 활성형인 morphine으로 전환되는 양이 적으 므로 진통효과가 잘 나타나지 않으나 초신속대사자의 경우 morphine으로 과도하게 전환되어 morphine 독성이 나타날 수 있다. 2006년 코데인을 투여받은 엄마의 모유를 먹은 신 생아가 morphine 중독으로 사망한 사건이 보고되었는데 아 기의 엄마가 CYP2D6 초신속대사자로 codeine이 morphine 으로 과도하게 전환되어 모유를 통해 아기에게 다량 전달되 었던 것으로 밝혀졌다[14].조직적합항원(human leukocyte antigen, HLA)은 사 람에서 주조직적합성복합체 단백질을 코딩하는 유전자복 합체로 I형과 II형으로 나눠진다. HLA I형 분자는 A, B, C 로 구성되며 모든 유핵세포에서 발견되고 CD8 세포독성 T 세포에 항원을 제시하는 역할을 한다. 반면 HLA II형 분자
는 주로 항원제시세포에서 발견되며 CD4 보조 T 세포에 항원을 제시한다. 약물유전체학 연구를 통해 HLA 유전자 형이 특정 약물에 의한 SCAR 발생위험과 연관성을 가지 는 것으로 확인되었다. 현재까지 알려진 SCAR 관련 HLA 유전자형은 한국인을 비롯한 동양인에서 유의한 연관성 을 보인 allopurinol과 HLA–B*58:01과 함께 백인에서 abacavir와 HLA–B*57:01, 중국 한족에서 carbamazepine 과 HLA–B*15:02, dapsone과 HLA–B*13:01 등이 있다 [11]. 이러한 약물-SCAR 간 강한 연관성은 예방목적으로 도 활용이 되었다. 대만에서 carbamazepine에 의해 SJS/ TEN이 발생한 환자의 100%에서 HLA–B*15:02 대립유 전자가 양성임을 보고한 후, carbamazepine 최초 처방 전 HLA–B*15:02 선별검사를 통해 SCAR 발생을 예방할 수 있음을 발표하였다. 그러나 HLA는 인종별로 상이한 분포를 보이므로 SCAR와 관련성 또한 인종별로 차이를 보여 한국 인에서는 HLA–B*15:02가 전인구의 0.4%에 지나지 않아 예방을 위한 사전검사로 활용은 어려웠다. HLA–B*15:11 (odds ratio, 18.0)과 HLA–A*31:01 (odds ratio, 8.8)이 한국인에서 carbamazepine 과민반응과 관련된 것으로 보 이지만 임상에 적용하기에는 연관성이 강하지 않았다[15]. 또 다른 예로 미국 식품의약국은 abacavir 과민반응증후군 을 피하기 위해 약 투여 전 HLA–B*57:01을 검사하여 양 성으로 나타날 경우 다른 약을 투여하도록 권고하였으나 한 국인에서는 HLA–B*57:01의 빈도가 극히 낮아 국내 HIV 환자에서 abacavir 투여 전 HLA–B*57:01 검사는 유용성 이 없었다[16]. 한국인에서는 allopurinol에 의한 SCAR와 HLA–B*58:01 간 강한 연관성을 보였으며, 만성 신부전 환 자에서 후향적 코호트 분석을 한 결과 HLA–B*58:01 양성 인 만성신부전 환자가 allopurinol을 복용할 경우 18%에서 SCAR가 발생하여, 전체 대상자 중 SCAR 발생률 2%보다 9배 높게 나타났다[17]. 이를 기반으로 allopurinol 처방 이 필요한 환자에서 HLA–B*58:01 사전 검사를 통해 성 공적으로 SCAR 발생을 예방할 수 있었다[18]. 다른 인종 에서는 흔치 않은 HLA–B*59:01은 한국인과 일본인, 중 국인에서 주로 분포하는데, 한중일 세 개 나라에서 보고한 methazolamide 등 carbonic anhydrase를 복용 후 발생한
SJS/TEN 증례에서 HLA–B*59:01이 거의 모든 환자에서 양성을 보였다[19,20].
약물이상반응의 진단과 인과성 평가
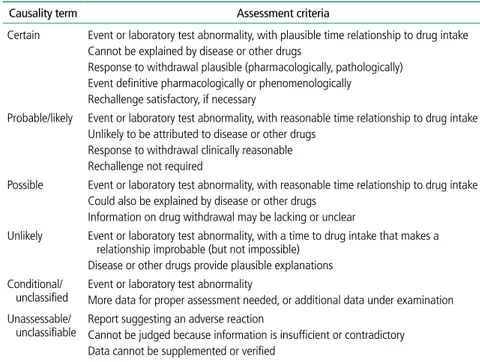
환자들은 약물이상반응이 나타나더라도 자신의 증상을 약 과 연관시키지 못할 가능성이 있으므로 처방의가 구체적으 로 물어보지 않으면 약물이상반응을 제대로 진단하지 못할 수 있다. 약 투여와 증상 발생 간의 시간적 연관성의 확인이 도움이 되며, 약제별로 특징적인 이상반응의 임상양상, 예를 들어 항히스타민 투여 후 졸림, 마약성 진통제 투여로 인한 구역감, 등에 대해 의료진이 인지하고 환자에게 미리 주지시 킬 경우 이상반응을 인지하는데 도움이 된다. 이상반응 발생을 확인할 때 정확한 약 복용력을 조사하는 것이 중요한데, 전문의약품 외 일반의약품, 건강기능식품, 한약 복용력까지 확인해야 하며, 여러 병원의 여러 진료과에 서 처방받아서 복용하는 경우 복용하는 모든 약물을 확인해 야 한다. 일단 의심되는 약물이 확인되면 국내허가사항, 미 국 식품의약국 허가사항, Micromedex, Lexicomp 등의 문 헌검색을 통해 해당약물의 알려진 부작용을 검색하여 환자 가 호소하는 증상과 부합하는지 확인한다. 이 밖에 일부 약 물은 혈중농도, 조직검사, 알레르기 검사 등이 진단에 도움 이 될 수 있으며, 약 투여 전 간기능, 신기능, 갑상선 검사 등 의 혈액 검사를 미리 시행해두면 약물 투여 전후 변화 여부 를 확인할 수 있다. 약물이상반응은 진단법이 없는 경우가 많아 정확한 진단이 어렵지만, 원인 약제의 가능성을 보다 객관적으로 평가하기 위해 다음의 방법들로 인과성을 평가한다. 대표적인 인과성 평가법으로는 WHO-UMC 지표, Naranjo 알고리즘, Rucam 알고리즘, 한국형 알고리즘 등이 있다. WHO-UMC 지표는 약물투여와 약물이상반응 간에 시간적 인과관계가 타당한지 여부, 약물 이외의 다른 원인이 있을 가능성, 약물의 투여 중 단 및 재투여 후 반응의 변화여부 등을 평가한다. 약 투여 와 증상발생 간에 시간적 연관성이 있고 증상이 기저질환이 나 다른 약에 의해 설명되지 않으며 재투여시 비슷한 증상이발생하는 경우 확실함(certain)으로 평가할 수 있다. 위의 조 건을 만족하나 재투여로 확인할 수 없는 경우는 가능성 높음 (probable), 시간적 연관성은 있으나 다른 질환이나 다른 약 물로도 증상이 설명되는 경우에는 가능성 있음(possible)으로 평가한다(Table 3) [6].
우리나라 부작용 보고시스템
약이 허가를 받기 전에 시행하는 임상시험에서는 드물지 만 중요한 부작용을 밝히지 못할 수 있으며 어떤 부작용의 경우는 발생하기까지 오랜 시간이 걸리는 경우도 있어서 허 가를 받기 전에 드러나지 않을 수 있다. 그래서 시판 후 임 상시험, 자발적 부작용신고, 부작용 증례 보고 등이 중요하 다. 국내에서는 1988년 자발적 부작용 보고제도를 시작하였 고 2006년 당시 식품의악품안전청에서 지역약물감시센터를 지정하여 자발적 신고제도를 활성화하였으며 2012년 10월 부터는 한국의약품안전관리원(안전원)에서 의약품 이상사례 자료를 수집하고 있다[21]. 의약품 이상사례는 안전원의 의약품 이상사례보고시스템(Korea Adverse Event Reporting System)에서 접수, 관리되며 필수정보 네 가지(의심되는 증 상, 복용한 의약품정보, 환자정보, 보고 자 정보)가 충족되어야 접수 가능하다. 현재 국내에서는 지역별로 병원 등을 ‘지역의약품안전센터’로 지정하여 이 곳 에서 수집한 이상사례를 안전원에서 관 리하는 분권화된 약물감시 시스템을 운 영하고 있다. 총 27개 지역센터 중 지역 별로 분포된 대학병원이 25개 권역센터 역할을 수행하고, 보건소와 공공병원을 관할하는 국립중앙의료원과 약국을 관 할하는 대한약사회가 전국 대상 센터의 역할을 수행한다. 이 곳에서 수집하는 ‘자발적부작용신고’ 자료가 국내 약물감 시체계의 핵심이 된다. 안전원은 전국의 다양한 보고원에서 신고한 자료를 WHO Programme for International Drug Monitoring으로 전송, 분석하여 실마리 정보를 탐색하는 등 의 역할을 수행한다.의약품 부작용 피해구제 제도
의약품 부작용 피해구제 제도는 정상적으로 의약품을 처 방, 조제, 복용했음에도 불구하고 부작용으로 피해를 입 은 소비자에게 보상금을 지급하는 것으로 의약품에 본질 적으로 내재하는 부작용의 위험을 사회적으로 인정하고, 드물지만 누구에게나 발생할지 모르는 심각한 피해에 대 하여 피해자, 제조자, 의료공급자 모두를 보호하는 제도 라고 할 수 있다. 일본은 1980년부터, 대만은 1999년부터 우리나라와 비슷한 의약품 부작용 피해구제 제도를 시행 하고 있다[22]. 국내에서는 의약품 부작용 피해구제 제도 가 1991년 약사법에 최초로 명시되었고, 2014년부터 시 행되고 있다. 현재 의약품 부작용 피해구제 제도의 주관기Table 3. World Health Organization-Uppsala Monitoring Center causality categories
Causality term Assessment criteria
Certain Event or laboratory test abnormality, with plausible time relationship to drug intake Cannot be explained by disease or other drugs
Response to withdrawal plausible (pharmacologically, pathologically) Event definitive pharmacologically or phenomenologically Rechallenge satisfactory, if necessary
Probable/likely Event or laboratory test abnormality, with reasonable time relationship to drug intake Unlikely to be attributed to disease or other drugs
Response to withdrawal clinically reasonable Rechallenge not required
Possible Event or laboratory test abnormality, with reasonable time relationship to drug intake Could also be explained by disease or other drugs
Information on drug withdrawal may be lacking or unclear
Unlikely Event or laboratory test abnormality, with a time to drug intake that makes a relationship improbable (but not impossible)
Disease or other drugs provide plausible explanations Conditional/
unclassified Event or laboratory test abnormalityMore data for proper assessment needed, or additional data under examination Unassessable/
unclassifiable Report suggesting an adverse reactionCannot be judged because information is insufficient or contradictory Data cannot be supplemented or verified
관은 식품의약품안전처로 운영기관인 안전원에 관련 사업 을 위탁하여 운영하고 있다. 제도 시행일자(2014년 12월 19일) 이후 정상적으로 사용된 의약품으로 인한 약물이상 반응으로 피해가 발생한 경우에 한해 피해구제 신청이 가 능하다. 이 제도는 단계적으로 보상범위가 확대 시행되어, 2015년 사망일시보상금, 2016년 장애일시보상금 및 장례 비, 2017년 진료비까지 확대되었다[23]. 신청방법, 보상범 위, 처리절차 등 의약품 부작용 피해구제 제도에 대한 자세 한 사항은 한국의약품안전관리원 의약품부작용피해구제 사 이트(https://karp.drugsafe.or.kr/)에서 확인 가능하다.
결론
약물이상반응은 중요한 건강문제이며 처방의사 등 의료 인, 제조사, 환자 모두에게 부담이 된다. 약물에 대한 치료 효과와 이상반응에는 개인차가 존재하며 완전히 예측하기 가 힘들어서 대처가 힘든 면이 있다. 개개인의 측면에서는 약물 유전체학의 발달로 약물이상반응을 예측하기 위한 노 력이 활발하게 진행되고 있다. 이러한 노력을 통해 약물이 상반응이 발생하기 이전에 위험성이 높은 사람을 선별하여 사전에 적극적으로 대처할 수 있다면 약물이상반응의 발생 을 예방할 수 있을 것으로 기대된다. 국내에서도 드물지만 심각한 이상반응을 확인하기 위해 약물감시체계를 발전시 켜왔으며 수동적 약물 감시체계의 한계를 극복하기 위해 빅 데이터를 이용한 능동적 약물감시체계의 개발을 연구하고 있다. 일단 약물이상반응이 발생한 경우 먼저 의심하고 인 과성 평가를 통해 원인 약물을 확인해서 빠르게 대처할 수 있다면 약물이상반응으로 인한 피해를 줄일 수 있을 것으로 생각된다. 이러한 노력에도 불구하고 의약품 부작용으로 인 한 피해사례가 발생한다면 의약품 부작용 피해구제 제도를 이용해 볼 수 있다. 찾아보기말: 약물이상반응; 약물감시; 약물이상반응 보고체계; 약물유전체; 빅데이터 ORCIDMin-Kyung Cho, https://orcid.org/0000-0001-9453-3366 Dong Yun Kang, https://orcid.org/0000-0003-4283-2633 Hye-Ryun Kang, https://orcid.org/0000-0002-2317-4201
Conflict of Interest
No potential conflict of interest relevant to this article was reported.
References
1. Kim SJ, Chung SY, Park BJ. Pharmacovigilance organization and activity of WHO-UMC. J Pharmacoepidemiol Risk Manag 2014;7:1-6.
2. International drug monitoring: the role of national centres: report of a WHO meeting. World Health Organ Tech Rep Ser 1972;498:1-25.
3. World Health Organization. The importance of pharmacovi-gilance: safety monitoring of medicinal products [Internet]. Geneva: World Health Organization; 2002 [cited 2019 Jen 18]. Available from: https://apps.who.int/medicinedocs/en/d/Js4893e/. 4. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug
reactions. Curr Opin Allergy Clin Immunol 2005;5:309-316. 5. Yang MS, Ban GY, Kim MH, Lim KH, Kwon HS, Song WJ,
Jung JW, Lee JM, Suh DI, Kwon JW, Kim SH, Shin YS, Kang HR, Kim TB, Lee BJ, Lee AY, Park HS, Cho SH. KAAACI Standardization Committee Report on the procedures and applications of the diagnostic tests for drug allergy. Allergy Asthma Respir Dis 2017;5:239-247.
6. Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis, and management. Lancet 2000;356:1255-1259. 7. Hartigan-Go KY, Wong JQ. Inclusion of therapeutic failures
as adverse drug reactions. Side Eff Drugs Annu 2000;23:xxvii-xxxiii.
8. Weiss ME, Adkinson NF. Immediate hypersensitivity reac-tions to penicillin and related antibiotics. Clin Allergy 1988; 18:515-540.
9. McNeil BD, Pundir P, Meeker S, Han L, Undem BJ, Kulka M, Dong X. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature 2015;519:237-241. 10. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac
AM, Greenberger PA, Khan DA, Lang DM, Park HS, Pichler W, Sanchez-Borges M, Shiohara T, Thong BY. International consensus on drug allergy. Allergy 2014;69:420-437.
11. Yang MS, Jung JW, Kang HR. Severe cutaneous adverse reac-tion. Korean J Med 2014;87:665-674.
12. Jang IJ. Introduction to clinical pharmacogenetics. Korean J Clin Pharmacol Ther 2007;15:5-19.
13. Wilkinson GR. Drug metabolism and variability among pati-ents in drug response. N Engl J Med 2005;352:2211-2221.
14. Koren G, Cairns J, Chitayat D, Gaedigk A, Leeder SJ. Phar-macogenetics of morphine poisoning in a breastfed neonate of a codeine-prescribed mother. Lancet 2006;368:704.
15. Jung JW, Kim JY, Park IW, Choi BW, Kang HR. Genetic mar-kers of severe cutaneous adverse reactions. Korean J Intern Med 2018;33:867-875.
16. Park WB, Choe PG, Song KH, Lee S, Jang HC, Jeon JH, Park SW, Park MH, Oh MD, Choe KW. Should HLA-B*5701 screening be performed in every ethnic group before starting abacavir? Clin Infect Dis 2009;48:365-367.
17. Jung JW, Song WJ, Kim YS, Joo KW, Lee KW, Kim SH, Park HY, Chang YS, Sho SH, Min KU, Kang HR. HLA-B58 can help the clinical decision on starting allopurinol in patients with chronic renal insufficiency. Nephrol Dial Transplant 2011;26:3567-3572.
18. Jung JW, Kim DK, Park HW, Oh KH, Joo KW, Kim YS, Ahn C, Lee KW, Cho SH, Min KU, Kang HR. An effective strategy to prevent allopurinol-induced hypersensitivity by HLA typing. Genet Med 2015;17:807-814.
19. Kim SH, Kim M, Lee KW, Kim SH, Kang HR, Park HW, Jee YK. HLA-B*5901 is strongly associated with methazolamide-induced Stevens-Johnson syndrome/toxic epidermal necroly-sis. Pharmacogenomics 2010;11:879-884.
20. Kim S, Yun J, Kang DY, Park HJ, Jo EJ, Jung JW, Park HK, Park JW, Jee YK, Kang HR, Lee JM. Carbonic anhydrase inhibitor-induced Stevens-Johnson syndrome/toxic epidermal necrolysis leads to extensive cutaneous involvement. J Allergy Clin Immunol Pract 2019 May 22 [Epub]. https://doi.org/10.1016/j.jaip.2019.05.010.
21. Choi NK, Park BJ. Adverse drug reaction surveillance system in Korea. J Prev Med Public Health 2007;40:278-284.
22. Yang MS. Relief system for adverse drug reactions in Korea. Korean J Med 2018;93:5-13.
23. Kim SJ, Kim JY, Song EH, Cho MJ, Lee KJ, Jung SY, Han SY. Introduction of current status of the adverse drug reaction relief system in Korea, Japan and Taiwan. J Pharmacoepidemiol Risk Manag 2019;11:1-8.
Peer Reviewers’ Commentary
의약품의 사용이 증가함에 따라, 약물 이상 반응도 증가하고 있 으며, 이는 약물 투여 과정 중 발생하는 불가피한 반응이다. 약 물 이상 반응 여부의 진단 및 치료를 위해서는 우선 임상 양상 과 약물 사이의 연관성을 의심하는 것이 중요하다. 이 논문에서 는 약물 이상 반응의 정의, 분류 및 진단에 대한 최신 지식을 정 리하여 설명해 주고 있다. 또한, 약물 이상 반응을 예방하기 위 한 최신 약물 유전체학 연구 결과들과 국내 약물 이상 반응 보고 시스템에 대해서도 잘 소개해 주고 있다. 약물 이상 반응은 환 자 개인뿐 아니라 의약품을 처방한 의사에게도 상당한 부담이 되는 문제이다. 이 논문에서 소개해 주고 있는 의약품 피해구제 제도 또한 임상 현장에 실질적인 큰 도움이 될 것으로 판단된다. [정리: 편집위원회]