이학 석사학위 논문
AMP-act
i
vat
edki
nase
pr
ot
ei
n-mTOR 신호전달 과정이 B형
간염 증식에 미치는 영향
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
AMP-act
i
vat
edki
nase
pr
ot
ei
n-mTOR 신호전달 과정이 B형
간염 증식에 미치는 영향
지도교수
김 경 민
이 논문을 이학 석사학위 논문으로 제출함.
2015년
2월
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
김 주 미
김주미의 이학 석사학위 논문을 인준함.
심사위원장
김
경
민
인
심 사 위 원
박
선
인
심 사 위 원
신
호
준
인
아 주 대 학 교
대 학 원
2014년 12월 19일
- 국문요약 -
AMP-activated protein kinase-mTOR 신호전달 과정이 B 형간염
바이러스
증식에 미치는 영향
`
B 형간염 바이러스(hepatitis B virus, HBV)는 Hepadnaviridae family 에 속하며, genome 크기가 약 3.2kb 의 작은 DNA 바이러스이다. 전 세계적으로 약 3 억 5 천만 명 이상이 만성으로 HBV 에 감염되어 있다. HBV 는 급성과 만성 B 형 간염을 일으키며 만성 B 형 간염 환자는 간경변이나 간암으로 발전할 가능성이 높다. AMP-activated protein kinase(AMPK)는 ATP 소비와 생성의 균형을 위해서 필요한 에너지 센서 단백질이다. Hepatitis C virus(HCV)의 증식을 위해서는 AMPK 의 억제와 mammalian target of rapamycin(mTOR)의 활성이 필요하며 이를 통해 바이러스 복제에 필요한 지질을 합성한다. HBV X 단백질(HBx)은 mTOR 의 활성을 증가시켜 hepatocellular carcinoma(HCC) 세포의 증식을 유도한다. 본 연구에서는 HBV 가 증식할 때 AMPK 와 mTOR 의 활성에 변화가 있는지 알아보았고, AMPK-mTOR 신호전달 과정의 변화가 HBV 증식에 영향을 미치는지 알아보고자 하였다. HCC 세포인 HepG2 세포에서 유래한 HBV 가 증식하는 HepG2.2.15 세포, PEB 세포와 Huh7 세포에서 유래한 HBV 가 증식하는 Huh7 HBV WT stable 세포에서 AMPK 의 발현과 인산화를 조사한 결과 세 가지 세포에서 AMPK 의 인산화가 감소한 것을 밝혀냈다. HepG2.2.15 세포, PEB 세포와 Huh7 HBV WT stable 세포에서 mTOR 발현과 인산화가 증가하였다. HepG2.2.15
세포에서 AMPK 의 인산화가 감소하였음에도 불구하고 regulatory-associated protein of mTOR(Raptor)와 tuberous sclerosis 2(TSC2)의 인산화는 증가하였다. HepG2.2.15 세포에서 Akt 발현과 인산화가 증가하였다. Protein phosphatase 2A(PP2A), S6 kinase 1(S6K1)와 eukaryotic translation initiation factor 4E-binding protein 1(4E-BP1)의 발현과 인산화는 HepG2.2.15 세포에서 증가하였다. Huh7 HBV WT stable 세포에서는 S6K1 의 인산화, PP2A 의 발현과 인산화가 증가하였다. AMPK alpha 2 가 과발현 될 때 HBV 의 core particle 과 그 속의 핵산, HBV 의 DNA 가 감소하였다. HepG2.2.15 세포에 metformin 을 처리하였을 때 AMPK 의 인산화는 증가하였고 이에 따라 Akt, mTOR, PP2A, S6K1 와 4E-BP1 의 인산화도 줄어들었다. 그렇기 때문에 mTOR, Akt, PP2A, S6K1 과 4E-BP1 는 AMPK 의 downstream 으로 추정되었다. Rapamycin 에 의해 HepG2.2.15 세포에서 mTOR 의 인산화가 억제되었고 S6K1 의 인산화 또한 감소되었다. 그리고 Akt 의 인산화는 감소하였고 AMPK 의 인산화는 증가하였다. 앞으로 Akt, mTOR, S6K1 과 PP2A 의 억제제를 처리함으로써 AMPK 의 upstream 과 mTOR 의 downstream 을 밝혀낼 것이다.
핵심어: B형간염 바이러스, AMPK-mTOR 신호 전달과정, Akt, PP2A, S6K1, 4E-BP1
차
례
국문요약 ··· ⅰ 차례 ··· ⅲ 그림차례 ··· ⅴ Ⅰ. 서론 ··· 1 A. B 형간염 바이러스 ··· 1 B. B 형간염 바이러스 증식 ··· 2 C. AMPK 신호전달 과정 ··· 3 D. 연구목적 ··· 5 Ⅱ. 재료 및 방법 ··· 7 A. 세포 배양··· 7 B. HBV 가 증식하는 stable 세포 구축 ··· 7C. Sodium dodecyl sulfate-polyacrylamide gel(SDS-PAGE) electrophoresis ··· 8
D. Western blotting ··· 9
E. Reverse transcription polymerase chain reaction(RT-PCR) ··· 10
F. HBV core particle 분석 ··· 12
G. HBV DNA 확인을 위한 Southern blotting ··· 13
H. 억제제 혹은 활성제 처리에 의한 HBV 증식 변화 ··· 14
Ⅲ. 결과 ··· 16 A. HBV 증식 세포에서의 AMPK 와 mTOR 발현 및 인산화 변화 ··· 16 B. HBV 증식 세포에서의 Raptor 와 TSC2 발현 및 인산화 변화 ··· 18 C. HBV 증식 세포에서 Akt 의 발현 및 인산화 변화 ··· 20 D. HBV 증식 세포에서 PP2A, S6K1 과 4E-BP1 발현 및 인산화 변화 ··· 22 E. AMPK 과발현에 의한 AMPK 의 변화가 HBV 증식에 미치는 영향 ··· 24 F. Metformin 에 의한 AMPK-mTOR 신호전달 과정의 변화 ··· 26 G. Rapamycin 에 의한 AMPK-mTOR 신호전달 과정의 변화 ··· 28 Ⅳ. 고찰 ··· 30 Ⅴ. 결론 ··· 32 참고문헌 ··· 34 ABSTRACT ··· 44
그림
차례
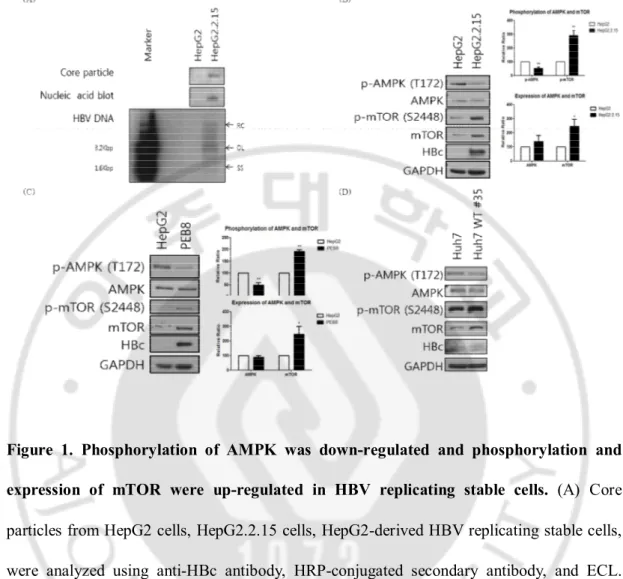
Fig. 1. Phosphorylation of AMPK was down-regulated and phosphorylation and expression of mTOR were up-regulated in HBV replicating stable cells
··· 17 Fig. 2. Phosphorylations of Raptor and TSC2 were up-regulated in HBV replicating
stable cells ··· 19 Fig. 3. Akt activation was up-regulated in HepG2-derived in HBV replicating stable cells ··· 21 Fig. 4. Phosphorylations and expressions of PP2A, S6K1 and 4E-BP1 were up-regulated in HBV replicating stable cells ··· 23 Fig. 5. Effects of AMPK overexpression on AMPK-mTOR signaling and HBV replication.
ㄴㄴ s ··· 25
Fig. 6. Effect of metformin, an AMPK activator, on AMPK-mTOR signaling pathway
ㅇㅇㅇ ··· 27 Fig. 7. Effect of rapamycin, a mTOR inhibitor, on AMPK-mTOR signaling pathway
I. 서 론
A. B 형간염 바이러스
B 형간염 바이러스(hepatitis B virus, HBV)는 Hepadnaviridae family 의 prototype 바이러스이며, genome 크기가 약 3.2kb 의 작은 DNA 바이러스이다(Liang, 2009; Cougot 등 2012). 전 세계적으로 20 억 명이 HBV 에 감염되어 있으며, 이 중 약 3 억 5 천만 명 이상이 만성 HBV 감염자이다(Lee, 1997; Cougot, Allemand 등, 2012). HBV 는 급성과 만성 B 형간염을 일으키는데, 급성 HBV 감염 환자 중에서 2/3 는 증상이 가볍거나 거의 없다. 그리고 나머지 1/3 은 피로, 메스꺼움, 황달 증상과 드물게는 급성 간 손상이 일어난다(Liang, 2009; McMahon 등 1985). 그러나 만성 B 형 간염 환자는 간경변이나 간암으로 발전할 가능성이 높다(Guo 등 2007). 동남아시아, 중국, 그리고 아프리카와 같은 나라에서는 절반 정도의 인구가 HBV 에 감염 되어있고 약 8%는 만성 B 형 간염 환자이다. 이러한 나라에서는 모체로부터 신생아에게 전달되는 수직 감염과 다른 사람으로부터 전달되는 수평 감염에 의해서 HBV 에 감염된다. 북아메리카, 동유럽, 그리고 호주에서도 소수의 사람들이 감염되어 있다. 이러한 국가에서는 성적 접촉, 오염된 주사기의 사용, 직업적인 노출, 수술이나 혈액투석에 의해서 HBV 에 감염된다(Lee, 1997; Kane, 1995).
B. B 형간염 바이러스 증식
3.2kb 의 HBV genome 에는 4 개의 open reading frame(ORF)이 겹쳐져 있으며, HBV 는 각각의 ORF 에 의해서 암호화 된 4 개의 단백질인 polymerase, core, surface(S, HBs)와 X(HBx)가 있다. Surface ORF 는 pre-S1, pre-S2, S 부위가 있으며 이 세가지 부위가 번역되면 large surface(LHBs)가, pre-S2 와 S 부위가 번역되면 middle surface(MHBs)가, S 부위만 번역되면 small surface(SHBs)가 합성된다. Precore/Core(PreC/C) ORF 는 precore 와 core 단백질을 암호화하고 있다. Polymerase(P, pol) ORF 는 polymerase 단백질을 암호화하고 있으며, 네 가지 도메인(terminal 단백질, spacer, 역전사효소[reverse transcriptase]와 ribonuclease H)으로 구성되어 있다(Liang, 2009). 감염성 있는 HBV virion 인 Dane particle 은 급성과 만성 B 형 환자의 혈액 속에서 발견되는데(Summers 등, 1975), Dane particle 의 LHBs 의 pre-S1 부위가 간 세포의 multiple transmembrane transporter 인 sodium taurocholate cotransporting polypeptide(NTCP)와 붙어서 간세포에 감염된다(Yan 등, 2012). 감염된 후에 relaxed circular DNA(rcDNA)가 핵 안으로 들어가 episomal covalently closed circular DNA(cccDNA)로 repair 된다. 이 cccDNA 는 바이러스의 RNA 전사를 위한 template 로 사용되어 pregenomic RNA(pgRNA)와 subgenomic RNA 들을 전사한다. pgRNA 는 core 단백질과 polymerase 를 합성하기 위한 mRNA 역할을 한다. Core 단백질은 core particle 을 형성하여 pgRNA 와 polymerase 를 같이 packaging 한다. 이러한 과정을 encapsidation 이라 부른다. Polymerase 의 역전사효소 활성에 의해 pgRNA 로부터
(-) strand DNA 가 합성되고 HBV 의 polymerase 의 RNase H 활성에 의해 새로 합성된 (-) strand DNA 와 결합된 RNA 를 분해한다. (-) strand DNA 를 template 로 하여 (+) strand DNA 가 합성되어 결론적으로 성숙한 형태의 rcDNA 가 합성된다. rcDNA 가 있는 성숙한 core particle 은 cccDNA 를 증폭하기 위해 다시 핵 속으로
들어가거나 소포체와 골지체를 통해 외피를 획득하여 세포 밖으로
방출된다(Cougot 등, 2012; Beck 과 Nassal, 2007; Seeger 와 Mason, 2000).
C. AMPK 신호전달 과정
AMP-activated protein kinase(AMPK)는 ATP 소비·생성 균형을 위해 필요한 에너지 센서 단백질이다. 이 AMPK 는 catalytic α subunit, regulatory β, subunit 이 heterotrimer 를 이루고 있다. AMPK 는 저산소증, 영양분 결핍과 같은 대사 생물학적 스트레스를 받아 AMP 와 ADP 의 양이 ATP 보다 높아졌을 때 활성화된다(Lee, Wong 등, 2012). 이 AMP 와 ADP 는 AMPK 의 regulatory subunit 과 붙어 AMPK 의 구조적인 변화를 유도하여 인산화를 촉진시키며
인산화된 AMPK 를 phosphatase 로부터 보호하여 활성을 유지하도록
한다(Mihaylova 와 Shaw, 2011). 그리고 포유류에서는 catalytic α subunit 을 암호화하는 α1, α2 유전자, regulatory β subunit 을 암호화하는 β1, β2 유전자, 그리고 subunit 을 암호화하는 1, 2, 3 유전자가 존재한다(Hardie, 2007). AMPK α1 subunit 은 세포질에 많이 존재하고 AMPK α2 는 핵과 세포질에 존재하는데 핵에 주로 존재한다(Ju 등, 2011). AMPK 의 upstream 에는 여러 가지 단백질이
있다. 그 중에 하나인 liver kinase B1(LKB1)은 최근에 암 억제 단백질로 밝혀졌다. LKB1 은 AMPK 를 인산화 시켜 활성화시킨다(Hawley, Boudeau 등, 2003; Shaw, Kosmatka 등, 2004). 암 억제 단백질인 LKB1 이 AMPK 를 활성화시키기 때문에 최근 AMPK 가 암 발생과 연관되어 연구되고 있다(Shackelford 와 Shaw, 2009). 그리고 또 다른 단백질인 calcium/calmodulin-dependent protein kinase kinase 2(CAMKK2)도 AMPK 를 인산화시킬 수 있다(Hawley 등, 2005; Hurley 등, 2005; Woods 등, 2005; Fogarty 등, 2010). Transforming growth factor beta-activated kinase 1 (TAK1)에 의해서도 AMPK 가 인산화될 수 있다. 하지만 AMPK 를 인산화 시키는 자세한 작용기전은 아직까지 밝혀지지 않았다. 그리고 palmitate 에 의해서 활성화된 protein phosphatase 2A(PP2A)는 AMPK 활성화를 억제한다(Wu 등, 2007). 대표적인 AMPK 의 downstream 은 mTOR 이다. AMPK 가 tuberous sclerosis 2(TSC2)의 Ser1387 부위를 인산화 시켜 mTORC1 을 억제한다. 또한 인산화된 AMPK 는 mTORC1 의 regulatory subunit 인 regulatory-associated protein of
mTOR(Raptor)를 인산화시켜서 mTORC1 의 인산화를 막아 mTORC1 을
억제한다(Mihaylova 와 Shaw, 2011). mTOR 는 세포 성장에 관여하는 eukaryotic translation initiation factor 4E-binding protein 1(4E-BP1)과 p70-S6 kinase 1(S6K1)을 조절한다. mTORC1 이 인산화되어 활성화되면 4E-BP1 와 S6K1 을 인산화시키며 인산화된 4EB-P1 은 번역 개시 인자인 eukaryotic translation initiation factor 4E(eIF-4E)를 붙잡지 못해 eIF-4E 는 다른 개시 인자와 결합하여 번역을 진행한다. 인산화 된 S6K1 은 세포성장과 자가 소화 작용에 관여한다. 그리고 AMPK 는 UNC-51-like kinase(ULK1)을 직접적으로 인산화시키거나(Egan 등, 2011; Kim 등, 2011), mTOR 를 억제함으로 ULK1 을 활성화시켜 자가 소화 작용을 유도한다.
AMPK 는 acetyl-CoA carboxylase(ACC1, ACC2)와 HMG-CoA
reductase(3-hydroxy-3-methyl-glutaryl-CoA reductase)를 억제하여 지방산과 스테롤 합성을
조절한다(Carling 등, 1987; Sato 등, 1993). 그리고 지방에서 AMPK 는 지방 분해 효소인 hormone-sensitive lipase(HSL) 76 과 adipocyte-triglyceride lipase(ATGL) 77 을 인산화 시킨다(Watt 등, 2006). AMPK 는 아세틸 전달 효소인 p300, 히스톤 아세틸라아제, 그리고 히스톤을 인산화 시켜 전사를 조절한다(Mihaylova 와 Shaw, 2011). AMPK 는 지질 합성에 관여하는 전사 인자인 sterol regulatory element-binding transcription factor 1(SREBP1)을 인산화 시킴으로써 SREBP1 이 downstream 인 ACC1 과 fatty acid synthase(FASN)을 자극하여 지방산 합성을 촉진한다(Li 등, 2011). 즉, AMPK 는 세포 성장과 자가 소화 작용을 조절하며, 물질대사에 관여하는 효소와 전사 인자를 통해 물질대사를 조절한다. AMPK 는 번역 개시에 필요한 eIF-4F 복합체의 형성에 중요한 단백질인 mTOR 의 활성을 억제함으로써 단백질 합성을 억제한다. 게다가 mTOR 와 AMPK 의 서로 다른 조절방식은 세포 내의 물질대사, 자가 소화 작용을 조절한다. AMPK 가 활성화되면 세포의 고분자 복합체의 자가 소화 작용을 촉진하여 에너지와 영양을 생성하고, 반대로 mTOR 가 활성화되면 autophagy 를 억제하여 세포 성장과 증식을 촉진시킨다.
D. 연구목적
지속적인 HBV 감염으로 만성 B 형 간염과 간암이 유발될 수 있다. 간암세포는 AMPK 활성이 억제되어 간암세포 증식과 성장을 촉진한다(Yang 등,2014; Cheng 등 2014). HBV 처럼 만성 간염 및 간암을 유발하는 hepatitis C virus(HCV)에 감염되면 AMPK 활성이 감소됨으로써 지방 축적을 유도하여 HCV 의 증식이 촉진된다(Mankouri 등, 2010). 그리고 protein kinase B(Akt) 신호전달 과정을 활성화시키고 TSC1/2 의 발현을 억제하여 mTOR 활성을 증가시킨다. HCV 는 AMPK 와 mTOR 신호전달 과정을 통해 바이러스의 복제를 위해 필수적인 지질을 합성한다. 한편, human cytomegalovirus(HCMV), simian virus 40(SV40)에 감염되면 AMPK 와 mTOR 의 활성이 증가한다. Arboviruses 인 Rift Valley fever virus(RVFV)에 감염되면 AMPK 의 활성이 억제된다(Brunton 등, 2013). 그리고 최근에 HBV 의 X 단백질이 mTOR 신호전달 과정을 활성화 증가시켜 간암세포 증식을 증가시킨다고 밝혀졌다(Yen 등, 2012). 간암세포와 HCV 가 증식하는 세포에서 AMPK 의 인산화가 감소하였기 때문에 HBV 가 증식할 때 AMPK 와 mTOR 의 활성에 변화가 있는지 분석하였고, 반대로 AMPK-mTOR 신호전달 과정의 변화가 HBV 의 증식에 변화를 주는지도 알아보았다.
II. 재료 및 방법
A. 세포 배양
HepG2 세포에서 유래한 HepG2.2.15 세포는 HBV genome 이 안정적으로 복제된다. HepG2.2.15 세포는 10% (v/v) fetal bovine serum(FBS, Gibco, Invitrogen), 100 units/ml penicillin 과 100 μg/ml streptomycin(Gibco, Invitrogen), 1 mg/ml G418(Duchefa biochemie)이 들어간 DMEM 배지를 사용하여 배양하였다. HepG2 세포는
앞의 HepG2.2.15 세포배양배지에서 1 mg/ml G418 이 없는 동일한 배지에서
배양하였다. 그리고 세포들은 5% CO₂의 37°C 인큐베이터에서 키웠다. 실험할
때 HepG2 세포, HepG2.2.15 세포와 PEB8 세포를 2 × 10⁶
cell / 6 cm dish 로 배양한
48 시간 뒤에 수확하였다. Huh7 세포와 Huh7 HBV WT stable 세포는 1 × 10⁶ cell / 6 cm dish 로 배양한 48 시간 후에 수확하였다.B. HBV 가 증식하는 stable 세포 구축
HBV adw R9 1.1 length 를 가지고 있어 증식이 가능한 HBV genome 을 진핵세포 발현 벡터인 pcDNA3 에 넣어 CMV 프로모터 하에서 HBV 가 발현할 수 있도록 제작한 HBV WT #12 플라스미드 DNA 를 Huh7 세포에 감염시킨다. 감염시킨 1 일 후에 새 배지로 바꾸고, 배지를 바꾼 2 일 후에 HBV WT #12 플라스미드 DNA 를 가지고 있는 세포만 자라도록, 앞에서의 1 mg/ml G418 이
포함된 배지에서 배양하였다. 그 뒤 2 일에 한 번씩 1 mg/ml G418 이 포함된 새 배지로 갈아주었다. 이런 방법을 통해 HBV 를 안정적으로 발현하는 세포를 구축하였다. 또한 HBV WT #12 DNA 로부터 제작한 돌연변이인 TP Y65F, X-deficient-3 변이주 또한 같은 방법으로 실험을 진행하였다. 그리고 X 단백질 발현 유전자를 진핵세포 발현 벡터인 p3×Flag-CMV-10(Sigma-Aldrich)에 클로닝하여 CMV 프로모터 하에서 X 단백질만 발현할 수 있도록 제작하여 실험을 진행하였다. 마찬가지로 HepG2 세포에서도 Huh7 세포에서와 동일한 방법으로 HBV 가 안정적으로 발현되는 stable 세포를 구축하였다.
C. Sodium dodecyl sulfate-polyacrylamide gel(SDS-PAGE)
electrophoresis
HepG2 세포와 HepG2.2.15 세포를 2 × 10⁶ cell / 6 cm dish 배양한 48 시간 후에 4 ml 의 phosphate buffered saline(PBS)로 1 회 씻어낸 후 1 ml 의 PBS 를 넣고 스크래퍼를 이용하여 수확하였다. 그리고 원심 분리하여 PBS 를 제거한 후 protease inhibitor cocktail(calbiochem, USA)이 들어간 lysis 용액(50 mM Tris-Cl pH 8.5, 2 mM EDTA, 0.5% Noniodet P-40, 50 mM NaF, 25 mM glycerol phosphate, 2 mM sodium orthovanadate) 200 μl 을 넣어 만든 현탁액을 얼음에서 10 분간 두었다. 그 후 4°C 에서 13,000 rpm 으로 2 분간 원심 분리하여 핵과 세포 소기관을 제거하여 lysate 를 얻었다. 각각의 lysate 에 sample 완충용액(250 mM Tris-Cl pH 6.8, 8% SDS, 0.1% bromophenol blue, 40% glycerol, 100 mM dithiothreitol)을 넣고 100°C 에서 5 분간 끓였다. 8%, 10%, 또는 12%의 polyacrylamide gel 로 sodium dodecyl
sulfate(SDS)-PAGE 를 수행하였다. 그 후에 전기영동된 단백질을 2 시간 동안 250 mA 로 처리하여 PVDF membrane 에 이동시켰다.
D. Western blotting
C 에서 얻은 membrane 을 bovine serum albumin(BSA)를 Tris buffered saline– 0.1% tween-20(0.1% TBS-T, pH 7.4)에 4%로 녹인 용액에 넣고 1 시간 동안 상온에서 블로킹하였다. 일차 항체(polyclonal rabbit anti p-AMPK antibody[cell signaling], monoclonal rabbit anti Akt antibody[cell signaling], polyclonal rabbit anti p-mTOR antibody[cell signaling], monoclonal rabbit anti p-PP2A antibody[cell signaling], polyclonal rabbit anti p-S6K1 antibody[cell signaling]와 polyclonal rabbit anti p-4E-BP1 antibody[cell signaling])를 0.1% TBS-T 에 1:1,000 으로 희석하여 4°C 에서 밤새 반응시켰고, membrane 을 0.1% TBS-T 로 10 분씩 3 회 씻어주었다. 그리고 horse radish peroxidase(HRP)가 결합된 이차 항체(HRP-polyclonal rabbit anti immunoglobulins, DAKO)를 0.1% TBS-T 에 1:2,000 으로 희석하여 상온에서 1 시간 동안 반응시킨 후 membrane 을 0.1% TBS-T 으로 10 분씩 3 회 씻어주었다. Membrane 에 enhanced chemical luminescence(ECL, GE healthcare, Amersham™)을 사용하여 X-ray film 에 감광하였다. Phospho-protein 을 본 membrane 을 stripping 용액(100 mM β-mercaptoethanol, 2% SDS, 62.5 mM Tris-Cl pH 6.8)에 넣고 68℃에서 30 분 처리하여 붙어있던 항체를 제거하였다. 4% BSA-0.1% TBS-T 로 상온에서 1 시간 동안 블로킹하였다. 일차 항체(polyclonal rabbit anti AMPK antibody [cell signaling], polyclonal rabbit anti Akt antibody [cell signaling], polyclonal rabbit anti mTOR
antibody [cell signaling], monoclonal rabbit anti PP2A antibody [abcam], polyclonal rabbit anti S6K1 antibody [cell signaling]와 polyclonal rabbit anti 4E-BP1 antibody [cell signaling])를 0.1% TBS-T 에 1:1,000 으로 희석하여 4°C 에서 밤새 반응시켜 위의 방식과 동일하게 실험을 수행하였다.
E. Reverse transcription polymerase chain reaction (RT-PCR)
HepG2 세포와 HepG2.2.15 세포를 2 × 10⁶ cell / 6 cm dish 로 배양한 48 시간 후에 세포전체 RNA 를 얻었다. 즉, 세포 배양 dish 에 1 ml 의 Trizol(Ambion, life technologies) 용액을 넣고 균질화시킨 후 1.5 ml 튜브에 옮겼다. 그 후 200 μl 의 chloroform 을 넣고 섞은 뒤 얼음에 5 분간 두었다. 그리고 4°C 에서 13,000 rpm 으로 15 분간 원심 분리하여 얻은 상층액을 1.5 ml 의 새 튜브에 옮긴다. 500 μl 의 isopropanol 을 넣은 후 상온에서 10 분간 반응시킨 후 4°C 에서 13,000 rpm 으로 10 분간 원심 분리하여 RNA 를 침전시킨 후 상층액을 제거하였다. 1 ml 의 70% ethanol 을 넣은 뒤 4°C 에서 13,000 rpm 으로 5 분간 원심 분리하여 침전시킨 RNA 를 씻어주었다. 그리고 nuclease free 증류수로 수용화하였다. 이렇게 얻은 RNA 는 ethidume bromide(EtBr)가 들어간 1% agarose gel 상에서 리보솜 RNA 를 확인한 후 spectrophotometer 로 세포 전체 RNA 의 농도를 확인하였다. 1 μg 의 RNA 와 500 ng 의 oligo dT(17 mer, 500 μg/ml), 2.5 mM dNTP (takara, Clontech)를 섞어 65°C 에서 변성시킨 후 얼음에 1 분간 두었다. Superscript III reverse transcriptase(Invitrogen, Life technologies)로 cDNA 를 합성하였다. 합성된 cDNA 를 이용하여 AMPK α1 sense primer(5’-CTCTATGCTTTATTATGTGG-3’) /
AMPK α1 antisense primer(5’-GATCCTGGTGATTTCTGTTG-3’), AMPK α2 sense TTGCAGTGGCTTATCATCTT-3’) / AMPK α2 antisense
primer(5’-TGTCATACGGTTTGCTCTGA-3’), AMPK β1 sense
primer(5’-ATGGGCAATACCAGCAGTGA-3’) / AMPK β1 antisense
primer(5’-TTGTATAACAAGGTGGTGAC-3’), AMPK β2 sense
primer(5’-CAGCCATGGGAAACACCAC-3’) / AMPK β2 antisense
primer(5’-GGTCCAGGATGGCAACAAAG-3’), AMPK 1 sense
primer(5’-GCTACAGATTGGCACCTATG-3’) / AMPK 1 antisense
primer(5’-TCAGGGCTTCTTCTCTCCAC-3’), AMPK 2 sense
primer(5’-GCCTTCTTTGCTTTGGTAGC-3’) / AMPK 2 antisense
primer(5’-GCTCATCCAGGTTCTGCTTC-3’), AMPK 3 sense
primer(5’-TGACCATCACTGACTTCATC-3’) / AMPK 3 antisense
primer(5’-CATCAAAGCGGGAATAGAGG-3’), S6K1 sense
primer(5’-TACTTCGGGTACTTGGTAA-3’) / S6K1 antisense
primer(5’-GATGAAGGGATGCTTTACT-3’)와 PP2A α sense
primer(5’-ATTACTTGTTTATGGGAGATTATGT-3’) / PP2A α antisense
primer(5’-AAGTGGTCACGGCTGTTGATG-3’)를 사용하여 원하는 유전자의 DNA 를
증폭시킨 다음 EtBr 이 포함된 1% agarose gel 에서 증폭된 DNA 밴드를 확인하였다.
F. HBV core particle 분석
HepG2 세포와 HepG2.2.15 세포를 2 × 10⁶ cell / 6 cm dish 배양한 48 시간 후에 4 ml 의 phosphate buffered saline(PBS)로 1 회 씻어준 후 1ml 의 PBS 를 넣고 스크래퍼로 수확하였다. 그리고 원심 분리하여 얻은 침전된 세포에 protease inhibitor cocktail(calbiochem, USA)이 들어간 lysis 용액(50 mM Tris-Cl pH 8.5, 2 mM EDTA, 0.5% Noniodet P-40, 50 mM NaF, 25 mM glycerol phosphate, 2 mM sodium orthovanadate) 200 μl 를 넣고 현탁액으로 만들어 얼음에 10 분간 두었다. 그 후 4°C 에서 13,000 rpm 으로 2 분간 원심 분리하여 핵과 세포 소기관을 제거하여 lysate 를 얻었다. Tris-acetate EDTA(TAE)완충액의 1% native agarose gel 에서 lysate 를 전기영동 하였다. PDVF membrane 을 methanol 에 적셔 정전기를 제거한 후 증류수로 씻은 후 10 × SSC buffer 에 담가두었다. Up-stream 방식을 이용하여 gel 에서 membrane 으로 단백질을 이동시켰다. 상온의 4% Skim milk-0.1% TBS-T 용액에서 1 시간 동안 membrane 을 처리하여 블로킹하였다. 일차 항체(anti hepatitis B virus core antibody from rabbit serum)를 4% skim milk-0.1% TBS-T 에 1:1,000 으로 희석하여 상온에서 2 시간 반응시켰고, 0.1% TBS-T 로 10 분씩 3 회 씻어주었다. 그리고 HRP 가 결합된 이차 항체(HRP-polyclonal rabbit anti immunoglobulins, DAKO)를 0.1% TBS-T 에 1:2,000 으로 희석하여 상온에서 1 시간 동안 반응시킨 후 membrane 을 0.1% TBS-T 로 10 분씩 3 회 씻어주었다. Membrane 에 ECL 을 뿌린 후 X-ray film 에 감광하였다.
G. HBV DNA 확인을 위한 Southern blotting
F 에서 분리한 core particle lysate 를 10 mM MgCl2와 8 mM CaCl2의 완충액에
micrococcal nuclease(45 U/ml; Worthington)를 처리하여 37°C 에서 1 시간 반응시켜 세포 내에 있는 플라스미드 DNA 와 RNA 를 제거하였다. Core particle lysate 에 core particle 등을 침전시키기 위한 polyethleneglycol(PEG) 용액(26% PEG, 1.4 M NaCl, 40 mM EDTA)을 넣어 얼음에서 1 시간 동안 반응시킨 후, 4°C 에서 15 분 동안 13,000 rpm 으로 원심 분리하여 pellet 을 얻었다. 얻은 pellet 을 200 μl 의 DNase I 반응 완충액(10 mM Tris-Cl pH 8.5, 6 mM MgCl2)에 재 부유하고, 200
μl 의 proteinase K 반응 완충액(20 mM Tris-Cl pH 8.5, 10mM EDTA, 1% SDS)을 넣은 뒤 proteinase K(10 μg/ml)를 넣어 37°C 에서 2 시간 이상 반응시켰다. 그 후 400 μl 의 phenol / chloroform / isoamylalcohol(25:24:1)을 넣고 5 분 동안 13,000 rpm 으로 원심 분리하였다. 상층액을 새로운 1.5 ml 튜브에 옮긴 후 ethanol 로 DNA 를 침전시킨다. 침전된 DNA 를 nuclease free 증류수에 녹인 후 DNA 를 1% agarose gel electrophoresis 하였다. Nylon membrane 은 증류수에 담근 후 20 × SSC 용액에 담가놓았다. Up-stream 방식으로 DNA 를 gel 에서 nylon membrane 으로 밤새 옮겼다. UV cross-linking 을 통해 DNA 가 membrane 에 더 잘 부착되게 한 후 hybridization 용액을 넣어 68°C 에서 블로킹하였다. Random primer labeling 방법으로 제작한 HBV 서열에 특이적인 α-32P [dATP]-labeled probe 를 사용하여
68°C 에서 밤새 HBV DNA 와 결합시켰다. 다음 날 2 × SSC buffer 로 씻어 낸 후 X-ray film 에 감광하였다.
H. 억제제 혹은 활성제 처리에 의한 HBV 증식 변화
HepG2 세포와 HepG2.2.15 세포를 배양한 48 시간 후에 각 세포에 AMPK 활성제인 metformin(Sigma-Aldrich)을 0.01, 0.05, 0.2 와 2 mM 로 또는 AMP analog 인 AICAR(Toronto Research Chemicals, TRC)를 0.1, 1, 2 와 5 mM 로 30 분 또는 1 시간 처리한 뒤 수확하였다. 또한 mTOR 의 억제제인 rapamycin(10 ng/ml, Calbiochem, Merck Millipore)을 10 nM 로 24 시간 혹은 72 시간 처리한 후 수확하였다. 그 후 C. 및 D. 방법으로 SDS-PAGE 하여 Western blotting 을 실시하였다. Akt 억제제인 Akti-1/2(5 μm, Calbiochem, Merck Millipore), PP2A 의 억제제인 okadaic acid(2 nM, abcam)을 처리하여 AMPK-mTOR 신호전달 과정의 순서를 파악하는 실험도 할 예정이다.
I. AMPK 과발현 벡터 제작
AMPK 과발현 벡터는 pcDNA3 에 AMPK α2(T172) 염기서열을 삽입하여 제작하였다. 우선 AMPK α1(D159, S172), AMPK α1(D159, T174) 그리고 AMPK
α2(T172)에 대한 염기서열을 증폭하기 위해서 E. 에서의 방법을
통해HepG2.2.15 세포에서 RNA 를 얻었다. 그 RNA 로 cDNA 를 합성한 후 PCR 로
증폭하였다. 이때의 PCR 조건은 AMPK α2(T172) sense
antisense primer(5’-GCGAATTCTCAACGGGCTAAAGTAGTAATCAGACTGGC-3’) 를 사용하여95°C 에 30 초, 55°C 에 30 초, 72°C 에 2 분씩 30 cycle 을 돌려 증폭시킨 다음 EtBr 이 포함된 1% agarose gel 에서 증폭된 DNA 를 확인하였다. 그리고 Geneclean kit(MP Biomedicals)를 이용하여 DNA 를 추출하였다. 증폭된 AMPK α2(T172) 유전자와 pcDNA3 를 HindⅢ / EcoRI 으로 자른 후 DNA 연결 효소를 이용하여 붙였다. Ligated DNA 로 E. coli DH5α competent 세포를 형질전환 하였다. 100 μg/ml ampicillin 이 있는 luria broth(LB) agar plate 에서 형성된 colony 를 100
μg/ml ampicillin 이 있는 5 ml 의 LB broth 에 접종하여 37°C 진탕배양기에서 16
시간 키웠다. 16 시간 후에 플라스미드 DNA 를 추출한 후 삽입된 pcDNA3-AMPK α2(T172)를 HindⅢ / EcoRI 로 자른 후 EtBr 이 포함된 1% agarose gel 에서 두 조각의 DNA 밴드를 확인하였다. 그 후 sequencing 분석을 통하여 pcDNA3-AMPK α2(T172)를 확인하였다. 그리고 AMPK α1(D159, S172) 및 AMPK α1(D159, T174)에 대한 AMPK 과발현 벡터도 위와 같은 방법으로 실험할 것이다. 그 때는 AMPK α1(D159, S172) sense primer(5’-GGTACCATGCGCAGACTCAGTTCCTGGAGA-3’) /AMPK α1(D159, S172) antisense
primer(5’-GGCGCTCGAGCTGTTTATTGTGCAAGAATTTTAATTAG-3’), AMPK α1(D159, T174) sense primer(5’-GCGAATCCGCCACCATGGCGACAGCCGAGAAGCAGAAA-3’) /
AMPK α1(D159, T174) antisense primer(5’-
GGCGCTCGAGCTGTTTATTGTGCAAGAATTTTAATTAG-3’)를 사용하여 AMPK 를 증폭시키고 각각을 KpnI/ XhoI 또는 EcoRI/ XhoI 을 이용하여 진행할 것이다.
III. 결 과
A. HBV 증식 세포에서의 AMPK 와 mTOR 발현 및 인산화 변화
여러 가지 바이러스의 증식은 AMPK 와 mTOR 의 활성과 연관되어 있다. HBV 처럼 만성 간염을 일으키는 HCV 증식 세포에서 AMPK 활성이 감소된 반면 mTOR 활성은 증가한다(Brunton 등, 2013). 따라서 HBV 가 증식하는 세포에서의 AMPK 발현과 인산화를 먼저 조사하였다. 세포를 배양 후 24, 48 과 72 시간으로 나뉘어 실험을 한 결과, 이 세 시간대에서의 AMPK 와 mTOR 의 인산화 정도는 비슷하였다. 그 중에서 48 시간에서의 결과가 가장 일정하였다. 이후에는 세포배양 48 시간 후를 기준으로 실험을 진행하였다. AMPK 의 인산화가 감소되어 있는 간암 세포인 HepG2 세포와 HepG2 세포에서 유래한 HBV 가 증식하는 HepG2.2.15 세포를 비교해본 결과 HepG2.2.15 세포에서 AMPK 의인산화는 HepG2 세포보다 더 감소한 것을 밝혀냈다. 그와 반대로 mTOR 의
발현과 인산화는 증가하였다. HepG2 에서 유래한 HBV 가 증식하는 또 다른 PEB8 세포에서도 AMPK 의 인산화는 감소한 반면 mTOR 의 발현과 인산화는 증가하였다. 또 다른 간암세포인 Huh7 세포에서 유래한 HBV 가 증식하는 Huh7 HBV WT stable 세포에서도 AMPK 의 인산화가 감소하였고 mTOR 의 발현과 인산화는 증가하였다.
Figure 1. Phosphorylation of AMPK was down-regulated and phosphorylation and
expression of mTOR were up-regulated in HBV replicating stable cells. (A) Core particles from HepG2 cells, HepG2.2.15 cells, HepG2-derived HBV replicating stable cells, were analyzed using anti-HBc antibody, HRP-conjugated secondary antibody, and ECL. Nucleic acid inside of core particles and HBV DNAs were analyzed using a random-primed
32P-labeled probe specific for HBV sequences. (B, C and D) 48 h after incubations, proteins
from cell lysates were analyzed using primary antibody, HRP-conjugated secondary antibody, and ECL. HepG2 and Huh7 cells are negative controls. HepG2.2.15 cells (B) and PEB8 cells (C) are the HepG2-derived stable HBV replicating cells. Huh7 HBV WT cells (D) are the Huh7-derived stable HBV replicating cells. GAPDH is a loading control. *p<0.05 vs. control, **p<0.02 vs. control (n=3).
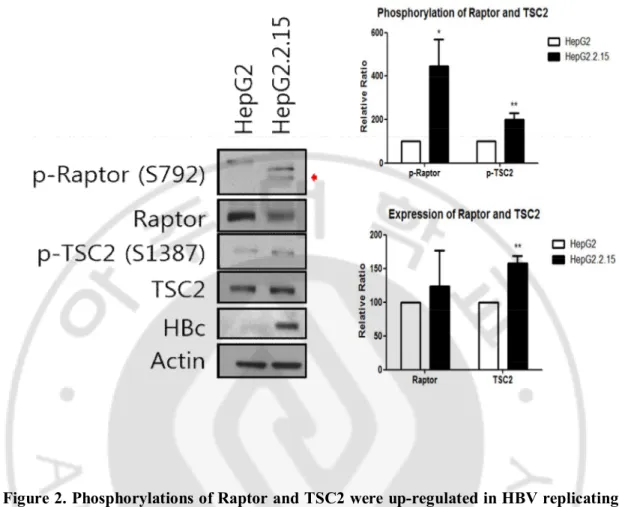
B. HBV 증식 세포에서의 Raptor와 TSC2 발현 및 인산화 변화
AMPK 가 mTOR 를 억제하는 방법에는 두 가지가 있다. AMPK 가 활성화되면 TSC2 의 Ser1387 부위를 인산화 시켜 mTORC1 을 억제하거나 mTORC1 의 regulatory subunit 인 Raptor 를 인산화 시켜 mTORC1 의 인산화를 막아서 억제한다(Mihaylova 와 Shaw, 2011). HBV 가 증식하는 세포에서 모두 AMPK 의 인산화는 감소하였기 때문에 HBV 가 증식할 때 Raptor 와 TSC2 의 인산화 또한 감소할 것이라고 예상하였다. 그러나 HepG2.2.15 세포에서 Raptor 와 TSC2 의 인산화가 오히려 증가하였다. 따라서 AMPK 와 mTOR 의 신호전달 과정에서 Raptor 와 TSC2 는 관여하지 않았다.
Figure 2. Phosphorylations of Raptor and TSC2 were up-regulated in HBV replicating
stable cells. 48 h after incubations, Proteins were analyzed using primary antibody,
HRP-conjugated secondary antibody, and ECL. HepG2 cell is a negative control and HepG2.2.15 cell is the HepG2-derived stable HBV replicating cell. Actin is a loading control. *p<0.05 vs. control, **p<0.02 vs. control (n=3).
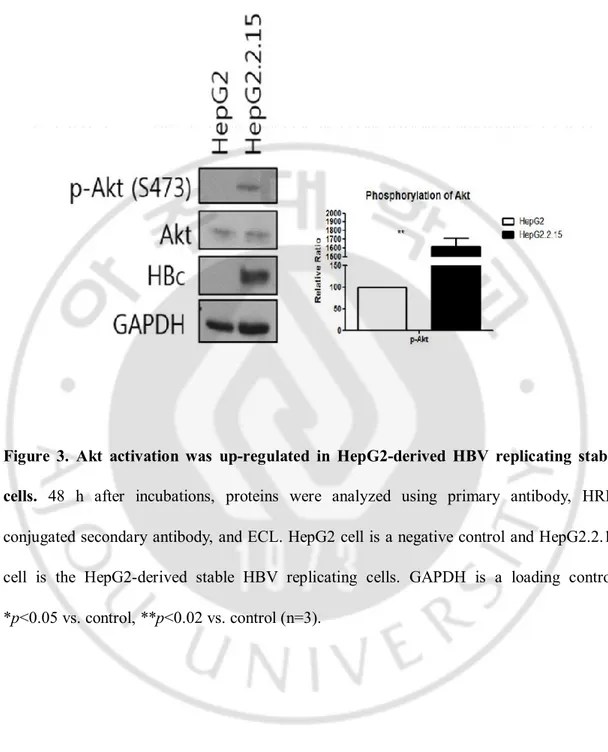
C. HBV 증식 세포에서 Akt 의 발현 및 인산화 변화
AMPK 의 활성이 억제되었음에도 불구하고 Raptor 와 TSC2 의 인산화가 증가하였기 때문에 AMPK-mTOR 신호전달 과정에 다른 단백질이 관여하는지 알아보았다. AMPK 가 인산화 되면 signaling adapter 인 insulin receptor substrate 1(IRS-1)을 인산화 시켜 protein kinase B(Akt)를 억제한다(Tzatsos 와 Tsichlis, 2007). AMPK 가 활성화되면 PP2A 의 활성을 통해 Akt 의 탈인산화를 유도한다(Kim 등, 2009). HBV 의 X 단백질이 IRS1 을 분해시킨다고 보고되었다(Kim 등, 2010). 또한 Akt 는 mTOR 의 활성을 증가시킨다고도 알려져 있다(Martelli 등, 2007). 또한 PP2A 는 HBV 가 증식하는 세포에서 AMPK 가 억제되었기 때문에 Akt 의 활성이 증가되어 mTOR 활성이 증가한다라는 가설을 확인하기 위해 Akt 발현과 인산화를 확인해 보았다. 예상과 같이 HepG2.2.15 세포에서 Akt 의 인산화는 증가하였다.
Figure 3. Akt activation was up-regulated in HepG2-derived HBV replicating stable
cells. 48 h after incubations, proteins were analyzed using primary antibody,
HRP-conjugated secondary antibody, and ECL. HepG2 cell is a negative control and HepG2.2.15 cell is the HepG2-derived stable HBV replicating cells. GAPDH is a loading control. *p<0.05 vs. control, **p<0.02 vs. control (n=3).
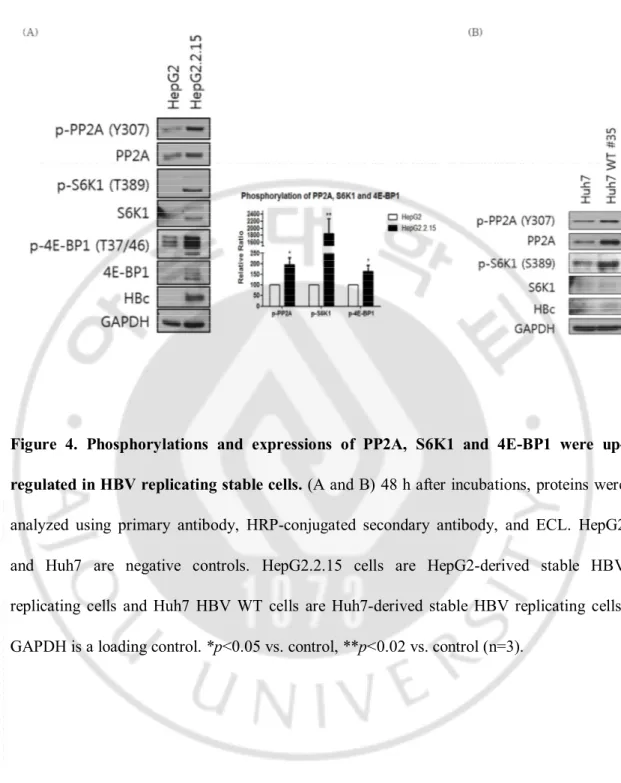
D. HBV 증식 세포에서 PP2A, S6K1 과 4E-BP1 발현 및 인산화
변화
보통은 PP2A 는 AMPK 를 억제한다고 알려져 있지만(Wu 등, 2007), AMPK 가 PP2A 를 활성화 시킨다는 보고도 있다(Kim 등, 2009). 또한 PP2A 는 mTOR 에 의해서 인산화 되어 억제된다고 한다(Hay 와 Sonenberg, 2004). HepG2.2.15 세포에서 PP2A 의 발현과 인산화의 변화를 조사한 결과 PP2A 발현 및 인산화가 증가하였다. mTOR 의 인산화가 증가하였기 때문에 mTOR 의 downstream 으로 잘 알려진 S6K1 와 4E-BP1 도 조사하였다. 그 결과 HepG2.2.15 세포에서S6K1 과 4E-BP1 의 발현과 인산화가 증가하였다. 그리고 Huh7 HBV WT stable 세포에서는 PP2A 의 발현과 인산화가 증가하였으며 S6K1 의 발현에는 변화가 없지만 인산화는 증가하였다.
Figure 4. Phosphorylations and expressions of PP2A, S6K1 and 4E-BP1 were
up-regulated in HBV replicating stable cells. (A and B) 48 h after incubations, proteins were
analyzed using primary antibody, HRP-conjugated secondary antibody, and ECL. HepG2 and Huh7 are negative controls. HepG2.2.15 cells are HepG2-derived stable HBV replicating cells and Huh7 HBV WT cells are Huh7-derived stable HBV replicating cells. GAPDH is a loading control. *p<0.05 vs. control, **p<0.02 vs. control (n=3).
E. AMPK 과발현에 의한 AMPK 의 변화가 HBV 증식에 미치는
영향
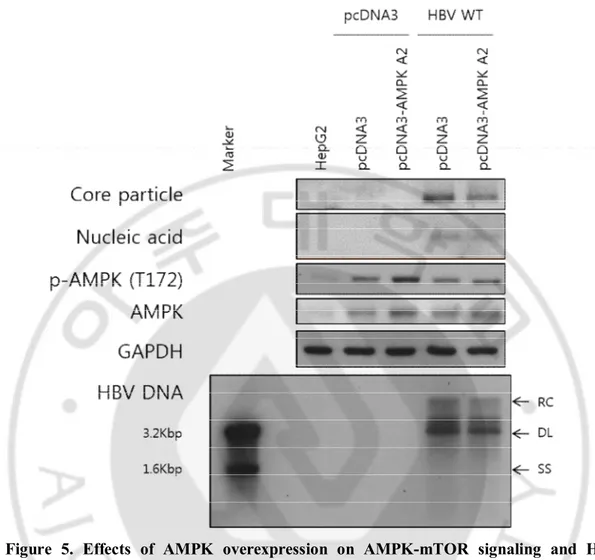
HepG2.2.15 세포에서 AMPK 의 인산화가 감소한 것을 밝혀냈다(그림 1.). 따라서 AMPK 의 과발현에 의해서 AMPK 가 변화할 때 HBV 의 증식에 영향을 미치는지 확인하기 위해서 AMPK 를 과발현 시켰다. HepG2 세포를 2 × 10⁶ cell / 6 cm dish 배양한 24 시간 후에 pcDNA3, pcDNA3-AMPK α2, pcDNA3-HBV WT 플라스미드 DNA 를 세포에 감염시켰다. 감염시킨 후 3 일 뒤 수확하여 AMPK 의 발현과 인산화를 확인한 결과, AMPK α2 과발현 벡터에 의해 AMPK 의 발현과 인산화 모두 증가하였다. 또한 AMPK α2 가 과발현 되었을 때 HBV 의 core particle 과 core particle 속의 핵산이 감소하였고 HBV DNA 도 감소하였다.
Figure 5. Effects of AMPK overexpression on AMPK-mTOR signaling and HBV
replication. HepG2 cells were plated and were co-transfected with pcDNA3, HBV WT, and
pcDNA3-AMPK alpha 2 plasmid. After 72 hours of co-transfection, cells were harvested. Core particles from HepG2 cells were analyzed using anti-HBc antibody, HRP-conjugated secondary antibody, and ECL. Nucleic acid inside of core particles and HBV DNAs were analyzed using a random-primed 32P-labeled probe specific for HBV sequences. Proteins
were analyzed using primary antibody, HRP-conjugated secondary antibody, and ECL. GAPDH is a loading control.
F. Metformin 에 의한 AMPK-mTOR 신호전달 과정의 변화
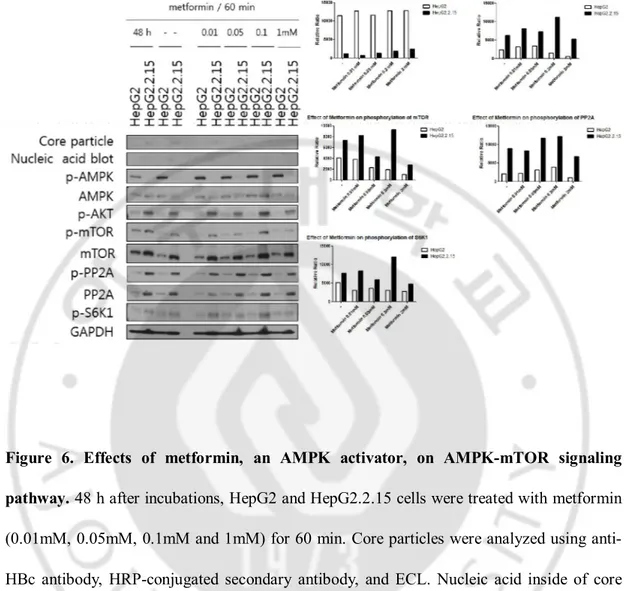
HepG2.2.15 세포에서 AMPK 의 인산화가 감소한 것을 밝혀냈고 mTOR 의 발현과 인산화는 증가하였다(그림 1.). 또한 HepG2.2.15 세포에서 Akt 의 인산화와 발현은 증가하였다(그림 2.). HepG2.2.15 세포에서 PP2A 와 S6K1 의 인산화와 발현도 증가하였다(그림 3.). AMPK 의 downstream 과 upstream 이 무엇인지 확인하기 위해 AMPK 의 활성제인 metformin 을 처리하였다. HepG2 세포와 HepG2.2.15 세포를 배양한 48 시간 후에 metformin 을 0.01, 0.05, 0.1 과 1 mM 로 1 시간동안 처리한 결과 1 mM 의 metformin 을 HepG2.2.15 세포에 처리하였을 때 metformin 을 처리하지 않은 군에 비해 증가시켰다. 그에 따라 Akt, mTOR, PP2A 와 S6K1 의 인산화는 metformin 을 처리하지 않은 군에 비해 감소하였다. 이때 Akt, mTOR, PP2A 와 S6K1 의 발현은 metformin 을 처리하여도 변화가 없었다. Akt, mTOR, PP2A 와 S6K1 이 AMPK 의 downstream 일 것이라고 추정하였다.
Figure 6. Effects of metformin, an AMPK activator, on AMPK-mTOR signaling
pathway. 48 h after incubations, HepG2 and HepG2.2.15 cells were treated with metformin
(0.01mM, 0.05mM, 0.1mM and 1mM) for 60 min. Core particles were analyzed using anti-HBc antibody, HRP-conjugated secondary antibody, and ECL. Nucleic acid inside of core particles were analyzed using a random-primed 32P-labeled probe specific for HBV
sequences. Proteins from cell lysates were analyzed using primary antibodies, HRP-conjugated secondary antibodies and ECL. HepG2 cell is a negative control and HepG2.2.15 cell is the HepG2-derived stable HBV replicating cell. GAPDH is a loading control.
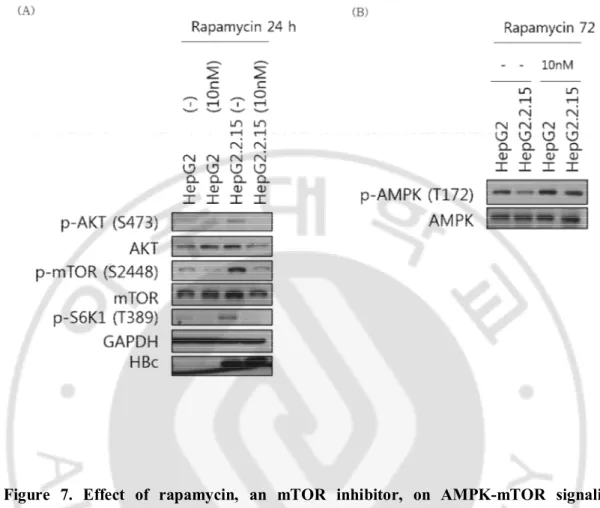
G. Rapamycin 에 의한 AMPK-mTOR 신호전달 과정의 변화
HepG2.2.15 세포에서 mTOR 의 활성은 증가하였다(그림 1.). mTOR 의 downstream 이 S6K1 이고 upstream 이 AMPK 와 Akt 이 맞는지 확인하기 위해 mTOR 억제제인 rapamycin 을 처리하였다. HepG2 세포와 HepG2.2.15 세포를 배양한48 시간 후에 rapamycin 을 10 nM 로 24 혹은 72 시간 처리하였다. 그 결과
HepG2.2.15 세포에서 rapamycin 을 처리하였을 때, mTOR 인산화는
감소되었고 downstream 인 S6K1 의 인산화 또한 감소되었다. Upstream 이라고 추정했던 Akt 와 AMPK 의 인산화는 변화가 없을 것으로 예상하였으나 HepG2.2.15 세포에 rapamycin 을 처리했을 때 Akt 의 인산화는 감소하였고 AMPK 의 인산화는 증가하였다.
Figure 7. Effect of rapamycin, an mTOR inhibitor, on AMPK-mTOR signaling
pathway. 48 h after incubations, HepG2 and HepG2.2.15 cells are treated with rapamycin
(10nM) for 24 or 72 hours. (A and B) Proteins were analyzed using primary antibody, HRP-conjugated secondary antibody, and ECL. HepG2 cell is a negative control and HepG2.2.15 cell is the HepG2-derived stable HBV replicating cell. GAPDH is a loading control.
IV. 고 찰
AMPK 는 ATP 생성·소비의 균형을 위한 에너지 센서 단백질로써 저산소증, 영양분 결핍과 같은 대사 생물학적 스트레스 상태에서 활성화된다. AMPK 가 활성화되면 자가 소화 작용을 촉진하여 에너지와 영양을 생성하고 mTOR 의 활성을 억제함으로써 단백질 합성을 억제한다. 반대로 mTOR 가 활성화되면 자가 소화 작용을 억제하여 세포 성장과 증식을 촉진한다. 이러한 AMPK 와 mTOR 의 서로 다른 조절방식을 통해서 에너지의 생산과 소비를 조절한다(Lee 등, 2012). 만성 HBV 감염 환자는 간경변이나 간암으로 발전할 가능성이 높다(Guo 등 2007). 간암 세포는 AMPK 의 활성이 낮다고 보고되어 있다(Yang 등, 2014; Cheng등 2014). 본 연구에서는 간암 세포인 HepG2 세포에서
유래한 HepG2.2.15 세포와 PEB8 세포와 HBV 가 증식하는 Huh7 HBV WT stable
세포에서도 AMPK 의 인산화는 감소하였으며, mTOR 의 발현과 인산화는 증가한
것을 밝혀냈다(그림 1.). 본 연구에서 조사한 HBV 가 증식하는 모든
세포에서 AMPK 의 인산화가 감소하였기 때문에 Raptor 와 TSC2 의 인산화가
감소할 것이라고 추정하였으나 오히려 증가하였다(그림 2.). 따라서 AMPK 와 mTOR 의 신호전달 과정에서 Raptor 와 TSC2 가 직접관여를 하지 않을 것으로 추정하였다. 혹은 Akt 가 mTOR 의 활성을 증가시킨다고 알려져 있으므로(Martelli 등, 2007), AMPK 가 억제된 상태에서는 Akt 의 활성이 증가됨으로써 mTOR 활성이
증가한다는 가설을 세웠다. 예상대로 HepG2.2.15 세포에서 Akt 인산화가
증식하는 HepG2.2.15, PEB8 및 Huh7 HBV WT stable 세포에서 mTOR 의 인산화가 증가하였기 때문에 mTOR 의 downstream 인 S6K1 와 4E-BP1 를 조사하였으며,
예상대로 HepG2.2.15 세포에서 S6K1 과 4E-BP1 의 발현과 인산화가
증가하였다(그림 4.). 그 다음, PP2A 가 AMPK 를 억제하거나(Wu 등, 2007) AMPK 가 PP2A 를 활성화 시킨다(Kim 등, 2009). mTOR 가 PP2A 를 인산화하여PP2A 를 억제한다고 알려져 있으나(Hay N 와 Sonenberg N, 2004) 아직 HBV 증식과 관련하여 밝혀진 것이 없다. HepG2.2.15 세포와 Huh7 HBV WT stable
세포에서 PP2A 발현과 인산화가 증가하였다(그림 4.). AMPK α2 가 과발현되면
HBV 의 증식이 감소됨을 밝혔다(그림 5.). 또한 AMPK 활성제인
metformin 처리시 HepG2.2.15 세포에서 AMPK 인산화가 증가하였으며 Akt, mTOR, PP2A 와 S6K1 의 인산화는 감소하였으나 이들 단백질 발현 양에는 변화가 없었다(그림 6.). 따라서 Akt, mTOR, PP2A 와 S6K1 이 AMPK 의 downstream 일 것이라고 추정하였다. HepG2.2.15 세포에 mTOR 억제제인 rapamycin 을 처리하여 mTOR 의 활성을 억제하였더니 mTOR 의 인산화가 감소하였으며 S6K1 의 인산화 또한 감소되었다(그림 7.). 그러나 upstream 이라고 예상했던 Akt 의 인산화는
감소하였고 AMPK 의 인산화는 증가하였다. 따라서 mTOR 의 downstream 인
어떠한 단백질에 의해서 feedback 효과로 upstream 인 AMPK 와 Akt 에 영향을 준 것이라고 추측하였으며 HBV 증식과 AMPK/Akt-mTOR 신호전달 과정을 밝히기 위한 추가 실험이 필요하다.
V. 결 론
HBV 증식과 AMPK 의 신호전달 과정에 관해서는 알려진 것이 거의 없다. AMPK 활성이 감소된 간암 세포와 그 간암 세포에서 유래한 HBV 증식 세포를 통해 HBV 증식 유무와 AMPK 의 활성여부를 조사하였다. 그 결과 HBV 가 없는 HepG2 및 Huh7 간암 세포보다 HBV 가 증식하는 이들 간암 세포에서 AMPK 의 활성이 더 감소된 것을 밝혔다. 또한 HBV 가 증식하는HepG2.2.15 세포에서는 Akt, mTOR, PP2A, S6K1 와 4E-BP1 의 발현과 인산화가 증가하였다. 또한 Huh7 세포에서 유래한 HBV 증식하는 세포에서도 mTOR, PP2A 그리고 S6K1 의 인산화가 증가하였다. AMPK 를 과발현하면 AMPK 의 발현과 인산화가 증가되며 이에 따라 HBV core particle 과 HBV DNA 가 감소하였다.
AMPK 활성제인 metformin 은 HepG2.2.15 세포에서 AMPK 인산화를
증가시켰으며, Akt, mTOR, PP2A 와 S6K1 의 인산화는 감소하였고 각각의 단백질 발현은 변화가 없었다. 따라서 Akt, mTOR, PP2A 와 S6K1 이 AMPK 의 downstream 일 것이라고 추정하였으나 Akt, PP2A 와 S6K1 에 대한 억제제를 처리하는 추가 실험이 필요하다. HepG2.2.15 세포에 rapamycin 을 처리하여 mTOR 의 활성을 억제하였더니 예상대로 S6K1 의 인산화가 감소하였다. Upstream 이라고 추정했던 AMPK 와 Akt 의 인산화에는 변화가 없을 것으로 예상하였지만 rapamycin 을 처리하였을 때 Akt 의 인산화는 감소하였고 AMPK 의 인산화는 증가하였다. 따라서 mTOR 의 downstream 인 어떤 단백질이 feedback
효과로 AMPK 와 Akt 에 활성에도 관여하는 것으로 추측하고 있으며 추가 실험이 필요하다.
참
고 문 헌
1. Beck J, Nassal M: Hepatitis B virus replication. World J Gastroenterol 13: 48-64, 2007
2. Brunton J, Steele S, Ziehr B, Moorman N, Kawula T: Feeding uninvited guests: mTOR and AMPK set the table for intracellular pathogens. PLoS Pathog 9: e1003552, 2013
3. Carling D, Zammit VA, Hardie DG: A common bicyclic protein kinase cascade inactivates the regulatory enzymes of fatty acid and cholesterol biosynthesis. FEBS
Lett 223: 217-222, 1987
4. Cheng J, Huang T, Li Y, Guo Y, Zhu Y, Wang Q, Tan X, Chen W, Zhang Y, Cheng W, Yamamoto T, Jing X, Huang J: AMP-activated protein kinase suppresses the in vitro and in vivo proliferation of hepatocellular carcinoma. PLoS One 9: e93256, 2014
5. Cougot D, Allemand E, Riviere L, Benhenda S, Duroure K, Levillayer F, Muchardt C, Buendia MA, Neuveut C: Inhibition of PP1 phosphatase activity by HBx: a mechanism for the activation of hepatitis B virus transcription. Sci Signal 5: ra1, 2012
6. Egan DF, Shackelford DB, Mihaylova MM, Gelino S, Kohnz RA, Mair W, Vasquez DS, Joshi A, Gwinn DM, Taylor R, Asara JM, Fitzpatrick J, Dillin A, Viollet B, Kundu M, Hansen M, Shaw RJ: Phosphorylation of ULK1 (hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy. Science 331: 456-461, 2011
7. Fogarty S, Hawley SA, Green KA, Saner N, Mustard KJ, Hardie DG: Calmodulin-dependent protein kinase kinase-beta activates AMPK without forming a stable complex: synergistic effects of Ca2+ and AMP. Biochem J 426: 109-118, 2010
8. Guo H, Zhou T, Jiang D, Cuconati A, Xiao GH, Block TM, Guo JT: Regulation of hepatitis B virus replication by the phosphatidylinositol 3-kinase-akt signal transduction pathway. J Virol 81: 10072-10080, 2007
9. Hardie DG: AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy. Nat Rev Mol Cell Biol 8: 774-785, 2007
10. Hawley SA, Boudeau J, Reid JL, Mustard KJ, Udd L, Makela TP, Alessi DR, Hardie DG: Complexes between the LKB1 tumor suppressor, STRAD alpha/beta and MO25 alpha/beta are upstream kinases in the AMP-activated protein kinase cascade. J Biol 2: 28, 2003
11. Hawley SA, Pan DA, Mustard KJ, Ross L, Bain J, Edelman AM, Frenguelli BG, Hardie DG: Calmodulin-dependent protein kinase kinase-beta is an alternative upstream kinase for AMP-activated protein kinase. Cell Metab 2: 9-19, 2005
12. Hay N, Sonenberg N: Upstream and downstream of mTOR. Genes Dev 18: 1926-1945, 2004
13. Hurley RL, Anderson KA, Franzone JM, Kemp BE, Means AR, Witters LA: The Ca2+/calmodulin-dependent protein kinase kinases are AMP-activated protein kinase kinases. J Biol Chem 280: 29060-29066, 2005
14. Ju TC, Chen HM, Lin JT, Chang CP, Chang WC, Kang JJ, Sun CP, Tao MH, Tu PH, Chang C, Dickson DW, Chern Y: Nuclear translocation of AMPK-alpha1 potentiates striatal neurodegeneration in Huntington's disease. J Cell Biol 194: 209-227, 2011
15. Kane M: Global programme for control of hepatitis B infection. Vaccine 13 Suppl 1: S47-49, 1995
16. Kaplan PM, Greenman RL, Gerin JL, Purcell RH, Robinson WS: DNA polymerase associated with human hepatitis B antigen. J Virol 12: 995-1005, 1973
17. Kim J, Kundu M, Viollet B, Guan KL: AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1. Nat Cell Biol 13: 132-141, 2011
18. Kim K, Kim KH, Cheong J: Hepatitis B virus X protein impairs hepatic insulin signaling through degradation of IRS1 and induction of SOCS3. PLoS One 5: e8649, 2010
19. Kim KY, Baek A, Hwang JE, Choi YA, Jeong J, Lee MS, Cho DH, Lim JS, Kim KI, Yang Y: Adiponectin-activated AMPK stimulates dephosphorylation of AKT through protein phosphatase 2A activation. Cancer Res 69: 4018-4026, 2009
20. Lamia KA, Sachdeva UM, DiTacchio L, Williams EC, Alvarez JG, Egan DF, Vasquez DS, Juguilon H, Panda S, Shaw RJ, Thompson CB, Evans RM: AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation.
Science 326: 437-440, 2009
21. Laplante M, Sabatini DM: mTOR signaling in growth control and disease. Cell 149: 274-293, 2012
22. Lee CW, Wong LL, Tse EY, Liu HF, Leong VY, Lee JM, Hardie DG, Ng IO, Ching YP: AMPK promotes p53 acetylation via phosphorylation and inactivation of SIRT1 in liver cancer cells. Cancer Res 72: 4394-4404, 2012
23. Lee WM: Hepatitis B virus infection. N Engl J Med 337: 1733-1745, 1997
24. Li Y, Xu S, Mihaylova MM, Zheng B, Hou X, Jiang B, Park O, Luo Z, Lefai E, Shyy JY, Gao B, Wierzbicki M, Verbeuren TJ, Shaw RJ, Cohen RA, Zang M: AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice. Cell Metab 13: 376-388, 2011
25. Liang TJ: Hepatitis B: the virus and disease. Hepatology 49: S13-21, 2009
26. Mankouri J, Tedbury PR, Gretton S, Hughes ME, Griffin SD, Dallas ML, Green KA, Hardie DG, Peers C, Harris M: Enhanced hepatitis C virus genome replication and lipid accumulation mediated by inhibition of AMP-activated protein kinase. Proc
Natl Acad Sci U S A 107: 11549-11554, 2010
27. Martelli AM, Tazzari PL, Evangelisti C, Chiarini F, Blalock WL, Billi AM, Manzoli L, McCubrey JA, Cocco L: Targeting the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin module for acute myelogenous leukemia therapy: from bench to bedside. Curr Med Chem 14: 2009-2023, 2007
28. Martinez-Lopez N, Varela-Rey M, Fernandez-Ramos D, Woodhoo A, Vazquez-Chantada M, Embade N, Espinosa-Hevia L, Bustamante FJ, Parada LA, Rodriguez MS, Lu SC, Mato JM, Martinez-Chantar ML: Activation of LKB1-Akt pathway
independent of phosphoinositide 3-kinase plays a critical role in the proliferation of hepatocellular carcinoma from nonalcoholic steatohepatitis. Hepatology 52: 1621-1631, 2010
29. McMahon BJ, Alward WL, Hall DB, Heyward WL, Bender TR, Francis DP, Maynard JE: Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis 151: 599-603, 1985
30. Mihaylova MM, Shaw RJ: The AMPK signalling pathway coordinates cell growth, autophagy and metabolism. Nat Cell Biol 13: 1016-1023, 2011
31. Robinson WS, Clayton DA, Greenman RL: DNA of a human hepatitis B virus candidate. J Virol 14: 384-391, 1974
32. Robinson WS, Greenman RL: DNA polymerase in the core of the human hepatitis B virus candidate. J Virol 13: 1231-1236, 1974
33. Salt I, Celler JW, Hawley SA, Prescott A, Woods A, Carling D, Hardie DG: AMP-activated protein kinase: greater AMP dependence, and preferential nuclear localization, of complexes containing the alpha2 isoform. Biochem J 334 ( Pt 1): 177-187, 1998
34. Sato R, Goldstein JL, Brown MS: Replacement of serine-871 of hamster 3-hydroxy-3-methylglutaryl-CoA reductase prevents phosphorylation by AMP-activated kinase and blocks inhibition of sterol synthesis induced by ATP depletion. Proc Natl Acad
Sci U S A 90: 9261-9265, 1993
35. Seeger C, Mason WS: Hepatitis B virus biology. Microbiol Mol Biol Rev 64: 51-68, 2000
36. Shackelford DB, Shaw RJ: The LKB1-AMPK pathway: metabolism and growth control in tumour suppression. Nat Rev Cancer 9: 563-575, 2009
37. Shaw RJ, Kosmatka M, Bardeesy N, Hurley RL, Witters LA, DePinho RA, Cantley LC: The tumor suppressor LKB1 kinase directly activates AMP-activated kinase and regulates apoptosis in response to energy stress. Proc Natl Acad Sci U S A 101: 3329-3335, 2004
38. Summers J, O'Connell A, Millman I: Genome of hepatitis B virus: restriction enzyme cleavage and structure of DNA extracted from Dane particles. Proc Natl
39. Turnley AM, Stapleton D, Mann RJ, Witters LA, Kemp BE, Bartlett PF: Cellular distribution and developmental expression of AMP-activated protein kinase isoforms in mouse central nervous system. J Neurochem 72: 1707-1716, 1999
40. Tzatsos A, Tsichlis PN: Energy depletion inhibits phosphatidylinositol 3-kinase/Akt signaling and induces apoptosis via AMP-activated protein kinase-dependent phosphorylation of IRS-1 at Ser-794. J Biol Chem 282: 18069-18082, 2007
41. Watt MJ, Holmes AG, Pinnamaneni SK, Garnham AP, Steinberg GR, Kemp BE, Febbraio MA: Regulation of HSL serine phosphorylation in skeletal muscle and adipose tissue. Am J Physiol Endocrinol Metab 290: E500-508, 2006
42. Woods A, Dickerson K, Heath R, Hong SP, Momcilovic M, Johnstone SR, Carlson M, Carling D: Ca2+/calmodulin-dependent protein kinase kinase-beta acts upstream of AMP-activated protein kinase in mammalian cells. Cell Metab 2: 21-33, 2005
43. Wu TT, Coates L, Aldrich CE, Summers J, Mason WS: In hepatocytes infected with duck hepatitis B virus, the template for viral RNA synthesis is amplified by an intracellular pathway. Virology 175: 255-261, 1990
44. Wu Y, Song P, Xu J, Zhang M, Zou MH: Activation of protein phosphatase 2A by palmitate inhibits AMP-activated protein kinase. J Biol Chem 282: 9777-9788, 2007
45. Xu Y, Liu C, Chen S, Ye Y, Guo M, Ren Q, Liu L, Zhang H, Xu C, Zhou Q, Huang S, Chen L: Activation of AMPK and inactivation of Akt result in suppression of mTOR-mediated S6K1 and 4E-BP1 pathways leading to neuronal cell death in in vitro models of Parkinson's disease. Cell Signal 26: 1680-1689, 2014
46. Yan H, Zhong G, Xu G, He W, Jing Z, Gao Z, Huang Y, Qi Y, Peng B, Wang H, Fu L, Song M, Chen P, Gao W, Ren B, Sun Y, Cai T, Feng X, Sui J, Li W: Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. Elife 1: e00049, 2012
47. Yang CC, Chang SF, Chao JK, Lai YL, Chang WE, Hsu WH, Kuo WH: Activation of AMP-activated protein kinase attenuates hepatocellular carcinoma cell adhesion stimulated by adipokine resistin. BMC Cancer 14: 112, 2014
48. Yano M, Ohkoshi S, Aoki YH, Takahashi H, Kurita S, Yamazaki K, Suzuki K, Yamagiwa S, Sanpei A, Fujimaki S, Wakai T, Kudo SE, Matsuda Y, Aoyagi Y: Hepatitis B virus X induces cell proliferation in the hepatocarcinogenesis via up-regulation of cytoplasmic p21 expression. Liver Int 33: 1218-1229, 2013
49. Yen CJ, Lin YJ, Yen CS, Tsai HW, Tsai TF, Chang KY, Huang WC, Lin PW, Chiang CW, Chang TT: Hepatitis B virus X protein upregulates mTOR signaling through IKKbeta to increase cell proliferation and VEGF production in hepatocellular carcinoma. PLoS One 7: e41931, 2012
- ABSTRACT -
AMP-activated protein kinase-mTOR signaling pathway and
hepatitis B virus replication
Jumi Kim
Department of Biomedical science The Graduate School, Ajou University
(Supervised by Associate Professor Kyongmin Kim)
Hepatitis B virus(HBV) is a small and enveloped DNA virus, belongs to family
Hepadnaviridae. 350 million people worldwide are chronically infected. HBV causes acute
and chronic hepatitis B infections. Patients with chronic hepatitis B have a risk of developing cirrhosis and hepatocellular carcinoma(HCC). AMP-activated protein kinase(AMPK), an energy sensor, is a necessary protein to maintain energy balance. Even though hepatitis C virus(HCV) replication decreases AMPK activity and increases mammalian target of rapamycin(mTOR) activity, nothing has been known regarding HBV replication and AMPK activity. HBV X protein(HBx) had been reported to up-regulate mTOR activity and contribute to HCC development. In the present study, we examined whether HBV replication can regulate AMPK-mTOR signaling pathway or vice versa. Expression and
phosphorylation of AMPK were analyzed in the HepG2-derived stable HBV replicating cells, HepG2.2.15 and PEB 8 cells, and the Huh7-derived stable HBV replicating cells. We found that phosphorylation of AMPK were down-regulated in the HepG2.2.15 cells and PEB8 cells and the Huh7 HBV WT stable cells. We found that expression and phosphorylation of mTOR were up-regulated in HepG2.2.15 cells, PEB8 cells, and Huh7 HBV WT stable cells. Because phosphorylation of AMPK was decreased, we expected that phosphorylation of regulatory subunit of mTOR (Raptor) and tuberous sclerosis 2 (TSC2) were decreased. But, phosphorylations of Raptor and TSC2 were increased in HepG2.2.15 cells. We found that phosphorylations of Akt was up-regulated in HepG2.2.15 cells. We found that expressions and phosphorylations of PP2A, S6K1 and 4E-BP1 were up-regulated in HepG2.2.15 cells. And expressions and phosphorylations of PP2A and S6K1 were up-regulated in the Huh7 HBV WT stable cells. When expression and phosphorylation of AMPK were up-regulated via overexpression of AMPK alpha 2, HBV core particle, nucleic acid inside core particle, and HBV DNAs were reduced in HepG2 cells. When HepG2.2.15 cells were treated with 1mM metformin, AMPK activator, Akt, mTOR, PP2A and S6K1 phosphorylation were decreased. No significant changes in protein expressions. When HepG2.2.15 cells were treated with 10nM rapamycin, mTOR inhibitor, phosphorylations of mTOR and S6K1 were decreased. Surprisingly, phosphorylation of AMPK were increased and phosphorylation of Akt were decreased. We will further pursue which molecules are upstream or downstream of AMPK-mTOR signaling pathway.
Keyword : HBV, AMPK-mTOR signal, Akt, PP2A, S6K1, 4E-BP1