저작자표시-비영리-동일조건변경허락 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. l 이차적 저작물을 작성할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 동일조건변경허락. 귀하가 이 저작물을 개작, 변형 또는 가공했을 경우 에는, 이 저작물과 동일한 이용허락조건하에서만 배포할 수 있습니다.
이학 석사학위 논문
TI
S21에 의한 mat
r
i
x
met
al
l
opr
ot
ei
nases(
MMPs)
발현 억제 연구.
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
TI
S21에 의한 mat
r
i
x
met
al
l
opr
ot
ei
nases(
MMPs)
발현 억제 연구.
지도교수
박 태 준
이 논문을 이학 석사학위 논문으로 제출함.
2014년
2월
아 주 대 학 교
대 학 원
의생명과학과/
분자의학전공
최 명 호
최명호의 이학 석사학위 논문을
인준함.
심사위원장
박 태 준
인
심 사 위 원
임 인 경
인
심 사 위 원
윤 계 순
인
아 주 대 학 교
대 학 원
2013년 12월 30일
- 국문요약 -
TIS21 에 의한 matrix metalloproteinases (MMPs)
발현
억제 연구.
TPA inducible sequence 21 (TIS21)은 12-O-tetradecanoyl phorbol-13-acetate (TPA)에 의해 유도 되는 anti-proliferative family (APRO)유전자이다. 이 유전자는 mouse 에서는 TIS21, human 과 rat 에서는 각각 B-cell translocation gene-2 (BTG2), pheochromocytoma cell 3 (PC3)로 존재하는 동등 유전자이다. TIS21 은 DNA 수복조절인자, 배아세포 분화 기작 조절의 기능을 가지고 있으며 세포내의 전사 보조 인자, 신경세포 분화인자 및 성장억제인자, 조혈모세포 증식 억제인자로 보고된 바 있다. TIS21 의 주요 기능은 세포주기를 억제하여 세포의 노화, 사멸을 유도하고 암 세포의 생성과 증식에 중요한 ROS 의 생산을 감소시켜 암 세포의 전이를 감소 시킴으로써 암 억제 기능을 한다는 것이다. 또한 TIS21 의 발현이 정상 조직에 비해 암 조직에서 저하되고 특히 전이된 암에서 발현 저하가 있음을 관찰한 여러 연구들이 TIS21 이 암 억제 유전자로써 중요한 기능을 한다는 것을 간접적으로 증명해주고 있다.
Matrix metalloproteinases (MMPs)는 zinc-dependent endopeptidase 이며 세포 외 기질 (ECM)이나 세포 부착 물질 (cellular adhesion molecule) 같은 물리적 장벽들을
분해하여 암 세포의 전이를 쉽게 하고 혈관 신생성을 촉진하며 암 세포가 전이될 2 차 조직의 환경을 적합하게 만드는 등, 암 세포의 성장과 전이에 중요한 역할을 한다. 따라서 본 연구는 암 전이에 중요한 역할을 하는 MMPs 와 암 억제 기능을 하는 TIS21 과의 상관 관계를 연구하고자 하였다.
Human breast carcinoma 세포 (MDA-MB-231), human dermal fibroblasts 세포 (HDF)에 아데노바이러스 TIS21 을 과발현 시켰을 때 세포의 이동성이 저해되는 것을 관찰하였고 MMP-9, 10 의 mRNA 발현 감소와 단백질 활성도의 감소도 관찰되었다. 이밖에 MMP-1, 2, 3, 14, 15, 19 의 mRNA 발현이 감소되었으며 MMPs 유전자의 promoter 에 결합하는 전사인자들 중 c-Fos, PEA3 의 발현 저하도 관찰 되었다. 아직 정확한 기전은 밝혀내지 못했지만 연구 결과를 통해 TIS21 이 MMPs 유전자의 promoter 에 결합하는 전사인자의 발현을 저해시켜 mRNA 발현을 떨어뜨리며 또한 MMPs 의 활성도를 조절하는 ROS 를 감소시켜 단백질 활성도와 세포의 이동성을 감소시킬 것으로 예상한다. TIS21 의 새로운 기능 으로써 MMPs 의 발현, 활성 저해제의 가능성을 제시하며 앞으로의 연구를 통해 정확한 기전을 밝혀 낸다면 의미 있는 발견이 될 것이다. 핵심어: TIS21/BTG2/PC3, MMPs 의 mRNA 발현과 단백질 활성도 감소, MDA-MB-231,
차례
국문요약 ··· ⅰ 차례 ··· iii 그림 차례 ··· vi 표 차례 ··· vii Ⅰ. 서론 ··· 1 A. TIS21 의 특징과 암 억제 기작 ··· 1 (1) TIS21 의 특징과 일반적인 기능 ··· 1 (2) 정상 세포와 암 세포간의 TIS21 발현 양상 ··· 2 (3) TIS21 의 세포주기 억제 기능··· 2 (4) TIS21 의 세포사멸 유도 기능··· 3 (5) TIS21 의 ROS 생성 감소 기능 ··· 4 (6) TIS21 의 세포 전이 감소 기능··· 4 B. MMPs 의 특징과 암 전이 과정에서의 기능 ··· 7 (1) MMPs 의 특징 ··· 7 (2) MMPs 의 활성 조절 ··· 7(3) MMPs 의 성장신호에 관한 기능 ··· 8 (4) MMPs 의 세포사멸 억제 기능 ··· 9 (5) MMPs 의 암 전이에 관한 기능 ··· 9 ① 물리적 장벽 분해 ··· 10 ② 혈관 신생성 ··· 10 ③ Metastatic niche ··· 11 Ⅱ. 재료 및 방법 ··· 14 A. 세포배양 ··· 14 B. TIS21 아데노바이러스 생산 ··· 14 C. RT-PCR··· 15 D. Gelatin zymography 분석 ··· 15 E. Wound healing 분석 ··· 16 Ⅲ. 결과 ··· 17 A. TIS21 과발현에 의한 MDA-MB-231, HDF 세포의 이동성 억제··· 17
B. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs 의 mRNA 발현 억제 ··· 20
C. HDF 세포에서 TIS21 과발현에 의한 MMPs 의 mRNA 발현 억제 ··· 23 D. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs 활성 억제 ··· 28 E. HDF 세포에서 TIS21 과발현에 의한 MMPs 활성 억제 ··· 30 F. TIS21 과발현에 의한 MMPs 발현을 조절하는 전사인자들의 발현 변화 31 Ⅳ. 고찰 ··· 36 Ⅴ. 결론 ··· 39 참고문헌 ··· 40 ABSTRACT ··· 49
그림
차례
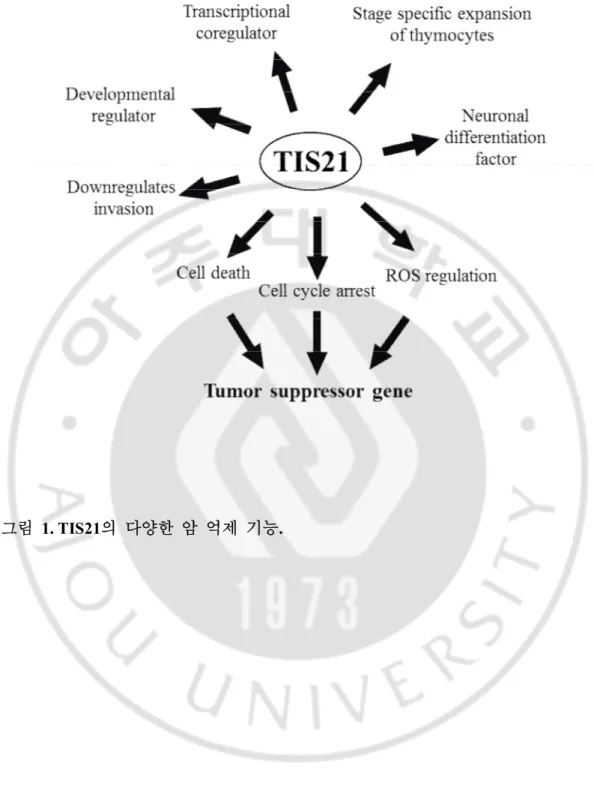
그림1. TIS21 의 다양한 암 억제 기능. ··· 6
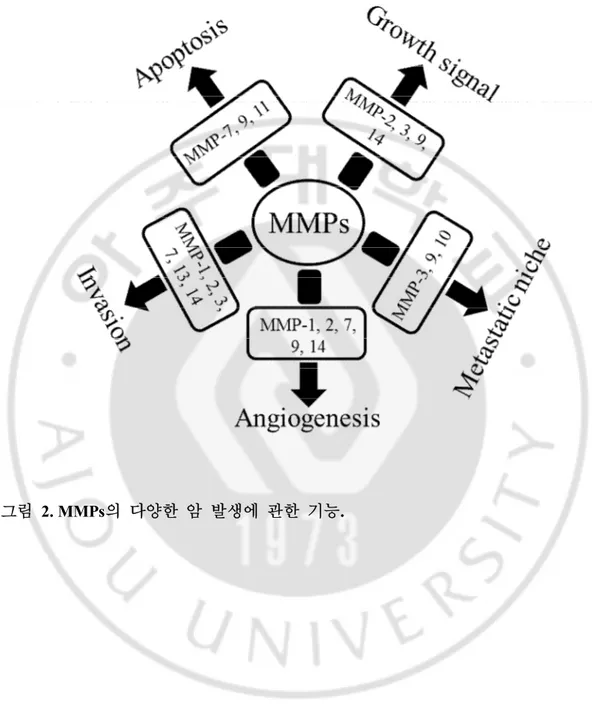
그림2. MMPs 의 다양한 암 발생에 관한 기능. ··· 13
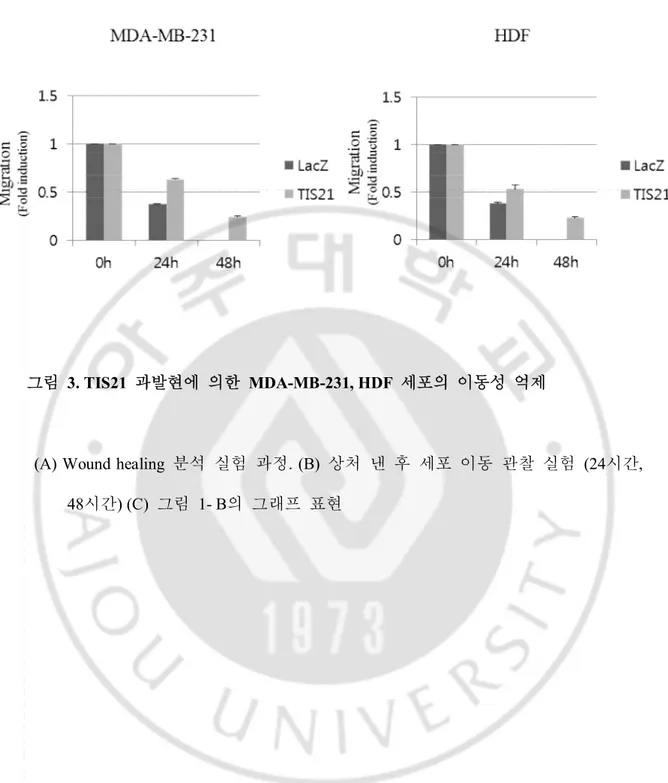
그림3. TIS21 과발현에 의한 MDA-MB-231, HDF 세포의 이동성 억제. ··· 17
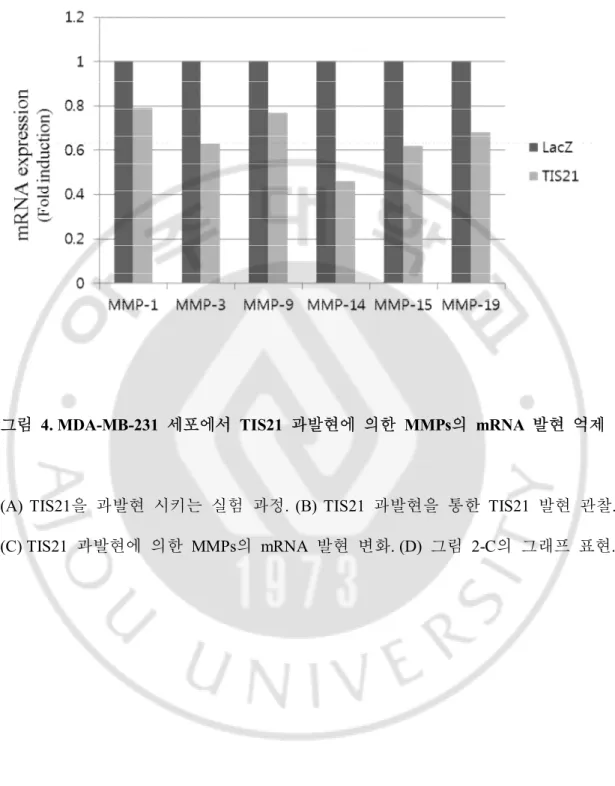
그림 4. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs 의 mRNA 발현 억제. ··· 20 그림 5. HDF 세포에서 TIS21 과발현에 의한 MMPs 의 mRNA 발현 억제. ···· 23 그림 6. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs 활성 억제. ··· 29 그림 7. HDF 세포에서 TIS21 과발현에 의한 MMPs 활성 억제. ··· 30 그림 8. TIS21 과발현에 의한 MMPs 발현을 조절하는 전사인자들의 발현 변화. ··· 32
표
차례
표 1. MMPs 의 mRNA 발현 측정 primers. ··· 26
표 2. MMPs 의 mRNA 발현 측정 RT-PCR 조건. ··· 27
표 3. 전사인자들의 발현 측정 primers. ··· 35
I. 서론
A. TIS21의 특징과 암 억제 기작
(1) TIS21의 특징과 일반적인 기능
TIS21 유전자는 초기의 성장 반응 유전자 (Sukhatme 1987)로 TPA로 자극을 준 SW3T3세포에서 최초 분리되었다 (Fletcher et al. 1991). TIS21과 동등 유전자인 PC3는 rat PC12세포에서 (Bradbury et al. 1991), BTG2는 human에서 각각 밝혀졌다 (Rouault et al. 1996). TIS21의 역할로는 전사 공동 조절자 (transcriptional co-regulator)로써 기능을 하고 (Duriez et al. 2004; Morel et al. 2003; Prevot et al. 2001; Rouault et al. 1998), 신경 조직의 분화에 관여하는 인자로 신경세포의 증식을 저해하며 (Canzoniere et al. 2004; Corrente et al. 2002; el-Ghissassi et al. 2002; Iacopetti et al. 1999), PC12 세포에서는 생존인자로써 신경돌기를 성장시키고 신경상피세포를 분화시키는데 관여한다. 또한 흉선세포가 특정한 분화단계에 맞게 증식하도록 하는데 중요한 매개자와 조혈 모세포의 증식을 억제하는 조절자로써 역할을 한다 (Konrad and Zuniga-Pflucker 2005; Oswald et al. 2006). 동물 모델인 TIS21
-/-생쥐에서 척추동물의 발달양식 (patterning) 조절자이고 zebrafish의 축옆중배엽 (paraxialmesoderm) 발달과정과 Xenopus의 척색 발달과정 조절자로써 기능을 한다.
(2) 정상 세포와 암 세포간의 TIS21 발현 양상
TIS21은 다양한 세포에서 암 억제 유전자로써 기능을 가지고 있다 (Atfi et al. 1994; Bian et al. 1997; Borghaei et al. 2004). TIS21은 mouse의 흉선, 폐, 비장, 위에서 발현이 가장 많이 되며 심장, 뇌, 신장, 고환에서는 어느 정도 발현되고 간과 골격근에서 발현이 낮게 관찰된다 (Lim et al. 1994). BTG2는 인간의 신장, 폐, 전립선에서 발현이 가장 높으며 가슴세포, 췌장, 창자의 상피 세포에서도 발현이 관찰되고 신경세포, 간세포, 난소에서 낮은 발현이 관찰된다 (Melamed et al. 2002).
Mouse의 흉선에서 항상 높게 발현을 보이는 TIS21이 흉선 암 세포 에서는 발현이 관찰되질 않거나 (Lim et al. 1995), 전립선에서 발현이 관찰되던 TIS21이 전립선 암 초기 단계에 발현이 관찰되질 않는다 (Ficazzola et al. 2001). 또한 인간 가슴세포에서 발현되던 BTG2도 유방암 세포에서는 거의 발현되지 않거나 매우 낮게 발현된다. 이러한 발견들이 TIS21/BTG2 이 암 발생 기전에 중요한 역할을 한다는 것을 간접적으로 보여주고 있다. (3) TIS21의 세포주기 억제 기능 TIS21의 세포주기 억제 기전을 살펴보면, p53 유전자나 RB 유전자의 발현 유무에 따라 다른 기능을 하게 된다. 다양한 암 세포에서 p53, RB 같은 암 억제 유전자의 발현이 감소되어 있다는 보고들이 많이 있다. RB의 발현이 없어지게 되면 세포주기의 S 단계 통과 과정은 cyclin D 대신 cyclin E가 관여 하게 되고
pRB에 의해서 억제된 세포주기는 다시 정상적으로 돌아가게 된다 (Leone et al. 1997). 이러한 RB의 발현이 없는 암 세포에서 TIS21은 cyclin E, cyclin-dependent kinase 4 (CDK4)의 생성을 늦추고 cyclin E와 관련된 CDK의 활성을 억제하며 RB가 발현이 될 때는 cyclin D1의 발현을 억제하여 pRB의 활성을 조절함으로써 G1에서 S 단계로의 이동을 방해하고 세포의 노화를 유도한다.
(4) TIS21의 세포사멸 유도 기능
p53 유전자가 발현되지 않는 human leukemic monocyte lymphoma (U937) 세포에 epidermal growth factor (EGF)를 처리하면 ERK1/2 가 활성화 되고 p-ERK는 TIS21의
Ser 147 잔기를 인산화 시킨다. 인산화된 TIS21의 Ser 147, Pro 148 잔기와 peptidyl-prolyl cis/trans isomerase (PIN-1)이 결합하면 TIS21에 의해서 핵에 있던 PIN-1이 세포질로 이동하게 되고 그 결과 미토콘드리아 막의 전위차를 잃게 되며 세포는 사멸하게 된다 (Hong et al. 2005). 또한 U937 세포를 이용한 다른 실험 결과를 보면 TPA에 의해 촉진된 TIS21의 발현증가로 인해 G2/M 통과가 억제된다. 이러한 TIS21의 발현 증가는 protein kinase C-δ (PKC-δ)에 의해 더욱 증가된다는 보고가 있다 (Ryu et al. 2004). 그리하여 PKC-δ의 억제제인 rottlerin을 칠 경우 TIS21의 발현이 감소되어 세포주기는 다시 정상으로 돌아온다. 이러한 세포주기의 억제가 일어나는 이유는 TIS21이 cyclin B1 대신 Cdc2에 결합하여 cyclin B1과 Cdc2의 결합을 방해 하며 cyclin A, cyclin B1의 분해를 억제하기 때문이다. 그 결과 세포주기의 유사분열 단계를 정상적으로 수행하지 못하여 세포가 죽게 된다 (Lim et al. 1998). 이러한 세포의 죽음을 유도하고 세포주기를
억제한다는 보고들은 TIS21이 암 억제 유전자로써 역할을 한다는 주장을 뒷받침 해주고 있다.
(5) TIS21의 ROS 생성 감소 기능
정상 세포에 비해 암 세포에서 많은 양이 발견되는 ROS는 암 세포의 생성과 증식에 중요한 역할을 한다. TIS21의 중요한 기능 중 하나는 이러한 ROS의 생성을 조절한다는 것이다. Hela (cervical cancer) 세포에서 관찰한 결과를 보면 TIS21 과발현시 reactive oxygen species (ROS)의 생성 감소가 관찰 되는데, 그 이유는 phosphatidylinositide 3-kinases (PI3K)에 의해서 Akt1의 Ser 473 잔기가 인산화 되고 그로 인해 Akt1이 활성화 되며 활성화된 Akt1은 nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) 의 저해제인 nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor, alpha (IκBα)의 분해를 촉진시킨다. 그 결과 NF-κB의 활성은 증가되고 manganese superoxide dismutase (MnSOD)의 두 번째 인트론에 위치하는 enhancer element에 결합하여 발현을 증가시킨다. 이렇게 늘어난 MnSOD는 ROS를 분해 하게 된다 (Sundaramoorthy S. et al. 2013).
(6) TIS21의 세포 전이 감소 기능
암 세포가 증식 하기 위해서는 물리적 장벽을 뚫는 전이 단계가 꼭 필요한데 TIS21은 세포의 전이 현상도 조절한다. Protein tyrosine kinase인 Src는 다른 단백질의 특별한 tyrosine 잔기를 인산화 시키는 단백질로 활성이 증가될 때 암
발생을 증가시킨다는 보고가 있으며 (Wheeler DL et al. 2009) 세포 골격을 조절하여 세포의 모양을 결정하고 세포 부착을 조절하며 세포의 이동과 전이에 관여하는 등 많은 역할을 한다 (Thomas, S. M and Brugge, J. S. 1997). Src의 활성화에는 Try527 잔기가 중요한 역할을 하는데, Try527 잔기가 Src의 SH2 domain과 결합하여 있으면 비활성 상태로 유지된다. 그러나 Try527 잔기가 protein tyrosine phosphatase (PTPs)에 의해서 탈인산화 되게 되면 SH2 domain과 떨어지게 되고 Src는 활성 상태를 띄게 된다. 이렇게 활성 상태가 되면 Tyr416 잔기도 자동 인산화가 되어 Src의 활성도는 더욱더 증가된다 (Giannoni et al. 2010). 활성도 증가의 마지막 단계로써 ROS에 의한 산화 상태의 환경이 필요하다. 그러나 TIS21에 의해서 ROS의 발현이 감소되면 Src의 활성을 완벽하게 마무리 하지 못하여 세포의 이동과 전이가 감소된다는 보고가 있다.
또한 MDA-MB-231 세포에서의 실험 결과를 보면 TIS21은 invadopodia의 형성을 감소시킨다. invadopodia는 암 세포가 이동하거나 전이 하는데 사용되는 세포 돌기로써 actin 조립 단백질, 막수송 단백질, 막관통 단백질, 세포골격 재배치에 관련된 단백질들을 많이 포함하고 있으며 세포 외 기질을 분해하고 세포골격을 재배치한다. 이러한 현상은 중요한 요소로써 암 세포의 전이를 위해 선행 되어야 한다 (Yamaguchi et al. 2005a, b). 기전이 밝혀져 있지 않지만 ROS는 invadopodia의 형성에 중요한 역할을 한다 (Diazet al. 2009). 그러나 TIS21에 의해서 ROS 생성이 감소되며 그 결과 invadopodia의 형성도 감소된다. 그로 인해 암 세포의 이동과 전이 현상도 줄어들게 된다 (Choi and Lim. 2013).
B. MMPs의 특징과 암 전이 과정에서의 역할
(1) MMPs의 특징
MMPs는 zinc-dependent endopeptidase 군에 속하며 1960년대 초반에 발견 되었다 (Gross and Lapiere 1962). 사람에게서 발현되는 MMPs는 구조적 특징에 따라 23 가지로 나누며 대부분의 MMPs는 공통적으로 “minimal domain”을 가지고 있다. Minimal domain에는 3가지의 domain이 포함되어 있는데 1) 소포체 안으로 들어갈 때 signal peptidase에 의해 잘리게 되는 pre domain과 2) thiol 그룹이 결합 되어있고 furin과 같은 convertase에 인식되어 잘리는 부분을 가지고 있는 pro domain, 3) 아연 결합 부위를 가지고 있고 효소 활성을 띄는 catalytic domain 이다. MMPs는 pro domain의 thiol기와 catalytic domain의 아연이 결합돼있는 비활성 상태로 생성이 되며 convertase에 의해 pro domain과 catalytic domain의 연결이 잘리게 되면 비로써 활성을 가지게 된다 (Sternlicht and Werb 2001).
(2) MMPs의 활성 조절
MMPs가 활성 상태로 전환되는 과정은 여러 가지 방법으로 조절 된다. 생체 내에 존재하는 proteinase inhibitor인 α1-chymotrypsin (α1-CT), α1-proteinase (α1-PI), α2-antiplasmin (α2-AP)들이 plasmin, furin 같은 convertase들을 억제하여 MMPs의 활성화를 저해 하지만 이미 활성화된 MMP-1, 2, 3 등에 의해 proteinase inhibitor들이 분해되면서 다시 정상적인 활성화 작용이 일어난다 (Lijnen et al.
2001). 먼저 활성화된 MMPs는 convertase의 역할을 하여 비활성 상태의 MMPs를 활성화 시키는 긍정적인 역할을 한다. 예를 들어 먼저 활성화된 MMP-3, 10은 비활성 상태인 MMP-1을 활성화 시키고 MMP-14는 MMP-2, 14를 활성화 시키며 MMP-3는 MMP-7을 활성화 시킨다. 반면에 먼저 활성화된 MMPs는 활성화에 부정적인 역할을 하기도 하는데 MMP-2, 3, 7, 9, 12가 convertase의 역할을 하는 plasmin의 전구체인 plasminogen을 분해하여 MMP의 활성화를 억제 시키기도 한다 (Parks et al. 2004). 또한 MMPs의 활성화는 ROS에 의해서 조절 되기도 한다. 암 세포 주변에서 흔히 발견되는 neutrophil, macrophage의 염증 반응에 의해서 다량의 ROS가 생성 되는데 이러한 ROS에 의해서 MMPs의 pro domain에 있는 cysteine 잔기가 산화되어 MMPs의 활성화를 촉진 시킨다. Tissue inhibitor of metalloproteinases (TIMPs)는 생체 내에서 생성되는 MMPs의 저해제로써 TIMP-1, 2, 3, 4 네 가지가 알려져 있다. 이들은 MMPs와 비공유 결합을 통해 1:1 복합체를 형성함으로써 MMPs의 분해를 촉진시켜 활성을 억제하게 된다 (Douglas et al. 1997).
(3) MMP의 성장 신호에 관한 기능
조절되지 않는 과다증식은 암 세포의 일반적인 특징이다. 이러한 과다 증식에는 transforming growth factor β (TGF-β)가 중요한 역할을 한다. 일반적인 TGF-β의 기능은 세포주기를 G1 단계에서 멈추게 하여 세포의 증식을 억제하고 세포의 분화를 촉진 하거나 세포 사멸을 유도한다. 그러나 암 세포화 되면 TGF-β 신호 체계에 변형이 생겨 세포주기를 조절하지 못하고 면역 감시를 피하는
기능을 하는 등, 암 활성인자로써 기능을 하여 암 세포의 침투, 전이를 증가시킨다 (Massague. 2008). 이러한 작용을 하는 TGF-β를 MMPs가 CD44 표면 receptor에 결합한 후 비활성 상태에서 활성상태로 전환시켜주게 된다 (Yu and Stamenkovic. 2000).
(4) MMPs의 세포사멸 억제 기능
암 세포는 과다 증식을 위하여 세포 사멸을 억제하는 행동을 보이는데 이러한 기작에도 MMPs가 관여를 한다. 세포 사멸을 직접적으로 유도하는 신호 체계로는 tumour necrosis factor (TNF)와 Fas가 있다. Fas 신호 체계는 Fas receptor가 Fas ligand에 결합하면서 시작된다. Fas receptor와 Fas ligand가 복합체를 이루면 FADD로 신호가 전달이 되고 caspase-8을 활성화 시키고 caspase-8은 다른 caspase들을 활성화 시킴으로써 세포 사멸을 유도한다. 하지만 신호 체계의 시작점이 되는 Fas receptor와 Fas ligand를 MMPs가 분해함으로써 세포 사멸을 피하게 된다. 이러한 MMPs에 의한 세포 사멸 억제는 항암 화학요법의 효과를 감소시키는 결과도 가져온다 (Liu et al. 2008). (5) MMPs의 암 전이에 관한 기능 MMPs는 관절염, 골다공증, 신장염 등의 질병에 관련이 있다는 보고가 있으나 가장 주목하고 있는 기능은 암 세포의 전이에 관여하는 것이다. 악성 암의 가장 큰 특징은 다른 부위로 전이하는 성격이 강하다는 것인데 성공적인 전이를
위해서는 연속적인 과정을 거치게 된다. 이러한 일련의 연속적인 과정에서 MMPs가 많은 역할을 하게 된다. ① 물리적 장벽 분해 우선 암 세포가 전이를 하기 위해선 초기 종양으로부터 떨어져 나와 주위의 물리적 장벽을 통과해야 한다. 그러기 위해선 세포 외 기질을 분해 하거나 재배치 해야 한다. 이 과정에서 MMP-1, 2, 7, 13, 14는 세포 외 기질을 분해하는 역할을 하고 세포간 부착에 관여하는 E-cadherin의 발현도 감소시킨다 (Behren et al. 1989). 뼈 또한 전이 현상이 많이 일어나는 지역 중 하나인데, 설치류 전립선 암 모델에서 관찰한 실험 결과를 보면 용골세포에서 생성된 MMP-7이 골 분해를 일으키고 골 전이를 일으킨다는 보고도 있다 (Lynch et al. 2005). 기저막을 뚫고 나온 암 세포들은 혈관이나 림프관으로 들어간 후 (intravasation) 이동하다 다른 목표 조직으로 침출 (extravasation)하여 새로운 조직에서 증식하여 2차 종양을 형성하게 된다. ② 혈관 신생성 암 세포의 효과적인 증식을 위해선 필요한 영양의 공급이 원활하게 이루어 져야 하기 때문에 혈관 신생성 (angiogenesis)을 필요로 하게 된다. 이 단계에 관련 있는 MMPs는 MMP-2, 9, 14이다. 이것들 중 가장 큰 역할을 하는 MMP-9은 염증 세포에서 생성되어 vascular endothelial growth factor (VEGF)의 활성을
조절함으로써 혈관 신생성을 시작하게 된다 (littlepage et al. 2010). Mouse 모델의 glioblastoma에서는 hypoxia inducible factor-1α (HIF1-α)가 CD45-positive myeloid 세포를 암 세포 주위로 끌어들여 신 혈관생성 시작에 꼭 필요한 MMP-9 활성화를 이루게 된다. Neutrophil에서 생성된 MMP-9은 억제제인 TIMP-1과 결합을 하지 않는 특이한 경우를 보이는데 이러한 현상 때문에 혈관 신생성을 훨씬 더 빨리 일으킨다는 보고가 있다 (Ardi et al. 2007). ③ Metastatic niche 또한 암 세포가 새로운 조직에서 정착 하기 위해선 정착할 조직의 환경을 적합하게 해줘야 한다. 암 세포가 새로이 정착할 장소를 “metastatic niche” 라고 하며 metastatic niche를 형성하는데 MMPs와 다른 proteinases 들이 중요한 역할을 하게 된다. Metastatic niche 지역에 있는 섬유아세포에서 생성된 embryonic-type fibronectin에 의해서 metastatic niche 형성이 준비가 되고 1차 암 세포에서 분비된 가용성 인자 (soluble factor)들이 metastatic niche의 형성을 시작하게 된다. 최근 연구에 의하면 1차 암세포에서 분출되는 가용성 인자들에 대해서 좀더 자세하게 밝혀져 있다. 예를 들어 VEGFA, TGF-β, TNF-α 같은 가용성 인자들이 S100 chemokines의 발현을 촉진 시키고 S100 chemokines은 metastatic niche로 골수 세포의 이동을 증가 시킨다. 이렇게 이동한 골수 세포는 NF-κB를 활성 시키고 stromal cell에서 MMPs의 생산을 증가 시키며 증가된 MMPs는 세포 외 기질을 분해하고 성장인자를 분비하는 등 metastatic niche의 환경을 적합하게 바꾸게 된다. MMPs중 MMP-9이 VEGF의 분비를 촉진 시켜 혈관 신생성을 증가시키고
Kit-ligand를 분비해 골수로부터 stem cell, progenitor cell을 끌어드려 정착하기 알맞은 환경을 만드는 등 가장 중요한 역할을 하게 된다 (Kaplan et al. 2005).
이렇듯 위에서 살펴본 암 억제 유전자의 역할을 하는 TIS21과 암 발생, 전이에 중요한 역할을 하는 MMPs와의 상관 관계를 밝히고자 실험을 진행 하였다. 우선 MDA-MB-231 세포와 HDF 세포에 아데노바이러스 TIS21을 과발현 시켜서 wound healing 분석을 통해 세포의 이동 정도가 감소하는 것을 관찰 하였다. 또한 TIS21 과발현 시 MMP-1, 2, 3, 9, 10, 14, 15, 19의 mRNA 발현 감소와 MMP-9, 10의 단백질 활성의 감소를 각각 RT-PCR, zymography로 관찰하였다. MMPs의 mRNA 발현 감소의 원인을 찾기 위해 MMPs 유전자의 promoter 지역에 결합하는 전사인자 중 c-Fos, PEA3, TCF4의 발현량을 관찰해본 결과 c-Fos와 PEA3가 감소하는 것을 관찰하였다. TIS21이 MMPs에 영향을 미치는 정확한 기전은 알아내지 못하였으나 c-Fos, PEA3 전사인자의 발현이 TIS21에 의해 감소되는 것을 관찰하였고 그 결과 MMPs의 mRNA 발현 정도가 감소되는 것을 관찰하였다. 또한 MMP-9, 10의 단백질 활성도 감소와 세포의 이동성 감소도 관찰하였다. 이러한 결과를 바탕으로 TIS21을 MMPs의 발현, 활성 저해제로써 가능성을 제시하며 앞으로의 실험을 통해서 정확한 기전을 밝혀낸다면 의미 있는 발견이 될 것이다.
그림 2. MMPs의 다양한 암 발생에 관한 기능.
Ц. 재료 및 방법
A. 세포배양
MDA-MB-231은 10% fetal bovine serum (FBS, GibcoBRL, carlsbed, CA) 와 1% antibiotics (GibcoBRL)가 첨가된 Rosewell Park Memorial Institute (RPMI 1640, GibcoBRL) 배지를 이용하여 37oC, 5% 이산화탄소 조건에서 배양하였으며 HDF는
모두 같은 조건에서 Dulbecco's Modified Eagle Medium (DMEM, GibcoBRL) 배지를 이용하여 배양하였다.
B. TIS21 아데노바이러스 생산
TIS21 cDNA를 cytomegalovirus (CMV) enhancer and chicken β-actin promoter를 가지고 E1, E3 가 제거된 adenoviral vectors에 삽입하였다. TIS21 adenovirus를 293인간 신장 상피세포에서 증대시켰고 virus입자는 0.45 ㎛ 필터로 정제하였다. 또한 대조군으로 사용하기 위해 bacterial β-galactosidase (LacZ)adenovirus도 같은 방법으로 준비하였다.
C. RT-PCR
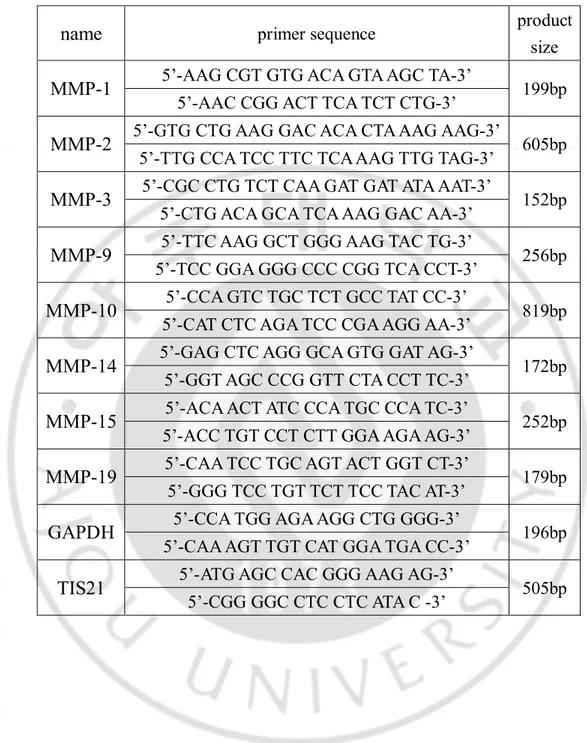
MDA-MB-231, HDF 세포를 각각 60 mm plate 2개씩 60% 정도 배양 후 Ad-TIS21
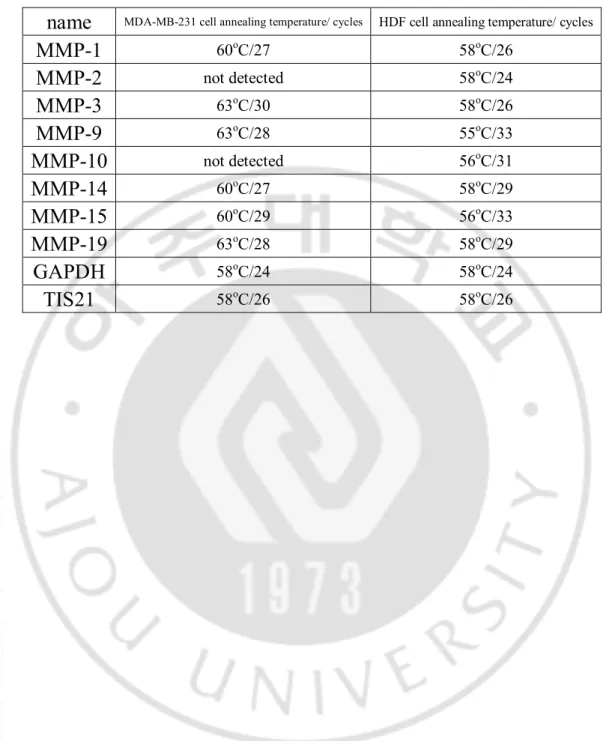
또는 Ad-LacZ를 100moi씩 감염 시킨다. 다음날 pellet 을 모아 RNeasy Mini Kit (QIAGEN, Hilden, Germany) 이용하여 RNA 추출하고 cDNA synthesis Kit (Nanohelix, daejeon, Korea) 이용하여 cDNA를 합성한다. 합성한 cDNA를 각각 primer 이용하여 (표1) 다양한 조건으로(표2) 증폭하였다. PCR product 는 2% agarose gel 에 전기영동 하여 확인한 후 Image J software를 이용하여 수치화 하였다.
D. Gelatin zymography 분석
8x104 개의 MDA-MB-231, HDF 세포를 24well 에 60% 정도 배양한 후에 각각
Ad-LacZ 또는 Ad-TIS21으로 100moi씩 감염 시킨 뒤 5시간 후 혈청이 없는 배지로 교환해 준 후 24 시간 동안 배양하고 배지의 상등액을 얻어내어 zymography에 쓰이는 sample buffer [2% (w/v) SDS, 60 mM Tris-HCl (pH 6.8), 5% (v/v)glycerol, 0.05% (w/v) bromophenol blue]를 섞어서, 끓이지 않고 비 환원 조건에 10% sodium dodecyl sulfate polyacrylamide gel (SDS-PAGE)에 loading 한다. 젤에는 screening 하고자 하는 MMPs가 공통적으로 이용하는 기질인 0.1% gelatin (Sigma, St. Louis, MO) 포함되어 있으며 SDS는 넣지 않는다. 얼음 속에 전기 영동 세트를 넣어 온도가 상승하지 않게 20mA/110 V로 100분간 전기 영동 하였다.
마찬가지로 전기 영동 한 gel 을 Enzyme renaturing buffer [2.5%(v/v)Triton X-100, 50 mM Tris-HCl (pH 7.5), 200mM NaCl, 5mM CaCl2, 0.02%(w/v)NaN3]용액에 3oC, 15분씩
4번, 용액을 교체하며 부드럽게 흔들어 주어 MMPs를 renaturation 시킨다. 그 후 Developing buffer(Enzyme renaturing buffer에서 Triton X-100만 빠짐)용액에서 37oC,
24시간 동안 부드럽게 흔들어 주며 반응시킨다. 반응시킨 젤을 Coomassie brilliant blue 로 염색한 후 28%(v/v) methanol, 0.01%(v/v) acetic acid 용액을 이용해 탈색시킨다.
E. Wound healing 분석
3.0x105 개의 MDA-MB-231, HDF 세포를 6well plate에 70% 정도 배양 후
12시간 후에 Ad-TIS21, As-LacZ를 100moi씩 각각 감염 시킨다. 5시간 후 200λ tip을 이용하여 직선으로 그어 상처를 낸 후 PBS washing 하고 RPMI, DMEM 배지로 각각 교환한다. 24시간, 48시간 사진 촬영하고 상처의 면적의 변화를 비교한다.
Ш. 결과
A. TIS21 과발현에 의한 MDA-MB-231, HDF 세포의 이동성 억제. 이전에 보고된 여러 논문들에서 TIS21은 암 억제 유전자로서 기능을 수행한다고 많이 알려져 있으며 특히 TIS21 발현 억제시 암 세포의 이동과 전이가 증가한다는 여러 보고들이 있다. 이러한 결과들을 토대로 TIS21이 세포의 이동과 전이에 관련이 있을 거라 생각하고 MDA-MB-231, HDF 세포의 이동에도 어떠한 영향이 있는지 확인을 위해 TIS21을 과발현 시켜서 wound healing 분석을 실시하였다. 실험결과 TIS21에 의해 MDA-MB-231, HDF 세포 역시 모두 이동이 감소되는 것을 관찰 함으로써 TIS21이 MDA-MB-231 세포와 HDF 세포의 이동에 관련이 있다는 것을 밝혀내었다.
C
그림 3. TIS21 과발현에 의한 MDA-MB-231, HDF 세포의 이동성 억제
(A) Wound healing 분석 실험 과정. (B) 상처 낸 후 세포 이동 관찰 실험 (24시간, 48시간) (C) 그림 1- B의 그래프 표현
B. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs의 mRNA 발현 억제.
TIS21과 MMPs의 상관 관계를 알아보기 위해 TIS21에 의해서 MMPs의 mRNA 발현량이 어떻게 변하는지 관찰 하였다. TIS21을 과발현 시킨 후 다양한 MMPs들의 mRNA 발현을 RT-PCR로 확인한 결과, 발현이 확인되지 않은 MMP-2, 10을 제외하고 관찰한 MMP-1, 3, 9, 14, 15, 19의 mRNA 발현이 TIS21에 의해서 감소하는 것을 관찰하였다. 이 결과로 TIS21이 전사 단계에서 MMPs를 조절하는 것이 확인되었다. A B
D
그림 4. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs의 mRNA 발현 억제
(A) TIS21을 과발현 시키는 실험 과정. (B) TIS21 과발현을 통한 TIS21 발현 관찰. (C) TIS21 과발현에 의한 MMPs의 mRNA 발현 변화. (D) 그림 2-C의 그래프 표현.
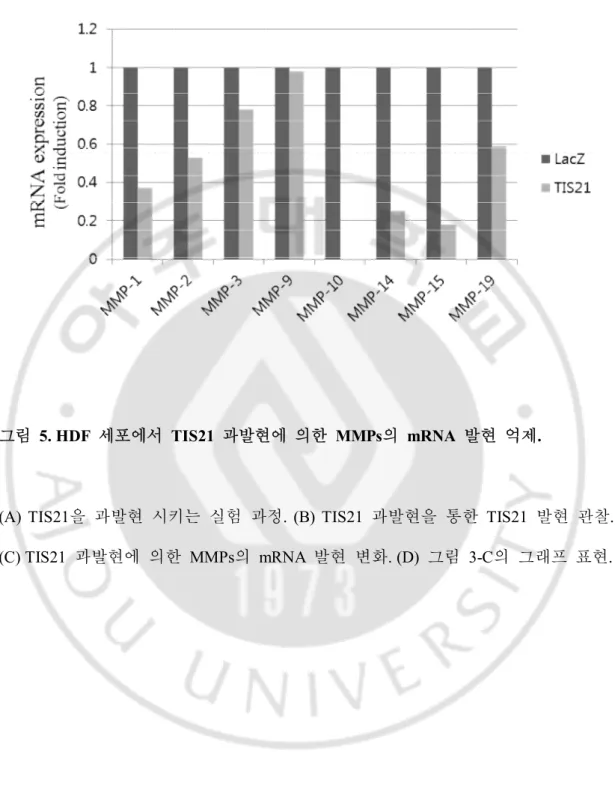
C. HDF 세포에서 TIS21 과발현에 의한 MMPs의 mRNA 발현 억제.
MDA-MB-231 세포에서 관찰된 TIS21에 의한 MMPs의 mRNA 발현 감소 현상이 암 세포가 아닌 일반 세포에서도 일어나는지 확인하기 위해 HDF 세포를 이용하여 같은 실험을 반복하였다. 그 결과 HDF 세포에서도 별 차이가 없는 MMP-9을 제외하고 관찰한 MMP-1, 2, 3, 10, 14, 15, 19의 mRNA 발현이 감소하는 것을 확인하였다. A B
D
그림 5. HDF 세포에서 TIS21 과발현에 의한 MMPs의 mRNA 발현 억제.
(A) TIS21을 과발현 시키는 실험 과정. (B) TIS21 과발현을 통한 TIS21 발현 관찰. (C) TIS21 과발현에 의한 MMPs의 mRNA 발현 변화. (D) 그림 3-C의 그래프 표현.
표 1. MMPs의 mRNA 발현 측정 위한 primers.
name
primer sequence
product
size
MMP-1
5’-AAG CGT GTG ACA GTA AGC TA-3’
199bp
5’-AAC CGG ACT TCA TCT CTG-3’
MMP-2
5’-GTG CTG AAG GAC ACA CTA AAG AAG-3’
605bp
5’-TTG CCA TCC TTC TCA AAG TTG TAG-3’
MMP-3
5’-CGC CTG TCT CAA GAT GAT ATA AAT-3’
152bp
5’-CTG ACA GCA TCA AAG GAC AA-3’
MMP-9
5’-TTC AAG GCT GGG AAG TAC TG-3’
256bp
5’-TCC GGA GGG CCC CGG TCA CCT-3’
MMP-10
5’-CCA GTC TGC TCT GCC TAT CC-3’
819bp
5’-CAT CTC AGA TCC CGA AGG AA-3’
MMP-14
5’-GAG CTC AGG GCA GTG GAT AG-3’
172bp
5’-GGT AGC CCG GTT CTA CCT TC-3’
MMP-15
5’-ACA ACT ATC CCA TGC CCA TC-3’
252bp
5’-ACC TGT CCT CTT GGA AGA AG-3’
MMP-19
5’-CAA TCC TGC AGT ACT GGT CT-3’
179bp
5’-GGG TCC TGT TCT TCC TAC AT-3’
GAPDH
5’-CCA TGG AGA AGG CTG GGG-3’
196bp
5’-CAA AGT TGT CAT GGA TGA CC-3’
TIS21
5’-ATG AGC CAC GGG AAG AG-3’
505bp
표 2. MMPs의 mRNA 발현 측정 위한 RT-PCR 조건.
name
MDA-MB-231 cell annealing temperature/ cycles HDF cell annealing temperature/ cyclesMMP-1
60oC/27 58oC/26MMP-2
not detected 58oC/24MMP-3
63oC/30 58oC/26MMP-9
63oC/28 55oC/33MMP-10
not detected 56oC/31MMP-14
60oC/27 58oC/29MMP-15
60oC/29 56oC/33MMP-19
63oC/28 58oC/29GAPDH
58oC/24 58oC/24TIS21
58oC/26 58oC/26D. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs 활성 억제.
MMPs는 비활성 상태인 proform으로 생성되어 convertase에 의해 pro domain 부분이 잘리면 MMPs 기능을 할 수 있는 활성 상태로 변하게 된다. MMPs의 기능 정도를 결정 짓는 중요한 단백질의 활성도 측정을 위해서 zymography를 실시하였다. MMPs는 기질 특이성이 비교적 광범위하여 기질들을 서로 중복되게 사용하기 때문에 관찰하려고 하는 MMPs가 공통으로 사용하는 기질인 gelatin을 이용하여 gelatin zymography를 실시하였다. 그 결과 단백질 크기로 유추해 봤을 때 가장 활성도가 큰 MMP-3, 9의 밴드가 zymography에서 확인이 됐으며 MMP-9 의 단백질 활성도는 크게 감소했으나 MMP-3의 단백질 활성도는 크게 변화가 없는 것을 확인하였다. MMP-3의 mRNA 발현 정도는 TIS21에 의해서 감소 되었으나 단백질 활성도의 변화는 없었다. mRNA가 발현된 후에 번역단계를 거처 단백질이 되고 여러 기작을 통해서 활성화가 되는 만큼 mRNA 발현 변화량과 단백질 활성 변화량이 일치하지 않는다. 이 실험 결과 MDA-MB-231 세포에서는 TIS21에 의해 MMP-9의 단백질 활성도가 감소되며 MMP-9의 밴드가 가장 두껍게 나타난 것으로 보아 MDA-MB-231 세포에서는 MMP-9의 기능이 가장 강할 것이라 판단된다.
A B
C
그림 6. MDA-MB-231 세포에서 TIS21 과발현에 의한 MMPs 활성 억제.
(A) TIS21을 과발현 시키는 실험의 과정. (B) TIS21 과발현을 통한 TIS21 발현 관찰. (C) Zymography를 이용한 MMPs의 활성도 측정.
E. HDF 세포에서 TIS21 과발현에 의한 MMPs 활성 억제. HDF 세포에서도 마찬가지로 gelatin zymography를 이용하여 MMPs의 단백질 활성도를 측정해 보았다. 단백질 크기로 유추해 봤을 때 MMP-10이 TIS21에 의해서 단백질 활성도가 감소되는 것을 관찰하였다. 하지만 zymography의 밴드가 옅은 것으로 보아 정상 세포인 HDF 세포에서는 평균적으로 MMPs의 활성도가 적은 것으로 보인다. A B C
그림 7. HDF 세포에서 TIS21 과발현에 의한 MMPs 활성 억제.
(A) TIS21을 과발현 시키는 실험 과정. (B) TIS21 과발현을 통한 TIS21 발현 관찰. (C) Zymography를 이용한 MMPs의 활성도 측정. F. TIS21 과발현에 의한 MMPs 발현을 조절하는 전사인자들의 발현 변화. 앞 실험에서 TIS21 과발현에 의해 MMPs의 mRNA 발현과 단백질의 활성도가 감소하는 것을 관찰하였고 이러한 현상의 원인을 밝히기 위해 TIS21에 의해서 MMPs 유전자의 promoter 지역에 결합하는 전사인자의 발현이 어떻게 변화하는지 관찰해 보았다. MMPs 유전자의 promoter 지역에는 다양한 전사인자들이 결합을 하게 되는데, 그 중에 다양한 MMPs 유전자의 promoter 지역에 공통적으로 결합하는 전사인자인 c-Fos, transcription factor 4 (TCF4), ETS translocation variant 4 (PEA3)를 이용하여 실험을 진행하였다. c-Fos 는 MMP-1, 3, 9, 10, 19의 promoter 지역에 결합하며, TCF4는 MMP-1, 3, 9, 10, 14, 19; PEA3는 MMP-1, 2, 3, 9, 10, 14, 19의 promoter 지역에 결합한다 (Marchenko GN et al. 2002; Marchenko GN et al. 2003; Overall CM and López-Otín C. 2002) (그림 8-A). 각 전사인자의 mRNA 발현 정도를 분석한 결과 MDA-MB-231 세포에서 TIS21의 과발현에 의한 PEA3의 발현에는 변화가 없고 TCF4는 관찰할 수 없었으며 c-Fos 만 발현의 감소를 확인하였다. HDF 세포에서는 TIS21의 과발현에 의해 c-Fos, PEA3의 발현
감소를 확인하였으나 TCF4의 발현은 변화가 없었다.
B C
D
F
그림 8. TIS21 과발현에 의한 MMPs 발현을 조절하는 전사인자들의 발현 변화
(A) MMPs 유전자의 promoter 지역에 결합하는 transcription factors. (B) TIS21을 과 발현 시키는 실험 과정. (C) MDA-MB-231 세포에서 TIS21 과발현을 통한 TIS21 발현 관찰. (D) HDF 세포에서 TIS21 과발현을 통한 TIS21 발현 관찰. (E) TIS21 과발현에 의한 전사인자의 mRNA 발현 변화. (F) 그림 6-E의 그래프 표현.
표 3. 전사인자들의 발현 측정 primers.
name
primer sequence
product
size
c-Fos
5′-TTC CTG GCA ATA GTG TGT TC-3′
173bp
5′-TTC AGA CCA CCT CAA CAA TG-3′
TCF4
5’-CCA GGA ACC CTT TCG CCA AC-3’
198bp
5’-TAG CCT GGC GAG TCC CTA TT-3’
PEA3
5'-GGA CTT CGC CTA CGA CTC AG-3
188bp
5'-CGA CCC CTT CCT GCT TGA TGT-3
표 4. 전사인자들의 발현 측정 RT-PCR 조건.
name
MB-231 cell Annealing temperature/cycles
HDF cell Annealing temperature/ cycles
c-Fos
54oC/30 54oC/34PEA3
54oC/28 54oC/34TCF4
not detected 54oC/30Ⅳ
. 고찰
MMPs는 세포 외 기질 분해에 관여하는 단백질 분해 효소로써 정상적인 발생과정, 혈관생성 및 상처재생 등에 관계가 있으며, 관절염, 골다공증 등의 질병에 관여하는 것으로 알려져 있다 (Liotta and Stetler-stevenson 1991; Liotta and Stetler-stevenson. 1990; Matrisian et al., 1990; Liotta et al., Bonfil et al. 1989; Collier et al. 1988). 특히 암 세포의 전이나 비정상적인 혈관 생성 등 tumorigenesis에 중요한 역할을 하기 때문에 학계에서 많은 주목을 받고 있다.
Tissue inhibitor of metalloproteinases (TIMPs)는 생체 내에서 생성되는 MMPs의 저해제로써 TIMP-1, 2, 3, 4 네 가지가 알려져 있다. 이들의 아미노산 배열은 50%정도 homology를 가지며 분자량은 21~28.5 kDa 정도이다. MMPs와 비공유 결합을 통해 1:1 복합체를 형성함으로써 MMPs의 활성을 억제하게 된다 (Douglas et al. 1997). 재조합 TIMPs를 만들어 동물 실험을 진행하였으나 고분자 단백질 특성으로 인한 짧은 half-life와 antigenicity로 인해 어려움을 겪고 있다 (Brown, P. E. 1997). 이러한 문제점을 해결하기 위해 화학 합성에 의한 저분자 저해제 개발도 진행이 되었다. 저분자 저해제의 대부분은 MMPs의 기질 결합 부위의 아미노산 배열을 기초로 한 peptide 골격에 hydroxamic acid나 thiol등의 zinc chelating ligand를 붙인 peptide 유도체이다 (Darlak et. al. 1990). 그러나 이러한 저분자 MMPs 저해제도 MMPs에 대한 선택성이 떨어지기 때문에 부작용이 나타나고 있다 (Davidson 1996). 그리하여 새로운 MMPs의 저해제에 대한
필요성을 인식하고 TIS21과 MMPs의 상관 관계를 밝혀 내고자 실험을 진행하였다.
AD-TIS21을 이용해 MDA-MB-231, HDF 세포에서 TIS21을 과발현 시켜 wound healing 분석을 통해 세포의 이동이 감소하는 현상을 확인하였다. 앞으로의 실험을 통해서 TIS21이 세포의 이동 감소 뿐만 아니라 세포의 전이 감소에도 영향을 미친다는 것을 확인해야 할 것이다. MMPs의 mRNA 발현을 RT-PCR로 확인해본 결과, MDA-MA-231 cell에서는 MMP-1, 3, 9, 14, 15, 19의 mRNA 발현 감소를 확인할 수가 있었으나 MMP-2, 10의 발현은 확인할 수 가 없었다. HDF 세포에서는 1, 2, 3, 10, 14, 15, 19의 mRNA 발현 감소를 확인하였으나 MMP-9의 mRNA 발현의 변화는 없었다. 감소 원인을 규명하기 위에 다양한 MMPs 유전자의 promoter 지역에 공통적으로 결합하는 전사인자인 c-Fos, TCF4, PEA3를 이용하여 실험을 진행하였다 (c-Fos 는 MMP-1, 3, 9, 10, 19, TCF4는 MMP-1, 3, 9, 10, 14, 19; PEA3는 MMP-1, 2, 3, 9, 10, 14, 19 의 promoter 지역에 결합한다) (Marchenko GN et al. 2002; Marchenko GN et al., 2003; Overall CM and López-Otín C, 2002). 그 결과 MDA-MB-231 세포에서는 PEA3의 변화는 없고 TCF4는 관찰할 수 없었으며 c-Fos 만 감소하는걸 확인하였고, HDF 세포에서는 c-c-Fos, PEA3의 감소를
확인하였으나 TCF4의 변화는 없었다. 이 결과 TIS21은 MDA-MB-231 세포에서는 c-Fos 전사 인자의 발현을 억제시켜 MMPs의 mRNA 발현을 감소시키고 HDF 세포에서는 c-Fos, PEA3 전사 인자의 발현을 억제시켜 MMPs의 mRNA 발현을 감소 시키는 것으로 생각되나 앞으로의 실험을 통해 정확한 기전을 밝혀내야 한다. 또한 MMPs 단백질의 활성도를 측정하기 위해 확인 하고자 하는 MMPs가
공통으로 이용하는 기질인 gelatin을 이용하여 zymography를 실시하였는데 MDA-MB-231 세포에서는 MMP-9의 단백질 활성도 감소와 HDF 세포에서는 MMP-10의 단백질 활성도 감소를 관찰하였다. 이것으로 보아 TIS21은 MMPs의 mRNA 발현 조절뿐만 아니라 단백질 활성도 에도 영향을 미친다는 결과를 얻었다. 정확한 활성도 감소 기전은 밝혀내지 못하였지만 가능성 중 하나로써 TIS21에 의한 ROS 감소를 꼽을 수 있다. 이미 ROS에 의해서 MMPs의 활성도가 증가된다는 보고가 있고 (Kai K. et al. 2010) 또한 TIS21은 MnSOD의 발현을 증가시켜 ROS의 분해를 촉진시킨다는 보고가 있다 (Sundaramoorthy S. et al. 2013). 앞으로의 실험을 통하여 TIS21에 의해 감소된 ROS에 의해 MMPs의 활성화가 감소된다는 기전을 밝혀 낸다면 의미 있고 새로운 발견이 될 것이다. TIS21에 의한 MMPs mRNA 발현 감소 원인에 가능성 중 한가지를 제시하였으나 정확한 기전을 밝혀내지 못했고 MMPs의 단백질 활성을 조절하는 기전을 아직 규명하지는 못했다. 하지만 다양한 MMPs들의 screening을 통해 TIS21이 MMPs의 mRNA 발현과 단백질 활성도를 조절한다는 것을 알게 된 것이 의미 있는 발견이라고 생각된다. 앞으로는 TIS21에 의해서 유도되는 MMPs의 mRNA 발현 감소, 단백질 활성 감소의 원인이 되는 기전을 밝혀내기 위한 연구를 계속 진행해야 할 것이라고 생각한다.
Ⅴ
. 결론
본 연구를 통해 TIS21 과발현 시 MDA-MB-231 세포에서 MMP-1, 3, 9, 14, 19의 mRNA 발현 감소가 관찰됐으며 HDF 세포에서는 MMP-1, 2, 3, 9, 10, 15, 19의 mRNA 발현 감소가 관찰됐다. 또한 MMP-9, 10의 단백질 활성도가 TIS21 에 의해서 감소하는 것을 관찰하였고 세포 이동도 감소하는 것을 관찰하였다. MDA-MB-231 세포에서는 MMP-1, 3, 9, 10, 19를 조절하는 c-Fos 전사인자가 TIS21에 의해 감소됐으며, HDF 세포에서는 c-Fos 와 MMP-1, 2, 3, 9, 10, 14, 19를 조절하는 PEA3 전사인자의 감소를 관찰하였다. 아직까지 정확한 기전은 밝혀내지 못했으나 TIS21에 의해서 MMPs의 mRNA 발현과 단백질 활성도가 감소되고 MDA-MB-231, HDF 세포의 이동성이 감소 된다는 것이 의미 있는 발견이라 생각되며 계속적인 연구를 통해서 기전을 밝혀내는 것이 중요한 과제로 생각된다.참고문헌
1. Aaronson, S.A.: Growth factors and cancer. Science 254, 1146-1153. 1991
2. Alvarez, O.A., Carmichael, D.F., and DeClerck, Y.A: Inhibition of collagenolytic activity and metastasis of tumor cells by a recombinant human tissue inhibitor of metalloproteinases.
J. Natl. Cancer Inst. 82 589-595. 1990
3. Atfi A, Drobetsky E, Boissonneault M, Chapdelaine A, Chevalier S: Transforming growth factor beta down-regulates Src family protein tyrosine kinase signaling pathways. J Biol
Chem 269: 30688-30693. 1994
4. Beckett, R. P., H. Davison, A. H. Drummond, P. Huxley, and M. Whittaker: Recent advances in matrix metalloproteinase inhibitor research. Drug Discovery Today. 1: 16-26. 1996
5. Behren, J., M. M. Mareel, F. M. Van Roy, and W. Birchmeier: Dissecting tumor cell invasion: Epithelial cells acquire invasion properties after the loss of uvomorunmediated cell-cell adhesion. J. Cell. Biol. 108: 2435-2447. 1989
6. Bonfil, R.D., Reddel, R.R., Ura, H., Reich, R., Fridman, R., Harris, C.C., and Klein-Szanto, J.P: Invasive and metastatic potential of a v-Ha-ras-transformed human bronchial epithelial cell line. J. Natl. Cancer Inst. 81, 587-594. 1989
7. Borghaei RC, Rawlings PL, Jr., Javadi M, Woloshin J: NF-kappaB binds to a polymorphic repressor element in the MMP-3 promoter. Biochem Biophys Res Commun 316: 182-188. 2004
8. Bian J, Sun Y: Transcriptional activation by p53 of the human type IV collagenase (gelatinase A or matrix metalloproteinase 2) promoter. Mol Cell Biol 17: 6330-6338. 1997
9. Bradbury A, PossentiR, ShooterEM and TironeF: Molecularcloning of PC3, a putatively secreted protein whose mRNA is induced by nerve growth factor and depolarization. Proc
Natl Acad Sci U S A. 88: 3353-3357. 1991
10. Brown MT, Cooper JA: Regulation, substrates and functions of src. Biochim Biophys
Acta 1287: 121-149. 1996
11. Brown, P. E.: Matrix metalloproteinase inhibitors. Angiogenesis. 1: 142-154. 1997
12. Bussolino, F., Mantovani, A., and Persico, G: Molecular mechanisms of blood vessel formation. Trends Biochem. Sci. 22, 251-256. 1997
13. Calalb MB, Polte TR, Hanks SK: Tyrosine phosphorylation of focal adhesion kinase at sites in the catalytic domain regulates kinase activity: a role for Src family kinases. Mol Cell
Biol 15: 954-963. 1995
14. Carmichael, D.F., Sommer, A., Thompson, R.C., Anderson, D.C., Smith, C.G., Welgus, H.G., and Stricklin, G.P: Primary structure and cDNA cloning of human fibroblast
collagenase inhibitor. Proc. Natl. Acad. Sci. U S A 83, 2407-2411. 1986
15. Canzoniere D, Farioli-Vecchioli S, Conti F, Ciotti MT, Tata AM, Augusti-ToccoG, MatteiE, LakshmanaMK, KrizhanovskyV, ReevesSA, GiovannoniR, Castano F, Servadio A, Ben-Arie N and Tirone F: Dual control of neurogenesis by PC3 through cellcycle inhibition and induction of Math1. JNeurosci. 24: 3355-3369. 2004
16. Chiarugi P, Pani G, Giannoni E, Taddei L, Colavitti R, Raugei G, Symons M, Borrello S, Galeotti T, Ramponi G: Reactive oxygen species as essential mediators of cell adhesion: the oxidative inhibition of a FAK tyrosine phosphatase is required for cell adhesion. J Cell Biol 161: 933-944. 2003
17. Choi JA and Lim IK: TIS21/BTG2 inhibits invadopodia formation by downregulating reactive oxygen species level in MDA-MB-231 cells. J Cancer Res Clin Oncol. 139:1657– 1665. 2013
18. Corrente G, Guardavaccaro D and Tirone F: PC3 potentiates NGF-induced differentiation and protects neurons from apoptosis. Neuroreport. 13:417-422. 2002
19. Collier, I.E., Wilhelm, S.M., Eisen, A.Z., Marmer, B.L., Grant, G.A., Seltzer, J.L., Kronberger, A., He, C.S., Bauer, E.A., and Goldberg, G.I: H-ras oncogene-transformed human bronchial epithelial cells (TBE-1) secrete a single metalloprotease capable of degrading basement membrane collagen. J. Biol. Chem. 263, 6579-6587. 1988
20. Douglas, D. A., Y. E. Shi, and Q. A. Sang: Computational sequence analysis of tissue inhibitor of metalloproteinase family. J. Prot. Chem. 16: 237-255. 1997
21. Diaz B, Shani G, Pass I et al.: Tks5-dependent, nox-mediated generation of reactive oxygen species is necessary for invadopodia formation. Sci Signal 2:ra53. 2009
22. Duriez C, Moyret-Lalle C, Falette N, El-GhissassiF and Puisieux A: BTG2, its family anditstutor. Bull Cancer. 91: E242-253. 2004
23. el-GhissassiF, Valsesia-WittmannS, FaletteN, DuriezC, WaldenPD and Puisieux A: BTG2 (TIS21/PC3) induces neuronal differentiation and prevents apoptosis of terminally differentiated PC12 cells. Oncogene. 21: 6772-6778. 2002
24. Fletcher BS, Lim RW, Varnum BC, Kujubu DA, Koski RA and Herschman HR: Structure and expression of TIS21, a primary response gene induced by growth factors and tumor promoters. J Biol Chem. 266: 14511-14518. 1991
25. Folkman, J: Tumor angiogenesis: therapeutic implications. N. Engl. J. Med. 285, 1182-1186. 1971
26. Giannoni E, Taddei ML, Chiarugi P: Src redox regulation: again in the front line. Free
Radic Biol Med 49: 516-527. 2010
27. Hanahan, D., and Folkman, J: Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell 86, 353-364. 1996
28. Hong JW, Ryu MS, Lim IK: Phosphorylation of serine 147 of TIS21.BTG2/pc3 by p-ERK1/2 induces Pin-1 binding in cytoplasm and cell death. J Biol Chem 280: 21256-21263. 2005
29. Iacopetti P, Michelini M, Stuckmann I, Oback B, Aaku-Saraste E and Huttner WB: Expression of the antiproliferativegeneTIS21at the onset of neurogenesis identifies single neuroepithelial cells that switch from proliferative to neuron-generating division. Proc
NatlAcad SciU S A. 96: 4639-4644. 1999
30. Kaplan, R.N., Riba, R.D., Zacharoulis, S., Bramley, A.H., Vincent, L., Costa, C., MacDonald, D.D., Jin, D.K., Shido, K., Kerns, S.A., et al.: VEGFR1-positive hematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature 438, 820–827. 2005
31. Konrad MA and Zuniga-Pflucker JC: The BTG/TOB family protein TIS21 regulates stage-specific proliferation of developing thymocytes. Eur. JImmunol. 35: 3030-3042. 2005
32. Leco, K.J., Khokha, R., Pavloff, N., Hawkes, S.P., and Edwards, D.R: Tissue inhibitor of metalloproteinases-3 (TIMP-3) is an extracellular matrix-associated protein with a distinctive pattern of expression in mouse cells and tissues. J. Biol. Chem. 269, 9352-9360. 1994
33. Lim IK, Lee MS, Ryu MS, Park TJ, Fujiki H, Eguchi H, Paik WK: Introduction of growth inhibition of 293 cells by downregulation of the cyclin E and cyclin-dependent kinase 4 protein due to overexpression of TIS21. Mol Carcinog 23: 25-35. 1998
34. Liotta, L.A., and Stetler-Stevenson, W.G: Tumor invasion and metastasis: an imbalance of positive and negative regulation. Cancer Res. 51, 5054-5059. 1991
35. Liotta, L.A., and Stetler-Stevenson, W.G: Metalloproteinases and cancer invasion. Semin.
Cancer Biol. 1, 99-106. 1990
36. Liotta, L.A., Tryggvason, K., Garbisa, S., Hart, I., Foltz, C.M., and Shafie, S: Metastatic potential correlates with enzymatic degradation of basement membrane collagen. Nature 284, 67-68. 1980
37. Litta, L. A., and Steler-Stevenson, W. G: Tumor invasion and metastasis: an imbalance of positive and negative regulation. Cancer Res. 51, 5054-5059. 1991
38. Littlepage, L.E., Sternlicht, M.D., Rougier, N., Phillips, J., Gallo, E., Yu, Y., Williams, K., Brenot, A., Gordon, J.I., and Werb, Z.: Matrix metalloproteinases contribute distinct roles in neuroendocrine prostate carcinogenesis, metastasis, and angiogenesis progression. Cancer
Res. 70, 2224–2234. 2010
39. Liu, H., Zhang, T., Li, X., Huang, J., Wu, B., Huang, X., Zhou, Y., Zhu, J., and Hou, J.: Predictive value of MMP-7 expression for response to chemotherapy and survival in patients with non-small cell lung cancer. Cancer Sci. 99, 2185–2192. 2008
40. Liu, Z., Zhou, X., Shapiro, S.D., Shipley, J.M., Twining, S.S., Diaz, L.A., Senior, R.M., and Werb, Z.: The serpin alpha1-proteinase inhibitor is a critical substrate for gelatinase B/MMP-9 in vivo. Cell 102, 647–655. 2000
41. Marchenko GN, Marchenko ND, Leng J, Strongin AY: Promoter characterization of the novel human matrix metalloproteinase-26 gene: regulation by the T-cell factor-4 implies specific expression of the gene in cancer cells of epithelial origin. Biochem. J. 15; 363(Pt 2):253-62. 2002
42. Marchenko GN, Marchenko ND, Leng J, Strongin AY: The structure and regulation of the human and mouse matrix metalloproteinase-21 gene and protein. Biochem. J. 503-15. 2003
43. Massague, J.: TGFbeta in Cancer. Cell 134, 215–230. 2008
44. Oswald J, Steudel C, Salchert K, Joergensen B, Thiede C, Ehninger G, Werner C and Bornhauser M: Gene-expression profiling of CD34+ hematopoietic cells expanded in a
collagen I matrix. Stem Cells. 24: 494-500. 2006
45. Matrisian, L.M: Metalloproteinases and their inhibitors in matrix remodeling. Trends
Genet. 6, 121-125. 1990
46. MorelAP, Sentis S, Bianchin C, Le Romancer M, Jonard L, Rostan MC, Rimokh R and Corbo L: BTG2 antiproliferative protein interacts with the human CCR4 complex existing in vivo in three cell-cycle-regulated forms. J Cell Sci. 116: 2929-2936. 2003
47. Overall CM, López-Otín C: Strategies for MMP inhibition in cancer: innovations for the post-trial era. Nat. Rev. Cancer. 657-72. 2002
48. Parks, W.C., Wilson, C.L., and Lopez-Boado, Y.S.: Matrix metalloproteinases as modulators of inflammation and innate immunity. Nat. Rev. Immunol. 4, 617–629. 2004
49. Prevot D, Voeltzel T, Birot AM, Morel AP, Rostan MC, Magaud JP, Corbo L: The leukemia-associated protein Btg1 and the p53-regulated protein Btg2 interact with the homeoprotein Hoxb9 and enhance its transcriptional activation. J Biol Chem 275: 147-153. 2000
50. Rouault JP, Falette N, Guehenneux F, Guillot C, Rimokh R, Wang Q, Berthet C, Moyret-Lalle C, Savatier P, Pain B, Shaw P, Berger R, Samarut J, Magaud JP, Ozturk M, Samarut C and Puisieux A: Identification of BTG2, an antiproliferative p53-dependent component of the DNA damage cellular response pathway. Nat Genet. 14: 482-486. 1996
51. Rouault JP, Prevot D, Berthet C, Birot AM, Billaud M, Magaud JP, Corbo L: Interaction of BTG1 and p53-regulated BTG2 gene products with mCaf1, the murine homolog of a component of the yeast CCR4 transcriptional regulatory complex. J Biol Chem 273: 22563-22569. 1998
52. Risau, W: Mechanisms of angiogenesis. Nature 386, 671-674. 1997
53. Sato, H., Takino, T., Okada, Y., Cao, J., Shinagawa, A., Yamamoto, E., and Seiki, M: A matrix metalloproteinase expressed on the surface of invasive tumour cells. Nature 370, 61-65. 1994
54. Sternlicht, M.D., and Werb, Z.: How matrix metalloproteinases regulate cell behavior.
Annu. Rev. Cell Dev. Biol. 17, 463–516. 2001
55. Sundaramoorthy S, Ryu MS and Lim IK.: B-cell translocation gene 2 mediates crosstalk between PI3K/Akt1 and NFκB pathways which enhances transcription of MnSOD by
accelerating IκBα degradation in normal and cancer cells. Cell Commun Signal. 11:69-84. 2013
56. Thomas, S. M. and Brugge, J. S.: Cellular functions regulated by Src family kinases.
Annu. Rev. Cell Dev. Biol. 13:513–609. 1997
57. Uleminckx, K., L. Vackat, M. Mareel, W. Fiers, and F. V. Roy: Genetic manipulation of E-cadherin expression by epithelial tumor cells reveals an invasion suppressor role. Cell. 66: 107-119. 1991
58. Weiss, S.J., Peppin, G., Ortiz, X., Ragsdale, C., and Test, S.T.: Oxidative autoactivation of latent collagenase by human neutrophils. Science 227, 747–749. 1985
59. Wheeler DL, Iida M, Dunn EF: The role of Src in solid tumors. Oncologist 14 (7): 667– 78. 2009
60. Woessner, J. F: Matrix metalloproteinases and their inhibitors in connective tissue remodeling. FASEB J. 5, 2145-2154. 1991
61. Will, H., and Hinzman, B: cDNA sequence and mRNA tissue distribution of a novel human matrix metalloproteinase with a potential transmembrane segment. Eur. J. Biochem. 231, 602-608. 1995
62. Yamaguchi H, Lorenz M, Kempiak S et al.: Molecular mechanisms of invadopodium formation: the role of the N-WASP–Arp2/3 complex pathway and cofilin. J Cell Biol 168:441–452. 2005
63. Yamaguchi H, Wyckoff J, Condeelis J: Cell migration in tumors. Curr Opin Cell Biol 17:559–564. 2005
64. Yu, Q., and Stamenkovic, I.: Cell surface-localized matrix metalloproteinase-9 proteolytically activates TGF-beta and promotes tumor invasion and angiogenesis. Genes Dev. 14, 163–176. 2000
TIS21 inhibits cell migration by downregulating expression of matrix metalloproteinases.
Myong-ho Choi
Department of Biomedical Sciences The Graduate School, Ajou University (Supervised by Associate professor Tae Jun Park)
Tetradecanoyl phorbol acetate-inducible sequence 21 (TIS21) is the mouse homolog of rat pheochromocytoma cell 3 (PC3) and human B-cell translocation gene 2 (BTG2). TIS21 regulates cell cycle progression and proneural genes expression by acting as a transcription coregulator that enhances or inhibits the activity of transcription factors. And In human tissue, BTG2 has a critical role in cancer cell migration and invasion. The matrix metalloproteinases (MMPs) are zinc-dependent endopeptidases that are capable of degrading all kinds of extracellular matrix proteins, but also can process a number of bioactive molecules, and to perform key functions in tumor progression, and in other diseases. In this study, we report that TIS21 can decrease the expression at both mRNA and protein levels of MMPs in human breast cancer (MDA-MB-231) cells and human dermal fibroblasts (HDF) cells, as confirmed by zymography, RT-PCR. Moreover we demonstrate that TIS21 decreases transcription factor (c-Fos, PEA3) of MMPs. We are going to examine the regulatory mechanism of TIS21-mediated MMPs proteoytic activity.
Key words: TIS21/BTG2/PC3, downregulation mRNA expression and proteolytic activity of MMPs, downregulation migration of MDA-MB-231, HDF cell