보험 약가 조정 방안 연구
주요국의 약가재평가제도 고찰을 중심으로
-연 구 진
연 구 책 임 자 배 승 진 부연구위원 공 동 연 구 원 임 지 혜 최 상 은 배 은 영 주임연구원 서울대학교 약학대학 상지대학교 의료경영학과건강보험에서 약제비가 차지하는 비중이 증가함에 따라, 정부는 약제비 지출을 합리화시키기 위한 노력으로 약제비 적정화 방안을 2006년 12월 29일에 발표하였다. 기존의 보험 약가 사후 평가제도 (실거래가 상환제도, 3년 주기 약가재평가 제도)외에 약제비 적정화 방안 이후 추가로 특허만료 의약품 약가인하, 기등재 의약품 목록정비, 사용량 약가 연동제 등의 제도가 도입되면서 약가 사후평가 제도의 숫자가 많고, 제도 간 관계가 명확하지 않다는 지적이 있었다. 본 연구는 각 제도가 의도한 목표를 효과적으로 달성하는지를 국내외 문헌 및 자료 분석을 통하여 제시하고, 제도 간 조정 기전을 제시할 목적으로 수행되었다. 약제비 적정화방안 이후에 도입된 제도들의 효과를 평가하기에는 연구 시점이 이른 감이 없지 않다. 제도 간 통합 및 폐지는 일정 기간을 두고 각 제도별 효과를 평가하여 이를 근거로 논의되어야 하나, 현 시점에서 각 제도의 장기간의 효과를 산출하기에는 어려움이 있다. 이에 본 연구에 서는 제도 간 통ㆍ폐합을 논하기보다는 의약품 사용 현황과 제도들의 역 할을 해외사례와 비교하여 제시하였고, 현 시점에서 국내 보험 약가 사후 평가제도를 총괄적으로 평가하였다는데 그 의의가 있다. 본 연구보고서에 제작에 된 건강보험자료는 건강보험심사평가원 약제 관리실의 협조 하에 분석하였고, 본 연구를 위하여 많은 협조와 노력을 기울여 주신 약제평가부, 약제등재부에 깊이 감사드린다. 끝으로 본 연구보고서의 내용은 연구자의 개인적 의견이며, 본원의 공식적인 견해가 아님을 밝혀둔다.
2010년 2월
건강보험심사평가원 원장 송 재 성
심사평가정책연구소 소장 최 병 호
요 약 ··· 1 제 1장. 서론 ··· 19 I. 연구배경 ··· 19 II. 연구 목적 ··· 22 III. 연구 범위 및 방법 ··· 23 제 2장. 국내 약가 제도 및 약품비 사용 현황 ··· 25 I. 국내 약가 사후 평가 제도 현황 ··· 25 1. 실거래가 상환제도(실거래가 사후관리) ··· 26 2. 3년 주기 약가재평가(3년재평가, 약가재평가) ··· 29 3. 특허만료 의약품 약가인하 ··· 31 4. 기등재 의약품 목록정비 ··· 34 5. 사용량 약가 연동제 ··· 35 II. 국내 보험 약품비 현황 ··· 36 1. 현 약가제도 재정절감 효과 평가 ··· 36 2. 국내 복수등재 의약품 보험의약품 사용 현황 분석 ··· 38 III. 제도 간 조정기전 ··· 43 IV. 소결 ··· 44 제 3장. 외국 제도 고찰 ··· 47 I. 특허만료 의약품 약가정책 ··· 47 1. 특허만료 의약품 약가동향 ··· 47 2. 1st generic 및 특허만료 의약품의 약가 인하폭 규제 ··· 54 3. 간접 규제 방식: 참조가격제 ··· 59 4. 제네릭 권장정책 ··· 67 5. 일괄인하정책 ··· 81
2. 스위스 ··· 91 III. 소결 ··· 93 제 4장. 고찰 및 결론 ··· 95 I. 국내 약가 사후 평가제도 현황 ··· 95 II. 고가약 관련 정책 ··· 96 1. 저가약 사용 권장 ··· 96 2. 고가약 약가 인하 ··· 97 III. 제도 간 조정기전 ··· 100 1. 결산개념 ··· 100 2. 조정기전 ··· 100 3. 중장기적 방안: 주요 제도 중심 ··· 103 IV. 제한점 ··· 104 참고문헌 ··· 105 별 첨 ··· 111
표 2-1. 국내의 약가 사후 평가제도 요약 ··· 26 표 2-2. 연도별 실거래가 사후관리 실적 ··· 29 표 2-3. 3년 주기 약가재평가로 인한 절감액 ··· 31 표 2-4. 각 제도로 인하된 폭 ··· 37 표 2-5. 년간 보험의약품 사용 현황, 2008년 ··· 39 표 2-6. 보험 등재 의약품 중 복수등재 성분의 최저가/최고가 비, 2008년 ··· 39 표 2-7. 각 성분 내에서 성분별 산술평균가 이상 품목들의 시장점유율 분포 ·· 40 표 2-8. 조정 기전의 사례 ··· 44 표 3-1. 외국의 특허만료 오리지널 및 제네릭 약가정책 ··· 54 표 3-2. 노르웨이의 특허만료 시 보험상환가 인하 사례 ··· 57 표 3-3. 참조가격제 실시 국가들 사례 ··· 66 표 3-4. 제네릭관련 정책 정리 ··· 79 표 3-5. 외국에서 약가 일괄 인하 사례 ··· 83 표 3-6. 한국과 일본의 약가제도 비교 ··· 84 표 3-7. 일본의 약가 재산정 기전 설명 ··· 86 표 3-8. 일본의 약가 재평가 History ··· 90 표 3-9. 국내 약가제도와 외국 약가 제도 비교. ··· 92 별첨 표 1. 국내 최고가 대비 가중평균가자료, 상위 25개 성분 ··· 113 별첨 표 2. 국내 최고가 대비 최저가, 가중평균가 자료, 분류번호별 자료 ··· 114 별첨 표 3. Clopidogrel 75mg 품목 수 변동 ··· 118
별첨 표 4. Dried Ivy Extract 7mg의 품목 수 변동 ··· 119
별첨 표 5. Famciclovir 250mg 품목 수 변동 ··· 120
별첨 표 6. Hydrochlorothiazide12.5mg+Losartan Potassium50mg ··· 121
별첨 표 7. Irinotecan HCl 100mg품목 수 경향 ··· 122
별첨 표 8. Latanoprost 50mcg+timolol maleate 6.93mg의 품목 수 변동 ··· 123
별첨 표 12. Megestrol acetate 40mg의 품목 수 변동 ··· 127
별첨 표 13. Meloxicam 7.5mg의 품목 수 변동 ··· 128
별첨 표 14. Oxcarpazepine 300mg 의 품목 수 변동 ··· 129
별첨 표 15. Paroxetine 20mg 품목 수 변동 ··· 130
별첨 표 16. Pantoprazol Sodium Sesquihydrate 45.2mg 의 품목 수 변동 ··· 131
별첨 표 17. Sodium Alendronate 70mg 품목 수 변동 ··· 132 별첨 표 18. Trimebutine Maleate 150mg 품목 수 변동 ··· 133 별첨 표 19. Zolpidem 10mg 의 보험 품목 수 변동 ··· 134 별첨 표 20. Acetylcarnitine 500mg 품목 수 변동 ··· 135 별첨 표 21. 주요국의 제네릭 관련 정책 ··· 139 별첨 표 22. 외국의 재평가기전 정리 ··· 142 별첨 표 23. 처방예산제 사례 정리 ··· 143 별첨 표 24. 참조가격제와 재정효과 분석 ··· 144 별첨 표 25. 독일에서 참조가격제 분류 예시 ··· 154 별첨 표 26. 독일에서 제네릭 시장점유율, 1989~2006 ··· 154 별첨 표 27. 이태리의 특허만료 오리지널 및 제네릭 사용 경향 ··· 169 별첨 표 28. 이태리의 최근 제약 정책 정리 ··· 170 별첨 표 29. 이태리의 제약 규모 정리 ··· 170 별첨 표 30. 프랑스에서 급여 기준 및 상환율 ··· 177 별첨 표 31. 프랑스에서 제네릭 의약품의 시장점유율 변동, 2000~2007 ··· 178
그림 1-1. GDP 중 의료비 지출 비중(%), 2007년 기준 ··· 20 그림 1-2. 1인당 의료비지출 (US PPP), 2007년 기준 ··· 20 그림 1-3. 의료비 지출 중 의약품 지출비중 (%), 2007년 기준 ··· 21 그림 1-4. 1인당 약품 및 기타 의료기기 비용(US PPP), 2007년 기준 ··· 21 그림 3-1. 특허만료 후 오리지널과 제네릭의 약가 변화, OECD 7개국 ··· 48 그림 3-1. 계속 ··· 49 그림 3-2. 특허만료 후 오리지널과 제네릭의 시장점유율 변화 ··· 50 그림 3-2. 계속 ··· 51 그림 3-3. 시점 t와 특허만료 시점(t=0)에서의 약가 비율 ··· 52 그림 3-4. 오스트리아에서 특허만료 및 제네릭 등재 시 약가 조정기전 ··· 56 그림 3-5. 일본의 제네릭 등재 후 약가인하 기전 ··· 59 그림 3-6. 경구 당뇨병제의 참조가격제 도입 이후 약가 변화 ··· 61 그림 3-7. 참조가격제 도입 이후 약가 경향 ··· 62 그림 3-8. 이태리에서 참조가격제 도입 이후 시장점유율 및 약가 변동 ··· 63 그림 3-9. 스페인에서 참조가격제 도입 이후 약가 변화, 2001~2004 ··· 64 그림 3-10. PBM에서 환자에게 제공되는 refill reminder 프로그램 ··· 76 그림 3-11 유럽 국가에서 전체 의약품 중 제네릭의 시장점유율(사용량 기준) · 77 그림 3-12. 특허만료 시장에서 제네릭 시장점유율(사용량 기준) ··· 78 그림 3-13. 일본의 실거래가 조사에 근거한 약가인하 기전 ··· 85 별첨 그림 1. Clopidogrel 75mg의 의 2004년~2008년 약가 동향 ··· 118
별첨 그림 2. Dried Ivy Leaf Extract 7mg 의 약가 변동, 2004~2008년 ··· 119
별첨 그림 3. Famciclovir 250mg 의 약가 변동 동향, 2004~2008 ··· 120
별첨 그림 4. Hydrochlorothiazide12.5mg+Losartan Potassium50mg ··· 121
별첨 그림 5. Irinotecan HCl 100mg의 약가 변동, 2004~2008 ··· 122
별첨 그림 6 Latanoprost50mcg+timolol maleate 6.93mg 의 약가 변동 ··· 123
별첨 그림 10. Megestrol 40mg 의 약가 변동, 2004~2008년 ··· 127
별첨 그림 11. Meloxicam 7.5mg 의 약가 변동, 2004~2008년 ··· 128
별첨 그림 12. Oxcarpazepine 300mg 의 약가 변동, 2004~2008년 ··· 129
별첨 그림 13. paroxetine 20mg의 약가 변동, 2004~2008년 ··· 130
별첨 그림 14. Pantoprazol Sodium Sesquihydrate 45.2mg 의 약가 변동 ··· 131
별첨 그림 15. Sodium Alendronate 70mg의 약가 변동, 2004~2008년 ··· 132 별첨 그림 16. Trimebutine Maleate 150mg의 약가 변동, 2004~2008년 ··· 133 별첨 그림 17. Zolpidem 10mg 의 약가 변동, 2004~2008년 ··· 134 별첨 그림 18. acetylcarnitine 500mg의 약가변동, 2004~2008년 ··· 135 별첨 그림 19. ranitidine, omeprzole 및 그 유사체의 사용경향 ··· 136 별첨 그림 20. 덴마크에서의 의약품의 허가, 등재, 유통 시스템 ··· 149 별첨 그림 21. 독일에서 정책변화에 따른 재정효과 ··· 153 별첨 그림 22. 독일에서 의약품 등재 및 급여 flow chart ··· 156 별첨 그림 23. 벨기에에서 의약품 등재 및 급여 flow chart ··· 157 별첨 그림 24. 벨기에에서 의료보험 재원 확보 ··· 158 별첨 그림 25. 스위스에서 신약의 등재까지 걸리는 시간, 1999-2002 ··· 160 별첨 그림 26. 스위스와 유럽 4개국(네델란드, 프랑스, 독일, 영국)의 약가비교 ···· 160 별첨 그림 27. 스위스 제약산업의 무역수지, 2004년 ··· 161 별첨 그림 28. 제네릭 시장점유율, 스위스, 2004년 ··· 161 별첨 그림 29. 이태리의 신약 등재과정 ··· 171 별첨 그림 30. 프랑스의 의약품 허가 및 등재 flowchart ··· 174 별첨 그림 31. 프랑스의 보건의료제도 ··· 175 별첨 그림 32. 오스트리아의 보건의료제도 ··· 183
제 1장. 서론
I. 연구의 배경 및 목적
○ 다른 OECD 국가 대비, 의료비 대비 약제비 비중이 큼 - 의료비 지출은 낮은 수준이나, 약제비 비중은 상위권임. - 약제비의 비중을 합리화시키기 위하여 약제비 적정화방안이 도입됨. - 약제비 적정화 방안 이후에 특허만료 의약품 약가인하, 기등재 의약품 목록정비, 사용량 약가 연동제가 도입됨. - 새로 도입된 3개의 제도는 기존의 약가 사후 평가제도(실거래가 상환 제도, 3년 주기 약가재평가)와의 관계 및 우선순위가 명확하지 않아, 적용 순서에 따라 인하폭이 달라짐. ▷ 기등재 의약품 목록정비 사업 도중에 특허가 만료되는 품목이 발생 하여, 특허만료 의약품 약가인하 20%의 기준 약가 관련하여 논란이 있었음. ▷ 제도의 숫자가 많아지면서 제도 간 중복적용 되는 경우가 발생할 수 있으나, 제도 간의 조정 기전은 명확하지 않음.○ 현 5개 약가 사후 평가 제도의 보험재정 절감효과 및 그 역할을 평가하여 문제점 및 개선방안을 모색하고 방안 간의 조정 기전을 고찰하는 것을 목적으로 함.
II. 연구 범위
○ 2장에서는 각 제도별 목적 및 보험절감 효과를 분석함 ○ 3장에서는 해외의 약가 사후 평가제도 및 주요 약가 조정 기전을 고찰하여 국내제도와 비교 ○ 4장에서는 종합 의견을 제시함III. 연구의 방법
○ 문헌 고찰 - 보험 약가의 등재 후 사후평가제도에 관련하여 기존에 발표된 문헌을 고찰 ○ 국내 보험의약품 사용경향 분석 - 2008년 1년 동안 의료기관과 약국에서 건강보험으로 청구된 의약품의 사용 현황을 분석 ○ 외국의 약가 사후 평가제도 고찰 - 각 나라의 급여 관련 기관의 홈페이지 및 발표된 논문을 통하여 조사함 - 외국에서의 약가 사후 평가 제도 및 그 성과를 고찰하여, 외국의 약가인 하기전과 국내의 약가인하기전 비교 및 장/단점 분석 고찰제 2장. 국내 현황
I. 국내 약가 사후 평가제도 현황
1. 실거래가 상환제도
○ 실거래가 상환제도는 시장에서의 실제 거래가격을 파악하고 그에 근거하여 약가를 조정하는 기전임 - 요양기관의 약가 이윤을 배제하고 차액을 소비자에게 환원하는 것을 목적 으로 함 - 그러나 실거래가 파악의 어려움 및 실거래가 인하 동기 부여의 한계 등 으로 제도 도입 이래 보험 재정 절감 효과는 2001년 1277억원에서 2008년 13억원으로 점점 감소하여, 그 효과가 미미함2. 3년 주기 약가 재평가
○ 선진 7개국 (A7) 의 조정평균가를 기준으로 3년에 한번 씩 약가를 평가함 - 정규적으로 외국의 가격변동요인에 근거하여 국내의 보험 약가를 조정하는 장치를 제공 - 그러나 우리보다 경제수준이 훨씬 높은 국가의 약가를 비교하여 평가하는 문제, 환율에 민감하게 반응하는 문제 등이 있음 - 제도 도입 이래 보험 재정 절감 효과는 2002년 734억원에서 2008년 328 억원, 2009년 70억원으로 점점 감소함3. 특허만료 의약품 약가인하
○ 특허가 만료되고 제네릭이 등재됨에 따라 오리지널 의약품의 약가를 일정 폭 인하함 - 특허보호 기간 동안 이미 연구개발비를 회수하였고, 시장에 더 저렴한 대체약제가 등재됨에 따라 오리지널 의약품의 약가를 조정함- 그러나 2006년 12월 29일 이전에 특허가 만료된 의약품은 대상에서 제외 되어 대상이 한정되어 있고, 등재 순서에 따라 차별된 제네릭 약가 순 서는 지속적으로 유지됨 - 제도 도입 이래 보험 재정 절감 효과는 2007년 483억원에서 2008년 782 억원으로, 2008년 현재 5개의 약가 조정 기전 중에서 가장 보험재정에 미치는 영향이 큼
4. 기등재 의약품 목록정비
○ 보험목록에 이미 등재된 의약품을 치료적ㆍ경제적 가치에 근거하여 선별적 으로 등재하기 위하여 도입됨. - 가격이 저렴하고 효과적인 의약품을 선별적으로 급여함으로써 보험 재정 안정화를 기함. - 한편, 국내 환자 대상의 효과자료 부족 등의 어려움이 있음. - 2008년 11월 현재, 기등재 의약품 목록정비로 약 57억원의 보험재정이 절감됨(편두통 치료제만 포함; 고지혈증 치료제까지 포함한 2009년 추정 절감액 317억원). 본 평가 진행 중.5. 사용량 약가 연동제
○ 약제비 지출의 합리화를 위하여 고려되어야 할 것은 약가와 사용량임. 기 존의 약가 정책들이 약가 조정 정책에 집중되어 있었다면, 사용량 약가 연 동제는 사용량 증가에 따라 약가를 조정한다는 면에서 기존의 약가제도들과 차별됨. 2007년 도입 시에는 신약만 대상으로 하였으나 등재된 지 4년 이상의 모든 기등재 (저가 의약품 및 일부 제외) 의약품을 대상으로 그 대 상이 확대됨. - 보험재정에 미치는 효과를 관찰하기에는 시기가 이름6. 제도 간 조정기전
○ 제도 간 중복 적용 시, 적용 순서에 따라 인하폭이 달라질 수 있고 우선 순위가 명확하지 않음 ▷ 기등재 의약품 목록정비 제도와 특허만료 의약품 약가인하제도에 관한 조정기전은 정의되었으나, 다른 기전 간에 조정 기전은 명확 하지 않음II. 국내 보험의약품 사용 현황
○ 특허가 만료되어 저가 대체품목이 등재된 복수등재 의약품은 저가 제품 권 장을 통하여 보험 재정 안정화에 도모할 수 있는 중요한 영역이나, 국내에서는 고가품목 위주로 사용되고 있고 고가품의 약가는 거의 인하되지 않음 - 2008년 1년 동안 보험에 청구된 의약품 사용 현황을 분석한 결과, 복수 등재 성분(동일 성분, 함량, 제형의 품목이 두 개 이상 등재되어 있는 성 분)에서 각 성분별 가중평균가/최고가 비율은 90%, 최저가/최고가 비율 은 69%로, 저가대체품이 있어도 고가의약품 위주로 사용되고 있음을 제 시함 - 2004~2008년 사이에 1st generic 이 등재된 17개 성분의 약가 경향을 관찰해 보면, 성분 당 품목수가 늘어나면서 성분별 최저가는 점차 내려가지만, 성분별 가중평균가는 최고가에 근접하고, 성분별 최고가 는 거의 인하되지 않음 ○ 이러한 고가품 사용양상은 소비자의 고가의약품 선호 문제, 고가품 사용 억 제 및 저가 제네릭 권장 정책 부족 뿐 아니라 현 약가 사후 평가 제도의 한계 (실거래가 파악의 어려움; 제네릭의 진입 순서에 따라 산정된 약가를 인하할 동기가 없어 높은 약가를 지속적으로 유지하고, 추후에 계단식 약가를 조정 하는 기전이 미비)하고도 관련됨III. 소결
○ 약제비 적정화 방안 이전에 들어온 제도들은 제도의 효과 및 제도의 원래 취지를 고려하였을 때 개선의 여지가 있음 - 실거래가 상환제도, 3년 주기 약가재평가제도는 도입 후 시간이 지 남에 따라 그 효과가 현격히 감소됨 ○ 새로운 제도들(특허만료 의약품 약가인하, 기등재 의약품 목록정비, 사용량 약가 연동제)이 도입되었으나 보험 의약품 청구 경향을 보면 여전히 개선의 여지가 있음 - 동일 성분, 함량, 제형의 저가 대체약제가 있지만 주로 고가약이 사용됨 - 성분별 약가의 산술평균은 점차로 인하되어도, 고가품목의 약가는 거의 인하되지 않음 - 고가약품에 대한 규제 (약가 인하) 뿐 아니라 저가약 사용 권장 정책에 있어 논의가 필요함 - 약가 사후 평가제도의 숫자는 많으나 제도 간 조정기전이 사전에 규정되지 않음 ○ 본 연구에서는 외국의 특허만료 의약품에서 제네릭 사용 경향 및 저가 제 네릭 권장 정책을 관찰하고, 다른 나라에서의 사후 약가 조정기전 간 관계 및 그 효과의 고찰을 통하여 개선방향을 제시하는 것을 목적으로 함.제 3장. 외국제도 고찰
I. 특허만료 의약품 약가정책
1. 특허만료 의약품의 약가 동향
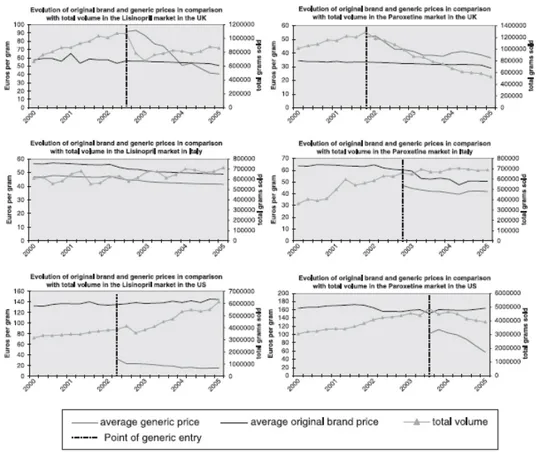
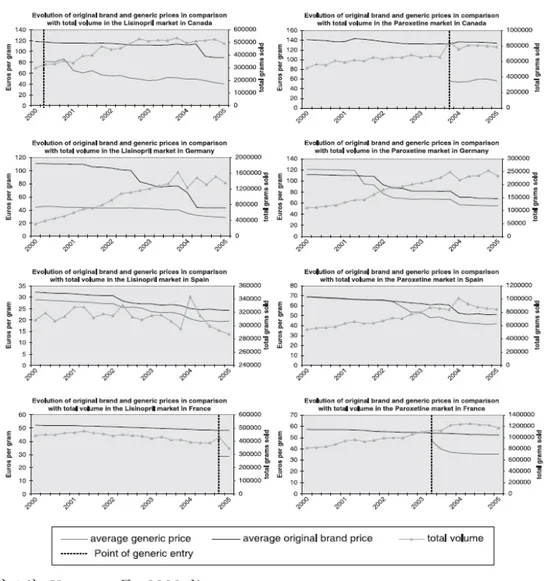
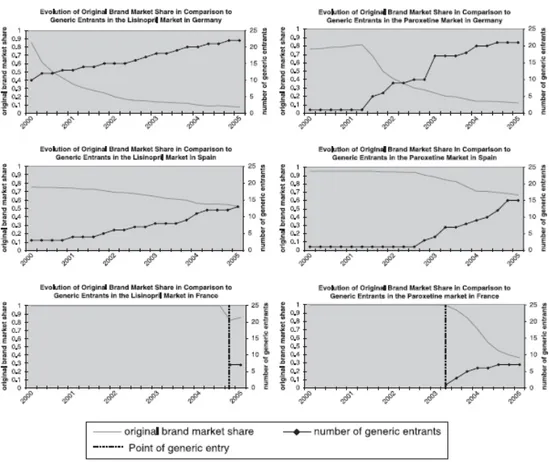
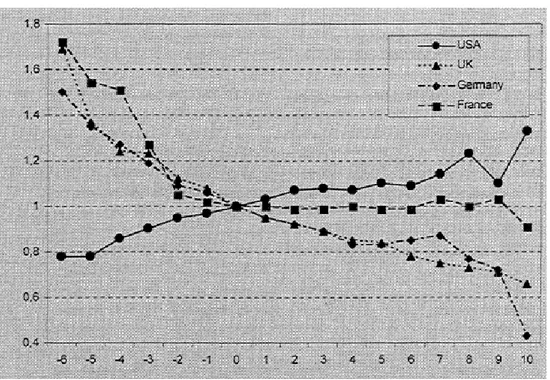
○ 대부분의 외국의 사례를 보면, 제네릭 진입 후에 고가품(오리지널)은 시장 점유율이 감소되면서 약가가 인하되는 경향을 보임- 미국을 제외한 OECD 7개국에서 특허만료 후 오리지널의 약가가 제약 사의 자발 또는 보험자의 강제를 통하여 지속적으로 인하되는 것이 관 찰됨 - 제약사가 자발적으로 낮출 수 있는 환경을 제공하는 것은 다양한 제네 릭 권장정책과 연관됨
2. 1st generic 및 특허만료 의약품의 약가 인하 경향
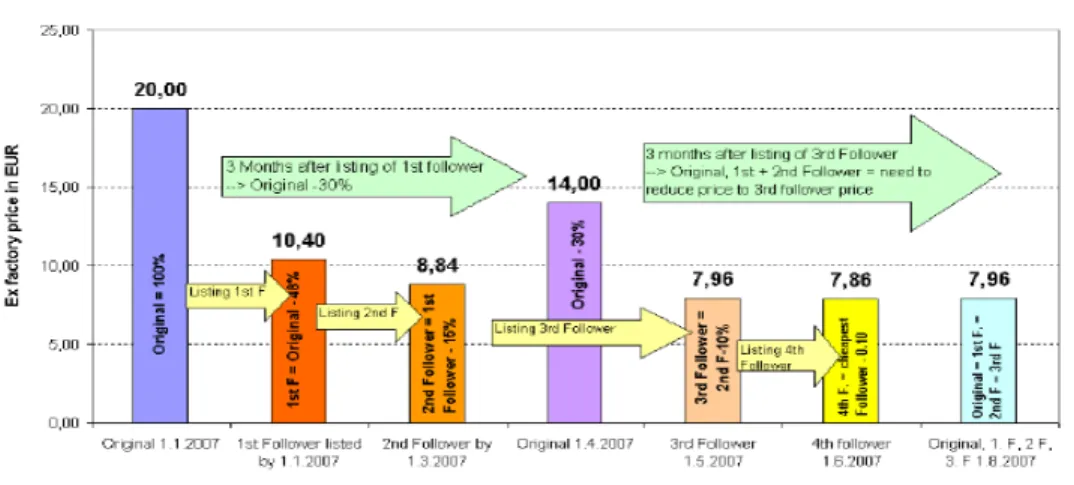
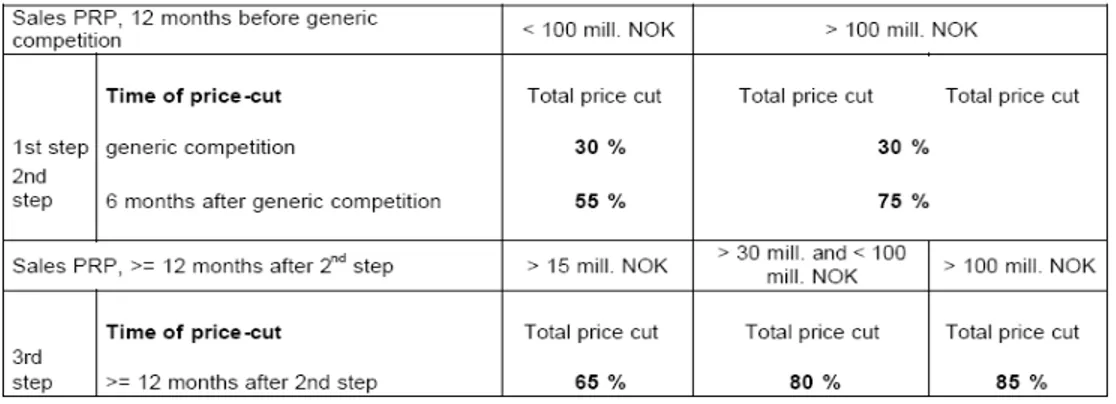
○ 약가를 규제하는 국가에서는 특허만료 오리지널 및 그 제네릭의 약가를 인하시키는 폭이 커지는 경향이 관찰됨 - 오스트리아는 1st generic 의 인하폭을 44%(2004)에서 48%(2006)로 증가 시켰고, 3번째 제네릭이 등재되면 특허만료 오리지널 및 선등재 제네릭의 약가가 3번째 제네릭과 같은 수준으로 인하됨. 특허만료 전 약가 대비 약 60% 가 인하됨을 뜻함- 노르웨이에서는 stepped pricing system을 2005년 1월부터 시행하여, 특 허만료 6개월, 1년, 2년 시차를 두고 특허가 만료된 성분의 보험 상환금 액을 대폭 인하함 (33개 판매량이 높은 성분군 대상으로 시행). 판매액 이 1억 노르웨이 크로네(NKr)이상인 성분은 제네릭 진입 시 30%, 6개 월 후 50%, 1년 후 70% 보험상환가가 인하됨; 판매액이 1억 노르웨이 크로네(NKr) 미만인 성분은 제네릭 진입 시 30%, 6개월 후 40%, 1년 후 50% 보험 상환가 인하; 최근에는 그 인하폭을 더 크게 하고 있음 - 일본은 1st generic의 특허만료 오리지널 대비 약가 인하폭을 20%에서 30%로 증가시킴
3. 참조가격제
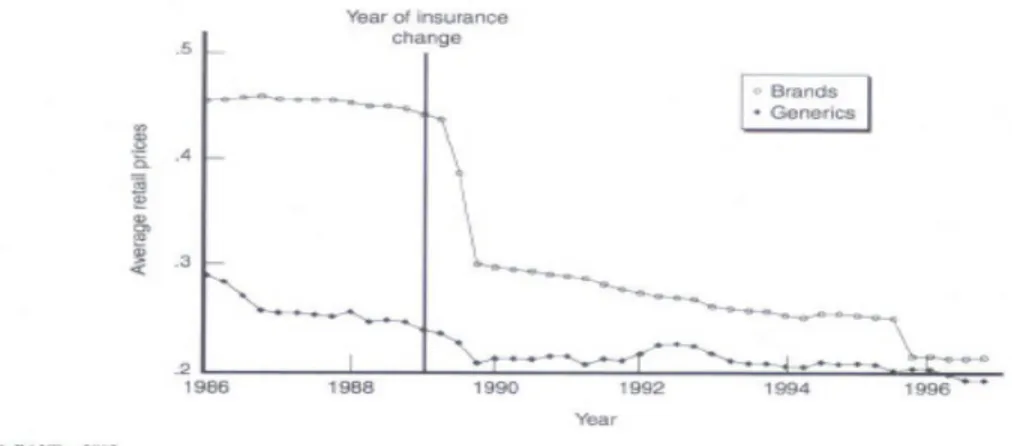
○ 참조가격제를 통하여 간접적으로 약가를 규제하는 국가들의 경우, 참조 가격(reference price) 수준을 점차로 낮추는 경향이 관찰됨 - 뉴질랜드, 덴마크, 호주, 이태리 등은 보험 상환금액 (reimbursement price)을 성분 내 최저가 제네릭의 수준으로 설정- 독일, 덴마크, 이태리 등은 참조가격 수준을 점차로 낮추고 있음 - 독일, 이태리, 스페인, 프랑스 등에는 참조가격 이상의 품목들의 약가가 참조가격 수준으로 대부분 인하됨. 이러한 약가 인하는 참조가격제만의 결과라기보다는, 참조가격 이상의 품목들이 사용되는 것을 억제하던가 아니면 저가 제네릭의 사용을 유도하는 정책들과 무관하지 않음
4. 제네릭 권장정책
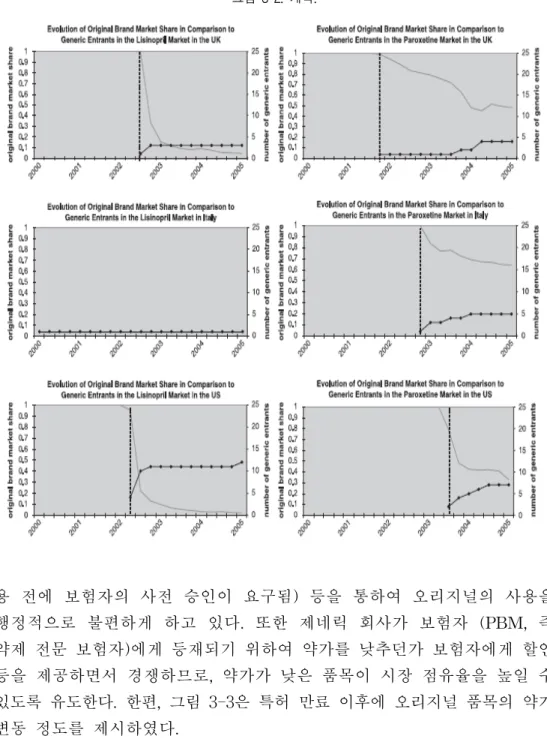
○ 외국에서는 다양한 정책을 통하여 저가 제네릭을 권장하고 고가품의 사용을 억제하는데, 이러한 정책은 다른 약가정책(참조가격제, 특허만료 약가인하) 들과 밀접하게 관련됨 - 성분명 처방을 합법화하고 권장하는 정책도 같이 실행 (영국, 의과대학 에서 성분명으로 처방하도록 교육; 프랑스, 성분명 처방 시 재정적 이익) - 보험자가 의사의 처방행태를 monitoring하여 고가품목을 지속적으로 처 방하는 의사에게는 feedback을 제공하여, 고가품 처방의 억제를 유도함 (덴마크, 이태리, 노르웨이, 벨기에, 영국, 프랑스) - 처방예산제를 통하여 처방자가 재정적으로 인식하도록 하여 저가품 처 방을 유도함(독일, 영국) - 조제예산제를 정하여 약사가 제네릭 대체조제 시 저가 제네릭을 조제하 도록 유도 (덴마크) ○ 제네릭 대체조제는 의사의 특정 품목에 대한 브랜드 로열티를 희석시켜, 고가품 제조회사가 의사의 브랜드 로열티만으로 시장 점유율을 보존할 수 없도록 하고, 강제로 저가품이 시장점유율을 넓힐 수 있는 장치를 제공함. - 덴마크, 스페인, 스웨덴, 이태리 (일정금액 이상 저렴/최저가 대체조제) - 프랑스, 네델란드, 스위스 (제네릭 대체조제 허용) - 일본, 독일 (제네릭 처방을 촉진할 수 있도록 처방전 양식 변경)○ 기타 정책 - 본인 부담금 정책 (참조가격 대비 30%이상 저렴한 제네릭은 본인부담금 면제, 독일; 고가품 조제 시 본인 부담금 상당히 증가, 미국) - 고가약 사용 시 행정적 불편함 가중(참조가격 이상의 품목 처방 시 환자 에게 고지해야 하는 의무, 독일; 사전 승인 및 fail-first 정책, 미국) - 제네릭 대체조제 시, 제네릭 제약사가 약사에게 할인 (discount) 를 제공 하여 시장 점유율을 경쟁. 그러나 보험자와 환자가 아닌 약사에게 재정적 이익이 돌아간다는 단점이 있음 ○ 주요국에서의 약가 정책의 효과는 다른 정책과 상호관계에서 해석되어함 - 참조가격제 뿐 아니라 처방예산제, 제네릭권장 등의 정책과 밀접히 관련됨 ○ 보험재정에 미치는 영향에 따라 일괄 인하 정책도 적용함 - 등재된 지 오래된 약에 대한 일괄인하 (스페인, 벨기에) - 보험자/제약사 간 협상의 일환으로 일괄인하 (프랑스, 독일) - 경쟁의약품이 많이 등재된 경우 인하(호주) - 등재된 지 1년 이상의 비참조가격군 약가 일괄인하(스페인)
II. 제도 간 조정기전
○ 일본의 경우, 2년 정규 약가 개정을 통하여 지속적 약가인하 - 실거래가 조사제도, 시장 확대로 인한 약가재산정(사용량 증가에 따른 약가 인하), 특허만료 의약품 인하기전을 갖고 있음 - 재정효과 및 대상품목 수로 보았을 때, 실거래가 조사제도가 가장 영향이 큼 - 외국약가 기준으로 인하하는 기전은 없음 - 사용량증가로 인한 인하폭은 시장 실거래가 조사제도에 의한 인하폭과 비교하여 더 큰 것 적용 (두 제도는 같은 주기로 적용)- 특허만료 약가인하는 실거래가 조사제도에서 조정된 약가를 기준으로 추가로 적용 - 제네릭 대체조제가 규정된 이래, 제네릭 회사들이 높은 할인율을 제공함. 그에 따라 할인된 약가는 2년 정규 약가 개정(시장가격 평균치 조정방식) 시에 반영되어 약가가 급격히 하락함. - 일본에서는 시장에서의 실거래가를 파악하는 것이 가능해지면서 실거 래가 조사제도가 강력한 효과를 발휘하였고, 나머지 제도들은 그 적용 범위 및 효과에 있어 상대적으로 미미함. 일본은 제도들 간의 관계를 미리 설정하여, 중복 적용 시 미리 예상할 수 있게 사전에 정의하고, 그 주기도 동일하게 운영하여 행정상의 효율성도 증가시켰음. ○ 스위스 - 일반적으로 등재 후 총 3번 약가를 재평가하는데, 만약 새로운 효능 효과가 추가되면 급여 후 7년째 되는 해에 추가로 평가하여 총 4번 평가 - 스위스는 등재/특허(주기를 바꿀 수 없음)를 기준으로 약가를 총 3~4번 평가하되, 일정 폭(예, 20%)인하하는 것이 아니라 외국 약가, 사용량 및 효과 평가도 같이 진행하여 종합적으로 평가 - 첫 번째 평가는 급여목록에 등재된 지 2년 후에 등재 가격이 적절한 지를 평가하고, 만약 약가가 너무 높아 경제적이지 않은 경우, 약가를 인하(만약 약가를 3% 이상 인하할 경우, 약가만 인하하는 것이 아 니라 등재 시부터 평가시점까지의 초과이익을 제약사는 보험자에게 상환해야 함). - 두 번째 평가는 특허만료 시, 또는 등재된 지 15년이 지나면, 효과 평가, 사용 적정성 평가 및 다른 나라와의 가격 비교를 근거로 가격을 조정 - 세 번째 평가는 특허만료 2년 후에 재평가함. 만약 오리지널 약가가 특허만료 2년 후의 재평가 시 인하되면, 제네릭 약가는 인하된 약가 대비 적어도 15% 이상 저렴해야 함
기등재 목록정비 사용량-약 가 연동 특허만료 의약품 가격인하 기타 영국 △1) X X 자율약가제 (free-pricing) 벨기에 X X O 오래된 약에 대하여 일괄인하 적용 덴마크 X X X 최저가 대체조제, 조제예산제 오스트리 아 X X O 3번째 제네릭 진입 시 선진입 및 품목의 약가가 동일하게 인하됨 프랑스 X O O 약품비가 일정비율 이상 증가 시 제약사가 재정적 으로 부담하는 Industry Payback Agreement를 보 험자와 제약사가 체결 독일 △2) X X 처방예산제 제네릭 사용 촉진 스위스 X △3) O4) 정규 재평가 총 3회, new indication 추가 시 4번 일본 X O O 시장조사 실거래가 제도가 가장 영향력 큼 표 3-9. 우리나라와 외국의 재평가기전 비교
III 소결
○ 간접 규제(참조가격제) 및 직접 규제(약가 강제 인하) 등의 방법을 이용 하여 특허가 만료되고 저가 대체품이 있는 품목들의 약가를 지속적으로 인하시키고, 그 인하폭을 점점 크게 하는 경향이 해외 사례에서 일관되게 관찰됨. 또한, 저가 제네릭 권장 정책을 통하여 소비 행태에 변화를 유도함. 1) 기등재 품목의 경제성평가를 근거로 처방 가이드라인을 제시하는데, 급여여부 및 약가 조정은 이루어지지 않음.2) IQWIG에서 2007년 이래로 기등재 의약품 평가(Benefit Assessment)를 실시 3) 정규 재평가 시, 사용량 증가도 고려됨
- 참조가격제 적용 국가는 참조가격 이상의 고가품의 사용을 억제하는 정 책을 통하여 참조가격 보다 고가 품목의 약가 인하를 유도하고, 참조가격 수준을 점점 낮추어 지속적 약가 인하를 유도함. 약가를 규제하는 국가는 고가품(특허만료 오리지널 및 1st generic)의 인하폭을 증가시킴으로써 고가품의 약가를 강제로 인하시키는데, 그 인하폭이 점점 커지는 것이 관찰됨. - 다양한 형태의 제네릭 권장정책 및 고가약 억제정책을 적용하여, 소비자의 의약품 사용행태에 영향을 끼치고, 저가약 사용을 권장함. - 기타, 등재된 지 오래된 품목에 대해서는 일괄인하 등의 방법을 이용하여 보험재정 안정화를 도모하는 사례가 보고됨. (스페인, 벨기에 등) ○ 외국은 우리나라 대비 보험약가 사후평가 제도의 수가 적고, 제도 간 조정 기전이 사전에 정의됨.
제 4장. 고찰 및 결론
I. 국내 약가 사후 평가제도 현황
○ 새로운 약가 사후 평가제도(특허만료 의약품 약가인하, 기등재 의약품 목록 정비, 사용량 약가 연동제)들은 기존 제도(실거래가 상환제도, 3년 주기 약가 재평가)의 한계를 극복하기 위하여 도입됨 ○ 새로운 약가 사후평가제도 도입 후에도 여전히 개선의 여지가 있음 - 현 제도들은 복수등재성분 중에서 저가 품목이 시장점유율을 높일 수 있는 기전을 제공하지 못함 ▷ 복수등재 품목 중에서 저가의약품의 시장점유율이 낮음. 제약사가 약가를 낮추지 않아도 시장점유율을 높일 수 있는 구조로 되어있어 제약사에게 약가를 낮출 동기를 제공하지 못함.- 복수등재 성분 중 고가의약품의 약가는 거의 인하되지 않음 ▷ 복수등재 성분의 대부분을 차지하는 2006년 12월 이전에 1st generic이 등재된 성분의 경우, 특허만료 후 저가 제네릭이 등재 되고 성분별 약가의 산술평균은 점차 인하되어도 고가품의 약가가 거의 인하되지 않는 것이 관찰됨. 이들의 약가는 기등재 의약품 목록정비 및 사용량 약가 연동제에 의하여 추후에 조정될 수 있 으나, 저가품이 시장 점유율을 높일 수 있는 기전이 마련되지 않 으면 제약사가 약가를 추가로 낮출 동기가 없어 보험 상환가의 상한선으로 약가가 수렴하는 현상이 지속될 것으로 예측됨. - 제도의 숫자가 많아지면서 제도 간 우선순위 및 조정기전의 정의가 필요함
II. 고가약 관련정책
○ (상대적) 저가약 사용 권장 - 저가 제네릭 대체조제, 고가약 처방 시 행정적 불편함 (환자에게 저가 제네릭이 있음을 고지해야 할 의무, 사전승인, 제네릭 먼저 사용 후 브랜드 사용가능한 fail-first 등), 제네릭 처방에 대한 재정적 동기 제공 등이 고려 될 수 있음 ○ (상대적)고가 품목의 약가 인하 - 오스트리아 등과 같이 특허가 만료 된 의약품의 약가를 큰 폭으로 인하 시키거나, 계단식 약가를 재조정하는 기전을 통하여 약가를 인하. 그러나 저가 제네릭 권장 정책이 동반되지 않으면, 오리지널과 제네릭의 약가 차이가 적어져 오리지널 의약품 위주로 사용될 수 있음 ○ 참조가격제를 통하여 고가품목의 약가 인하를 간접적으로 유도 - 의사의 선택에 따른 재정적 부담을 환자가 가져가는 문제, 고가품목들이 약가를 인하하지 않을 경우 보험자의 부담을 환자에게 전가하고 보장성이축소될 수 있는 문제, 저가품에 대한 품질 확신, 제네릭 대체조제 허용 등이 같이 고려되어야 함.
III. 제도 간 조정기전
○ 만약 현재의 약가 사후 평가 제도들을 그대로 유지한다면 결산제도를 고려 할 수 있음 - 결산 개념은 다른 기전으로 인한 약가의 인하를 고려하여 최종 인하 폭을 결정하면서, 잦은 약가 고시로 인한 행정비용을 줄일 수 있다는 장점이 있음 - 반면, 약가 인하 시점이 결산 시점으로 지연되어 그만큼 보험재정 및 환자의 본인부담금 절감 시점이 늦어진다는 단점도 있음 ○ 조정 기전 - 특허만료 의약품 약가인하와 기등재 의약품 목록정비의 경우, 먼저 오는 정책을 먼저 적용하고 추후에 그 차액만큼 적용한다고 결정됨. 이 결정은 정책의 적용 순서가 달라져도 최종 인하폭은 동일하게 함. - 특허만료 의약품 약가인하 제도는 직전 약가를 기준으로 인하하므로 적용 순서에 따라 인하폭이 달라질 수 있음. 특허만료 의약품 약가인하 제도와 실거래가 제도가 중복 적용되는 경우, 실거래가 상환제도는 그 제도의 목적(실거래가에 근거한 약가 조정에 따른 약가 이윤 배제)을 보았을 때, 실거래가로 조정된 약가를 기준으로 인하되는 것이 고려될 수 있음 (중복 적용). - 3년 주기 약가재평가제도와 특허만료 의약품 약가인하제도의 경우, 특허 만료 시 기준 약가를 A7 조정평균가로 인하된 약가를 기준으로 20% 인 하하던가, 기등재 의약품 목록정비사업과 특허만료 의약품 약가인하에서 결정된 것처럼 두 제도의 인하폭의 차액만큼 적용할 수 있음. ▷ A7 조정평균가는 우리나라 보다 경제수준이 훨씬 높은 국가의 약가수준을 상한선으로 조정한다는 면에서, A7 조정평균가를 기준으로 20% 인하할 수 있음. 그러나 대체로 우리나라의 특허만료 시기가 외국대비 늦어 외국에서 특허가 만료되어 인하된 약가를 기준으로 국내에서 약가를 추가로 인하할 수 있다는 점, 추가로 인하하기에는 인하폭이 큰 점(추가로 인하하는 일본의 경우, 특허만료 시 약가 인하는 약 6~8%임), 환율 등의 불안정한 요소에 의한 인하 요인이 많은 점 등을 고려해야 함. ▷ 만약 3년 주기 약가재평가제도와 특허만료 의약품 약가인하의 약 가 조정을 차액만큼 적용한다고 하면, 적용 순서에 따라 달라지는 면이나 중복 적용은 피할 수 있으나, 특허가 만료되어도 우리보다 경제수준이 높은 A7 조정평균가와 비교하여 이미 약가가 조정되 었다는 근거로 사전 인하폭과 20% 인하폭의 차액만큼만 인하되는 것이 사회적으로 수용 가능한지는 추가로 논의되어야 함. - 사용량 약가 연동제는 한계비용이 상대적으로 적은 의약품 생산구조로 보았을 때 사용량 증가는 평균비용 감소와 관련되고, 따라서 다른 기전 으로 약가가 조정된 후라도 사용량 증가가 관찰된 해당 약가를 추가로 인하하는 것을 고려할 수 있음. 또한 동일 성분 중에서 저가 의약품은 그 대상에서 제외되었으므로 추가 인하로 인한 저가 의약품의 퇴장은 차단됨. 한편, 사용량 증가에 따라 고정비용은 감소하지만 변화비용은 그대로 유지되어, 감소된 고정비용에 해당하는 만큼만 인하시키는 것은 쉽지 않으므로 중복 적용에 대한 우려도 있음. ▷ 만약 사용량 약가 연동제가 적정 의약품비의 존재를 전제한다면, 다른 기전에 의해 약가가 인하된 후에 시용량이 증가된 경우와, 약가는 변동이 없으면서 사용량이 증가된 경우는 보험재정에 끼 치는 영향에 있어 차이가 있으므로 약가 조정 시 사용량 뿐 아니 라 변동된 약품비도 같이 고려하는 방안이 논의될 수 있음 ▷ 참고로 일본의 경우, 실거래가 상환제도와 사용범위 확대로 인한 재산정은 같은 주기로 운영되며, 각 제도로 조정된 인하폭을 비교 하여 더 큰 것을 적용함. - 실거래가 상환제도와 3년 주기 약가재평가는 절대값(실거래가, A7 조정 평균가)를 기준으로 적용하는 제도이므로, 적용 순서에 따라 인하폭이
바뀌지 않고, 가장 큰 인하폭을 적용하면 최종 인하폭과 동일해짐. 그러 므로 가장 큰 인하폭을 적용함 ○ 중장기적 방안: 제도의 단순화 및 주된 제도 위주로 운영 - 약가 사후 평가 제도들은 많지만 각 제도들은 개선의 여지가 있음. 효율성 및 행정비용 면에서 보았을 때, 제도의 숫자를 줄이고 기존 제도를 개선 시키는 것이 필요함. - 일본의 경우, 실거래가 상환제도에서 음성적 할인을 파악하는 것이 가능 해지면서 주된 약가 인하 기전이 됨. 일본에서는 제네릭 대체조제 권장 이후, 제약사들이 높은 할인을 제공하면서 시장점유율을 높이려 하였고, 이러한 할인이 정규 약가 개정 시 파악되면서 약가가 대폭 인하된 것이 관찰됨. 만약 개선된 실거래가 상환제도가 일본 수준의 약가조정 효과를 낸다면 (즉 음성적 할인 및 리베이트를 실제로 파악하는 것이 가능하여, 이에 따라 약가를 조정함) 실거래가 제도 위주로 재정비 될 수 있음. - 만약 개선된 실거래가 제도가 기대한 효과를 낸다면, A7 국가의 조정평 균가의 상한가와 비교하여 약가를 조정하는 3년 주기 약가재평가제도의 효과는 상대적으로 미미할 것으로 예상됨. 따라서 3년 주기 약가재평가를 단계적으로 폐지되는 고려할 수 있으나, 이는 개선된 유통제도의 효과에 따라 결정할 수 있음. 만약 기대하는 효과를 거두지 못하면 3년 주기 약 가재평가의 개선(비교국가로 미국 제외, 우리와 소득 수준이 비슷한 국 가로 확대, 외국에서의 인하폭 반영, 조정평균가가 아닌 최저가)등의 대 안이 고려되어야 함. - 복수등재성분에 대하여 참조가격제 및 실거래가 상환제도를 적용하고, 단수등재성분은 외국 약가와 비교 및 사용량 약가 연동제를 통하여 조정하는 방안도 고려해 볼 수 있는데, 이 때 제네릭 대체조제 및 제네릭 권장정책이 같이 고려되어야 하고 참조가격 수준은 지속적으로 조정 되어야 함.
IV. 제한점
○ 본 연구는 외국의 약가 사후 평가 제도를 소개하면서 현 시점에서 국내 보험 약가 사후 평가제도를 총괄적으로 평가하였다는 의의가 있으나, 제도 간 조정기전을 제언하기에는 그 시점에 있어 한계가 있음. 제도들이 도입된 지 얼마 안 되어 제도 평가에 어려움이 있고, 몇몇 제도는 수정이 논의되고 있음 - 기등재 의약품 목록정비는 2009년부터 본 평가 시작 - 사용량 약가 연동제는 2009년부터 전 품목으로 적용 범위를 확대 - 실거래가 상환제도는 개선안이 논의되고 있음 ○ 특정 제도를 없애거나 단순화시키기에는 현 시점이 한계가 있고, 앞으로 3-5년 안에 고려되는 것이 바람직함. 기등재 의약품 목록정비는 1회성 사업 으로, 앞으로 사업이 종료된 후에는 새로운 관점에서 재평가 기전 전체를 재 논의하는 것이 필요함 ○ 특허 보호 기간의 의약품인 경우, 여러 약가 사후 평가제도로 약가가 조정 되면 신약 개발 의지를 저해할 수 있음. 제약기업의 연구개발 강화방안은 송현종 등의 연구(2009)에서 보다 자세히 논의되므로 본 연구에서는 고려 되지 않음.I. 연구배경
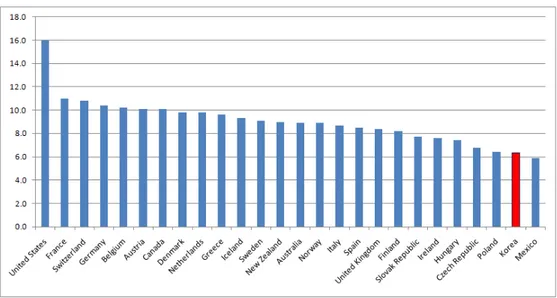
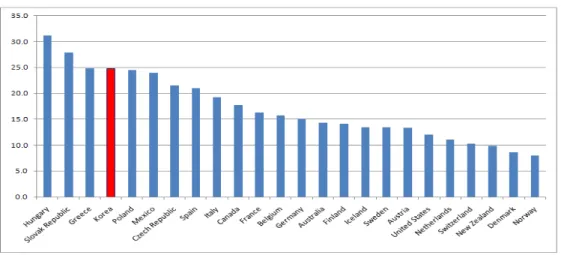
우리나라의 건강보험 진료비 중 약제비 지출은 2001년 4조 1,804억원에서 연평균 14.7%씩 증가하여 2005년의 경우 7조2,298억원으로 72.9% 증가하 였다(이용갑, 2006). 그리고 전체 요양급여비중 약제비의 비율은 2001년 23.5%에서 2005년 29.2%로 증가하였다(국민건강보험공단, 2006). 그림 1-1에서 제시하는 것처럼, 우리나라의 GDP 당 의료비 비중은 6%를 약간 상회하는데, OECD 국가 대비 낮은 편이다. 구매력 환산지수(Purchasing Power Parity, 이하 PPP)를 이용하여 의료비 지출의 절대값을 구한 그림 1-2는, 여전히 우리나라의 의료비지출(1688 US PPP)이 OECD 국가들(평균 3083 US PPP)에 비하여 낮은 편임을 제시한다. 즉, 의료비 지출비중 및 그 절대 비용은 대부분의 OECD 국가 대비 낮은 편이다. 그러나 의료비 중 약제비가 차지하는 비중은 헝가리, 슬로바키아, 그리 스에 이어 4위권(24.7%)이다(그림 1-3). 구매력 환산지수로 변경한 값을 보아도, 1인당 우리나라의 의약품 지출 규모는 416US PPP로, 평균(448 US PPP) 보다 약간 아래다. 즉, 우리나라는 절대 의료비는 다른 OECD그림 1-1. GDP 중 의료비 지출 비중(%), 2007년 기준.
자료원:OECD Health data 2009, 자료 제시된 국가만 포함
그림 1-2. 1인당 의료비지출 (단위: US Purchasing Power Parity, PPP), 2007년 기준
국가 대비 낮은 편이지만, 약제비가 차지하는 비중이 기형적으로 높은 것을 그림 1-3과 1-4는 제시한다. 이에 제한된 보험재정을 합리적으로 지
그림 1-3. 의료비 지출 중 의약품 지출비중 (%), 2007년 기준.
자료원: OECD Health data 2009.자료 제시된 국가만 포함
그림 1-4. 1인당 약품 및 기타 의료기기 비용, US Purchasing Power Parity, 2007
출하고 앞으로의 고령화 사회에 적극적으로 대처하기 위한 제도의 구축 및 운영이 시급하다고 볼 수 있다. 이를 위해 보건복지부는 국민건강보험 의 의약품비 지출 규모를 감소시키고자 ‘건강보험 약제비 적정화 방안’을 발표하였다. 건강보험 약제비 적정화 방안에는 의약품 등재방식을 급여제 외목록(Negative system)에서 선별급여목록(Positive system)으로의 전환 하고, 약가 협상 절차를 도입하겠다는 내용을 포함하고 있다. 또한, 이미 등재된 의약품의 임상적 유용성과 비용효과성을 평가하여 선별 여부를 재 평가하는 기등재 의약품 목록정비 사업, 특허가 만료된 의약품 및 제네릭 의약품 등재 약가를 인하하는 특허만료 의약품 약가인하 제도, 사용량 증 가에 따라 약가를 조정하는 사용량 약가 연동제가 도입되었다. 그런데, 약 가 사후 평가 제도의 숫자가 늘어나면서 새로 도입된 제도들과 기존의 약 가 제도 (실거래가 상환제도, 3년 주기 약가재평가)와의 관계가 규정되지 않았다는 지적이 있다. 즉, 새로 3개의 제도가 도입되면서 기존 제도들과 같이 적용 시 제도의 적용 순서에 따라 약가 인하폭이 달라지고, 여러 제 도에 의한 반복적 약가 인하로 행정 부담 등이 있는 반면, 제도의 숫자는 많지만 약품비를 적절히 통제하지 못하고 있다는 우려가 있다. 본 연구는 크게 세 부분으로 나누어진다. 첫 번째 부분은 국내 보험약가 제도의 역할 및 보험재정 절감효과를 평가하여 현황을 분석하는 것이고, 두 번째는 주요국의 약가사후 평가 제도를 고찰하는 것이고, 마지막은 개선 방 안을 제시하는 것이다.
II. 연구 목적
본 연구의 목적은 우리나라의 기 등재된 보험의약품들의 등재 후 사후 약가 평가 기전을 평가하고, 개선방향을 제시하는 것을 목적으로 한다. 구체적인 연구 목표는 다음과 같다. 첫째, 우리나라의 약가 재평가 기전을 검토하고 국내에서의 적용 현황을 분석하여 정책의 효율성, 문제점 등을 기존 문헌고찰 및 자료 분석 등을 통 하여 분석한다.둘째, 주요국의 약가 재평가 기전들의 상호관계 및 조정 기전을 고찰하여, 각제도의 효과 및 장단점을 파악하며, 국내 제도와 비교한다. 셋째, 외국의 약가 재평가기전 사례를 제시하여 정책 집행가에게 충분한 근거자료를 제시한다.
III. 연구 범위 및 방법
제 2장에서는 기존의 문헌고찰을 통하여 국내에서의 약가 사후 평가 제도 관련된 문헌을 고찰하고, 보험 의약품 청구 현황을 분석하여 각 제도의 효 과를 분석하였다. 제도별 효과 평가 뿐 아니라 요양기관의 보험의약품 청구 자료를 분석하여, 보험 약품비 사용현황에 근거하여 현 약가제도를 전체적 으로 평가하였다. 제 3장은 각종 학술논문, 각국 보험자의 약가 및 급여 관련자료, 관련 서적 등을 근거로 외국의 사후 평가 제도를 조사하였고, 재평가 기전 간의 조정 기전을 요약하였다. 또한 많은 국가에서 적용이 되고 있는 재평가 제도들을 보다 상세히 고찰하여 기술하였다. 제 4장은 2장 및 3장의 결과에 근거하여 국내 약가재평가 기전에 대한 종 합적인 의견을 제시하였다.I. 국내 약가 사후 평가 제도 현황
이미 보험 목록에 등재된 의약품은 실거래가 상환제도, 3년 주기 약가재평가, 특허만료 의약품 약가인하, 기등재 의약품 목록정비, 사용량 약가 연동제의 5개 약가제도를 통하여 약가 및 등재여부가 조정된다. 표 2-1에 제시되어 있는 것 처럼, 상기 5개의 제도는 다른 제도와 구분되는 고유한 목적을 갖고 있다. 즉 3년 주기 약가 재평가는 3년 주기로 선진 7개국(미국, 영국, 이태리, 스위스, 프랑스, 독일, 일본)의 조정 평균 약가(세금, 유통마진 등을 제외하여 국내 약 가와 비교할 수 있도록 조정하여 산출된 약가)를 기준으로 국내의 보험 약가를 인하하며, 실거래가 상환제도는 요양기관의 약가 이윤을 배재하고 차액을 소비자에게 환원하는 것을 목적으로 의약품의 실제 거래가격에 근거하여 약 가를 조정한다. 특허만료 시 약가인하는 특허가 만료되어 제네릭 의약품이 보 험에 등재되었을 때 약가를 일정 % 인하시키는 기전이며, 기등재 의약품 목 록정비는 이미 보험 목록에 등재된 의약품을 치료적ㆍ경제적 가치에 근거하 여 등재 여부를 결정하기 위한 제도이고, 사용량 약가 연동제는 사용량을 약 가와 연동시켜 약품비의 적정화를 도모하는 기전이다. 특허만료 의약품 약가 인하, 기등재 의약품 목록정비, 사용량 약가 연동제의 3개 정책은 약제비 적 정화방안 도입 이후에 새로 도입된 제도들인데, 사용량 약가 연동제는 그 대제도 대상군 내용 기준 주기 실 거 래 가 상환제도 모든 기등재 의약품 요양기관의 약가이윤을 배제하면서도 적정 금액을 수가로 보전해주면서, 차액을 소비자에게 환원 하는 목적 현지 조사에 의한 실거래가 1년 1~4회 3년 주기 약가 재평가 모든 기등재 의약품 A7약가 기준으로 국내 약가 조정 A7 조정평균가 년 1회, 3년 주기 특허만료 가격인하 2006년 12월 이후 특허 만료된 의약품과 그의 복제약 특허만료된 기등재 의약품의 20% 일괄 가격인하 특허여부 및 등재 순서에 따른 약가 조정 1회성 기등재 의 약품 목록 정비 모든 기등재 의약품 임상적 유용성 및 비용효 과성에 근거한 목록정비 치료적 경제적 가치 1회성 사 용 량 약 가연동제 모든 기등재(저가 품 제외, 2004년 이후 등재) 사용량이 증가/사용범위 확대된 약제에 대한 가격 조정 사용량 증가 년 1회 상이 혐상을 통하여 등재된 신약이었으나, 등재된 지 4년이 경과한 기등재 의 약품으로 그 적용범위를 확대한다고 2009년에 고시되었다(2009.1.13). 상기 5개 제도의 목적은 모두 다르지만, 그 적용 대상이 상당수 겹치고, 주 기는 다르며, 독립적으로 운영된다. 즉, 직전 약가 인하폭과 관계없이 (기등재 목록정비와 특허만료 의약품 약가인하가 중복 적용된 경우 제외) 인하폭이 적용되고, 적용 시점도 1년 중에 각기 다른 시기다. 본 장에서는 국내의 5개 약가 조정기전의 현황을 검토하여 그 문제점 및 개선방안을 고찰하고자 한다. 표 2-1. 국내의 약가 사후 평가제도 요약
1. 실거래가 상환제도(실거래가 사후관리)
실거래가 상환제도 관련된 자세한 내용은 최윤정(2009)을 참고하기 바란다.1-1. 도입 배경 우리나라의 보험약가제도는 1977년 7월 1일 의료보험 실시와 함께 시행되 었고, 1999년 11월 15일 실거래가 상환제로 전환되기 전까지 20여 년 간 고 시가 상환제도5)로 유지되어 왔다. 그러나 고시가 상환제는 ① 의약품 유통 단계에서의 음성적인 뒷거래, 이면계약, 덤핑 등 보험의약품 거래의 불공정 행위 및 불투명성과 약가 이윤 확보를 위한 과잉투약 가능성 등으로 인한 국민의 의혹과 불신 초래, ② 제약회사 간 과다경쟁으로 의약품이 저가로 거 래됨에 따라 실거래가와 고시간 간의 차이로 발생하는 약가 이윤이 요양기 관의 몫이 되었기 때문에 국민의 저가거래 혜택으로부터 배제 등의 사회적 문제가 야기되자 의료계, 시민 및 소비자 대표, 정부의 3자간 합의로 실거래가 상환제도를 도입하게 되었다. 또한 의약분업을 앞두고 약가 마진을 없앰으 로써 의료계와 약계의 제도 순응도를 높일 필요가 있다는 현실적 측면을 고 려하여 1999년 11월 평균 30.7%의 약가 인하와 더불어 실거래가 상환제도를 실시하게 되었다. 실거래가 상환제는 근본적으로 요양기관의 약가이윤을 배제하고 차액을 소비자에게 환원하는 것을 목적으로 의약품의 실 구입가격을 조사하여 상한 금액을 조정하는 제도이다. 따라서 의료기관에서 구입하는 품목별 실거래가 의 가중평균가를 산정하여 이를 기준약가 이내에서 품목별 실거래가로 진료 비를 산정․청구하는 것을 원칙으로 하므로, 실구입가보다 높은 가격으로 청구하여 상환 받은 약제비에 대해서는 차액을 환수하고 업무정지 또는 과 징금 처분 한다. 1-2. 정책목표 실거래가 상환제도는 의료기관이 실제 거래한 내역을 기초로 하여 약품비를 상환한다는 점에서 고시가와 차이를 보인다. 이에 보건복지가족부가 의료보험 약가제도를 ‘고시가 상환제도’에서 ‘실거래가 상환제로’로 전환하면서 제시한 정책목표는 다음과 같다(변재환, 2001). 5) 고시가는 제약회사가 신고한 공장도출하가에 일정 유통거래폭을 가산하여 산정하는 제도로써, 의 료보험 의약품으로 등재된 의약품에 한하여 정부가 의약품 가격을 결정하고 그 가격을 기준으로 요양기관에 의약품 대금을 지급하는 제도이다.
○ 요양기관에 의약품 제반 관리비용 등 적정 금액을 수가로 보전해줌으로 써 의약품의 건전한 거래질서를 유도하여 의약품 유통관행의 정상화와 투명화를 도모하고 의약품 가격의 상환이 실구입가에 근거하여 이루어 짐으로써 보험약가의 책정 및 사후관리의 적정화로 건강보험 약가를 정 상화시킨다. ○ 의약품 사용에 따른 요양기관의 이윤을 배제하여 과잉투약 등 의약품 오․남용을 방지하고, 품질이 우수한 의약품 사용을 유도하여 의료서비스 의 수준을 향상시킨다. ○ 제약 기업 간 의약품 품질경쟁 유도로 신약개발을 위한 연구개발 투자 를 장려하고, 음성적 거래를 위한 허구의 매출액으로 인한 세금 및 인건 비 등 경비를 감소시켜 제약 산업의 발전과 국제경쟁력을 강화하고 수 입의 약품 및 다국적 기업 제품과의 경쟁을 통한 국제화시대 적응 능력 을 배양시킨다. ○ 실거래가와 고시가간의 차액을 제거함으로써 소비자인 국민에게 직접적 인 혜택을 주게 되므로 보험재정 및 국민의료비 절감에 기여한다. ○ 의약품 거래에 따른 각종 부조리를 줄이고 의약품 구매 과정에서 음성 적 방법으로 개인 또는 재단으로 누수되는 자금을 요양기관으로 흡수되 도록 함으로써 요양기관과 제약회사에 대한 국민들의 불신을 해소한다. ○ 의약분업 등 의약관련 정책의 정상적인 추진을 위한 토대를 마련한다. 1-3. 평가 및 문제 제기 실거래가 상환제도는 30.7%의 약가인하조치를 취하면서 시작된 제도이며, 제도 실시 이후에도 정기, 혹은 수시 사후관리를 통해 약가를 인하하였는데, 1999년 11월 15일부터 2000년 1월 5일까지 177개 요양기관(174개 종합병원, 3개 의원)에 대한 서면조사, 12개 종합병원에 대한 현지조사를 통하여 실구 입가격을 조사하였다(배은영, 2001). 수입의약품은 1999년 8월 1일부터 11월 15일 기간에 거래된 요양기관의 실 구입가격을 조사하고, 국산의약품은
년도 상한금액 인하 횟수 인하품목수 평균인하율 연간(보험재정)절감추계액 2000 2 617 2.6% 약 33(23)억원 2001 3 5,819 7.4% 약 1,824(1,277)억원 2002 4 1,953 5.7% 약 821(575)억원 2003 3 1,794 3.2% 약 669(468)억원 2004 3 782 2.2% 약 54(38)억원 2005 4 1,561 1.5% 약 130(90)억원 2006 4 1,519 0.9% 약 81(57)억원 2007 2 1,099 0.7% 약 83(58)억원 2008 1 346 0.5% 약13(9)억원 1999년 4월 1일부터 11월 15일 기간에 거래된 요양기관의 실 구입가격을 조 사하여 2000년 2월 1일 319개 품목에 대해 평균 2.0%의 가격인하 조치를 취 하였다. 또한 2000년 상반기 실태조사 결과에 따라 2000년 10월 1일 297개 품목에 대해 평균 3.01% 가격 인하조치를 취했으며, 동년도 하반기 실태조 사를 통해 118개사 1,092개 품목에 대해 평균 13.28%를, 그리고 133개사 2,349개 품목에 대해 자율인하 함으로써 평균 6.53% 가격인하 성과를 보였다. 표 2-2. 연도별 실거래가 사후관리 실적 자료원: 건강보험심사평가원 내부자료 이처럼 제도도입 초기에는 사후관리를 통해 가격 조정을 시도했지만, 요양 기관의 저가구매동기 부족 및 제약업체의 상한가 유지 동기로 요양기관의 품목별 실거래가격은 상한가의 99%를 초과하였고, 가격 조정률도 계속 낮아 져서 2006년 이후부터는 평균 0.9% 이하의 가격 인하율을 보이게 되었다. 또 한 2007년 공정거래위원회가 적발한 제약업체의 리베이트 규모는 5,228억원 이었으며, 약가 인하 방지를 위한 공급자간 가격 담합 등으로 실거래가를 파 악하는데 한계가 있다고 보고되었다.
2. 3년 주기 약가재평가(3년재평가, 약가재평가)
2-1. 도입 배경 3년 주기 약가재평가제도는 보험 등재 이후 가격변동요인을 반영하여국내 약가를 조정하기 위하여 보험약가의 상한금액을 정규적으로 다시 산 정/조정하는 제도로, 2002년 처음 도입되었다.(보건복지부 보험급여과 503-7534.) 종전에는 건강보험에서 한 번 약값이 결정되면 약가에 대한 실제 거래가격이 보험 상한가 대비 낮게 거래된 사실이 적발되어야만 약 가를 조정할 수 있었으나, 3년 주기 약가재평가제도는 기존 제도를 보완 하여 정규적으로 외국의 가격변동요인에 근거하여 국내의 보험 약가를 조 정하는 장치를 제공하였다는데 그 의의가 있다. 재평가 기준은 성분별 최고가 품목 기준으로 선진 7개국(미국, 영국, 프 랑스, 독일, 이태리, 스위스, 일본) 조정평균가 보다 가격이 높은 성분은 그 이하로 조정하며, 제네릭은 최고가 품목의 인하율과 같은 비율로 인하 한다. 등재 및 재평가 후 3년이 경과된 의약품을 식약청 분류번호, 등재년도 등에 따라 매 3년마다 재평가하며, 저가의약품, 마약, 희귀의약품, 퇴장방 지의약품 중 원가보전 의약품은 대상에서 제외한다. 2-2. 문제 제기 3년 약가재평가의 효율 및 그 목적에 있어 개선되어야 한다는 의견이 있다. 즉, 전체 보험등재 신약의 대부분(95.4%)6)을 차지하는 일반신약은 ‘상대비교가’로 약가를 산정하여 ‘A7조정평균가’ 이하가 되고, 2008년이 이미 2번의 주기를 통 한 약가 조정이 있어 약가 조정을 위한 새로운 방법과 기전의 모색이 고려될 수 있다. 또한, A7 국가의 약가는 우리나라보다 훨씬 경제적으로 풍요로운 나라들의 약가이다. 따라서 우리와 소득 수준이 비슷한 국가가 아닌 A7 국 가의 조정평균가를 기준으로 약가를 조정하는 것에 대한 논란, 환율에 민감 하게 반응하는 문제, 미국의 도매평균가격(AWP, Average Wholesale Price)를 포함하는 문제, 외국 약가가 인상되어도 올려주는 기전 부재 등이 고려되어야 한다는 의견이 있다.
구 분 품 목 인하율 연간 약제비 절감액(억원) 대 상 인하품목 비율 청구액 절감액 비율 2002년 12,178 2,732 22.4% 7.2% 9,353 734 7.8% 2003년 344 82 23.8% 7.5% 815 43 5.3% 2004년 749 226 30.1% 6.3% 391 57 14.6% 2005년 5,320 1,477 28.0% 10.8% 5,349 591 11.0% 2006년 4,895 1,421 29.0% 17.2% 5,916 812 13.7% 2007년 4,596 1,570 34.2% 14.1% 10,271 1,565 15.2% 2008년 4,208 699 16.6% 6.6% 4,425 328 7.4% 계 32,290 8,207 - - 36,520 4,130 -2-3. 평가 2002년부터 2005년까지 18,591개 품목의 의약품을 대상으로 가격을 재평 가한 결과 4,517개 품목(24.3%)의 가격을 7.9% 인하하였으며, 최근 2년간은 15.7%의 높은 인하율을 보였다. 그러나 약가재평가의 주요 인하요인이 외국 약가 인하보다는 제도의 연착륙을 위해 도입 원년 발생 인하율의 50%를 조 정한 결과에 대한 나머지 50%의 인하율과 환율하락이었기 때문에 우리의 환 경에서의 내용적인 가치 평가에 의한 재평가 기전이 요구되고 있다는 연구 보고가 있다(이소영, 2008). 표 2-2에서 제시된 바와 같이 2008년 이래로 약가 재평가의 효과가 인하율 및 보험 절감액면에서 급감한 것을 관찰할 수 있다7). 표 2-3. 3년주기 약가재평가로 인한 절감액
3. 특허만료 의약품 약가인하
3-1. 도입 배경 오리지널 의약품은 특허기간 동안에 보장된 독점권을 통하여 신약의 연구 및 개발에 소요된 비용을 회수한다. 이러한 독점적 지위는 신약 개발에 관련 된 연구 개발비용의 보상이라는 차원에서 주요 선진국들에서도 보호되고, 7) 2009년도 보험재정 절감효과는 70억원임약가를 인하하는 기전은 특허 보호 의약품 보다는 특허가 만료 된 의약품 으로 치우쳐있다고 보고된다 (Garattini, 2007; Ghislandhi, 2004). 특허가 만료된 의약품의 경우, 이미 특허보호 기간 동안 독점적 지위를 통하여 연구 개발비를 보상받았으므로 특허기간 동안의 높은 약가가 그대로 유지되어야 할 근거가 부족하다. 외국에서도 특허만료 이후에 일정 % 약가를 인하시키 거나, 약가 인하를 유도하는 기전을 제공하는 사례가 흔히 관찰된다(IMS 2007; Simone 2006). 이에 2006.12.29일 이후로 특허가 만료되어 1st generic 이 등재된 의약품에 대하여 약가를 인하하는 기전으로 “특허만료 의약품 가격 인하제도”가 도입되었다. 즉, 오리지널은 특허만료 전 대비 20% 인하하고, 제네릭의 약가는 진입 순서에 따라 계단식으로 산정된다. 3-2. 문제 제기 가) 이미 특허만료 된 의약품 배제 이 제도는 기존에 특허가 만료된 의약품은 제외하고, 2006년 12월 29일 이 후에 특허가 만료되는 의약품만 대상으로 하였다. 이미 특허가 만료된 의약 품의 약가를 인하하는 기전을 제공하지 못하였다는 점에서 제도의 효과가 제한되어 있고, 2007년 이후에 특허가 만료되는 의약품만 대상으로 한다는 점에서 형평성 또한 문제될 수 있다. 나) 등재 순서에 따라 약가가 지속적으로 차별되는 것에 대한 논란 선진입하는 제네릭에게 높은 약가를 부여하여 시장에 진입 할 재정적 동 기를 부여하는 것은, 제네릭의 진입을 촉진하여 특허만료 오리지널의 독점적 지위를 견제하고 대체 약제의 공급 및 보험재정의 부담을 줄일 수 있다는 면 에서 고려될 수 있다. 미국에서는 선진입 제네릭에게 180일간의 독점적 판매 권을 인정하는 Hatch-Waxman법을 제정(1984년; 2003년 개정)함으로써, 제 네릭의 시장 진입에 대한 재정적 동기를 부여하였다. 또한 진입 순서에 따라 약가 차이를 주는 것은, 후진입 제네릭은 선진입 제네릭 대비 상대적으로 법 률/기술적인 면에서 진입 장벽이 낮아, 선진입 제네릭의 투자를 후진입 제네 릭이 무임승차(free-ride) 한다는 면에서 후진입 제네릭의 약가를 상대적으로 낮게 보상해준다고도 할 수 있다.
문제는, 진입 순서에 따라 차별된 약가 순서가 등재 이후에 역전되는 경우는 거의 없으며, 제약사가 약가를 인하할 동기를 현 제도가 제공하지 못했다는 것이다. 등재 시 결정된 약가의 순서는 재평가 후에도 지속적으로 유지되어, 선진입 제네릭은 후진입 제네릭 대비 시장을 우선 선점할 뿐 아니라 상대적 으로 우월한 가격 구조를 영구적으로 보장받게 된다. 선 제네릭의 높은 약가 는 추후의 재평가 제도의 대상이 되어도 그 약가 순서가 역전되는 경우는 거 의 없으며, 제약사가 경영효율화를 통한 원가 절감으로 약가를 인하하거나 품질 향상을 통하여 경쟁하는 것 보다는 의/약사에 음성적으로 제공하는 할 인/리베이트를 통하여 시장점유율을 확대시키는 구조로 되어있다. 현 제도 하에서, 의/약사는 저렴한 약을 처방할 경제적 동기가 부족하고, 고가약 처방 에 대한 억제책 또한 미약하다. 성분, 약효, 제형이 같은 제네릭 의약품의 가 격을 진입 순서에 따라 차별하는 계단식 약가제를 유지하므로써, 동일 성분 군 간의 가격 인하를 유도하기 보다는 1st 제네릭 등재를 통하여 높은 가격을 보존받는 데 중점을 올릴 동기를 제공하였다(배은영, 2007). 이러한 계단식 약가 제도는 가격 경쟁을 저해할 뿐 아니라 국내 제약회사들이 고비용, 고위 험의 신약 개발 보다는 상대적으로 빠른 기간 안에 적은 비용으로 높은 가격 을 보장받는 선진입 제네릭 등재에 더 의존하는 동기를 제공하였다 (윤희숙, 국회 토론회 용). 저가 구매 동기를 제공하지 못하고 실거래가 파악에 한계 가 있는 실거래가 상환제도 하에서, 진입순서에 따라 가격이 결정되는 계단 식 약가제도는 가격 경쟁을 억제하는 제도적 장치를 마련하여, 선진입 품목 들이 높은 가격을 기반으로 공격적 마케팅 등을 통하여 높은 시장 점유율을 유지하도록 해 왔고, 이는 건강보험 재정에도 부정적인 영향을 끼친다. 우리나라와 유사하게 계단식 약가제도를 도입했던 캐나다의 ontario 사례도 비슷한 결론을 제시한다. 온타리오에서 최초 진입 제네릭은 브랜드 가격의 70%를 초과할 수 없고, 그 다음으로 진입한 제네릭은 최초 진입 제네릭 가격의 90%를(따라서 브랜드의 63%) 초과할 수 없다고 규제하였는데, 이 정책은 1993년 5월 75/90 규제로 시 작해서 1998년 11월 70/90 규제로 개정되었다. 이미 Anis 등(2003) 은 상기 계단식 약가 제도가 제네릭 제조사가 가격을 인하시킬 동기를 제공하지 못하여 성분 내에 제네릭 품 목수가 늘어나도 전체 약가는 감소하지 않는 경향을 제시하였다. 외국의 경향은 3장에서 보다 자세히 고찰하였다.