Attenuation of Lipopolysaccharide-induced Inflammatory and Oxidative Response by 5-Aminolevulinic Acid Phosphate in RAW 264.7 Macrophages
Seon Yeong Ji1,2, Min Yeong Kim1,2, Hyun Hwangbo1,2, Hyesook Lee1,2, Su Hyun Hong1,2, Hee-Jae Cha3, Heui-Soo Kim4, Suhkmann Kim5 and Yung Hyun Choi1,2*
1Anti-Aging Research Center, Dong-eui University, Busan 47340, Korea
2Department of Biochemistry, Dong-eui University College of Korean Medicine, Busan 47227, Korea
3Department of Parasitology and Genetics, Kosin University College of Medicine, Busan 49104, Korea
4Department of Biological Sciences, College of Natural Sciences, Pusan National University, Busan 46241, Korea
5Department of Chemistry, College of Natural Sciences, Pusan National University, Busan 46241, Korea Received May 13, 2021 /Revised June 7, 2021 /Accepted June 17, 2021
5-Aminolevulinic acid phosphate (5-ALA-p) is a substance obtained by eluting 5-ALA (a natural delta amino acid) with aqueous ammonia, adding phosphoric acid to the eluate, and then adding acetone to confer properties suitable for use in photodynamic therapy applications. However, its pharmaco- logical efficacy, including potential mechanisms of antioxidant and anti-inflammatory reactions, re- mains unclear. This study aimed to investigate the effects of 5-ALA-p on oxidative and inflammatory stresses in lipopolysaccharide (LPS)-stimulated RAW 264.7 cells. Our data showed that 5-ALA-p sig- nificantly inhibited excessive phagocytic activity via LPS and attenuated oxidative stress in LPS-treat- ed RAW 264.7 cells. Furthermore, 5-ALA-p improved mitochondrial biogenesis reduced by LPS, sug- gesting that 5-ALA-p restores mitochondrial damage caused by LPS. Additionally, 5-ALA-p sig- nificantly suppressed the release of nitric oxide (NO) and pro-inflammatory cytokines, such as tumor necrosis factor α (TNF-α), interleukin (IL)-1β, and IL-6, which are associated with the inhibition of in- ducible NO synthase and respective cytokine expression. Furthermore, 5-ALA-p reduced the nuclear translocation of nuclear factor-kappa B (NF-κB) and inhibited phosphorylation of mitogen-activated protein kinases (MAPKs), indicating that the anti-inflammatory effect of 5-ALA-p is mediated through the suppression of NF-κB and MAPK signaling pathways. Based on these results, 5-ALA-p may serve as a potential candidate to reduce inflammation and oxidative stress.
Key words : 5-Aminolevulinic acid phosphate, inflammation, MAPKs, NF-κB, oxidative stress
*Corresponding author
*Tel : +82-51-890-3319, Fax : +82-51-890-3333
*E-mail : choiyh@deu.ac.kr
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
서 론
천연 아미노산의 일종인 5-aminolevulinic acid (5-ALA)는 헴 합성 경로에서 생성되는 첫 번째 화합물이며, 헤모글로빈 과 미오글로빈의 주요 구성 요소이다[5, 7]. 또한 5-ALA는 미 토콘드리아 전자 전달 사슬의 최종 효소인 cytochrome c oxi- dase의 활성화를 통한 에너지 대사 관여한다[23]. 특히 미토콘 드리아의 기능 장애는 인슐린 저항성 및 제2형 당뇨병과 관련 이 있으며, 선행 연구에 따르면 포도당 생산이 증가하면 5- ALA의 생산이 감소하는 것으로 나타났다[30, 34]. 이는 5-ALA 가 미토콘드리아의 기능 조절과 밀접한 연관성이 있음을 의미 한다. 전임상 및 임상 연구에 따르면 5-ALA와 구연산 철 나트
륨(sodium ferrous citrate)이 결합된 식이 보충제는 당뇨병 환 자에게 유익할 뿐만 아니라 알츠하이머병 등에도 적용 가능한 것으로 나타났다[7, 23, 24, 33]. 또한 5-ALA는 시스플라틴 유 발 신독성, 횡문근 융해 유발 급성 신장 손상, 저산소증 유발 심근 세포 손상 및 신경독성 등에 대한 광범위한 보호 효과가 있음이 입증되었다[35, 37, 39, 42]. 아울러 5-ALA는 강력한 항염증 효능을 가지며, 이는 heme oxygenase-1 (HO-1)의 발 현 증가에 의한 항산화 활성과 연관성이 있다[9, 15, 42].
5-ALA phosphate (5-ALA-p)는 이온교환 수지에 흡착된 5- ALA를 암모니아수로 용출한 용출액에 인산을 첨가한 후 아세 톤을 첨가하여 침전시켜 얻은 물질로서 광역학 요법(photody- namic therapy)에 적합한 특성을 갖도록 설계된 것이다.
5-ALA-p는 5-ALA에 비하여 수용성과 열 안정성이 높고 흡수 력이 우수한 장점을 가진다[6]. 현재 5-ALA의 전임상 및 임상 연구의 결과를 바탕으로 5-ALA-p가 절제 불가능한 위암 환자 에서 시스플라틴 유발 신장 손상을 예방하는지에 대해 평가하 기 위한 중재 단일군 임상 시험이 미국에서 진행 중이다(trial ID: UMIN000024642). 또한, 미토콘드리아 기능 손상 매개 질 환, 알츠하이머 질환 및 자폐 스펙트럼 장애 환자 등을 위한
임상적 유의성을 조사하기 위해 일본에서 이중 맹검 무작위 위약 대조 시험이 진행 중이다(JMA-IIA00358, jRCTs041180135 및 jRCTs051190017). 특히 Miyake et al. [19]은 최근 저선량 방사선 치료 후의 암 환자 관리를 위한 5-ALA-p 효능 평가에 서 유의적인 결과를 제시한 바 있다. 그러나 이러한 임상적 적용과 유의성 평가에도 불구하고 5-ALA-p의 생리학적 효능 에 대한 연구는 현재까지 거의 이루어진 바가 없다. 본 연구에 서는 5-ALA-p의 기초적인 효능 평가를 위하여 그람음성 세균 (Gram negative bacteria) 세포벽의 peptidoglycan을 둘러싸 는 외막의 중요 구성성분 중의 하나인 지질다당류(lipopoly- saccharide, LPS)가 처리된 RAW 264.7 대식세포 모델에서 산 화적 및 염증성 스트레스에 대한 5-ALA-p의 보호 효과를 평가 하였으며, 유의적인 결과를 얻었기에 이를 보고하고자 한다.
재료 및 방법
세포배양 및 5-ALA-p의 처리
RAW 264.7 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, Republic of Korea)에서 구입하였으며, 10% fetal bo- vine serum 및 antibiotics가 함유된 Dulbecco’s modified Eagle’s medium (WelGENE, Inc., Daegu, Republic of Korea) 을 이용하여 37℃, 5% CO2 조건에서 배양하였다. 5-ALA-p는
㈜삼오제약(Samoh Pharm. Co., Seoul, Republic of Korea)에 서 구입하였으며, 세포에 처리하기 위하여 dimethyl sulfoxide (DMSO, Sigma-Aldrich Chemical Co., St. Louis, MO, USA)에 녹여 stock solution (5 mg/ml)을 제조한 후, 세포 배양 배지로 적정 농도로 희석하여 처리하였다.
세포 생존력 및 세포사멸 분석
LPS 및 5-ALA-p의 단독 또는 동시 처리가 RAW 264.7 세포 에 미치는 세포 독성을 평가하기 위하여 적정 농도의 5-ALA-p 를 1시간 처리 후, 100 ng/ml의 LPS (Sigma-Aldrich Chemical Co.)를 24시간 동안 처리하였다. 처리가 완료된 세포를 대상으 로 세포 생존력을 평가하기 위하여 540 nm에서 microplate reader (Molecular Devices, Sunnyvale, CA, USA)를 이용하여 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) 분석을 실시하였다[9]. 그리고 동일 조건에서 배양된 RAW 264.7 세포를 대상으로 세포사멸(apoptosis) 유도 여부 를 평가하기 위해서는 Annexin-V Apoptosis Detection Kit (BD Biosciences, Can Diego, CA, USA)를 사용하였다
식균 활성 분석
LPS 및 5-ALA-p가 단독 또는 동시 처리된 RAW 264.7 세포 를 대상으로 식균 활성(phagocytic activity) 분석을 위하여 Phagocytosis Assay Kit (Cayman Chemical Co., Ann Arbor, MI, USA)를 이용하였다. 이를 위하여 제조사의 지침에 준하여
유세포 분석기(BD Biosciences)를 이용한 형광 강도에 따른 식균 활성을 평가하였다[13].
Reactive oxygen species (ROS) 생성의 측정
LPS 처리에 의한 ROS의 생성에 미치는 5-ALA-p의 영향을 조사하기 위하여 2’,7’-dichlorodihydrofluorescein diacetate (DCF-DA) 염색법을 적용하였다. 이를 위하여 40 μg/ml의 5-ALA-p를 1시간 전에 처리한 후, 100 ng/ml의 LPS를 1시간 동안 처리하여 세포를 배양하였다. 준비된 세포들을 phos- phate-buffered saline (PBS)로 수세한 후, 10 μM DCF-DA (Invitrogen, Carlsbad, CA, USA)를 첨가하여 37℃, 5% CO2
incubator에서 20분간 반응시키고 유세포 분석기를 이용하여 ROS 생성 변화 여부를 평가하였다.
미토콘드리아 활성 측정
미토콘드리아 활성을 측정하기 위해 RAW 264.7 세포를 40 μg/ml의 5-ALA-p가 포함된 배지에서 1시간 동안 배양하고 100 ng/ml의 LPS를 24시간 동안 처리한 후, 37℃에서 15분 동안 100 nM의 MitoTracker® Red (Invitrogen)로 염색하였다.
염색 후 PBS로 세척한 후, MitoTracker® Red의 형광 강도를 측정하고 제조사의 지침에 따라 미토콘드리아 매스(mitochon- drial mass)의 양적 변화로 미토콘드리아 생물 발생(mitochon- drial biogenesis)의 정도를 유세포 분석기로 분석하여 미토콘드 리아 활성 정도를 평가하였다[9].
일산화 질소(nitric oxide, NO) 및 염증성 사이토카인의 생 성량 분석
LPS 처리에 의한 염증성 반응에 미치는 5-ALA-p의 영향을 조사하기 위하여 NO의 생성 양을 분석하였다. 이를 위하여 선행 방법에 준하여[12] RAW 264.7 세포에 LPS를 단독으로 24시간 동안 처리하거나 다양한 농도의 5-ALA-p를 1시간 동 안 전처리한 후, LPS가 존재하는 배지에서 24시간 배양하였 다. 그 후 세포 배양 상등액 100 μl와 Griess 시약(Sigma- Aldrich Chemical Co.) 100 μl를 혼합하여 반응시킨 후 ELISA reader를 이용하여 540 nm에서 흡광도를 측정하였다. 아울러 동일 조건에서 배양된 세포를 대상으로 염증성 사이토카인의 생성 양을 조사하기 위하여 enzyme-linked immunosorbent assay (ELISA) kit (R&D Systems Inc., Minneapolis, MN, USA)를 제조사의 지침에 준하여 사용하였다[12].
단백질 분리 및 Western blot analysis
5-ALA-p 단독 또는 LPS와 5-ALA-p가 동시에 처리된 세포 들을 수집한 후, 선행 방법에 준하여 총 단백질을 분리하였으 며[12], 핵 및 세포질 단백질을 분리하기 위해서는 NE-PER Nuclear and Cytoplasmic Extraction Reagent (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하였다. 각각의 조
A B
C
D
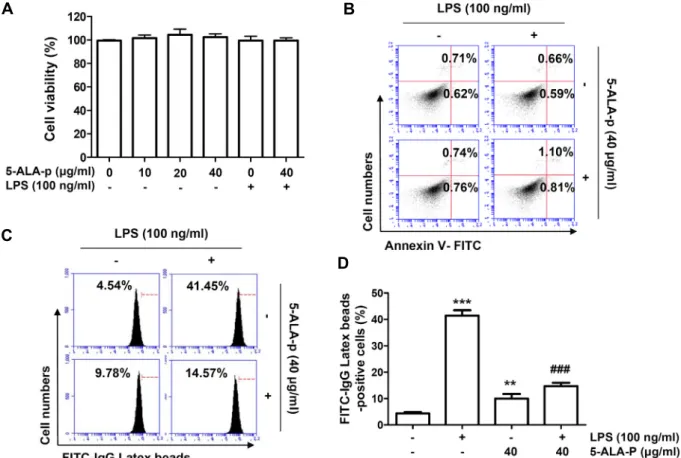
Fig. 1. Effect of 5-ALA-p on the cell viability, apoptosis and phagocytic activity in LPS-treated RAW 264.7 cells. Cells were treated with the indicated concentrations of 5-ALA-p alone for 24 hr or pre-treated with or without 40 μg/ml of 5-ALA-p for 1 hr before 100 ng/ml of LPS stimulation for 24 hr. (A) Cell viability was analyzed using the MTT assay. (B) Cell apoptosis was detected by flow cytometry following annexin-V and propidium iodide double staining. The number of annexin V-positive cells was quantified as the frequency of apoptotic cells. (C and D) Representative flow cytometric histogram (C) and quantita- tive analysis (D) of the phagocytosis capacity using fluorescein isothiocyanate-immunoglobulin G latex beads are presented.
(A and D) The error bars represent the SD of three independent experiments (**p<0.01 and ***p<0.001, vs. LPS-unstimulated cells; ###p<0.001, vs. LPS-stimulated cells).
건에서 배양된 세포에서 분리한 동량의 단백질들을 sodium dodecyl sulphate-polyacrylamide gel을 이용한 전기영동으로 분리하고, nitrocellulose membrane (GE Healthcare, Illinois, IL, USA)으로 전이시켰다. 그 후 각 검출 대상 단백질에 대한 1차 항체(Cell Signaling Technology, Danvers, MA, USA 및 Santa Cruz Biotechnology, Inc., Santa Cruz, CA, USA)를 처 리하여 반응시킨 후, 적정 2차 항체(horseradish peroxidase- conjugated secondary antibodies, Santa Cruz Biothechnology, Inc.)에 다시 반응시킨 후, enhanced chemiluminescence kit (Thermo Fisher Scientific Inc.)와 Fusion Solo S system (Vilber Lourmat, Collégien, France)을 이용하여 해당 단백질의 발현 을 비교하였다.
통계 처리
실험 결과는 최소 3회 반복한 결과의 평균 ± 표준 편차 (standard deviation, SD)로 제시하였다. 이를 위하여 Graph-
Pad Prism5.03 (GraphPad Software, Inc., La Jolla, CA, USA) 을 이용한 통계적 분석을 수행한 후, one-way analysis of var- iance (ANOVA)-Tukey’s-post hoc test를 수행하였으며, p<0.05 의 경우를 통계적으로 유의한 것으로 고려하였다.
결과 및 고찰
RAW 264.7 세포의 증식에 미치는 5-ALA-p의 영향 LPS가 처리된 RAW 264.7 세포에서 5-ALA-p의 항산화 및 항염증 효능 검증을 위한 조건을 설정하기 위하여 RAW 264.7 세포의 증식에 미치는 5-ALA-p의 영향을 먼저 조사하였다.
이를 위하여 다양한 농도의 5-ALA-p가 처리된 조건에서 24시 간 동안 배양한 RAW 264.7 세포를 대상으로 MTT 분석을 수 행하였다. Fig. 1A에 나타낸 결과에서 알 수 있듯이, 40 μg/ml 까지의 5-ALA-p가 처리된 RAW 264.7 세포의 생존율은 대조 군과 유사한 수준으로 유지되어, 5-ALA에 비하여 상대적으로
세포 독성이 현저하게 낮음을 알 수 있었다[9]. 아울러 선행 연구의 조건에 준하여 RAW 264.7 세포의 생존에 유의적인 영향을 미치지 않았던 100 ng/ml의 LPS를 염증성 및 산화적 스트레스 유발 조건으로 설정하였으며[9], 40 μg/ml의 5-ALA-p가 존재하는 조건에서 100 ng/ml의 LPS가 처리된 세포에서도 대조군에 비하여 유의적인 세포 생존율의 감소는 관찰되지 않았다. 따라서 5-ALA-p의 항산화 및 항염증 효능을 조사하기 위하여 LPS의 농도는 100 ng/ml으로, 5-ALA-p의 최고 농도는 40 μg/ml로 선정하였다. 동일 조건에서 세포 독 성이 유발되지 않았음을 재검정하기 위하여 세포사멸에 미치 는 영향을 분석한 결과에서도 5-ALA-p 및 LPS가 단독 처리된 세포에서 뿐만 아니라 5-ALA-p와 LPS가 동시에 처리된 세포 에서도 대조군 세포와 유사하게 유의적인 세포사멸이 유도되 지 않았다(Fig. 1B).
RAW 264.7 세포에서 LPS에 의한 식균 활성에 미치는 5-ALA-p의 영향
비록 적정 수준의 대식세포 활성은 생체 기능의 항상성 유 지에 도움이 되지만, LPS와 같은 자극에 따라 대식세포가 과 도하게 활성화되면 염증성 매개 인자 및 염증성 사이토카인의 생산 증가에 따른 조직 손상 및 생체 조직 괴사 유도 등의 악영향을 미치게 된다[14, 25]. 따라서 LPS에 의한 대식세포의 활성화에 미치는 5-ALA-p의 영향을 평가하기 위하여 다양한 조건에서 배양된 RAW 264.7 세포를 대상으로 식균 활성을 평가하였다. Fig. 1C 및 Fig. 1D에 제시한 결과에서 알 수 있듯 이, 40 μg/ml의 5-ALA-p가 단독 처리된 RAW 264.7 세포는 대조군 세포에 비하여 식균 활성이 2배 이상 증가하였으나, 100 ng/ml의 LPS 단독 처리군에서는 9배 이상으로 증가되었 다. 그러나 5-ALA-p가 존재하는 조건에서는 LPS 단독 처리군 에 비하여 식균 활성이 현저하게 감소하였다. 이는 5-ALA-p가 세포 독성이 없는 조건에서 RAW 264.7 세포의 식균 활성은 다소 증가시키지만, LPS 처리에 의한 RAW 264.7 세포의 과다 활성은 억제할 수 있음을 보여주는 결과이다.
RAW 264.7 세포에서 LPS에 의한 ROS의 생성에 미치는 5-ALA-p의 영향
ROS의 과잉 생산으로 정의되는 산화적 스트레스는 염증을 포함한 다양한 인체 병리학적 상태와 밀접한 관련이 있다[2, 18]. 만성 염증 반응 동안에 ROS는 nuclear factor-kappa B (NF-κB) 신호 전달 경로의 활성화와 염증 관련 유전자의 과발 현을 통해 대식세포의 염증 신호를 증폭한다[11, 36]. 또한 ROS는 세포 내 단백질, 지질 및 핵산을 포함한 여러 생체 물질 들의 변형을 유발하여 세포 항상성을 저하시키고, 암, 동맥경 화, 염증과 당뇨 등의 다양한 질환을 일으키는 원인이 된다[26, 29]. 따라서 5-ALA-p의 항산화 효능을 평가하기 위하여 DCF- DA 염색을 통하여 LPS에 의해 유도되는 ROS의 생성을 줄일
수 있는지를 조사하였다. Fig. 2A 및 Fig. 2B에 나타낸 유세포 분석 분석의 결과에 의하면, 100 ng/ml의 LPS가 단독 처리된 RAW 264.7 세포에서는 대조군에 비하여 ROS의 생성이 20배 이상 증가되었다. 그러나 5-ALA-p가 전처리된 조건에서는 대 조군 수준으로 ROS의 생성이 거의 완벽하게 차단되어 5- ALA-p가 LPS의 처리에 따른 산화적 스트레스를 현저하게 감 소시켰음을 보여주었다.
RAW 264.7 세포에서 LPS에 의한 미토콘드리아 활성 저하 에 미치는 5-ALA-p의 영향
한편 미토콘드리아는 ROS 생성을 담당하는 주요 세포 내 소기관이면서 염증성 반응과 연관된 산화적 스트레스에 취약 하다[17, 27]. 따라서 5-ALA-p에 의한 ROS 생성의 억제가 미 토콘드리아의 활성과 어떤 연관성이 있는지를 조사하기 위하 여 미토콘드리아 매스의 dye인 MitoTracker Red를 이용한 유 세포 분석을 실시하였다. MitoTracker Red는 음전하를 띤 극 성화된 미토콘드리아에 의해 흡수되며, 미토콘드리아 막 전위 (mitochondrial membrane potential, MMP (ΔΨm))에 의존적 이다[3, 40]. 즉 MMP (ΔΨm)의 소실은 염증성 면역 세포에서 미토콘드리아 산화적 인산화(mitochondrial oxidative phos- phorylation)에서 해당 과정으로의 대사 전환과 관련이 있기 때문에 MitoTracker Red는 미토콘드리아의 생물 발생의 증감 을 바탕으로 미토콘드리아 기능의 활성 또는 소실을 평가하는 데 사용할 수 있다[8, 20]. 선행 연구의 결과와 유사하게[20], 정상 배지에서 배양된 RAW 264.7 세포에 비하여 LPS가 처리 된 세포에서는 MitoTracker Red의 평균 형광 강도(mean fluo- rescence intensity, MFI)가 감소되어 미토콘드리아의 생물 발 생이 억제되었음을 보여주었다. 그러나 5-ALA-p 단독 처리군 에서는 대조군에 비하여 3.5배 정도 증가되었으며, 5-ALA-p와 LPS가 동시 처리된 조건에서 배양된 세포에서는 대조군에 비 하여 2배 이상의 MFI를 보여주었다(Fig. 2C, Fig. 2D). 이는 5-ALA-p가 LPS에 의한 RAW 264.7 세포의 미토콘드리아 활 성 저하를 유의적으로 차단하였음을 의미한다.
RAW 264.7 세포에서 LPS에 의한 염증성 반응에 미치는 5-ALA-p의 영향
LPS에 의한 대식세포의 활성화는 세포막의 Toll-like recep- tor 4 (TLR4)를 경유하여 유도되며, TLR4 경로의 활성화는 세 포 내의 다양한 신호 전달 경로의 활성화로 이어져 염증성 매개 인자 및 염증성 사이토카인의 생성을 촉진한다[38, 41].
NO는 prostaglandin E2와 함께 중요한 매개 인자로서 염증성 사이토카인과 함께 만성 염증성 질환의 발병에 중요한 역할을 한다[1, 22, 32]. 따라서 특정 약물에 의한 대식세포의 불활성화 와 이들의 생성 억제는 항염증 효능의 평가 지표로 활용된다.
본 연구의 결과에 의하면, LPS가 단독으로 처리된 RAW 264.7 세포에서는 NO 뿐만 아니라 tumor necrosis factor-α (TNF-α),
A
B
C
D
Fig. 2. Inhibition of ROS generation and increase of mitochondrial biogenesis by 5-ALA-p in LPS-treated RAW 264.7 cells. Cells were pre-treated with 40 μg/ml of 5-ALA-p for 1 hr and then treated with 100 ng/ml of LPS for 1 hr (A and B) or 24 hr (C and D). (A and B) The cells were collected, and then stained with DCF-DA for flow cytometry. Representative flow cytometric histogram (A) and quantitative analysis (B) of the DCF-DA-stained cells are presented. (C and D) The cells were stained with MitoTracker® Red, and the total mitochondrial mass was analyzed by flow cytometry. Representative flow cytometric histogram (C) and quantitative analysis (D) of the MitoTracker® Red-stained cells are presented. (B and D) The error bars represent the SD of three independent experiments (***p<0.001, vs. LPS-unstimulated cells; ##p<0.01 and ###p<0.001, vs. LPS-stimulated cells).
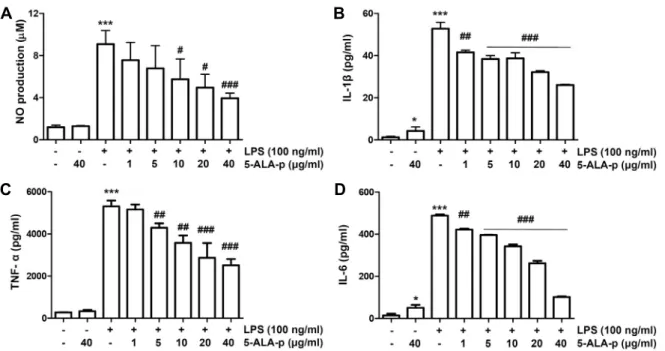
interleukin (IL)-1β 및 IL-6와 같은 염증성 사이토카인의 생성 이 매우 증가되었다. 그러나 5-ALA-p가 전처리된 조건에서는 이들의 생성이 5-ALA-p 처리 농도의 증가에 따라 유의적으로 모두 감소하였다(Fig. 3). 아울러 NO의 생성에 핵심적인 역할 을 하는 효소인 inducible NO synthase (iNOS)와 각 사이토카 인의 발현 또한 5-ALA-p가 존재하는 조건에서는 현저하게 억 제되었다(Fig. 4A). 따라서 5-ALA-p에 의한 NO 및 염증성 사 이토카인의 생성 억제는 그들 유전자의 발현 차단에 의한 것 이며, 5-ALA-p의 항염증 잠재력이 항산화 효과와 관련이 있을 수 있음을 시사하여 준다.
RAW 264.7 세포에서 LPS에 의한 세포 신호 전달계의 활성 에 미치는 5-ALA-p의 영향
Nuclear factor-kappa B (NF-κB)는 염증 관련 효소 및 사이 토카인의 전사 활성을 조절하는 핵심 전사 인자로서 염증 조 절에 중요한 역할을 한다[16, 31]. 생리적 조건에서 p65 및 p50 subunit의 이량체로 구성된 NF-κB는 내인성 억제제인 in- hibitor kappa B-alpha (IκB-α)와 결합하여 세포질에 존재하지
만, LPS를 포함한 염증성 자극 신호가 유발되면 IκB-α는 빠르 게 인산화되고 프로테아좀 매개 경로(proteasome-mediated pathway)를 통해 분해된다. 이로 인하여 IκB-α에서 해리된 NF-κB는 핵으로 이동하여 염증 관련 유전자의 전사 활성을 유도한다[10, 21]. Extracellular signal-regulated kinase (ERK), c-Jun N-terminal kinase (JNK) 및 p38 mitogen-activated pro- tein kinase (MAPK)를 포함한 serine/threonine 단백질 kin- ase 계열인 MAPKs는 또한 NF-κB 경로를 통해 활성화된 대식 세포에서 전 염증 인자의 생성에 기여하는 신호 전달 이벤트 를 제어하는 데 직접 관여하며, ROS에 매우 민감하게 반응한 다[4, 28]. 따라서 산화적 스트레스와 함께 NF-κB 및 MAPKs 활성화를 효과적으로 조절하는 약물은 다양한 염증성 질환 치료에 유망한 후보가 될 수 있다. 본 연구에서 5-ALA-p의 염증 억제 기전 연구의 수행을 위하여 LPS에 의한 NF-κB 및 MAPKs의 활성에 미치는 5-ALA-p의 영향을 평가하였다. Fig.
4B 및 Fig. 4C에 나타낸 결과에 의하면, LPS가 처리된 RAW 264.7 세포에서 NF-κB p65의 발현은 세포질에서 현저히 감소 된 반면, 핵에서의 발현은 증가되었으며, 세포질에서 IκB-α의
A B
C D
Fig. 3. Inhibitory effect of 5-ALA-p on the production of NO and pro-inflammatory cytokines in LPS-stimulated RAW 264.7 cells.
Cells were treated with the indicated concentrations of 5-ALA-p for 1 hr and then stimulated with 100 ng/ml of LPS for 24 hr. (A) The concentration of NO in the culture medium was determined by the Griess reaction. (B-D) Cytokine concen- trations, including IL-1β (B), TNF-α (C), and IL-6 (D), in the culture medium were measured by ELISA kits. Data are given as the mean ± SD of three independent experiments (*p<0.05 and ***p<0.001, vs. LPS-unstimulated cells; #p<0.05, ##p<0.01 and
###p<0.001, vs. LPS-stimulated cells).
A
B
C
D
Fig. 4. Effect of 5-ALA-p on the expression of iNOS and pro-inflammatory, members of NF-κB and MAPKs signaling pathways in LPS-stimulated RAW 264.7 cells. Cells were treated with the indicated concentrations of 5-ALA-p for 1 hr and then stimu- lated with 100 ng/ml of LPS for 24 hr (A and C) or 1 hr (B and D). (A and C) Total cell lysates were prepared and the levels of the indicated proteins were evaluated by Western blot analysis. Actin was used as an internal control. (B and D) Cytoplasmic and nuclear proteins were isolated and determined the expression of NF-κB and IκB-α. Actin and lamin B were used as loading controls for cytosolic and nuclear proteins, respectively.
IκB-α의 발현은 감소되어 LPS 자극에 의하여 NF-κB가 핵으로 전이되었음을 알 수 있었다. 그러나 5-ALA-p가 존재하는 조건 에서 이러한 변화는 현저히 감소되어 5-ALA-p가 NF-κB 신호 경로의 활성을 억제하였음을 보여주었다. 그리고, 비록 5-ALA-p가 MAPKs 중에서 p38 MAPK의 인산화를 다소 증가 시켰으나, LPS 자극에 이해 증가된 ERK, JNK 및 p38 MAPK 의 인산화 수준을 모두 감소시켰다. 이러한 결과는 5-ALA-p가 NF-κB 및 MAPKs 신호 경로를 억제함으로써 NO 및 염증성 사이토카인의 생성을 억제하였음을 시사한다.
본 연구에서는 최근 활발한 임상 연구로 주목받고 있는 5-ALA-p의 잠재적 효능을 평가하기 위하여 LPS 자극에 의한 산화성 및 염증성 반응에 미치는 영향을 조사하였다. 본 연구 의 결과에 의하면 5-ALA-p는 세포 독성이 없는 조건에서 LPS 에 의한 RAW 264.7 세포의 식균 활성을 유의적으로 억제하였 다. 또한 5-ALA-p는 ROS 생성을 억제하였으며, 이는 미토콘 드리아 기능 소실의 억제와 연관성이 있었다. 아울러 5-ALA-p 에 의한 염증성 매개 인자 및 염증성 사이토카인의 생성 억제 는 NF-κB와 MAPKs와 같은 세포 내 신호전달 경로의 활성 차단과 밀접한 관련이 있음을 확인하였다. 비록 이러한 5- ALA-p의 효능이 ROS 축적의 차단에 의한 NF-κB 및 MAPKs 신호 경로의 억제에 의한 것으로 추정되지만, 미토콘드리아의 기능 보존 효능이 mitophagy 관련 ROS 생성 의존적인지에 대한 추가 연구가 요구된다. 아울러 TLR4 매개 신호전달 과정 에서 5-ALA-p가 LPS에 대한 antagonist로서 역할을 할 가능 성과 ROS 생성과의 연계성에 관한 연구도 동물 실험과 함께 추후 보충되어야 할 것이다.
감사의 글
이 논문은 해양수산부 재원으로 한국해양과학기술진흥원 의 지원을 받아 수행된 연구임(20150242, 환경변화에 대응한 오믹스 기반 수산생물 감염성질병 제어기술 개발).
The Conflict of Interest Statement
The authors declare that they have no conflicts of interest with the contents of this article.
References
1. Aderem, A. and Ulevitch, R. J. 2000. Toll-like receptors in the induction of the innate immune response. Nature 406, 782-787.
2. Brüne, B., Dehne, N., Grossmann, N., Jung, M., Namgaladze, D., Schmid, T., von Knethen, A. and Weigert, A. 2013. Redox control of inflammation in macrophages. Antioxid. Redox Signal. 19, 595-637.
3. Buckman, J. F., Hernández, H., Kress, G. J., Votyakova, T.
V., Pal, S. and Reynolds, I. J. 2001. MitoTracker labeling in primary neuronal and astrocytic cultures: influence of mi- tochondrial membrane potential and oxidants. J. Neurosci.
Methods 104, 165-176.
4. Fu, P., Birukova, A. A., Xing, J., Sammani, S., Murley, J. S., Garcia, J. G., Grdina, D. J. and Birukov, K. G. 2009. Amifos- tine reduces lung vascular permeability via suppression of inflammatory signalling. Eur. Respir. J. 33, 612-624.
5. Fujino, M., Nishio, Y., Ito, H., Tanaka, T. and Li, X. K. 2016.
5-Aminolevulinic acid regulates the inflammatory response and alloimmune reaction. Int. Immunopharmacol. 37, 71-78.
6. Higashikawa, F., Kanno, K., Ogata, A. and Sugiyama, M.
2020. Reduction of fatigue and anger-hostility by the oral administration of 5-aminolevulinic acid phosphate: a random- ized, double-blind, placebo-controlled, parallel study. Sci.
Rep. 10, 16004.
7. Higashikawa, F., Noda, M., Awaya, T., Tanaka, T. and Sugiyama, M. 2013. 5-Aminolevulinic acid, a precursor of heme, reduces both fasting and postprandial glucose levels in mildly hyperglycemic subjects. Nutrition 29, 1030-1036.
8. Ip, W. K. E., Hoshi, N., Shouval, D. S., Snapper, S. and Medzhitov, R. 2017. Anti-inflammatory effect of IL-10 medi- ated by metabolic reprogramming of macrophages. Science 356, 513-519.
9. Ji, S. Y., Cha, H. J., Molagoda, I. M. N., Kim, M. Y., Kim, S. Y., Hwangbo, H., Lee, H., Kim, G. Y., Kim, D. H., Hyun, J. W., Kim, H. S., Kim, S., Jin, C. Y. and Choi, Y. H. 2021.
Suppression of lipopolysaccharide-induced inflammatory and oxidative response by 5-aminolevulinic acid in RAW 264.7 macrophages and zebrafish larvae. Biomol. Ther (Seoul).
doi: 10.4062/biomolther.2021.030.
10. Kaminska, B. 2005. MAPK signalling pathways as molecular targets for anti-inflammatory therapy-from molecular mech- anisms to therapeutic benefits. Biochim. Biophys. Acta 1754, 253-262.
11. Kauppinen, A., Suuronen, T., Ojala, J., Kaarniranta, K. and Salminen, A. 2013. Antagonistic crosstalk between NF- kappaB and SIRT1 in the regulation of inflammation and metabolic disorders. Cell Signal. 25, 1939-1948.
12. Kim, S. Y., Jin, C. Y., Kim, C. H., Yoo, Y. H., Choi, S. H., Kim, G. Y., Yoon, H. M., Park, H. T. and Choi, Y. H. 2019.
Isorhamnetin alleviates lipopolysaccharide-induced in- flammatory responses in BV2 microglia by inactivating NF- κB, blocking the TLR4 pathway and reducing ROS genera- tion. Int. J. Mol. Med. 43, 682-692.
13. Kwon, D. H., Lee, H., Park, C., Hong, S. H., Hong, S. H., Kim, G. Y., Cha, H. J., Kim, S., Kim, H. S., Hwang, H. J.
and Choi, Y. H. 2019. Glutathione induced immune-stim- ulatory activity by promoting M1-like macrophages polar- ization via potential ROS scavenging capacity. Antioxidants (Basel) 8, 413.
14. Lee, Y. G., Lee, J., Byeon, S. E., Yoo, D. S., Kim, M. H., Lee, S. Y. and Cho, J. Y. 2011. Functional role of Akt in macro- phage-mediated innate immunity. Front. Biosci (Landmark Ed). 16, 517-530.
15. Liu, C., Zhu, P., Fujino, M., Isaka, Y., Ito, H., Takahashi,
K., Nakajima, M., Tanaka, T., Zhuang, J. and Li, X. K. 2019.
5-Aminolaevulinic acid (ALA), enhances heme oxygenase (HO)-1 expression and attenuates tubulointerstitial fibrosis and renal apoptosis in chronic cyclosporine nephropathy.
Biochem. Biophys. Res. Comm. 508, 583-589.
16. Lu, Y. C., Jayakumar, T., Duann, Y. F., Chou, Y. C., Hsieh, C. Y., Yu, S. Y., Sheu, J. R. and Hsiao, G. 2011. Chondropro- tective role of sesamol by inhibiting MMPs expression via retaining NF-kappaB signaling in activated SW1353 cells. J.
Agric. Food. Chem. 59, 4969-4978.
17. Magnani, N. D., Marchini, T., Calabró, V., Alvarez, S. and Evelson, P. 2020. Role of mitochondria in the redox signal- ing network and its outcomes in high impact inflammatory syndromes. Front. Endocrinol (Lausanne). 11, 568305.
18. Mills, E. L. and O'Neill, L. A. 2016. Reprogramming mi- tochondrial metabolism in macrophages as an anti-inflam- matory signal. Eur. J. Immunol. 46, 13-21.
19. Miyake, M., Tanaka, N., Asakawa, I., Yamaki, K., Inoue, T., Suzuki, S., Hori, S., Nakai, Y., Anai, S., Torimoto, K., Torit- suka, M., Nakagawa, H., Tsukamoto, S., Fujii, T., Ohbayashi, C., Hasegawa, M., Kasahara, M. and Fujimoto, K. 2020. A prospective study of oral 5-aminolevulinic acid to prevent adverse events in patients with localized prostate cancer un- dergoing low-dose-rate brachytherapy: Protocol of the AMBER study. Contemp. Clin. Trials Commun. 19, 100593.
20. Monteiro, L. B., Davanzo, G. G., de Aguiar, C. F. and Moraes-Vieira, P. M. M. 2020. Using flow cytometry for mi- tochondrial assays. MethodsX 7, 100938.
21. Muralidharan, S. and Mandrekar, P. 2013. Cellular stress re- sponse and innate immune signaling: integrating pathways in host defense and inflammation. J. Leukoc. Biol. 94, 1167- 1184.
22. Nikaido, H. 2003. Molecular basis of bacterial outer mem- brane permeability revisited. Microbiol. Mol. Biol. Rev. 67, 593-656.
23. Ogura, S., Maruyama, K., Hagiya, Y., Sugiyama, Y., Tsuchiya, K., Takahashi, K., Abe, F., Tabata, K., Okura, I., Nakajima, M. and Tanaka, T. 2011. The effect of 5-aminolevulinic acid on cytochrome c oxidase activity in mouse liver. BMC Res.
Notes 4, 66.
24. Omori, C., Motodate, R., Shiraki, Y., Chiba, K., Sobu, Y., Kimura, A., Nakaya, T., Kondo, H., Kurumiya, S., Tanaka, T., Yamamoto, K., Nakajima, M., Suzuki, T. and Hata, S.
2017. Facilitation of brain mitochondrial activity by 5-amino- levulinic acid in a mouse model of Alzheimer's disease.
Nutr. Neurosci. 20, 538-546.
25. Ostareck, D. H. and Ostareck-Lederer, A. 2019. RNA-bind- ing proteins in the control of LPS-induced macrophage response. Front. Genet. 10, 31.
26. Patergnani, S., Bouhamida, E., Leo, S., Pinton, P. and Rimessi, A. 2021. Mitochondrial oxidative stress and "Mito-Inflam- mation": Actors in the diseases. Biomedicines 9, 216.
27. Picca, A., Calvani, R., Coelho-Junior, H. J. and Marzetti, E.
2021. Cell death and inflammation: The role of mitochondria in health and disease. Cells 10, 537.
28. Rahman, I. and MacNee, W. 1998. Role of transcription fac-
tors in inflammatory lung diseases. Thorax 53, 601-612.
29. Rani, V., Deep, G., Singh, R. K., Palle, K. and Yadav, U.
C. 2016. Oxidative stress and metabolic disorders: Pathogen- esis and therapeutic strategies. Life Sci. 148, 183-193.
30. Rehani, P. R., Iftikhar, H., Nakajima, M., Tanaka, T., Jabbar, Z. and Rehani, R. N. 2019. Safety and mode of action of diabetes medications in comparison with 5-aminolevulinic acid (5-ALA). J. Diabetes Res. 2019, 4267357.
31. Rigoglou, S. and Papavassiliou, A. G. 2013. The NF-κB sig- nalling pathway in osteoarthritis. Int. J. Biochem. Cell. Biol.
45, 2580-2584.
32. Rocca, B. and FitzGerald, G. A. 2002. Cyclooxygenases and prostaglandins: shaping up the immune response. Int. Imm- unopharmacol. 2, 603-630.
33. Rodriguez, B. L., Curb, J. D., Davis, J., Shintani, T., Perez, M. H., Apau-Ludlum, N., Johnson, C. and Harrigan, R. C.
2012. Use of the dietary supplement 5-aminiolevulinic acid (5-ALA) and its relationship with glucose levels and hemo- globin A1C among individuals with prediabetes. Clin.
Transl. Sci. 5, 314-320.
34. Saitoh, S., Okano, S., Nohara, H., Nakano, H., Shirasawa, N., Naito, A., Yamamoto, M., Kelly, V. P., Takahashi, K., Tanaka, T., Nakajima, M. and Nakajima, O. 2018. 5-amino- levulinic acid (ALA) deficiency causes impaired glucose tol- erance and insulin resistance coincident with an attenuation of mitochondrial function in aged mice. PLoS One 13, e0189593.
35. Takase, N., Inden, M., Sekine, S. I., Ishii, Y., Yonemitsu, H., Iwashita, W., Kurita, H., Taketani, Y. and Hozumi, I. 2017.
Neuroprotective effect of 5-aminolevulinic acid against low inorganic phosphate in neuroblastoma SH-SY5Y cells. Sci.
Rep. 7, 5768.
36. Tan, H. Y., Wang, N., Li, S., Hong, M., Wang, X. and Feng, Y. 2016. The reactive oxygen species in macrophage polar- ization: Reflecting its dual role in progression and treatment of human diseases. Oxid. Med. Cell. Longev. 2016, 2795090.
37. Terada, Y., Inoue, K., Matsumoto, T., Ishihara, M., Hamada, K., Shimamura, Y., Ogata, K., Inoue, K., Taniguchi, Y., Horino, T., Karashima, T., Tamura, K., Fukuhara, H., Fuji- moto, S., Tsuda, M. and Shuin, T. 2013. 5-Aminolevulinic acid protects against cisplatin-induced nephrotoxicity with- out compromising the anticancer efficiency of cisplatin in rats in vitro and in vivo. PLoS One 8, e80850.
38. Tsan, M. F. 2006. Toll-like receptors, inflammation and can- cer. Semin. Cancer Biol. 16, 32-37.
39. Uchida, A., Kidokoro, K., Sogawa, Y., Itano, S., Nagasu, H., Satoh, M., Sasaki, T. and Kashihara, N. 2019. 5-amino- levulinic acid exerts renoprotective effect via Nrf2 activation in murine rhabdomyolysis-induced acute kidney injury.
Nephrology 24, 28-38.
40. Xiao, B., Deng, X., Zhou, W. and Tan, E. K. 2016. Flow cy- tometry-based assessment of mitophagy using MitoTracker.
Front. Cell. Neurosci. 10, 76.
41. Zamyatina, A. and Heine, H. 2020. Lipopolysaccharide rec- ognition in the crossroads of TLR4 and caspase-4/11 medi- ated inflammatory pathways. Front. Immunol. 11, 585146.
초록:RAW 264.7 대식세포에서 lipopolysaccharide 자극에 의한 염증성 및 산화적 스트레스에 미 치는 5-aminolevulinic acid phosphate의 영향
지선영1,2․김민영1,2․황보현1,2․이혜숙1,2․홍수현1,2․차희재3․김희수4․김석만5․최영현1,2*
(1동의대학교 항노화연구소, 2동의대학교 한의과대학 생화학교실, 3고신대학교 의과대학, 4부산대학교 생명과학과,
5부산대학교 화학과)
5-ALA-p는 천연 아미노산인 5-ALA를 암모니아수로 용출하고 인산과 아세톤을 첨가하여 광역학 요법에 적합 한 특성을 갖도록 개발된 물질이다. 그러나 항산화 및 항염증에 대한 잠재적인 기전을 포함한 약리학적 효능은 아직 명확하지 않다. 본 연구에서는 LPS로 자극된 RAW 264.7 세포에서 산화적 및 염증성 반응에 대한 5-ALA-p 의 효과를 평가하였다. 본 연구의 결과에 의하면, 5-ALA-p는 LPS에 의한 RAW 264.7 세포의 과도한 식균 활성을 유의하게 억제하였고 산화적 스트레스를 약화시켰다. 5-ALA-p는 또한 LPS에 의해 감소된 미토콘드리아 생물 발 생을 개선하였으며, 이는 5-ALA-p가 LPS로 인한 미토콘드리아 손상을 복원시켰음을 시사한다. 아울러 5-ALA-p 는 NO와 TNF-α, IL-1β 및 IL-6과 같은 염증성 사이토카인의 생성을 현저히 억제하였으며, 이는 iNOS 및 각 사이 토카인의 발현 감소와 연관성이 있었다. 나아가 5-ALA-p는 NF-κB의 핵 전이를 감소시키고 MAPKs의 인산화를 억제하여 5-ALA-p의 항염증 효과가 이들 신호전달 경로의 활성 억제와 매개되었음을 보여주었다. 이러한 결과들 은 5-ALA-p가 산화적 및 염증성 스트레스를 줄이는 잠재적인 후보 약물로 적용될 수 있음을 의미한다.
42. Zhao, M., Zhu, P., Fujino, M., Nishio, Y., Chen, J., Ito, H., Takahashi, K., Nakajima, M., Tanaka, T., Zhao, L., Zhuang, J. and Li, X. K. 2016. 5-Aminolevulinic acid with sodium ferrous citrate induces autophagy and protects cardiomy-
ocytes from hypoxia-induced cellular injury through MAPK- Nrf-2-HO-1 signaling cascade. Biochem. Biophys. Res. Commun.
479, 663-669.