접수: 2020년 7월 2일, 승인: 2020년 8월 30일 연락처: 나현오, 14662, 경기도 부천시 지봉로 43
가톨릭대학교 성심교정 약학대학
Tel: (02) 2164-6598, Fax: (02) 2164-4059 E-mail: hola@catholic.ac.kr
Correspondence to: Hyen Oh La, PhD
College of Pharmacy, The Catholic University of Korea, 43 Jibong-ro, Bucheon 14662, Korea
Tel: +82-2-2164-6598, Fax: +82-2-2164-4059 E-mail: hola@catholic.ac.kr
국내 자발적 약물이상사례 보고자료를 이용한 로수바스타틴의 실마리 정보 탐지
가톨릭임상연구지원센터
1, 가톨릭대학교 의과대학 의료정보학교실
2, 가톨릭대학교 의과대학 예방의학교실
3, 가톨릭대학교 약학대학
4윤혜영1ㆍ최인영2ㆍ임현우3ㆍ나현오4
Signal Detection of Rosuvastatin Calcium Using Spontaneous Adverse Drug Event Reports
Hye Young Yoon, MS
1, In Young Choi, PhD
2, Hyeon Woo Yim, MD, PhD
3and Hyen Oh La, PhD
41
Clinical Research Coordinating Center, The Catholic University of Korea,
2Department of Medical Informatics, College of Medicine, The Catholic University of Korea,
3Department of Preventive Medicine, College of Medicine,
The Catholic University of Korea,
4College of Pharmacy, The Catholic University of Korea, Bucheon, Korea
Objective: The purpose of this study was to detect for the signals of rosuvastatin calcium applying a data mining anal- ysis based on data of domestic adverse drug reaction reporting system and to check the detected signals listed in the drug label. Methods: This study used the database based on drug-related side effects and adverse reactions, reported spontaneously to the Ministry of Food and Drug Safety (MFDS) through pharmacovigilance centers between Jul. 2009 and Dec. 2010. The database contains 46,231 reports of adverse drug events (ADEs) and 153,557 drug-adverse events (AEs) pairs reconstituted. Data mining analysis by proportional reporting ratio (PRR), reporting odds ratio (ROR), and information component (IC) conducted to detect signals of rosuvastatin calcium. Results: The data which attributed to rosuvastatin calcium was 199 ADEs and 297 drug-AE pairs. There were 76 types of AEs in 297 drug-AE pairs. The AEs detected as signals of rosuvastatin calcium were 36 out of 76 AEs. The signals that did not include in the label of rosuvastatin calcium were 15 out of 36 signals (41.7%). Most of the unlabeled signals were AEs that rosuvastatin calcium reported as concomitant drugs. Unlabeled signals based on more than two drug-AE pairs were bradycardia, hy- perkalemia, and azotemia. Conclusion: The detected signals of rosuvastatin calcium were 36 reports. The detected signals not listed on the domestic and foreign drug labels were 41.7% among them, which was 19.7% of all reported types of rosuvastatin calcium adverse events. (JPERM 2020;12:85-90)
Key Words: Adverse drug reaction reporting systems; Drug-related side effects and adverse reactions; Data mining;
Rosuvastatin calcium, drug labeling
서 론
국내에서 진행되고 있는 시판 후 약물감시활동은 자발적 부
작용 보고 제도를 통한 새로운 약물이상반응의 파악 및 실마리
정보의 검색과 시판과정에서 이미 허가된 안전성과 유효성을
재검토 하는 신약 등의 재심사 제도 등이 대표적이다.
1)정부는
Table 1. Signal detection criteria for the implemented for the data mining indices
Indices Criteria for signal detection PRR (proportional
reporting ratio)
Adverse events ≥ 3, PRR ≥ 2, chi-squared ≥ 4 ROR (reporting odds ratio) Adverse events ≥ 3,
ROR ≥ 2, chi-squared ≥ 4 IC (information component) Lower limit of 95% CI > 0 CI, confidence interval.
2009 년에 자발적 부작용 보고의 활성화를 위하여 약물감시사 업단을 운영하면서 약물감시활동을 발전시켰고
2)나아가 세계 보건기구의 웁살라 모니터링 센터
3)와 연결하여 약물이상사례 의 국제적인 교류를 확대시키고 있다.
보고된 약물이상사례들은 임상적으로 의미 있는 빈도 분석과 새로운 중대한 약물이상반응의 평가, 그리고 아직 인과관계가 알려지지 않았거나 입증자료가 불충분하여 지속적인 관찰과 연 구가 필요한 약물의 실마리정보 파악을 위한 기초자료로도 활 용되고 있다.
국민건강보험공단의 자료에 의하면 고지혈증환자가 지속적 으로 증가하고 있으며 고지혈증치료제로 스타틴계열의 약물이 가장 많이 사용되고 있다. 그 중에서도 로수바스타틴은 다른 스 타틴계열의 약물들에 비해 혈중 저밀도콜레스테롤 저하 효과 및 고밀도콜레스테롤 증가 효력이 강하여
4-6)사용량이 계속 증 가할 것으로 예상된다. 이에 본 연구는 로수바스타틴 국내 발매 후 비교적 초기에 사용한 환자들을 대상으로 약물이상사례 및 실마리정보를 살펴봄으로써 지속적인 사용 증가에 따른 약물이 상사례 및 실마리정보의 파악에 있어 기초자료로 활용하고자 하였다.
대상 및 방법 1. 연구 대상 및 절차
본 연구는 로수바스타틴의 국내 발매 이후 비교적 초기에 사 용했던 약물이상반응 및 사례에 대한 전수조사를 목표로 하였 으므로 식품의약품안전처(이하 ‘식약처’)에서 지역약물감시센 터를 지정하여 지역 병원과 지역 약국 및 환자로부터 자발적 부작용 보고를 활발하게 수집하기 시작했던 2009년 6월부터 2010 년 12월까지 식약처에 보고된 약물이상반응 46,231건과 또한 의심 약물과 이상반응과의 조합(이하 ‘약물-이상반응조 합’) 총 153,557건을 연구대상으로 설정하였다. 이 중에서 로수 바스타틴의 약물-이상사례조합 297건을 토대로 로수바스타틴의 약물이상사례 종류와 실마리정보의 검색 및 상세 분석을 시행 하였고, 전체 의심 약물-이상사례조합 자료는 로수바스타틴 실 마리정보의 검색에서 분모로 활용하였다. 본 연구는 다음의 단 계에 따라 진행되었다.
1) 전체 약물-이상사례조합 자료 및 로수바스타틴 약물-이상 사례조합 자료의 특성 분석
2) 로수바스타틴 약물-이상사례조합 중 다빈도 보고된 종류 분석
3) 로수바스타틴과 이외 전체 약물을 대상으로 proportional reporting ratio (PRR), reporting odds ratio (ROR) 및 information component (IC) 의 데이터 마이닝 기법을 적 용하여 로수바스타틴 실마리정보의 검색
4) 탐지된 로수바스타틴의 실마리정보가 국내 및 국외 약물
라벨에 기재되어 있는지 확인
5) 탐지된 로수바스타틴 실마리정보가 의심 약물 또는 병용 약물로 보고된 것인지 확인하고, 병용 약물로 보고된 경 우에는 이상사례원인 약물로 로수바스타틴을 배제할 수 있는지 확인
2. 연구 방법
약물-이상사례조합 자료의 연도별 보고 건수, 보고자 특성, 이상사례발생 환자의 성별 및 연령, 의심 약물의 조합 건수와 병용 약물의 조합 건수를 분석하였다. 그리고 로수바스타틴의 약물-이상사례조합 자료 중에서 상위 10개 다빈도 이상사례종 류를 확인하였다. 로수바스타틴 실마리정보의 검색은 로수바스 타틴 이외 모든 약물들과 대조하여 데이터 마이닝 지표로 PRR, ROR, IC 를 각각 적용하여 실시하였고, 이 중 한 가지 지표 이 상에서 실마리정보로 검색된 경우에 로수바스타틴의 실마리정 보로 간주하였다. 본 연구에서 실마리정보의 검색 기준으로 사 용된 각 지표는 표 1과 같다.
데이터 마이닝은 총153,557건의 데이터베이스를 대상으로 본 연구진이 개발한 ‘ADR Detector’ 전산프로그램을 사용하여 실 시하였다. ‘ADR Detector’는 조사대상 약물의 각 이상사례종류 별 조합 건수와 전체 약물의 해당 이상사례조합 건수를 이용하 여 PRR, ROR, 카이 제곱 값(chi-squared), IC 95%신뢰구간의 하한(LCI95) 값을 계산하고, WHO-ART ARRN (Adverse Re- action Record Number) 이상사례번호 순으로 표시한다. ‘ADR detector’ 로 계산된 데이터 마이닝 지표의 각 통계 값은 SAS 9.2 프로그램을 통하여 검증하였다.
로수바스타틴의 탐지된 실마리정보가 약품 라벨에 기재되어
있는지 확인하기 위해 식약처 의약품 허가사항 변경지시정보와
UpToDate
ⓇDrug Information 을 정보원으로 사용하였고, 실마
리정보의 확인 과정은 연구자 외에 별도의 전문가에게 동일하
게 의뢰한 후에 그 확인 결과가 일치하지 않는 부분에 대해서
는 함께 논의하여 최종 결정하였다. 로수바스타틴의 탐지된 실
마리정보의 특성 파악을 위해서는 로수바스타틴 라벨에 기재되
지 않은 실마리정보에 대하여 해당 이상사례의심 약물 혹은 병
용 약물로 보고된 것인지 확인하였고, 병용 약물로 보고된 이상
Table 2. Characteristics of spontaneous adverse event reports associated with rosuvastatin calcium in MFDS from Jun. 2009 to Dec. 2010 (n = 297)
Characteristics Reports (n)
Reports
% Drug-AE pairs (year) 2009.6-2009.12 119 40.1
2010.1-2010.12 178 59.9
Sex Male 164 55.2
Female 127 42.8
Unknown 6 2.0
Age group 0-9 3 1.0
10-19 0 0
20-29 6 2.0
30-39 18 6.1
40-49 41 13.8
50-59 61 20.5
60-69 76 25.6
70-99 71 23.9
Unknown 21 7.1
Report source by affiliation
Healthcare institutions
93 31.3 Report source by
person
Pharmacist 148 49.8
Nurse 42 14.1
Clinician 14 4.7 Reported medication Suspect drug 131 44.1 Concomitant drug 166 55.9 MFDS, the ministry of food and drug safety; AE, adverse event.
Table 3. Reported adverse events associated with rosuvastatin calcium to spontaneous reporting system in MFDS from Jun.
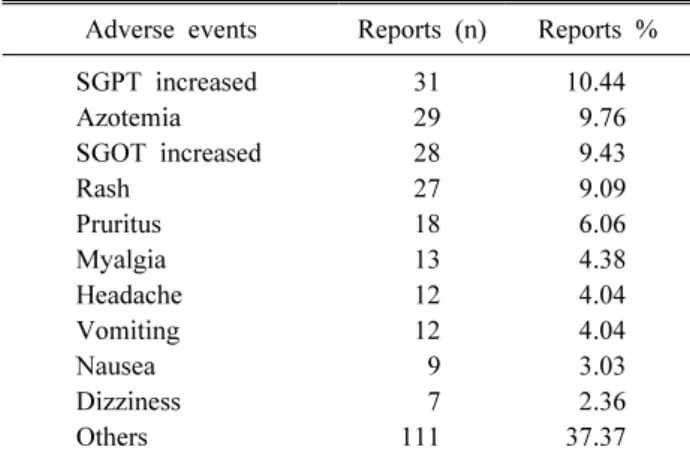
2009 to Dec. 2010 (n = 297)
Adverse events Reports (n) Reports % SGPT increased 31 10.44
Azotemia 29 9.76
SGOT increased 28 9.43
Rash 27 9.09
Pruritus 18 6.06
Myalgia 13 4.38
Headache 12 4.04
Vomiting 12 4.04
Nausea 9 3.03
Dizziness 7 2.36
Others 111 37.37
MFDS, the ministry of food and drug safety; SGPT (ALT), alanine aminotransferase; SGOT (AST), aspartate aminotrans- ferase.
사례보고서 내용을 토대로 의심 약물에 대한 이상사례발생 시 점 타당성 혹은 재 투여 결과의 타당성을 재평가 하였다. 의심 약물에 대한 재평가 결과가 타당한 경우에 병용 약물로 보고된 로수바스타틴의 약물-이상사례조합을 ‘배제 가능(Unclassi- fiable)’ 으로 판단하였고, 보고서 내용이 불충분하거나 누락되어 판단할 수 없는 경우에 ‘평가 곤란(Conditional unclassified)’으 로 분류하였다.
본 연구는 연구기관의 임상연구윤리위원회 승인을 받고 진행 되었다(승인번호 KIRB-00373_32_001).
결 과 1. 로수바스타틴의 다빈도 이상사례보고
식약처의 자발적 이상사례보고 자료 중 로수바스타틴과 연관 된 보고는 199건이었고, 이를 재구성한 약물-이상사례조합 건 수는 297건이었다. 로수바스타틴 연관 이상사례발생 보고는 남 성과 60세 이상에서 많았다. 로수바스타틴을 병용 약물로 보고 한 비율은 55.9%를 나타냈다(표 2).
로수바스타틴 연관 약물-이상사례조합 297건 중 다빈도 이상 사례로서 SGPT 증가 31건(10.44%), 질소혈증 29건(9.76%),
SGOT 증가 28건(9.43%), 발진 27건(9.09%), 소양증 18건(6.06%), 근육통 13건(4.38%), 두통 12건(4.04%), 구토 12건(4.04%), 오 심 9건(3.03%), 어지러움 7건(2.36%)이었다(표 3).
2. 로수바스타틴 실마리정보의 검색 및 약물 라벨 기재 여부
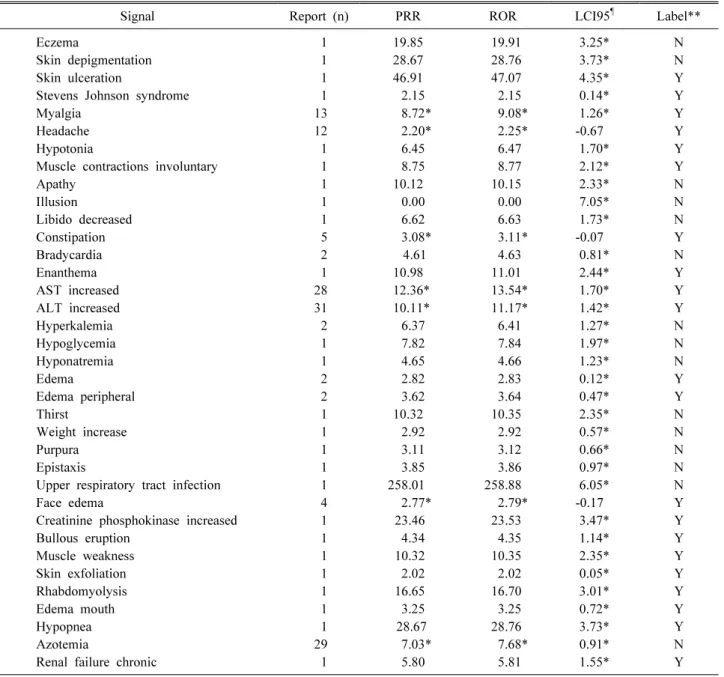
로수바스타틴 약물-이상사례조합 297건에 보고된 이상사례 종류는 총 76개였으며, 이중 47.4%인 36개 이상사례종류가 PRR, ROR 또는 IC를 이용한 데이터 마이닝 기법에 의해 실마 리정보로 검색되었다. PRR과 ROR로 탐지된 실마리정보는 각 7 건으로 모두 일치하였으며, IC로 탐지된 33건의 이상사례건수 는 실마리정보로 탐지되었다(표 4). 3가지 데이터 마이닝 지표 중 하나 이상의 기준에 의해 실마리정보로 탐지된 36건 중 21 건은 로수바스타틴의 약물 라벨 및 UpToDate
ⓇDrug Infor- mation 에 기재되어 있어 이미 알려진 이상반응이었고, 15건 (41.7%) 은 라벨에 기재되지 않은 실마리정보로 확인되었다(표 4). 이 때 15건 중에서 14건은 IC를 이용한 지표에서만 탐지되 었고, 질소혈증은 세 가지 모든 지표에서 탐지되었다.
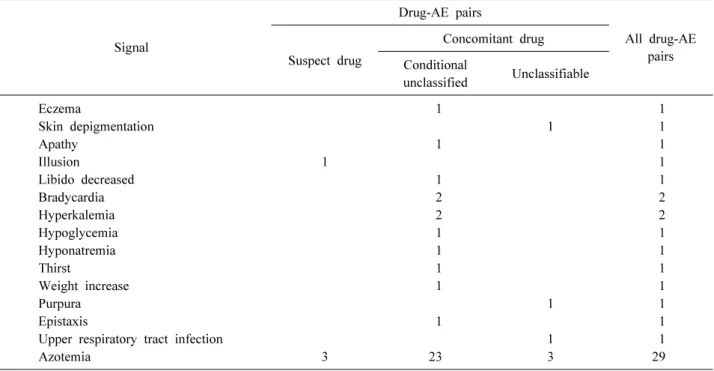
3. 라벨에 기재되지 않은 로수바스타틴 실마리정보의 특성
라벨에 기재되지 않은 15개의 실마리정보에 대한 추가 분석
결과에서 대부분 보고된 조합 건수는 1건이었으며, 2건 이상의
실마리정보로 탐지된 이상사례명은 ‘서맥’ ‘고칼륨혈증’ ‘질소
혈증’이었다. 로수바스타틴을 모두 병용 약물로 보고된 이상사
례명은 ‘서맥’과 ‘고칼륨혈증’이었고, ‘질소혈증’은 총 29건 조
합 중 26건이 병용 약물로 보고되었다. 로수바스타틴을 의심
약물로 모두 보고한 이상사례명은 ‘착각’이었다. 중대한 이상사
Table 4. Detected signals for rosuvastatin by data mining and existence of the information on the drug labels (n = 36)
Signal Report (n) PRR ROR LCI95
¶Label**
Eczema 1 19.85 19.91 3.25* N
Skin depigmentation 1 28.67 28.76 3.73* N
Skin ulceration 1 46.91 47.07 4.35* Y
Stevens Johnson syndrome 1 2.15 2.15 0.14* Y
Myalgia 13 8.72* 9.08* 1.26* Y
Headache 12 2.20* 2.25* -0.67 Y
Hypotonia 1 6.45 6.47 1.70* Y
Muscle contractions involuntary 1 8.75 8.77 2.12* Y
Apathy 1 10.12 10.15 2.33* N
Illusion 1 0.00 0.00 7.05* N
Libido decreased 1 6.62 6.63 1.73* N
Constipation 5 3.08* 3.11* -0.07 Y
Bradycardia 2 4.61 4.63 0.81* N
Enanthema 1 10.98 11.01 2.44* Y
AST increased 28 12.36* 13.54* 1.70* Y
ALT increased 31 10.11* 11.17* 1.42* Y
Hyperkalemia 2 6.37 6.41 1.27* N
Hypoglycemia 1 7.82 7.84 1.97* N
Hyponatremia 1 4.65 4.66 1.23* N
Edema 2 2.82 2.83 0.12* Y
Edema peripheral 2 3.62 3.64 0.47* Y
Thirst 1 10.32 10.35 2.35* N
Weight increase 1 2.92 2.92 0.57* N
Purpura 1 3.11 3.12 0.66* N
Epistaxis 1 3.85 3.86 0.97* N
Upper respiratory tract infection 1 258.01 258.88 6.05* N
Face edema 4 2.77* 2.79* -0.17 Y
Creatinine phosphokinase increased 1 23.46 23.53 3.47* Y
Bullous eruption 1 4.34 4.35 1.14* Y
Muscle weakness 1 10.32 10.35 2.35* Y
Skin exfoliation 1 2.02 2.02 0.05* Y
Rhabdomyolysis 1 16.65 16.70 3.01* Y
Edema mouth 1 3.25 3.25 0.72* Y
Hypopnea 1 28.67 28.76 3.73* Y
Azotemia 29 7.03* 7.68* 0.91* N
Renal failure chronic 1 5.80 5.81 1.55* Y
PRR, proportional reporting ratio; ROR, reporting odds ratio; IC, information component; AST, aspartate aminotransferase; ALT, alanine aminotransferase.
*Detected signal by PRR, ROR or IC.
**Y: the adverse event (AE) listed on a drug label, N: the AE not listed on a drug label.
¶