556
인슐린 저항성 및 대사증후군의 상관성
Correlation of the Serum Testosterone Level with Insulin Resistance and Metabolic Syndrome in Patients of Erectile Dysfunction and Benign Prostatic
Hyperplasia
Seo-Yeon Lee, Sae-Chul Kim
From the Department of Urology, College of Medicine, Chung-Ang University, Seoul, Korea
Purpose: Testosterone deficiency has recently captured attention as a possible risk factor for metabolic syndrome. This study was conducted to investigate a correlation of the serum testosterone level with insulin resistance (IR) and metabolic syndrome (MS).
Materials and Methods: The metabolic risk factors, the blood pressure, the waist circumference and the fasting serum levels of glucose, trigly- ceride and high density lipoprotein cholesterol were measured for a total of 215 patients (mean age; 61.04±0.54 years) with erectile dysfunction (ED) or/and symptomatic benign prostatic hyperplasia (BPH). The serum total testosterone and insulin were measured at the same time, and the free testosterone, bioavailable testosterone and IR were calculated.
Results: The prevalence of MS and the number of associated MS risk factors were significantly higher in the insulin resistance group (IRG) than in the insulin sensitive group (ISG). The serum testosterone level signifi- cantly decreased with more risk factors. The IRG showed a significantly lower level of serum testosterone than the patients with ED and the total patients.
Conclusions: The negative correlation of a decrease in the serum testo- sterone level with IR and MS suggests that late onset hypogonadism might be a risk factor of MS. (Korean J Urol 2008;49:556-561)
Key Words: Metabolic syndrome, Insulin resistance, Testosterone
대한비뇨기과학회지 제 49 권 제 6 호 2008
중앙대학교 의과대학 비뇨기과학교실
이소연ㆍ김세철
접수일자:2008년 2월 19일 채택일자:2008년 4월 21일
교신저자: 김세철
중앙대학교병원 비뇨기과 서울시 동작구 흑석동 224-1
156-861
TEL: 02-6299-1785 FAX: 02-822-8496 E-mail: saeckim@
unitel.co.kr
서 론
최근 식생활의 서구화와 함께 우리나라에서도 심혈관 질 환의 발생률과 유병률이 급증하고 있으며, 사망통계에서도 뇌혈관질환 및 심장질환에 의한 사망은 남, 녀 모두에서 2, 3위를 차지하고 있다 (통계청, 2003).1 이에 심혈관질환의 위험인자로 인식되고 있는 대사증후군에 대한 관심도 고조 되고 있다.
대사증후군은 한 개인에게 비만, 당대사이상, 이상지질혈 증 및 고혈압 등과 같은 관상동맥질환의 위험요인들이 군 집되어 나타나는 것이며, 이에 동반되는 인슐린 저항성을
특징으로 한다.2-4 최근 테스토스테론 결핍이 인슐린 저항성 과 대사증후군의 위험인자가 될 수 있으며,5-7 반대로 인슐 린 저항성과 대사증후군이 성선기능저하증의 위험인자가 될 수 있다는 보고가 있다.5,8-12 이에 저자들은 테스토스테론 과 인슐린 저항성 및 대사증후군과의 상관성에 대해 조사 해보고자 하였다.
대상 및 방법
1. 대상
2004년 10월부터 2007년 7월 사이에 본원 비뇨기과에 내 원한 발기부전과 증상적 전립선비대증 환자 215명을 대상
Table 1. Patient characteristics
ED BPH+ED BPH Total
(n=41) (n=72) (n=102) (n=215)
Age (years) 59.22±1.26 63.71±0.77 61.50±0.76 61.80±0.54
Testosterone
Total (ng/ml) 4.93±0.21 4.30±0.16 4.95±0.15 4.73±0.10
Free (ng/dl) 7.66±0.32 6.40±0.26 6.86±0.26 6.86±0.16
Bioavailable (ng/ml) 1.79±0.07 1.48±0.06 1.59±0.06 1.59±0.38
Metabolic syndrome risk factor
TG (mg/dl) 146.79±0.21 112.97±7.05 102.76±6.10 114.28±4.53
HDL (mg/dl) 47.41±1.28 47.37±1.39 51.48±1.11 49.33±0.75
FBS (mg/dl) 113.17±6.28 114.28±3.45 100.63±1.00 107.63±1.78
sBP (mmHg) 121.95±1.30 125.80±1.47 124.19±1.26 124.30±0.81
dBP (mmHg) 81.58±1.16 83.62±1.15 82.51±0.82 82.70±0.59
Waist (cm) 90.92±1.29 89.46±0.71 88.23±0.72 89.18±0.49
TC (mg/dl) 193.20±5.21 180.36±4.12 192.45±3.32 188.54±2.34
LDL (mg/dl) 115.02±4.84 108.07±3.11 114.58±2.72 112.48±1.90
ED: erectile dysfunction, BPH: benign prostatic hyperplasia, TG: triglyceride, HDL: high desity lipoprotein, FBS: fasting blood sugar, sBP: systolic blood pressure, dBP: diastolic blood pressure, Waist: waist circumference, TC: total cholesterol, LDL: low density lipoprotein
으로 전향적으로 조사하였다. 발기부전만 있는 환자 수는 41명, 증상적 전립선비대증만 있는 환자수는 102명이었으 며, 발기부전과 증상적 전립선 비대가 함께 있는 환자 수는 72명이었다. 환자의 평균연령은 61.04±0.54세였다 (Table 1).
2. 방법
1) 대사증후군 위험인자: 수진자들로부터 과거력, 약 복 용력 등을 질문하여 기록한 의무기록지와 국제 전립선 증 상점수 및 국제발기능지수 설문지를 근거로 하였으며, 발 기부전은 국제발기능점수 (International Index of Erectile Function; IIEF-5) 설문에서 21점 이하의 발기 장애가 있는 경우, 증상적 전립선비대증은 국제전립선증상점수 (Interna- tional Prostate Symptom Score; IPSS)가 8점 이상이며 경직장 초음파검사상 전립선 용적이 25g 이상인 경우로 하였다. 환 자들에게 혈압측정, 신체 계측, 검사실 검사를 위한 채혈을 시행하였다. 허리둘레는 환자가 숨을 편안히 내쉰 상태에 서 줄자를 이용하여 지면과 수평이 되면서 피부에 압력이 가해지지 않도록 하여 늑골 하단과 장골릉 사이의 중간 가 장 가는 부위를 측정하였다. 혈압은 10분 이상 안정상태를 유지한 후 우측상완에서 수은혈압계로 일정한 조사자에 의 해 측정하였으며, Korotkoff 음 중 Phase I을 수축기 혈압으 로, Phase V을 이완기 혈압으로 판정하였다. 혈청검사를 위 하여 12시간 이상 공복 후 오전 8시에서 11시 사이에 채혈 하여 혈당, 중성지방, 총 콜레스테롤, 고밀도 및 저밀도 지 단백 콜레스테롤을 측정하였다.
대사증후군의 위험인자는 2001년 5월 미국에서 발표된
제3차 콜레스테롤 관리지침 (The Third National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults; NCEP- ATPIII)13에 따라 중성지방≥150mg/dl, 고밀도지단백 콜레 스테롤<40mg/dl, 수축기혈압≥130mmHg 또는 이완기혈압
≥85mmHg, 공복시혈당≥110mg/dl을 기준으로 하였으며, 복부비만은 한국인 신체특성에 맞추기 위하여 2000년 세계 보건기구 서태평양지국 (WHO Western Pacific Region)14에 서 제안한 허리둘레≥90cm로 하였고, 이 중 3가지 이상에 해당할 때 대사증후군으로 판정하였다. 단, 고혈압이나 당 뇨, 고지혈증의 과거력이 있으면서 이에 대한 약을 복용중 인 환자는 정상범위라도 대사증후군 위험군으로 분류하였다.
2) 테스토스테론 측정: 혈중 테스토스테론은 대사증후군 위험인자 판정을 위해 채혈한 혈액으로 알부민, 성호르몬 결합단백질과 함께 측정하였으며, Vermeulen 등15이 사용한 방법으로 유리 테스토스테론과 생체이용가능 테스토스테 론 치를 산출하였다.
3) 인슐린 저항성: 인슐린 저항성은 공복 혈당과 공복 인 슐린 농도를 측정해서 이를 통해 계산하는 homeostasis model assessment: insulin resistance (HOMA-IR) 공식 (HOMA- IR=insulin (μU/ml)xglucose (mg/dl)/405)16을 통하여 산출하 였으며, HOMA-IR이 2.12 이상이면 인슐린 저항성이 있는 것으로 평가하였다.
4) 통계처리: 인슐린 저항성 유무군과 대사증후군 유무군 의 상관관계를 알아내기 위하여 chi-square test을 사용하였 으며, Student's t-test와 상관분석을 이용하여 인슐린 저항성
Table 2. The relationship between insulin resistance and metabolic syndrome
Metabolic syndrome
Total
Yes No
Insulin resistance Yes 27 21 48
No 38 122 160
Total 65 143 208*
p<0.01, *: seven cases were excluded because homeostasis model assessment-insulin resistances (HOMA-IRs) were not available.
Table 3. Comparison of the serum total, free, and bioavailable testosterone between the insulin resistant and sensitive groups
Insulin Insulin
resistance resistance p-value
(+) (−)
Total patients group* (n=48) (n=160)
Total testosterone 4.31±0.18 4.86±0.12 0.022 Free testosterone 6.53±0.31 7.00±0.19 NS Bioavailable testosterone 1.52±0.08 1.61±0.04 NS
ED patients group (n=14) (n=25)
Total testosterone 4.43±0.32 5.24±0.27 NS Free testosterone 6.50±0.56 8.34±1.71 0.005 Bioavailable testosterone 1.58±0.52 1.92±0.07 0.020 ED+BPH patient group (n=16) (n=55)
Total testosterone 3.98±0.28 4.38±0.20 NS Free testosterone 6.16±0.38 6.47±0.31 NS Bioavailable testosterone 1.38±0.09 1.50±0.07 NS
BPH patient group (n=18) (n=80)
Total testosterone 4.50±0.31 5.07±0.17 NS Free testosterone 6.87±0.63 6.96±0.28 NS Bioavailable testosterone 1.60±0.15 1.60±0.06 NS
*: seven cases (ED: 2 cases, ED+BPH: 1 case, BPH: 4 cases) were excluded because homeostasis model assessment-insulin resistances (HOMA-IRs) were not available. ED: erectile dysfunc- tion, BPH: benign prostatic hyperplasia, NS: not significant
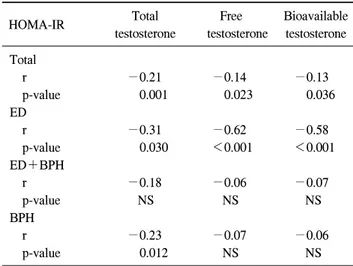
Table 4. Correlation of the serum total, free and bioavailable testo- sterone with insulin resistance
Total Free Bioavailable
HOMA-IR
testosterone testosterone testosterone Total
r −0.21 −0.14 −0.13
p-value 0.001 0.023 0.036
ED
r −0.31 −0.62 −0.58
p-value 0.030 <0.001 <0.001
ED+BPH
r −0.18 −0.06 −0.07
p-value NS NS NS
BPH
r −0.23 −0.07 −0.06
p-value 0.012 NS NS
NS: not significant, ED: erectile dysfunction, BPH: benign prostatic hyperplasia, HOMA-IR: homeostasis model assessment- insulin resistance, r: Pearson correlation coefficient
유무와 대사증후군 위험인자 수와의 관계와 인슐린 저항성 의 정도와 위험인자 수의 관계를 구하였다. 혈중 테스토스 테론 치와 인슐린 저항성과의 상관관계, 혈중 테스토스테 론 치와 대사증후군 유무 및 위험인자 동반수와의 상관관 계 분석은 Student's t-test와 상관분석을 이용하였다. 혈중 테스토스테론 치와 각각의 대사증후군 위험인자와의 상관 관계에서는 일원배치분산분석 (ANOVA)을 이용하였다. 모 든 통계분석은 Windows 용 SPSS 10.0 통계 프로그램을 이 용하였으며, p값이 0.05 미만인 경우 통계학적으로 유의한 것으로 판단하였다.
결 과
1. 인슐린 저항성과 대사증후군 유무 및 위험인자수와 의 관계
전체 환자에서 인슐린 저항성이 있는 군 (HOMA-IR≥
2.12)에서 인슐린 저항성이 없는 군 (HOMA-IR<2.12)보다 대사증후군 유병률이 더 높았으며 (p<0.01), 반대로 대사증 후군이 있는 군에서 대사증후군이 없는 군보다 인슐린저항 성의 빈도가 더 높았다 (p<0.01) (Table 2). 또한 인슐린 저 항성이 있는 군의 대사증후군 위험인자 동반수 (3.98±0.22) 가 인슐린 저항성이 없는 군 (2.66±0.13)보다 통계적으로 유 의하게 높았다 (p<0.01). 인슐린 저항성의 정도와 위험인자 수와는 유의한 양의 상관관계를 보였다 (상관계수 0.37, p<
0.01).
2. 혈중 총 테스토스테론, 유리 및 생체이용가능 테스 토스테론과 인슐린 저항성의 상관관계
전체 환자군에서 인슐린 저항성이 있는 군은 없는 군에 비해 총 테스토스테론 치가 유의하게 감소하였다. 발기부 전 환자군에서는 인슐린 저항성이 있는 군이 없는 군에 비 해 유리 테스토스테론 및 생체이용가능 테스토스테론 치가 유의하게 감소되어 있었다. 전립선비대증 환자군과 전립선
비대증과 발기부전이 함께 있는 환자군에서는 인슐린 저항 성이 있는 군이 없는 군보다 총 테스토스테론, 유리 및 생체 이용가능 테스토스테론 치 모두 낮았으나 통계적으로 유의
Table 5. Correlation of the serum total, free and bioavailable testo- sterone with the number of metabolic syndrome risk factors
No. of risk
Total Free Bioavailable factors of metabolic
testosterone testosterone testosterone syndrome
Total patients group
r −0.24 −0.02 0.01
p-value 0.001 NS NS
ED patients group
r −0.23 −0.46 −0.384
p-value NS 0.017 NS
ED+BPH patient group
r −0.026 −0.007 0.076
p-value NS NS NS
BPH patient group
r −0.143 −0.013 0.002
p-value NS NS NS
NS: not significant, ED: erectile dysfunction, BPH: benign pro- static hyperplasia, r: Pearson correlation coefficient
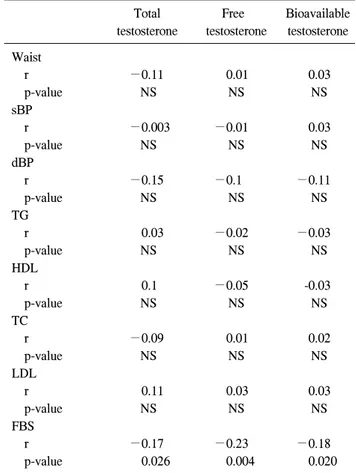
Table 6. Correlation of the serum total, free and bioavailable testo- sterone with each risk factor
Total Free Bioavailable
testosterone testosterone testosterone Waist
r −0.11 0.01 0.03
p-value NS NS NS
sBP
r −0.003 −0.01 0.03
p-value NS NS NS
dBP
r −0.15 −0.1 −0.11
p-value NS NS NS
TG
r 0.03 −0.02 −0.03
p-value NS NS NS
HDL
r 0.1 −0.05 -0.03
p-value NS NS NS
TC
r −0.09 0.01 0.02
p-value NS NS NS
LDL
r 0.11 0.03 0.03
p-value NS NS NS
FBS
r −0.17 −0.23 −0.18
p-value 0.026 0.004 0.020
ED: erectile dysfunction, BPH: benign prostatic hyperplasia, NS:
not significant, Waist: waist circumference, sBP: systolic blood pressure, dBP: diastolic blood pressure, TG: triglyceride, HDL:
high desity lipoprotein, TC: total cholesterol, LDL: low density lipoprotein, FBS: fasting blood sugar, r: Pearson correlation coefficient
한 상관관계가 없었다 (Table 3). 또한 HOMA-IR 치와 테스 토스테론 치의 상관분석에서도 HOMA-IR 치는 전체 환자 군과 발기부전 환자군, 전립선비대증 환자군에서 총 테스 토스테론 치와 음의 상관관계가 있었으며, 전체 환자군과 발기부전 환자군에서는 유리 테스토스테론과 생체이용가 능 테스토스테론 치와도 통계적으로 유의한 음의 상관관계 가 있었다 (Table 4).
3. 혈중 총 테스토스테론, 유리 및 생체이용가능 테스 토스테론과 대사증후군 유무 및 위험인자 동반수와 의 상관관계
전체 환자군에서 대사증후군이 있는 군의 총 테스토스테 론 치가 4.33±0.17ng/ml로 대사증후군이 없는 군의 4.90±
0.12ng/ml보다 낮았다 (p=0.01). 전체 환자의 68.37%는 고저 밀도지단백 콜레스테롤혈증, 48.37%는 비만증, 39.53%는 총 콜레스테롤이 높았으며, 31.63%는 고혈당, 26.51%는 고 중성지방혈증, 24.19%는 저고밀도지단백 콜레스테롤혈증 이었다. 혈중 총 테스토스테론 치는 전체 환자군에서 대사 증후군의 위험인자 수가 증가할수록 감소하였으며 (p=0.001), 유리 테스토스테론 치는 발기부전 환자군에서만 위험인자 수가 증가함에 따라 감소하였다 (p=0.017) (Table 5).
4. 혈중 총 테스토스테론, 유리 및 생체이용가능 테스 토스테론과 각각의 대사증후군 위험인자와의 상관 관계
공복혈당치는 총 테스토스테론, 유리 테스토스테론, 생체
이용가능 테스토스테론 치와 유의한 음의 상관관계를 가졌 으나, 나머지 위험인자와는 통계적으로 유의한 상관관계가 없었다 (Table 6).
고 찰
대사증후군의 기본생태병리는 인슐린 매개성 포도당 흡 수의 장애로 발생하는 인슐린 저항성에 의한 이차적 고인 슐린혈증으로 알려져 있다.17 인슐린이 인슐린 수용체와 결 합한 후 일어나는 세포 내 신호전달 경로는, 포도당 수송체- 4 (glucose transporter-4; GLUT-4)의 전위와 혈관 이완을 일 으키는 phosphatidylinositol (PI)-3 kinase 경로, 유사분열생식 (mitogenesis), 성장효과 및 혈관수축인자인 endothelin-1 생 산에 관여하는 Ras/mitogen-activated protein (MAP) kinase 경
로가 있다. 대사증후군과 제2형 당뇨병에서는 PI-3 kinase 경로는 차단되고, MAP kinase 경로는 유지되므로, 보상성 고인슐린혈증이 있을 경우 두 경로 간에 불균형이 심화되 면서 MAP kinase 경로를 통한 생물학적 효과가 더욱 심해 질 것으로 생각한다.18
저테스토스테론혈증은 인체 지방 비율을 변화시키고,19 남성호르몬 수용체 다형성을 초래하며,20 당 운반 장애21와 산화방지 작용 저하22를 일으켜 인슐린 저항성과 대사증후 군의 위험성을 높일 수 있다.5
혈중 테스토스테론 치가 감소하면 지단백 lipase 활성도 가 증가되어 중성지방이 증가하므로 비만증을 유도하며, 복부 지방이 증가하면 지방 내 방향효소에 의해 테스토스 테론을 에스트로겐으로 전환시키고 leptin에 의해 뇌하수체 로부터 황체호르몬 박동성 분비의 진폭을 감소시켜 혈중 테스토스테론 치를 떨어뜨리는 악순환이 일어난다.19 본 연 구에서도 인슐린 저항성이 있는 환자군의 혈중 총 테스토 스테론 치는 인슐린 저항성이 없는 군보다 통계적으로 유 의하게 낮았으며, 혈중 총 테스토스테론 치와 대사증후군 위험인자 수와도 유의한 상관성을 보였다. 한편 혈중 테스 토스테론 치와 대사증후군 위험인자 각각의 상관관계를 조 사한 결과 공복혈당만이 혈중 총 테스토스테론, 유리 테스 토스테론, 생체이용가능 테스토스테론 치 모두에서 유의한 음의 상관관계를 보여 인슐린 저항성과 테스토스테론 치 간의 상관성을 설명하는데 가장 예민한 지표가 되는 것으 로 생각한다.
대사증후군은 심혈관 및 뇌혈관질환뿐만 아니라 비뇨기 과적으로 발기부전23과 하부요로증상24을 유발하고 진행을 촉진하는 것으로 알려져 있다.18 대사증후군 환자에서의 발 기부전 유병률은 대조군보다 2배 정도 더 높게 보고되었으 며, 대사증후군의 위험인자를 많이 가지고 있을수록 발기 부전의 위험이 증가한다고 한다.18,23 또한 당뇨, 고혈압, 비 만, 고중성지방혈증, 저고밀도지단백 콜레스테롤혈증 등 대 사증후군의 위험인자를 가진 환자 군이 그렇지 않은 군에 비해 유의하게 큰 전립선 용적 및 빠른 전립선 성장속도를 보이며 보다 심한 하부요로증상을 보이는 것으로 보고되어
있다.17,25,26 테스토스테론 저하가 발기부전과 전립선비대증
의 위험인자인 사실과 발기부전 환자와 전립선비대증 환자 의 높은 대사증후군 유병률을 고려해 볼 때 테스토스테론 저하와 대사증후군의 상관성을 추정해 볼 수 있다.
테스토스테론 저하가 대사증후군의 원인이 될 수 있는 설명으로 Bojesen 등19은 클라인펠터 증후군 환자 71명을 대 상으로 한 연구에서 남성호르몬 보충요법을 하지 않은 환 자의 44%가 대사증후군이 있어 보충요법을 한 대조군의 10% 유병률에 비해 큰 차이가 있었으며, 체중, 체질량지수,
혈중 중성지방, 저밀도 지단백 콜레스테롤, 총 콜레스테롤, 인슐린, 혈당 치와 허리둘레 등도 보충요법을 하지 않은 환 자군에서 통계적으로 유의하게 높았다고 보고하였다. 또한 Braga-Basaria 등27과 Keating 등28은 전립선암 환자를 대상으 로 한 연구에서 gonadotropin-releasing hormone (GnRH) analo- gue 치료군이 비슷한 나이의 정상 대조군이나 치료를 하지 않은 전립선암 환자군보다 높은 대사증후군 이환율을 보고 하였으며, Nuver 등29은 고환절제술을 한 고환암 환자군을 대상으로 한 연구에서도 비슷한 결과를 보고하였다. 이는 남성호르몬 결핍이 대사증후군 발생과 유관하다는 사실을 시사한다. 또한 중년 이후에 나타나는 남성호르몬결핍증후 군 (testosterone deficiency syndrome)이 대사증후군의 발생과 상관성이 있다는 임상적 및 실험적 연구보고가 있었으 며,7,12 저자들의 연구에서도 혈중 총 테스토스테론 치가 총 환자군에서 대사증후군의 위험인자가 증가할수록 감소하 여 남성호르몬 감소가 인슐린저항성 및 대사증후군 발생과 상관관계가 있는 것을 확인할 수 있었으며, 이런 연구 결과 에 근거하여 남성 호르몬 감소가 인슐린저항성과 대사증후 군 발생에 관여하였을 것으로 추정할 수 있다. 전립선비대 증은 전신적인 성호르몬의 변화와 호르몬 대사 효소들의 변화에 의해 전립선 내 에스트로겐/테스토스테론 비의 증 가로 스테로이드 호르몬 반응 유전자들의 변화가 일어나 고, 이로 인해 테스토스테론 수용체 발현이 증가되어 전립 선 기질부분의 변화와 섬유모세포들의 증식이 일어나며 전 립선의 상피 부분에서 세포의 증식을 일으키는 성장인자들 이 분비되어 일어나게 된다.30 본 연구에서 증상적 전립선비 대증 환자군은 혈중 테스토스테론 치와 대사증후군 위험인 자수 사이에 통계적으로 유의한 상관관계를 보이지 않았는 데, 이는 발기부전은 인슐린의 신호전달경로인 PI-3 kinase 가 저해되어 내피세포기능부전을 일으키고 MAP kinase 경 로와 교감신경계가 항진되어 혈관평활근 수축이 일어나 발 생하는 두 가지 경로 모두에 의해 발생되지만, 증상적 전립 선비대증은 주로 MAP kinase 경로와 자율신경계 항진에 의 해 발생하므로 발기부전에 비해 대사증후군과의 연관성이 상대적으로 적을 것으로 생각한다.
결 론
혈중 테스토스테론 치는 인슐린 저항성과 음의 상관관 계가 있을 뿐 아니라 대사증후군 위험인자 수가 증가할수 록 감소한다. 그러므로 앞으로 혈중 테스토스테론 결핍도 대사증후군의 위험인자로 고려될 수 있을 것으로 생각한 다.
REFERENCES
1. 2003 Cause of Death in Korea, The Department of Statistics.
2003;5
2. Ferrannini E, Haffner SM, Mitchell BD, Stern MP. Hyper- insulinemia: the key feature of a cardiovascular and metabolic syndrome. Diabetologia 1991;34:416-22
3. Gray RS, Fabsitz RR, Cowan LD, Lee ET, Howard BV, Savage PJ. Risk factor clustering in the insulin resistance syndrome. The Strong Heart Study. Am J Epidemiol 1998;
148:869-78
4. Carantoni M, Zuliani G, Volpato S, Palmieri E, Mezzetti A, Vergnani L, et al. Relationships between fasting plasma insulin, anthropometrics, and metabolic parameters in a very old healthy population. Associazione Medica Sabin. Meta- bolism 1998;47:535-40
5. Kalyani RR, Dobs AS. Androgen deficiency, diabetes, and the metabolic syndrome in men. Curr Opin Endocrinol Diabetes Obes 2007;14:226-34
6. Stellato RK, Feldman HA, Hamdy O, Horton ES, McKinlay JB. Testosterone, sex hormone-binding globulin, and the development of type 2 diabetes in middle-aged men: pro- spective results from the Massachusetts male aging study.
Diabetes Care 2000;23:490-4
7. Oh J, Barrett-Connor E, Wedick NM, Wingard DL. Endo- genous sex hormones and the development of type 2 diabetes in older men and women: the Rancho Bernardo study.
Diabetes Care 2002;25:55-60
8. Zitzmann M, Faber S, Nieschlag E. Association of specific symptoms and metabolic risks with serum testosterone in older men. J Clin Endocrinol Metab 2006;9:4335-43
9. Kapoor D, Malkin CJ, Channer KS, Jones TH. Androgens, insulin resistance and vascular disease in men. Clin Endocrinol 2005;63:239-50
10. Tan RS, Pu SJ. Impact of obesity on hypogonadism in the andropause. Int J Androl 2002;25:195-201
11. Barrett-Connor E, Khaw KT, Yen SS. Endogenous sex hormone levels in older adult men with diabetes mellitus. Am J Epidemiol 1990;132:895-901
12. Lunenfeld B. Testosterone deficiency and the metabolic syndrome. Aging Male 2007;10:53-6
13. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the national cholesterol education program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (adult treatment panel III). JAMA 2001;285:2486-97
14. WHO Regional Office for the Western Pacific/International Association for the Study of Obesity/International Obesity Task Force. The Asia-Pacific perspective: redefining obesity and its treatment. Sydney, Health Communications Australia, 2000
15. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab 1999;84:3666-72
16. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resis- tance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985;28:412-9 17. DeFronzo RA, Ferrannini E. Insulin resistance. A multifaceted
syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic cardiovascular disease. Dia- betes Care 1991;14:173-94
18. Kim SC. Insulin resistance and erectile dysfunction. Korean J Urol 2006;47:917-27
19. Bojesen A, Kristensen K, Birkebaek NH, Fedder J, Mosekilde L, Bennett P, et al. The metabolic syndrome is frequent in Klinefelter's syndrome and is associated with abdominal obesity and hypogonadism. Diabetes Care 2006;29:1591-8 20. Gustafson DR, Wen MJ, Koppanati BM. Androgen receptor
gene repeats and indices of obesity in older adults. Int J Obes Relat Metab Disord 2003;27:75-81
21. Lacko L, Wittke B, Geck P. Interaction of steroids with the transport system of glucose in human erythrocytes. J Cell Physiol 1975;86(Suppl 2):673-80
22. Morimoto S, Mendoza-Rodriguez CA, Hiriat M, Larrieta ME, Vital P, Cerbon MA. Protective effect of testosterone on early apoptotic damange induced by streptozotocin in rat pancreas.
J Endocrinol 2005;187:217-24
23. Hellmich M, Evers T, Kubin M, Merchant S, Lehmacher W, Engelmann U, et al. Development and validation of a risk score for somatic erectile dysfunction: combined results from three cross-sectional surveys. Eur Urol 2005;48:495-502 24. Kim JH, Shim BS, Hong YS. The relating factors of metabolic
syndrome to benign prostatic hyperplasia. Korean J Urol 2005;
46:1046-50
25. Hammarsten J, Hogstedt B, Holthuis N, Mellstrom D.
Components of the metabolic syndrome-risk factors for the development of benign prostatic hyperplasia. Prostate Cancer Prostatic Dis 1998;1:157-62
26. Hammarsten J, Hogstedt B. Clinical, anthropometric, meta- bolic and insulin profile of men with fast annual growth rates of benign prostatic hyperplasia. Blood Press 1999;8:29-36 27. Braga-Basaria M, Dobs AS, Muller DC, Carducci MA, John
M, Egan J, et al. The metabolic syndrome in men with prostate cancer undergoing long-term androgen-deprivation therapy. J Clin Oncol 2006;24:3979-83
28. Keating NL, O'Malley AJ, Smith MR. Diabetes and cardio- vascular disease during androgen deprivation therapy for prostate cancer. J Clin Oncol 2006;24:448-56
29. Nuver J, Smit AJ, Wolffenbuttel BH, Sluiter WJ, Hoekstra HJ, Sleijfer DT, et al. The metabolic syndrome and disturbances in hormone levels in long-term survivors of disseminated testicular cancer. J Clin Oncol 2005;23:3718-25
30. Sampson N, Unterggasser G, Plas E, Berger P. The aging male reproductive tract. J Pathol 2007;211:206-18