대한임상병리사회지 : 제 25 권 l 호 1993
여려 염색조건이 AgNORs 염색에 미치는 영향
원광보건전문대학 임상병리과 제갈승주
Key words : Nucleolar organizer regions, Argyrophilic staining technique, DNA, RNA, Nucleolus
1 . 서 트료 L -
핵 소 체 형 성 부 위 (nucleolar organizer regions
; 이하 NORs로 약칭)는 분열기 중기세포의 선 두부 착 염 색 체 (acrocentric chromosome) 인 13, 14, 15, 21, 22 번 염 색 체 의 단완부에 존재 하는 ribosomal RNA(rRNA) 를 전사하는 DNA고리 로서 단백질 합성에 있어 필수적인 부위이다 1)
이 NORs은 파라핀절편의 간기 (interphase) 세포의 핵에서 은 (Ag) 으로 쉽게 염색할 수 있 기 때문에 이 염색법을 AgNORs 염색이라 부르 고 있으며 2) , NORs 의 이같은 호은성은 rRNA 를 전사하는 유전자 자체에 염색되는 것이 아니 라 전사에 관련된 RNA polymerase P), B234\
C235) 등의 단백질에 기인하는 것으로 추정하
고 있다.
AgNORs 염색은 10 여년 이전부터 세포유전학 자들에 의해 유전성질환(특히, 21 번 염색체와 관련된)의 조사를 위해 사용하고 있는데 6) , 이 들이 사용하고 있던 방법을 1980 년 Howell과
또 이 염색법은 핵의 배수성 (ploidity) 을 측 정하여 세포증식능을 평가하는 유식세포 분리 분석법 (flow cytometry)14 , 15) 이나 정상세포와 인 유두종바이러스감염세포를 감별하기 위한 m situ hybridization9) 및 세 포 의 단백 질 합성 능을 측정하는 생화학적 분석과도 상관관계 16) 가 있 다는 발표가 많아지고 있기 때문에, 유식세포 분리분석기 (flow cytometer) 와 같은 고가의 장 비가 없이도 간편하게 염색할 수 있다는 이점 으로 인해 점차로 사용빈도가 늘어나고 있는 추세이다.
그러나 AgNORs 염색의 사용이 증가하면서 고정조건이나 염색조건에 따라 염색성에 차이 가 있다는 보고들이 나오고 있어 이 평가법의 큰 문제점으로 지적되고 있다 17 , 18 , 19)
따라서 본 연구는 기존의 AgNORs 염색에 미치는 제 조건을 검토하여 가장 좋은 염색성 을 얻을 수 있는 조건을 찾기 위한 것과 특히 기존의 질산은액의 농도를 50% 로 처방하고 있어서 질산은액의 농도를 낮추기 위한 목적으 Black7) 이 보호콜로이드를 이용한 간편한 1- 로 시도하였다.
step method 로서 소개하였으며 이 방법을 1987
년 Crocker8l가 처음 진단종양병리학분야에 적
n.
재료 및 방법용하여 유용성이 있음을 발표한 이래, 종양세
포의 증식능의 평가 및 양성종양과 악성종양의 1. 실험재료 감별을 위한 보조수단으로 AgNORs 염색이 많
은 관심을 불러일으키고 있다9 , 10 , 11,12,13) 그 이 실험에 사용한 동물은 Sprague-Dawley 계 암 유로는 정상 또는 양성세포에 비해 악성세포의 컷 흰쥐(체중 190-240 g) 로서 20마리를 무작 핵에서 AgNORs 의 출현빈도가 높다는 주장들 위로 추출하여 1 주일간 환경에 적응시킨 후, 1 이 많아지고 있기 때문이다. 군에 5 마리씩 4군으로 나누어 고형사료(신촌
야 ω
실험동물사료, 서울)와 물을 먹이로 사육하였 으며 실험전에 24 시간 절식시켜 실험에 사용 하였다.
2. 실험방법
각 군을 ethyl ether로 마취하여 개복한 후 간을 적출하고 동일 엽 Oobe) 을 2--3mm 두께로 앓 게 잘 라 즉 시 10% neutral buffered formalin (NBF), Formol-cacium(FC), Carnoy, Bouin 액 에 나누어 고정하였다. 각 고정액에 고정한 4
군은 질산은의 농도, 염색온도, 염색시간을 달 리하여 염색하였다. 질산은의 농도는 현재 가 장 많이 사용하는 Crocke와 Skillbeck 법의 50
%보다 낮게 10%, 20%, 30%, 40%, 염색온도 는 200C, 40oC, 60oC, 염색시간은 40, 60, 80
분으로 구분하여 시행하여 각 군에서 질산은의 농도가 낮으면서 뚜렷한 염색성을 보이는 조건 을 찾아내어 각 군별로 AgNORs수의 차이가 있는가를 조사하였다.
3. AgNORs염색 및 결과판정
고정이 완결된 각 군의 조직편을 알코올 상 승계열 탈수, 크실렌 투명과정을 거쳐 파라핀 으로 포매 한 다음 Rotary microtome(AO-820,
USA) 을 사용하여 5 μ m 두께로 절편을 작성 하였다. 이 절편을 크실렌으로 탈파라핀하고 알코올 하강계 열을 거 쳐 증류수에 함수시 킨 후
1 % f ormic acid (Hayashi pure chemical Co.) 액
gelatin(Difco Co.) 을 2% 가 되도록 녹인 용액 과 10%, 20%, 30%, 40% 의 silver nitrate (Junsei chemical Co.) 수용액을 비율이 1:2 가 되도록 섞어 만든 silver colloid용액에 넣어 위 에 기술한 염색온도, 염색시간을 달리하여 암 소에서 반웅시킨 후 증류수로 2-3 회 수세하 고 탈수, 투명과정을 거쳐 canada balsam으로 봉입하였다.
이 표본을 광학현미경 유침하에서 관찰하여 간소엽 중심정맥 근처에서 임의로 1007~ 의 세 포를 선정하여 각각의 세포핵 내에서 진한 갈 색점으로 보이는 AgNORs 의 수를 세어 세포당
평균 NORs수를 다음과 같이 구하였다.
평균 AgNOR수
Z( 세포핵당 AgNOR수×세포핵수)
100
4. 자료분석
간 군의 간세포핵내 AgNORs의 분포를 구하 고, 핵내 평균 AgNORs 수를 각 군간 비교하 기 위해 일원 분산분석 (one-way ANOVBA) 을 하였고 사후겸 정은 Duncan’s multiple range
test를 시행하였다. 통계분석은 SPSSjPC+ 로 하였다.
m.
결 과배경은 황색, 간세포핵은 연한 갈색으로 염 색되었고 NORs은 핵내에 진한 갈색의 경계가 분명한 점으로 나타났는데, 세포핵에 따라 어 떤 것은 굵은 과립형으로 어떤 것은 크기가 작 은 미세한 분말 형태로 관찰되었다.
1. 각 군벌 염색성
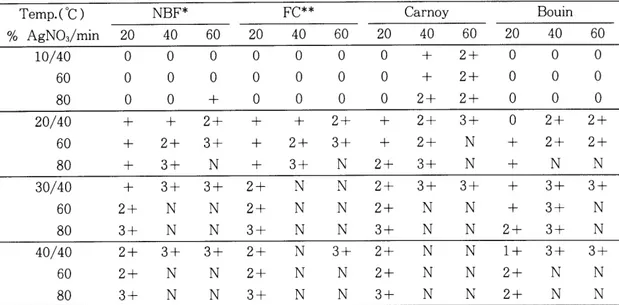
NBF 고정조직에서는 20% 600C 40 분과 40 OC 60 분, 30% 200C 60 분, 40% 200C 40--60
분에서 AgNORs을 충분히 관찰할 수 있었으 며, FC 고정조직의 경우는 NBF 고정조직과 동일하게 나타났고, Carnoy 고정조직에서는
10% 600C 40분 이 상과 10% 400C 60분, 20%
200C 80 분과 20% 400C 40--60분 및 30--40
% 200C 40--60분에서, Bouin 고정조직에서는
20% 40--60oC 40--60 분, 30% 200C 80 분 및 40% 200C 60--80분에서 관찰하기 좋은 상태 를 보였다. 그러나 온도가 200C 이상으로 상승 하면서 배경에 은침착도가 높아져 AgNORs 수 의 판정시 혼동을 일으킬 수 있으므로 200C 로 기준으로 하여 최적의 조건을 설정하여 보면
NBF 고정조직의 경우 30% 60 분에서, FC 고 정조직은 NBF와 동일하고, Carnoy 고정조직 은 20% 80분에서, Bouin 고정조직은 30% 80
분에서 가장 좋은 염색성을 얻을 수 있었다
T able 1. Intensity of AgNORs staining according to various conditions.
Temp.(OC) NBF* FC** Carnoy Bouin
% AgN03/min 20 40 60 20 40 60 20 40 60 20 40 60
10/40 0 0 0 0 0 0 0 + 2+ 0 0 0
60 0 0 0 0 0 0 0 + 2+ 0 0 0
80 0 0 + 0 0 0 0 2+ 2+ 0 0 0
20/40 + + 2+ + + 2+ + 2+ 3+ 0 2+ 2+
60 + 2+ 3+ + 2+ 3+ + 2+ N + 2+ 2+
80 + 3+ N + 3+ N 2+ 3+ N + N N
30/40 + 3+ 3+ 2+ N N 2+ 3+ 3+ + 3+ 3+
60 2+ N N 2+ N N 2+ N N + 3+ N
80 3+ N N 3+ N N 3+ N N 2+ 3+ N
40/40 2+ 3+ 3+ 2+ N 3 十 2+ N N 1+ 3+ 3+
60 2+ N N 2+ N N 2+ N N 2+ N N
80 3+ N N 3+ N N 3+ N N 2+ N N
O=No staining(no nucleation); + =minimal staining;2+ =good, quantifiable staining;3+ =quanti- fiable, but overstained; N = diffuse dark, not quantifiable
*
Neutral buffered formalin* *
Formol-calcium(Table 1). 또한 이 4 군의 최적조건 중 간세포 핵의 보존성은 NBF와 FC(Fig. 1, 2) 가 Carnoy 와 Bouin 고정조직 (Fig. 3, 4) 에 비해 좋은 것 으로 관찰되었다.
2. 각 군별 평균 AgNORs 수의 비교
간세포핵내 평균 AgNORs 수는 Table 2,
Fig. 1, 핵내 AgNORs 의 분포는 Table 3 과 같 으며 일원 분산분석 결과는 Table 4 와 같았다.
핵 내 평 균 AgNORs 수는 NBF, FC, Carnoy, Bouin 고정조직 각각 1.47 ::!::: 0.09, 1.53::!::: 0.096,
1.72::!:::0.12, 1. 40::!:::0.16 으로 Carnoy 고정조직 이 다른 3 군에 비해 유의하게 높은 것으로 나타났 다 (P<O.Ol ).
간세 포 핵 당 AgNOR 의 분포는 NBF, FC,
Bouin 고정조직에서 AgNOR 이 없는 경우가 각각 11.80%, 10.60%, 15.40%, 하나만 있는 경 우가 각각 46.80%, 44.00%, 43.40%, 두 개
%, 네 개 있는 경 우가 각각 2.60%, 2.60%, 1.
60%, 다섯 개 있는 경우는 Bouin 고정에서만 0.40% 가 출현하여 이들 3 군간에는 큰 차이를 보이지 않았다. 이에 대해 Carnoy 고정조직에 서는 AgNOR 이 없는 경우가 2.20%, 하나만
T able 2. AgNOR counts in normal liver tissue according to four fixatives.
Specimen No. NBF FC Carnoy Bouin 1
2 3
44
5
1 1 0 0 7
-o
6
mω
j
AA
AA
A J -4·J
j
1i
14
14
14
14 -1i
nU nU
R m씨 U
였
@u
쩌
-찌
찌파
1i
14
1i
1i
1i
--,
4
nU nU
쇄
$
$
패
퍼-퍼 m 씨 패
1i
1i
1i
1i
14 -1L
nU nU
죄
?써야씨 야써
mJ
-죄
싸 싸 Mm1i
1l4
14
14
14 -14
nU nU
Mean S.D.
S.E.M.
있는 경 우가 각각 27.00%, 29.80%, 29.60%, S.D.=standard deviation;S.E.M=standard err- 세 개 있는 경우가 각각 11.80%, 13.00%, 9.6 or of mean
- 55-
Fig. 1. Normalliver, fixed in 10% neutral buff- ered ‘ f ormalin (NBF) showing optimal staining for AgNORs, with good nuclear morphology.
x 1000
Fig. 3. Normal liver in Carnoy fixation. The liver cells contain one to two AgNORs per nu- cleus with poor morphology. X 1000
Fig. 2. Normal liver in 10% Formol--calcium fixation. The AgNORs staining was similar to NBF fixation, but nuclear size was smaller than NBF-fixed liver. X 1000
Fig. 4. Normal liver in Bouin fixation. The AgNORs staining was similar to formalin-based fixatives, but nuclear morphology, in part
×
m
m Fi
쨌
p、‘,,/따
뼈
찰
AgNORs 염색은 핵소체 형성부위 (NORs) 내
의 호은성 단백질을 증명하는 방법으로 사용되 고 있는데, 이 반응의 화학적 기전에 대해서는 몇 가지 설이 있기는 하지만 아직 정확하게 규
N. 고
l }
f
ι
I
ψ
l f
에
{
τ
삐 륙 삐」
명 되 어 있 지 않다. Buys와 Osinga20) 는 핵 내 히 스톤 단백질을 추출한 표본에서 AgNORs 염색 이 된다는 것을 확인하고 AgNORs 반응은 비 히스톤단백질과 반응할 것으로 추론하여, 분열 중 기 표본 에 서 sulfydryl 기 와 disulfide 기 에 특 이 적 이 로 결 합하는 형 광염 료 인 mercuridibro- mofluorescein과 반응 시 킨 결 과 ribosomal RNA 를 code하는 gene 이 있는 곳에 형광성 점으로 나타났으며, 이 위치는 AgNORs 염색에서 은이 침착하는 위치와 동일한 것으로 관찰되었다.
이들은 이같은 사실을 증명하기 위해 disulfide bond를 분해 하고 sulfydryl를 thiosulfite로 전환 시키는 산화제인 황산동 (copper sulfate) 을 처 리하였을 때 이 반응이 일어나지 않는다는 것 도 확 인 하 였 다. 또 Buys와 Osinga20) 는 sulfy- dryl과 disulfide 기 외에 음(- )으로 하전된 비 히스톤단백질의 carboxyl 기도 AgNORs 반웅에 관여한다는 것도 보여주었다.
한편, 포르마린의 고정작용은
',<:,‘
:>:>~
앙J
Fig. 5. Scattergram of AgNOR numbers in normal liver tissues. There are difference in dis- tribution of AgNORs between Carnoy and other fixatives.
<?껴 G~
‘
G총’ ‘、
2.0 1.8
n피
Ad
2
n써
1J
14
1i
1i m3φ강「g 」φgm‘여。Z }。’iφ고〔섭3딩 낌‘띠@릅
Table 3. Analysis of variance for mean num- bers of AgNORs per nucleus in normal liver tis- sue.
3 0.2881 0.0960 6.7917 0.0036 16 0.2262 0.0141
P MS F
DF SS Source
Between Groups Within Groups
Total 단백질의
sulfydryl 기 와 carboxyl 기 가 근 접 해 있 는 사 이 에서 메틸렌다리 (methylene bridge) 를 형성함 으로서 이루어진다는 것은 잘 알려져 있다21)
따라서 AgNORs 반웅은 메틸렌다리에 의해 저
해될 것으로 생각되지만 조직침투과정의 70%
19 0.5143
Table 4. Distribution of AgNORs per nucleus in normal liver tissue.
알코올 단계를 거치면서 메틸렌다리가 분해되 기 때문에 이 두 기는 다시 활성되어 은이온과 결합될 수 있다. 본 실험에서도 포르마린을 기 초로 한 NBF나 FC 의 AgNORs 염색이 잘 나타 나는 것으로 보아 이같은 사실을 확인할 수 있 었다.
알코올을 기초로 하는 대표적인 고정액인 Carnoy 액을 사용한 경우에 있어서도 Smith 둥 17) 의 보고와 마찬가지로 좋은 결과를 나타내었 다! 이같은 결과는 Pearse22) 가 암시한 에탄올 고정이 단백질의 3, 4차 구조를 붕괴하여 di- sulfide bond와 sulfydryl7] 를 외 부로 유 리 해 낸
5 2.60 2.60 4 Fixa-
tIves
NEF(%) 11.80 46.80 27.00 11.80 FC 10.60 44.00 29.80 13.00 Carnoy 2.20 40.60 41.80 13.80 Bouin 15.40 43.40 29.60 9.60
0 1
1.60 0.40
- 57- 1.60
있는 경우가 40.60%, 두 개 있는 경우가 41.80
%, 세 개 있는 경우가 13.80%, 네 개 있는 경 우가 1. 60% 의 비율로 나타나 앞의 3군에 비해 AgNOR 이 출현하지 않는 비율이 적은 대신 2 개가 출현하는 비율이 상대적으로 높게 나타났 다.
다는 보고와 또 이 고정액에 포함된 아세트산 이 이 효과를 증가시킨다는 것을 재확인할 수 있었다.
Bouin 액에 고정한 간조직의 경우도 Smith
등 17) 의 보고와 같이 AgNORs 반응이 뚜렷이 관찰되었다. 이같은 결과는 Smith 등 17) 이 지적 한대로 피크르산이 비히스톤단백질의 sulfydryl
기와 disulfide 기와 결합하는 작용이 있으나 이 액 내에 포함된 아세트산과 포르마린의 확산계 수가 더 높기 때문에 피크르산이 조직에 작용 하기 전에 먼저 이 두 고정제에 의해 고정된다 는 것과 일치하는 소견이다.
본 실험에서 조직 고정에 사용되는 주요한 고정액인 Zenker 액을 제외시킨 것은 예비 실 험과정에서 ZeI)ker 액에 고정한 조직의 경우
AgNORs 반웅이 어떤 조건하에서도 약하거나
거의 구별이 불가능하였기 때문이다. 이것은
Smith 둥 17) 이 지적한 바와같이 중크롬산칼륨의
강한 산화능에 의해 근접한 sulfydryl 기가 결합 하여 디술피드다리 (disulfide bridge) 를 만든 다 음 더 욱 산화되 어 두 개 의 cysteic acid 분자로 분해됨으로서 은이온이 결합하지 못한다는 것 과 일치하였다.
본 실험의 주요 목적은 기존의 AgNORs 염 색에 사용되는 질산은의 농도를 낮출 수 있는 가를 검토하고 서로 다른 고정액이 AgNORs
숫자의 판정에 어떠한 영향을 미칠 것인가를 알아보기 위한 것이었다.
실험결과에 의하면 반웅온도와 시간에 따라 반웅성에 차이가 있는 것으로 나타났으며 이 중 특히 반웅온도의 상승은 배경에 은침착을 유발시켜 AgNORs 계수에 혼동을 초래하는 인 자로 지적되었다. NBF와 FC 고정조직의 경우 질산은 농도 30% 에서 20 VC 60 분간 염색하였 을 때 AgNORs 숫자판정 이 충분하였으며,
Carnoy 고정조직은 20% 에서 200C 80분간,
Bouin 고정조직의 경우는 30% 에서 200C 80분 간이 적정수준이었다. 이 결과를 비교하면
Carnoy 고정된 간세포핵내 NORs 이 은이온과
가장 높은 친화력이 있음을 알 수 있었다. 그 러나 Carnoy 액과 Bouin 액에 고정된 조직은 핵
의 위축이 심하고 핵막의 요철이 심하게 나타 났으나 NBF 액과 FC 액에 고정된 조직에서는 핵형태의 보존이 아주 우수하였다. 또 핵형태 의 보존이 좋은 조직의 경우는 AgNORs 의 계 수에도 편차가 적은 것으로 나타났기 때문에 조직의 고정에는 포르마린계 고정액올 사용하 는 것이 AgNORs 판정에 좋을 것으로 사료된다.
정상 간세포의 핵내 AgNOR 수에 있어서는 김 등23) 이 포르마린으로 고정된 사람조직에서 1.46 개를 보고하였으며, Crocker 둥 10) 이 포르마 린고정의 사람조직에서 1.88개로 보고 있어서 검사자간에 약간의 차이를 보여주고 있다. 본 실 험 에 서 는 NBF, FC, Carnoy, Bouin 고 정 조직 에 서 각각 1.47, 1.53, 1.72, 1.40 개 로 나타나 위의 두 보고와 일치함을 알 수 있었다. 그러 나 동일조직 사이에도 Carnoy 고정조직과 다 른 3종류의 고정조직간에 유의있는 차이를 보 이고 있어서 임상에서 활용시 동일 고정조직에 서 AgNOR올 계수해야 편차를 줄일 수 있을 것으로 사료된다.
또 핵내 AgNOR 분포에 있어서는 어느 고정 액이나 5 개를 넘지 않았으며 다른 3 종류의 고 정액에 비해 Carnoy 고정조직에서 AgNOR 이 출현하지 않는 경우가 적은 대신 두 개 있는 핵이 많은 것으로 관찰되었다. 이같은 결과는
Carnoy 고정액이 AgNOR을 고립산재성으로
유지하는 고정효과를 가지고 있는 것으로 보이 며, 이에 대해 다른 3종류는 AgNOR을 서로 융합하는 작용이 있는 것으로 추정된다.
마지막으로, 질산은의 농도, 염색온도 및 염 색시간에 따른 실험성적을 보면 질산은의 농도 에 있어서는 기존의 처방에 비해 상당히 낮은 농도에서도 관찰에 적정한 결과를 얻을 수 있 는 것으로 나타났으며, 염색온도와 염색시간에 있어서는 名古屋美智 둥애)이 보고한 바와 같이 온도가 높고 반웅시간이 길수록 AgNOR 이 대 형화하고 핵내의 다른 구조가 공염(共씻)되며 배경에 은침착이 증가하는 경향을 나타내었다.
따라서 추후 은침착을 방지할 수 있는 연구가 있어야 좀 더 안정성 있는 방법으로 사용될 수 있을 것이다.
v.
~~ {I~~ 71~~ AgNORs~~oJl ul~l~ ~ c~ Jl ~ ~
g
~R ~L£-t}~ 7}AJ ~ ~ 3:~g
1i~ ~ -&~ _Q_£ -"1 S:.-5"}~
q .
.Jl~ Ql} ~ ~*' ~~ ~ ~ ~s:., ~ ~
.g.s:.
~ ~ ~ -"1 Z!-g
rg-cl-t}~ ~ ~J!}, _¥_.§..u}~7-ll .Jl~S:~.Q.£ ~~~
~s:. 20----30%, ~~.g.s:. 20°C, ~~-"lZ!- 40----
60~ oJl Ai mj ~ ~ ER .!2_ ~ 01
Jf-T-
-t} .Jl ~ {1 ;3fs:.
7} ~ .Q.
Tt!
Ai ~ ~ ~ ~ ~ x7} ~_g. ~ .Q.£ 1-}E}~q. !£ .Jl~~oJ1 n:}c} liaTI- AgNORs T-oJ1
~Z!-9-1 ~}017} .!2_ol.Jl ~~ <iJAJoJlAi lf%~
7(l Jf- ol ~ ~ .Jl ~ -t}~ o~ ~ ~_Q_£ ;?:A}~<»
r:}.
Effect of Various Staining Conditions on the AgNORs technique
Jekal, S. J.
Dept. of Clinical Pathology, WonKwang Public Health Junior Collage
ABSTRACT
With increasing interest being shown in nu- cleolar organizer region(NORs) in pathology, it was considered of great importance to evaluate the effect of various conditons on the staining properties.
NORs can be demonstrated in paraffin sec- tions by a silver technique(AgNOR method) which was developed from a method used by cytogeneticists for the demonstration of NORs in chromosome spreads. The degree of staining is dependent on the staining conditons including fixation regime employed and results may vary greatly.
To evaluate the stainability of AgNORs ac- cording to the fixation regime, silver concentra- tion, staining temperature and staining time, the author have done AgNORs staining in the normal liver tissue.
Twenty Sprague-Dawley adult female rat were
divided into four group; 10% neutral buffered formalin, formal-calcium, Carnoy and Bouin. the rats were sacrified, and the liver removed, fixed by immersion, and processed for light microscopy.
The fixative schadules and post-treatments used in this study were based on standard sequences from literature and other staining conditions were determined in our option.
We have shown that, m general, formalin- based fixatives(lO% neutral buffered formalin and 10% formal-calcium) give optimal results.
Although it badly revealed morphological as- pect, Carnoy and Bouin fixative were similar to formalin-based fixation in the AgNORs count- ing. But, Carnoy fixation have shown signifi- cant differences in mean AgNOR count per nu- cleus when compaired with the other groups(p
<0.01). We have shown also that it give adequate results at 20%----30%, 20 OC and 40---- 60 min in silver concentration, staining tempera- ture and staining time, respectively.
References
Bioi Cell 56: 189-206, 1986.
1. Fakan S, Hernandez-Verdun D. :The nucl-
olus and the nucleolar organizer regions. 2. Ploton D, Menager M, Jeanesson P, Himber -59-
G, Pigeon F, Adnet JJ. : Improvement in the staining and in the visualization of the argyrophilic proteins of the nucleolar orga- nizer region at the optical level. Histochem J 18:5-14, 1986.
3. William MA, Kleinschmidt J A, Krohne G, Franke WW. : Argyrophilic nuclear and nu- cleolar proteins of Xenopus laevis oocytes identified by gel electropheresis. Exp Cell Res 137:341-51, 1982.
4. Lischwe MA, Smetana K, Olson MOJ, Busch H. : Proteins C23 and Bz3 are the major nucleolar silver staining proteins. Life Sci 25:701-8, 1979.
5. Ochs R, Lischwe M, O'Leary P, Busch H.:
Localization of nucleolar phophoprotein B23 and C23 during mitosis. Exp Cell Res 146:
139-49, 1983.
6. de la Cruz FF, Gerald PS. Trisomy 21. Bal- timore : University Park Press 165 -7, 1981.
7. Howell WM, Black DA. : Controlled silver staining of nucleolus organizer regions with a protective colloidal developer ; a 1-step method. Experientia 36:1014-5, 1980.
8. Crocker J, Skilbeck N. : Nucleolar organizer region associated proteins in cutaneous mel- anotic lesions ; a quantitative study. J Clin Pathol 40:885-9, 1987.
9. Egan M, Freeth M, Crocker J. : lntrae- pithelial neoplasia, human papillomavirus in- fection and argyrophilic nucleoprotein in cervical epithelium. Hisopathol 13:561-7, 1988.
10. Crocker J, McGovern J. : Nucleolar organiz- er regions in normal, cirrhotic, and carci- nomatous livers. J Clin Pathol 41:1044-8, 1988.
11. Morgan DW, Crocker J, Watts A, Shenoi PM. : Salivary gland tumors studied by means of the AgNOR technique. Histopathol 13:553-9, 1988.
12. Egan MJ, Crocker J. : Nucleolar organizer regions in cutaneous tumors. J Pathol 154:
247-53, 1988.
13. Sivridis E, Sims B. Nucleolar organizer re- gions : new prognostic variable in breast carcinomas. J Clin Pathol 43: 390-2, 1990.
14. Crocker J, Macartney JC, Smith PJ. : Cor- relation between DNA flow cytometric and nucleolar organizer region data in non- Hodgkin's lymphomas. J Pathol 154:151- 6, 1988.
15. %71~. ~..!fd ~. ~:{!-, ~~llH :Nucleolar organizer regions9}
%J.il
!£. ~~71
~ol%
~ ~~
llH4-J-a
~"'}~ .!8-~ %l=lJ~%~tJl.llL
CjT· rl1
~~ C-1 ~§1Al
26:117-124, 1992.16. olAH~. ~1~~+. 0Jej~: ~7lA}~ol ~
~ ~~ -2-~ ~ ~j1l ~ J-cj Jf-.sfl ~J-cj
oJl 01
~1~
OJt>J.
qj~%2-l~lliA}~§lAl 11:83-91, 1990.17. Smith PJ, Skilbeck N, Harrison A, Crocker J. : The effect of a series of fixatives on the AgNOR technique. J Pathol 155:109-12, 1988.
18. ij~J¥.~~. fill: AgNORs~~~t-lHI}ffi~t:~
ffl-9 0 t-=61)0)£WR':i ~a1 2. ~IE~t: J: 0
~-· B ~trtnEtt-lHI}ffi~**J?:~[):£fffhi!r~ 8:
5-53, 1990.
19. ijif]¥.~~.: AgNORs~~O)t-lHI}ffi~/\.,.0)~
ffl. trtnEK~lt 36:1292-4. 1992.
20. Buys CHCM, OSinga J. : Abundance of pro- tein bound sulfydryl and disulfide groups at chromosomal nucleolus organizer regions.
Chromosoma 77: 1-11, 1980.
21. Ail~~+ ~
:
5:?4~A}~. Jl~9-l~ p.31, 1992.22. Pearse AGE. Histochemistry :Theoretical and Applied, vol 1, 4th edn. Edinburgh:
Churchill Livingstone 159-252, 1980.
23.
7dtrol.
~~1"!. ~~%:AaAJ5:?4:rrl-
~~Aa~ %0JJ-cj ~ ~