145
림프종 환자에서 회귀모형을 이용한 vincristine의 약물 용량 예측 인자 및 부작용 모델 연구
서정원1,2·김동현2·윤진상3·김선화4·최보윤5·오정미5·권광일2
1식품의약품안전평가원 의료제품연구부 신약연구팀, 2충남대학교 약학대학
3충남대학교병원 진단검사의학과, 4식품의약품안전평가원 약리연구과, 5서울대학교 약학대학
(2011년 2월 23일 접수·2011년 5월 13일 수정·2011년 5월 14일 승인)
Pharmacodynamic Modeling of Vincristine in Lymphoma Patients
Jeong-won Seo
1,2, Dong-hyun Kim
2, Jin-sang Yun
3, Seon Hwa Kim
4, Boyoon Choi
5, Jung-mi Oh
5, and Kwang-il Kwon
21New Drug Research Team, National Institute of Food and Drug Safety Evaluation (NIFDA)
2College of Pharmacy, Chungnam National University, Daejeon, Korea
3Chungnam National University Hospital, Daejeon, Korea
4Division of Pharmacological Reserch, National institute of Food and Drug Evaluation, Korea Food & Drug Evaluation
5College of Pharmacy, Seoul National University, Seoul, Korea (Received February 23, 2011·Revised May 13, 2011·Accepted May 14, 2011)
The objective of this study was to determine whether any pretreatment parameters were associated with pharmacologi- cal effect or toxicity parameters after vincristine administration and to describe a mathematical model, which explains the interpatient pharmacodynamic variability. The relationship between patient characteristics and vincristine dose and hematological toxicity were evaluated. 68 pediatric and adolescence patients and 107 adults with acute lymphoblastic leukemia were treated with vincristine 1.5 mg/m2/day IV and other anticancer drugs as scheduled. Complete blood counts and other blood test results were obtained. The input variables were age, gender, weight, lean body weight (LBW), height, body surface area, vincristine dose and total vincristine dose. The outcome measures were nadir values (white blood cells, absolute neutrophil counts, hemoglobin, and platelets); the absolute decrease, relative decrease, and survival fraction of blood cells. Polynomial regression analysis was carried out to determine the other significant covari- ates. The variability of WBCnadir was modeled with good precision and accuracy with a two-covariate model. This model should be validated and improved on with further clinical data. We believe that such pharmacodynamic model- ing should be explored further to determine its performance and clinical relevance compared with modeling using phar- macokinetic parameter.
□ Key words - vincristine, pharmacodynamic model, lymphoma
Vincristine은 1960년대부터 쓰여지고 있는 vinca alkaloid 계 항종양 물질로서, 여러 종류의 종양치료제로 광범위하게 사용된다.1,2)특히 소아와 성인에서의 급성 림프구성 백혈병 (acute lymphoblastic leukemia, ALL)의 항암화학요법치료에 중요한 약물로 단독보다는 다른 부신피질 호르몬약물들과 함
께 병용요법으로 주로 사용되어 왔다.3-5) Vincristine은 세포 주기 특이성 항암제로 세포분열기에 방추사 형성을 방해하여 세포를 파괴한다. 방추사는 tubulin이 중합화(polymerization) 되어 형성되는 미세관(microtubule)으로 구성되어 있는데 vincristine은 종양세포의 tubulin과 결합하여 세포분열에 필요 한 미세소관의 합성을 저해하여 종양세포의 괴사를 유발하는 것으로 알려져 있다.6-9) 그러나 vincristine은 약제의 부작용 으로 말초신경, 자율신경, 뇌신경장애 등의 신경독성 증상을 호발시킬 수 있다.10-13) 또한 다른 항암제처럼 골수를 억제 (myelosupperssion)하여 혈소판 수를 감소시키는 작용이 있는 것으로 알려져 있으나, ALL 치료에서 사용되는 작은 용량에 서는 오히려 혈소판 수를 증가시키는 것으로 알려져 있다.14,15) Correspondence to : 권광일
대전광역시 충남대학교 약학대학
Tel: +82-42-821-7310, Fax: +82-42-823-6781 E-mail: kwon@cnu.ac.kr
오정미
서울대학교 약학대학 Tel: +82-2-740-8552 E-mail: jmoh@snu.ac.kr
작용기전은 아직 확실히 규명되지 않았으나 이 약물이 세포 및 체액성 면역억제작용이 있는 것으로 보아, 혈소판 관련 항체의 생성을 억제하리라 예상된다.16)
일반적으로 vincristine의 성인과 소아의 표준용량은 1.4~2.0 mg/m2으로, 환자의 체표면적을 기준으로 하여 결정하 는데 1일 투여 최대용량은 2 mg 이다.17) 약물의 용량은 환자 의 체표면적에 근거하여 결정되나, 이는 일반적으로 약물의 약동학적 파라미터들과 체표면적 간의 어떠한 상관관계를 근 거로 한 것이다. 그러나 이러한 가정은 세포독성을 가지는 약 물의 복잡한 제거 과정을 고려하고 있지 않으며, 약물의 효과 에 있어 예측할 수 없는 차이를 나타내게 된다. 따라서 약물 용량 결정에 있어서 체표면적뿐 아니라 다른 input factor의 영향력을 용량결정에 반영하는 것이 필요하다.18,19)
이 논문에서는 급성백혈병 (ALL) 및 다양한 lymphoma 환자에서 약물 용량 결정에 영향을 줄 수 있는 요인을 환자 의 체표면적, 몸무게, 키, 나이, 간기능 수치 (AST, ALT, ALP, total bilirubin) 및 total protein, 혈청 크레아티닌 수치 와 약물 투여 전 백혈구(WBC), 절대호중구수(ANC), 혈소판 수 및 헤모글로빈 수치 등으로 규정하고 각각을 조사하여 변수들과 약물 용량간의 상관성을 조사하였고, 이 변수들과 약물용량 간의 회귀 모형을 설정하는 연구를 수행하였다. 또 임상에서 다양한 종양질환 치료에 사용되는 항암제는 골수의 변화 및 혈액학적 변화를 유발하고, 이로 인하여 치료성적에 아주 많은 영향을 주게 된다. 따라서, 이 논문에서는 항암제 투여 후 부작용으로 나타나는 혈구수 및 혈소판, 헤모글로빈 의 감소에 대한 연관성 있는 요인을 찾고 이들로부터 모델 을 설정하고자 하였다. 부작용 측정인자는 약물 투여 후 백 혈구수, 절대호중구수, 혈소판 수, 헤모글로빈의 수치의 최소 값 및 감소비율로 정하고, 이러한 부작용 파라미터들과 이들 파라미터의 변화에 영향을 줄 수 있는 요인인 약물의 용량 및 체표면적당 약물용량, 환자의 체표면적, 몸무게, 키, 나이, 간기능수치 (ALT, AST, ALP, total bilirubin), total protein, 혈청 크레아티닌 수치, 약물투여 전 백혈구, 절대호중구, 혈 소판 수 및 헤모글로빈 수치 등과의 상관성을 연구하였다.
또한, 각 부작용 파라미터와 이에 영향을 주는 요인들 간의 회귀모형을 설정하고자 하였다.
시험방법
환자집단
2006년 1월부터 2009년 10월까지 서울대학교 병원에서 입원 또는 내원하여 급성 림프아구성 백혈병 (acute lymphoblastic leukemia, ALL)을 진단받은 소아환자 46명, 성인환자 25명의 vincrinstine의 용량 및 환자의 나이, 성별, 몸무게, 키, 체표면 적, 간기능 수치 (AST, ALT, total bilirubin) 및 혈청 크레아 티닌 수치와 약물 투여 전후의 백혈구(WBC), 절대호중구수 (ANC), 혈소판 수 및 헤모글로빈 수치 등의 정보를 수집하
였다. 또 2009년 1월부터 2009년 12월까지 충남대학교 병원 에 입원 또는 내원하여 급성 림프아구성 백혈병(ALL)과 림 프종(lymphoma)을 진단받은 소아 환자 23명과 성인환자 81 명의 vincristine 용량 및 환자의 나이, 성별, 몸무게, 키, 체 표면적, 간기능 수치 (AST, ALT, ALP, total bilirubin) 및 total protein, 혈청 크레아티닌 수치와 약물 투여 전후의 백 혈구(WBC), 절대호중구수(ANC), 혈소판 수 및 헤모글로빈 수치 등의 정보를 수집하였다. 환자집단의 정보는 Table 1에 나타내었다.
분석방법
본 연구에서는 ALL 및 lymphoma 환자에서 체표면적 이 외에 약물의 용량을 결정하는 데 영향을 줄 수 있는 input factor를 찾고자 하였다. Input factor로 가능성이 있다고 생각 되는 파라미터는 환자의 체표면적(BSA), 키, 체중, 나이, 투 여 전 혈소판수치, 헤모글로빈수치, 백혈구와 절대호중구수, ALT, AST, ALP, Total bilirubin, 혈청 크레아티닌, total protein 등 이었다. 이들 파라미터들과 약물용량(dose) 및 체 표면적당 약물용량(BSA normalized dose)과의 상관성 분석 은 SPSS (version 17.0)의 상관분석 방법을 이용하였다. 변수 간 상관관계 분석에서 약물용량, 체표면적 당 약물용량, 환 자의 체표면적, 몸무게, 키, 나이, AST, ALT, ALP, total bilirubin 수치 및 total protein, 혈청 크레아티닌 수치, 약물 투여 전 백혈구수, 절대호중구수, 혈소판 수, 헤모글로빈 수 치, 연령집단과 성별 등을 변수로 하였고, 이들간의 상관계 수를 구하였다. 이때, 키, 몸무게, 체표면적, 약물용량 등 연 속형 변수 간의 상관성은 Pearson’s correlation coefficient로, 환자의 나이를 그룹으로 분류하여 나타낸 연령집단과 성별 변수 등의 범주형 변수와 연속형 변수 사이의 상관성은 Spearman’s correlation coefficient (rho)로 나타내었다. 또 약 물의 부작용 파라미터 중 약물용량과 비례하여 감소하는 경 향이 나타나는 백혈구수의 최저치(WBCnadir)와 절대호중구 감소율(ANCRD)에 대하여 상관성분석을 하였다. 각각의 부작 용 parameter와 상관성이 있을 것으로 생각되는 약물 1회 투 여 용량, 체표면적당 약물 1회 투여용량, 환자의 체표면적, 키, 몸무게, 나이, AST, ALT, ALP, total bilirubin, total protein, 혈청 크레아티닌 수치, 약물투여 전 백혈구수, 절대 호중구수, 혈소판수, 헤모글로빈 수치 등을 변수로 하였고, 앞서 시행했던 약물용량의 상관성 분석방법과 마찬가지로 연 속형 변수간의 상관성은 Pearson’s correlation coefficient로, 범주형 변수와 연속형 변수 사이의 상관성은 Spearman’s correlation coefficient (rho)로 나타내었다. 범주형 변수인 나 이 그룹을 구분하는 기준은 Table 2에 나타내었다.
다음으로, 각 회귀모델의 상관식을 SigmaPlot(ver 10.0)을 이용하여 구하였다. 약물의 용량 결정에 영향을 줄 수 있는 결정인자로 임상에서 가장 많이 고려되는 파라미터인 환자의
나이, 체표면적, 키, 체중 등을 독립변수로 하고, 약물용량 (dose) 및 체표면적당 약물용량(Dose/BSA)을 종속변수로 하 여, 이 변수들 간의 상관식을 구하고자 여러 모델에 적합시
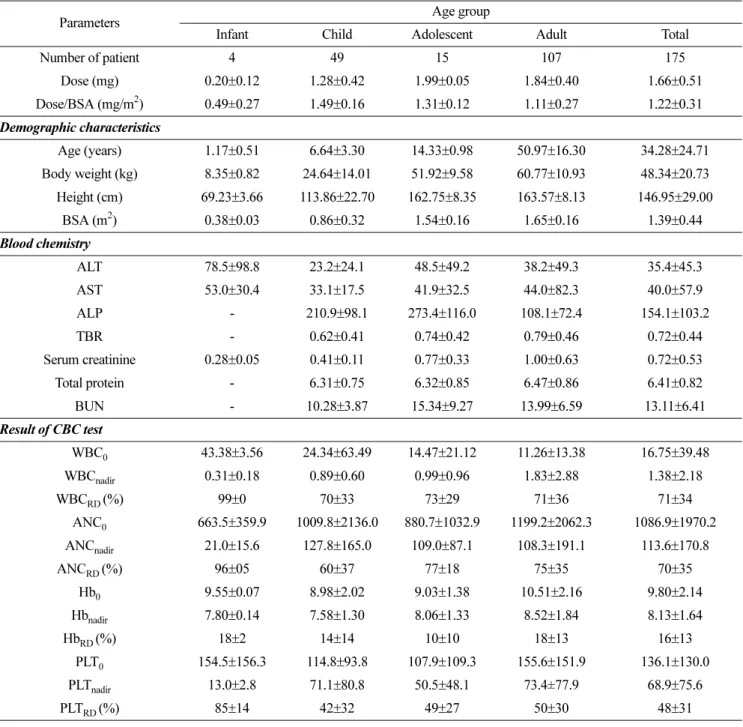
켜 보았다. 또 환자의 체표면적, 키, 체중 중 하나의 변수를 결정인자로 고정하고, 이들 외에 약물 용량 결정에 영향을 줄 수 있을 것으로 생각되는 영향인자인 환자의 나이, 체중, 키, 혈청 크레아티닌, total bilirubin, AST, ALT, ALP, total protein, BUN, 투여 전 백혈구 수, 절대호중구수, 혈소판 수 치, 헤모글로빈수치 등을 관계식에 첨가하고자 하였다. 그러 기 위해 약물용량 또는 체표면적당 약물용량을 종속변수로 하고, 결정인자와 영향인자 두 변수를 독립변수로 포함한 2 차 함수 모형을 설정하였다. 또 약물 부작용 파라미터를 종 속변수로 하고, 결정인자에 해당하는 약물용량, 또는 체표면 Table 1. The characteristics of patients
Parameters Age group
Infant Child Adolescent Adult Total
Number of patient 4 49 15 107 175
Dose (mg) 0.20±0.12 1.28±0.42 1.99±0.05 1.84±0.40 1.66±0.51 Dose/BSA (mg/m2) 0.49±0.27 1.49±0.16 1.31±0.12 1.11±0.27 1.22±0.31 Demographic characteristics
Age (years) 1.17±0.51 6.64±3.30 14.33±0.98 50.97±16.30 34.28±24.71 Body weight (kg) 8.35±0.82 24.64±14.01 51.92±9.58 60.77±10.93 48.34±20.73 Height (cm) 69.23±3.66 113.86±22.70 162.75±8.35 163.57±8.13 146.95±29.00
BSA (m2) 0.38±0.03 0.86±0.32 1.54±0.16 1.65±0.16 1.39±0.44 Blood chemistry
ALT 78.5±98.8 23.2±24.1 48.5±49.2 38.2±49.3 35.4±45.3 AST 53.0±30.4 33.1±17.5 41.9±32.5 44.0±82.3 40.0±57.9 ALP - 210.9±98.1 273.4±116.0 108.1±72.4 154.1±103.2
TBR - 0.62±0.41 0.74±0.42 0.79±0.46 0.72±0.44
Serum creatinine 0.28±0.05 0.41±0.11 0.77±0.33 1.00±0.63 0.72±0.53 Total protein - 6.31±0.75 6.32±0.85 6.47±0.86 6.41±0.82 BUN - 10.28±3.87 15.34±9.27 13.99±6.59 13.11±6.41 Result of CBC test
WBC0 43.38±3.56 24.34±63.49 14.47±21.12 11.26±13.38 16.75±39.48
WBCnadir 0.31±0.18 0.89±0.60 0.99±0.96 1.83±2.88 1.38±2.18
WBCRD (%) 99±0 70±33 73±29 71±36 71±34
ANC0 663.5±359.9 1009.8±2136.0 880.7±1032.9 1199.2±2062.3 1086.9±1970.2
ANCnadir 21.0±15.6 127.8±165.0 109.0±87.1 108.3±191.1 113.6±170.8
ANCRD (%) 96±05 60±37 77±18 75±35 70±35
Hb0 9.55±0.07 8.98±2.02 9.03±1.38 10.51±2.16 9.80±2.14
Hbnadir 7.80±0.14 7.58±1.30 8.06±1.33 8.52±1.84 8.13±1.64
HbRD (%) 18±2 14±14 10±10 18±13 16±13
PLT0 154.5±156.3 114.8±93.8 107.9±109.3 155.6±151.9 136.1±130.0
PLTnadir 13.0±2.8 71.1±80.8 50.5±48.1 73.4±77.9 68.9±75.6
PLTRD (%) 85±14 42±32 49±27 50±30 48±31
Table 2 Age groups criteria
Age group Number of patient Interval Infant 4 0.1-24 months old
Child 49 2-12 years old
Adolescent 15 12~16 years old Adult 107 >16 years old
적당 약물용량과 영향인자를 두 가지 독립변수로 포함하는 2차 함수 상관식을 만들고자 하였다. 결정인자 외에 부작용 파라미터에 영향을 줄 수 있을 것으로 생각되는 영향인자는 환자의 체표면적, 나이, 체중, 키, 혈청 크레아티닌, total bilirubin, AST, ALT, ALP, total protein, BUN, 투여 전 백혈 구 수, 절대호중구수, 혈소판 수치, 헤모글로빈수치 등으로 설정하였다. 각 회귀모델에 대하여 상관성이 높은 영향인자 는 각 회귀모델을 비교하였을 때, adjusted R2값이 증가하는 것을 기준으로 하였다. 다항식의 회귀모델의 경우, 사용한 회귀계수의 수가 많아질수록, 정확성이 증가하지 않아도 R2 값이 증가하게 되는데, 설계변수의 개수가 다른 회귀모델간 의 정확성을 R2 값으로 비교하는 것은 의미가 없게 되므로, adjusted R2 값을 이용하여 비교하였다.
결 과
약물의 1회 투여용량 또는 체표면적당 투여용량과 각 변 수간의 상관계수 분석
약물의 1회 투여용량 또는 체표면적당 1회 투여용량과 연 관성이 있을 것으로 생각되는 요인을 알아보기 위해 변수간 의 상관계수를 분석하였다. 약물용량, 체표면적 당 약물용량, 환자의 체표면적, 몸무게, 키, 나이, AST, ALT, ALP, total bilirubin 수치, total protein, 혈청 크레아티닌 수치, 약물투여 전 백혈구수, 절대호중구수, 혈소판 수, 헤모글로빈 수치, 연 령집단, 성별 등을 변수로 하여 각 변수간의 상관관계를 SPSS (version 17.0)의 상관분석으로 분석하였다. 약물 투여 용량과 키, 나이, 몸무게 등 연속형 변수 간의 상관성은 Pearson’s correlation coefficient로, 환자의 나이를 그룹으로 분 류하여 나타낸 연령집단과 성별과 같은 범주형 변수와 연속 형 변수 사이의 상관성은 Spearman’s correlation coefficient (rho)로 나타내었으며, 상관성 분석결과는 Table 3에 요약하여 나타내었다. 약물의 투여용량과 상관성이 가장 높은 변수는 환자의 키(R=0.756, p<0.0001)였다. 실제 약물 투여 시에는 체표면적으로 약물용량을 결정하지만, 체표면적과 약물용량의 상관성은 0.703 (p<0.0001)으로 키와의 상관성보다 낮았다.
또 환자의 혈청 크레아티닌도 양의 상관관계를 보였으며, (R=0.414, p<0.0001) 이것은 환자의 나이 (R=0.406, p<0.0001) 보다 높은 연관성이 있었다.
약물의 1회 투여용량 또는 체표면적당 투여용량과 각 변 수간의 관계식 설정
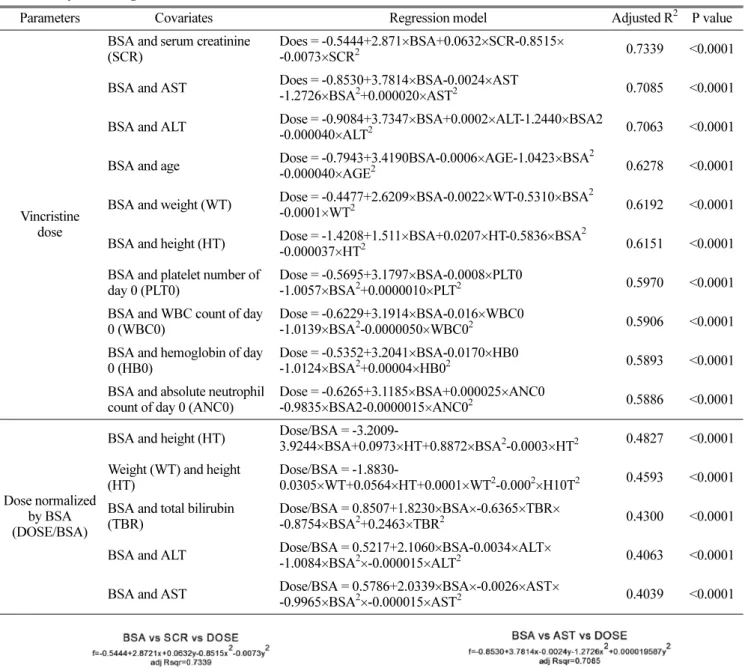
각 회귀모델의 상관식은 SigmaPlot(ver 10.0)으로 분석하였 다. 약물의 용량에 영향을 줄 수 있는 결정인자인 환자의 체 표면적, 체중, 키, 나이 등과 약물용량(dose) 및 체표면적당 약물용량(Dose/BSA)과의 상관식을 여러 모델에 적합시킨 결 과, 상관성이 비교적 높고, 통계적으로 유의한 모델로 Hill
equation이 선정되었고, 그 결과는 Fig. 1에 나타내었다. 또 약물용량에 직접적인 결정인자인 체표면적, 체중, 키 중 하 나와 환자의 인구학적 정보, 혈액화학치, CBC 결과값 중 회 귀모형에 포함시켰을 때, 설명력을 높이는 영향인자를 찾기 위해 회귀 모형을 만들었다. 회귀모형은 두 요인을 포함하는 이차함수로 설정하였으며, 상관관계식 분석결과 실제 투여된 약물 용량을 가장 잘 설명하는 관계식으로 R2 값이 상대적 으로 크고, 통계적으로 유의한 관계식을 Table 4에 요약하여 나타내었다. 약물 용량과 관련하여 환자의 체표면적과 혈청 크레아티닌을 영향인자로 하여 설정된 회귀모형이 가장 큰 adjusted R2값을 가졌으며, 그 값은 0.7339 (p<0.0001)로 약 물용량과 체표면적간의 회귀모형을 Hill function으로 적합 시켰을 때 얻어진 R2 값(0.6044)과 adjusted R2 값(0.5997) 보 다 높은 값으로 잘 설명이 되었다고 할 수 있다. 이 곡면의 적합 결과는 Fig. 2에 나타내었다. 마찬가지로 환자의 체표 면적과 AST, ALT를 각각 포함한 회귀모형을 구하였을 때, adjusted R2 값은 각각 0.7085(p<0.0001), 0.7063(p<0.0001) Table 3. Significant correlation coefficients between covariates and dose of vincristine
Parameters Covariates Pearson’s correlation coefficient (p value)
Dose
Height (HT) 0.756 (<0.0001) BSA 0.703 (<0.0001) Weight (WT) 0.624 (<0.0001) serum creatinine (SCR) 0.414 (<0.0001) age 0.406 (<0.0001) dose normalized by
BSA (DOSE/BSA) 0.281 (0.0002) Hemoglobin of day 0
(HB0) 0.195 (0.044)
Dose normalized
with BSA
WT -0.477 (<0.0001) BSA -0.412(<0.0001) Age -0.408 (<0.0001) Total bilirubin (TBR) -0.365 (0.0003)
HT -0.304 (<0.0001) Dose 0.281 (0.0002) SCR -0.193 (0.039) HB0 -0.193 (0.046) Parameters Covariates
Spearman’s correla- tion coefficient
(p value) Dose Age group 0.595 (<0.0001) Dose normalized
with BSA Age group -0.579 (<0.0001)
이었으며, 이들 또한 Hill equation으로 적합된 결과보다 높 은 adjusted R2 값을 가졌다. (Fig. 3, 4)
약물 부작용 파라미터와 각 변수간의 상관관계 분석 약물의 영향으로 감소할 수 있는 백혈구, 절대호중구수, 혈소판수, 헤모글로빈 수치를 약물 투여 전과 투여 후 일정 시간 동안 환자마다 불규칙하게 모니터링한 데이터를 이용하 여 약물 투여 전 백혈구수(WBC0), 절대호중구수(ANC0), 혈 소판수(PLT0), 헤모글로빈 수치(HB0) 및 각 혈구수의 최저치 (WBCnadir, ANCnadir, PLTnadir, HBnadir), 절대감소량(WBCAD, ANCAD, PLTAD, HBAD), 상대감소율(WBCRD, ANCRD, PLTRD, HBRD)을 구하였다. 이렇게 구한 파라미터 중 최저 WBC수
(WBCnadir) 및 절대호중구 감소율(ANCRD)과 각 변수간의 상
관관계를 SPSS로 분석하였을 때, 환자의 약물1회 투여 용량, 체표면적당 약물 1회 투여용량, 환자의 인구학적 정보, 혈액 화학 검사 결과, CBC 결과 등은 연속형 변수이므로 이들간 의 상관성은 Pearson’s correlation coefficient로 구하였고, 환 자의 연령집단, 성별 등의 범주형 변수와 연속형 변수 사이 의 상관성은 Spearman’s correlation coefficient (rho)로 구하 였다. 상관분석의 결과는 Table 5에 나타내었다. 이 중 백혈 구의 최저치와 체표면적당 약물 용량의 상관성은 r=-0.331
(P<0.0001)로 약물용량과의 상관성(r=-0.137, p=0.160, not shown in the table) 보다 높은 값을 가지고 있었다. 또 절대 호중구수의 감소율은 약물용량과 양의 상관관계를 보여 (r=0.352, p<0.0001) 약물 투여용량이 많아질수록 백혈구 및 호중구의 감소경향이 커지는 경향이 나타난다는 것을 알 수 있었다.
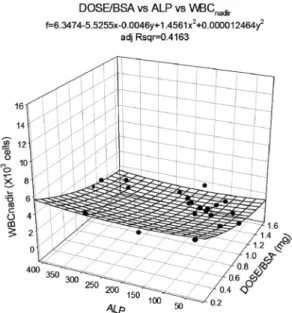
약물 부작용 파라미터와 각 변수간의 관계식 설정 약물 부작용 파라미터인 백혈구 최저치(WBCnadir) 및 절대 호중구 감소율(ANCRD)과 약물 용량, 또는 체표면적당 약물 용량과 음의 또는 양의 상관관계가 있으며, 이를 결정인자로 포함하는 관계식을 설정하고자 하였다. 약물 투여량 이외에 약물 부작용에 영향을 줄 수 있는 요인을 찾고자 환자의 인 구학적 정보, 혈액화학 검사결과 및 CBC 검사결과를 영향인 자로 대입하여 회귀 방정식을 구하였다. 약물의 부작용은 결 정인자와 영향인자를 포함하는 2차함수로 설정하였다. 곡면 적합 결과 실제 체표면적당 약물투여량과 ALP가 약물 부작 용 파라미터인 WBCnadir 값을 가장 잘 설명하였다.
(R2=0.4163, p=0.0094) ALP 이외의 다른 변수를 영향인자로 대입하여 회귀방정식을 적합하였을 때, 비교적 상관성이 높 고, 통계적으로 유의한 회귀방정식을 Table 6에 요약하였고, Fig. 1. Correlation between BSA, height, weight and age with vincristine dose.
Table 4. Polynomial regression models for vincristine dose
Parameters Covariates Regression model Adjusted R2 P value
Vincristine dose
BSA and serum creatinine (SCR)
Does = -0.5444+2.871×BSA+0.0632×SCR-0.8515×
-0.0073×SCR2 0.7339 <0.0001
BSA and AST Does = -0.8530+3.7814×BSA-0.0024×AST
-1.2726×BSA2+0.000020×AST2 0.7085 <0.0001 BSA and ALT Dose = -0.9084+3.7347×BSA+0.0002×ALT-1.2440×BSA2
-0.000040×ALT2 0.7063 <0.0001
BSA and age Dose = -0.7943+3.4190BSA-0.0006×AGE-1.0423×BSA2
-0.000040×AGE2 0.6278 <0.0001
BSA and weight (WT) Dose = -0.4477+2.6209×BSA-0.0022×WT-0.5310×BSA2
-0.0001×WT2 0.6192 <0.0001
BSA and height (HT) Dose = -1.4208+1.511×BSA+0.0207×HT-0.5836×BSA2
-0.000037×HT2 0.6151 <0.0001
BSA and platelet number of day 0 (PLT0)
Dose = -0.5695+3.1797×BSA-0.0008×PLT0
-1.0057×BSA2+0.0000010×PLT2 0.5970 <0.0001 BSA and WBC count of day
0 (WBC0)
Dose = -0.6229+3.1914×BSA-0.016×WBC0
-1.0139×BSA2-0.0000050×WBC02 0.5906 <0.0001 BSA and hemoglobin of day
0 (HB0)
Dose = -0.5352+3.2041×BSA-0.0170×HB0
-1.0124×BSA2+0.00004×HB02 0.5893 <0.0001 BSA and absolute neutrophil
count of day 0 (ANC0)
Dose = -0.6265+3.1185×BSA+0.000025×ANC0
-0.9835×BSA2-0.0000015×ANC02 0.5886 <0.0001
Dose normalized by BSA (DOSE/BSA)
BSA and height (HT) Dose/BSA = -3.2009-
3.9244×BSA+0.0973×HT+0.8872×BSA2-0.0003×HT2 0.4827 <0.0001 Weight (WT) and height
(HT)
Dose/BSA = -1.8830-
0.0305×WT+0.0564×HT+0.0001×WT2-0.0002×H10T2 0.4593 <0.0001 BSA and total bilirubin
(TBR)
Dose/BSA = 0.8507+1.8230×BSA×-0.6365×TBR×
-0.8754×BSA2+0.2463×TBR2 0.4300 <0.0001 BSA and ALT Dose/BSA = 0.5217+2.1060×BSA-0.0034×ALT×
-1.0084×BSA2×-0.000015×ALT2 0.4063 <0.0001 BSA and AST Dose/BSA = 0.5786+2.0339×BSA×-0.0026×AST×
-0.9965×BSA2×-0.000015×AST2 0.4039 <0.0001
Fig. 2. Correlation between serum creatinine, BSA of patient and administered dose of vincristine assessed by using SigmaPlot.
Fig. 3. Correlation between BSA, AST of patient and administered dose of vincristine assessed by using SigmaPlot.
그 중 WBCnadir와 ANCRD를 가장 잘 설명한 2차 회귀모형 의 곡면 적합을 Fig. 5 및 6에 나타내었다.
고 찰
최근 항암요법(anticancer treatment)과 새로운 targeted therapy 연구에 있어서 눈부신 발전에도 불구하고, cytotoxic chemotherapy의 약물 용량 결정은 최소한 수십 년 동안 현재와 같은 방법으로 이루어 질 것으로 사료된다. 1996년 및 1998년에 Gurney가 발표한 논문들과 1998년 Ratain 등이 발표한 논문에서 현재 가장 많이 사용되는 BSA를 이용한
chemotherapy 약물용량 계산법이 정확하지 않다고 알려졌
다.20,21) 이 방법들을 이용하여 약물을 투여할 때 환자간에
서 나타나는 뚜렷한 차이는 고려하지 않기 때문에, 이로 인 해 나타나는 독성 등의 부작용 또한 매우 크고, 예측할 수 없는 개체간의 변이가 관찰된다. 이처럼 BSA에 근거한 용량 결정방법을 이용할 때 나타날 수 있는 문제 중 하나가 underdosing 이다. 과도한 약물의 사용은 약물의 부작용을 일으켜 쉽게 관찰할 수 있지만, 약물의 underdosing은 chemotherapy의 효율성을 떨어뜨려 약물의 효과를 얻을 수 없게 한다. 그러므로 약물의 적절한 용량을 계산하기 위해서 는 약물의 소실에 대한 이해가 무엇보다도 필요하다.22)특이 적으로 cytotoxic drug의 클리어런스는 개체에 따라 4~10배 의 변이가 나타나게 되는데, 이것은 약물소실과정에 있어서 유전적으로 또는 환경적으로 연관된 소실과정의 활성이 서로 다르기 때문이라고 알려져 있다.20) 신약의 경우, phase I의 약물용량은 관례에 따라 결정되었고, 이후 더 널리 쓰이게 된 후에 조정된다. 이 과정의 endpoint는 가장 좋은 항암효 과를 나타내는 약물용량을 규명하기 보다는 약물의 독성을 막는 것에 초점을 맞추어왔다. 그 결과, 유의한 underdosing 은 BSA-dosing 의 부정확성으로 인해 약물 용량결정 시스템 에서 내재적인 문제가 되었다. 이와 같은 underdosing 문제 의 해결을 위해 Gurney는 항암약물요법의 약용량 결정시 하 나의 파라미터(BSA)에만 의존하지 말고, 약물의 소실과 관 련된 다른 파라미터들(혈청크레아티닌, 사구체 여과속도, 빌 리루빈, transaminase, 또는 genotype 등)을 이용하여 약물용 량 결정에 반영해야 한다고 주장하였다.23) 또 cytotoxic drug 의 소실을 저하시키거나 증가시키는 다른 약물을 확인할 필 요가 있으며, 약물의 분포에 영향을 줄 수 있는 요인들(혈청 알부민, 복수의 여부, cachexia, 비만도, 장기들의 기능상태 등)과 약물이 정상조직에 미치는 영향도 확인하여야 한다고 말하고 있다. 또 골수억제효과 등의 biological endpoint를 측 정하여 약물용량이 적절히 설정되었는지 확인해야 한다고 주 장하고 있다. 항암약물의 경우에는 정기적으로 약물의 혈중 농도를 측정하고 있지 않다. 이론적으로 TDM 대상 약물이 갖추어야 할 조건은 약물의 개체간, 개체내의 약동학적 변동 이 크고, 약물의 농도와 약리효과 간의 뚜렷한 관계가 존재 하며, 약물의 치료역이 좁고, 생체액 내에서의 약물 정량이 가능해야 한다는 것 등이다. 항암제의 경우, 약물의 개체간 약동학적 변동이 크고, 독성과 전신노출과의 뚜렷한 연관성 이 있어 일부 항암약물은 TDM이 성공적으로 적용되어 항암 치료를 적정화할 수 있다고 알려져 있다. 이 약물들 이외에 다른 약물들에도 항암치료요법의 TDM을 시행한다면 개별화 된 항암치료뿐 아니라 효과를 개선시키고, 부작용을 줄이는 등의 부가적인 이득도 얻을 수 있을 것으로 생각된다. 그러 나 아직까지는 항암제에 TDM 적용이 어려운데, 그 이유로 첫 번째는 대부분의 항 종양 약물에 대해서 얻을 수 있는 약리학적, 약동학적인 정보가 부족하다는 것이며, 두 번째 Fig. 4. Correlation between BSA, ALT of patient and
administered dose of vincristine assessed by using SigmaPlot.
Table 5. Significant correlation coefficients between covariates and adverse effect parameters of vincristine
Parameters Covariates Pearson’s correlation coefficient (p value)
WBCnadir
Age 0.319 (0.001) Weight (WT) 0.245 (0.011) BSA 0.199 (0.040) Dose normalized with
BSA (DOSE/BSA) -0.331 (<0.0001) ANCRD
Dose 0.352 (<0.0001) Serum creatinine
(SCR) 0.231 (0.038) Parameters Covariates
Spearman’s correlation coefficient
(p value)
WBCnadir Age group 0.237 (0.014)
이유는 약물의 작용지점이 종종 혈관계에서 멀리 떨어져 있 고 더군다나 고형암의 경우 자체의 특별한 혈액공급체계를 가지고 있기 때문에, TDM으로 측정 가능한 약물의 혈중농 도로는 표적기관에서의 약물의 양을 간접적으로 측정할 수 밖에 없다는 점이다. 결국 약물의 혈중농도와 표적이 되는 암 발병지점에서의 약물농도가 일치하지 않을 수도 있다는 것이다. 세 번째는 약물의 치료효과를 혈중농도와 연관시키
기에는 효과가 너무 느리게 관찰되며, 약리학적 효과로 정의 되는 완치의 경우는 더욱 늦게 나타난다는 문제점이 있다.
더군다나 암이 완전이 치료되는지를 평가하는 follow-up study는 최소한 5년간 암의 재발 및 전이를 관찰하여야 하기 때문에 완벽한 평가는 어려우며, 매우 많은 시간이 필요하고 복잡한 과정을 고려하여야 한다. 넷째로 항암제의 경우, 일 반적으로 환자에 투여할 때 단독투여보다는 다른 약제들과 Table 6. Polynomial regression models for adverse effect parameters of vincristine
Parameters Covariates Regression model Adjusted R2 P value
WBCnadir
BSA-normalized Dose (DOSE/
BSA) and ALP
WBCnadir= 6.3474-5.2526×
-0.0046×ALP+1.4561× - +0.000012×ALP2 0.4163 0.0094
BSA-normalized Dose (DOSE/
BSA) and total protein (TPRO)
WBCnadir= 7.4413-5.9210×
-0.5002×TPRO+1.6800× +0.0473×TPRO2 0.4069 0.0106
BSA-normalized Dose (DOSE/
BSA) and BUN
WBCnadir= 6.2807-5.0639×
-0.0468×BUN+1.1543× +0.0014×BUN2 0.4029 0.0112
BSA-normalized Dose (DOSE/
BSA) and total bilirubin (TBR)
WBCnadir= 5.4980-7.9779×
-0.1158×TBR+3.1993× +0.0807×TBR2 0.3176 <0.0001
Dose and height WBCnadir= -8.9861-1.8924×DOSE+0.1728×HT
-0.3115×DOSE2-0.0005×HT2 0.2736 <0.0001
BSA-normalized Dose (DOSE/
BSA) and AST
WBCnadir= 5.46367-7.3329×
-0.0114×AST+2.8317× +0.0001×AST2 0.2442 <0.0001
BSA-normalized Dose (DOSE/
BSA) and ALT
WBCnadir= 5.3212-7.2508×
-0.0001×ALT+2.7963× −0.0000017×ALT2 0.2389 <0.0001
Dose and weight WBCnadir= -8.9444+1.8910×DOSE+0.1162×WT
-1.6744×DOSE2-0.0005×WT2 0.2033 <0.0001 Dose and BSA WBCnadir= -2.2925+0.7318×DOSE+7.0381×BSA
-1.3330×DOSE2-1.5655×WT2 0.2009 <0.0001
ANCRD
Dose and ANC0 ANCRD= 0.4373-0.0879×DOSE+0.0001×ANC0
+0.1080×DOSE2-0.000000011×ANC02 0.2123 <0.0001
BSA-normalized Dose (DOSE/
BSA) and ANC0
ANCRD= -0.0556+1.3610×
+0.0001×ANC0-0.6263× −0.000000010×ANC02 0.2113 <0.0001
Dose and WBC0 ANCRD= 0.3511+0.0401×DOSE+0.0068×WBC0
+0.0769×DOSE2-0.000022×WBC02 0.2058 <0.0001
BSA-normalized Dose (DOSE/
BSA) and WBC0
ANCRD= -0.1738+1.6263×
+0.0069×WBC0-0.7352× +0.000023×WBC02 0.2032 <0.0001 DOSEBSA
--- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
DOSEBSA --- DOSEBSA
---
⎝ ⎠
⎛ ⎞2
병용하여 투여하므로, 약물 단독의 용량-효과 상관성을 평가 하기 어렵고, 또 약제들에 의한 독성도 복잡하게 나타나기 때문에 평가가 어렵다. 다섯째로 종양질환은 질환 자체가 약 물의 농도-효과 관계에 영향을 미칠 수 있는 내재적 특성을 가진 이종 질환(heterogeneous disease)이기 때문에 혈액공급 과 세포수준의 특성에서 이질성을 보인다는 점이다. 아주 일 부의 약물들만 효과와 전신노출의 연관성이 알려져 있으며, 그 예로 methotrexate와 ALL, carboplatin과 난소암, 5-FU와 metastasis colorectal 또는 head and neck cancer 간의 치료 의 연관성이 알려져 있다.24)
이번 연구대상 약물인 vincristine은 환자의 체표면적(Body surface area, BSA)에 근거하여 약용량을 결정한다. 이와 같 은 BSA-based dosing decision은 다른 항암제의 용량결정에 서도 자주 사용되는 방법으로, 항암제 개발과정에서 전임상 동물 독성데이터로부터 임상 1상 시험에서의 안전한 개시 용량을 예측하기 위한 방법으로 소개되었다.25) 1958년 Pinkel이 처음으로 최대내성용량(maximum tolerated dose (MTD))을 mg/m2으로 표현하여 제안하였으며, 이 값은 다른 종들 사이에서도 비슷한 값을 가진다. 이 종설에서는 동물과 인 간대상 실험에서 mechlorethamine, methotrexate, 6- mercaptopurine, actinomycin D와 triethylenethio-phosphoramide (tiothepa)의 MTD가 mg/m2으로 표현될 때, 거의 유사한 값을 가진다는 것을 알아냈다.26) 실제 인간에서의 18가지 항종양 약 물의 MTD와 전임상 동물실험으로부터 예측한 MTD를 비교 하였을 때, 동물데이터가 거의 정확하게 인간에서의 MTD를 예측한다는 연구논문이 1966년 Freireich에 의해 발표되었다.27) 그러나 많은 연구자들이 초기 임상 1상에서의 개시 용량을 예측하기 위해 BSA로 표준화시킨 용량결정방법을 제안하고 있지만, 그 중 어떤 논문에서도 단계적인 용량 확대 전략에 있어서는 BSA 에 근거한 약용량의 사용을 권장하지는 않는 다. BSA를 계산하기 위한 식들은 키와 몸무게라는 두 가지 의 정확히 측정되는 변수로부터 결정되나 이 식은 한번도 충분히 실증된 적이 없다.28) 또, BSA는 약물의 약물동태를 결정하는 장기 기능과 거의 관련이 없으며, 장기 기능과의 관련성에 있어서 BSA 보다는 lean body weight와 같은 다 른 측정치들이 더 우세한 것으로 알려져 있다. 즉, 체표면적 에 근거한 약물용량 결정방법은 항암제 소실의 복잡한 과정 을 고려하고 있지 않으며, 이것은 효과에 있어서 예측할 수 없는 변이를 가져올 수 있다. 과용량은 쉽게 인식되어 용량 조절이 가능하지만, 측정되지 않는 underdosing은 발견 및 해결이 어려울 뿐만 아니라, 표준 약물투여 계획에 의해 약 물을 투여 받는 30% 또는 그 이상의 환자에서 일어날 수 있다고 생각된다. 부주의에 의해 underdose된 환자들은 약물 의 항종양효과가 유의하게 나타나지 않으므로 위험에 노출될 수 있다. 이미 문헌에 보고된 논문의 데이터들을 살펴보았을 때, unrecognized underdosing으로 인하여 유방암에 대한 보 조적 항암치료를 받은 여성 환자들의 생존률이 20% 가까이 감소한 것으로 추정되었다. 문제는 대부분의 약물에서 BSA 와 약물동태와의 관련성은 연구되어 있지 않고, taxane 등의 일부 약물에서만 연구되어 있다는 점이다. 더 합리적인 약물 개발 시작단계의 연구에서는 약물의 약동학 및 약력학에서 체표면적은 유의한 결정요소가 아닌 것으로 가정하고, 대신 초기의 연구에서 fixed dosing을 사용하거나 사구체 여과율 (gomerular filtration rate, GFR), 간 기능 검사, albumin, 나 이 등의 다른 모든 covariate 처럼 체표면적 또한 하나의 covariate으로서 영향력을 시험하도록 하고 있다. 따라서 이 번 연구에서는 실제로 환자에서 투여된 약물용량과 다른 인 Fig. 5. Correlation between BSA-normalized dose of vincristine
(DOSE/BSA), ALP and WBCnardir of patient assessed by using SigmaPlot.
Fig. 6. Correlation between ANC0, ANCRD of patient and administered dose of vincristine assessed by using SigmaPlot
구학적 정보 및 약물의 소실과 관련 있을 것으로 생각되는 요인들간의 상관성을 보고, 약물의 1회 투여 용량과 환자의 체표면적, 체중, 또는 키를 결정인자로 하고, 그 외에 약물의 용량에 영향을 줄 수 있는 영향요인을 회귀모형으로 설명하 고자 하였다. 약물용량과 상관성이 높은 인자로 환자의 키, 체표면적, 체중 등이 있었으며, 비교적 낮은 상관성을 가지 지만 혈청 크레아티닌, 나이 등도 약물용량과 상관성을 보였 다. 약물용량 결정에 영향을 주는 인자를 포함하는 회귀모형 을 설정하였을 때, 환자의 체표면적과 혈청 크레아티닌을 영 향인자로 한 회귀모형이 가장 설명력이 높았다. 혈청 크레아 티닌 외에도 AST, ALT 등이 adjusted R2 값이 0.7 이상으로 좋은 설명력을 보였지만, 전체 환자의 수가 175명으로 비교 적 작은 값이고, AST, ALT의 경우 일부 환자에서만 얻어진 데이터였기 때문에 (n=93) 임상에 적용하기 위해서는 더 많 은 데이터를 수집하여 이번 연구에서 얻어진 회귀모형을 검 증하는 것도 의미가 있을 것으로 생각된다.
이번 연구에서 약물의 용량은 전적으로 체표면적에 근거하 여 정했으며, 그 부작용은 혈구수의 감소를 일정 시간 동안 관찰한 결과로 판단하였다. 보통의 임상 상황에서 vincristine 은 TDM 대상약물이 아니며, 약물의 투여 또한 단독으로 이 루어지기보다는 복합화학요법으로 투여되기 때문에 약물의 혈중농도와 단독으로 나타나는 약물의 약리효과를 직접 얻을 수 없었다. 또 다른 연구논문에서 vincristine 투여 시 혈소판 수 증가가 보고되었으나 본 연구에서는 여러 가지 항암약물 이 포함된 chemoregimen을 투약하였을 때 chemoregimen에 포함된 전체 항암약제들이 주로 혈소판 및 혈구수 감소 등 의 부작용을 나타낼 것으로 생각하여 혈구감소치를 outcome factor로 설정하였다. 최종적으로 약물의 효과를 평가하기 위 해서는 약물투여를 통하여 암이 치료되고, 향후 5년 이후에 도 재발되지 않는지에 대한 follow-up 연구가 필요했지만, 우리가 가지고 있는 데이터에서는 최종적인 clinical outcome 을 얻을 수 없었다. 그래서 단시간 내에 측정 가능한 부작용 지표로서 후향적 자료조사를 통하여 WBC의 최저치와 ANC 의 상대감소율 값으로 약물의 효과를 갈음하고자 하였다. 앞 에서 언급한 것처럼 항암약물의 개체 내 약동학적, 또는 약 리학적 효과에서의 변이는 우리가 관찰한 독성 파라미터인 WBC의 최저치나 ANC의 상대감소율과 체표면적당 약물 용 량이 유의한 상관관계를 보였고, 또 상관성 조사 뿐 아니라 약물 부작용으로 나타날 수 있는 WBC의 최저치와 ANC의 상대감소율을 골수억제 효과의 지표로 하고, 약물용량 및 체 표면적당 약물 투여용량을 결정인자로, 그 외 다른 파라미터 들을 영향요인으로 가정하여 골수억제효과 지표를 설명할 수 있는 회귀모형을 설정하고 영향력 있는 영향인자를 찾은 것 은 의미가 있다고 하겠다.
결 론
본 논문에서는 vincristine 투여 후 부작용으로 나타나는 혈구수 및 혈소판, 헤모글로빈의 감소에 대한 연관성 있는 요인을 찾고 이들로부터 모델을 설정하고, 각 부작용 파라미 터와 이에 영향을 주는 요인들 간의 회귀모형을 설정하고자 하였으며 그 결과는 다음과 같았다.
Vincristine의 실제 약물 투여 용량은 환자의 키와 가장 상 관성이 높았으며 (r=0.756, p<0.0001), 투여용량과 체표면적 의 상관성은 0.703 (p<0.0001)으로 환자의 키보다는 상관성 이 낮았다. 약물 투여량을 종속변수로, 환자의 체표면적과 혈청 크레아티닌을 독립변수로 하여 설정된 회귀 모형은 아 래 식과 같았으며(adjusted R2=0.7339, p<0.0001), 이는 약물 투여량과 체표면적을 Hill equation으로 적합시킨 모형 (adjusted R2=0.5997, p<0.0001)보다 더 높은 설명력을 가지 고 있었다.
약물 투여 용량 및 체표면적당 약물 용량은 약물 부작용으 로 나타나는 백혈구 및 절대호중구수 감소와 양의 상관관계 를 가지고 있었다. 가장 설명력이 좋은 모형은 체표면적당 약 물용량과 ALP를 독립변수로 하는 2차함수 모형으로 백혈구 의 최저치(WBCnadir)를 잘 설명하였다. (adjusted R2=0.4163, p=0.0094)
비록 후향적 연구방법을 통하여 얻은 자료로 약물동태학/
약물동력학적 자료를 충분히 얻기 힘들었고, 자료의 양도 제 한적이었지만, 체표면적 이외의 약물 용량의 영향인자 및 부 작용 파라미터와 이의 영향 요인들 간의 회귀모형의 설정만 으로도 충분한 의미가 있을 것으로 생각된다.
감사의 글
본 연구는 2010년도 식품의약품안전청 용역연구개발사업 의 연구비 지원(10172의약안226)에 의해 수행되었으며 이에 감사드립니다.
참고논문
1. Costa G, Hreshchyshyn, Holland J. Initial studies with vincristine. Cancer Chemother Rep 1962; 24: 39-43.
2. Johnson I, Armstrong J, Gorman M. The vinca alkaloids:
a new class of oncolytic agents. Cancer Res 1963; 23:
1390-427.
3. B-M Frost, G Lönnerholm, P Koopmans, et al., DRA Uges and SSN de Graaf. Vincristine in childhood leukemia: no pharmacokinetic rationale for dose reduction in adolescents. Acta Paediatr 2003: 92: 551-557.
4. 이성문, 함순식, 전인상. 급성 림프구성 백혈병의 항암 유 지요법 중 vincristine과 관련된 혈소판수의 변화, Korean Journal of Pediatrics Vol. 49. No.2.2006 :181-186.
5. 강형진, 신희영, 안효섭. 소아 급성 림프모구 백혈병: 과거, 현재, 미래 Korean Journal of Pediatrics Vol. 50.
No.7.2007 : 601-605.
6. Rahmani R, Zhou XJ. Pharmacokinetics and metabolism of vinca alkaloids. Cancer Surv 1993; 17: 269-81.
7. Owellen RJ, Hartke CA, Dickerson RM, et al., Inhibition of tubulin-microtubule polymerization by drugs of the vinca alkaloid class. Cancer Res 1976; 36: 1499-502.
8. Rowinsky EK, Donehower RC. Antimicrotubule agents. In : Chabner BA, Longo DL, editors. Cancer chemotherapy and biotherapy principles and practice. 2nd ed. Philadelphia : Lippincott-Raven Co, 1996: 26-96.
9. Giannakakou P, Sackett DL, Ward Y, et al., p53 is associated with cellular microtubules and is transported to the nucleus by dynein. Nat Cell Biol 2000; 2:709-17.
10. Allen JC .The effects of cancer theraphy on the nervous system.J Pediatr 1978; 93: 903-909.
11. Legha SS. Vincristine neurotoxity.Pathophysiology and managemant. Med Toxicol 1986; 1: 421-427.
12. Hussain M, Wozniak AJ, Edelstein MB. Neurotoxicity of antineoplatic agents.Crit Rev Oncol Hematol 1993; 14: 61- 75.
13. Gidding CE, Kellie SJ, Kamps WA, et al., Vincristine revisited. Crit Rev Oncol Hematol 1999; 29: 267-287.
14. Harris RA, Penington DG. The effects of low-dose vincristine on megakaryocyte colony-forming cells and megakaryocyte ploidy. Br J Haematol 1984; 57: 37-48.
15. Rak K. Effect of vincristine on platelet production in mice.
Br J Haematol 1972; 22: 617-24.
16. Kelton JG, McDonald JW D, Barr RM, et al., The reversible binding of vinblastine to platelets: implications for therapy. Blood 1981; 57: 431-8.
17. http://www.druginfo.co.kr.
18. Donita L. Frazier and G. Sylvester Price. Use of body surface Area to Calculate Chemotherapeutic Drug Dose in Dogs : II. Limatations Imposed by Pharmacokinetic factors.
1998; 12: 272-278.
19. John J. Reilly, Paul Workman. Normalisation of anti- cancer drug dosage using body weight and surface area : is it worthwhile? 1993; 32: 411-418.
20. Gurney H .Dose calculation of anticancer drugs:a review of the current practice and introduction of an alternative.
Journal of Clinical Oncology, vol 14. 1996: 2590-2611.
21. Ratain MJ. Body surface area as a basis for dosing of anticancer agents:science, myth,or habit?. Journal of Clinical Oncology ,vol 16,no7, 1998: 2297-2298.
22. Gurney H. How to calculate the dose of chemotherapy.
Brithsh Journal of cancer, 2002: 1297-1302
23. Bo Gao, Heinz-Jose Klumpen, Gurney H. Dose calculation of anticancer drugs. informa healthcare vol 4, 2008: 1307- 1319.
24. Lamya Alnaim, Therapeutic drug monitoring of cancer chemotherapy.Jounnal of Oncology Pharmacy Practice vol 14 no 4 2007: 207-221.
25. Sawyer M, Ratain Mark J. Body surface area as a determination of pharmacokinetics and drug dosing.
Investigational new drugs 19 2001: 171-177.
26. D.Pinkel. The use of body surface area as a criterion of Drug dosage in Cancer Chemotherapy. Cancer Res. 1958 Aug;18(7): 853-6.
27. Freireich EJ, Gehan EA, Rall DP, et al., Quantitative comparison of toxicity of anticancer agents in mouse, rat, hamster, dog, monkey, and man. Cancer Chemother Rep.
1966 May; 50(4): 219-44.
28. Sawyer M, Ratain Mark J. Body surface area as a determination of pharmacokinetics and drug dosing.
Investigational new drugs 19 2001: 171-177.