31
유산균의 항산화 활성 비교
조윤희․오세종*
전남대학교 동물자원학부
Comparative Study of Lactic Acid Bacteria for Antioxidative Activities
Yoonhee Cho and Sejong Oh*
Division of Animal Science, Chonnam National University, Gwangju 500-757, Korea
ABSTRACT
Lactic acid bacteria (LAB) are typical probiotic microbes which are used in various industries including fermented foods, feed additives, and pharmaceuticals. The purpose of this study was to compare the ability of antioxidative activities of 23 strains of LAB isolated from cheese, kimchi, yogurt, and etc. LAB were tested for antioxidative activities such as 2,2'- azino-bis(3-ethyl-benzothiazoline-6-sulphonic acid) (ABTS) radical scavenging abilities and superoxide dismutase (SOD)-like ability. Antioxidative activities were examined different media such as MRS, M17, and 10% skim milk. Culture supernatant in M17 medium showed a higher antioxidative activity than these in MRS and 10% skim milk. Comparison of ABTS radical scavenging ability by the LAB showed a wide variation with a range from 9∼93% and SOD-like ability of LAB ranged from 70∼78%, respectively. Therfore, some of LAB can play important roles in the protection for oxidative stress and CPP-producing activity of LAB may be a promising material for application in the dairy industry.
Keywords : lactic acid bacteria, antioxidant, ABTS, SOD
* Corresponding author: Sejong Oh, Division of Animal Science, Chonnam National University, Gwangju 500-757, Korea. Tel: +82-62-530-2116, Fax: +82-62-530-2129, E-mail: soh@chonnam.ac.kr
서 론
유산균은probiotics로 이용되는 대표적인 미생물로 김치, 유제품, 양조식품 등의 발효식품이나 제약, 사료산업에서 광범위하게 사용되어져 왔으며, 설사 예방, 장내 정상 세균 총의 유지, 면역 증강 효과, 항암 효과, 혈중 콜레스테롤의 저하 등의 효능이 보고되었다(McFarland, 2000; Andersson et
al., 2001; Salminen, 2001). 또한, 유산균은 활성산소로부터
자신을 보호할 수 있는 항산화 활성을 가지고 있다고 보고 되었는데(Sanders et al., 1995; Ahotupa et al., 1996; Korpelaet al., 1997), 활성산소는 산소와는 다르게 짝을 이루지 못한
전자를 가지고 있어 불안정한 상태에 있는 산소로 인체 내 에서 가장 흔하게 생기는 라디칼이다. 활성산소는 체내에축적될 경우 암, 간경변증, 관절염 등 각종 질병을 초래하게 되어 문제가 되고 있다(Halliwell & Gutteridge, 1984). 이를 방지하기 위하여 수많은 항산화제에 대한 연구가 이루어져 왔다. 항산화물이란 자유라디칼의 작용을 방지하는 화합물 로써 활성 산소에 의한 각종 질병을 예방할 수 있다(Halliwell, 1991; Aruoma, 1996). 유산균의 항산화 효과는 주로 금속 이 온chelating, 활성산소종의 소거, 그리고 환원작용 등이 복 합적으로 관여하여 나타나는 것으로 알려져 있다(Lin &
Yen, 1999). 이미 Lactobacillus sp. SBT 2028(Kaizu et al., 1993)과 L. fermentum strain ME-3(Kullisaar et al., 2002) 등 여러 유산균의 높은 항산화 효과가 보고되었다.
1969년 McCord와 Fridovich가 활성산소를 제거하는 효소 인SOD를 발견하면서 항산화제에 대한 연구가 시작되었다.
생물체는 산화촉진물질(prooxidant)과 산화억제물질(antioxidant) 이 균형을 이루고 있으나, 여러 가지 요인들에 의해 이러한 균형상태가 무너지면서 활성산소가 발생하여 산화적 스트
레스를 일으키게 된다. 산화적 스트레스의 직접적인 원인이 되는 활성산소종(reactive oxygen species, ROS)은 자유라디 칼 중에서 가장 많은 부분을 차지하며, 비공유 전자를 가지 고 있어서 불안정하고, 인체 내에 축적되면 노화, 뇌졸중, 암, 간경변증, 관절염, 아테롬성 동맥경화증 등 각종 질병을 일으키게 된다(Ito et al., 1983; Halliwell & Gutteridge, 1984;
Lee, 1997). 항산화제에 대한 연구는 주로 식품첨가물로서 연구되어져 왔으며, 최근에는 질병 예방 및 치료제로서의 항산화제에 대한 연구도 진행되고 있다. 그 중 하나가 유산 균으로서 유산균의 항미생물 효과가 유산균에 의해 생성되 는 활성산소에 의한 것이라고 밝혀지면서 유산균은 식품 보 존에 중요한 역할을 해왔다(Dahiya & Speck, 1968).
유산균의 항산화 효과는 SOD나 세포 내 Mn2+의 농도에 대해 이루어져왔다(Archibald & Fridovich, 1981). 일반적으 로 항산화 활성의 측정은 지질의 과산화 억제가 많이 사용 되고 있다. Vitamin E가 부족한 쥐에게 유산균을 섭취하게 하여 항산화 효과를 증명하였고(Kaizu et al., 1993), Ahotupa 등(1996)은 Lactobacillus GG가 지질산화를 억제하였다고 보 고하였으며, Lin과 Chang(2000)은 B. longum, L. acidophilus 는 28∼48%의 지질과산화 억제 효과를 나타내었다고 보고 하였다. 또한, 건강한 사람에게 L. fermentum을 넣은 발효우 유를 섭취하게 했더니 항산화 효과가 나타났다고 보고되는 (Kullisaar et al., 2003) 등 수많은 연구를 통해서 유산균의 항산화 활성이 입증되었다.
재료 및 방법
1. 유산균의 분리 및 동정
1) 유산균의 분리
본 실험에서 사용한23종의 유산균은 김치, 유아 분변, 유 제품 등에서 분리하여MRS agar(Difco, USA)에 도말평판법 으로 도말하고37℃에서 18시간 배양하였다. 배양 후 노란 색 집락을 띄는 균주들을 선택하여 순수 분리하였다.
균주의 보존을 위하여 모든 유산균은 MRS broth에 2차 계대 배양한 후, 3,000 rpm에서 15분간 원심분리하여 세포 침 전물을 얻었으며, 여기에 10% 탈지분유, 0.5% dextrose(Difco), 0.25% yeast extract(Difco)가 각각 함유된 배지를 제조하여 혼합하였다. 이것을 동결 건조시켜 -70℃에 보관하였다.
2) 당 발효성 평가
유산균의 당 발효성 실험을 하기 위하여API 50 CH kit(Bio- merieux, France)를 사용하였다. 유산균 23종을 MRS broth에 37℃, 18시간 배양한 다음 MRS agar에 도말하였다. 동일한
집락을 여러 개 취해서bromo cresol purple 배지에 취한 후, 2 McFarland로 탁도를 맞춘 다음 접종하여 37℃에서 48시간 동안 배양하여 색을 판정하였다.
3) 16S rDNA를 이용한 유산균의 동정
유산균을MRS broth에 접종한 다음 37℃에서 18시간 2차 계대 배양하여 배양액2 mL를 8,000 rpm에서 1분 동안 원심분 리 하였다. 원심분리하여 얻은 세포 침전물은 0.85% NaCl로 2회 세척하였다. 세척 후, lysozyme(10 mg/mL) 0.5 mL를 첨 가하여37℃에서 1시간 동안 처리하였다. Protease K(10 mg/
mL) 20 μL와 10% sodium dodecyl sulfate(SDS) 25 μL를 첨 가한 후, 60℃에서 30분 처리하였다. 동량의 Phenol-Chloroform- Isoamyl alcohol(25:24:1)을 첨가하여 현탁한 후, 14,000 rpm
으로5분 동안 4℃에서 원심분리하여 상층액만 취한 다음
다시 반복하였다. 상층액량의 1/2 volume의 3 M ammonium acetate(pH 4.8)와 2 volume의 100% alcohol를 첨가하고 -20℃
에서1시간 정치하였다. 14,000 rpm으로 5분 동안 4℃에서 원심분리하여 세포 침전물을 확인하고, 상등액을 완전히 제 거한 후에 70% ethanol 1 mL를 넣고 다시 14,000 rpm으로 5분 동안 4℃에서 원심분리하였다. 상등액 제거 후, 증류수 100 μL를 넣고 잘 녹여준 다음, RNase A(10 mg/mL) 1 μL 를 첨가하고 37℃에서 1시간 처리하였다.
Chromosomal DNA를 분리한 후, 16S rDNA를 증폭하기 위해 forward primer(341f): (5'-CGC CCG CCG CGC CCC GCG CCC GGC CCG CCG CCC CCG CCC CCC TAC GGG AGG CGA CAG-3')와 reverse primer(534r): (5'-ATT ACC GCG GCT GCT GG-3')를 사용하였다. PCR premix(Bioneer, Cat No. K-2012)에 증류수 17 μL, forward primer 1 μL, reverse primer 1 μL, DNA 1 μL를 첨가하여 혼합한 후 PCR을 수 행하였다. PCR 조건은 94℃에서 5분간 처리 후, 94℃에서 1 분, 62℃에서 40초, 72℃에서 40초로 30 cycles을 반복하였으 며, 72℃에서 40초로 반응을 종료하였다. PCR 반응산물을 0.8% agarose gel로 전기영동을 실시하여 확인하였으며, PCR product purification kit(Intron, Korea)를 사용하여 정제하였 다. DNA 염기서열은 ABI 3730xl 자동 염기서열 분석기를 이용하였으며, 분석결과는 NCBI blast(www.ncbi.nih.gov/blast/) 의 database를 이용하여 조사하였다.
2. 유산균의 항산화 활성 평가
1) 유산균의 준비
항산화 활성을 측정하기 위해23종의 유산균을 MRS 배지, M17 배지, 10% 탈지분유에 각각 유산균을 2차 계대 배양하여 3,000 rpm에서 15분간 원심분리 후, 상등액으로 실험하였다.
2) 유산균의 단백질 정량
유산균의 단백질 정량은 Bradford 방법을 사용하였으며, bovine serum albumin(BSA; Bio-Rad, USA)을 표준물질로 하 여standard curve를 작성하였다. Protein assay(Bio-Rad)는 증 류수로5배 희석해서 사용하였고, 각 유산균의 상등액과 희 석한protein assay의 비율을 1:20으로 혼합하여 5분 후에 흡 광도 595 nm에서 측정하였다.
3) ABTS 라디칼 소거능 측정
ABTS 라디칼 소거능은 Roberta 등(1999) 및 Ken과 Ann (2001)의 방법에 준하여 실험하였다. ABTS 라디칼을 조제 하기 위해7.01 mM ABTS 15 mL, 39.2 mM potassium persulfate 1 mL를 혼합하여 상온에서 12~16시간 방치한 후 사용하였 다. 5 mM phosphate buffered saline(PBS, pH 7.4)으로 ABTS 라디칼을 희석하여 734 nm에서 흡광도가 0.70(±0.02)이 측 정되도록 조정하였다. 희석한 ABTS 라디칼 1 mL와 유산균 상등액 10 μL를 혼합하여 6분 후에 734 nm에서 흡광도를 측정하였다. 아래와 같은 식으로 ABTS 라디칼 소거능을 측 정하였으며, 대조구로는 증류수를 사용하였다.
ABTS 라디칼 소거능(%)=(1-시료의 흡광도/대조구 흡광도)×100
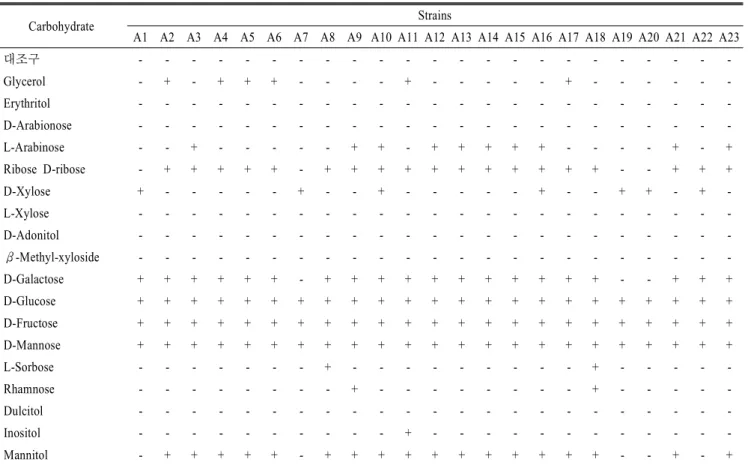
Table 1. Carbohydrate utilization pattern of the tested lactic acid bacteria
Carbohydrate Strains
A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 A12 A13 A14 A15 A16 A17 A18 A19 A20 A21 A22 A23
대조구 - - - - - - - - - - - - - - - - - - - - - - -
Glycerol - + - + + + - - - - + - - - - - + - - - - - -
Erythritol - - - - - - - - - - - - - - - - - - - - - - -
D-Arabionose - - - - - - - - - - - - - - - - - - - - - - -
L-Arabinose - - + - - - - - + + - + + + + + - - - - + - +
Ribose D-ribose - + + + + + - + + + + + + + + + + + - - + + +
D-Xylose + - - - - - + - - + - - - - - + - - + + - + -
L-Xylose - - - - - - - - - - - - - - - - - - - - - - -
D-Adonitol - - - - - - - - - - - - - - - - - - - - - - -
β -Methyl-xyloside - - - - - - - - - - - - - - - - - - - - - - -
D-Galactose + + + + + + - + + + + + + + + + + + - - + + +
D-Glucose + + + + + + + + + + + + + + + + + + + + + + +
D-Fructose + + + + + + + + + + + + + + + + + + + + + + +
D-Mannose + + + + + + + + + + + + + + + + + + + + + + +
L-Sorbose - - - - - - - + - - - - - - - - - + - - - - -
Rhamnose - - - - - - - - + - - - - - - - - + - - - - -
Dulcitol - - - - - - - - - - - - - - - - - - - - - - -
Inositol - - - - - - - - - - + - - - - - - - - - - - -
Mannitol - + + + + + - + + + + + + + + + + + - - + - +
4) SOD 유사 활성 측정
SOD 유사 활성 측정은 Marklund 등(1974)의 방법을 참조 하여 측정하였다. Buffer는 50 mM tris buffer(pH 8.5)에 10 mM EDTA를 녹여 사용하였으며, 기질은 7.2 mM pyrogaliol 을 사용하였다. 유산균 상등액 0.2 mL에 buffer 3 mL와 기질 0.2 mL를 혼합하고, 10분간 반응한 후에 1 N HCl 0.2 mL를 첨가하여 반응을 정지시켰다. 420 nm에서 흡광도를 측정하 였으며, 다음과 같은 식으로 SOD 유사 활성을 측정하였다.
SOD 유사 활성(%)=(1-시료의 흡광도/대조구 흡광도)×100
결과 및 고찰
1. 유산균의 당 발효성
유산균의 신속한 동정 방법인API 50 CH kit(Biomerieux, France)를 이용하여 당 발효성을 분석하였다. API 방법은 BCP 배지의 고유색인 보라색이 유산균과 당이 반응하여 산을 생 성하면서 노란색으로 탈색되는 점을 평가하여 동정하는 방법 이다. 유산균 23종에 대한 49종 탄수화물의 발효성을 분석하 였고, 이 결과는 동정용 프로그램인 http://apiweb.biomerieux.com 에 접속하여 해석하였으며, 그 결과를 Table 1에 나타내었다.
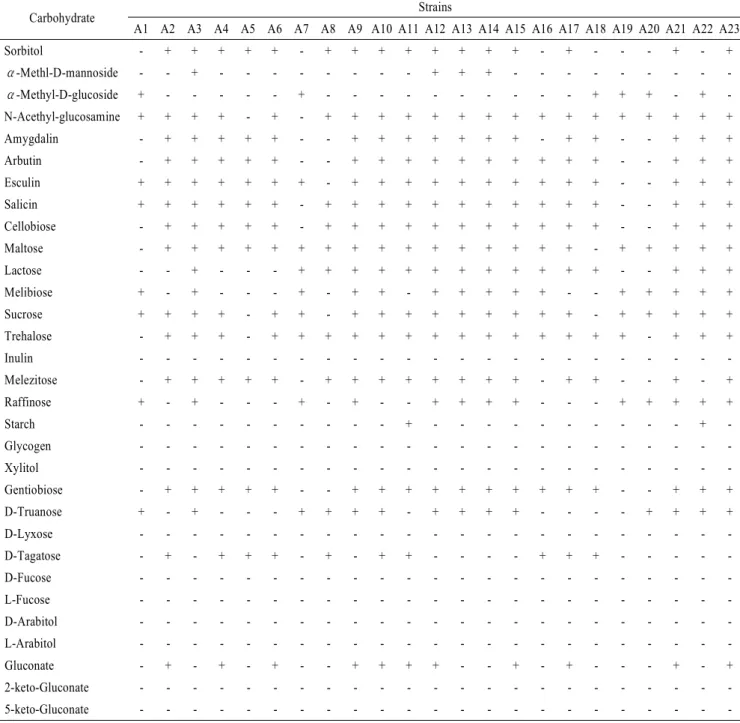
Table 1. Continued
Carbohydrate Strains
A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 A12 A13 A14 A15 A16 A17 A18 A19 A20 A21 A22 A23
Sorbitol - + + + + + - + + + + + + + + - + - - - + - +
α -Methl-D-mannoside - - + - - - - - - - - + + + - - - - - - - - -
α -Methyl-D-glucoside + - - - - - + - - - - - - - - - - + + + - + -
N-Acethyl-glucosamine + + + + - + - + + + + + + + + + + + + + + + +
Amygdalin - + + + + + - - + + + + + + + - + + - - + + +
Arbutin - + + + + + - - + + + + + + + + + + - - + + +
Esculin + + + + + + + - + + + + + + + + + + - - + + +
Salicin + + + + + + - + + + + + + + + + + + - - + + +
Cellobiose - + + + + + - + + + + + + + + + + + - - + + +
Maltose - + + + + + + + + + + + + + + + + - + + + + +
Lactose - - + - - - + + + + + + + + + + + + - - + + +
Melibiose + - + - - - + - + + - + + + + + - - + + + + +
Sucrose + + + + - + + - + + + + + + + + + - + + + + +
Trehalose - + + + - + + + + + + + + + + + + + + - + + +
Inulin - - - - - - - - - - - - - - - - - - - - - - -
Melezitose - + + + + + - + + + + + + + + - + + - - + - +
Raffinose + - + - - - + - + - - + + + + - - - + + + + +
Starch - - - - - - - - - - + - - - - - - - - - - + -
Glycogen - - - - - - - - - - - - - - - - - - - - - - -
Xylitol - - - - - - - - - - - - - - - - - - - - - - -
Gentiobiose - + + + + + - - + + + + + + + + + + - - + + +
D-Truanose + - + - - - + + + + - + + + + - - - - + + + +
D-Lyxose - - - - - - - - - - - - - - - - - - - - - - -
D-Tagatose - + - + + + - + - + + - - - - + + + - - - - -
D-Fucose - - - - - - - - - - - - - - - - - - - - - - -
L-Fucose - - - - - - - - - - - - - - - - - - - - - - -
D-Arabitol - - - - - - - - - - - - - - - - - - - - - - -
L-Arabitol - - - - - - - - - - - - - - - - - - - - - - -
Gluconate - + - + - + - - + + + + - - + - + - - - + - +
2-keto-Gluconate - - - - - - - - - - - - - - - - - - - - - - -
5-keto-Gluconate - - - - - - - - - - - - - - - - - - - - - - -
2. 유산균의 동정
유산균의 동정은NCBI에서 개발한 Basic Local Alignment Search Tool(BLAST)을 사용하였으며, 본 실험에서 사용된 유산균의 16S rDNA를 추출하여 동정한 결과는 Table 2와 같이 나타내었다.
16S rDNA 염기 서열에 의한 동정은 유전자 수준에서 정 확한 동정법이라 알려져 있다. 그러나 본 실험에서 유산균 의 형태와16S rDNA sequencing의 동정 결과는 일치하였으 나, 당 발효성에 의한 동정 결과와는 상이하게 나타났다. A-9,
A-10 균주는 당 발효성에서는 L. pentosus로 동정되었지만, DNA 염기서열에서는 L. plantarum으로 동정되었다. A-16, A-22 균주는 당 발효성에서는 Lactococcus로 동정되었지만, DNA 염기서열에서는 E. durans로 동정되었다. A-17 균주는
L. paracasei로 동정되었지만 DNA 염기서열 동정 결과는 L.
plantarum으로 나타났다. 이처럼 5종류의 유산균에서 서로
다른 균종이 동정되어 이에 대한 추가 실험이 필요하다고 판단되었다.당 발효성에서 A-2, A-4, A-5, A-6, A-11 균주는 당 발효
Table 2. Identification of the lactic acid bacteria Strains Carbohydrate
utilization DNA sequencing Source
A-1 Leuc.
mesenteroides
Leuc.
mesenteroides
American type culture collection A-2 L. paracasei E. faecalis Infant feces A-3 L. plantarum L. plantarum Pig intestine A-4 L. paracasei E. faecalis Infant feces
A-5 L. paracasei E. faecalis Cheese
A-6 L. paracasei E. faecalis Infant feces A-7 Leuc.
mesenteroides
Leuc.
mesenteroides
American type culture collection A-8 L. paracasei L. paracasei Cheese
A-9 L. pentosus L. plantarum American type culture collection A-10 L. pentosus L. plantarum Pig intestine A-11 L. paracasei E. faecalis Infant feces A-12 L. plantarum L. plantarum Pig intestine
A-13 L. plantarum L. plantarum -
A-14 L. plantarum L. plantarum Cheese A-15 L. plantarum L. plantarum Kimchi A-16 Lc. lactis ssp. E. durans Cheese A-17 L. paracasei L. plantarum Pig intestine A-18 L. rhamnosus L. rhamnosus Infant feces A-19 Leuc.
mesenteroides NT
1)American type
culture collection A-20 Leuc.
mesenteroides
Leuc.
mesenteroides
American type culture collection A-21 L. plantarum L. plantarum Kimchi
A-22 Lc. raffinolactis E. durans -
A-23 L. plantarum L. plantarum Infant feces NT
1): Not tested.
성에 의한 동정 결과, L. plantarum으로 간균으로 동정되었 지만, 현미경으로 관찰한 결과는 구균 모양으로 서로 일치 하지 않았다. 하지만 16S rDNA 염기서열에 의한 동정 결과 는
E. faecalis로 구균 모양의 유산균으로 동정이 되었고, 현
미경으로 관찰한 결과와 그 형태가 일치하였다. 본 실험에 서 유산균 동정 방법으로 사용한16S rDNA 염기서열 결과 는 60% 이상의 DNA 상동성을 갖는 균군을 동일 균종으로 결정한다는 Jonson(1986)의 보고와 DNA 비교는 미생물의 분류학상에 있어서 가장 신뢰성이 높은 판단 기준으로 사용 되고 있다는 보고에 일치하였다. 본 실험에서는 유산균의 동정 결과와 현미경으로 검경한 결과를 바탕으로 당 발효성에 의한 동정보다DNA 염기서열 동정 방법이 더 유의성이 있다고 판단할 수 있었다.
3. 유산균의 단백질 정량
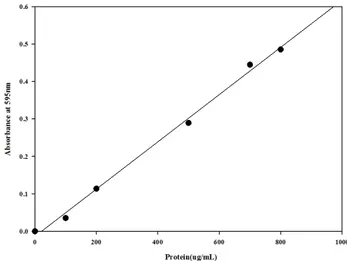
유산균의 단백질을 정량하는 방법으로 가장 많이 사용하 는 방법은Bradford 방법과 Lowry 방법이 있다. Lowry 방법 은 절차가 복잡하고 다른 화합물에 의해 간섭을 많이 받는 단점이 있기 때문에 본 실험에서는Bradford 방법을 이용하 여 단백질 정량을 측정하였다. Bradford 방법은 아미노산의 일종인 아르기닌, 히스티딘, 리신, 타이로신, 트립토판, 페닐 알라닌 같은 잔기가Coomassie brilliant blue G-250(CBB)에 결 합할 때 흡광도의 변화에 의거하여 측정하는 방법으로 정량 시간이 매우 빠르고 간단하다는 장점을 가지고 있다(Bradford, 1976; Compton & Jones, 1985).
Standard curve는 Fig. 1에 나타내었고, MRS 배지, M17 배 지, 10% 탈지분유에 23종의 유산균을 각각 배양하여 단백 질 정량을 측정한 값은Fig. 2~4에 나타내었다. 실험 결과, 배지별로 단백질의 농도는 달랐으며, M17 배지에서 단백질 농도가 가장 낮았으며, 10% 탈지분유에서 가장 높은 단백 질 농도를 보였다. 10% 탈지분유의 영양성분을 보면 탈지 분유 자체에 단백질이58.3%가 함유되어 있기 때문에 단백 질 함량이 높게 나왔다고 판단된다. 단백질 정량은 항산화 측정 시에 각각의 배지에 단백질 함량을 동일하게 맞추어 기준을 세우기 위하여 실시하였다. 배지별로 가장 낮은 단 백질 함량을 가지고 있는 유산균을 기준으로MRS 배지는 450 μg/mL, M17 배지는 193 μg/mL, 10% 탈지분유는 395 μg/mL로 단백질의 함량을 조정하였다. 이로써 단백질이 항산화 측정 시에 영향을 최소화 할 수 있었다고 판단되어 진다.
Fig. 1. Standard curve of protein assay.
Fig. 2. Protein concentration of culture supernatant of lactic acid bacteria in MRS broth.
Fig. 3. Protein concentration of culture supernatant of lactic acid bacteria in 10% skim milk broth.
Fig. 4. Protein concentration of culture supernatant of lactic acid bacteria in M17 broth.
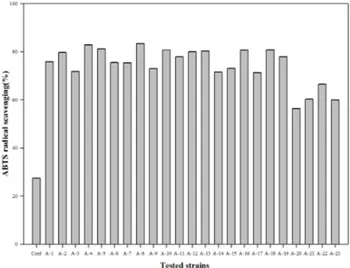
4. ABTS 라디칼 소거능
2,2'-azino-bis(3-ethyl-benzothiazoline-6-sulphonic acid)와 pota- ssium persulfate를 혼합하여 암소에 두면 ABTS 라디칼이 생 성되는데 유산균의 항산화물질과ABTS 라디칼이 반응하여 양이온이 소거됨으로써 특유의 청록색이 탈색된다. 이 탈색 되는 정도를 흡광도를 측정하여 항산화 능력을 시험할 수 있다. ABTS는 비교적 안정한 자유 라디칼로서 lipophilic 또 는hydrophilic 같은 항산화 물질의 측정에 적용 가능한 방법 이다(Rice-Evans et al., 1997).
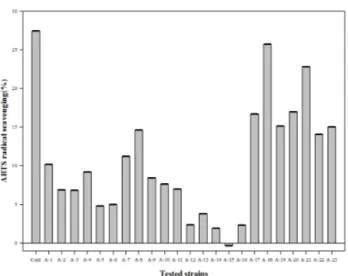
ABTS 라디칼 소거능은 Fig. 5~7에 나타내었다. 대조구 는27%로 다른 항산화 실험에 비해 낮게 평가되어 ascorbic acid가 ABTS 라디칼 소거 능력은 떨어진다고 판단된다. ABTS 라디칼 소거능 방법에서 ascorbic acid가 standard 물질로서 뛰어난 물질이라고 보고한Mathew와 Abraham(2006)의 연구 와는 다르게 나타났다. MRS 배지와 M17 배지에서 배양한 23종류의 균주 모두 대조구보다 높은 소거능을 보였으며, 특히, M17 배지에서 배양한 유산균은 평균 93% 정도의 높 은 소거능을 나타내었다. 평균적으로 MRS 배지는 74%, 10%
탈지분유는9% 정도의 소거능을 보였다. ABTS 라디칼 소 거능이 가장 높은 균주는M17 배지에서 배양한 A-8 균주가 99%로 가장 높았으며, 같은 배지에서 배양한 A-7, A-13 균 주가 각각 98%로 높은 활성을 나타내었다.
ABTS 방법과 DPPH 방법은 자유 라디칼을 소거한다는 점에서 비슷한 방법이지만 본 실험에서DPPH 라디칼 소거 능력보다 ABTS 라디칼 소거 능력이 더 높게 측정되었다.
Adedapo 등(2008)과 Binsan 등(2008)은 항산화 활성 측정 시 DPPH 라디칼 소거 활성보다 ABTS 라디칼 소거 활성이 더 뛰어나다고 보고하며, 본 실험과 일치하는 결과를 나타내었
Fig. 5. ABTS radical scavenging of culture supernatant of lactic
acid bacteria in MRS broth.
Fig. 6. ABTS radical scavenging of culture supernatant of lactic acid bacteria in 10% skim milk broth.
Fig. 7. ABTS radical scavenging of culture supernatant of lactic acid bacteria in M17 broth.
다. 이와 같은 결과가 나타난 이유는 서로 다른 라디칼을 갖 는 방법으로 실험할 때 원리가 비슷하더라도 추출물의 용해 성이나 라디칼의 입체선택성 같은 요소가 제지하는 라디칼 이 다르기 때문이라고 보고되었다(Yu 등, 2002).
5. SOD 유사활성
항산화제에 대한 연구는 1969년 McCord와 Fridovich가 superoxide radical을 소거하는 SOD를 발견하면서부터 본격 적으로 시작되었다. SOD 유사활성 물질은 SOD와 유사한 역 할을 하여 이를 갖는 물질을 섭취하면 인체 내의superoxide 를 제거할 수 있어 노화 억제와 산화적 장해를 방어할 수 있다고 보고되었다(Kitani et al., 2002). SOD 유사활성 반응
을 측정할 때 사용되는pyrogallol은 superoxide radical에 의 해 자동 산화가 일어나 갈색을 형성하여 이를 흡광도로 측 정하고, superoxide 물질이 존재하면 pyrogallol의 산화 속도 가 낮아지는 원리를 이용해서SOD 활성을 간접적으로 측정 하는 방법이다(Bae와 Lee, 1990; Jo 등, 1990).
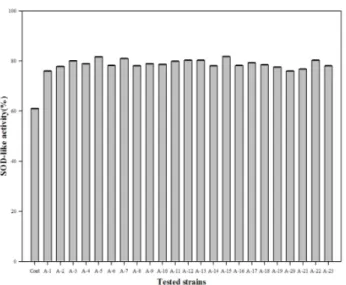
SOD 유사활성을 측정한 결과는 Fig. 8~10에 나타내었 다. Fig. 8~10을 보면 알 수 있듯이 DPPH, FRAP, ABTS 측 정 결과와는 차이가 있었다. MRS 배지, M17 배지, 10% 탈 지분유 별로 비교했을 때 다른 항산화 실험에서는10% 탈 지분유의 활성이 월등히 떨어졌으나, SOD 유사활성 실험에 서는 다른 배지보다 활성이 떨어지긴 하지만 큰 차이가 나 타나지 않았다. 유산균별로 비교해 보았을 때는 SOD 유사 활성이 몇몇 균주가 월등하기 보다는23종의 유산균이 모두
Fig. 8. SOD-like activity of culture supernatant of lactic acid bacteria in MRS broth.
Fig. 9. SOD-like activity of culture supernatant of lactic acid
bacteria in 10% skim milk broth.
Fig. 10. SOD-like activity of culture supernatant of lactic acid bacteria in M17 broth.
유사하게 측정되었다. 이는 실험 방법마다 사용되는 시료나 원리가 다르고, 유산균마다 반응하는 물질이 같을 수 없기 때문이라고 판단되어진다. 평균적으로는 M17 배지가 78%로 SOD 유사활성이 가장 높았으나, 가장 높은 활성을 보인 균 주는MRS 배지에서 배양한 A-13 균주로 86%의 활성을 보 였다. 이 외에도 MRS 배지에서 배양한 A-12 균주가 82%, M17 배지에서 배양한 A-15 균주가 81%로 높은 유사활성을 보였다. 대조구의 SOD 유사 활성은 61%로 유산균은 이보 다 높게 측정된 것으로 보아23종의 유산균은 SOD 유사 활 성이 있다고 사료된다.
유산균의 항산화 효과는 주로 SOD에 관하여 그 효과를 입증하였다(Archibald & Fridovich, 1981). Lc. lactis는 활성산 소를 비독성화시키고(Zitzelsberger et al., 1984), Lactobacillus sp. SBT 2028은 인체 내 활성산소 축적을 감소시켜 준다고 보고되었다(Kaizu et al., 1993). 이밖에도 Lc. lactis subsp.
lactis DIP15(Stecchini et al., 2001), L. sake(Amanatidou et al.,
2001) 균주가 SOD 유사 활성이 있다고 보고되는 등, 유산균 의 활성산소에 대한 제거 능력이 다양하게 보고되었다(Sanderset al., 1995; Ahotupa et al., 1996; Korpela et al., 1997).
참고문헌
1. Adedapo, A. A., Jimoh, F. O., Koduru, S., Masika, P. J.
and Afolayan, A. J. 2008. Evaluation of the medicinal potentials of the methanol extracts of the leaves and stems of Halleria lucida. Bioresource Technology. 99:4158-4163.
2. Ahotupa, M., Saxelin, M. and Korpela, R. 1996. Antioxi- dative properties of Lactobacillus GG. Nutr. Today(Suppl).
31:51S-52S.
3. Amanatidou, A. E., Smid, J., Bennik, M. H. J. and Gorris, L. G. M. 2001. Antioxidative properties of Lactobacillus
sake upon exposure to elevated oxygen concentration.
FEMS Microl. Lett. 203:87-94.
4. Anotupa, M., Saxelin, M. and Korpela, R. 1996. Antioxidative properties of Lactobacillus GG. Nutr. Today(Suppl.) 31:
51S-52S.
5. Andersson, H. N.-G., Asp, Å., Bruce, S., Roos, T., Wadström and Wold, A. 2001. Health effects of probiotics and pre- biotics. A literature review on human studies. Scan. J. of Nutr. 45:58-75.
6. Archibald, F. S. and Fridovich, I. 1981. Manganese, super- oxide dismutase and oxygen tolerance in some lactic acid bacteria. J. Bacteriol. 146:928-936.
7. Aruoma, O. I. 1996. Characterization of drugs as anti- oxidant prophylactics. Free Radical Bio. Med. 20:671-683.
8. Bae, R. N. and Lee, S. K. 1990. Factors affecting browning and its control methods in chopped garlic. J. Korean Soc.
Hort. Sci. 31:213-218.
9. Binsan, W., Benjakul, S., Visessanguan, W., Roytrackul, S., Tanaka, M. and Kishimura, H. 2008. Antioxidative activity of mungoong, an extract paste, from the cephalothorax of white shrimp(Litopenaeus vannamei). Food Chem. 106:185- 193.
10. Bradford, M. M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:
248-254.
11. Compton, S. J. and Jones, C. G. 1985. Mechanism of dye response and interference in the Bradford protein assay.
Anal. Biochem. 151:369-374.
12. Dahiya, R. S. and Speck, M. L. 1968. Hydrogen peroxide formation by lactobacilli and its effect on Staphylococcus
aureus. J. Dairy Sci. 51:1568-1572.
13. Halliwell, B. and Gutteridge, J. M. C. 1984. Oxygen toxicity, oxygen radicals, transition metals and disease. Biochem. J.
219:7-20.
14. Halliwell, B. 1991. Drug antioxidant effects: A basis for drug selection. Drugs. 42:569-605.
15. Ito, N., Fukushima, S. and Hasebawa, A. 1983. Carcinogenic of BHA in F344 rats. J. Natl. Cancer Inst. 70:343-348.
16. Jo, K. S., Kim, H. K., Ha, J. H., Park, M. H. and Shin, H.
S. 1990. Flavor compounds and storage stability of essential
oil from garlic distillation. Korean J. Food Sci. Technol.
22:50-55.
17. Johnson, J. L. 1986. Bergey's manual of systematic bacte- riology, Vol. 2, Williams & Wilkins, Baltimore.
18. Kaizu, H., Sasaki, M., Nakajima, H. and Suzuli, Y. 1993.
Effect of antioxidative lactic acid bacteria on rats fed a diet deficient in vitamin E. J. Dairy Sci. 76:2493-2499.
19. Ken, M. R. and Ann, E. H. 2001. Tannin-protein complexes as radical scavengers and radical sinks. J. Agric. Food Chem. 49:4917-4923.
20. Kitani, K., Minami, C., Ymamoto, T., Kanai, S., Ivy, G. O.
and Carrillo, M. C. 2002. Pharmacological interventions in aging and age-associated disorders: Potentials of propargy- lamines for human use. Ann. N. Y. Acad Sci. 959:295-307.
21. Korpela, R., Peuhkuri, K., Lähteenmäki, T., Sievi, E., Saxelin, M. and Vapaatalo, H. 1997. Lactobacillus rhamnosus GG shows antioxidative properties in vascular endothelial cell culture. Milchwissenschaft. 52:503-505.
22. Kullisaar, T., Songisepp, E., Mikelsaar, M., Zilmer, K., Vihalemm, T. and Zilmer, M. 2003. Antioxidative probiotic fermented goats' milk decreases oxidative stress-mediated atherogenicity in human. Br. J. Nutr. 90:449-456.
23. Kullisaar, T., Zilmer, M., Mikelssar, M., Vihalemm, T., Annuk, H., Kairane, C. and Kilk, A. 2002. Two antioxidative lacto- bacilli strains as promising probiotics. Int. J. Food Microbiol.
72:215-224.
24. Lee, J. M. 1997. Protective effect of Ganoderma iucidum and Panax ginseng, C. A. Meyer on oxidative damage. M.
S. Thesis, Seoul National University.
25. Lin, M. Y. and Chang, F. J. 2000. Antioxiative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356. Diges. Diseases and Sci. 45:1617-1622.
26. Lin, M. Y. and Yen, C. L. 1999. Antioxidative ability of lactic acid bacteria. J. Agric. Food Chem. 47:1460-1466.
27. Marklund, S. and Marklund, G. 1974. Involvement of super- oxide anion radical in the oxidation of pyrogallol and a convenient assay for superoxide dismmutase. Eur. J. Biochem.
47:468-474.
28. Mathew, S. and Abraham, E. T. 2006. In vitro antioxidnat activity and scavenging effects of Cinnamomum verum leaf extract assayed by different methodologies. Food Chem.
Toxicol. 44:198-206.
29. McFarland, L. 2000. A review of evidences of health claims for biotherapeutic agents. Microb. Ecol. Health Dis. 12:
65-76.
30. Rice-Evans, C. and Miller, N. J. 1997. Factors affecting the antioxidant activity determined by the ABTS radical cation assay. Free Radic Res. 195:26-27.
31. Roberta, R., Nicoletta, P., Anna, P., Ananth, P., Min, Y. and Catherine, R. E. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology & Medicine. 26:1231-1237.
32. Salminen, S. 2001. Human studies on probiotics: Aspects of scientific documentation. Scand. J. Nutr. 45:8-12.
33. Sanders, J. W., Leehouts, K. J., Haandrikmam, A. J., Venema, G. and Kok, J. 1995. Stress response in Lactococcus lactis:
Cloning, expression analysis and mutation of the lactococcal superoxide dismutase gene. J. Bacteriol. 177:5254-5260.
34. Stecchini, M. L., Torre, M. D. and Munari, M. 2001. Deter- mination of peroxy radical scavenging of lactic acid bacteria.
Int. J. Food Microbiol. 64:183-188.
35. Yu, L., Haley, S., Perret, J., Harris, M., Wilson, J. and Qian, M. 2002. Free radical scavenging properties of wheat extracts.
J. Agr. Food Chem. 50:1619-1624.
36. Zitzelsberger, W., Götz, F. and Schleifer, K. H. 1984. Distri- bution of superoxide dismutases oxides and NADH peroxides and various streptococci. FEMS Microbiol. Lett. 21:243- 246.
(2010년 11월 17일 접수; 2010년 11월 23일 채택)