330 책임저자:김광혁, 602-702, 부산시 서구 암남동 34
고신대학교 의과대학 미생물학교실 Tel: 051-990-6422, Fax: 051-990-3081 E-mail: ghkim@ns.kosinmed.or.kr
접수일:2008년 11월 10일, 게재승인일:2008년 11월 24일
Correspondence to:Kwang Hyuk Kim
Department of Microbiology, Kosin University, 34, Amnam-dong, Suh-gu, Busan 602-702, Korea
Tel: +82-51-990-6422, Fax: +82-51-990-3081 E-mail: ghkim@ns.kosinmed.or.kr
하프물개오일이 마우스에서 전염증성 사이토카인의 생성에 미치는 효과
고신대학교 의과대학 1의과학연구소, 2미생물학교실, 3비뇨기과학교실, 4자연과학대학 식품영양학과
김광혁1,2ㆍ박인달2ㆍ서재수4ㆍ류현열3
Effects of Harp Seal Oil on the Production of Proinflammatory Cytokines in Mice
Kwang Hyuk Kim1,2, In Dal Park2, Jae Soo Suh4 and Hyun Yul Rhew3
1Institute for Medicine, Departments of 2Microbiology, 3Urology, College of Medicine, 4Department of Food and Nutrition, College of Natural Science, Kosin University, Busan 602-702, Korea
Omega-3, a polyunsaturated fatty acid, is essential fatty acids necessary for human health against cardiovascular disease, inflammation, and cancer. In the present study, we investigated the effects of omega-3-rich harp seal oil (HSO) on the production of the proinflammatory cytokines such as tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), and interleukin-6 (IL-6) in mice. The culture supernatants of splenocytes exposed with HSO alone or HSO plus lipopolysaccharide (LPS) were harvested to assay TNF-α, IL-1β, and IL-6 production. Also, sera from the mice ip-injected with HSO alone or LPS plus HSO were assayed for the same cytokines. The TNF-α, IL-1β, and IL-6 from mice splenocytes exposed with HSO were decreased compared to dimethylsulfoxide (DMSO) control. The TNF- α and IL-1β in the culture supernatants from mice splenocytes exposed with LPS+HSO were lower than those of the groups exposed with LPS alone. The TNF-α and IL-6 in the sera from mice injected with LPS+HSO were lower than those of the groups injected with LPS only. These findings demonstrate that omega-3-rich harp seal oil downregulates the production of the proinflammatory cytokines such as TNF-α, IL-1β, and IL-6. These results show the probability of its usefulness for antiinflammatory effects if more research results were accumulated. (Cancer Prev Res 13, 330-335, 2008)
Key Words: Harp seal oil, Inflammation, TNF-α, IL-1β, IL-6, Mice
서 론
에스키모인들은 식품 중에 생선기름을 많이 섭취하고 있으며 이들은 혈전이나 심혈관질환 혹은 심근경색과 같은 질환의 발생률이 매우 낮다는 것을 Dyerberg 등1)이 시험을 통하여 밝힌 이래로 오메가-3 불포화지방산에 대 한 관심이 집중되었다. 또한 시험관 및 생체실험을 통한
많은 연구결과들은 오메가-3 지방산이 류마티스 관절 염,2,3) 천식,4) 건선5) 등의 질환을 갖고 있는 환자들의 상 태를 호전시킬 수 있음을 보여줬다. 따라서 오메가-3 지 방산은 항염증 활성을 보임으로서 환자들에서 면역 및 염증반응에 변화를 줄 수 있음이 증명된 것이다.6∼8) Kato 등9)은 사람 결장암세포를 주사한 누드마우스에 고 농도의 오메가-3 지방산이 포함된 먹이를 투여하였을 때 암조직의 무게가 50% 이상 감소되는 것을 관찰함으로서
오메가-3 지방산 식이가 유의한 암세포억제효과를 발휘 한다고 결론지었다. Micallef 등10)은 n-3 polyunsaturated fatty acid (PUFA)와 식물성스테롤을 사람들에게 3주간 투 여시킨 후 관찰한 결과 몇 가지 염증관련표지들이 감소 하는 것을 보고하였다. 즉 C-반응단백, tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), leukotriene B4가 아 주 유의하게 감소하여 전반적인 심혈관 위험인자가 감 소됨으로서 고 지질 성 개체들에서의 염증반응을 줄이 게 되어 심장을 보호할 수 있을 것이라 하였다. Wang 등11)은 쥐 실험을 통하여 n-3 PUPA가 장에서의 IL-15의 발현을 억제시킴으로서 장 림프구의 특성에 변화를 초 래하여 장면역반응의 조절작용을 수행한다고 하였다.
본 연구에서는 오메가-3지방산을 다량 함유(오메가-3:
20∼25%)하고 있는 하프물개기름(Harp Seal Oil, HSO)을 이용하여 염증관련 사이토카인인 TNF-α, interleukin-1β (IL-1β), 그리고 IL-6의 생성을 마우스 비장세포 배양을 통하여 알아보고자 하였다. 또한 생체에서의 이들 사이 토카인의 생성을 보기 위하여 마우스에 HSP를 주사한 후 채혈된 혈액의 혈청 내 함량을 측정함으로서 시험관 에서의 HSO노출의 경우와 어떤 차이가 있는지에 대하 여 알아보고자 하였다.
재료 및 방법 1. 재료
1) 실험동물: 암컷 Balb/C 마우스로서 생후 8주 내외,
체중 25 g 내외의 것을 대한바이오링크(음성군, 충청북 도, 한국)로부터 구입하여 실험에 사용하였다.
2) 시약: 하프물개기름(Harp seal oil, HSO)은 하프오일 (Newfoundland Health Food Corp., Newfoundland, Canada)로 고신대학교산학협력단의 오메가-3플러스를 사용하였 고, lipopolysaccharide (LPS)는 Escherichia coli (serotype 026:B6) 에서 분리 정제된 표품(Sigma-Aldrich Corp., St. Louis, Mo, USA)을 사용하였다. TNF-α, IL-1β, IL-6을 측정하기 위 한 시약은 Mouse TNF-α, IL-1β, IL-6 ELISA kit (eBioscience, San Diego, CA, USA)을 이용하였다.
2. 방법
1) 비장세포배양 상층 액: 비장세포배양 상층 액 준비
는 미리 준비된 비장세포 부유 액을 10%가 되게 소 태아 혈청을 가한 RPMI 1640 (Gibco BRL., Grand Island, NY, USA) 배지로 ml 당 2×106 세포가 되도록 조절하여, 24 wells tissue culture plate (Costar, Cambridge, MA, USA)에 1 ml씩 분주한 후 HSO 3.0, 10.0μg을 각각 작용시켜 37oC,
5% CO2 배양기에 배양하였다. 또한 LPS 2.0μg과의 복합 작용도 함께 시험하였다. 대조군은 0.1% DMSO액을 사 용하였다. 배양시간은 상기의 조건에 6시간으로 하였다.
배양이 끝난 후 전량 배양액을 수거한 다음 300×g에서 10분간, 10,000×g에서 30분간 원침시킨 후 그 상층 액을 수거하여 −70oC에 보관하였다.
2) 마우스에 시료접종 후 혈청분리: 마우스 복강 내에
LPS 2.5μg과 HSO 500μg을 주사하고 24시간 경과시킨 후 마우스 심장으로부터 혈액을 채취한 후 혈청을 분리 하였다. 대조군은 0.1% DMSO액을 사용하였다. 분리된 혈청은 −70oC에 보관하였다.
3) TNF-α, IL-1β, IL-6 측정: 미리 96 wells microplate 에 mouse TNF-α, IL-1β, IL-6에 대한 capture 항체를 coating buffer에 희석하여 100μl씩을 분주한 후 4oC에서 하룻밤 방치하였다. 다음날 plate를 세척용 완충액으로 5 번 세척한 후 assay diluent 250μl씩을 분주한 후 실온에 서 1시간동안 방치하였다. 세척용 완충액으로 5번 세척 한 후 plate의 각 well에 시료 100μl씩 을 적하하여 실온 에서 2시간 동안 방치하였다. 세척용 완충액으로 5번 세 척한 후 detection 항체 100μl씩을 분주한 후 실온에서 1시간 동안 방치하였다. 세척용 완충액으로 5번 세척한 후 avidin-horseradish peroxidase 액 100μl씩을 적하하여 다 시 실온에서 30분 동안 방치하였다. 세척용 완충액으로 7번 세척한 후 tetramethylbenzidine이 포함된 기질 액 100 μl씩을 적하하여 실온에서 15분 동안 방치한 후 stop액 50μl씩을 가하였다. Stop액 50μl씩을 가하여 반응을 정 지시켰다. Optical density는 microplate reader (Model 550 microplate reader, Bio-Rad, Richmond, USA)를 이용하여 450 nm에서 측정하였다.
4) 통계학적 분석: 실험성적은 평균 또는 평균±표준편
차로 나타냈으며 각 군 간의 통계학적 검정에는 Student’s t-test를 사용하고 P값이 0.05 미만일 때 의의 있는 차로 간주하였다.
결과 및 고찰 1. HSO에 의한 TNF-α생성의 변화
정상마우스의 비장에서 분리된 세포 부유 액에 HSO 를 작용시켰을 때 생성되는 TNF-α의 량을 측정하였다.
HSO, 3μg/ml을 작용시켰을 때 TNF-α가 30.22 pg/ml로 대조군의 37.10 pg/ml 보다 낮게 났으며, 10μg/ml을 작용 시켰을 때는 26.29 pg/ml을 나타내어 유의한 감소효과를 나타냈다(Fig. 1). 마우스 비장세포에 LPS를 2.0μg을 작 용시켰을 때 TNF-α의 생성은 350.12 pg/ml을 나타내어
Fig. 1. Production of TNF-α by mice splenocytes exposed to harp seal oil (HSO). Splenocytes were cultivated with 3.0 and 10μg for 6 hrs respectively. Control was exposed to 0.1%
DMSO. Data shown are mean±SD. *p<0.05 compared to the control.
Fig. 2. Production of TNF-α by mice splenocytes exposed to harp seal oil (HSO) and lipopolysaccharide (LPS). Splenocytes were cultivated with HSO (1.0μg/ml) and LPS (2.0μg) for 6 hrs respectively. Control was exposed to 0.1% DMSO. Data shown are mean±SD.
Fig. 3. Production of IL-1β by mice splenocytes exposed to harp seal oil (HSO). Splenocytes were cultivated with 3.0 and 10.0μg for 6 hrs respectively. Control was exposed to 0.1%
DMSO. Data shown are mean±SD. **p<0.01 compared to the control.
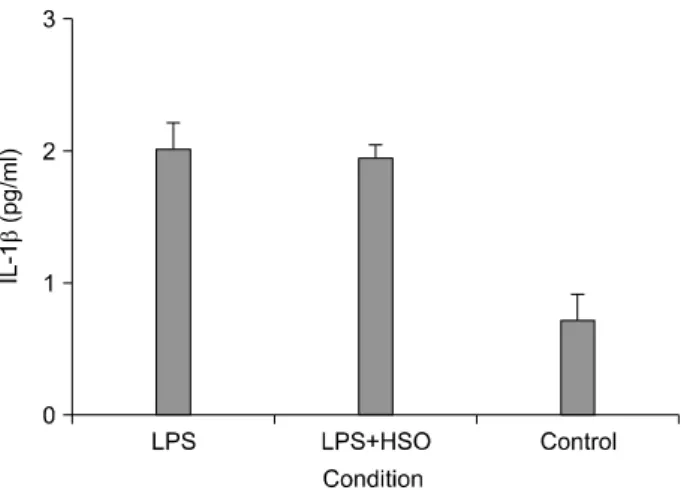
Fig. 4. Production of IL-1β by mice splenocytes exposed to harp seal oil (HSO) and lipopolysaccharide (LPS). Splenocytes were cultivated with HSO (1.0μg/ml) and LPS (2.0μg) for 6 hrs respectively. Control was exposed to 0.1% DMSO. Data shown are mean±SD.
대조군에 비하여 큰 상승을 보였으며 LPS 2.0μg과 HSO 1.0μg을 함께 작용시켰을 때는 332.43 pg/ml으로 나타나 LPS 단독 작용시보다 감소하였다(Fig. 2). 따라서 정상의 비장세포가 배지속의 성분들에 의해서도 자극을 받아 TNF-α의 생성을 유도하였으며 배지 속에 HSO를 작용 시켰을 시 TNF-α의 생성이 억제됨을 알 수 있고 HSO의 농도를 증가시켰을 때 그 억제력은 더욱 증가하였다. 세 균독소인 내독소를 비장세포에 작용시켰을 때는 예상대 로 TNF-α의 생성이 크게 증가함을 볼 수 있었고 내독소 와 HSO를 함께 작용시키면 다시 감소됨으로서 HSO가
염증관련 사이토카인인 TNF-α생성의 억제를 유도하는 것으로 보여 진다. 이러한 결과는 Micallef 등10)이 시도한 연구 결과와도 유사점을 보인다. 즉, 고지혈증을 갖는 사 람들에게 오메가-3 지방산과 식물성 스테롤을 투여시켰 을 때 TNF-α의 생성이 대조군에 비하여 10% 감소를 보 인 결과로부터 항염증 및 심장보호 효과를 제시하였다.
Lennie 등12)은 심장병을 가진 환자들에 불포화지방산을 높게 투여할수록 TNF-α에 대한 가용성 수용체인 sTNF- R1과 sTNF-R2의 량이 낮아지는 것을 관찰하여 식이용 지방의 선택에 따라 심장병환자의 염증관련 사이토카인 의 활성을 바꿀 수 있음을 보고한 바 있다.
Fig. 5. Production of IL-6 by mice splenocytes exposed to harp seal oil (HSO). Splenocytes were cultivated with 3.0 and 10.0μg for 6 hrs respectively. Control was exposed to 0.1%
DMSO. Data shown are mean±SD. **p<0.01 compared to the control.
Fig. 6. Production of IL-6 by mice splenocytes exposed to harp seal oil (HSO) and lipopolysaccharide (LPS). Splenocytes were cultivated with HSO (1.0μg/ml) and LPS (2.0μg) for 6 hrs respectively. Control was exposed to 0.1% DMSO. Data shown are mean±SD. **p<0.01 compared to the LPS group.
2. HSO에 의한 IL-1β생성의 변화
정상마우스의 비장에서 분리된 세포 부유 액에 HSO 를 작용시켰을 때 생성되는 IL-1β의 량을 측정하였다.
HSO, 3μg/ml을 작용시켰을 때 IL-1β가 0.86 pg/ml로 대 조군의 0.72 pg/ml보다 높게 나타났으나, 10μg/ml을 작 용시켰을 때는 0.43 pg/ml을 나타내어 매우 유의한 감소 효과를 나타냈다(Fig. 3). 마우스 비장세포에 LPS를 2.0μg 을 작용시켰을 때 IL-1β의 생성은 2.01 pg/ml을 나타내 어 대조군에 비하여 큰 상승을 보였으며 LPS 2.0μg과 HSO 1.0μg을 함께 작용시켰을 때는 1.94 pg/ml으로 나 타나 LPS 단독 작용시보다 감소하였다(Fig. 4). 이러한 결 과는 HSO가 비장세포에 작용될 때 HSO의 농도에 따라 IL-1β의 생성에 있어서 낮은 농도에서는 자극적으로 작 용하여 증가를 보이나 일정 농도 이상에서는 IL-1β의 생성억제를 유도하는 것을 보인 것이다. 또한 세균독소 에 의해서 IL-1β의 생성이 크게 증가하였으나 HSO의 추가에 의해서 IL-1β의 생성이 감소되었다. 이는 HSO에 의해서 IL-1β가 억제된 결과로서 염증관련 질환에 도움 을 줄 것으로 보인다.
3. HSO에 의한 IL-6생성의 변화
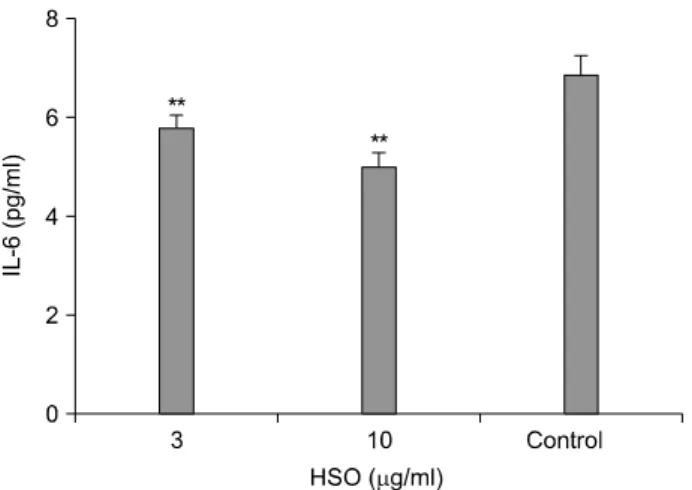
정상마우스의 비장에서 분리된 세포 부유 액에 HSO를 작용시켰을 때 생성되는 IL-6의 량을 측정하였다. HSO, 3μg/ml을 작용시켰을 때 IL-6가 5.80 pg/ml로 대조군의 6.86 pg/ml 보다 낮게 나타났으며, 10μg/ml을 작용시켰 을 때는 5.02 pg/ml을 나타내어 감소효과를 나타냈다(Fig.
5). 마우스 비장세포에 LPS를 2.0μg을 작용시켰을 때 IL-6의 생성은 89.93 pg/ml을 나타내어 대조군에 비하여 큰 상승을 보였으며 LPS 2.0μg과 HSO 1.0μg을 함께 작 용시켰을 때는 104.23 pg/ml으로 나타나 LPS 단독 작용시 보다 증가하였다(Fig. 6). 이와 같이 비장세포에 HSO를 작용시켰을 때 농도가 증가됨에 따라 IL-6의 생성이 더 욱 억제됨을 알 수 있었으나 세균독소를 작용시켰을 때 는 HSO가 가담됨으로서 더욱 IL-6의 생성이 항진됨을 볼 수 있다. 따라서 LPS와 HSO에 의한 IL-6 생성의 증가 는 시험관내에서 IL-6관련 염증반응을 높일 것으로 생각 된다. Kawashima 등13)은 IL-1β로 자극시킨 C6 신경교종 세포 주에 에이코사펜타노익 산을 작용시키면 IL-6의 생 성이 저해됨을 관찰하였고 Kato 등9)은 누드마우스에 사 람결장암 세포를 접종하고 오메가-3지방산을 투여하였 을 때 암세포성장이 저해되고 IL-6 전구물질이 감소하는 것을 관찰하였다. 여기에서 나타난 결과들과 본 실험에 서 나타난 차이는 생체나 혹은 세포가 노출된 조건들에 따른 차이로 생각된다.
4. HSO에 노출된 마우스의 혈청 내 TNF-α, IL-1β, IL-6생성의 변화
정상마우스의 복강으로 HSO를 주사한 후 생성되는 TNF-α의 량을 측정하였다. HSO, 500μg/ml을 작용시켰 을 때 혈청내 TNF-α는 14.74 pg/ml로 대조군의 0.37 pg/ml 보다 높게 나타났다. 마우스 복강으로 LPS를 2.5μg 을 작용시켰을 때 TNF-α의 생성은 23.34 pg/ml을 나타 냈으며 LPS 2.5μg과 HSO 500μg을 함께 작용시켰을 때
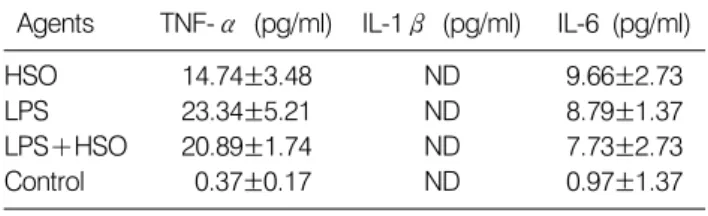
Table 1. Production of TNF-α, IL-1β, and IL-6 in sera of mice exposed to HSO
Agents TNF-α (pg/ml) IL-1β (pg/ml) IL-6 (pg/ml)
HSO 14.74±3.48 ND 9.66±2.73
LPS 23.34±5.21 ND 8.79±1.37
LPS+HSO 20.89±1.74 ND 7.73±2.73
Control 0.37±0.17 ND 0.97±1.37
Mice were ip injected with harp seal oil (HSO, 500μg) or lipopolysaccharide (LPS, 2.5μg). Control mice were injected with 0.1% DMSO. Sera were harvested and assayed for TNF- α, IL-1β and IL-6. Data shown are mean±SD. ND: not detected.
는 20.89 pg/ml으로 나타나 LPS 단독 작용시보다 감소하 였다. 정상마우스의 복강으로 HSO를 주사한 후 생성되 는 IL-1β의 량을 측정하였으나 모든 시험 군들에서 검 색되지 않았다. 이는 시료채취시간(24시간 후 채혈)이 IL-1β를 정량하기에 적합지 않았던 것으로 보인다. 정 상마우스의 복강으로 HSO를 주사한 후 생성되는 IL-6의 량을 측정하였다. HSO, 500μg/ml을 작용시켰을 때 혈청 내 IL-6는 9.66 pg/ml로 대조군의 0.97 pg/ml 보다 높게 나타났다. 마우스 복강으로 LPS를 2.5μg을 작용시켰을 때 IL-6의 생성은 8.79 pg/ml을 나타냈으며 LPS 2.5μg과 HSO 500μg을 함께 작용시켰을 때는 7.73 pg/ml으로 나 타나 LPS 단독 작용시보다 감소하였다(Table 1). 이와 같 은 결과는 시험관에서 보인 결과와는 약간 다르게 나타 났다. 즉, 더욱 복잡한 생체적 환경을 고려한다면 예상되 는 것이라 하겠다. 오메가-3 나 오메가-6 불포화지방산 모두 인간건강에 필요한 필수지방산이다. 그러나 근래 에 서구의 음식에는 오메가-6가 오메가-3보다 월등히 높 음으로 인하여 심장질환, 염증, 악성종양의 발생에 관련 을 갖는 것으로 분석되고 있다. EPA나 DHA는 단구 혹은 림프구에 의한 T-helper 타잎 1 사이토카인과 전염증성 사이토카인의 생성을 감소시키고 T림프구, 자연살해세 포, 단구 등을 포함하는 몇 가지 면역 관련 세포들을 억 제한다는 보고가 있다.14∼19) 동물이나 세포배양 실험모 델을 통하여 얻어진 결과들이지만 암에 미치는 오메가-3 불포화지방산의 효과는 암을 예방하고 치료하는 영역으 로 확대되어 암환자의 몸무게 감소를 줄인다든지 면역 계를 조절하는 방향으로 연구가 진전되고 있다.20∼22) 본 실험에서도 in vivo 조건 속에서 HSO를 마우스에 작용시 키면 세균독소 단독작용시의 TNF-α, IL-6 생성을 억제 시키는 결과로 나타남으로서 염증관련 사이토카인의 양 적변화에 의한 면역반응의 조절작용이 나타나 HSO가 염증반응을 완화시킬 수 있을 것으로 생각된다.
결 론
본 연구에서는 omega-3 불포화지방산이 다량 함유된 하프물개오일(Harp Seal Oil, HSO)이 마우스에서 전염증 성 사이토카인의 생성에 미치는 효과를 보기 위하여 HSO에 의한 TNF-α생성의 변화, HSO에 의한 IL-1β생 성의 변화, 그리고 HSO에 의한 IL-6생성의 변화를 시험 관내에서 시험하였고 HSO에 노출된 마우스의 혈청 내 TNF-α, IL-1β, IL-6생성의 변화를 in vivo를 통하여 관찰 하였다. HSO를 비장세포에 노출시켰을 때 TNF-α와 IL-6의 생성은 HSO의 양이 증가됨에 따라 감소하는 정 도가 크게 나타났으나 IL-1β는 일정농도에서만 감소효 과를 보였다. 세균독소인 LPS를 비장세포에 노출시켰을 때 TNF-α, IL-1β, IL-6생성의 큰 상승을 나타냈으며 HSO노출 군들에서 HSO에 의하여 TNF-α, IL-1β의 생 성이 감소를 보였으나 IL-6의 생성은 증가하였다. 마우 스에 LPS만을 단독 투여하거나 혹은 LPS와 HSO를 복합 투여하였을 시 혈청 내 TNF-α, IL-6생성은 복합 투여한 군이 LPS단독 투여군 보다 낮았다. 따라서 이러한 결과 들로 부터 HSO가 TNF-α, IL-1β, IL-6와 같은 전염증성 사이토카인의 생성을 하향 조절할 수 있을 것으로 보이 며 앞으로의 추가적인 연구결과들이 있게 되면 염증관 리의 임상영양 차원에서 HSO의 이용가능성을 나타낸다 하겠다.
감사의 글
본 연구는 2008년도 고신대학교 의과대학 고신의대 의과학연구소의 지원으로 수행되었음에 감사드립니다.
참 고 문 헌
1) Dyerberg J, Bang HO, Hjorne N. Fatty acid composition of the plasma lipids in Greenland eskimos. Am J Clin Nutr 28, 958-966, 1975.
2) Cleland LG, James MJ, Proudman SM. The role of fish oils in the treatment of rheumatoid arthritis. Drugs 63, 845-853, 2003.
3) Kremer JM. Clinical sudies of omega-3 fatty acid supple- mentation in patients who have rheumatoid arthritis. Rheum Dis Clin North Am 17, 391-402, 1991.
4) Hodge L, Salome CM, Peat JK, Haby MM, Xuan W, Woolcock AJ. Consumption of oily fish and childhood asthma risk. Med J Aust 164, 137-140, 1996.
5) Mayser P, Grimm H, Grimminger F. N-3 fatty acids in
psoriasis. Br J Nutr 87, 77-82, 2002.
6) Koch T, Heller AR. Benefits of omega-3 fatty acids in parenteral nutrition. Clin Nutr 1, 17-24, 2005.
7) Heller AR, Koch T, Schmeck J, van Ackern K. Lipid mediators in inflammatory disorders. Drugs 55, 487-496, 1998.
8) Gadek JE, DeMichele SJ, Karlstad. Effect of enteral feeding with eicosapentaenoic acid, γ-linolenic acid and antioxidants in patients with acute respiratory distress syndrome. Crit Care Med 27, 1409-1420, 1999.
9) Kato T, Hancock RL, Mohammadpour H, McGregor B, Manalo P, Khaiboullina S, Hall MR, Pardini L, Pardini RS.
Influence of omega-3 fatty acids on the growth of human colon carcinoma in nude mice. Cancer Lett 187, 169-177, 2002.
10) Micallef MA, Garg ML. Anti-inflammatory and cardio- protective effects of n-3 polyunsaturated fatty acids and plant sterols in hyperlipidemic individuals. Atherosclerosis, in press, 2008
11) Wang Hao, Hao Q, Li QR, Yan XW, Ye S, Li YS, Li N, Li JS. Omega-3 polyunsaturated fatty acids affect lipopoly- saccharide-induced maturation of dendritic cells through mitogen-activated protein kinases p38. Nutrition 23, 474-482, 2007.
12) Lennie TA, Chung ML, Habash DL, Moser DK. Dietary fat intake and proinflammatory cytokine levels in patients with heart failure. J Card Fail 11, 613-618, 2005.
13) Kawashima A, Harada T, Imada K, Yano T, Mizuguchi K.
Eicosapentaenoic acid inhibits interleukin-6 production in interleukin-1β-stimulated C6 glioma cells through peroxi- some proliferator-activated receptor-gamma. Prostaglandins Leukot Essent Fatty Acids 79, 59-65, 2008.
14) Arrington JL, McMurray DN, Switzer KC, Fan YY, Chapkin
RS. Docosahexaenoic acid suppresses function of the CD28 costimulatory membrane receptor in primary murine and Jurkat T cells. J Nutr 131, 1147-1153, 2001.
15) McMurry DN, Jolly CA, Chapkin RS. Effects of dietary n-3 fatty acids on T cell activation and T cell receptor-mediated signaling in a murine model. J Infect Dis 182, 103-107, 2000.
16) Pompos LJ, Fritsche KL. Antigen-driven murine CD4+ T lymphocyte proliferation and interleukin-2 production are diminished by dietary (n-3) polyunsaturated fatty acids. J Nutr 132, 3293-3300, 2002.
17) Kelley DS, Tayer PC, Nelson GJ, Mackey BE. Dietary doco- sahexaenoic acid and immunocompetentence in young men.
Lipids 33, 559-566, 1998.
18) Thies F, Nebe-von-Caron G, Powell JR, Yaqoob P, Newsholme EA, Calder PC. Dietary supplementation with eicosapentaenoic acid, but not with other long-chain n-3 or n-6 polyunsaturated fatty acids, decreases natural killer cell activity in healthy subjects aged >55 y. Am J Clin Nutr 73, 539-548, 2001.
19) Hughes DA, Pinder AC. N-3 polyunsaturated fatty acids inhibit the antigen-presenting function of human monocytes.
Am J Clin Nutr 71, 357-360, 2000.
20) Blot WJ, Lanier A, Fraumeni JF, Bender TR. Cancer mortality among Alaska natives, 1960-1969. J Natl Cancer Inst 55, 547-554, 1975.
21) Bartsch H, Nair J, Owen RW. Dietary polyunsaturated fatty acids and cancers of the breast and colorectum: emerging evidence for their role as risk modifiers. Carcinogenesis 20, 2209-2218, 1999.
22) Sasaki S, Horacsek M, Kestleloot H. An ecological study of the relationship between dietary fat intake and breast cancer mortality. Prev Med 22, 187-202, 1993.