917 서 론
복부비만, 고혈압, 고혈당, 고중성지방혈증, 저고밀도지 단백혈증의 5가지 심혈관계질환 위험인자 중 3가지 이상을 가지고 있으면 대사증후군으로 진단한다.1,2 대사증후군이 중요한 것은 그 자체가 질병이기도 하지만 심혈관 및 뇌혈 관질환 뿐만 아니라 비뇨기과적으로 발기부전3과 하부요로 증상4을 유발하고 진행을 촉진하는 것으로 알려져 있다. 대 사증후군 환자에서의 발기부전 유병률은 대조군보다 2배 정도 더 높게 보고되었으며, 대사증후군의 위험인자를 많 이 가지고 있을수록 발기부전의 위험이 증가한다.3 대사증후군의 기본 병태생리는 인슐린 매개성 포도당 흡 수의 장애로 인해 발생하는 인슐린 저항성으로 인슐린의 양이 정상적으로 분배되는데도 불구하고 그 생리학적 작용 이 현저히 감소된 상태를 말한다. 그러므로 비뇨기과 의사
는 발기부전의 발생기전 이해와 효과적 치료를 위해 인슐 린 저항성에 대한 기본적 이해가 필요하다.
인슐린의 혈관내피세포에서 신호전달과 혈류역동학적 작용
인슐린 신호전달 경로는 다수의 되먹임 경로, 주된 신호 전달경로 사이의 cross talk, 다른 종류의 수용체 신호전달경 로부터의 cross talk을 포함한 매우 복잡한 신호망으로 구성 되어 있다. 인슐린의 생물학적 작용은 표적세포의 표면 수 용체에 결합함으로써 시작된다.5,6 인슐린의 2가지 중요한 신호전달경로에는 주로 대사기능 및 혈관 확장을 조절하는 phosphatidylinositol (PI) 3-kinase-의존성 경로와 유사분열촉 진 및 성장효과, 혈관수축에 관여하는 Ras/mitogen- activated protein (MAP)-kinase 경로가 있다.
인슐린 저항성과 발기부전
Insulin Resistance and Erectile Dysfunction
Sae-Chul Kim
From the Department of Urology, Chung-Ang University College of Medicine, Seoul, Korea
Insulin resistance is a hallmark of metabolic syndrome, including type 2 diabetes mellitus and obesity which are characterized by endothelial dysfunction. The endothelial dysfunction leads to erectile dysfunction (ED). Thus, understanding of insulin resistance is mandatory for urologists to understand a pathophysiology of ED. There are two distinct features of insulin signal transduction pathway. One is phosphatidylinositol 3-ki- nase-dependent pathway which regulates glucose uptake in skeletal mus- cle and nitric oxide (NO) production and vasodilation in vascular endo- thelium. In cavernous smooth muscles, insulin also induces the endothe- lium-dependent relaxation, however it may emanate from the direct inhibition of L-type Ca2+ channels by prostacyclin in addition to NO pro- duction. The other one is mitogen-activated protein (MAP)-kinase pathway which regulates growth and mitogenesis and controls secretion of endo- thelin-1 in vascular endothelium. Stimulation of sympathetic activity by insulin may also contribute to hemodynamic regulation. A shift in balance between vasoconstrictor and vasodilator actions of insulin may be an important factor in the vascular pathophysology of insulin resistance, leading to ED. Hyperglycemia, elevated free fatty acid levels, and proin- flammatory states share mechanisms between insulin resistance and endothelial dysfunction. There is evidence to suggest that testosterone is an important regulator of insulin sensitivity in men and hypotestoste- ronemia may have a role in the pathogenesis of insulin-resistant states.
(Korean J Urol 2006;47:917-927)
대한비뇨기과학회지 제 47 권 제 9 호 2006
중앙대학교 의과대학 비뇨기과학교실
김세철
교신저자: 김세철
중앙대학교병원 비뇨기과 서울시 동작구 흑석동 224-1 ꂕ 156-861
TEL: 02-6299-1785 FAX: 02-822-8496 E-mail: saeckim@unitel.
co.kr
1. PI 3-kinase 신호전달경로
인슐린 수용체가 활성화되면 먼저 인슐린 수용체 물질 (insulin receptor substance; IRS)과 Shc를 포함한 세포 내 기 질을 인산화한다. 인산화된 IRS는 PI 3-kinase의 SH2 do- mains에 선택적으로 결합하여 PI 3-kinase를 활성화하며, 활 성화된 PI 3-kinase는 다시 phosphoinositide-dependent kinase-1 (PDK-1)를 인산화, 활성화하고 이것은 다시 Akt와 다른 serine kinases를 인산화, 활성화시키면 다시 신경전달경로 의 하류기질을 인산화, 활성화시키는 일련의 단계적 과정 이 일어난다. 인슐린은 골격근과 지방조직에서 PI 3-kinase 와 Akt를 활성화시키면 당 섭취가 일어나도록 인슐린-반응 성 당 전달자인 glucose transporter (GLUT)4를 세포표면에 전위시킨다 (Fig. 1).5,6
또 인슐린은 PI 3-kinase 경로를 통해 endothelial nitric oxide synthase (eNOS)를 활성화하여 혈관 내피세포에서 NO가 생 산되면 NO는 인접한 혈관 평활근세포 내로 확산해 들어가 혈관확장을 일으킨다.7-9 그러나 성장인자에 의한 내피세포 자극도 PI 3-kinase와 Akt를 활성화시키기 때문에 인슐린-자 극만으로는 불충분하다.7 혈관내피세포에서 eNOS를 활성 화하여 NO 생산을 증가하는 인슐린 신호전달경로는 아세 틸콜린 수용체와 같은 G-단백질-결합 수용체에 의해 이용
되는 전형적인 칼슘-의존성 기전과는 완전히 다르며 독립 적이다.10
당대사와 혈류는 상호 연계되어 있으므로 대사작용이 증 가하면 추가적인 혈류공급이 필요하며, 반대로 당과 인슐 린을 생리적 수준으로 유지하면서 혈류를 증가하면 당소모 는 혈류-의존성으로 증가한다.11 혈류가 증가하면 골격근으 로 인슐린이 많이 이동하여 골격근에서 GLUT4 전위를 자 극하여 직접 당섭취를 촉진시킨다. 그러므로 인슐린은 골 격근에서 당섭취를 증가시키는 직접적 효과가 있으며, 혈 류증가에 의해 당소모를 촉진시키는 간접적 효과를 갖고 있다. 이 같은 대사작용과 혈관작용 사이의 cross talk은 당 항 상성 (homeostasis)과 내피세포 기능을 연결하는데 중요하다.
2. Ras/MAP-kinase 신호전달경로
인슐린은 세포 내 또 다른 기질인 Shc를 인산화시키면 Shc가 Grb-2의 SH2 domain에 결합하여 guanosine triphos- phate (GTP) 교환인자인 Sos를 활성화한다. Sos는 GTP 결합 단백질인 Ras를 활성화시키면 Raf, MAP-kinase를 포함한 일련의 단계적 인산화 과정이 시작된다. Ras/MAP-kinase 인 슐린-신호전달경로는 일반적으로 인슐린의 대사작용과 eNOS 활성화에는 관여하지 않으며 유사분열생식 (mitogenesis), 성장 효과 및 혈관수축인자인 endothelin-1 (ET-1) 생산에 관
Fig. 1. General feature of insulin signal transduction pathways. PI 3-kinase branch of insulin signaling regulates GLUT4 translocation and vasodilation in vascular endothelium. MAP-kinase branch of insulin signaling generally regulates growth and mitogenesis and controls secretion of ET-1 in vascular endothelium.91 PI: phosphatidylinositol, GLUT: glucose transporter, MAP: mitogen-activated protein, ET:
endothelin.
여한다 (Fig. 1).12
또 인슐린은 교감신경을 자극하여 혈류 조절에도 관여할 수 있다. 건강한 사람에서 생리적 농도의 인슐린은 혈중 노 르에피네프린 농도와 교감신경의 활성도를 증가시킨다.13 국소 교감신경절제술을 시행한 경우, 인슐린에 의한 NO-의 존성 혈관확장은 더욱 신속히 일어난다.14 그러므로 인슐린 에 의한 교감신경 자극은 인슐린의 혈관확장 작용에 반대 될 수 있으나 인슐린의 베타-아드레날린성 활성화는 혈관 확장을 일으킬 수 있다.15 또 인슐린에 의한 신장의 Na 재흡 수 촉진은 세포 외 용액량을 증가시켜 개인에 따라서 고혈 압을 촉진시킬 수 있다.16 그러므로 인슐린은 정상인에 있어 서 혈압에 무시할 수 있을 정도이지만 혈류 역동학적으로 다수의 부정적 작용을 갖고 있다 (Fig. 2). 그러나 인슐린의 혈관수축작용과 혈관확장작용 사이에 균형이 깨어지면 인 슐린 저항성의 혈관 병태생리에 중요한 요인이 될 수 있다.
인슐린은 또 MAP-kinase-의존성 신호전달 경로를 통해 내피세포에서 vascular cell adhesion molecule (VCAM)-1과 E-selectin 생산을 자극한다.17
인슐린의 음경해면체평활근에서 혈관운동작용
인슐린의 음경해면체평활근에서 혈관운동작용에 대한 연구보고는 한 편 밖에 찾을 수 없다. 최근 Myung 등18의 보고에 의하면 인슐린은 농도-의존적으로 해면체평활근을 이완시켰고 내피세포를 제거하였을 때 이완반응이 완전히 소실되는 것으로 보아 인슐린은 다른 혈관에서처럼 음경해 면체평활근에 대한 내피세포-의존적 이완작용을 갖고 있는
것으로 보인다. 그러나 정상 발기반응에서 인슐린이 어느 정도 관여하는지에 대해서는 알려진 바 없다. 발기부전 유 병률은 노화와 함께 증가하며 인슐린-의존성 당뇨병 유병 기간이 길수록 증가한다.19 더욱이 젊은 인슐린-의존성 당 뇨병 환자와 젊은 일반 연령군 사이에 발기부전의 유병률 에는 차이가 없는 것으로 보아20 발기부전은 저인슐린혈증 에 의해서가 아니라 여러 가지 만성적 약화과정에 의해 발 생하는 것으로 추정된다. 그러므로 인슐린은 음경해면체평 활근 이완반응에 대해 부가적인 효과를 갖거나 정상 발기 조직에서 음경해면체의 기초 혈류를 유지하도록 하는 효과 를 갖고 있을 것으로 추정된다.
인슐린에 의한 NO-매개성 이완은 100%까지 관찰되지만 Myung 등18의 보고에 의하면 음경해면체평활근에서의 인 슐린에 의한 이완반응은 50%만 관찰되어 NO 활성화 이외 의 다른 경로의 활성화가 관여할 수 있다는 것을 시사한다.
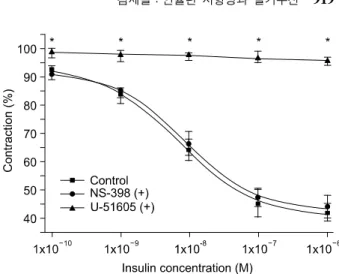
더욱이 인슐린에 의한 이완반응은 NOS 억제제인 N-nitro- L-arginine methyl ester (L-NAME) 또는 선택적 cyclooxy- genase (COX)-2 길항제 (NS-398)에 의해서는 거의 변화가 없었으나 비특이적 COX 억제제인 indomethacin과 prostacy- clin 합성 억제제 (U-51605)에 의해 유의하게 억제되었는데 (Fig. 3) 이것은 인슐린에 의한 음경해면체평활근 내피세포- 의존성 이완반응은 주로 COX-1 경로를 통해 중재된다는 것을 시사한다. 쥐의 장간막 동맥에서도 인슐린-매개성 혈 관확장이 prostacyclin에 의해 중재된다는 보고가 있다.21 또 인슐린에 의한 이완반응은 K+ 통로 차단제인 tetraethylam- monium (TEA) 또는 4-AP (aminopyridine)에 의해서는 억제 되지 않았다. 더욱이 L형 Ca2+ 전류는 prostacyclin에 의해서 는 감소되었으나 insulin에 의해서는 감소되지 않았다 (Fig.
Fig. 2. Pathway specific insulin resistance creates imbalance between prohypertensive and antihypertensive vascular actions of insulin exacerbated by compensatory hyperinsulinemia.92 SNS:
sympathetic nervous system, ET: endothelin, NO: nitric oxide.
Fig. 3. Effects of NS-398 (10μM) and U-51605 (10μM) on the insulin-induced relaxations (n=8). NS-398 produced no remarkable changes, but U-51605 almost completely inhibits the insulin- induced relaxation.18 *p<0.05.
4). 이상과 같은 결과는 인슐린은 음경해면체평활근의 내피 세포-의존성 이완을 일으키며, 이 같은 이완반응은 내피세 포에서 NO 생산에 추가해서 prostacyclin에 의한 L형 Ca2+
통로의 직접적 억제에 의해 일어나는 것으로 추정된다.
인슐린 저항성과 내피세포기능부전의 발생기전
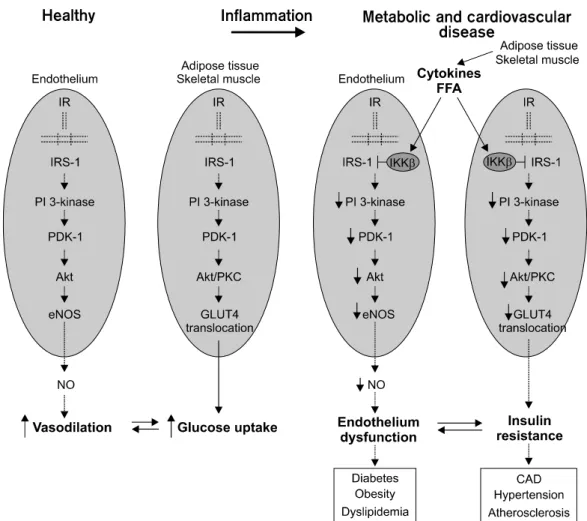
인슐린 저항성이란 인슐린의 양이 정상적으로 분비됨에 도 불구하고 당 소비를 촉진하는 인슐린의 대사작용에 대 한 감수성 및/또는 반응이 감소된 상태를 말한다. 인슐린 저항성을 유발하는 주된 원인은 인슐린 표적세포에서 인슐 린과 수용체가 결합하는 부위의 결함 및/또는 수용체와 결 합 이후의 인슐린 신호전달경로 장애에 있다. 인슐린 저항 성이 내피세포기능부전을 일으키는 일차적 기전은 고혈당 에 의한 당독성 (glucotoxicity), 고유리지방산혈증에 의한 지 독성 (lipotoxicity), 염증성 cytokines의 증가이며, 역으로 내
Fig. 5. Left, Parallel PI 3-kinase-dependent insulin-signaling pathways in metabolic and vascular tissues synergistically couple metabolic and vascular physiology under healthy conditions. IR: insulin receptor. Right, Parallel impairment in insulin-signaling pathways under pathological conditions contributes to synergistic coupling of insulin resistance and endothelial dysfunction.93 PI: phosphatidylinositol, eNOS:
endothelial nitric oxide synthase, PDK: phosphoinositide-dependent kinase, GLUT: glucose transporter.
Fig. 4. L-type calcium channel activities recorded in whole cell patch clamp mode (n=8). L-type Ca2+ currents are unaffected by insulin (10μM) treatment but prostacyclin (10μM) treatment sig- nificantly reduces the L-type Ca2+ currents.18 *p<0.05.
피세포기능부전이 발생하면 인슐린 저항성을 유발 내지 악 화시킬 수 있다 (Fig. 5).
1. 당독성
당뇨병에 동반되는 고혈당은 산화 스트레스 증가, advanced glycation end products (AGEs) 형성 및 hexosamine 생합성 경 로를 통한 이상 유출에 의해 인슐린 저항성을 유발한다.
고혈당은 정확한 기전은 밝혀져 있지 않지만 reactive oxygen species (ROS) 생산을 증가시킨다. ROS가 증가하면 여러 가지 serine/threonine kinases (JNK, PKCs, IKKβ)를 자 극하여 nuclear factor (NF)-κB와 activator protein (AP)-1을 활성화시켜 인슐린 저항성을 동반하고 결국 GLUT4 전위와 당 운반을 저해하게 된다.22-24 Superoxide가 증가하면 NO를 제거하고 peroxynitrite를 생산하여 NO의 생물학적 이용효 능을 감소시키고 혈관확장을 저해한다.25 게다가 ROS는 PKC-α, PKC-β, PKC-δ를 활성화하여 e-NOS, ET-1, vascu- lar endothelial growth factor (VEGF), transforming growth factor (TGF)-β 및 plasminogen activator inhibitor (PAI)-1의 유전자 발현과 NF-κB를 활성화하여 전염증 (proinflamma- tory) 유전자 발현을 증가시킨다.26 고혈당은 ROS 생산과 PKC 활성화를 통하여 IL-6 생산은 물론 내피세포의 자멸사 를 유발하고 intracellular adhesion molecule (ICAM), VCAM 및 E-selectin의 발현을 증가시킨다.27,28
고혈당과 산화 스트레스는 AGE 형성을 촉진한다.28,29 AGE는 IRS-1과 IRS-2의 인슐린에 의한 인산화를 억제하여 PI 3-kinase와 Akt의 활성장애를 일으키고 골격근에서 gly- cogen 합성효소의 활성도를 감소시킨다.29 더욱이 AGE는 ROS를 생산시키고 AGE 수용체를 통해 nicotinamide ade- nine dinucleotide phosphate (NADPH) oxidase를 활성화하여 산화 스트레스를 증가시킨다.30 AGE 수용체는 NF-κB를 활 성화하여 전염증 신호전달을 증가시킨다.31
Hexosamine 생합성경로 (hexosamine biosynthetic pathway;
HSP)를 통한 이상 유출은 고혈당이 인슐린 저항성을 유발 하는 또 다른 기전이다.32 Glutamine:fructose-6-phosphate ami- dotransferase (GFAT)는 이 경로의 속도조절 효소이며 GFAT 의 과발현은 인슐린 저항성을 유발하는 것으로 보고되었다.33 2. 지독성
당뇨병, 비만증, 이상지혈증을 포함한 인슐린 저항 상태 에서 관찰되는 유리 지방산 (free fatty acid; FFA) 치의 증가 는 FFA가 후천성 인슐린 저항성을 일으키는 중요한 요인이 라는 것을 뜻한다.34 FFA를 주입하면 NO-의존성 혈류는 물 론 인슐린-매개성 당섭취를 저해한다.35 고혈당과 마찬가지로 FFA치 증가는 산화 스트레스와 전염증 신호전달을 유발한다.
FFA는 사구체기능장애와 NADPH oxidase를 자극하여 내 피세포에서 ROS를 생산한다.36 ROS는 NO를 제거하고 per- oxynitrite를 생산하여 내피세포를 손상시킨다.37 FFA는 내 피세포 증식을 억제하고 자멸사를 증가시킨다.
FFA는 전염증 신호전달경로를 활성화하여 인슐린 저항 성을 일으킨다. FFA에 반응하여 ROS가 증가하면 NF-κB를 활성화시키고 이는 다시 TNF-α, IL-6 등의 다른 전염증 cytokines의 생산을 자극한다.38-40 TNF-α는 염증 신호전달 경로와 인슐린 신호전달경로 사이에서 corss talk의 중심적 역할을 하는 IKKβ 및 JNK를 활성화하며 IRS-1/2를 인산화 하여 인슐린 저항성을 유발한다.41 내피세포에 FFA를 처치 하면 인슐린-자극성 eNOS의 활성화와 IKKβ 활성화에 의 한 NO 생산을 저해하여 내피세포에서 인슐린 신호전달장 애를 유발한다.42
포화 지방산 유도산물인 ceramide는 Akt의 활성화와 GLUT4의 전위를 억제한다.43 Ceramide는 eNOS를 활성화시 키고 NO 생산을 증가시킨다.44 그러나 ceramide가 ROS를 과잉 생산하면 NO를 제거하고 peroxynitrite를 생산한다.45 그러므로 ceramide의 순 효과는 NO의 생물학적 이용 효능 을 감소시켜 내피세포기능부전을 유발하는 것이다.
3. 염증
전염증 신호전달이 인슐린 저항성에 관여할 가능성이 있 는 수많은 생화학적 기전이 있다. 가장 광범위하게 연구된 인슐린 저항성에 관여하는 전염증 cytokines은 TNFα이다.
TNFα는 JNK, IKKβ, IL-1 수용체-관련 kinase 등의 다양한 serine kinase를 활성화하고,46-48 IRS-1/2의 serine 인산화를 직 간접적으로 증가시켜 PI-3 kinase 및 Akt의 활성도를 떨어뜨 린다. 그러므로 전염증 cytokines는 인슐린 신호전달과 전사 를 조정하여 인슐린 저항성을 유발할 수 있다.
TBFα와 IL-1β 등의 전염증 cytokines는 JNK, IKKβ을 활 성화하고, 이어 AP-1과 NF-κB를 활성화하여49 인슐린-자극 성 eNOS의 활성화50와 발현을 억제한다.51 NF-κB는 ICAM, VCAM, E-selectin과 같은 유착분자의 발현을 자극하여 혈 관질환을 일으키기도 한다.52 중요한 사실은 NO는 내피세 포에서 NF-κB 활성도를 억제하고53 백혈구 유착분자인 VCAM, ICAM, E-selectin의 발현을 감소시키는 항염증성 작 용를 갖고 있다.54 그러므로 인슐린 저항성으로 야기된 기초 상태 하에서 NO의 생물학적 이용 효능 감소는 죽상경화증, 고혈압, 당뇨병과 같은 만성 질환의 추가적인 병인이 될 수 있다. TNFα는 C-reactive protein (CRP), IL-6 등의 다른 염증 성 단백질 발현을 자극할 수 있다. CRP는 혈관염증의 중요 한 표지자로서 CRP 혈중 농도는 심혈관계질환 위험과 상관 관계가 있다.55 CRP는 또 내피세포에서 전염증 cytokines 발
현을 조정하여 심혈관계질환을 직접 촉진할 수도 있다.56 CRP는 내피세포에서 eNOS 발현을 감소시키고57 angioten- sin 수용체 1형 발현을 상승시킨다.58 더욱이 CRP는 내피세 포의 ICAM, VCAM, E-selectin, MCP-1 발현을 증가시키고, ET-1의 발현을 증가시킨다.59,60 그러므로 CRP는 죽상경화 증과 내피세포기능부전의 직접적 병인이 될 수 있는 염증 성 표지자이다.
인슐린 저항성과 내피세포기능부전, 발기부전의 상관관계
인슐린 수용체, IRS-1, PI 3-kinase, PDK-1, Atk를 포함한 인슐린 신호전달경로는 골격근과 지방조직에서 GLUT4 전 위와 당섭취를 조절하며, 내피세포에서의 똑같은 경로가 eNOS 활성화와 NO 생산을 조절한다. 그러므로 대사조직에 서 인슐린 신호전달경로의 장애를 일으키는 요인은 인슐린 저항성을 일으키지만, 내피세포에서의 똑같은 인슐린 신호 전달 장애는 내피세포기능부전을 유발한다 (Fig. 5).61,62 이 러한 논리는 유전적 요인의 인슐린 저항성에도 적용된다.
실제로 IRS-1 유전자가 존재하지 않는 생쥐는 인슐린 저항 성 뿐만 아니라 내피세포-의존성 혈관확장장애를 동반한 고혈압이 따른다.63
NO 합성효소인 NOS는 L-arginine으로부터 NO 생산의 촉 매작용을 한다. 신경에서 분비되는 neuronal NOS (nNOS)와 혈관내피세포에서 분비되는 eNOS는 음경발기를 중재하지 만, nNOS가 주된 역할을 하는 것으로 널리 인식되어 왔다.
그러나 NO의 혈류-의존성 생산이 eNOS의 인산화 활성에 의한다는 증명은 발기능의 조절은 신경에서 분비되는 NO 에 의해 전적으로 또는 주도적으로 중재된다는 통상적 인 식에 이의를 제기한다. 즉, 음경혈관에서 혈류-유도성 전단 자극 (shear stress)이 PI 3-kinase를 자극하여 protein kinase (PK) B를 인산화하면 다시 eNOS를 인산화하여 NO를 생산 한다. 그러므로 nNOS는 음경해면체평활근 이완을 일으키 며, eNOS는 완전 발기의 달성과 유지에 관여할 수 있다.64 따라서 인슐린 저항성에 의해 내피세포기능부전으로 eNOS 생산장애가 발생하면 발기부전의 중요한 원인이 될 수 있 다. 정상 발기를 위해서 내피세포에서 eNOS 활성화와 NO 생산이 절대적으로 중요하므로 내피세포기능부전에 동반 되거나 내피세포기능부전을 일으키는 고혈압, 고혈당, 비만 증, 이상지혈증, 등의 심혈관계질환 위험인자가 동시에 발 기부전의 위험인자가 되는 것은 당연하다.
대사성 인슐린 저항성의 주요 양상은 PI 3-kinase-의존성 신호전달경로의 특수 장애가 있는 반면, Ras/MAP-kinase-의
존성 경로를 포함한 다른 인슐린 신호전달경로 분지는 영 향을 받지 않는 것으로 특징되어진다. 그러나 대사성 인슐 린 저항성이 발생하면 정상 혈당치를 유지하기 위하여 흔 히 보상성 고인슐린혈증이 동반된다. 고인슐린혈증은 혈관 과 기타 장소에서 MAP-kinase-의존성 신호전달경로를 지나 치게 가동시켜 인슐린의 PI 3-kinase와 MAP-kinase-의존성 기능 사이의 불균형을 초래한다. 내피세포에서 인슐린에 반응하여 PI 3-kinase 신호전달이 감소하고 MAP-kinase 신 호전달이 증가하면 내피세포기능부전의 특징인 NO 생산이 감소하고 ET-1 분비가 증가하게 된다. 그러므로 인슐린의 NO 생산을 자극하는 항고혈압성 효과는 인슐린 저항성 상 태에서는 감소한다. 동시에 인슐린 저항성 환자는 혈중 ET-1 농도가 증가하고 고인슐린혈증은 ET-1 분비를 증가시 킨다.65 내피세포기능부전과 NO 생산 감소에 의한 발기부 전은 PI 3-kinase와 MAP-kinase-의존성 기능 사이의 불균형 에 의한 ET-1 분비증가와 교감신경 활성화에 의하여 부가 적으로 발기능에 악영향을 미칠 수 있을 것이다. ET-1은 cross talk에 의해 IRS-1의 serine 활성화를 증가시켜 PI 3-kinase 활성도를 감소시키고 결과적으로 인슐린-자극성 GLUT4 전위를 방해한다.
Renin angiotensin system (RAS)의 조절장애는 고혈압을 일으키며, 반대로 angiotensin-converting enzyme (ACE) 억제 제와 angiotensin II type I receptor blockers (ARBs)는 본태성 고혈압 치료에 효과적이다. 또 ACE 억제제는 인슐린 감수 성을 개선시키고 심혈관계질환 환자에서 당뇨병 발생을 감 소시킨다. 이것은 대사 및 혈관 조직에서 angiotensin II 신호 전달과 인슐린 신호전달 사이의 cross talk을 억제하는 데서 비롯될 수 있다.66 내피세포를 angiotensin II로 처치하면 JNK와 MAP-kinase 경로를 활성화시켜 IRS-1의 serine 활성 화를 증가시키고, PI 3-kinase 활성도를 저해시키며, 내피세 포기능부전을 유발한다.67 또 angiotensin II로 angiotensin II 1형 수용체를 활성화하면 NADPH oxidase를 통해 ROS 생 산을 자극하고,68 ICAM-1 발현을 증가시키며,69 내피세포에 서 ET-1 분비를 증가시킨다.70 그러므로 RAS가 대사 및 혈 관조직에서 인슐린 신호전달 및 기타 경로 조절을 통해 인 슐린 저항성과 내피세포기능부전을 일으키는 데는 많은 직 간접 기전이 관여한다. Angiotensin II는 음경해면체평활근 의 긴장도를 유지하는 데도 강력한 조절자로 알려져 있다.71 Adiponectin은 지방세포에서 분비되는 가장 많은 adipo- kine이며 에너지 대사와 함께 인슐린 감수성을 조절하는 데 관여할 수 있다. 다른 adipokines와는 대조적으로 adiponectin 치가 증가하면 인슐린 감수성이 증가한다. 혈중 adiponectin 농도 감소는 비만증, 2형 당뇨병, 고혈압, 관상동맥질환 환 자에서 관찰되며, 경도의 만성 염증 상태를 동반한다.72
Adiponectin은 당섭취를 촉진하고 간에서 당 생산을 억제하 는 인슐린과 비슷한 대사작용을 갖고 있다.73 흥미롭게도 adiponectin은 내피세포에서 NO 생산을 자극하는 혈관작용 도 갖고 있으며,74 죽종형성성 및 항염증성 특성을 갖고 있 다.75 그러므로 adiponectin의 발현감소는 대사 및 혈관조직 사이의 cross talk에도 관여하여 대사성 및 심혈관계 질환에 서 인슐린 저항성과 내피세포기능부전을 유발할 수 있다.
당뇨병, 비만증, 이상지혈증 및 심혈관계 질환이 흔히 동 반되는 이유 중 하나는 다수의 스트레스 요인이 독립적으 로 인슐린 저항성과 내피세포기능부전을 일으키는 것이다.
인슐린 저항성과 성선기능저하증
성호르몬과 인슐린의 상호작용은 여성에서 광범위하게 보고되었다. 2형 당뇨병 여성에서 호르몬 보충요법은 인슐 린 저항성을 개선시킨다.76 한편 다낭성 난소증후군 여성과 비당뇨병성 비만 여성에서 볼 수 있는 남성호르몬과잉증은 인슐린 저항성과 상관있는 것으로 잘 알려져 있다. 암컷 쥐 에 테스토스테론 농도를 중정도 증가시키면 인슐린 감수성 의 현격한 감소를 초래한다.77 남성호르몬과잉증과 인슐린 저항성의 상관성에 대한 기전은 불명확하나 인슐린 저항상 태에서 나타나는 고인슐린혈증이 난소로 하여금 남성호르 몬을 생산토록 자극하는 것으로 믿고 있다.
남성에서 인슐린 저항성의 병인으로 남성호르몬의 역할 에 대해서는 거의 관심이 없다가 최근들어 대사증후군의 개념이 도입됨에 따라 남성호르몬의 역할에 대한 관심이 증가하고 있다. 저남성호르몬혈증은 관상동맥질환, 이상지 혈증, 복부비만, 고혈압, 등의 대사증후군의 위험인자에 동 반되며,78 대사증후군의 발생 원인인 인슐린 저항성은 명확 한 기전은 알 수 없지만 저남성호르몬혈증에 동반되고, 테 스토스테론은 대사증후군의 3가지 주된 위험인자인 인슐 린 감수성, 체질량지수, 혈압조절에 유익한 효과가 있다. 혈 중 남성호르몬 치와 공복 시 혈당치는 연령과 체질량지수 로 보정하더라도 역상관계가 있으며,79 당뇨병 남성에서 테 스토스테론 치는 연령과 체질량지수로 보정하더라도 대조 군보다 유의하게 낮다.80 성선기능저하증과 인슐린치의 연 관성은 치료 중인 전립선암 환자에서도 보고되었다.81 GnRn작용제 치료 또는 고환적출술을 받은 전립선암 환자 에서 공복 시 혈당치 및 인슐린치는 연령을 보정한 대조군 에 비해 증가하였다.
Massachusetts Male Aging Study82에 의하면 기저 총 및 유 리 테스토스테론과 sex hormone binding globulin (SHBG) 치 는 추적관찰에서 나중에 당뇨병을 일으킨 남성에서 유의하 게 낮았다. 이 같은 사실은 낮은 테스토스테론 치는 인슐린
저항성의 발생과 2형 당뇨병으로의 진행에 관여할 가능성 을 강력히 시사한다. 그러나 최근 보고에 의하면 비만증 및 당뇨 환자에서 유리 남성호르몬 치와 인슐린 감수성 사이 에 상관성이 없고83 생체이용가능 테스토스테론 치도 유의 한 차이가 없는 것으로 보아84 총 테스토스테론과 인슐린의 연관성은 SHBG와 혈중 인슐린 사이의 부정적 연관성으로 설명될 수 있다. 당뇨병 환자에서 총 테스토스테론과 SHBG 치는 당뇨병이 없는 대조군에 비해 유의하게 낮으나 유리 테스토스테론 치는 두 군 사이에 유의한 차이가 없는 것은 낮은 총 테스토스테론 치는 낮은 SHBG 치에 이차적 으로 발생하는 것을 시사한다.85 건강한 남성에서 갑작스럽 게 인슐린 농도가 상승하면 역시 SHBG 농도가 유의하게 감소하는 것이 관찰되었다.83 그러므로 낮은 SHBG 치는 고 인슐린혈증과 인슐린 저항성의 지표가 될 수 있다. 즉, SHBG 치가 낮은 남성은 대사증후군을 일으킬 위험이 증가 한다. 그러나 Pitteloud 등86의 보고에 의하면 혈중 테스토스 테론 치는 SHBG와 무관하게 인슐린 감수성과 상관성이 있 으므로 인슐린 저항성 환자에서 나타나는 저테스토스테론 혈증은 낮은 SHBG 농도로만으로는 설명할 수 없고 시상하 부-뇌하수체-성선 축에서 한 가지 또는 그 이상의 기능적 결함에서 비롯될 수 있으나 인슐린 감수성과 LH 생산량 또 는 GnRH 주사에 대한 LH 반응 사이에 상관성을 관찰할 수 없으므로 인슐린 저항성에 동반된 저테스토스테론혈증은 시상하부 또는 뇌하수체 결함에서 비롯된 것이 아니라 고 환의 라이디히 세포 결함에서 비롯된다고 하였다.
또 Pitteloud 등87은 체질량지수를 보정하면 테스토스테론 치와 인슐린 감수성 사이의 연관성이 더 이상 유의하지 않 으므로 비만증이 저테스토스테론혈증과 인슐린 감수성의 원인이며, 테스토스테론의 인슐린 감수성에 대한 영향은 체질량지수의 변화에 의해 중재된다고 하였다. 저테스토스 테론혈증은 내장 비만증에 걸리기 쉽게 하며 지방산 대사 조절장애를 일으켜 인슐린 저항성을 유발한다.88
최근에는 인슐린 저항성 환자에서 peroxisome proliferator- activated receptor-γ coactivator (PGC-1α)의 발현 감소와 oxidative phosphorylation (OXPHOS) 유전자의 하향조절이 발견됨에 따라 인슐린 저항성의 병인으로 사구체 기능의 역할에 대해 관심을 갖게 되었다.89,90
성선기능저하증과 고인슐린혈증 중 어느 것이 먼저 일어 나는지에 대해서는 명확하지 않다. 내당능 장애를 흔히 동 반하는 클라인펠더 증후군에서는 남성호르몬결핍증이 일 차적으로 일어나고 고인슐린혈증이 이차적으로 일어난다.
인슐린은 간에서 SHBG 생산을 억제하는 것으로 알려져 있 다. 고인슐린혈증과 인슐린 저항성이 일차적으로 일어나고 이어서 SHBG가 감소하며 이 때문에 남성호르몬 농도가 떨
어질 가능성도 있다.
결 론
인슐린 신호전달에는 2가지 서로 다른 주요 경로가 있다.
하나는 골결근에서 당섭취와 혈관내피세포에서 NO 생산과 혈관확장을 조절하는 PI 3-kinase-의존성 통로이다. 인슐린 은 음경해면체평활근에서도 내피세포-의존성 이완을 일으 키지만 NO 생산 이외에 prostacyclin에 의한 L형 Ca2+통로 를 직접 억제함으로써 나타나는 것으로 보고되었다. 다른 하나는 MAP-kinase 경로로서 성장과 전사를 조절하며 혈관 내피세포에서 endothelin-1을 분비하여 교감신경 활성도를 증가시키고 혈관수축을 일으킨다. 인슐린의 혈관이완작용 과 수축작용 사이에 균형이 깨어지면 인슐린 저항성의 혈 관 병태생리에 중요한 요인이 될 수 있다. 고혈당, 유리 지 방산 농도의 증가, 전염증 상태는 인슐린 저항성과 내피세 포기능부전의 원인이 되며, 역으로 내피세포기능부전이 발 생하면 인슐린 저항성을 유발 내지 악화시킬 수 있다. 정상 발기를 위해서는 내피세포에서의 eNOS 활성화와 NO 생산 이 절대적으로 중요하므로 내피세포기능부전에 동반되거 나 내피세포기능부전을 일으키는 고혈압, 고혈당, 비만증, 이상지혈증, 등의 심혈관계질환 위험인자가 동시에 발기부 전의 위험인자가 되는 것은 당연하다.
테스토스테론은 남성에서 인슐린 감수성의 중요한 조절 자로 작용하는 많은 증거가 있으므로 남성호르몬결핍증은 인슐린 저항상태를 유발할 수 있을 것이며, 앞으로는 성선 기능저하증이 대사증후군의 구성요소로 추가될 것으로 생 각된다.
REFERENCES
1. Alberti KG, Zimmet PZ. Definition, diagnosis and classifi- cation of diabetes mellitus and its complications: Part 1: diag- nosis and classification of diabetes mellitus. Provisional report of a WHO consultation. Diabet Med 1998;15:539-53 2. Western Pacific Regional Office of the World Health Orga-
nization, The International Obesity Task Force: The Asia- Pacific perspective: redefining obesity and its treatment. Sid- ney: Health Communications Australia, 2000. http://www. obe- sityasiapacific.com
3. Hellmich M, Evers T, Kubin M, Merchant S, Lehmacher W, Engelmann U, et al. Development and validation of a risk score for somatic erectile dysfunction: combined results from three cross-sectional surveys. Eur Urol 2005;48:495-502 4. Kim JH, Shim BS, Hong YS. The relating factors of metabolic
syndrome to benign prostatic hyperplasia. Korean J Urol 2005;
46:1046-50
5. Salitel AR, Kahn CR. Insulin signaling and the regulation of glucose and lipid metabolism. Nature 2001;414:799-806 6. Nystrom FH, Quon MJ. Insulin signalling: metabolic pathways
and mechanism for specificity. Cell Signal 1999;11:5630-74 7. Zeng G, Qoun MJ. Insulin-stimulated production of nitric
oxide is inhibited by wortmannin: direct measurement in vascular endothelial cells. J Clin Invest 1996;98:894-8 8. Zeng G, Nystrom FH, Ravichandran IV, Cong IN, Kirby M,
Mostowski H, et al. Roles for insulin recptor. PI 3-kinase and Akt in insulin-signaling pathways related to production of nitric oxide in human vascular endothelial cells. Circulation 2000;101:1539-45
9. Montagnani M, Ravichandran IV, Chen H, Esposito DL, Quon MJ. Insulin receptor substrate-1 and phosphoinositide-depen- dent kinase-1 are required for insulin-stimulated production of nitric oxide in endothelial cells. Mol Endocrinol 2002;16:
1931-42
10. Montagnani M, Chen H, Barr VA, Quon MJ. Insulin-stim- ulated activation of eNOS is independent of Ca2+ but requires phosphorylation by Aky at Ser (1179). J Biol Chem 2001;
276:30392-8
11. Grubb B, Snarr JF. Effect of flow rate and glucose con- centration on glucose uptake rate by the rat limb. Proc Soc Exp Biol Med 1977;154:33-6
12. Potenza MA, Marasciulo FL, Chieppa DM, Brigiani GS, Formoso G, Quon MJ, et al. Insulin resistance in spon- taneously hypertensive rats is associated with endothelial dysfunction characterized by imbalance between NO and ET-1 production. Am J Physiol Heart Circ Physiol 2005;289:H813- 22
13. Anderson EA, Hoffman RP, Balmon TW, Sinkey CA, Mark AL. Hyperinsulinemia produces both sympathetic neural acti- vation and vasodilation in normal humans. J Clin Invest 1991;
87:2246-52
14. Sartori C, Trueb L, Nicod P, Scherrer U. Effects of sym- pathectomy and nitric oxide synthase inhibition of vascular actions of insulin in humans. Hypertension 1999;34:586-9 15. Creager MA, Liang CS, Coffman JD. Beta adrenergic-medi-
ated vasodilator response to insulin in the human forearm. J Pharmacol Exp Ther 1985;235:709-14
16. Vierhapper H. Effect of exogenous insulin on blood pressure regulation in healthy and diabetic subjects. Hypertension 1985;
7:II49-53
17. Montagnani M, Golovchenko I, Kim I, Koh GY, Goalstone ML, Mundhekar AN, et al. Inhibition of phosphatidylinositol 3-kinase enhances mitogenic actions of insulin in endothelial cells. J Biol Chem 2002;277:1794-9
18. Myung SC, Keum EM, Park SY, Lee MY, Kim SC. Vaso- motor action of insulin on the rabbit normal cavernous smooth muscle. Eur J Pharmacol 2006;536:142-7
19. Klein R, Klein BE, Lee KE, Moss SE, Cruickshanks KJ.
Prevalence of self-reported erectile dysfunction in people with long-term IDDM. Diabetes Care 1996;19:135-41
20. Kuboki K, Jiang ZY, Takahara N, Ha SW, Igarashi M, Yamauchi T, et al. Regulation of endothelial constitutive nitiric oxide synthase gene expression in endothelial cells and in vivo: a specific vascular action of insulin. Circulation 2000;
101:676-81
21. Miller AW, Tulbert C, Puskar M, Busija DW. Enhanced endothelin activity prevents vasodilation to insulin in insulin resistance. Hypertension 2002;40:78-82
22. Furukawa S, Fujita T, Shimabukuro M, Iwaki M, Yamada Y, Nakajima Y, et al. Increased oxidative stress in obesity and its impact on metabolic syndrome. J Clin Invest 2004;114:
1752-61
23. Gao Z, Hwang D, Bataille I, Lefevre M, York D, Quon MJ, et al. Serine phosphorylation of insulin receptor substrate 1 by inhibitor kappa B kinase complex. J Biol Chem 2002;277:
48115-21
24. Hirosumi J, Tuncman G, Chang L, Gorgun CZ, Uysal KT, Maeda K, et al. A central role for JNK in obesity and insulin resistance. Nature 2002;420:333-6
25. Salt JP, Morrow VA, Brandie FM, Connell JM, Petrie JR.
High glucose inhibits insulin-stimulated nitric oxide production without reducing endothelial nitric-oxide synthase Ser1177 phosphorylation in human aortic endothelial cells. J Biol Chem 2003;278:18791-7
26. Quagliaro L, Piconi L, Assaloni R, Da Ros R, Maier A, Zuodar G, et al. Intermittent high glucose enhances ICAM-1, VCAM-1 and E-selectin expression in human umbilical vein endothelial cells in culture: the distinct role of protein kinase C and mitochondrial superoxide production. Atherosclerosis 2005;183:259-67
27. Quagliaro L, Piconi L, Assaloni R, Martinelli L, Motz E, Ceriello A. Intermittent high glucose enhances apoptosis re- lated to oxidative stress in human umbilical vein endothelial cells: the role of protein kinase C and NAD(P)H-oxidase acti- vation. Diabetes 2003;52:2795-804
28. Espesito K, Nappo F, Margella R, Giugliano D, Giugliano F, Ciotoal M, et al. Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: role of oxi- dative stress. Circulation 2002;106:2067-72
29. Nishikawa T, Edelstein D, Du XL, Yamagishi S, Matsumura T, Kaneda Y, et al. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycemic damage.
Nature 2000;404:787-90
30. Wautier MP, Chappey O, Corda S, Stern DM, Schmidt AM, Wautier JL. Activation of NADPH oxidase by AGE links oxidant stress to altered gene expression via RAGE. Am J Physiol Endocrinol Metab 2001;280:E685-94
31. Hofmann MA, Drury S, Fu C, Qu W, Taguchi A, Lu Y, et al. RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides. Cell
1999;97:889-901
32. Buse MG. Hexosamines, insulin resistance, and the com- plications of diabetes: current status. Am J Physiol Endocrinol Metab 2006;290:E1-8
33. Veerababu G, Tang J, Hoffman RT, Daniels MC, Hebert LF Jr, Crook ED, et al. Overexpression of glutamine: fructose- 6-phosphate amidotransferase in the liver of transgenic mice results in enhanced glycogen storage, hyperlipidemia, obesity, and impaired glucose tolerance. Diabetes 2000;49:2070-8 34. Schulman GI. Cellular mechanisms of insulin resistance. J Clin
Invest 2000;106:171-6
35. Steinberg HO, Baron AD. Vascular function, insulin resistance and fatty acids. Diabetologia 2002;45:623-34
36. Inoguchi T, Li P, Umeda F, Yu HY, Kakimoto M, Imamura M, et al. High glucose level and free fatty acid stimulate reactive oxygen species production through protein kinase C-dependent activation of NADPH oxidase in cultured vas- cular cells. Diabetes 2000;49:1939-45
37. O'Donnell VB, Freeman BA. Interactions between nitric oxide and lipid oxidation pathways: implications for vascular disease.
Circ Res 2001;88:12-21
38. Ajuwon KM, Spurlock MI. Palmitate activates the NF-kappaB transcription factor and induces IL-6 and TNFalpha expression in 3T3-1,1 adipocytes. J Nutr 2005;135:1841-6
39. Jove M, Planavila A, Laguna JC, Vazquez-Carrera M.
Palmitate-induced interleukin 6 production is mediated by protein kinase C and nuclear factor kappaB activation and leads to glucose transporter 4 down-regulation in skeletal mus- cle cells. Endocrinology 2005;146:3087-95
40. Boden G, She P, Mozzoli M, Cheung P, Gumireddy K, Reddy P, et al. Free fatty acids produce insulin resistance and activate the proinflammatory nuclear factor- κB pathway in rat liver.
Diabetes 2005;54:3458-65
41. Gao Z, Zhang X, Zuberi A, Hwang D, Quon MJ, Lefevre M, et al. Inhibition of insulin sensitivity by free fatty acids re- quires activation of multiple serine kinases in 3T3-L1 adipo- cytes. Mol Endocrinol 2004;18:2024-34
42. Kim F, Tysseling KA, Rice J, Pham M, Haji L, Gallis BM, et al. Free fatty acid impairment of nitiric oxide production in endothelial cells is mediated by IKKbeta. Arterioscler Thromb Vasc Biol 2005;25:989-94
43. Chavez JA, Knotts TA, Wang LP, Li G, Dobrowsky RT, Florant GL, et al. A role for ceramide, but not diacylglycerol, in the antagonism of insulin signal transduction by saturated fatty acids. J Biol Chem 2003;278:10297-303
44. Igarashi J, Thatte HS, Prabbakar P, Golan DE, Michel T.
Calcium-independent activation of endothelial nitric oxide synthase by ceramide. Proc Natl Acad Sci USA 1999;96:
12583-8
45. Li H, Junk P, Huwiler A, Burkhardt C, Wallerath T, Pfeilschifter J, et al. Dual effect of ceramide on human en- dothelial cells: induction of oxidative stress and transcriptional
upregulation of endothelial nitric oxide synthase. Circulation 2002;106:2250-6
46. Nguyen MT, Satoh H, Favelyukis S, Babendure JI, Imamura T, Shodio JI, et al. JNK and tumor necrosis factor-alpha mediate free fatty acid-induced insulin resistance in 3T3-L1 adipocytes. J Biol Chem 2005;280:35361-71
47. Gao Z, Zuberi A, Quon MJ, Dong Z, Ye J. Aspirin inhibits serine phosphorylation of insulin receptor substrate I in tumor necrosis factor-treated cells through targeting multiple serine kinases. J Biol Chem 2003;278:24944-50
48. de Alvaro C, Teruel T, Hernandez R, Lorenzo M. Tumor necrosis factor alpha produces insulin resistance in skeletal muscle by activation of inhibitor kappaB kinase in a p38 MAPK-dependent manner. J Biol Chem 2004;279:17070-8 49. Li X, Commane M, Jiang Z, Stark GR. IL-1-mediated
NFkappa B and c-Jun N-terminal kinase (JNK) activation di- verge at IL-1 receptor-associated kinase (IRAK). Proc Natl Acad Sci USA 2001;98:4461-5
50. Kim F, Gallis B, Corson MA. TNF-alpha inhibits flow ad insulin signaling leading to NO production in aortic endothelial cells. Am J Physiol Cell Physiol 2001;280:C1057-65 51. Anderson HD, Rahmutula D, Gardner DG. Tumor necrosis
factor-alpha inhibits endothelial nitric-oxide synthase gene pro- motor activity in bovine aortic endothelial cells. J Biol Chem 2004;279:963-9
52. Min JK, Kim YM, Kim SW, Kwon MC, Kong YY, Hwang IK, et al. TNF-related activation-induced cytokine enhances leukocyte adhesiveness: induction of ICAM-1 and VCAM-1 via TNF receptor-associated factor and protein kinase C-de- pendent NF-kappaB activation in endothelial cells. J Immunol 2005;175:531-40
53. Peng HB, Libby P, Liao JK. Induction and stabilization of I kappa B alpha by nitric oxide mediates inhibition of NF-kappa B. J Biol Chem 1995;270:14214-9
54. De Caterina P, Libby P, Peng HB, Thannickal VJ, Rajavahisth TB, Gimbrone MA Jr, et al. Nitric oxide decreases cytokine- induced endothelial activation. Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflam- matory cytokines. J Clin Invest 1995;96:60-8
55. Saito M, Ishimitsu T, Minami J, Ono H, Ohrui M, Matsuoka H. Relations of plasma high-sensitivity C-reactive protein to traditional cardiovascular risk factors. Atherosclerosis 2003;
167:73-9
56. Jialal I, Devaraj S, Venugopal SK. C-reactive protein: risk marker or mediator in atherothrombosis? Hypertension 2004;
44:6-11
57. Venugopal SK, Devaraj S, Yuhanna I, Shaul P, Jialal I.
Demonstration that C-reactive protein decreases eNOS ex- pression and bioactivity in human aortic endothelial cells.
Circulation 2002;106:1439-41
58. Wang CH, Li SH, Weisel RD, Fedak PW, Dumont AS, Szmitko P, et al. C-reactive protein upregulates angiotensin
type I receptors in vascular smooth muscle. Circulation 2003;
107:1783-90
59. Pasceri V, Cheng JS, Willerson JT, Yeh ET. Modulation of C-reactive protein-mediated monocyte chemoattractant protein-1 induction in human endothelial cells by anti-athrosclerosis drugs. Circulation 2001;103:2531-4
60. Pasceri V, Willerson JT, Yeh ET. Direct proinflammatory effect of C-reactive protein on human endothelial cells. Circu- lation 2000;102:2165-8
61. Jiang ZY, Lin YW, Clemont A, Feener EP, Hein KD, Igarashi M, et al. Characterization of selective resistance to insulin signaling in the vasculature of obese Zucker rats. J Clin Invest 1999;104:447-57
62. Kuboki K, Jiang ZY, Takahara N, Ha SW, Igarashi M, Yamauchi T, et al. Regulation of endothelial constitutive nitric oxide synthase gene expression in endothelial cells and in vivo: a specific vascular action of insulin. Circulation 2000;
101:676-81
63. Federici M, Pandolfi A, De Filippis EA, Pellegrini G, Menghini R, Lauro D, et al. G972R IRS-1 variant impairs insulin regulation of endothelial nitric oxide synthase in cultured human endothelial cells. Circulation 2004;109:399- 405
64. Burnett AL. Novel nitric oxide signaling mechanisms regulate the erectile response. Int J Impot Res 2004;16(Suppl 1):S15-9 65. Piatti PM, Monti LD, Conti M, Baruffaldi L, Galli L, Phan CV, et al. Hypertriglyceridemia and hyperinsulinemia are potent inducers of endothelin-1 release in humans. Diabetes 1996;45:316-21
66. Folli F, Kahn CR, Hansen H, Bouchie JL, Feener EP. Angio- tensin II inhibits insulin signaling in aortic smooth muscle cells at multiple levels. A potential role of serine phospho- rylation in insulin/angiotensin II crosstalk. J Clin Invest 1997;
100:2158-69
67. Andreozzi F, Laratta E, Sciacqua A, Perticone F, Sesti G.
Angiotensin II impairs the insulin signaling pathway pro- moting production of nitric oxide by inducing phosphorylation of insulin receptor substrate-1 on Ser312 and Ser616 in human umbilical vein endothelial cells. Circ Res 2004;94:1211-8 68. Rajagopalam S, Kurz S, Munzel T, Tarpey M, Freeman BA,
Griendling KK, et al. Angiotensin II-mediated hypertension in the rat increases vascular superoxide production via membrane NADH/NADPH oxidase activation. Contribution to alterations of vasomotor tone. J Clin Invest 1996;97:1916-23
69. Pastore I, Tessitore A, Martinotti S, Toniato E, Alesse E, Bravi MC, et al. Angiotensin II stimulates intercellular adhesion molecule-1 (ICAM-1) expression by human vascular endothel- ial cells and increases soluble ICAM-1 release in vivo. Cir- culation 1999;100:1646-52
70. Desideri G, Ferri C, Bellini C, De Mattia G, Santucci A.
Effects of ACE inhibition on spontaneous and insulin-stim- ulated endothelin-1 secretion: in vitro and in vivo studies.
Diabetes 1997;46:81-6
71. Park JK, Kim SZ, Kim SH, Park YK, Cho KW. Renin angiotensin system in rabbit corpus cavernosum: functional characterization of angiotensin II receptors. J Urol 1997;158:
653-8
72. Yu JG, Javorschi S, Hevener AL, Kruszynska YT, Norman RA, Sinha M, et al. The effect of thiazolidinediones on plasma adiponectin levels in normal, obese, and type 2 diabetic sub- jects. Diabetes 2002;51:2968-74
73. Goldstein BJ, Scalia R. Adiponectin: a novel adipokine linking adipocytes and vascular function. J Clin Endocrinol Metab 2004;89:2563-8
74. Chen H, Montagnami M, Funahashi T, Shimomura I, Quon MJ. Adiponectin stimulates production of nitric oxide in vas- cular endothelial cells. J Biol Chem 2003;278:45021-6 75. Yamauchi T, Hara K, Kubota N, Terauchi Y, Tobe K, Froguel
P, et al. Dual roles of adiponectin/Acrp30 in vivo as an anti- diabetic and anti-atherogenic adipokine. Curr Drug Targets Immune Endocr Metabol Disord 2003;3:243-54
76. Borissova AM, Tankova T, Kamenova P, Dakovska L, Kova- cheva R, Kitilov G, et al. Effect of hormone replacement therapy on insulin secretion and insulin sensitivity in post- menopausal diabetic women. Gynecol Endocrinol 2002;16:
67-74
77. Holmang A, Larsson BM, Brzezinsak Z, Bjorntorp P. Effects of short term testosterone exposure on insulin sensitivity of muscles in female rats. Am J Physiol 1992;262:E851-5 78. Malkin CI, Pugh PJ, Iones TH, Channer KS. Testosterone for
secondary prevention in men with ischemic heart disease.
Ouart J Med 2003;96:521-9
79. Simon D, Preziosi P, Barrett-Connor F, Roger M, Saint-Paul M, Nahoul K, et al. Interrelation between plasma testosterone and plasma insulin in healthy adult men: The Telecom Study.
Diabetologia 1992;35:173-7
80. Barrett-Connor E. Lower endogenous androgen levels and dyslipidemia in men with non-insulin-dependent diabetes mellitus. Ann Intern Med 1992;117:807-11
81. Smith MR, Lee H, Nathan DM. Insulin sensitivity during combined androgen blockade for prostate cancer. J Clin Endo- crinol Metab 2006;91:1305-8
82. Stellato RK, Feldman HA, Hamdy O, Horton FS, McKinlay JB. Testosterone, sex hormone-binding globulin, and the devel- opment of type 2 diabetes in middle-aged men: prospective
results from the Massachusetts Male Aging Study. Diabetes Care 2000;23:490-4
83. Abate N, Haffner SM, Garg A, Peshock RM, Grundy SM. Sex steroid hormones, upper body obesity, and insulin resistance.
J Clin Endocrinol Metab 2002;87:4522-7
84. Simon D, Charles MA, Nahoul K, Orssaud G, Kremski J, Hully V, et al. Association between plasma total testosterone and cardiovascular risk factors in healthy adult men: The Telecom Study. J Clin Endocrinol Metab 1997;82:682-5 85. Andersson B, Marin P, Lissner I, Vermeulen A, Bjorntorp P.
Testosterone concentrations in women and men with NIDDM.
Diabetes Care 1994;17:405-11
86. Pitteloud N, Hardin M, Dwyer AA, Valassi E, Yialamas M, Elahi D, et al. Increasing insulin resistance is associated with a decrease in Leydig cell testosterone secretion in men. J Clin Endocrinol Metab 2005;90:2636-41
87. Pitteloud N, Mootha VK, Dwyer AA, Hardin M, Lee H, Eriksson KF, et al. Relationship between testosterone levels, insulin sensitivity, and mitochondrial function in men. Diabe- tes Care 2005;28:1636-42
88. Roden G, Jadali F, White J, Liang Y, Mozzoli M, Chen X, et al. Effects of fat on insulin-stimulated carbohydrate metabo- lism in normal men. J Clin Invest 1991;88:960-6
89. Mootha VK, Lindgren CM, Eriksson KF, Subramanian A, Silhag S, Lehar J, et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes. Nat Genet 2003;34:267-73
90. Patti ME, Butte AJ, Grunkhorn S, Cusi K, Berria R, Kashyap S, et al. Coordinated reduction of genes of oxidative metab- olism in humans with insulin resistance and diabetes: potential role of PGC1 and NRF1. Proc Natl Acad Sci USA 2003;
100:8466-71
91. Kim JA, Montagnani M, Koh KK, Quon MJ. Reciprocal rela- tionships between insulin resistance and endothelial dysfunc- tion: molecular and pathophysiological mechanisms. Circula- tion 2006;113:1888-904
92. Montagnani M, Quon MJ. Insulin action in vascular endothe- lium: potential mechanism linking insulin resistance with hy- pertension. Diabetes Obes Metab 2000;2:285-92
93. Kim JA, Koh KK, Quon MJ. The union of vascular and metabolic actions of insulin in sickness and in health. Arte- riosclerosis Thromb Vasc Biol 2005;25:889-91