접수: 2016년 1월 15일, 승인: 2016년 4월 29일 연락처: 정수연, 14051, 경기도 안양시 동안구 부림로
169번길 30 6층 한국의약품안전관리원
Tel: (02) 2172-6730, Fax: (02) 2172-6702 E-mail: sooyoun@drugsafe.or.kr
Correspondence to: Soo-Youn Chung, MD, PhD
Korea Institute of Drug Safety and Risk Management, 6th Fl., 30, Burim-ro 169beon-gil, Dongan-gu, Anyang-si, Gyeonggi- do 14051, Korea
Tel: +82-2-2172-6730, Fax: +82-2-2172-6702 E-mail: sooyoun@drugsafe.or.kr
국외 지역의약품안전센터의 최근 운영 현황
한국의약품안전관리원
김수진ㆍ김인혜ㆍ김현정ㆍ정수연
Current Operating Status in the Foreign Regional Pharmacovigilance Centers
Su-Jin Kim, MS, In-Hye Kim, BS, Hyeon-Jeong Kim, MS and Soo-Youn Chung, MD, PhD Korea Institute of Drug Safety and Risk Management, Gyeonggi-do, Korea
Spontaneous reporting of adverse drug reactions (ADRs) is the basis of pharmacovigilance (PV). Many countries operate monitoring centers for collecting and evaluating ADR reports, espacially regional PV centers (RPVCs).
Most of RPVCs collect ADR reports, do causality assessment between suspected drugs and events, and then re- port safety information to national PV centers (NPVCs) or national regulatory authorities (NRAs). Also they offer consultations to patients and operate education and training programme for healthcare professionals to expand the PV activities. The number of RPVCs has been gradually increased globally. There are 31 RPVCs in France, 5 in United Kingdom, over 400 in China, 150 in India, and 27 in Korea in 2014. In this paper we examined current operation characteristics in the foreign RPVCs as well as their PV activities. Then, we proposed the direction for further development of operating PRVCs in Korea. (JPERM 2016;8:1-7)
Key Words: Adverse drug reactions (ADRs); Pharmacovigilance (PV); Regional pharmacovigilance center (RPVC);
National PV centers (NPVCs); National regulatory authorities (NRAs)
서 론
약물감시(Pharmacovigilance, PV)란 약물의 유해작용 또는 약물관련 문제의 탐지·평가·해석·예방에 관한 과학적 연구 및 활동을 말한다.1) 약물감시의 목적은 의약품을 사용하는 환자를 보호하고 안전성을 증진시키는데 있으며, 의약품의 이익과 위해성을 효과적으로 평가하기 위한 정보를 제공함 으로써 공공보건프로그램을 지원하는 데 있다.2) 약물감시를 위해서는 자발적 부작용 보고가 가장 근간이 되지만, 많은 제약이 있어 체계적인 약물감시 활동을 위해 전략적으로 약
물감시 조직을 구성하여 운영하는 국가가 많아지고 있다.3) 이러한 약물감시 조직으로 지역의약품안전센터(regional phar- macovigilance center, RPVC, 이하 지역센터)가 운영되고 있다.
우리나라는 1988년 자발적부작용보고제도가 시작되었으 나, 보고건수는 미미한 수준이었다. 이후 식품의약품안전처 (이하 식약처)에서는 부작용 보고 활성화를 위해 인터넷으 로 신고할 수 있도록 웹페이지를 마련하고, 소수의 병원과 제약회사를 지정하기 시작하였다.4) 2006년 식약처는 시범사 업으로 대학병원 3곳을 지역센터로 지정하였고, 2007년 6개 소, 2008년 9개소, 2009년 15개소, 2011-2012년 20개소, 2013
(A) (B)
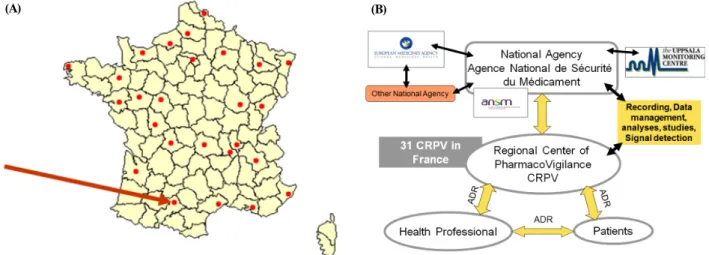
Figure 1. Distribution Status of the Regional Pharmacovigilance Centers and the Operating System of Pharmacovigilance in France.
(A) Distribution Status of the Regional Pharmacovigilance Centers of France. (B) The Operating System of Pharmacovigilance in France. <출처> 2013년 웁살라모니터링센터 국제약물감시교육과정의 발표자료 중 일부 발췌(French PharmacoVigilance System.
François Montastruc).
년 22개소로 지역센터 지정수를 점차 확대하였다. 2013년에 는 식약처에서 관리하던 지역센터 사업이 한국의약품안전 관리원(이하 의약품안전원)으로 이관되었으며, 지역센터의 지정수 증가와 함께 국내 부작용 보고건수도 급증하여 2013 년 한 해 동안 약 18만 건이 보고되었다. 2014년 기준 총 27 개의 지역센터가 운영 중이며 대학병원 중심의 권역센터 25 개소와 전국 보건소 및 약국과 네트워크를 갖춘 중앙센터 2 개소로 구성되어 있다. 이로써, 우리나라 지역센터는 다양 한 보고 채널을 구축함으로써 보다 포괄적인 약물감시망을 확보하고 있다.5) 지역센터에서는 각 센터별 전산시스템 내 에 부작용 보고체계를 구축하여 운영하고 있으며, 기관 내 에서 보고된 부작용 정보(이하, 원내보고)와 인근 지역에 위 치한 병의원 및 약국 등에서 보고된 부작용 정보(이하, 지역 보고)를 수집하고 있다. 수집된 부작용에 대하여 인과성 평 가를 수행한 후, 의약품안전원으로 보고하고 있으며, 보고 자들에게 보고 사례에 대한 인과성 평가결과를 제공하는 환 류체계를 운영하고 있다. 약물부작용에 대한 상담활동도 수 행하고 있으며, 의사, 약사 및 간호사 등 보건의료전문가와 환자를 대상으로 부작용 보고 독려를 위한 교육·홍보 활동 을 수행하고 있다. 또한, 식약처에서 지정한 성분 또는 취약 계층 등을 대상으로 집중모니터링 활동을 수행하고 있다.6) 최근 들어 국내외 약물감시 분야에서 급격한 변화가 나타 나고 있는데, 프랑스, 영국 등 유럽 뿐만 아니라, 중국 및 인 도에서도 지역센터 확대지정을 통한 약물모니터링 활동이 더욱 활성화되고 있는 추세를 보이고 있다. 신뢰도 높은 안 전정보를 생산하기 위해 자발적 부작용 보고자료의 질관리 가 강조되고 있으며,7) 병원 전자의무기록 자료 등을 활용한 능동적 약물감시체계도 운영되고 있다.8) 나아가 환자와 의
약전문가 간 상호교류를 통한 위해최소화 활동이 강조되고 있다.9)
이러한 일련의 약물감시 활동에는 지역센터가 근간이 되 고 있으며, 보다 효율적이고 효과적인 약물감시체계를 도입 하기 위해서 지역센터 운영 현황을 점검해 볼 필요가 있다.
본 논문에서는 프랑스, 영국, 중국 및 인도의 지역센터 운영 현황를 조사하고 특징을 파악하여 국내 지역센터 운영에 있 어 보다 발전적인 방안을 모색해보고자 한다.
본 론 1. 프랑스
프랑스는 1973년 의사협회와 제약협회의 후원으로 6개 지역센터가 창설된 이래 1994년 프랑스 국립의약품건강제 품안전청(the French National Agency for Medicines and Health Products Safety, Agence nationale de sécurité du médicament et des produits de santé, ANSM)으로 관리 업무 가 이관되었다. 프랑스의 지역센터 운영방식은 지방분권방 식과 중앙집권방식의 혼합형이다. 프랑스의 지역센터 활동 목적은 의약품의 잠재적 위해성 또는 발생된 부작용에 대한 모니터링, 평가 및 예방활동을 수행하고 적절한 의약품 사 용을 도모하는데 있다. 지역사회를 대상으로 약물감시 관련 정보를 제공하며, 의약전문가들을 대상으로 약물감시 활동 참여에 필요한 교육 및 훈련을 제공하고 있다. 또한 오남용 및 의약품 품질문제 등과 관련하여 의약전문가들에게 정보 를 제공하는 역할도 수행하고 있다. 2014년 기준으로 프랑 스 26개 지역에서 총 31개 지역센터가 운영 중이며, 지역센 터는 해당 지역의 부작용을 수집하여 ANSM에 보고하고
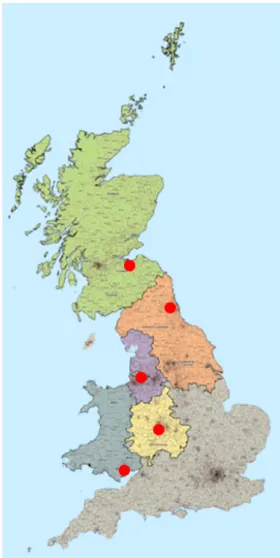
Figure 2. Distribution Status of the Regional Pharmacovigilance Centers in United Kingdom. <출처> 2011년 MHRA 발표자료 중 일부 발췌(Yellow Card Reporting–Engaging with patients.
Mick Foy).
ANSM에서는 평가 및 의사결정을 하며 유럽의약품청(Euro- pean Medicines Agency, EMA), 다른 국가 및 국제약물부작 용모니터링센터인 세계보건기구-웁살라모니터링센터(WHO- Uppsala Monitoring Center, WHO-UMC)와 주기적으로 안전 정보를 교류하고 있다(그림 1). 각 지역센터의 소재지, 연락 처 및 센터 책임자는 국립의약품건강제품안전청의 웹페이 지(http://ansm.sante.fr)를 통해 확인할 수 있다.10) 프랑스의 지역센터는 수집된 부작용 자료를 토대로 연구활동도 활발 히 수행하고 있다. B. Lebrun-Vignes 등은 프랑스약물감시데 이터베이스(the French Pharmacovigilance Database, FPD)와 의약품 품목 허가권자들이 매년 프랑스 의약품 관리기관 (the French Drugs Agency)으로 보고하는 자료를 기반으로 테트라사이클린계의 부작용 보고자료의 특징과 판매량에 대해 분석하였다.11) E. Bondon-Guitton 등은 17년간 프랑스 의 한 지역센터에서 수집한 부작용 자료를 토대로 약물 유 발성 파킨슨 증후군에 대한 분석도 실시한 바 있다.12)
2. 영국
영국의 지역센터는 1980년대 병원을 기반으로 웨스트미 들랜즈, 북부, 웨일스 및 머지 지역에 설립되었으며, 황색카 드센터(Yellow Card Centres, YCCs)로 불린다. 황색카드센터 는 지역사회의 부작용 보고를 증진시키고 교육과 관련 활동 정보를 제공하기 위한 목적으로 운영되고 있다. 2002년 10 월에 스코틀랜드 지역을 담당하는 센터가 설립되고, 북부 지역을 담당하던 센터는 요크셔까지 담당 구역을 확대하였 다. 2014년 기준으로 황색카드센터는 북서부(리버풀), 웨스 트미들랜즈(버밍엄), 스코틀랜드(에든버러), 웨일스(카디프) 와 북부 및 요크셔(뉴캐슬)에 있다(그림 2). 각 지역센터의 소재지, 연락처 및 센터 책임자는 의약품및의료기기관리국 (Medicines and Healthcare Products Regulatory Agency, MHRA)의 웹페이지(https://www.gov.uk/government/organisations/medicines- and-healthcare-products-regulatory-agency)를 통해 확인할 수 있 다.13) MHRA은 황색카드체계(Yellow Card Scheme, YCS)와 함께 황색카드센터를 운영하고 있다. 기존에는 황색카드센 터에서 부작용 접수를 위한 별도의 시스템을 운영하기도 하 였으나 보고자들의 보고 대상기관에 대한 혼돈을 방지하기 위하여 보고 접수처(신고처)를 MHRA로 일원화하였다. 특 히 황색카드센터는 의약전문가를 대상으로 보고시스템에 대한 인지도를 제고시키는 데 중요한 역할을 하고 있다고 평가되고 있으며, MHRA로 접수된 모든 부작용 신고건은 지역별 담당센터에 전달이 되어야 한다고 강조되고 있다.14) MHRA에서 발간한 ‘2008-2012년 약물부작용 보고 동향 (Trends in adverse drug reaction (ADR) reporting 2008-2012)’에 따르면, 2008-2012년간 황색카드체계를 통해 보고된 부작용 중 약 50%(33,368건)는 황색카드센터에서 보고된 것이었으
며, 해당 지역별로 수집된 부작용 현황을 정리하고 있다.15) 황색카드센터는 병원이 중심이 되어 주로 의사와 약사가 팀 을 이뤄 활동하고 있으며, 보통 약국과 함께 의약정보서비 스를 제공하고 있다. 지역사회의 부작용 보고를 독려하며, MHRA를 대신하여 부작용 보고건을 추적조사하고 있다. 황 색카드센터는 의약전문가 및 보건의료분야 전공 학생 등을 대상으로 부작용 보고 교육 및 훈련을 주기적으로 수행하며 환자의 부작용 보고 인식도 제고를 위한 활동을 펼치고 있 다. 또한 약물감시 및 약물부작용과 관련하여 연구도 수행 하고 있다. 북서부 지역을 담당하고 있는 황색카드센터에서 는 보고현황 및 활동현황을 연보로 발간하여 홈페이지에 게 시하고 있다. 2010/2011년 연보에서는 참여연구원, 해당기간 동안의 부작용 보고동향(총 보고건수, 보고자 정보, 다빈도 보고 성분명, 집중모니터링 성분의 보고건수 및 중대사례
(A) (B)
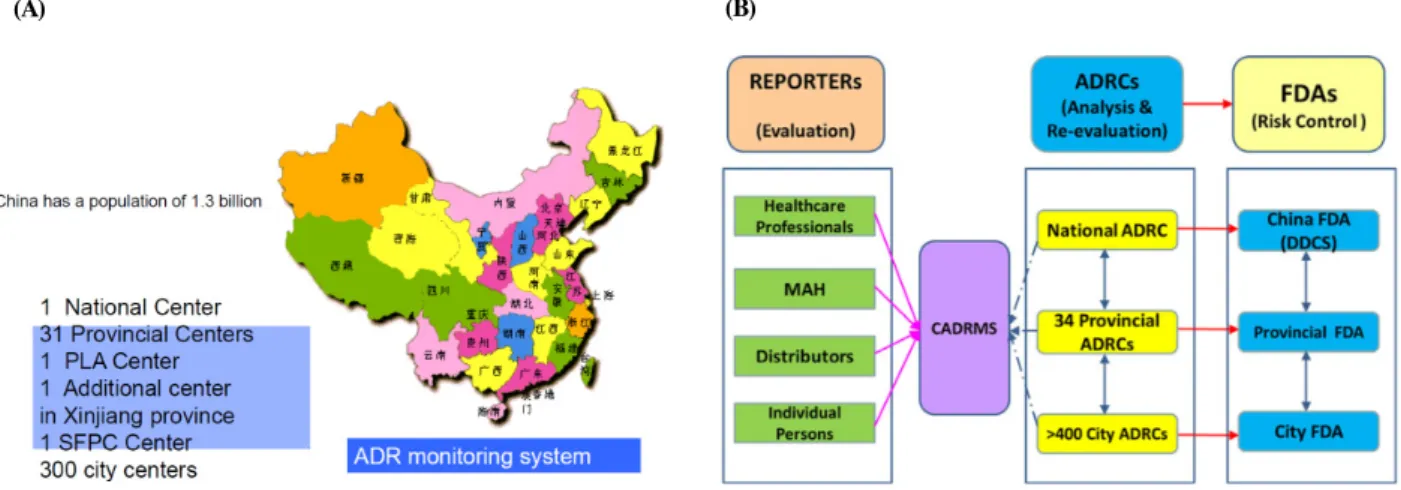
Figure 3. Distribution Status of the Regional Pharmacovigilance Centers and the Operating System of Pharmacovigilance in China.
(A) Distribution Status of the Regional Pharmacovigilance Centers of China. (B) The Operating System of Pharmacovigilance in China.
<출처> (A) 2013 AHC pharmacovigilance workshop 발표자료 중 일부 발췌(Current status of Pharmacovigilance and Risk Control in China. Zhang Li, Cheng Gang); (B) Li Zhang, Lisa Y. L. Wong, Ying He, Ian C. K. Wong. Pharmacovigilance in China: Current Situation, Successes and Challenges. Drug Saf 2014;37:765-70.
등), 부작용 보고 교육 및 훈련 활동, 약물감시 관련 출간물 및 연구사례를 상세하게 소개하고 있다.16,17)
3. 중국
중국은 1988년 중국 보건부(China Ministry of Health, MOH) 에서 ‘약물부작용 모니터링 프로젝트(ADR monitoring project)’
를 추진하여 베이징, 상하이 등 지역에 있는 10개의 의료기 관이 모니터링 활동에 참여하기 시작하였다. 이후, 1989년 에 85개 의료기관으로 확대되었다.18) 1988년에 국가약물부 작용모니터링센터(the National ADR Monitoring Center)가 설 립되었으며, 1998년에 국제약물감시프로그램에 참여하기 시작하였다. 중국의 국가약물부작용모니터링센터는 지역센 터에서 보고되는 부작용을 취합하여 국가식품약품감독관리 국(China food and drug administration, CFDA)과 중국 보건부 에 보고하고, 세계보건기구-웁살라모니터링센터와 주기적으 로 안전정보에 대해 교류하고 있다. CFDA 산하에는 국가약 물부작용센터가 있으며, 총 5개의 부서로 구성되어 있다.19) 2014년 기준으로 중국의 국가약물부작용모니터링센터는 34 개소의 성단위 지역센터(provincial center)와 400개소 이상의 시단위 지역센터(municipal center)가 연계되어 있다(그림 3).
2009년 약 63만 건에서 2012년 약 120만 건으로 최근 들어 부작용 보고건수가 급증하고 있다. 시단위 지역센터에서 제 조업체 및 의약전문가 등으로부터 부작용을 수집하고, 인과 성 평가를 수행하며 특히 중대한 부작용의 경우 성단위 지 역센터 및 국가약물부작용모니터링센터를 거쳐 CFDA로 신 속 보고되고 있다. 중대한 부작용의 경우 성단위 지역센터 와 국가약물부작용모니터링센터가 함께 조사하여 확인하는 활동도 수행하고 있다. Wang Yue 등은 장쑤 지역센터(the
Jiangsu Province Drug Adverse Reaction Monitoring Center)의 활동 사례를 소개한 문헌에 따르면, 중국의 성단위 지역센 터에서는 부작용 수집 뿐만 아니라 실마리정보 탐색 및 평 가 활동도 수행하고 있다. 2003년 짱쑤 지역센터에서는 보 다 의미있는 약물부작용 모니터링 활동을 위해 중의학 (traditional Chinese medicine, TCM) 중 주사제의 안전성에 대 한 후향적 모니터링 연구에 참여하기도 하였다. 이 연구를 통해 약물부작용 모니터링 방법론에 대한 다양한 시도되었 다.20) 2010년 기준으로 전체 부작용 보고건 중 약 10-15%가 중의학의 보고건이다.21)
4. 인도
인도는 1986년에 처음으로 지역센터 12개소를 구성하여 약물부작용모니터링 프로그램을 운영하기 시작하였으나 성 공적이지 못했다. 1997년 국제약물감시프로그램에 참여하기 시작하였으며, 특히 세계보건기구는 뭄바이(KEM Hospital, Mumbai)와 엘리가르(JLN Hospital, Aligarh Muslim University) 에 특수 센터(WHO special centers)를 두고 활동하기로 하였 으나 역시 성공적이지 못했다. 이런 이유로 2005년에 세계 보건기구 및 세계은행의 후원을 통해 국가약물감시프로그 램(National Pharmacovigilance Program, NPVP)이 운영되기 시작하였으며, 중앙약물표준관리기관(Central Drugs Standard control Organisation, CDSCO)의 국가약물감시자문위원회(the National Pharmacovigilance Advisory Committee)가 중심이 되 어 활동하였다.19) 2009년에는 전인도의약연구소(All India Institute of Medical Sciences, AIIMS)와 중앙약물표준관리기 관간 공동워크숍을 통해 새로운 틀의 운영방식을 구상하기 도 하였으며, 이후 국가약물감시프로그램은 인도약물감시
(B) (A)
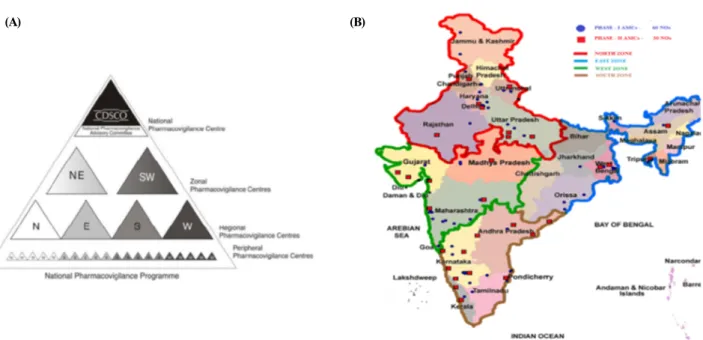
Figure 4. The Construction and Distribution Status of Regional Pharmacovigilance Centers in China. (A) The Construction of Regional Pharmacovigilance Centers in India. (B) Distribution Status of the Regional Pharmacovigilance Centers of India. <출처> (A) The Construction of Regional Pharmacovigilance Centers in India. [cited 2014 Nov 12] Available from: http://www.
aiims.edu/aiims/departments/pharmacology/npvp.htm. [assessed 2014 Nov 12]; (B) 2013년 웁살라모니터링센터 국제약물감시교육과 정의 발표자료 중 일부 발췌(Pharmacovigilance Programme of India (PvPI): Achievements and Challenges Ahead. Indian Pharmacopoeia Commission).
프로그램(the Pharmacovigilance Programme for India, PvPI)으 로 명칭이 변경되었다.22) 2010년 7월에 전인도의약연구소와 중앙약물표준관리기관이 함께 인도약물감시프로그램 운영 을 주관하였으며, 2011년 4월에 국가약물감시 협력센터인 인도약전위원회(the Indian Pharmacopoeia Commission, IPC)로 모든 업무가 이관되었다. 인도의 지역센터(ADR Monitoring Centre, AMC)는 부작용 수집과 수집된 정보를 추적하는 데 있어 중요한 역할을 수행하며, 의학협회에서 승인받은 의과 대학, 병원, 또는 의학관련 기관이어야 지역센터로 활동할 수 있다. 2010년 22개소로 시작하여, 2011년에 60개소가 지 정되었고, 2012년에는 30개소가 추가되어 총 90개소의 지역 센터가 운영되었다. 이후 60개소가 추가 지정되면서 2014년 기준으로 총 150개소의 지역센터가 운영되고 있다.23) 2013 년까지 보고된 VigiBase 집계기준으로 미국(55%), 일본(6%), 독일(5%), 이탈리아(5%), 한국(4%), 캐나다(3%)에 이어 인도 가 7위(2%)를 차지하고 있다.24) 각 지역센터의 소재지, 연락 처 및 센터 책임자는 인도약전위원회의 웹페이지(http://www.
ipc.gov.in/PvPI/pv_home.html)를 통해 확인할 수 있다. 지역센 터 구성은 인도약전위원회를 중심으로 남서 및 북동 지역을 담당하는 센터, 동부, 서부, 남부, 북부 지역을 담당하는 센 터와 더 하위 지역을 담당하는 센터의 총 4단계 피라미드 구조로 되어 있다(그림 4).
결론 및 제언
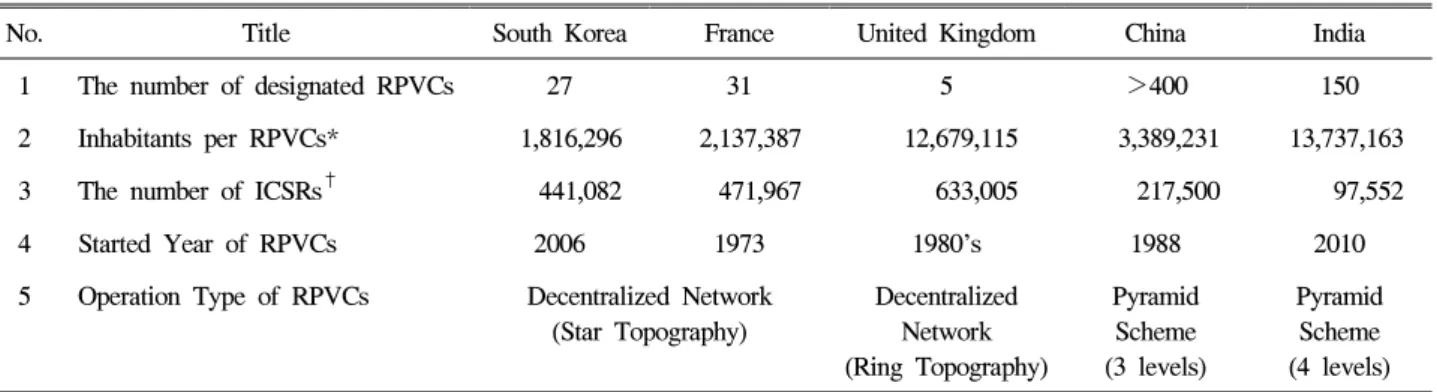
우리나라는 2006년 지역센터를 도입하게 되면서 프랑스 의 지역센터 운영체계를 참조하였다. 따라서 우리나라의 지 역센터 운영방식은 프랑스와 유사하게 지방분권방식 및 중 앙집권방식이 혼합된 형태를 띠고 있다. 프랑스의 지역센터 는 부작용수집 및 인과성 평가활동 외에도 오남용 및 의약 품 품질문제 등에 대한 안전정보 제공활동도 수행하고, 수 집된 부작용 보고자료를 활용한 모니터링 연구활동도 수행 하고 있었다. 영국의 경우는 각 지역센터별로 담당하고 있 는 지역사회에서 수집되는 부작용 중 중대한 부작용을 추적 조사하는 활동을 수행하고 있었으며, 자체 수집되는 보고건 에 대한 동향을 분석하여 뉴스레터 또는 연보 형태로 발간 하고 있었다. 중국은 3단계의, 인도는 4단계의 피라미드 형 태로 지역센터를 운영하고 있는 것이 특징적이다. 중국의 성단위 지역센터에서는 국가약물감시센터와 함께 중대한 부작용에 대한 조사하는 활동을 함께 수행하고 있었고, 중 의학에 대한 안전성 모니터링 활동도 수행하고 있다. 인도 의 경우 지역센터로 참여하는 절차 및 지역센터로서 활동할 경우의 장점을 소개하면서 지역센터로 참여할 것을 적극적 으로 권장하고 있었으며, 최근에 지정된 기관수가 대폭 상 승하고, 부작용 보고건수도 이와 함께 증가하는 경향을 보 이고 있다(표 1).
No. Title South Korea France United Kingdom China India 1 The number of designated RPVCs 27 31 5 >400 150 2 Inhabitants per RPVCs* 1,816,296 2,137,387 12,679,115 3,389,231 13,737,163 3 The number of ICSRs† 441,082 471,967 633,005 217,500 97,552 4 Started Year of RPVCs 2006 1973 1980’s 1988 2010 5 Operation Type of RPVCs Decentralized Network
(Star Topography)
Decentralized Network (Ring Topography)
Pyramid Scheme (3 levels)
Pyramid Scheme (4 levels) RPVCs: Regional Pharmacovigilance Centers. <출처>*국제 인구수 산출 기준 [cited 2014 Nov 12]. Available from: https://
www.cia.gov/library/publications/the-world-factbook/ rankorder/2119rank.html [assessed 2014 Nov 12]. †VigiBase 보고건수 (1987~2014년 11월 13일) [cited 2014 Nov 18]. Available from: https://vigilyze.who-umc.org/ [assessed 2014 Nov 18].
Table 1. The Operating Status of Foriegn Regional Pharmacovigilance Centers in 2014
국외 지역센터의 최근 운영 현황 조사 결과, 국내 지역센 터와 가장 큰 차이점은 관할 지역의 부작용 사례를 관리하 며 중대한 부작용에 대한 추적조사를 수행한다는 점이었다.
물론 국내 지역센터에서도 관할 지역의 부작용 사례를 관리 하고 있으나, 여전히 병원내 발생하는 부작용 사례 보고에 치우쳐 있고, 중대한 부작용에 대한 보고율도 저조하다. 또 한 중국과 인도 등 최근 지역센터의 개소수가 크게 증가하 고 있었는데, 이는 활동에 대한 재원 지원보다는 공공보건 의료기관의 네트워크를 적극 활용하고 있었다. 그러나 이는 국가별 보건정책 및 의약품관리정책과 조직 구성의 차이점 에 기인한 것으로, 국내 지역센터 운영 시 재원 지원없이 체 계적인 부작용 수집관리는 어려운 실정이다.
최근 우리나라는 보다 적극적으로 부작용 사례를 수집하 고 전국적인 안전성 모니터링 체계를 구축하기 위하여 지역 센터 운영방식에 변화를 두고 있다. 이는 바로 종합병원으 로 구성된 권역센터와 전국 보건소 및 약국의 네트워크를 갖춘 중앙센터의 두 가지 운영체계를 두고 있는 점이다. 권 역센터에서는 주로 기관 내ㆍ외의 의약전문가를 대상으로 부작용 보고방법, 보고자료의 충실도 제고 및 약물과 부작 용간 인과성 평가사례 교육 등 활동을 하고 있으며, 병원 전 자의무기록 자료를 활용한 다양한 모니터링 활동과 연구 활 동이 수행되고 있다. 중앙센터 중 국립중앙의료원은 전국 보건소 및 지방의료원과, 대한약사회는 전국 시ㆍ도 지부의 약사회 및 약국과 네트워크를 구축·확대시키고 있다. 이러 한 우리나라만의 고유한 지역센터 운영모델을 마련하여 부 작용 보고자료의 양적 확대 뿐만 아니라 질적 향상도 이룰 수 있을 것으로 기대된다. 국외 선진사례를 살펴볼 때, 특히 부작용 수집사례에 대한 모니터링 강화 및 중대한 부작용에 대한 추적조사가 이루어져야 할 필요가 있다. 결핵, 백신 등 공공보건의료사업과 접목시켜 약물감시 범위를 확대시켜야 하겠으며, 환자에게 접근성이 높은 약국과의 협력 강화를
통해 의약품 사용과오 주의 안내 등 안전정보 제공 확대 및 커뮤니케이션을 더욱 강화할 수 있을 것으로 기대된다. 이 를 통해 지역센터를 기반으로 우리나라의 약물감시 운영체 계가 더욱 견고해지고, 보다 신뢰도 높은 안전정보 생산을 통해 정책 수행의 근거 제공에 크게 기여할 수 있을 것으로 기대된다.
REFERENCES
1. 대한약물역학위해관리학회. 약물역학. 서울: 서울대학교출 판문화원; 2011. p. 74.
2. Introduction of pharmacovigilance purpose in WHO. [cited 2014 Oct 1]. Available from: http://www.who.int/medicines/
areas/quality_safety/safety_efficacy/pharmvigi/en/ [assessed 2014 Oct 1].
3. Lee JH. Characteristics of Symposia of Regional Pharmacovi- gilance Centers. JPERM 2010;3:32-35.
4. Choi NK, Park BJ. Adverse Drug Reaction Surveillance System in Korea. J Prev Med Public Health 2007;40:278-84.
5. Introduction of regional pharmacovigilance center in Korea.
[cited 2014 Aug 14]. Available from: https://www.drugsafe.
or.kr/iwt/ds/ko/community/ EgovCenterGuide.do [assessed 2014 Aug 14].
6. 지역의약품안전센터 운영 우수사례집 [cited 2014 Aug 14].
Available from: https://www.drugsafe.or.kr/iwt/ds/ko/bbs/EgovBbs.
do?bbsId=BBSMSTR_000000000024&nttId=499&pa- geIndex=2&searchCnd=0&searchWrd= [assessed 2014 Aug 14]
7. Park BJ. ADR reporting, it’s time to grow up qualitatively.
[cited 2014 Aug 14]. Available from: http://koperm. drline.
net/Board/BoardView.asp?SiteModuleSrno=1&Category=&
Mode=&Key=&KeyWord=&PageSize=10&mainSrno=948 [assessed 2014 Aug 14].
8. Choi NK, Lee JY, Park BJ. Recent international initiatives of drug safety management. JKMA 2012;55:819-26.
9. Priya Bahri. Public pharmacovigilance communication a process calling for evidence-based, objective-driven strategies. Drug Saf 2010;33:1065-79.
10. France ANSM. [cited 2014 Oct 1]. Available from:
http://ansm.sante.fr/Declarer-un-effet-indesirable/Pharma- covigilance/Centres-regionaux-de-pharmacovigilance/(offset)/4 [assessed 2014 Oct 1].
11. B. Lebrun-Vignes, C. Kreft-Jais, A. Castot, O. Chosidow, the French Network of Regional Centers of Pharmacovigilance.
Comparative analysis of adverse drug reactions to tetracy- clines: results of a French national survey and review of the literature. BR J Dermatol 2012;166:1333-41.
12. Emmanuelle Bondon-Guitton, Santiago Perez-Lloret, Haleh Bagheri, Christine Brefel, Olivier Rascol, Jean-Louis Mon- tastruc. Drug-induced parkinsonism: a review of 17 years’ ex- perience in a regional pharmacovigilance center in France.
Movement disorders. 2011;26:2226-31.
13. Introduction of the Yellow Card Scheme in UK. [cited 2016 Apr 29]. Available from: https://www.gov.uk/report-problem- medicine-medical-device [assessed 2016 Apr 29].
14. Report of an Independent Review of Access to the Yellow Card Scheme [cited 2013 Sep 5]. Available from: http://www.
mhra.gov.uk/home/groups/comms-ic/documents/websiteresources/
con2015008.pdf [assessed 2013 Sep 5].
15. Trends in UK spontaneous Adverse Drug Reaction (ADR) re- porting between 2008-2012. [cited 2016 Apr 29]. Available from: http://webarchive.nationalarchives.gov.uk/20141205150130/
http://www.mhra.gov.uk/home/groups/pl-p/documents/websi- teresources/con408250.pdf [assessed 2016 Apr 29].
16. Yellow Card Centres North West [cited 2014 Nov 12].
Available from: http://www.yccnorthwest.nhs.uk/ [assessed 2014 Nov 12].
17. Yellow Card Centres Scotland [cited 2014 Nov 12]. Available from: http://www.yccscotland.scot.nhs.uk/publications/Pages/
Journal-Articles-regarding-Adverse-Drug-Reactions.aspx [assessed 2014 Nov 12].
18. Wenmin Du, Jeff J. Guo, Yonghua Jing, Xing Li, Christina M. L. Kelton. Drug safety surveillance in China and other countries: a review and comparison. Value Health 2008;2:
S130-6.
19. Biswas P. Pharmacovigilance in Asia. J Pharmacol Pharmaco- ther 2013;4:S7-19.
20. Wang Yue, Xu Hou-Ming, Li Ming, Guo Yan, Yu Bo-Yang, Zeng Fan-Dian. Regional pharmacovigilance practice in China. JRS 2008;20:51-6.
21. Li Zhang, Jingbo Yan, Xinmin Liu, Zuguang Ye, Xiaohui Yang, Ronald Meyboom, Kelvin Chan, Debbie Shaw, Pierre Duez. Pharmacovigilance practice and risk control of Traditional Chinese Medicine drugs in China: current status and future perspective. J Ethnopharmacol 2012;140:519-25.
22. Introduction of Pharmacovigilance Programme of India [cited 2014 Oct 1]. Available from: http://www.aiims.edu/aiims/departments/
pharmacology/npvp.htm [assessed 2013 Sep 5].
23. ADR Monitoring Centres under Pharmacovigilance Pro- gramme of India [cited 2014 Oct 1]. Available from:
http://www.ipc.gov.in/PvPI/pv_amcs.html [assessed 2013 Sep 5].
24. Newsletter of Indian Pharmacopoeia Commission [cited 2014 Oct 1]. Available from: http://www.ipc.gov.in/PvPI/Newsletter_
April_issue.pdf [assessed 2013 Sep 5].