바나나(Musa acuminate Colla) 껍질 추출물의 항비만 활성
김령현․이승철․김교남 경남대학교 바이오융합학부
Effect of Banana (Musa acuminate Colla) Peel Extract on the Anti-Adipogenic Activity in 3T3-L1 Adipocytes
Ryeong-Hyeon Kim, Seung-Cheol Lee, and Gyo-Nam Kim School of Bioconvergence, Kyungnam University
ABSTRACT Banana (Musa acuminate Colla) is widely grown in tropical regions. Banana peel is normally discarded and thrown away as waste. Although several studies have reported the nutritional value of bananas, the biological activities of banana peel are relatively unknown. In this study, we investigated the anti-adipogenic activities of water and ethanol extracts of banana peel (BPE-W and BPE-E, respectively) and banana peel matured for 2 days at room temperature (MBPE-W and MBPE-E, respectively) on 3T3-L1 adipocytes. To evaluate the effects of the extracts on 3T3-L1 adipogenesis, the cells were treated with 10 and 100 μg/mL of the extracts from day 2 to day 6. Treatment with 100 μg/mL of extracts significantly inhibited lipid accumulation in 3T3-L1 adipocytes. The BPE-W and BPE-E showed strong anti-adipogenic activities compared to MBPE-W and MBPE-E. Furthermore, 3T3-L1 adipocytes treated with the extracts down-regulated the transcription factor CCAAT/enhancer binding protein beta (c/EBPβ) and perox- isome proliferator-activated receptor gamma (PPAR-γ) expressions. Taken together, our results indicate that the hydrol- ysis of components such as tannins in banana peel during maturation could affect the anti-adipogenic activities of banana peel extracts. The results of the study suggest a potential role for banana peel extracts as ingredients in the development of functional foods for obesity.
Key words: adipogenesis, banana peel, maturation, obesity, 3T3-L1
Received 31 August 2020; Accepted 8 November 2020
Corresponding author: Gyo-Nam Kim, School of Biconvergence, Kyungnam University, Gyeongnam 51767, Korea,
E-mail: gnkim@kyungnam.ac.kr
Author information: Ryeong-Hyeon Kim (Graduate student), Seung- Cheol Lee (Professor), Gyo-Nam Kim (Professor)
서 론
비만이란 체내에 과도하게 지방이 축적된 상태를 일컫는 다. 비만을 유발하는 원인은 다양한데 대표적으로 중추신경 계의 기능 조절 장애 및 내분비계의 호르몬 조절 이상 등의 유전적 원인과 서구화된 식습관, 음주, 신체활동 부족과 같 은 후천적 원인에 의해 비만이 발생될 수 있다. 비만은 고혈 압, 당뇨병 그리고 심혈관계 질환 등의 대사성 질환 발생위 험을 높일 수 있어 현대사회의 큰 문제점으로 지적되고 있 다. 비만은 섭취 열량의 감소, 체지방 분해 촉진 및 지질합성 억제 등을 통해 예방할 수 있으며, 최근에는 지방세포의 분 화(adipogenesis) 및 성장 억제, 지질대사 억제와 같은 분자 생물학적 조절을 통한 비만을 예방하고자 하는 다양한 시도 가 보고되고 있다(Choi와 Kim, 2014; Lee 등, 2014).
Adipogenesis란 전 지방세포(preadipocytes)에서 지방
세포(adipocytes)로 분화하는 과정을 의미하며 중성지방 형 태의 과잉 에너지 저장을 유도하는 주요한 과정이다(Nao- waboot 등, 2012). Adipogenesis는 지방 조직의 성장 및 발달에 중요하며 비만과 밀접한 관련이 있음이 보고되었다 (Kang 등, 2012; Min 등, 2014). 따라서 adipogenesis를 효 율적으로 억제하거나 지연시키는 것은 비만 예방에 있어 중 요하다. Zhang 등(2012)은 포도 껍질 추출물 처리가 3T3- L1 세포의 adipogenesis 억제를 통해 비만 예방에 기여한 다고 보고하였고, Ejaz 등(2009)은 curcumin이 3T3-L1 세 포의 분화 과정 중 중성지방 축적을 억제했다고 보고하였다.
Adipogenesis 과정은 다양한 전사인자 및 단백질 발현을 통해 조절된다고 알려져 있다(Yang 등, 2014). CCAAT/en- hancer binding protein family(C/EBPs)와 peroxisome proliferator-activated receptors γ(PPARγ)는 특히 adi- pogenesis에 있어 중추적인 역할을 수행하는 것으로 잘 알 려져 있다(Kim 등, 2013a). C/EBPs는 총 6가지 형태의 이 성질체가 보고되었고, 그중에서 α, β 그리고 δ 형태의 C/
EBP가 adipogenesis의 조절에 있어 중요하게 작용한다고 보고되었다(White와 Stephens, 2010). 지방세포의 분화는 인슐린 등과 같은 호르몬 및 성장인자들에 의해 유도되고 초기 과정에서 C/EBPβ와 C/EBPδ가 발현되어 adipogene-
요하다.
최근 안전성이 확보된 천연물 소재 등을 활용하여 adipo- genesis를 억제하고 비만을 예방하고자 하는 다양한 노력이 시도되고 있다(Kim과 Jang, 2014). 바나나(Musa acumi- nate Colla)는 열대 및 아열대 지방에서 널리 재배되고 있는 과일로(Kim 등, 2013b; Kim과 Youn, 2013) 일반적으로 과육이 총 중량의 약 60~70%, 껍질이 약 30~40%를 차지 하고 있다. 최근 보고된 관련 연구로는 바나나의 지질 과산 화 억제 활성(Krishnan과 Vijayalakshimi, 2005) 및 항산화 활성(Someya 등, 2002), 혈액 내 콜레스테롤 저하, 제2형 당뇨병 조절(Cressey 등, 2014) 등이 보고되었다. 바나나 껍질에는 탄닌, 플라보노이드, 페놀 화합물, 잔토필 그리고 섬유소와 같은 생리활성 물질이 풍부하게 함유되어 있음에 도 불구하고 바나나의 껍질은 대부분 폐기되고 있다(Oberoi 등, 2012). 바나나 껍질에 대한 연구로는 항균 활성과 항산 화 활성(Matook와 Fumio, 2005; González-Montelongo 등, 2010) 등에 대한 연구가 일부 수행되었으나 미미한 실정 이다.
본 연구에서는 신선한 바나나 껍질과 2일 동안 자연 숙성 시킨 바나나 껍질을 물과 에탄올로 추출하고, 3T3-L1 세포 모델을 이용하여 지방축적 억제 활성을 평가하였다. 더 나아 가 바나나 껍질 추출물이 adipogenesis와 밀접하게 관련된 전사인자의 발현에 미치는 영향을 분석하고, 폐기물로 다량 버려지고 있는 바나나 껍질의 항비만 기능성 소재로서의 가 능성에 대해 고찰하였다.
재료 및 방법
실험재료
본 연구에 사용된 바나나는 신세계백화점 마산점(Chang- won, Korea)에서 구입하였으며, 후숙된 바나나 껍질 추출 물은 실온에서 2일 동안 자연 숙성하여 제조하였다. Dul- becco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS), bovine calf serum(BCS), antibiotics cock- tail(penicillin-streptomycin), phosphate-buffered sal- ine(PBS), RNase-free water는 Welgene Inc.(Gyeong- san, Korea)에서 구입하였다. Oil Red O(ORO), dexame- thasone(DEX), 3-isobutyl-1-methylxanthine(IBMX), in- sulin, chloroform은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였다. Dimethyl sulfoxide(DMSO) 및 formaldehyde는 Bio Basic Inc.(Markham, Canada)에 서 구입하였다. TRIzol®은 Life Technologies(Carlsbad, CA, USA)에서 구매하였으며, Maxime PCR PreMix(i-
바나나 껍질과 2일간 후숙된 바나나 껍질을 물과 에탄올 로 추출하였다. 후숙 기간에 따른 항산화 활성을 평가하여 바나나 껍질의 후숙 기간은 2일로 정하였다. 각 시료 5 g에 물과 에탄올을 각각 200 mL씩 가하여 25°C, 100 rpm에서 24시간 동안 추출하였고, Whatman No. 3 여과지를 사용하 여 여과하였다. 여과한 추출액은 37°C에서 감압농축한 후 DMSO에 녹여 -20°C에서 보관하면서 이후 실험에 사용하 였다. 바나나 껍질 물 추출물(banana peel extract by water, BPE-W), 바나나 껍질 에탄올 추출물(banana peel extract by ethanol, BPE-E), 2일간 후숙된 바나나 껍질 물 추출물 (matured banana peel extract by water, MBPE-W), 2일 간 후숙된 바나나 껍질 에탄올 추출물(matured banana peel extract by ethanol, MBPE-E)로 표시하였다.
바나나 껍질 추출물의 세포독성
BPE-W, BPE-E, MBPE-W 및 MBPE-E의 3T3-L1 세 포에 대한 독성은 EZ-Cytox cell viability assay kit을 이 용하여 평가하였다. Confluent 상태의 3T3-L1 전 지방세 포는 50, 100, 200, 400 μg/mL 농도의 BPE-W, BPE-E, MBPE-W 및 MBPE-E에 24시간 동안 처리되었다. BPE- W, BPE-E, MBPE-W 및 MBPE-E를 24시간 동안 처리한 후 시료가 포함된 배지를 완전히 제거하고 5%(v/v)의 EZ- Cytox가 포함된 DMEM 배지를 각 well에 1 mL씩 가하여 37°C CO2 incubator에서 1시간 동안 추가로 배양하였다.
반응이 끝난 후 배지를 96-well plate에 100 μL씩 옮긴 후 microplate reader(VersaMax, Molecular Devices, San Jose, CA, USA)를 이용하여 450 nm에서 흡광도를 측정하 였다. 시료를 처리하지 않은 3T3-L1 전 지방세포에 사용된 배지의 흡광도를 대조군으로 하여 BPE-W, BPE-E, MBPE- W, MBPE-E의 세포독성(% of control)을 평가하였다.
3T3-L1 세포 배양 및 지방세포 분화
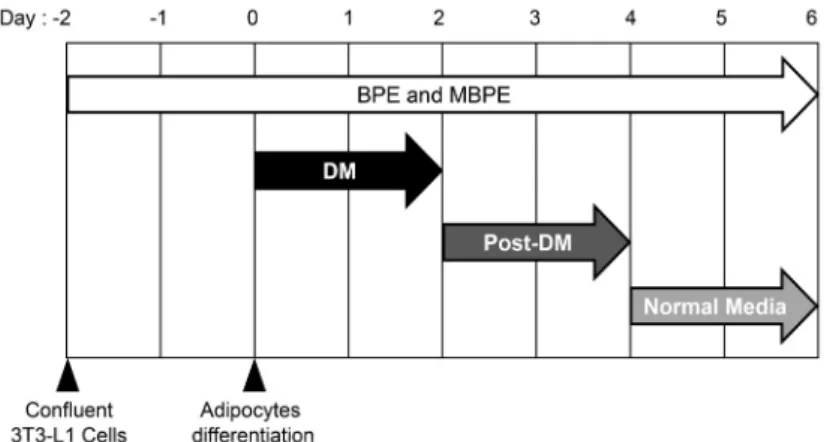
본 실험에 사용된 3T3-L1 세포는 한국세포주은행(Ko- rean Cell Line Bank, Seoul, Korea)에서 분양받아 사용하 였다. 3T3-L1 전 지방세포는 BCS-DMEM 배지(DMEM에 10%(v/v) BCS와 1%(v/v) antibiotics cocktail을 첨가한 배지)에서 37°C, 5% CO2 환경에서 배양하였다. 3T3-L1 세포의 지방세포 분화를 위한 유도과정은 Fig. 1과 같다.
3T3-L1 전 지방세포가 confluent된 상태를 Day -2라 표기 하고, 분화유도 배지(differentiation medium; DM)를 이용 하여 지방세포 분화를 유도한 날을 Day 0이라 표시하였다.
분화유도 배지는 FBS-DMEM 배지(DMEM에 10%(v/v) FBS와 1%(v/v) antibiotics cocktail을 첨가한 배지)에 167
Table 1. Primer sequences for RT-PCR analysis
Gene Forward (5′→3′) Reverse (5′→3′)
C/EBPβ PPARγ β-Actin
GCAAGAGCCGCGACAAG CCATTCTGGCCCACCAACTT AGGGAAATCGTGCGTGACAT
GGCTCGGGCAGCTT CCTTCTCGGCCTGTCGATCC AGCTCAGTAACAGTCCGCCT C/EBPβ, CCAAT/enhancer binding protein β; PPARγ, peroxisome proliferator-activated receptor γ.
Fig. 1. Scheme of 3T3-L1 differentiation and BPEs and MBPEs treatment. DM: differentiation medium consist of 10% FBS-DMEM, 0.5 mM IBMX, 5.2 μM dexame- thasone, and 167 nM insulin; Post-DM: post-differen- tiation medium consist of 10% FBS-DMEM and 167 nM insulin.
nM의 insulin, 500 µM의 IBMX 및 5.2 µM의 DEX를 첨가하 여 사용했으며 Day 2까지 48시간 동안 처리하였다. 분화유도 후 배지(post-differentiation medium; Post-DM)는 FBS- DMEM 배지에 167 nM의 insulin만을 첨가하여 Day 2에서 Day 4까지 사용하였다. 지방세포 분화는 Day 6에 종료하였 으며 Day 4에서 Day 6까지는 FBS-DMEM 배지를 사용하 였다.
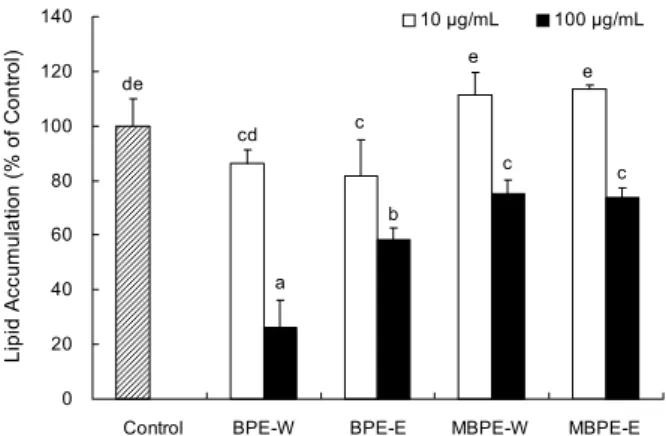
바나나 껍질 추출물의 adipogenesis 억제 활성 평가 BPE-W, BPE-E, MBPE-W 및 MBPE-E 처리가 3T3- L1 세포의 adipogenesis에 미치는 영향을 알아보기 위해 ORO 염색법을 실시하였다. BPE-W, BPE-E, MBPE-W 및 MBPE-E는 confluent 상태의 3T3-L1 전 지방세포에 10, 100 μg/mL의 농도로 Day -2에서 Day 6까지 총 8일 동안 처리하고, ORO 염색은 Day 6에 수행하였다. 분화가 완료된 3T3-L1 지방세포는 25°C에서 30분 동안 3.7%(v/v) form- aldehyde를 사용하여 고정시킨 후, 고정된 3T3-L1 지방세 포는 3 mg/mL의 ORO를 이용하여 25°C에서 15분 동안 염 색시켰다. 지방세포 내 지방구와 결합된 ORO는 DMSO를 사용하여 용해시키고 96-well plate에 100 μL/well씩 옮겨 microplate reader(Molecular Devices)를 이용하여 510 nm에서 흡광도를 측정하였다. 시료를 처리하지 않은 Day 6의 3T3-L1 지방세포를 대조군으로 하여 지방축적률(% of control)을 계산하였다.
바나나 껍질 추출물이 3T3-L1 세포의 지방구 수 및 크기에 미치는 영향
BPE-W, BPE-E, MBPE-W 및 MBPE-E가 3T3-L1 지 방세포의 지방구 수 및 크기에 미치는 영향을 분석하였다.
BPE-W, BPE-E, MBPE-W 및 MBPE-E는 10, 100 µg/mL 의 농도로 Day -2부터 Day 6까지 처리하였으며 3T3-L1 세포의 지방구 수 및 크기는 Day 6에 관찰하였다. 분화가 완료된 Day 6의 3T3-L1 지방세포는 3.7%(v/v)의 form- aldehyde를 처리하여 30분 동안 25°C에서 고정시켰다. 그 후 흐르는 물을 이용해 씻어준 뒤 3 mg/mL의 ORO를 가하 여 15분 동안 25°C에서 염색하였다. 염색을 완료한 후 증류 수를 이용하여 3번 씻었으며 3T3-L1 세포 내 ORO에 의해 염색된 지방구의 수 및 크기는 현미경을 통해 관찰하였다.
Reverse transcription-polymerase chain reaction (RT-PCR)을 통한 유전자 발현 분석
BPE-W, BPE-E, MBPE-W 및 MBPE-E 처리가 3T3- L1 세포의 adipogenesis를 조절하는 전사인자에 미치는 영 향을 알아보고자 RT-PCR을 통해 mRNA 발현을 분석하였 다. 3T3-L1 전 지방세포는 BPE-W, BPE-E, MBPE-W 및 MBPE-E에 10, 100 µg/mL의 농도로 Day -2에서 Day 6까 지 처리되었으며, Day 6에 Trizol®을 이용하여 RNA를 추출 하였다. Trizol® 추출물에 100 µL의 chloroform을 넣고 15 초 동안 잘 혼합한 후, 12,500×g에서 20분 동안 원심분리 하여 상층액을 얻었다. 획득한 상층액에 250 µL의 iso- propanol을 넣고 10분 동안 상온에 정치한 다음 12,500×g 에서 15분 동안 재 원심분리하여 RNA를 최종 분리하였다.
분리된 RNA는 정량한 뒤 cDNA를 합성하고, 합성된 cDNA 는 thermal cycler(T100, Bio-Rad, Berkeley, CA, USA) 를 이용하여 PCR을 수행한 후 1.5~3.0%(w/v) agarose gel 에 전기영동 하여 mRNA 유전자 발현 수준을 분석하였다.
RT-PCR 분석에 사용된 primer sequences는 Table 1과 같 다. PCR amplification은 C/EBPβ에서는 95°C에서 3분 동
**
0 50
Control BPE-W BPE-E MBPE-W MBPE-E
Cell Viability (
Fig. 2. Effects of BPEs and MBPEs treatment on 3T3-L1 viabil- ity. The 3T3-L1 preadipocytes were incubated with 10% BCS- DMEM containing banana peel and mature banana peel for 24 h to measure cell viability. Cell viability was determined by EZ- Cytox assay. The 3T3-L1 preadipocytes were quantified using microplate reader at 450 nm. Corresponding letters indicate sig- nificant differences by Student’s t-test. *P<0.05, **P<0.01. Con- trol: 3T3-L1 preadipocytes.
0 20 40 60 80 100 120 140
Control BPE(W) BPE(E) MBPE(W) MBPE(E)
Lipid Accumulation (% of Control) .
10 μg/mL 100 μg/mL
de e
c e
b c
a cd
c
Control BPE-W BPE-E MBPE-W MBPE-E
Fig. 3. Inhibitory effects of BPEs and MBPEs on 3T3-L1 adipo- genesis. The levels of lipid accumulation of 3T3-L1 cells was evaluated by Oil Red O staining, and it was quantified using microplate reader at 510 nm. Different letters (a-e) above the bars are significantly different based on Duncan’s multiple range test by one-way ANOVA. P<0.05. Control: mature 3T3-L1 adi- pocytes.
에서 30초 동안 annealing, 72°C에서 30초 동안 extension) 하였으며, 발현비교 기준이 되는 β-actin은 95°C에서 3분 동안 prior incubation한 후, 32 cycle의 amplification (95°C에서 30초 동안 denaturation, 62°C에서 30초 동안 annealing, 72°C에서 30초 동안 extension) 하였다.
통계분석
본 연구의 결과는 평균±표준편차로 표현하였으며, 데이 터의 통계처리는 Statistical Package for Social Science (SPSS, Chicago, IL, USA)를 이용하여 분석하였다. 사후검 증은 Duncan’s multiple range test(P<0.05) 또는 Stu- dent’s t-test(P<0.05, P<0.01) 방법에 의해 대조군과 비교 하여 각 구간의 유의성 차이를 검증하였다.
결과 및 고찰
바나나 껍질 추출물의 세포독성 평가
BPE-W, BPE-E, MBPE-W 및 MBPE-E가 3T3-L1 전 지방세포에 독성을 나타내는지 알아보기 위해 시료를 24시 간 처리 후 세포 생존율을 평가하였다. 50, 100, 200, 400 μg/mL의 농도로 BPE-W, BPE-E, MBPE-W 및 MBPE-E 를 24시간 동안 처리한 결과, BPE-W, BPE-E, MBPE-W 및 MBPE-E 모두 50, 100, 200 μg/mL의 농도에서 유의적 인 세포독성이 관찰되지 않았다. 그러나 400 μg/mL 농도의 BPE-W, BPE-E, MBPE-W 및 MBPE-E 처리군은 각각 대 조군 대비 세포 생존율이 83.4%, 86.8%, 73.5%, 63.5%로 아무것도 처리하지 않은 대조군과 비교하여 유의적인 세포독 성을 나타냈다. 400 μg/mL 농도에서 2일간 숙성된 MBPE- W, MBPE-E는 숙성되지 않은 BPE-W, BPE-E와 비교하 여 낮은 세포 생존율을 나타냈다(Fig. 2). 따라서 이후 실험 에서는 세포 생존율에 아무런 영향을 미치지 않는 200 μg/
mL 이하의 농도 중 10, 100 μg/mL의 농도를 선택하여 추후 실험을 진행하였다.
바나나 껍질 추출물의 adipogenesis 억제 활성
BPE-W, BPE-E, MBPE-W 및 MBPE-E 처리가 3T3- L1 세포의 adipogenesis 과정에 미치는 영향을 알아보기 위 하여 Day -2에서 Day 6까지 10, 100 μg/mL의 농도로 총 8일 동안 처리하였다(Fig. 3). 10 μg/mL의 농도로 BPE-W, BPE-E, MBPE-W 및 MBPE-E를 3T3-L1 세포에 처리한 결과 아무것도 처리하지 않은 대조군 지방세포와 비교했을 때, MBPE-W와 MBPE-E에서는 유의적인 차이가 관찰되 지 않았다. 그러나 10 μg/mL의 BPE-W, BPE-E 처리는
2일간 숙성한 바나나 껍질 추출물인 MBPE-W, MBPE-E와 비교하여 상대적으로 높은 adipogenesis 억제 활성을 나타 냈다. 3T3-L1 세포에 BPE-W, BPE-E, MBPE-W 및 MBPE-E를 100 μg/mL의 농도로 처리했을 때 모든 처리군 에서 유의적인 adipogenesis 억제 활성을 나타냈다. 또한 지방세포는 BPE-W, BPE-E, MBPE-W 및 MBPE-E를 처 리했을 때, 각각 대조군 대비 73.7%, 41.5%, 24.8%, 26.4%
낮은 지방세포 분화율을 나타냈다. 10, 100 μg/mL의 농도 에서 모두 숙성하지 않은 바나나 껍질 추출물인 BPE-W, BPE-E가 2일간 숙성한 바나나 껍질 추출물 MBPE-W, MBPE-E와 비교하여 높은 adipogenesis 억제 활성을 나타 냈으며, 특히 BPE-W는 BPE-E보다 adipogenesis 억제 활 성이 더 우수한 것으로 나타났다. 이는 숙성과정을 통해 바
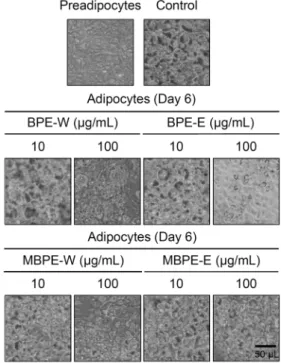
Fig. 4. Effects of BPEs and MBPEs treatment on the lipid accu- mulation of 3T3-L1 adipocytes. The 3T3-L1 preadipocytes were treated with 10, 50, and 100 μg/mL of water and ethanol extracts from banana peel and mature banana peel from Day -2 to Day 6. Inhibitory effects of extracts from banana peel and mature banana peel treatment on the differentiation in ORO-stained 3T3-L1 cells were observed using scanner at Day 6. Pre: 3T3-L1 preadipocytes, Adi: mature 3T3-L1 adipocytes.
Fig. 5. Effects of BPEs and MBPEs on number and size of intra- cellular lipid droplets in 3T3-L1 adipocytes. Inhibitory effects of extracts from banana peel and mature banana peel treatment on the number and size of lipid droplets in ORO-stained 3T3-L1 cells were observed using microscope at Day 6. Pre: 3T3-L1 preadipocytes, Adi: mature 3T3-L1 adipocytes.
나나 껍질에 존재하는 탄닌 등과 같은 성분들이 분해되거나 영향을 받아 항비만 활성의 차이를 가져온 것으로 생각된다.
추후 연구에서는 숙성차이에 따른 페놀 화합물의 조성 및 변화에 관한 연구가 추가로 수행되어야 할 것으로 보인다.
3T3-L1 전 지방세포가 지방세포로 변환되는 과정인 adipogenesis는 특정 유전자 발현에 대해 프로그램된 변화 의 연속에 의해 유도되며, PPARγ, C/EBPα 및 SREBP1과 같은 전사인자의 발현은 지방세포가 분화되는 동안 adipo- genesis를 위한 중요한 활성인자로 알려져 있고 초기에 변 화를 보이는데, 이러한 전사인자들의 과발현은 지방세포의 분화를 가속화시킬 수 있다고 보고되었다(Kim과 Jang, 2014). 이처럼 adipogenesis의 분화과정을 억제하는 것은 비만 예방에 있어 중요하게 작용한다. 최근 식품소재를 활용 하여 adipogenesis의 조절을 통해 항비만 활성을 평가하고 자 하는 연구가 다각도로 진행되고 있다. 오미자(Schisan- dra chinensis) 에탄올 추출물은 C/EBPβ, C/EBPα 및 PPARγ와 같은 전사인자들의 억제를 통해 3T3-L1 adipo- genesis를 억제하는 것으로 보고되었으며, 고지방식이 섭 취된 Sprague-Dawley rat에서 체중을 감소시켰다고 보고 하였다(Park 등, 2012). 또한 등칡(Aristolochia Manshuri- ensis) 물 추출물이 ERK1/2와 Akt pathway의 조절을 통해 C/EBPβ, C/EBpα 및 PPARγ와 같은 전사인자들의 발현을 감소시키고, 3T3-L1 지방세포 내 중성지방의 축적을 억제 하였다고 보고하였다. 바나나와 관련한 보고로는 바나나의 과육과 껍질을 함께 추출한 에탄올 추출물이 3T3-L1 지방 세포의 adipolysis를 촉진한다고 보고되었으나 과육과 껍질 이 구분되지 않아 부위에 따른 활성의 비교가 필요하다 (Niwano 등, 2009). 선행연구를 통해 바나나 껍질의 항비만 활성 및 기전 연구는 미미한 실정이었으며, 숙성도에 따른 바나나 추출물의 항비만 활성에 대한 보고는 없었다.
바나나 껍질 추출물이 3T3-L1 세포 내 지방구의 수 및 크기 에 미치는 영향
바나나 껍질 추출물 BPE-W, BPE-E, MBPE-W 및 MBPE-E가 3T3-L1 세포 내 지방구의 수와 크기에 미치는 영향을 알아보기 위해 분화유도 과정이 끝난 3T3-L1 지방 구를 ORO로 염색하고 현미경 관찰을 통해 지방구의 수와 크기의 변화를 관찰하였다. 그 결과, 분화시키지 않은 3T3- L1 전 지방세포에서는 지방구가 형성되지 않았지만 아무것 도 처리하지 않고 분화를 유도한 지방세포 대조군은 다량의 지방구가 형성된 것을 확인하였다. 바나나 껍질 및 후숙된 바나나 껍질의 물, 에탄올 추출물을 10, 100 μg/mL의 농도 로 처리한 후 아무것도 처리하지 않고 분화 유도만 시킨 대 조군과 비교하였을 때, 지방세포 내 지방구의 수와 크기는 Fig. 3의 결과와 마찬가지로 10, 100 μg/mL에서 농도 의존 적으로 지방세포의 수와 크기가 줄어드는 것을 확인하였다 (Fig. 4, 5).
peel treatment on the mRNA expression of tran- scriptional factors in 3T3-L1 adipocytes. mRNA expression levels in 3T3-L1 adipocytes were esti- mated by RT-PCR analysis. β-Actin was used as a control in RT-PCR analysis.
바나나 껍질 추출물이 3T3-L1 세포의 mRNA 발현수준에 미치는 영향
BPE-W, BPE-E, MBPE-W 및 MBPE-E가 adipogen- esis를 조절하는 전사인자들에 어떠한 영향을 미치는지 분 석하기 위해 3T3-L1 세포는 10, 100 μg/mL의 농도로 Day -2에서 Day 6까지 처리되었으며 RT-PCR을 통해 분석하 였다. BPE-W, BPE-E, MBPE-W 및 MBPE-E에 의한 C/
EBPβ, PPARγ의 mRNA 발현 수준은 Fig. 6에 나타내었다.
분화되지 않은 전 지방세포에서 mRNA 발현 수준은 C/EBP β와 PPARγ에서 지방세포 대비 매우 낮았으며, 분화유도만 시킨 대조군(control)에서는 C/EBPβ와 PPARγ의 mRNA 발현 수준이 매우 높았다. 10 μg/mL 농도의 BPE-W, BPE- E, MBPE-E가 C/EBPβ의 발현을 효과적으로 억제하였으 며, MBPE-E의 처리는 C/EBPβ의 발현 수준을 농도 의존적 으로 감소시켰다. PPARγ의 mRNA 발현 수준은 100 μg/
mL의 MBPE-E 처리에 의해 감소한 것으로 나타났다. 이것 은 바나나 껍질 추출물 처리가 adipogenesis를 활성화하는 데 관여하는 C/EBPβ, PPARγ와 같은 전사인자 발현의 조절 을 통해 항비만 활성을 나타내며 숙성된 바나나 껍질보다 신선한 바나나 껍질이 그 효과가 더 우수하다는 것을 의미한 다.
Lee 등(2013)은 지방세포의 후기 분화과정에서 연잎-연 근 혼합 발효물이 IBMX, DEX 및 insulin과 같은 분화유도 인자에 노출된 직후 C/EBPβ의 발현이 유발되어 adipo- genesis 과정이 시작되며, insulin-sensitive glucose up- take와 같은 성숙한 비만세포의 특징을 증가시키는 데 관여 하는 C/EBPα 및 PPARγ의 발현을 촉진함으로써 지방세포 내 중성지방의 축적을 증가시킨다고 보고하였다. 최근 연구 에서는 돌미나리 씨 추출물이 지방세포의 adipogenesis 과 정 중 발현되는 전사인자인 C/EBPβ, C/EBPα 및 PPARγ의 발현 수준이 감소하여 지방세포 분화과정의 억제를 통해 항 비만 활성을 나타낸다고 보고하였다(Ji 등, 2012). 또한 기 장(Panicum miliaceum) 물 추출물이 3T3-L1 adipogene- sis의 C/EBPα, PPARγ, SREBP1c의 발현을 감소시킴으로 써 지방세포의 지방축적을 억제하였다고 보고하였으며(Park 등, 2011), 등칠(Aristolochia manshuriensis) 물 추출물은 C/EBPα, C/EBPβ 및 PPARγ를 억제함으로써 3T3-L1 세 포의 adipogenesis 과정을 억제했다고 보고하였다(Kwak
등, 2012). 그러므로 adipogenesis의 분화과정에 관여하는 전사인자들의 조절을 통해 비만을 예방하고 관리하는 것은 중요한 분자생물학적 전략이 될 수 있음을 의미한다.
요 약
식생활 및 생활습관의 서구화, 내분비 장애, 유전적인 요인 등에 의해 발생하며, 전 세계적으로 심각한 질환으로 알려진 비만은 열량의 섭취와 소비의 불균형으로 인해 체내 지방이 과잉 축적되어 생기는 질환이다(Park 등, 2015). 전 지방세 포가 지방세포로 분화되는 과정인 adipogenesis의 조절은 비만의 예방 및 관리에서 중요한 타겟이 되며, 최근 식품에 존재하는 생리활성 성분 및 영양성분을 이용한 adipogene- sis 억제 기전 연구들이 많이 진행되고 있다. 바나나(Musa acuminate Colla)는 다년생 목상 초본으로 열대 및 아열대 지방에서 널리 재배되고 있는 과일로 대부분이 생과나 디저 트로 많이 활용되고 있으나 바나나 껍질은 대부분이 부산물 로서 폐기되고 있다. 따라서 본 연구에서는 바나나 껍질의 활용방안을 강구하기 위한 기초연구로써 바나나 껍질의 숙 성기간에 따른 항비만 활성을 평가하고자 하였다. 3T3-L1 전 지방세포에서 세포독성이 나타나지 않은 범위의 농도를 설정하였으며, 10, 100 μg/mL 농도의 바나나 껍질 물, 에탄 올 추출물(BPE-W, BPE-E)과 2일간 숙성된 바나나 껍질 물, 에탄올 추출물(MBPE-W, MBPE-E)의 처리는 농도 의 존적으로 adipogenesis를 조절하여 지방구 생성을 억제하 였고, 숙성시키지 않은 신선한 바나나 껍질 추출물을 숙성된 바나나 껍질 추출물과 비교하여 항비만 활성이 높은 것으로 관찰되었다. 이것은 숙성과정 중 바나나 껍질에 존재하는 탄닌류의 성분이 분해되면서 바나나 껍질이 항비만 활성에 영향을 주었을 것으로 추측되며 이에 대한 추후 연구가 요구 된다. 또한 바나나 추출물 처리는 adipogenesis 초기 단계 의 중요한 전사인자로 알려진 C/EBPβ와 PPARγ의 mRNA 발현 수준을 현저하게 감소시키는 것으로 관찰되었다. 이상 의 연구 결과는 부산물로 폐기되는 바나나 껍질의 항비만 기능성 식품 소재로 활용될 수 있다는 가능성을 보여주는 결과로 생각되며, 추후 바나나 껍질의 주요 생리활성 물질에 대한 규명이 수행되어야 할 것으로 사료된다.
REFERENCES
Bae CR, Park YK, Cha YS. Quercetin-rich onion peel extract suppresses adipogenesis by down-regulating adipogenic tran- scription factors and gene expression in 3T3-L1 adipocytes.
J Sci Food Agric. 2014. 94:2655-2660.
Choi HY, Kim GH. Inhibitory effects of Allium senescens L.
methanol extracts on reactive oxygen species production and lipid accumulation during differentiation in 3T3-L1 cells.
Korean J Food Sci Technol. 2014. 46:498-504.
Cressey R, Kumsaiyai W, Mangklabruks A. Daily consumption of banana marginally improves blood glucose and lipid pro- file in hypercholesterolemic subjects and increases serum adi- ponectin in type 2 diabetic patients. Indian J Exp Biol. 2014.
52:1173-1181.
Ejaz A, Wu D, Kwan P, Meydani M. Curcumin inhibits adipo- genesis in 3T3-L1 adipocytes and angiogenesis and obesity in C57/BL mice. J Nutr. 2009. 139:919-925.
González-Montelongo R, Lobo MG, González M. Antioxidant activity in banana peel extracts: Testing extractions and re- lated bioactive compounds. Food Chem. 2010. 119:1030-1039.
Ji HH, Jeong HY, Jin S, Kwon HJ, Kin BW. Inhibition of adipo- cyte differentiation by methanol extracts of Oenanthe javanica seed in 3T3-L1 preadipocytes. J Life Sci. 2012. 22:1688-1696.
Kang SI, Shin HS, Kim HM, Yoon SA, Kang SW, Ko HC, et al. Callophyllis japonica extract improves high-fat diet-in- duced obesity and inhibits adipogenesis in 3T3-L1 cells. Anim Cells Syst. 2012. 16:447-454.
Kim HO, Hwang YI, Kim GN. Anti-obese function of demethox- ycurcumin through suppression of adipogenesis in 3T3-L1 cells. Asian J Beauty Cosmetol. 2013a. 11:29-34.
Kim JS, Kim JY, Kim GC, Kim KM, Kang MH. Quality charac- teristics and antioxidant properties of saccharified banana gruels. J Korean Soc Food Sci Nutr. 2013b. 42:1071-1078.
Kim JW, Youn KS. Effects of ripeness degree on the physico- chemical properties and antioxidative activity of banana. Ko- rean J Food Preserv. 2013. 20:475-481.
Kim KB, Jang SH. Anti-obesity effect of EGCG and glucosa- mine-6-phosphate through decreased expression of genes re- lated to adipogenesis and cell cycle arrest in 3T3-L1 adipocy- tes. J Nutr Health. 2014. 47:1-11.
Krishnan K, Vijayalakshmi NR. Alterations in lipids & lipid per- oxidation in rats fed with flavonoid rich fraction of banana (Musa paradisiaca) from high background radiation area. In- dian J Med Res. 2005. 122:540-546.
Kwak DH, Lee JH, Kim T, Ahn HS, Cho WK, Ha H, et al.
Aristolochia manshuriensis Kom inhibits adipocyte differ- entiation by regulation of ERK1/2 and Akt pathway. PLoS
One. 2012. 7:e49530. http://doi.org/10.1371/journal.pone.004 9530
Lee M, Nam DE, Kim OK, Heo SH, Lee J. Lipolytic effect of supercritical extraction from pine cone (Pinus koraiensis) in mature 3T3-L1 adipocytes. J Korean Soc Food Sci Nutr. 2014.
43:1342-1348.
Lee SJ, Bose S, Lee SJ, Jeong JE, Koo BS, Kim DI, et al. Effects of fermented lotus extracts on the differentiation in 3T3-L1 preadipocytes. J Korean Med Obes Res. 2013. 13:74-83.
Matook SM, Fumio H. Antibacterial and antioxidant activities of banana (Musa, AAA cv. Cavendish) fruits peel. Am J Biochem Biotechnol. 2005. 1:125-131.
Min B, Lee H, Song JH, Han MJ, Chung J. Arctiin inhibits adipo- genesis in 3T3-L1 cells and decreases adiposity and body weight in mice fed a high-fat diet. Nutr Res Pract. 2014. 8:
655-661.
Naowaboot J, Chung CH, Pannangpetch P, Choi R, Kim BH, Lee MY, et al. Mulberry leaf extract increases adiponectin in murine 3T3-L1 adipocytes. Nutr Res. 2012. 32:39-44.
Niwano Y, Beppu F, Shimada T, Kyan R, Yasura K, Tamaki M, et al. Extensive screening for plant foodstuffs in Okinawa, Japan with anti-obese activity on adipocytes in vitro. Plant Foods Hum Nutr. 2009. 6:6-10.
Oberoi HS, Sandhu SK, Vadlani PV. Statistical optimization of hydrolysis process for banana peels using cellulolytic and pec- tinolytic enzymes. Food Bioprod Process. 2012. 90:257-265.
Park HJ, Cho JY, Kim MK, Koh PO, Cho KW, Kim CH, et al. Anti-obesity effect of Schisandra chinensis in 3T3-L1 cells and high fat diet-induced obese rats. Food Chem. 2012.
134:227-234.
Park HJ, Kim AJ, Cheon YP, Lee M. Anti-obesity effects of water and ethanol extracts of black ginseng. J Korean Soc Food Sci Nutr. 2015. 44:314-323.
Park MY, Seo DW, Lee JY, Sung MK, Lee YM, Jang HH, et al. Effects of Panicum miliaceum L. extract on adipogenic transcription factors and fatty acid accumulation in 3T3-L1 adipocytes. Nutr Res Pract. 2011. 5:192-197.
Someya S, Yoshiki Y, Okubo K. Antioxidant compounds from bananas (Musa Cavendish). Food Chem. 2002. 79:351-354.
White UA, Stephens JM. Transcriptional factors promote for- mation of white adipose tissue. Mol Cell Endocrinol. 2010.
318:10-14.
Yang SJ, Park NY, Lim Y. Anti-adipogenic effect of mulberry leaf ethanol extract in 3T3-L1 adipocytes. Nutr Res Pract.
2014. 8:613-617.
Zhang XH, Huang B, Choi SK, Seo JS. Anti-obesity effect of resveratrol-amplified grape skin extracts on 3T3-L1 adipo- cytes differentiation. Nutr Res Pract. 2012. 6:286-293.