진단유전학분과 신빙도조사 결과보고(2006)
김선희(집필대표)․기창석․박현경․조현정․김종원․박성섭․김재석․이유경․공선영․기승정
한성희․서을주․조현찬․김은지․박선영
대한임상검사정도관리협회 진단유전학분과위원회
Annual Report on External Quality Assessment in Diagnostic Genetics in Korea (2006)
Sun-Hee Kim, Chang-Seok Ki, Hyun-Kyung Park, Hyun-Jung Cho, Jong-Won Kim, Sung-Sup Park, Jae-Seok Kim, You-Kyoung Lee, Sun-Young Kong, Seung-Jung Ki, Sung-Hee Han, Eul-Ju Seo, Hyoun-Chan CHo, Eun-Ji Kim,
and Sun-Yung Park Diagnostic Genetics Subcommittee,
The Korea Association of Quality Assurance for Clinical Laboratory, Seoul, Korea
The importance of quality control for dramatically growing genetic tests continues to be emphasized with increasing clinical demands. Diagnostic genetics subcommitee of KSQACP performed two trials for cytogenetic study in 2006. Cytogenetic surveys were performed by 40 laboratories and answered correctly in most laboratories except some problems in karyotype nomenclature and the detection of complex cytogenetic abnormalities in hematologic neoplasias.
The molecular genetic test surveys included many kinds of tests like M. tuberculosis, HBV, HCV, HPV, leukemias/lymphomas, APOE genotyping, MTHFR genotyping, BRCA1 & BRCA2, Duchenne muscular dystrophy, and Huntington disease. Molecular genetic surveys showed excellent results in most of participants. External quality assessment program for genetic analysis in 2006 was proved to be helpful in continuous education and evaluation of quality improvement.
Key Words:External quality assurance, Diagnostic genetics, Cytogenetics, Molecular genetics
교신저자:김선희
우) 135-710 서울시 강남구 일원동 50 삼성서울병원 진단검사의학과
전화:02)3410-2704, FAX:02)3410-2719 E-mail:sunnyhk@smc.samsung.co.kr
서 론
2006년에도 예년과 마찬가지로 2회의 염색체검사 분야 의 정도관리 사업을 실시하였고, 모두 9예의 핵형분석 (karyotyping) 방법과 1예의 whole blood 검체로 신빙도 검사를 실시하였다. 이번 신빙도 검사에서는 작년에 이어서 실검체(whole blood)를 참가기관에 보내 각 기관에서 직 접 배양을 시행하고 핵형을 분석하여 보고하도록 하였다.
2005년 정도관리부터는 합격/불합격의 기준을 마련하여 이 에 따라서 판정하였으며, 발송된 10 예의 정도관리물질 중 6 예 이상, 즉 60% 이상의 검사 결과에서 acceptable per- formance를 보인 경우를 합격으로 판정하였다.
2006년도 분자유전검사 정도관리는 1차의 10종, 2차의 6종의 검사를 대상으로, 전체 회원기관에서 참가 신청 조사 를 하여 2회 시행하였다. 금년에는 추가 검사 항목 없이 삼 성서울병원 진단유전검사실에서 검체준비 및 결과 분석을 실시하였다.
I. 염색체검사
2006년도에는 2회에 걸쳐 각각 정도관리용 사진을 발송 하여 염색체검사의 핵형분석에 대한 정도관리를 실시하였 다. 2006년 6월에 실시된 첫 번째 염색체검사 정도관리 프 로그램은 5예(06CY-01, 06CY-02, 06CY-03, 06CY-04, 06CY-05)의 핵형분석을 위한 것이었고 증례마다 환자의 간 단한 임상정보와 서로 다른 5개의 세포분열중기 사진을 보 냈다. 2006년 12월에 실시된 두 번째 염색체검사 정도관리 프로그램은 5예(06CY-06 06CY-07, 06CY-08, 06CY-09, 06CY-10)의 핵형분석을 위한 것이었다. 06CY-06부터 06CY-09까지는 각 증례에 대한 4개의 세포분열중기 사진이 었으며, 06CY-10 검체의 경우, 불임을 주소로 내원한 남자 와 여자에게서 공여받은 신선한 말초혈액에 sodium heparin 항응고제를 첨가하여 발송하였다. 각각의 분열중기세포의 사진은 염색체 배열을 통한 핵형분석이 필요한 기관을 위해 서 같은 사진을 2장씩 보냈으며 대한임상검사정도관리협회 홈페이지(http://www.lab-qa.org) 에서도 해당하는 세포분열 중기사진과 FISH 사진을 다운로드 받을 수 있도록 하였다.
검사결과의 보고는 각 검사실에서 사용하는 통상적 방법 으로 분열중기세포를 분석한 후 최종 핵형 결과를 인체 염 색체 명명법의 국제규약 즉, International System of Human Cytogenetic Nomenclature (ISCN)의 단축형 에 따라 기술하도록 하였으며, 최근 개정된 2005년 판을 기준으로 판정하였다. 결과분석 방법으로는 각 검체에 대한 핵형을 M : Modal chromosome Number, S : Sex chromosome designation, A : Recognition of abnor- malities, N : Karyotype nomenclature와 같은 M, S, A, N의 네 가지 요소로서 평가하였다. 각 네 가지 요소에 대한 평가등급은 □, , , 으로 분류하였으며, 그 기 준은 □ : Not Graded, : Good Performance, : Acceptable Performance, : Unacceptable Perfor- mance와 같다. 2001년도부터는 지난 5년 간 성적을 바탕 으로 4곳의 참고기관을 선정하여 따로 분석하였고 각 검체 에 대한 핵형의 target value는 “참고기관의 75% 이상 및 참여기관 다수의 의견일치“가 있는 경우로 정하였다. 적절 한 절단점으로 인정하는 기준은 ”two-band rule"를 따랐는 데 이는 최빈수의 절단점으로부터 two-band 또는 two- subband내에 있는 절단점 만을 인정하는 것이다. 회신한 핵형의 명명이 ISCN 2005의 원칙에 벗어나는 사항은 결 과요약지의 의견란(comments)에 기술하였다.
2. 분자유전검사
2006년도에는 2회에 걸쳐 1차는 10종, 2차는 6개 종목 에 관하여 외부정도관리용 검체를 발송하였다. 1차 조사는 6월 21일에 검체를 발송하고 9월 12일 결과지를 발송하였
1월 17일 결과지를 발송하였다. 정도관리 물질 제조와 준 비는 Table 11, Table 12 와 같이 시행하였다. 각 기관의 보고에 따라 검사방법, 검사결과 및 검사방법별 검사결과를 비교 분석하였다. 또한 기관별 보고결과에 대하여 기본적인 평가(acceptable, unacceptable)를 실시하였다. 그리고 HBV 와 HCV 정량검사를 실시한 기관에서 보고한 정량검사 결 과를 참고로 나열하였다.
결 과
1. 염색체검사
2006년 6월과 12월에 각 각 실시된 제 1, 2차 염색체 검사 정도관리 검체는 40개 기관의 검사실에 발송하였고, 참가한 모든 검사실로부터 결과회신을 받았다. 검체별 결과 분석 내용은 Table 1부터 Table 10과 같다. 제 1, 2차 염색체검사 정도관리의 결과를 제시된 합격/불합격의 기준 에 따라 판정하였을 때 참여한 40 기관 모두가 합격 판정 을 받았다.
2. 분자유전검사
각 종목별 참여기관수는 Table 11과 Table 12와 같다.
각 기관별 보고결과를 분석한 통계는 Table 13, Table 14 와 같다. 분자유전검사의 방법에는 다양한 종류의 검사법과 시약이 사용되고 있다. 이들 검사 방법의 분포는 Table15, Table 16, Table 17, Table 18과 같다.
고 찰
1. 염색체검사
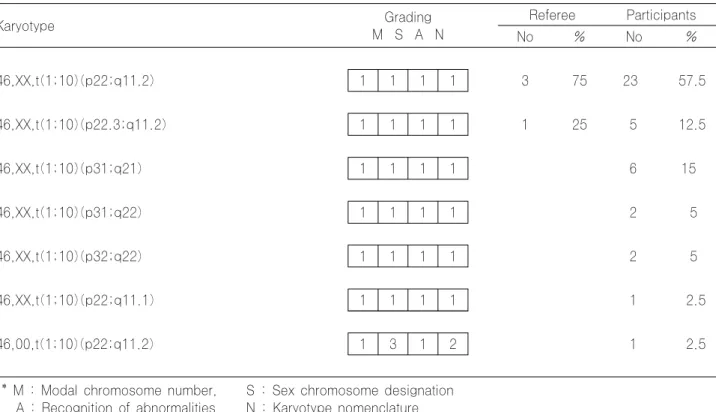
06CY-01은 고령 산모의 양수 검체로 t(1;10)(p22; q11.2) 염색체 이상을 보인 증례였다. 참고기관을 포함한 모든 기 관에서 1번과 10번 염색체의 balanced translocation 의 절 단점의 약간의 차이를 보였을 뿐 염색체의 이상 소견을 정 확히 판독하였다. 1개 기관에서 양수검체인것을 고려하여 성염색체를 표기하지 않아 Sex chromosome designation 상 UNACCETABLE 로 평가하였다.
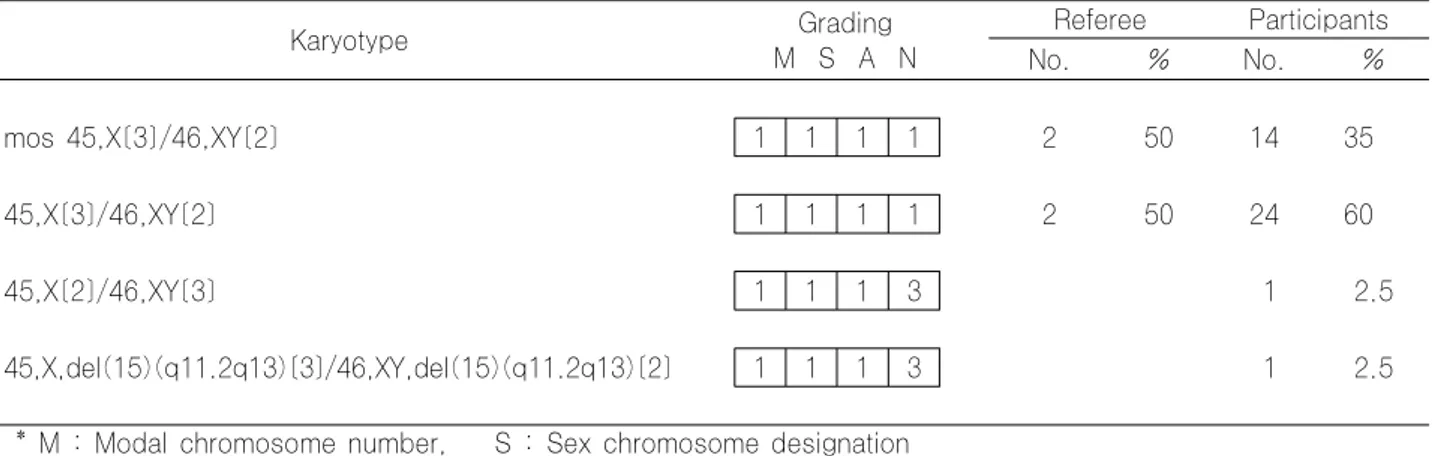
06CY-02는 hypospadia를 주소로 내원한 mosaic Turner syndrome 환자의 검체였다. monosomy X를 가진 clone 수 를 잘못 기재한 기관이 1개 기관이 있어 nomenclature 상의 UNACCEPTABLE 로 평가 하였다.
06CY-03은 Tetralogy of Fallot, Hypognathia, Gloss- optosis, Cleft palate, High arched palate, Low set ear, Small ear lobe 등의 다발성 기형을 특징으로 한 Deletion of 1p36 syndrome 으로 subtelomeric FISH for 1p telomere 를 추가 시행하여 1p36 deletion 을 확인하였던 환자의 검체 이다. 6 기관(15%)에서 del(1p)를 관찰하지 못하였고 1개 기
관에서 그 외의 다른 염색체 이상을 보고하여 UNACCEP- TABLE 로 판정하였다.
06CY-04는 골수이형성증후군(MDS) 환자의 골수 검체 로 20q의 deletion과 염색체 1번 장완의 partial trisomy 소견이 관찰된 증례였다. 골수이형성증후군 환자에서 20q 의 deletion만을 가지는 경우 예후가 좋은 것으로 알려져 있으나, 20q의 deletion을 포함하여 여러 가지 cytogene- tic abnormalities가 있을 경우 중간 정도의 예후를 보이 는 것으로 보고되어 있다. 32개 기관(80%)에서 two- band rule을 고려하였을 때 일치된 결과를 보였다. 20q의 deletion에 있어서 terminal deletion이 아니라 interstitial deletion으로 판독한 경우도 ‘GOOD’으로 평가하였고 20q11.2 의 이상을 관찰하지 못한 경우 ‘UNACCEPTABLE’로 평가 하였다.
06CY-05는 AML with eosinophilia 환자의 골수검체로서, inv(16)(p13.1q22)의 equivalent rearrangement를 일으키는 특징적인 t(16;16)(p13.1;q22) 염색체 이상이 관찰된 증례였 다. 21개 기관(52.5%)에서 two-band rule을 고려하였을 때 일치된 결과를 보였다. 오류를 보인 19개 기관(47.5%) 중 11 개 기관에서는 del(16)으로 보고하였고 7개 기관에서 inv(16)으로 보고하여 ‘UNACCEPTABLE‘로 평가하였다.
16p13 band의 경우는 ISCN 2005에 제시되어 있지 않으므로
‘UNACCEPTABLE’로 평가하였다.
06CY-06은 constitutional anomaly로서 1번과 6번 염색체 전좌를 보인 증례였다. 핵형의 target value는 46,XX,t(1;6)(p32.2~34.2;q21~22.2)로 설정되었으며, two-band rule을 고려하였을 때 대부분의 기관(97.5%)에서 일치된 결 과를 보였다.
06CY-07은 양수 검체에서 염색체 이상이 발견되어 부 모검사를 실시하였던 아버지의 말초 혈액 검체로 3번 염색 체의 paracentric inversion 소견이 관찰된 증례였다. 39 개 기관(97.5%)에서는 약간의 절단점 차이는 있었지만 inv(3)으로 판독하였고, 1개 기관(2.5%)에서 band 표기상 오 류를 보여 ‘UNACCEPTABLE’로 평가하였다.
06CY-08은 급성 골수성 백혈병 환자의 골수 검체로, I(17)(q10)이 관찰된 증례였다. 34개 기관(85%)에서 일 치된 결과를 보였다. 나머지 6개 기관 중 3기관은 염색체 분석에서 오류는 없었지만 표기상의 오류를 보였고 2개 기 관에서는 I(17)(q10) 이외의 염색체 이상을 보고 하였으며 1 개 기관에서는 성염색체를 잘못 표기하여 ‘UNACCEP- TABLE‘로 평가하였다.
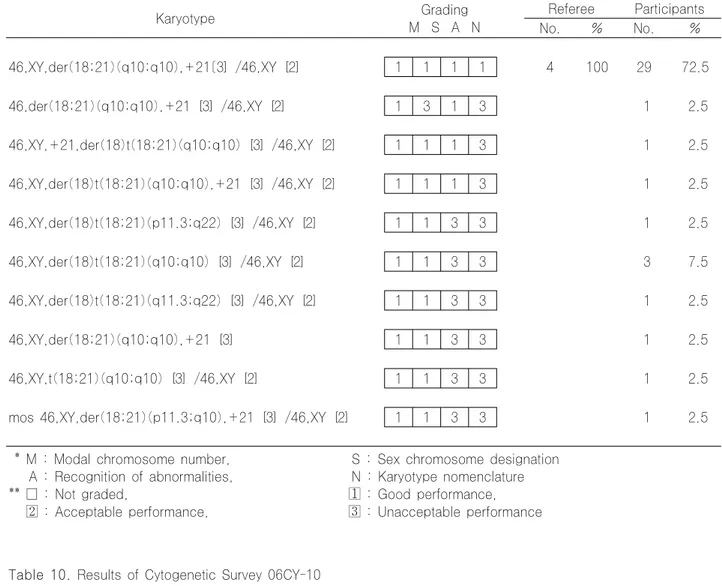
06CY-09은 골수이형성 증후군에서 급성 골수성 백혈병 으로 이환된 환자의 골수 검체로, 18번 염색체 장완과 21번 염색체 장완의 unbalanced whole arm translocation 으로 인하여 monosomy 18p 와 trisomy 21q가 초래된 소견으로 첨부한 FISH 사진은 AML1/ETO FISH 로 세 개의 AML1(21q) 을 보여주는 증례였다. 29개 기관(72.5%)에서
two-band rule을 고려하였을 때 일치된 결과를 보였다. +21 을 표기하지 않은 6 기관(15%)과 염색체 이상이 발견된 clone 의 성염색체를 표기하지 않은 1기관(2.5%), Mosa- icism 을 관찰하지 못한 1개 기관에 대하여 ‘UNACCEP- TABLE’로 평가하였고, 2개 기관(5%)에서 nomenclature에 서 오류를 보였다.
06CY-10은 실검체를 이용한 정도관리 프로그램으로서, 불임을 주소로 내원 하였으나 정상 핵형을 가진 남성과 여 성의 말초혈액 검체였고, sodium heparin 항응고제를 포 함하여 각 기관으로 발송하였으며, 각 기관에서 직접 배양 을 시행하여 세포분열 중기세포를 분석하여 응답하였다. 모 든 참여기관에서 배양에 성공하였고 결과를 보내왔다. 39개 기관(97.5%)에서 정상 핵형의 결과를 보였고, 1기관(2.5%)에 서 46,XY,dup(16)(p11.2p11.1) or dup(16)(p11.2p 12.1) 를 보 고하였다.
2. 분자유전검사 1) 참여기관의 수
2006년 1차 및 2차 외부정도관리에 참여한 기관은 각각 79개 기관이었다. 1차 미생물 분자유전검사는 결핵균, HBV, HCV, HPV 4종류에 대해 시행하였는데 1차 외부 정도관리에서는 각각 68개, 57개, 50개, 35개 기관이었고, 2차 미생물 분자유전검사는 결핵균, HBV, HCV 3종류에 관하여 시행하였고 각각 73개, 62개, 49개 기관이 참가하 였다. 백혈병/림프종 분자진단검사와 APOE genotype 검 사는 각각 1차는 23, 25 기관, 2차는 24, 27기관으로 2005년의 23, 20 기관에서 증가하는 추세이다.
2) 검사종목
이번 조사에는 1차에서 10개 종목, 2차에서 6개 종목을 시행하였다. 참가신청 기관이 작년과 비슷하고 검사항목이 작년과 동일하였다. 2007년에도 설문조사를 통하여 실제 많이 사용되는 검사에 대한 정도관리를 실시할 것이며, 다 양한 검사, 특히 여러 종류의 분자미생물검사에 대해 실무 적인 사항을 고려하여 추가 실시할 예정이다.
3) 검사방법
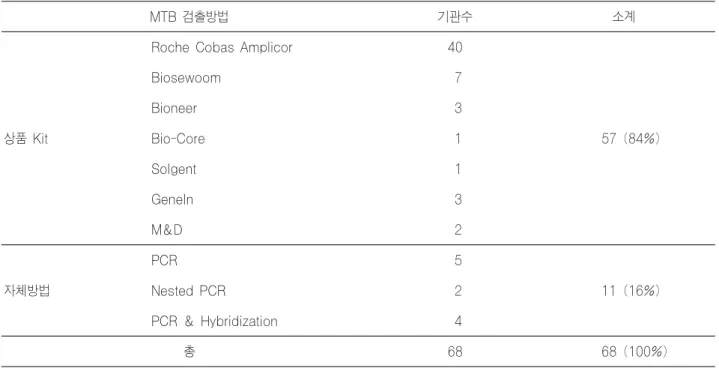
분자미생물검사의 경우 결핵균 검사에서 킷트 사용기관 의 비율은 1999년 66%, 2001년 77%, 2002년 93%, 2003년 94%, 2004년 90%, 2005년도 90%, 2006년도 90%로 비슷한 추세였다. 킷트 사용은 일반적으로 정도관리에 도움이 될 것으로 생각되나, 민감도, 특이도 및 상호오염에 대한 정확 한 검증이 필요하다.
4) 검사결과
2006년도 분자유전검사 정도관리는 전체적으로 우수한 결과를 보였다. 가장 많은 기관이 참여한 결핵균 검사의 경
57 검체의 경우 모두 일치하는 결과를 보였다. HBV와 HCV는 정성 및 정량검사는 모두 우수한 결과를 보여 모든 기관이 정답을 보였다.
결핵균 검사인 MD06-1, 2, 56, 57 검체는 M.
tuberculosis ATCC 3580과 MOTT E1-10로 제조하였 다. 2차의 MD 06-57 검체는 ATCC 표준균주를 이용하여 제조한 검체로 M. tuberculosis DNA 양이 적어 각 기관에 서 시행하는 검사법의 민감도에 따라 양성(28기관, 38%) 또 는 음성(45기관, 62%) 결과를 보여 이 검체에 대해서는 평 가를 유보하였다.
HBV 검체는 정성 및 정량 검사에서 1, 2차 모두 우수 한 결과를 보였다. HBV의 in-house PCR의 경우 검출한 계가 30-10,000 copies/mL로 알려져 있다. 최근 건강보 균자와 만성간염 환자를 구분하는 검사치(cutoff)로 105 HBV DNA copies/mL가 제시되고 있으며(National Insti- tutes of Health Research Workshop, 2001), 104 copies/mL 이하를 보이면 항바이러스제제 치료가 효과적인 것으로 생 각된다고 한다. HBV의 경우 임상적으로 정량검사의 이용이 높은 편이어서 각 검사실에서 시행하는 검사법의 검출한계 에 대한 이해도 필요하다.
HCV 검체는 2006년에는 모든 기관에서 매우 우수한 결과를 보였다. HCV의 경우도 임상적으로 정량검사의 이 용이 높아서 각 검사실에서 시행하는 검사법의 검출한계에 대한 이해도 필요하다.
2006년 2차 정도관리 보고서에서는 처음으로 HBV DNA 및 HCV RNA 정량검사 방법과 보고 단위별로 정량 값을 제시하였으며, 동일한 검사방법과 보고 단위를 쓰는 경우에도 결과의 차이가 관찰되어 보고 단위의 통일과 검사 기관별 변이를 줄이기 위한 노력이 필요한 것으로 판단되었 다.
HPV 검사의 경우 1차만 시행하였고 2기관을 제외한 모 든 기관에서 우수한 결과를 보였다. Caski 세포주를 사용 하여 양성검체를 제조하였다. Caski 세포주는 자궁경부암이 전이된 부위에서 수립된 세포주로서 HPV 16 genome이 이 입되어(integration) 있고, 세포당 HPV 60-600 copy 정도가 있는 것으로 알려져 있다. 또한, HPV 18의 일부 염기서열도 포함하고 있다고 한다.
백혈병/림프종 검사의 경우는 환자의 진단에 상당한 영 향을 줄 수 있으므로 정도관리에 각별한 주의가 필요하다.
대체적으로 만족할 만하나 몇몇 기관에서는 보완이 필요하 다고 생각되며 검체량 부족 등으로 재 발송을 몇 차례 하였 다. 안정적으로 동일한 분자 유전 정도관리 물질을 만들어 낼 수 있는 세포주 등을 확보하는 작업이 필요할 것으로 생 각하며, 제작부터 참가 기관이 받을 때까지 검체 물질이 안 정되어 있도록 검체물질의 안정화를 위한 기술 개발이 필요 할 것으로 판단된다.
였다. BRCA1 및 BRCA2의 경우 1차에서는 3 기관에서 참가하였고 그 중 한 기관에서는 polymorphism 을 mu- tation 으로 명시하였고 2차에서는 4기관 참여 중 1기관에서 mutation을 발견하지 못하였다.
결론 및 요약
세포유전학 분야인 염색체검사 신빙도 조사는 2006에 두 차례에 걸쳐 총 10 증례에 대하여 실시되었다. 2006년 정도관리 물질에는 여러 가지 종양질환 증례와 선천성 질환 의 증례를 포함시켜 다양한 세포유전 검사의 판독 교육을 위해 교육용 증례를 함께 보내 여러 검사실의 교육에 도움 이 되고자 하였다. 2005년도와 마찬가지로 이번 해에도 실 검체(whole blood)를 참가기관에 보내 각 기관에서 직접 배양을 시행하고 핵형을 분석하여 보고하도록 하여 더욱 효 과적인 정도관리 프로그램이 될 수 있도록 하였다. 그 결과 정도관리에 참여한 40기관 모두에서 합격 판정을 받았다.
분자유전검사 외부정도관리는 대체적으로 우수한 결과를 보였다. 분자유전검사 참여기관은 해마다 증가하고 있다. 검 사종목은 2001년 7종, 2002년 9종, 2003년 8종, 2004년 10종, 2005년 10종, 2006년 10종(1차)으로 매년 확대하여 시행하고 있다. 정기적으로 참가신청을 받아 검체준비를 한 것이 검 체 종목의 증가에 도움이 된 것으로 보인다. 앞으로도 정기 적인 참가신청을 받아 검체 발송을 실시하며, 설문조사에서 파악된 요구종목으로 검사종목도 다양하게 선택할 수 있을 것으로 보인다. 또한, 2007년에는 HBV 및 HCV 등 바이러 스 핵산정량 검사법의 표준화를 위해 보고 단위의 통일 및 검체 수의 증가 등 더 많은 노력을 기울여야 할 것으로 생 각된다.
참 고 문 헌
1. 김선희(집필대표), 김종원, 기창석, 김인숙, 남명현, 조현 정, 김은지, 박선영, 박성섭, 김재석, 이유경, 기승정, 조은 해, 한성희, 서을주, 조현찬 진단유전학검사 신빙도조사 결과보고(2005). 임상검사와 정도관리 2006;28(1):S205- S225.
2. ISCN (2005): An International System for Human Cytogenetic Nomenclature, Shaffer L.G., Tommerup N.
(eds); S. Karger, Basel, 2005.
3. European Proficiency Testing Program for Molecular Detection and Quantitation of Hepatitis B Virus DNA. J Clin Microbiol 2001, 39(12), 4407-12.
4. Bendinelli M, Pistello M, Freer G, Vatteroni M, Maggi F.
Viral hepatitis. In: Rose NR, Hamilton RG, et al. eds.
Manual of clinical laboratory immunology. 6th ed.
Table 1. Results of Cytogenetic Survey 06CY-01
Karyotype Grading
M S A N
Referee Participants
No % No %
46,XX,t(1;10)(p22;q11.2) 1 1 1 1 3 75 23 57.5
46,XX,t(1;10)(p22.3;q11.2) 1 1 1 1 1 25 5 12.5
46,XX,t(1;10)(p31;q21) 1 1 1 1 6 15
46,XX,t(1;10)(p31;q22) 1 1 1 1 2 5
46,XX,t(1;10)(p32;q22) 1 1 1 1 2 5
46,XX,t(1;10)(p22;q11.1) 1 1 1 1 1 2.5
46,00,t(1;10)(p22;q11.2) 1 3 1 2 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded,
: Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance Washington, D.C.: ASM PRESS, 2002:696-717.
5. Agatino Battaglia Del 1p36 syndrome: a newly emerging clinical entity. Brain & Development 2005;27:358-361.
6. Meng-Luen Lee, Lon-Yen Tsaob, Bao-Tyan Wangc,
Mei-Huei Leec, Ing-Sh Chiu Revisit on a distinctive chromosome 1p36 deletion syndrome: report of one case and review of the English literature. International Journal of Cardiology 2004;96:477-480.
Karyotype Grading M S A N
Referee Participants
No. % No. %
mos 45,X[3]/46,XY[2] 1 1 1 1 2 50 14 35
45,X[3]/46,XY[2] 1 1 1 1 2 50 24 60
45,X[2]/46,XY[3] 1 1 1 3 1 2.5
45,X,del(15)(q11.2q13)[3]/46,XY,del(15)(q11.2q13)[2] 1 1 1 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded,
: Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Table 3. Results of Cytogenetic Survey 06CY-03
Karyotype Grading
M S A N
Referee Participants
No. % No. %
46,XY,del(1)(p36.2) 1 1 1 1 2 50 11 27.5
46,XY,del(1)(p36.3) 1 1 1 1 2 50 19 47.5
46,XY,del(1)(p36.1) 1 1 1 1 3 7.5
46,XY,del(22)(q11.2q11.2) 1 1 3 3 2 5
46,XY,del(4)(p34) 1 1 3 3 1 2.5
46,XY,del(4)(p34.2) 1 1 3 3 1 2.5
46,XY,del(6)(p23.2)[1]/46.XY[4] 1 1 3 3 1 2.5
mos 46,XY,del(6)(q24)[1]/46,XY[4] 1 1 3 3 1 2.5
46,XY,del(1)(p36.1),del(17)(q11.2q21) 1 1 1 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded, : Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Table 4. Results of Cytogenetic Survey 06CY-04
Karyotype Grading
M S A N
Referee Participants
No. % No. %
46,XY,trp(1)(q21q41),del(20)(q11.2)[5] 1 1 1 1 3 75 8 20
46,XY,trp(1)(q21q32),del(20)(q11.2)[5] 1 1 1 1 1 25 3 7.5
46,XY,trp(1)(q21q32),del(20)(q11.2q13.1)[5] 1 1 1 1 8 20
46,XY,trp(1)(q21.1q32.1),del(20)(q11.2q13.1)[5] 1 1 1 1 2 5
46,XY,trp(1)(q21q32),del(20)(q13.1)[5] 1 1 1 1 2 5
46,XY,trp(1)(q21q42),del(20)(q11.2q13.1)[5] 1 1 1 1 2 5
46,XY,trp(1)(q21.1q32.1),del(20)(q13.1)[5] 1 1 1 1 1 2.5
46,XY,trp(1)(q12q32),del(20)(q12)[5] 1 1 1 1 1 2.5
46,XY,trp(1)(q12q32),del(20)(q11.2q13.1)[5] 1 1 1 1 1 2.5
46,XY,trp(1)(q21q32),del(20)(q12)[5] 1 1 1 1 1 2.5
46,XY,trp(1)(q21q41),del(20)(q11.2q13.1) 1 1 1 2 1 2.5
46,XY,trp(1)(q21q41),del(20)(q11.2q13.1)[5] 1 1 1 1 1 2.5
46,XY,trp(1)(q12q32),del(20)(q11.2)[5] 1 1 1 1 1 2.5
46,XY,trp(1)(q21q32),del(20)(q11.2) 1 1 1 2 1 2.5
46,XY,trp(1)(q21q32),del(20)(q12)[5] 1 1 1 1 1 2.5
46,XY,ins(1;20)(q24q11.2q11.3),der(1)hsr(1;20)(q25q24) 1 1 3 3 1 2.5
46,XY,trp(1)(q42q21),del(20)(q13.2)[5] 1 1 3 3 1 2.5
46,XY,trp(1)(q21q44),del(20)(q11.2)[5] 1 1 3 3 1 2.5
46,XY,dup(1)(q11q44),del(20)(q11.2)[5] 1 1 3 3 1 2.5
46,XY,trp(1)(q21q32)[5] 1 1 3 3 1 2.5
46,XY,trp(1)(q21q32) 1 1 3 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded,
: Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Karyotype Grading M S A N
Referee Participants
No % No %
46,XY,t(16;16)(p13.1;q22)[5] 1 1 1 1 3 75 18 45
46,XY,del(16)(q22)[5] 1 1 3 3 1 25 6 15
46,XY,t(16;16)(p13.1;q22) 1 1 1 2 2 5
46,XY,inv(16)(p13.1q22)[5] 1 1 3 3 3 7.5
46,XY,inv(16)(p13.1;q22)[5] 1 1 3 3 3 7.5
46,XY,del(16)(q23)[3]/46,XY[2] 1 1 3 3 1 2.5
46,XY,inv(16)(p13q22)[5] 1 1 3 3 1 2.5
46,XY,t(16;16)(p13;q22)[3]/46,XY[2] 1 1 3 3 1 2.5
46,XY,t(16;16)(p13;q22)[5] 1 1 1 3 1 2.5
46,XY,del(16)(q23)[3]/46,XY[2] 1 1 3 3 1 2.5
46,XY,del(16)(q22) 1 1 3 3 1 2.5
46,XY,del(16)(q13;q22)[3]/46,XY[2] 1 1 3 3 1 2.5
46,XY,del(13)(q13q14),del(16)(q23)[3]/46,XY[2] 1 1 3 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded,
: Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Table 6. Results of Cytogenetic Survey 06CY-06
Karyotype Grading
M S A N
Referee Participants
No % No %
46,XX,t(1;6)(p34.1;q22.2) 1 1 1 1 2 50 12 30
46,XX,t(1;6)(p32.3;q16.2) 1 1 1 1 1 25 3 7.5
46,XX,t(1;6)(p34.3;q22.2) 1 1 1 1 1 25 2 5
46,XX,t(1;6)(p31.3;q22.3) 1 1 1 1 1 2.1
46,XX,t(1;6)(p32.1;q22.1) 1 1 1 1 1 2.5
46,XX,t(1;6)(p32.2;q21)[5] 1 1 1 1 1 2.5
46,XX,t(1;6)(p32.3;q21) 1 1 1 1 4 8.5
46,XX,t(1;6)(p32;q21) 1 1 1 1 1 2.5
46,XX,t(1;6)(p32;q22.2) 1 1 1 1 2 4.3
46,XX,t(1;6)(p33;q21) 1 1 1 1 1 2.5
46,XX,t(1;6)(p33;q22) 1 1 1 1 1 2.5
46,XX,t(1;6)(p33;q22.1) 1 1 1 1 1 2.5
46,XX,t(1;6)(p33;q22.2) 1 1 1 1 1 2.5
46,XX,t(1;6)(p34.1;q21) 1 1 1 1 2 5
46,XX,t(1;6)(p34.1;q22) 1 1 1 1 1 2.5
46,XX,t(1;6)(p34.2;q22.2) 1 1 1 1 4 10
46,XX,t(1;6)(p34;q22.1) 1 1 1 1 1 2.5
46,XX,t(1;6)(p34.1;q14) 1 1 2 2 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded,
: Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance,
: Unacceptable performance*
Karyotype Grading M S A N
Referee Participants
No. % No. %
46,XY,inv(3)(p13p25) 1 1 1 1 1 25 17 42.5
46,XY,inv(3)(p14p26) 1 1 1 1 1 25 2 5
46,XY,inv(3)(p14.1p26) 1 1 1 1 1 25 3 7.5
46,XY,inv(3)(p14.2p25) 1 1 1 1 1 25 5 10.6
46,XY,inv(3)(p13p25)[5] 1 1 1 1 1 2.5
46,XY,inv(3)(p13p26) 1 1 1 1 3 7.5
46,XY,inv(3)(p14.1p25) 1 1 1 1 1 2.5
46,XY,inv(3)(p14.1p26.1) 1 1 1 1 1 2.5
46,XY,inv(3)(p14.2p26) 1 1 1 1 2 4.3
46,XY,inv(3)(p14.3p25) 1 1 1 1 1 2.5
46,XY,inv(3)(p14p25) 1 1 1 1 2 5
46,XY,inv(3)(p21.3p25) 1 1 2 2 1 2.5
46,XY,inv(3)(p26p14.3) 1 1 3 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded,
: Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Table 8. Results of Cytogenetic Survey 06CY-08
Karyotype Grading
M S A N
Referee Participants
No. % No. %
46,XX,i(17)(q10)[5] 1 1 1 1 4 100 33 82.5
46,XX,idic(17)(p11.2)[5] 1 1 1 1 1 2.5
46,XX,i(17)(q10) 1 1 1 3 1 2.5
46,XX,i(17)(q10q10)[5] 1 1 1 3 2 5
46,XX,i(17)(q10)[3]/46,idem,del(18)(p11.2p11.2)[2] 1 1 3 3 1 2.5
46,XX,i(9)(p12q13)c,i(17)(q10)[5] 1 1 3 3 1 2.5
46,XY,i(17)(q10)[5] 1 3 1 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded, : Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Karyotype Grading M S A N
Referee Participants
No. % No. %
46,XY,der(18;21)(q10;q10),+21[3]/46,XY[2] 1 1 1 1 4 100 29 72.5
46,der(18;21)(q10;q10),+21[3]/46,XY[2] 1 3 1 3 1 2.5
46,XY,+21,der(18)t(18;21)(q10;q10)[3]/46,XY[2] 1 1 1 3 1 2.5
46,XY,der(18)t(18;21)(q10;q10),+21[3]/46,XY[2] 1 1 1 3 1 2.5
46,XY,der(18)t(18;21)(p11.3;q22)[3]/46,XY[2] 1 1 3 3 1 2.5
46,XY,der(18)t(18;21)(q10;q10)[3]/46,XY[2] 1 1 3 3 3 7.5
46,XY,der(18)t(18;21)(q11.3;q22)[3]/46,XY[2] 1 1 3 3 1 2.5
46,XY,der(18;21)(q10;q10),+21[3] 1 1 3 3 1 2.5
46,XY,t(18;21)(q10;q10)[3]/46,XY[2] 1 1 3 3 1 2.5
mos 46,XY,der(18;21)(p11.3;q10),+21[3]/46,XY[2] 1 1 3 3 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded, : Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
Table 10. Results of Cytogenetic Survey 06CY-10
Karyotype Grading
M S A N
Referee Participants
No % No %
46,XX 1 1 1 1 1 2.5
46,XY 1 1 1 1 3 75 36 90
46,XY[20] 1 1 1 1 1 2.5
46,XYqh+ 1 1 1 1 1 2.5
46,XY,dup(16)(p11.2p11.1)
or dup(16)(p11.2p12.1) 1 1 3 3 1 25 1 2.5
* M : Modal chromosome number, A : Recognition of abnormalities,
** □ : Not graded, : Acceptable performance,
S : Sex chromosome designation N : Karyotype nomenclature
: Good performance, : Unacceptable performance
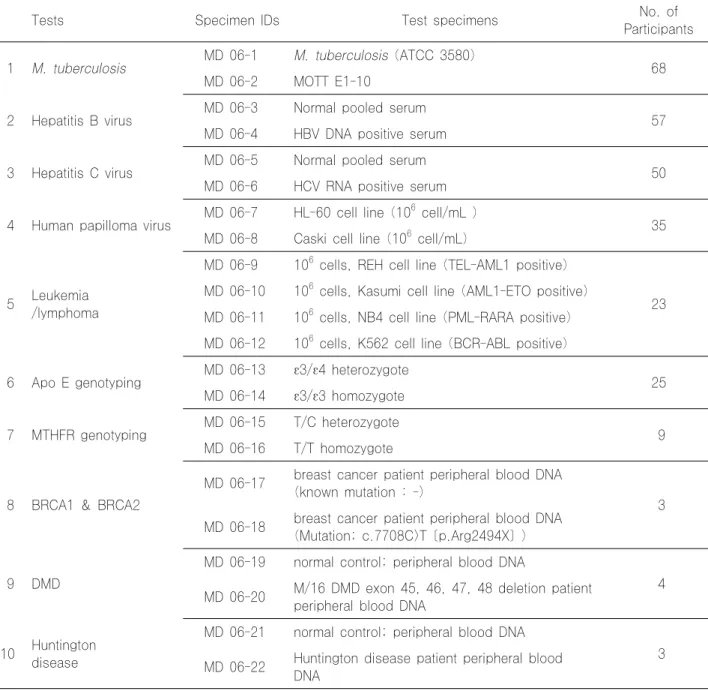
Table 11. Survey tests, specimen IDs, test specimens and total participants of trial 1 for external quality assessment of molecular genetic test survey in 2006
Tests Specimen IDs Test specimens No. of
Participants
1 M. tuberculosis MD 06-1 M. tuberculosis (ATCC 3580) MD 06-2 MOTT E1-10 68
2 Hepatitis B virus MD 06-3 Normal pooled serum MD 06-4 HBV DNA positive serum 57
3 Hepatitis C virus MD 06-5 Normal pooled serum MD 06-6 HCV RNA positive serum 50
4 Human papilloma virus MD 06-7 HL-60 cell line (106 cell/mL ) MD 06-8 Caski cell line (106 cell/mL) 35
5 Leukemia /lymphoma
MD 06-9 106 cells, REH cell line (TEL-AML1 positive)
MD 06-10 106 cells, Kasumi cell line (AML1-ETO positive) 23 MD 06-11 106 cells, NB4 cell line (PML-RARA positive) MD 06-12 106 cells, K562 cell line (BCR-ABL positive)
6 Apo E genotyping MD 06-13 ε3/ε4 heterozygote MD 06-14 ε3/ε3 homozygote 25
7 MTHFR genotyping MD 06-15 T/C heterozygote MD 06-16 T/T homozygote 9
8 BRCA1 & BRCA2
MD 06-17 breast cancer patient peripheral blood DNA (known mutation : -)
3 MD 06-18 breast cancer patient peripheral blood DNA
(Mutation; c.7708C>T [p.Arg2494X] )
9 DMD
MD 06-19 normal control; peripheral blood DNA
MD 06-20 M/16 DMD exon 45, 46, 47, 48 deletion patient 4 peripheral blood DNA
10 Huntington disease
MD 06-21 normal control; peripheral blood DNA MD 06-22 Huntington disease patient peripheral blood 3
DNA
assessment of molecular genetic test survey in 2006
Tests Specimen ID Test specimens No. of
Participants
Leukemia/Lymphoma MD 06-51 107 cells, Kasumi cell line (AML1-ETO positive) MD 06-52 107 cells, HL-60 24
APOE Genotype MD 06-53 ε3/ε3 homozygote MD 06-54 ε3/ε4 heterozygote 27
Breast Cancer (BRCA) MD 06-55 Established cell line 4
M. tuberculosis MD 06-56 M. tuberculosis ATCC 3580 MD 06-57 MOTT E1-10 73
Hepatitis B Virus MD 06-58 Normal pooled serum MD 06-59 HBV DNA positive serum 62
Hepatitis C Virus MD 06-60 HCV RNA positive serum MD 06-61 Normal pooled serum 49
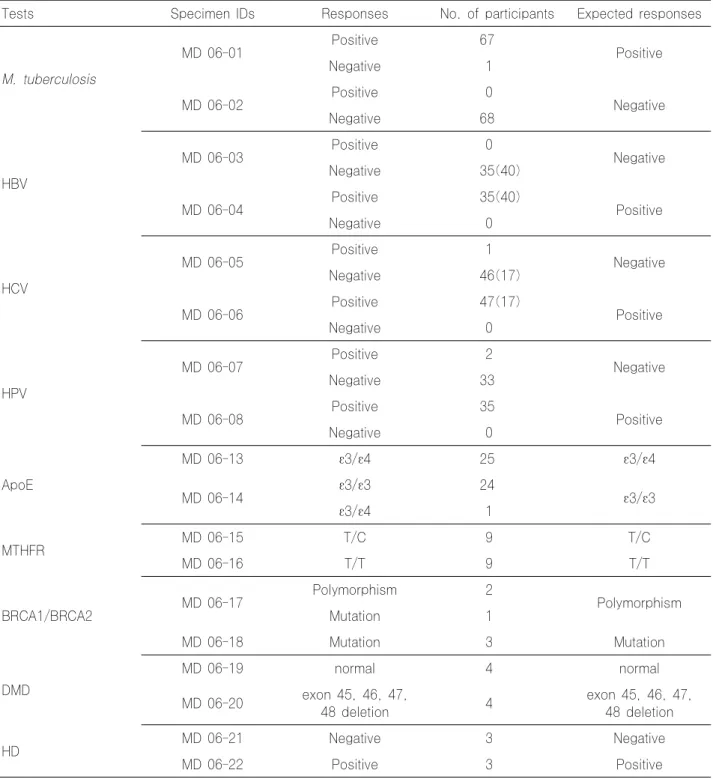
Table 13. Results of molecular genetic test survey of trial 1 in 2006
Tests Specimen IDs Responses No. of participants Expected responses
M. tuberculosis
MD 06-01 Positive 67
Positive
Negative 1
MD 06-02 Positive 0
Negative
Negative 68
HBV
MD 06-03 Positive 0
Negative
Negative 35(40)
MD 06-04 Positive 35(40)
Positive
Negative 0
HCV
MD 06-05 Positive 1
Negative
Negative 46(17)
MD 06-06 Positive 47(17)
Positive
Negative 0
HPV
MD 06-07 Positive 2
Negative
Negative 33
MD 06-08 Positive 35
Positive
Negative 0
ApoE
MD 06-13 ε3/ε4 25 ε3/ε4
MD 06-14 ε3/ε3 24
ε3/ε3
ε3/ε4 1
MTHFR MD 06-15 T/C 9 T/C
MD 06-16 T/T 9 T/T
BRCA1/BRCA2 MD 06-17 Polymorphism 2
Polymorphism
Mutation 1
MD 06-18 Mutation 3 Mutation
DMD
MD 06-19 normal 4 normal
MD 06-20 exon 45, 46, 47,
48 deletion 4 exon 45, 46, 47,
48 deletion
HD MD 06-21 Negative 3 Negative
MD 06-22 Positive 3 Positive
* ( )의 숫자는 정량검사를 실시한 기관임.
Tests Specimen ID Responses No. of participants Expected responses
Leukemia/Lymphoma
MD 06-51 AML1/ETO - positive 21
AML1/ETO - positive BCR/ABL - positive 3
MD 06-52
Negative 22
Negative BCR/ABL - positive 1
PML/RARa - positive 1
APOE Genotype
MD 06-53 ε3/ε3 26
ε3/ε3
ε2/ε2 1
MD 06-54 ε3/ε4 26
ε3/ε4
ε2/ε4 1
Breast Cancer (BRCA) MD 06-55 Mutation 3
Mutation
No mutation 1
M.tuberculosis
MD 06-56 Positive 28
Negative 45
MD 06-57 Positive 0
Negative
Negative 73
Hepatitis B Virus
MD 06-58 Positive 0
Negative
Negative 26(59)
MD 06-59 Positive 26(59)
Positive
Negative 0
Hepatitis C Virus MD 06-60 Positive 46(21) Positive
MD 06-61 Negative 46(21) Negative
* ( )의 숫자는 정량검사를 실시한 기관임.
Table 15-1. M. tuberculosis detection methods in survey of trial 1 in 2006
MTB 검출방법 기관수 소계
상품 Kit
Roche Cobas Amplicor 40
57 (84%)
Biosewoom 7
Bioneer 3
Bio-Core 1
Solgent 1
GeneIn 3
M&D 2
자체방법
PCR 5
11 (16%)
Nested PCR 2
PCR & Hybridization 4
총 68 68 (100%)
Table 15-2. M. tuberculosis detection methods in survey of trial 2 in 2006
MTB 검출방법 기관수 소계
상품 Kit
Roche Cobas Amplicor 44
66 (90%)
Biosewoom 10
Bioneer 4
Bio-Core 3
GeneIn 2
M&D 2
Genotech 1
자체방법
기타 2
7 (10%)
dUTP-UDG PCR 1
PCR 1
Nested PCR 1
Real time PCR 1
총 73 73 (100%)
HBV 정성검사 방법 기관수 소계
상품 kit
Roche 6
26 (74%)
Bioneer 5
Biosewoom 4
Digene 4
Bayer 3
Bio-Core 2
Genotech 1
Diaprobe 1
자체방법 Nested PCR 7
9 (26%)
PCR 2
총 35 35 (100%)
HBV 정량검사 방법 기관수 소계
상품 kit
Roche Cobas Amplicor HBV Monitor 15 35 %
Bayer Versant HBV DNA 3.0 11 26 %
Diagene HBV Hybrid Capture II 11 26 %
Arthus RealArt HBV RG PCR Kit 2 5 %
Biosewoom Real Q HBV Kit 2 5 %
Combination (Roche, Digene, Bayer) 1 3 %
총 42 100 %
Table 16-2. HBV detection methods in survey of trial 2 in 2006
HBV 정성검사 방법 기관수 소계
상품 kit
Bioneer 6
19 (73%)
Biosewoom 4
Genotech 2
Bio-Core 2
Roche 2
Abbott 1
Diaprobe 1
Undescribed 2
자체방법
Nested PCR 1
7 (23%)
PCR 1
In hange method 1
Undescribed 4
총 26 26 (100%)
HBV 정량검사 방법 기관수 소계
상품 kit
Roche Cobas Amplicor HBV Monitor 18 31 %
Bayer Versant HBV DNA 3.0 15 25 %
Diagene HBV Hybrid Capture II 14 24 %
Biosewoom Real Q HBV Kit 4 7 %
Roche Cobas TaqMan 4 7 %
Arthus RealArt HBV RG PCR Kit 2 3 %
Arthus RealArt HBV LC PCR Kit 1 2 %
Abbott Real-Time PCR Kit 1 2 %
총 59 59 (100 %)
HCV 정성검사 방법 기관수 소계
상품 kit
Roche Cobas Amplicor HCV Kit 30
38 (80%)
Bioneer 2
Genotech 1
Solgent 1
Biosewoom 2
Bio-Core 1
LIPA 1
자체방법 Nested RT-PCR 9 9 (20%)
총 47 47 (100%)
HCV 정량검사 방법 기관수 소계
상품 kit
Roche Cobas Amplicor HCV Monitor 14 14 (82%)
Biosewoom Real Q HCV Kit 1 1 (6%)
Bayer Versant HCV RNA 3.0 1 1 (6%)
Artus RealArt HCV RG Kit 1 1 (6%)
총 17 17 (100%)
Table 17-2. HCV detection methods in survey of trial 2 in 2006
HCV 정성검사 방법 기관수 소계
상품 kit
Roche Cobas Amplicor HCV Kit 32
44 (96%)
Bioneer 2
Genotech 2
Invitrogen 1
Biosewoom 4
Bio-Core 2
Bayer 1
자체방법 Nested RT-PCR 2 2 (4%)
총 46 4 (100%)
HCV 정량검사 방법 기관수 소계
상품 kit
Roche Cobas Amplicor HCV Monitor 15 71 %
Abbott Real-Time PCR Kit 3 14 %
Biosewoom Real Q HCV Kit 1 5 %
Bayer Versant HCV RNA 3.0 1 5 %
Artus Realart HCV RG Kit 1 5 %
총 21 100 %
HPV 검출 방법 기관수 소계
Hybrid capture (Digene II) 17
High-Risk HPV DNA 6
Biosewoom 3
HPV DNA chip (Biomed lab) 2
DNA sequencing 2
HPV screen PCR, HPV Genotype 2
Nested PCR 1
PCR-RFMP 1
PCR 2
총 35
![Table 4. Results of Cytogenetic Survey 06CY-04 Karyotype Grading M S A N Referee ParticipantsNo.%No.% 46,XY,trp(1)(q21q41),del(20)(q11.2)[5] 1 1 1 1 3 75 8 20 46,XY,trp(1)(q21q32),del(20)(q11.2)[5] 1 1 1 1 1 25 3 7.5 46,XY,trp(1)(q21q32),del(20)(q11.2q1](https://thumb-ap.123doks.com/thumbv2/123dokinfo/5457184.240975/7.892.81.796.156.1024/table-results-cytogenetic-survey-karyotype-grading-referee-participantsno.webp)