대한소화기학회지 1999;33:38 - 50
1)
접수: 1998년 6월 23일, 승인: 1998년 8월 27일
연락처: 현진해, 136-705, 서울시 성북구 안암동 5가 126-1 고대안암병원 소화기내과
Tel: (02) 920-5565, Fax: (02) 953-1943
※ 본 논문의 요지는 1997년 추계소화기학회에서 발표되 었음.
서 론
한국의 위암은 전 악성 종양 중 1위의 빈도를 차 지하고 있으며 전체 암 사망의 수위를 기록하고 있
Interferon-γ가 인체 위암세포의 성장과 세포주기에 미치는 영향
고려대학교 의과대학 내과학교실, 소화기연구소 및 생화학교실*
박 민 희・진 윤 태・전 훈 재・이 성 준・이 구・김 광 희・송 치 욱
엄순호・이상우・최재현・김창덕・류호상・유수진・손정원*・현진해
E ffe c t o f In t e r fe r o n o n Gr o w t h a n d Ce l l Cy c le P r o g r e s s i o n o f S t o m a c h Ca n c e r Ce ll s
Mi n H e e P a r k , M.D., Yo o n Ta e J e e n , M.D., H o o n J a i Ch u n , M.D., S u n g J o o n Le e , M.D., Go o Le e , M.D., Kw a n g H e e Ki m , M.D.,
Ch i Wook Son g, M.D., Soo n Ho Um , M.D., San g Woo Le e , M.D., J ai Hyun Ch oi, M.D., Chang Duk Kim, M.D., Ho San g Ryu, M.D., Su J in Yu, M.D., J u ng Won Soh n, M.D.* a nd J in Hae Hyun, M.D.
Departments of Internal Medicine and Biochemistry*,
Institute of Nutrition and Gastroenterology, Korea University College of Medicine, Seoul, Korea
Background/Aims: The aims of this study were to examine the in vitro effects of IFN (interferon)-γ
on growth of human stomach cancer cell lines and to investigate the antiproliferative effects of IFN γ by cell cycle regulation. Methods: Three human gastric cancer cell lines, SNU-1, SNU-16 and AGS, and recombinant human IFN-γ were used. The cells were treated with IFN-γ for various time frames and/or at various concentrations and then, DNA synthesis, cell cycle and the expression of cel cycle regulators were examined. Results: IFN-γ inhibited the proliferation of SNU-1 and SNU-16 in time- and concentration- dependent manners as judged by [3H]-thymidine incorporation assay. In the cell cycle analysis of SNU-1 and SNU-16, IFN-γ induced G1 block at the cell cycle. IFN-γ increased the expression of two or all three of the cycline-dependent kinase (CDK) inhibitors p21WAF1, p27Kip1, and p16INK4, depending on the cell line. Conclusions: These data suggest that the antiproliferative effect of IFN-γ on human stomach cancer cell lines was mediated by increase in the expression of CDK inhibitors and blocking cell cycle at G1-S transition. (Kor J Gastroentero1999;33:38 - 50)
Key Words: IFN-γ, Antiproliferative effect, Stomach cancer
박민희 외 13인. Interferon-γ의 위암세포에 대한 영향 39
어 임상 뿐만 아니라 국민보건적 차원에서도 매우 중요한 질환이다. 대부분의 위암은 자각 증상의 발 현이 늦어 많은 예에서 완전 절제가 불가능한, 진행 된 상태로 진단되므로 예후가 매우 불량하다.1 따라 서 진행 위암의 새로운 치료 방법이 요망되고 있으 며, 최근에는 이러한 가능성을 지닌 치료법의 하나 로 면역요법이 임상에서 많은 연구가 되고 있는데, 이 중 대표적인 것이 인터페론이다.
인터페론은 1957년에 Issacs와 Lindemnamm2에 의하여 세포의 바이러스 감염을 막아주는 물질로 발 견되었다. 인터페론은 알파, 베타, 감마의 3 종류로 크게 구분되는데 인터페론 알파와 베타는 거의 모든 종류의 세포에서 생산된다. 면역 인터페론으로도 불 리는 인터페론 감마는 면역반응 중에 활성화된 T림 프구(T0, Th1, CD8 T 세포)와 자연살상세포 등에 의 해 생산되며 적어도 20 kD와 25 kD의 두 종류의 분 자가 있다. 인터페론 감마는 알파나 베타와는 분자 적 유사성도 없고 서로 다른 수용체를 통해 작용하 지만 생리적인 활성은 중복되는 부분이 많다.
인터페론 감마는 숙주의 자연살상세포와 대식세 포를 활성화시키는 등 면역반응을 증가시켜 간접적 으로 암조직의 성장을 억제할 뿐 아니라 여러 암세 포의 증식을 직접적으로 억제하는 효과도 있는 것으 로 알려져 있다.3-5 암세포에 인터페론 감마를 처리 하면 면역반응에 관계되는 세포 표면 항원들인 ICAM-1, MHC class I, II와 여러 종양 특이 항원의 발현이 증가하는데, 이러한 세포 표면 항원의 발현 증가는 면역반응을 증가시킴으로써 암세포를 제거 하는데 기여하는 것으로 생각된다.6,7 인터페론의 직 접적인 항증식 작용은 개개의 종양에 따라 크게 차 이가 나지만 종양의 종류와 증식 억제의 정도는 별 로 연관이 없다고 한다.8,9 인터페론은 c-myc이나 c- Ha-ras 등의 암유전자의 발현을 억제한다는 보고가 있어, 이러한 암유전자의 발현을 억제하는 것이 세 포의 증식을 억제하는 것과 관련이 있을 것으로 생 각된다.10,11 그러나 인터페론 감마가 어떤 분자생물 학적 기전에 의해 직접적인 성장 억제 효과를 나타 내는지는 아직 알려지지 않고 있다. 한 보고에서는 Retinoblastoma(이하 Rb) 단백질이 인터페론 감마에 의한 아포토시스(apoptosis)의 유도를 막는다고 하
여, 인터페론 감마가 특히 Rb 단백질의 기능을 상실 한 암세포에 효과가 있을 것으로 추측하였다.12
최근 특히 유전자 재조합 기법의 발달에 의해 인 터페론 감마의 대량 생산이 가능하여짐에 따라, 그 항암 효과를 알아보기 위한 많은 연구가 시도되어, 만성 골수성 백혈병, 다발성 골수종, 악성 흑색종, 신장암, 악성 림프관종 등의 치료에 인터페론의 유 효성이 보고되고 있다.13-17 그러나 인터페론 감마와 위암세포의 관계는 세계적으로 아직 확립되지 않고 있으며, 국내의 경우 위암세포주인 Kato III 세포주 를 이용한 연구에서 인터페론 감마가 성장 억제 효 과가 없다는 보고가 있을 뿐이다.18 따라서 본 연구 에서는 인터페론 감마에 의한 인체 위암세포의 직접 적인 성장 억제 효과를 여러 위암세포주에서 조사하 고, 인터페론 감마에 의한 성장 억제 효과가 있는 세 포주에서는 세포주기의 진행 및 세포주기 조절 인자 들의 발현 양상을 연구하여 인터페론 감마에 의한 성장 억제 효과의 기전을 밝히고자 하였다.
대상 및 방법
1. 대 상 1) 배 지
Penicillin (100 units/mL), streptomycin (100 μg/
mL), 10 mM의 HEPES (N-2-hydroxyethyl pipera- zine-N-2-ethanesulfonic acid)와 10% 우태아혈청 (fetal bovine serum, Gibco BRL, Grand Island, NY, USA)이 함유된 RPMI 1640 조직배양액(Gibco BRL) 을 사용하였다.
2) 위암 세포주
인체 위암세포주로는 SNU-1, SNU-16, AGS를 한 국세포주은행(서울대학교)에서 분주받아 37℃ 배양 기(5% CO2, 포화습도)에서 배양하였으며, myco- plasma에 감염되지 않은 것을 확인하였다.
3) 인터페론 감마
럭키생명공학연구소에서 유전자 재조합기법(re- combinant DNA technology)으로 효모에서 생산하여 냉동 건조된 인터페론 감마를 증류수에 녹여 분주한
40 The Korean Journal of Gastroenterology : Vol. 33, No. 1, 1999
후 -70℃에서 냉동 보관하였다.
2. 방 법
1) 인터페론 감마 처리 후 시험관내 위암세포의 성장과 생존도의 측정
인터페론 감마가 위암세포주의 성장을 억제하는 효과를 통상적인 [3H]-thymidine 통합 분석법으로 측 정하였다. SNU-1, SNU-16, AGS를 2×104 cells/mL, 100 L/well로 96 well microtiter plate (Costar, Cam bridge, MA, USA)에 분주한 후 인터페론 감마를 최 종농도가 0, 10, 100, 300, 1000, 6,000, 10,000 U/mL 이 되게 배양액에 희석하여 100 L/mL로 세포가 들 어있는 plate에 처리하였다. 3일간 CO2 배양기에서 배양한 후 [3H]-thymidine (Amersham, Buckingha- mshire, England)을 l Ci/well로 더해주고 18시간 더 배양하였다. 세포를 반자동 세포 수확기(Skatron, Transby, Norway)로 유리섬유 filter에 수확하여 DNA에 통합된 [3H]-thymidine의 양을 -scintillation counter (Pharmacia, Uppsala, Sweden)로 측정하였다.
암세포의 성장 억제율(growth inhibition rate)은 다음 과 같이 계산하였다; Growth inhibition rate (%)=[1- (cpm of treated cells/cpm of non-treated cells)]×100.
2) 인터페론 감마 처리 후 위암세포주의 세포 주기 분석
세포주기 분석에는 Becton Dickinson사의 세포주 기 분석 kit (Becton Dickinson, Mountain View, CA, USA)를 사용하였다. 요약하여 기술하면 암세포 배 양액에 1,000 U/mL의 인터페론 감마를 더해주고 24, 48, 72시간 동안 각각 배양한 후 수확하였다.
Trypsin과 spermine을 포함하는 용액 A를 더하여 실 온에 10분간 둔 후 RNase와 trypsin 억제제를 포함 하는 용액 B를 더하고 다시 10분간 두었다. 마지막 으로 propidium iodide를 더하고 어두운 곳에서 10분 간 반응시켰다. 세포당 DNA 함량은 585 nm에서 나 오는 형광을 유세포 측정기로 측정해서 세포의 DNA 함량에 따라 세포주기 각 단계의 분포를 Cell fit 프로그램으로 분석하였다.
3) 인터페론 감마 처리 후 위암세포에서의 세포 주기 조절 인자 발현 분석
인터페론 감마가 위암세포에서 세포주기 조절 인 자로 알려진 단백질들의 발현에 어떤 영향을 미치는 지를 알고자, SNU-1과 SNU-16에 1,000 U/mL의 인 터페론 감마를 2, 4, 8, 24, 48시간 동안 각각 처리하 였고, 또한 SNU-1에는 10, 100, 1,000, 10,000 U/mL 의 인터페론 감마로 24시간 동안 각각 처리하여 배 양한 후 수확하였다. 원심분리 후 2x 시료 완충액 (20% glycerol, 5% -mercaptoethanol, 0.5% brom- phenol blue, 20% SDS, 0.0625 M Tris-HCl, pH 6.8) 에 희석하고 80℃의 heat block에서 5분간 처리하여 단백질을 완전히 변성시킨 후 30 g의 단백질을 포 함하는 세포 용해액을 Laemmli 방법에 의하여, Rb 단백질의 분석시에는 8%, 그 외는 10% SDS- polyacrylamide gel을 사용하여 전기영동하였다.19
표준 단백질로는 prestained molecular weight mar- ker (BioRad, Hong Kong)를 사용하였고 크기에 따 라 분리된 단백질을 nitrocellulose막(Schleicher &
Schuell)에 전기적으로 전이시키고 막을 5% skim milk를 포함한 TBS-T (50 mM Tris-HCl, pH 7.6, 150 mM NaCl, 0.05% Tween-20) 차단 완충액에 넣 어 실온에서 1시간 반응시켰다. 차단 후 막을 일차 항체 용액에 넣고 실온에서 1시간 흔들며 반응시킨 다음 TBS-T에 넣고 10분씩 3회를 흔들며 세척하였 다. 일차항체로는 anti-p27Kip1, anti-p21WAF1, anti-CDK2 (Transduction Laboratories, KY, USA), anti-cyclin D1, anti-cyclin E, anti-p16 (PharMingen, CA, USA) 및 anti-CDK4, anti-cyclin A, anti-Rb (IF8), anti- E2F-1 (Santa Cruz, CA, USA) 항체를 사용하였다.
일차항체 반응 후 horseradish peroxidase (HRP)가 붙은 anti-mouse IgG (H+L)(Transduction Laborato- ries, KY, USA) 및 anti-rabbit Ig (Amersham, Buc- kinghamshire, England) 이차항체를 차단 완충액에 각각 1:2,000과 1:1,000으로 희석하여 일차항체 때와 같이 반응시키고 TBS-T로 세척하였다. Chemilumi- nescence 기질용액(ECL, Amersham)에 막을 1분간 처리하고 plastic wrap으로 싸서 X선 film (X- Omat AR2, Kodak, Rochester, NY)에 노출시킨 후 현상하 였다.
Park et al. Effect of Interferon-γ on Stomach Cancer Cells 41
결 과
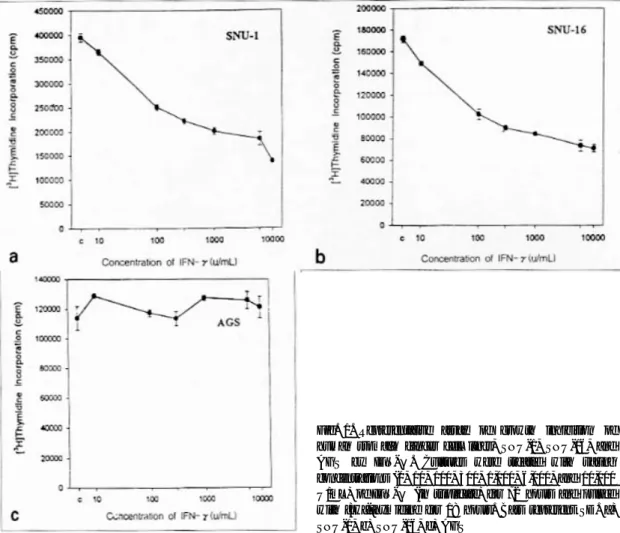
1. 인터페론 감마가 세포 성장에 미치는 효과 인체 위암세포주인 SNU-1, SNU-16는 인터페론 감마의 농도에 비례하여 성장이 억제되었으나, 또 다른 인체 위암세포주인 AGS는 인터페론 감마에 의 한 성장 억제 효과가 거의 없었다. SNU-1과 SNU- 16은 인터페론 감마에 의해 서로 유사한 성장 억제 효과를 보였는데, 10, 100, 300, 1,000, 6,000, 10,000 U/mL의 인터페론 감마를 처리하였을 때 SNU-1은 인터페론 감마의 농도가 증가할수록 각각 8, 37, 44, 50, 53, 65%의 성장 억제 효과를 보였고, SNU-16은 각각 14, 40, 48, 51, 58, 59%의 성장 억제 효과가 관 찰되었다. SNU-1과 SNU-16은 모두 1,000 U/mL 농
도에서 50% 정도의 세포 성장 억제를 보였다(Fig.
1).
2. 인터페론 감마가 세포주기에 미치는 효과 인터페론 감마에 의해 증식이 억제되는 SNU-1과 SNU-16을 대상으로 세포주기를 분석한 결과, 인터 페론 감마는 이들 모두에서 G1단계의 세포비를 증 가시키고 S단계의 세포비를 감소시킨 것으로 나타 났다. 또한 인터페론 감마를 처리한 시간이 길어질 수록 G1단계의 세포비 증가 및 S단계의 세포비 감 소 정도가 증가하였다. SNU-1에서는 1,000 U/mL의 인터페론 감마를 24시간 동안 처리하였을 때, 대조 군에 비하여 G1단계 세포가 43.8%에서 52.9%로 증 가하였고, S단계 세포는 54.6%에서 40.2%로 감소하 였으며, G2+M단계 세포는 1.5%에서 6.9%로 증가하
Fig. 1. Representative assay of growth inhibition of human stomach cancer cell lines, SNU-1, SNU-16, and AGS by IFN-γ. Cultures were treated with varing concentrations (0, 10, 100, 300, 1,000, 6,000, and 10,000 U/mL) of IFN-γ (in triplicate) for 72 hours and pulsed with [3H]-thymidine for 18 hours. Bars represent SD. a) SNU-1, b) SNU-16, c) AGS
42 대한소화기학회지 : 제 33 권 제 1 호 1999
였다. 같은 농도로 72시간 동안 처리시 G1단계 세 포가 47.0%에서 59.4%로 증가하였고, S단계 세포는 50.4%에서 35.3%로 감소하였으며, G2+M단계 세포 는 2.6%에서 5.3%로 증가하였다(Table 1). SNU-16 의 경우 같은 농도의 인터페론 감마를 24시간 동안 처리하였을 때 대조군에 비하여 G1단계 세포가 46.7%에서 64.0%로 증가하였고, S단계 세포는 36.1%에서 25.4%로 감소하였으며, G2+M단계 세포 는 17.2%에서 10.6%로 감소하였다. 같은 농도로 48 시간 동안 처리시에는 G1단계 세포가 54.6%에서 69.6%로 증가하였고, S단계 세포는 34.2%에서 20.5%로 감소하였으며, G2+M단계 세포는 11.2%에 서 9.9%로 감소하였다. 또한 같은 농도로 72시간 동 안 처리하였을 때는 G1단계 세포가 44.0%에서 72.5%로 증가하였고, S단계 세포는 51.0%에서 23.0%로 감소하였으며, G2+M단계 세포는 5.0%에 서 4.5%로 감소하였다(Table 2). SNU-1과 SNU-16 에 인터페론 감마를 24, 48, 72시간 동안 각각 처리 하여 관찰된 G1단계 세포의 증가와 S단계 세포의 감소는, 인터페론 감마의 처리에 의하여 G1에서 S 단계로의 진행이 억제된 것임을 보여준다. G2+M단
계의 세포비는 SNU-1에서는 증가하였으나 SNU-16 에서는 감소하여 인터페론 감마에 의한 성장 억제 효과에 중요한 영향을 미치는 것은 아니라고 생각된 다.
3. 인터페론 감마가 세포주기 조절 인자 발현에 미치는 영향
SNU-1과 SNU-16에서의 세포주기 조절 인자들의 발현 양상에 대한 인터페론 감마의 영향을 알아보기 위해 각 세포주에 인터페론 감마를 시간 및 농도별 로 처리하여 Western 분석하였다.
세포주기 역조절 인자인 p21WAF1은 SNU-1에서 1,000 U/mL의 인터페론 감마를 시간별(2, 4, 8, 24, 48시간)로 처리하였을 때 2시간부터 증가하여 24시 간이 경과 후 감소했다. SNU-16에서도 p21WAF1의 발현 증감이 관찰되었는데 인터페론 감마를 처리한 후 2시간 되는 때에 증가하였고 4시간부터 감소했다.
다른 세포주기 역조절 인자인 p27Kip1의 경우 SNU-1 에서는 큰 변화를 보이지 않았지만 SNU-16에서는 인터페론 감마를 처리한 후 2시간부터 증가하기 시 작해서 48시간까지 계속 증가하였다. 또 다른 세포 Table 1. Effects of IFN-γ on the Cell Cycle Distribution of SNU-1
Time (hours) IFN-γ (U/mL)
Cell cycle distribution (%)
G1 S G2+M G1:S ratio
24
72
0 1,000
0 1,000
43.8 52.9 47.0 59.4
54.6 40.2 50.4 35.3
1.5 6.9 2.6 5.3
0.8 1.3 0.9 1.7
Table 2. Effects of IFN-γ on the Cell Cycle Distribution of SNU-16
Time (hours) IFN-γ (U/mL)
Cell cycle distribution (%)
G1 S G2+M G1:S ratio
24
48
72
0 1,000
0 1,000
0 1,000
46.7 64.0 54.6 69.6 44.0 72.5
36.1 25.4 34.2 20.5 51.0 23.0
17.2 10.6 11.2 9.9 5.0 4.5
1.3 2.5 1.6 3.4 0.9 3.2
박민희 외 13인. Interferon-γ의 위암세포에 대한 영향 43
주기 음성 조절자인 p16INK4은 SNU-1의 경우 인터 페론 감마 처리한 후 2시간이 되는 때부터 증가하여 8시간부터 감소했고, SNU-16에서는 2시간부터 증 가하기 시작해서 8시간까지 계속 증가하다가 24시 간부터 감소했다.
Rb 단백질의 발현은 SNU-1과 SNU-16에서 인터 페론 감마를 처리했을 때 서로 다른 양상을 보였다.
SNU-1의 경우, 인터페론 감마를 처리한 후 24시간 부터 발현이 증가하였고, 특히 과인산화 형태의 Rb 가 증가하였다. 이에 비해 SNU-16의 경우에는 인터 페론 감마를 처리한 후 24시간부터 발현이 감소하였 으며, 과인산화 형태와 저인산화 형태의 비는 변화 하지 않았다.
S단계의 DNA 합성에 필요한 세포주기 조절 인자 인 E2F-1의 경우 SNU-1에서는 인터페론 감마 처리 시간에 따라 단백질 발현이 증가하였는데 인터페론 감마를 처리한 후 8시간부터 증가하기 시작해서 48 시간까지 계속 증가했다. SNU-16에서는 인터페론
감마를 처리한 후 2시간부터 감소하기 시작해서 48 시간까지 계속 감소하였다.
그 밖의 세포주기 조절 인자들인 cyclin D1, cyclin E, cyclin A, CDK2, CDK4는 SNU-1과 SNU-16에서 모두 인터페론 감마 처리 시간에 따라 각 단백질의 양이 변화하지 않았다. 인터페론 감마로 처리하였을 때 처리 시간에 따른 세포주기 조절 인자들의 변화 를 요약하면 다음과 같다(Fig. 2).
SNU-1의 경우 인터페론 감마를 농도별(10, 100, 1,000, 10,000 U/mL)로 24시간 동안 각각 처리하여 인터페론 감마의 농도에 따른 세포주기 조절 인자들 의 발현 양상을 알아보았다. Western 분석 결과 인 터페론 감마의 농도가 높아질수록 세포주기 음성 조 절자인 p21WAF1와 p27Kip1 발현이 증가하였다.
p21WAF1의 경우 10 U/mL로 처리한 때부터 증가 하기 시작해서 10,000 U/mL까지 계속적으로 증가하 였고, p27Kip1은 10 U/mL로 처리한 때부터 증가해서 1,000 U/mL부터는 감소하였다. 또한 G1에서 S단계 Fig. 2. (A), (B), (C), (D) Western blot analysis of the cell cycle regulators in SNU-1 and SNU-16. Cells were treated with IFN-γ (1,000 U/mL) for 2, 4, 8, 24, 48 hours. Cells were harvested and cell lysates were analyzed by Western blotting.
44 The Korean Journal of Gastroenterology : Vol. 33, No. 1, 1999
의 이행을 조절하는 cy clin D1도 인터페론 감마의 농도에 따라 발현 정도가 증가했는데, 10 U/mL로 처리한 때부터 증가하기 시작해서 10,000 U/mL까 지 증가하였다. 그러나 그 밖의 세포주기 조절 인자 들인 cyclin E, cyclin A, CDK2, CDK4, Rb, E2F-1 의 경우 인터페론 감마의 농도에 따라 단백질 양이 증가하지 않았다. SNU-1에서 인터페론 감마로 처리 하였을 때 처리한 농도에 따른 세포주기 조절 인자 들의 변화를 요약하면 다음과 같다(Fig. 3).
인터페론 감마 처리 후 시간별 변화와 인터페론 감마 농도에 따른 발현 변화를 종합해 볼 때, SNU-1 에서는 인터페론 감마에 의하여 p16INK4과 p21WAF1 의 발현이 증가하였고, SNU-16에서는 p16INK4, p21WAF1, p27Kip1의 발현이 증가하였다. 결과적으로 인터페론 감마가 세포주기 역조절 인자들인 p16INK4, p21WAF1, p27Kip1의 발현을 증가시켜 G1-S세포주기
과정이 차단되면서 세포의 성장이 억제된다는 것을 알 수 있었다.
고 찰
위암은 매우 예후가 좋지 않은 악성 종양의 하나 이며, 특히 한국인에게 그 발생 빈도가 높아 장기별 암 발생 빈도 1위를 차지하고 있다. 위암의 근치적 치료는 수술이지만 많은 환자가 진단 당시 이미 절 제가 불가능하며 임상적으로 절제가 가능한 경우에 도 실제 완치가 가능한 절제는 40% 이하이다.20 따 라서 진행 위암의 치료를 위하여서는 효과적인 전신 요법이 필요하나, 현재까지 개발된 항암화학요법으 로는 만족할 만한 결과를 얻지 못하고 있다. 또한 대 부분의 위암 환자가 진단 당시, 혹은 치료 과정 중 전이성 질환으로 진행된다는 사실을 고려할 때 위암 환자의 치료 성적을 향상시키기 위하여서는 보다 효 과적인 전신항암제요법의 개발이 절실히 요구된다.
근래 유전공학의 발전으로 유전자 재조합기법에 의한 cytokine의 대량 생산이 가능해지면서 여러 인 체암에 대한 이들의 항암 효과가 많이 연구되고 있 으며 이 중 일부는 임상적으로 이용이 가능하게 되 었다. 인터페론은 항바이러스 효과, 항암 효과 및 면 역조절 기능을 가진 당단백질로 hairy cell leukemia, adult T cell leukemia, 만성 백혈병, 다발성 골수종, 악성 흑색종, 신장암, 악성 림프종 등의 치료에 유효 성이 보고되고 있다. 인터페론 알파, 베타, 감마 중 알파 인터페론을 이용한 연구가 가장 많아서 신장암 이나 악성 흑색종의 경우 10%에서 20%의 반응률을 보이는 것으로 알려져 있고, 만성 골수종 백혈병의 경우 완전 관해율이 70% 이상인 것으로 보고되고 있다. 특히 최근에 클론된 인터페론 감마는 그 자체 의 성장 억제 효과가 우수하며, 저농도에서도 MHC class I 및 class II 항원과 2 5 -oligoadenylate syn- thetase의 유도가 뛰어나고 강력한 단핵구의 activa- tor로서 면역 조절 기능이 뛰어나서 알파나 베타 인 터페론보다 효과가 우수할 것으로 기대되고 있다.
단핵구는 인터페론 감마로 처리했을 때 활성화되어 NO synthease, TNF- , IL-1 등을 생산하게 된다. 인 터페론 감마에 의해 감작된 단핵구는 이후 촉발신호 Fig. 3. (A), (B), (C) Western blot analysis of the cell
cycle regulators in SNU-1. Cells were treated with IFN-γ (10, 100, 1,000 10,000 U/mL) for 24 hours. Cells were harvested and cell lysates were analyzed by Western blotting.
Park et al. Effect of Interferon-γ on Stomach Cancer Cells 45
(triggering signal)를 받게되면 완전히 활성화되어 종 양세포를 죽일 수 있는 능력을 획득하게 된다. 인터 페론을 포함한 생물학적 반응조절제(BRM; biolo- gical response modifier) 물질들은 그 자체의 종양에 대한 항증식 효과 외에도, 개체의 종양에 대한 면역 조절 기능이 항암 효과에 중요한 역할을 할 것으로 추정되고 있다. 이러한 경우 BRM들의 생체내 항암 효과는 투여량에 직선적으로 비례하지 않고 bell shape를 보이는 것으로 알려져 있어, 임상에 적용하 기 위해서는 최대의 항암 효과를 보일 수 있는 용량 즉 biologically active dose (BAD)를 결정하는 것이 중요하다. 이러한 연구는 in vivo 실험에서 계속되어 야 할 것으로 생각된다.
인터페론 감마의 직접적인 성장 억제 효과는 다 른 cytokine들과 함께 처리하였을 때, 더 좋은 효과 를 나타낸다는 보고가 있다.13,15,16,21-28 그러나 인터페 론 감마의 암세포에 대한 직접적 성장 억제 효과의 기전은 아직까지 알려져 있지 않다. 따라서 본 연구 에서는 3가지 인체 위암세포주를 사용하여 인터페 론 감마에 의한 직접적인 성장 억제 효과를 연구하 고 암세포의 증식 억제와 세포주기 조절 인자들의 발현 양상과의 관계를 밝히고자 했다.
본 실험에서 사용한 3가지 인체 위암세포주(SNU- 1, SNU-16, AGS) 중 SNU-1과 SNU-16은 한국인 위 암 환자에서 유래된 세포주로, 인터페론 감마를 처 리하였을 때 농도에 비례하여 성장이 억제되었다.
이에 비하여 AGS는 인터페론 감마의 농도에 따른 성장 억제 효과가 나타나지 않았다. 따라서 이 연구 에서는 위암 세포주의 2/3에서 인터페론 감마가 성 장 억제 효과를 나타내었으나, 인체 위암세포의 인 터페론 감마에 대한 전체적인 반응률을 알아보기 위 해서는 좀더 많은 세포주에 대한 연구가 있어야 할 것으로 생각된다.
이 실험을 위한 기초 실험으로 인터페론 감마와 함께 인터페론 알파와 IL-4의 직접적인 성장 억제 효과도 같이 시험해 보았다. 인터페론 알파는 10, 100, 300, 1,000, 3,000, 10,000 U/mL의 농도로 처리 하였을 때 SNU-1에서는 8, 16, 20, 30, 40, 44%, SNU-16에서는 3, 10, 20, 42, 65, 85%의 성장 억제 효과가 관찰되었다. 그러나 AGS에서는 성장 억제
효과를 보이지 않아 인터페론 알파는 인터페론 감마 와 유사한 양상으로 인체 위암세포주의 증식을 억제 하였다. IL-4는 위암세포와 인체 신장암세포를 비롯 한 몇 종류의 암세포에서 증식 억제 효과를 보인다 는 보고가 있었으나29-32 본 연구에 사용한 세 가지 의 인체 위암세포주에서는 SNU-1, SNU-16, AGS에 서 모두 성장 억제 효과가 나타나지 않았다. 따라서 종양의 종류에 따라 cytokine의 성장 억제 효과는 각각 다르게 나타나고 있으며 인터페론 알파와 감 마는 인체 위암세포주에서 동일한 반응 양상을 보 이나 같은 인체 위암세포주들 중에서도 인터페론에 대한 반응 양상은 개개의 세포주에 따라 차이가 있 었다.
최근 세포주기를 조절하는 분자적 기전에 관한 지식이 급속도로 증가함에 따라, 암세포의 증식을 억제하는 약제들의 작용 기전을 세포주기의 조절과 연관하여 이해하는 것이 가능하게 되었다. 예를 들 면 흑색종에서 세포 증식을 억제하는 TGF- 는 G1 단계의 세포비는 증가시키고 S와 G2+M기의 세포비 는 감소시켜 세포주기의 G1단계에서 S단계로 이행 하는 과정을 억제시킨다고 알려져 있으며,33 또한 위 암세포주에서도 IL-4가 G1단계에서 S단계로의 세포 주기 과정을 억제한다는 보고가 있다.29 본 실험에서 는 SNU-1과 SNU-16에 인터페론 감마를 24-72시간 처리하였을 때, G1단계의 세포비는 21-65% 증가하 였고 S단계의 세포비는 26-55% 감소한 결과를 얻었 는데, 인터페론 감마를 처리한 시간이 길수록 G1단 계의 세포비 증가 및 S단계의 세포비 감소율이 증가 하였다. 이상의 결과로 볼 때 인터페론 감마도 G1-S 이행단계에서 세포주기의 진행을 억제함으로써 인 체 위암세포주에 대한 성장 억제 효과를 나타낸다는 것을 알 수 있었다. 그러나 G2+M단계의 세포비는 SNU-1에서는 증가하고 SNU-16에서는 감소하여 일 정하지 않은 양상을 보였으므로 이 변화는 인터페론 감마의 성장 억제 효과에 중심적인 현상은 아닌 것 으로 판단하였다.
최근 인터페론 감마가 정상적인 인체 유선 상피 세포(mammary epithelial cell)에서 세포주기의 G1 단계를 차단하여 세포 성장을 비가역적으로 정지시 키며, 이때 저인산화 형태의 Rb가 증가되고 cyclin
46 대한소화기학회지 : 제 33 권 제 1 호 1999
A, c-myc, cdc2 단백질의 발현이 감소된다는 사실이 보고되었다.34 또 간세포에서 인터페론 감마가 p53 과 p21WAF1의 발현을 증가시켜 세포주기를 억제시킨 다고 보고된 바 있다.35 Cyclin은 세포주기의 진행에 따라 합성되고 파괴되는 것을 반복하면서 cyclin dependent kinase(이하 cdk)의 활성과 기질 특이성을 조절한다. 포유동물 세포에서는 G1에서 S단계의 이 행을 조절하는 G1 cyclin이 세포주기 조절의 중요한 인자로 생각되고 있다. G1 cyclin에는 세 종류의 cyclin D와 cyclin E 등이 있고, 이 중 cyclin D1은 대표적인 세포주기의 양성 조절 인자 중의 하나로 알려져 있다. 특히 두경부 편평세포암, 식도암, 유방 암, 폐암, 방광암 등 여러 종류의 인체암에서 cyclin D1이 과발현되거나 유전자가 증폭된 것이 보고되었 고,36-39 위암세포주를 IL-4로 처리하였을 때 세포의 성장 억제와 cyclin D1의 단백질 발현 감소가 관찰 된 바 있어 암유전자의 하나로 인식되고 있다.29 본 실험에서도 인터페론 감마가 G1단계에서 S단계로 의 진입을 억제하는 분자적 기전을 연구하기 위하 여 세포주기 진행에 관여하는 조절 인자들의 발현 을 분석해 보았다. SNU-1과 SNU- 16에 인터페론 감마를 처리하고 cyclin D1, cyclin E, cyclin A의 발 현 양상을 분석한 결과, cyclin 단백질들은 전반적으 로 인터페론 감마 처리에 따른 단백질 발현의 변화 를 보이지 않았지만 cyclin D1 단백질의 경우 SNU-1에서는 인터페론 감마의 농도가 높을수록 발 현 정도가 증가하는 것을 관찰할 수 있었다. 세포의 증식이 억제되었을 때 cyclin D1의 발현이 증가되는 이유는 확실치 않다.
CDK2 및 CDK4는 cyclin A, D, E와 결합하여 Rb 등의 기질 단백질을 인산화시킴으로써 G1-S 단계의 이행을 촉진한다.40 본 연구에서는 SNU-1과 SNU-16 모두에서 인터페론 감마의 처리에 의한 CDK2 및 CDK4의 단백질 발현의 변화는 거의 없는 것으로 나타났다. 그러나 CDK2와 CDK4는 단백질 발현 수 준이 변화되지 않더라도 cyclin과 CDK inhibitor들에 의해 kinase 활성이 변할 수 있으므로 kinase 활성에 대한 직접적인 연구가 필요한 것으로 생각된다.
Cyclin dependent kinase inhibitor (CDKI)로 알려 진 음성조절 인자에는 p16INK4, p21WAF1, p27Kip1 등이
있다. 이들은 cyclin-cdk 복합체에 결합하여 cdk를 불활성화시킴으로써 세포주기의 G1 arrest에 관여한 다.40-46 세포주기 음성조절 인자들은 세포주기의 진 행을 억제하므로 암 억제 유전자로 작용할 수 있다.
일부 암종에서는 이들 유전자의 결핍 혹은 유전자 를 불활성화시키는 기전이 암종 형성에 관여하는 것으로 보고되어 있다.45 또한 epidermal growth factor나 transforming growth factor로 처리한 세포에 서 G1 arrest에 의한 세포 증식 억제시 p21WAF1이나 p27Kip1의 발현이 증가된다는 보고도 있다.42,43 본 실 험에서도 SNU-1에 인터페론 감마를 처리한 후 농 도 또는 시간을 증가시켰을 때 시간 변화에 따라 p16INK4, p21WAF1, p27Kip1 중 p16INK4, p21WAF1이, 농 도 변화에 따라 p21WAF1, p27Kip1이 증가되는 것이 관찰되어 SNU-1 경우 세포주기의 G1 정지는 p16INK4, p21WAF1, p27Kip1의 발현 증가에 의해 매개 되는 것으로 생각된다. 또한 SNU-16에서도 인터페 론 감마의 처리 시간을 늘렸을 때 p16INK4, p21Kip1, p27Kip1이 증가하는 것이 관찰되어 SNU-1과 SNU-16 모두에서 CDKI가 인터페론 감마에 의한 성장 억제 효과를 유도하는 것으로 생각된다.
Rb 단백질은 세포주기의 G1-S 이행단계에서 중 요한 역할을 하는 것으로 알려져 있다.47,48 Rb 단백 질은 G1단계에서 탈인산화되고 S, G2, M단계에서 는 과인산화되는데, 저인산화된 Rb는 정상세포나 암세포에서 G1 점검점(check point)을 통과하는 데 가장 중요한 억제인자이다.29,37 저인산화 형태의 Rb 단백질은 E2F-1과 결합하여 E2F-1의 기능을 억제하 는데, E2F-1는 S단계의 개시에 필요한 여러 유전자 의 전사를 증가시킴으로써 G1-S단계의 이행을 촉진 하는 것으로 알려져 있다.47,48 p16INK4, p21WAF1, p27Kip1 등 세포주기 음성조절 인자들은 cyclin-cdk 복합체에 의한 Rb 단백질의 인산화를 억제하는 반 면, cyclin D1은 cdk4에 의한 Rb 단백질의 인산화를 증가시키는 작용을 하는 것으로 알려져 있다.40,43,46 위암세포주에 IL-4를 처리하였을 때와,29 림프종에 인터페론을 처리하였을때,49 성장 억제와 함께 저인 산화형태의 Rb가 증가하였다는 보고가 있다. 본 실 험에서는 SNU-1에 인터페론 감마를 처리하였을 때 처리한 시간에 따라 과인산화 형태의 Rb의 발현 증
박민희 외 13인. Interferon-γ의 위암세포에 대한 영향 47
가가, SNU-16에서는 Rb의 발현 감소가 관찰되었다.
이와 같이 SNU-1과 SNU-16에서 Rb의 발현은 서로 다른 양상을 보였는데, 흥미롭게 Rb에 의해 활성이 조절되는 E2F-1에서도 동일한 양상의 차이가 나타 났다. 즉, E2F-1의 발현은 인터페론 감마 처리 후 시 간의 경과에 따라 SNU-1에서는 증가하였으나, SNU- 16에서는 감소하였다. 위에서 기술한 바와 같 이 세포주기의 G1 정지는 주로 Rb가 E2F-1과 결합 하여 E2F-1의 기능을 억제하여 이루어지는 것으로 되어있는데, 본 실험의 결과 SNU-1에서는 Rb와 E2F-1의 발현이 함께 증가하고 SNU-16에서는 함께 감소하는 양상으로 나타났다. 그러므로 인터페론 감 마에 의한 세포주기의 G1 정지 때 Rb와 E2F-1의 병 합 효과가 어떻게 나타나는지에 대해서는 이 결과 만으로는 판단하기가 어렵다. 이것을 해결하기 위해 서는 Rb와 결합하여 활성이 억제된 E2F-1과 Rb와 결합하지 않은 E2F-1의 양을 비교하기 위한 실험이 필요할 것으로 사료된다. 결론적으로 3가지 인체 위 암세포주(SNU-1, SNU-16, AGS)에서 인터페론 감 마의 성장 억제 효과를 시험한 결과 그 중 SNU-1과 SNU- 16에서 세포주기의 G1정지를 동반한 세포 성 장 억제 효과와 함께 세포주기 음성조절 인자인 p16INK4, p21WAF1, p27Kip1의 증가가 관찰되었다. 이는 인터페론 감마가 세포주기 음성조절 인자들의 발현 을 증가시켜, 세포주기 진행 억제 및 세포의 성장 억제 효과를 나타내는 것으로 생각된다. 추후 보다 많은 인체 위암세포주를 이용한 연구와 nude mouse 를 이용한 in vivo 실험에서의 성장 억제 효과 확인 이 필요하다고 생각된다.
요 약
목적: Helper T cells로부터 분비되는 인터페론 감마는, MHC class II 항원의 발현을 유도하여 cytotoxic T cells의 활성을 촉진하는 cytokine으로, 항암제로의 이용 가능성이 활발히 연구되고 있다.
그러나 인터페론 감마와 위암세포의 관계에 대한 연 구는 매우 미흡하여 인터페론 감마가 위암세포의 성 장과 세포주기에 미치는 영향이 확립되지 않고 있 다. 따라서 본 연구에서는 인터페론 감마에 의한 직
접적인 위암세포의 성장 억제 효과와 세포주기 조절 인자들의 발현 양상과의 관계를 밝히고자 했다. 대 상 및 방법: 위암세포인 SNU-1, SNU-16, AGS에 인 터페론 감마를 처리하여 세포 성장 억제 효과와 세 포주기 조절 인자들의 발현 양상을 관찰하였다. 인 터페론 감마에 의한 세포 성장 억제 효과는 [3H]- thymidine 통합 분석법을 이용하였다. SNU-1, SNU- 16, AGS에 인터페론 감마를 0, 10, 100, 1,000, 6,000, 10,000 U/mL로 각각 처리하여 72시간 동안 배양, [3H]-thymidine를 처리하고 18시간 후에 수확 하여 DNA에 통합된 [3H]-thymidine 양을 측정하였 다. 세포주기 조절 인자들의 발현 양상은 SNU-1, SNU-16에 각각 1,000 U/mL의 인터페론 감마를 0, 2, 4, 8, 24, 48시간 동안 처리하여 Western 분석법 을 이용하여 관찰하였다. 결과: 인터페론 감마에 의 한 세포 증식 분석 결과, SNU-1은 농도가 증가할수 록 8, 37, 44, 50, 53, 65%의 성장 감소를 보였고 SNU-16은 14, 40, 48, 51, 58, 59%의 감소를 보였 다. 그러나 AGS에서는 농도에 따른 의미있는 변화 가 관찰되지 않았다. SNU-1, SNU-16에서 세포주기 조절 인자들의 인터페론 감마에 의한 발현 양상을 Western 분석한 결과, 세포주기 조절 과정에서 cdk inhibitor로 알려진 p21, p27, p16은 인터페론 감마 처리 후 증가하였으나, 그 외의 세포주기 조절 인자 들인 cyclin D1, cyclin E, cyclin A, CDK2, CDK4, Rb는 의미있게 변화하지 않았다. 결론: 인터페론 감 마는 SNU-1, SNU-16에 성장 억제 효과가 있었으 며, 인터페론 감마에 의한 위암세포 증식 억제 효과 는 cdk inhibitors인 p21, p27, p16의 증가에 의한 것 으로 생각된다.
색인단어: 인터페론 감마, 증식 억제 효과, 위선암
참 고 문 헌
1. Kono S, Hirohata T. Nutrition and stomach cancer Cancer Causes Control 1996;7:41-55.
2. Issacs A, Lindemnamm J. Virus interference: I. The Interferon. Proc R Soc Lond [Ser B] 1957;147:258 265.
48 The Korean Journal of Gastroenterology : Vol. 33, No. 1, 1999
3. Darnell JE Jr, Kerr IM, Stark GR. Jak-Stat pathway transcriptional activation in response to IFNs and other extracellular signalling proteins. Science 1994;
264:1415-1421.
4. Fresa KL, Murasko DM. Role of natural killer cell in the mechanism of the antitumor effect of inter feron on Noloney sarcoma virus transformed cells Cancer Res 1986;46:81-88.
5. Fidler IJ. Macrophages and metastasis-a biological approach to cancer therapy. Cancer Res 1985;45 4714-4726.
6. Shimada S, Ogawa M, Schlom J, Greiner JW. Com parison of the interferon-gamma-mediated regulation of tumor associated antigens expressed by human gastric carcinoma cells. In Vivo 1993;7:1-8.
7. Ibrahim L, Dominguez M, Yacoub M. Primary hu man adult lung epithelial cells in vitro response to interferon-gamma and cytomegalovirus. Immunology 1993;79:119-124.
8. Bradley EC, Ruscetti FW. Effect of fibroblast, lym phoid, and myeloid interferons on human tumor colony formation in vitro. Cancer Res 1981;41:244- 249.
9. Ludwig CU, Durie BGM, Salmon SE, Moon TE Tumor growth stimulation in vitro by interferon. Eu J Cancer 1983;19:1625-1632.
10. Jonak GJ, Friedland BK, Anton ED, Knight E Jr Regulation of c-myc RNA and its proteins in Daud cells by interferon-beta. J Interferon Res 1987;7:41- 52.
11. Samid D, Chang EH, Friedman RM. Biochemica correlates of phenotypic reversion in interferon-trea ted mouse cells transformed by a human oncogene Biochem Biophys Res Commun 1984;119:21-28.
12. Berry DE, Li Y, Schmidt B, et al. Retinoblastoma protein inhibits IFN-γ induced apoptosis. Oncogene 1996;12:1809-1819.
13. Ono M, Tanaka N, Orita K. Positive interactions between human interferon and cepharanthin against human cancer cells in vitro and in vivo. Cance Chemother Pharmacol 1994;35:10-16.
14. Markman M, Reichman B, Hakes T, et al. Intraperi
toneal chemotherapy in the management of ovarian cancer. Cancer 1993;71:1565-1570.
15. Lejeune F, Bauer J, Leyvraz S, Lienard D. Dissemi nated melanoma, preclinical therapeutic studies, clinical trials, and patient treatment. Curr Opin On- col 1993;5:390-396.
16. Chen JT, Hasumi K, Masubuchi K. Interferon- interferon-γ and sizofiran in the adjuvant therapy in ovarian cancer. A preliminary trial. Biotherapy 1992 5:275-280.
17. Wandl UB, Kloke O, Nagel-Hiemke M, et al Combination therapy with interferon -2b plus low-dose interferon-γ in pretreated patients with Ph-positive chronic myelogenous leukemia. Br J Haematol 1992;81:516-519.
18. 송형근, 박성희, 김노경, 이상국. 인체종양세포주들에 대한 재조합 감마인터페론의 세포살해능, 증식억제능, HLA항원 표현에 관한 연구. 대한의학협회지 1990;
33:292-304.
19. Laemmli UK. Cleavage of structural proteins during the assmbly of the head of bacteriophage T4. Nature 1970;227:680-685.
20. Lawrence WT, Lawrence W Jr. Gastric Cancer: the surgeon' s viewpoint. Semin Oncol 1980;7:400-417.
21. Delvenne P, al-Salah W, Gilles C, Thiry A, Bonive J. Inhibition of growth of normal and human papillomavirus-transformed keratinocytes in monola- yer and organotypic cultures by interferon-γ and tumor necrosis factor- . Am J Pathol 1995;146 589-598.
22. Mallat A, Preaux AM, Blazejewski S, Rosenbaum J Dhumeaux D, Mavier P. Interferon- and γ inhibi proliferation and collagen synthesis of human Ito cells in culture. Hepatology 1995;21:1003-1010.
23. Mauerhoff T, Belflore A, Pujol-Borrell R, Bottazzo GF. Growth inhibition of human endothelial cells by human recombinant tumor necrosis factor α and interferon-γ. Tumor 1994;80:301-305.
24. Snoeck HW, Van Bockstaele DR, Nys G, et al Interferon-γ selectively inhibits very primitive CD342+CD38- and not more mature CD34+CD38+
human hematopoietic progenitor cells. J Exp Med
Park et al. Effect of Interferon-γ on Stomach Cancer Cells 49
1994;180:1177-1182.
25. Palumbo A, Battaglio S, Napoli P, et al. Recom binant Interferon-γ inhibit the in vitro proliferation of human myeloma cells. Br J Haematol 1994;86:
726-732.
26. Jetten AM, Nervi C, Vollberg TM. Control o squamous differantiation in tracheobronchial and epidermal epithelial cells: role of retinoids. Monogr Natl Cancer Inst 1992;13:93-100.
27. Jia SF, Kleinerman ES. Antitumor activity of TNF , IL-1, and IFN-γ against three human osteosarco ma cell lines. Lymphokine Cytokine Res 1991;10 281-284.
28. Baron S, Tyring SK, Fleischmann WR Jr, et al. Th interferons: mechanisms of action and clinical appli cations. JAMA 1991;266:1375-1383.
29. Morisaki T, Uchiyama A, Yuzuki D, Essner R Morton DL, Hoon DSB. Interleukin 4 regulates G1 cell cycle progression in gastric carcinoma cells Cancer Res 1994;54:1113-1118.
30. Hoon DSB, Banez M, Okun E, Morton DL, Irie RF Modulation of human melanoma cells by interleu kin-4 and in combination with γ-interferon or α tumor nectrosis factor. Cancer Res 1991;51:2002- 2008.
31. Toi M, Bicknell R, Harris AL. Inhibition of colon and breast carcinoma cell growth by interleukin-4 Cancer Res 1992;52:275-279.
32. Obiri NI, Hillman GG, Haas GP, Sud S, Puri RK Expression of high affinity interleukin-4 receptor on human renal cell carcinoma cells and inhibition o tumor cell growth in vitro by interleukin-4. J Clin Invest 1993;91:88-93.
33. Rodeck U, Melber K, Kath R, et al. Constitutive expression of multiple growth factor genes by melanoma cells but not normal melanocytes. J Inves Dermatol 1991;97:20-26.
34. Harvat BL, Jetten AM. γ-interferon induces an irreversible growth arrest in mid-G1 in mammary epithelial cells which correlates with a block in hyperphosphorylation of retinoblastoma. Cell Gro wth Differ 1996;7:289-300.
35. Kano A, Watanabe Y, Takeda N, Aizawa S, Akaike T. Analysis of IFN-γ-induced cell cycle arrest and cell death in hepatocytes. J Biochem 1997;121:677 683.
36. Karp JE, Broder S. Molecular foundations of cancer new targets for intervention. Nat Med 1995;1:309- 320.
37. Jiang W, Zhang YJ, Kahn SM, et al. Altered expression of the cyclin D1 and retinoblastoma genes in human esophageal cancer. Proc Natl Acad Sci USA 1993;90:9026-9030.
38. Lukas J, Pagano M, Staskova Z, Draetta G, Bartek J. Cyclin D1 protein oscillates and is essential fo cell cycle progression in human tumour cell lines Oncogene 1994;9:707-718.
39. Bartkova J, Lukas J, Muller H, Strauss M, Gusterson B, Bartek J. Abnormal patterns of D-type cyclin expression and G1 regulation in human head and neck cancer. Cancer Res 1995;55:949-956.
40. Serrano M, Hannon GJ, Beach D. A new regulatory motif in cell-cycle control causing specific inhibition of cyclin D/CDK4. Nature 1993;366:704-707.
41. Toyoshima H, Hunter T. p27, a novel inhibitor o G1 cyclin-Cdk protein kinase activity, is related to p21. Cell 1994;78:67-74.
42. Fan Z, Lu Y, Wu X, DeBlasio A, Koff A Mendelsohn J. Prolonged induction of p21Cip1/
WAF1/CDK2/PCNA complex by epidermal growth factor receptor activation mediates ligand-induced A431 cell growth inhibition. J Cell Biol 1995;131 235-242.
43. Polyak K, Lee MH, Erdjument-Bromage H, et al Cloning of p27Kip1, a cyclin-dependent kinase inhi bitor and a potent mediator of extracellular antimi togenic signals. Cell 1994;78:59-66.
44. Coats S, Flanagan WM, Nourse J, Roberts JM Requirement of p27kip1 for restriction points contro of the fibroblast cell cycle. Science 1996;272:877- 880.
45. Kawamata N, Seriu T, Koeffler HP, Bartram CR Molecular analysis of the cyclin-dependent kinase inhibitor family: p16 (CDKN2/MTS1/INK4A), p18
50 대한소화기학회지 : 제 33 권 제 1 호 1999
(INKC) and p27 (Kip1) genes in neuroblastomas Cancer 1996;77:570-575.
46. Harper JW, Adami GR, Wei N, Keyomarsi K Elledge SJ. The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases.
Cell 1993;75:805-816.
47. Sherr CJ. Cancer cell cycles. Science 1996;274 1672-1677.
48. Weinberg RA. The retinoblastoma protein and cell cycle control. Cell 1995;81:323-330.
49. Resnitzky D, Tiefenbrun N, Berissi H, Kimchi A.
Interferon and interleukin 6 suppress phosphoryla- tion of the retinoblastoma protein in growth sensitive hematopoetic cells. Proc Natl Acad Sci USA 1992; 89:402-406.