Printed in the Republic of Korea
291
단 신
근대 뿌리를 이용한 도파민의 정량에 대한 연구
권효식*·김현정·윤길중†·박용남‡
충북대학교사범대학과학교육학부
†청주대학교자연과학부
‡한국교원대학교화학교육과
(2007. 1. 23 접수)
Chard Root-Tissue Based Biosensor for the Determination of Dopamine
Hyoshik Kwon
*, Hyunjung Kim, Kil-Joong Yoon
†, and Yongnam Pak
‡School of Science Education, Chungbuk National University, Cheongju 361-763, Korea
†Division of Applied Sciences, Chongju University, 360-764, Korea
‡Department of Chemistry Education, Korea National University of Education, Cheong-Won, Chungbuk 363-791, Korea (Received January 23, 2007)
주제어: Chard Root-Tissue Based Biosensor, Dopamine, Carbon Paste Electrode
Keywords: Chard Root-Tissue Based Biosensor, Dopamine, Carbon Paste Electrode
1.
서 론생체반응에활성인효소를촉매로사용하여바이오
센서를제작하는개념이 1962년 Clark등에의하여처
음으로제안되었고,1 1967년에 Updike등은이에관한
논문을발표하였다.2
감응전극(작업전극)에동물 또는식물 조직으로부
터추출된효소를고정하여도잘감응한다는사실이
알려진이후 Mascini는처음으로동식물조직을이용
한전류법 바이오센서를보고하였는데, 이것은산소
감응전극에소의간조직을고정시켜서과산화수소를 정량한것이었다.3 그후, Wang등은버섯, 바나나, 고
추냉이뿌리의조직을이용 phenol 유도체를정량하였
고,4 Gunasingham등은혈액중에포함된 glucose를,5 Rosa
등은갯벌이나키위속에잔류하는유기농약을6정량
하였다. 또한 Conrath 등은감자를이용하여무기인산
을,7 Lee 등은미생물과 dithizone을이용하여 cyanide
와납을정량하였다.8이와같이바이오센서는유기
물뿐만아니라무기물의정량에도이용되어왔다.
Dopamine은인간의몸에서신경전달 물질로서중
요한생물학적아민으로알려져있다. 즉, dopamine은
파킨슨씨병(Parkinson’s disease)9, 근육고정(muscular immobility), 신경관종양(neural crest tumor)10그리고 마약 중독자의정신분열적인 행동과관련이있다고 보고되었다.11
Dopamine 정량을위한바이오센서로서 tyrosinase,
catechol oxidase 및 lactase12-13와같은순수한효소로
만든 dopamine 바이오센서와 바나나, 감자, 버섯, 사
과, 아보카도등의식물조직을사용한 dopamine 바이
오센서가 보고된 바 있다.14-18 Tyrosinase, catechol
oxidase 및 lactase 전극은 예외적으로낮은 특이성
(specificity), 낮은감도, 낮은재현성을나타내었으며,
전극의수명은 3~4일이었다.19-20
식물조직의세포막은세포막속에들어있는효소들 이비활성화되는것을잘보호해주지만효소가빠르 게부패됨으로서감응물질로서의 효용성이 크게줄
어들수있다. Tan 및 Chen 등은22식물조직으로부터
부패과정의원인을 알아내어생분해를시키는 유기 물질들을사전에제거하는전처리과정을수행함으로 서이문제를해결하였다. 이들은전처리한 dopamine
센서를사용한결과 3개월이상동안센서의특성을
나타났다고보고하였다.17,18
Biosensor에사용되는 dopamine정량의첫간행물중 의하나는 Sidwell과 Rechnitz21에의해보고되었는데 흑연가루와미네럴 oil, 소량의바나나로만든바나나 전극이었다. 바나나에서 polyphenol oxidase 효소는일 반적인 current에서나타나는 dihydroxy 형태에서 돌
아온 quinone을전기화학적으로환원시키며 dopamine
의농도에직선으로비례한다.
Caruso 등22은 Cara(Dioscorea bulbifera) 뿌리로부터 추출한 polyphenol oxidase를이용하여 dopamine을정
량하였다. Pravda 등23은고성능액체크로마토그래피
(HPLC)의전기화학적검출기로서유리질탄소전극과
tyrosinase를고정한고체탄소반죽전극 (SCPE)을이
용하여 dopamine을정량하여두전극을비교하였다.
검출기의안정성과선택성은이동상의 pH에크게영 향을받는다는것을알았다.
최근 Karina 등은서양호박(zucchini)의추출물을이
용하여 dopamine을정량할수있는방법을보고하였
으며검출한계는 2.6×10-5 M임을보고하였다.24
본연구에서는아직까지보고된바없는근대뿌리
조직을이용한 dopamine 센서의전기화학적특성을
알아보고자한다.
재료 및 방법
기기 및 시약
본실험은 20 mL들이의부피를갖는 BAS Model
VC-2 Voltammetric cell을사용하였다. 이 cell에구멍
뚫린 teflon 마개로막은 다음작업전극, 기준전극으
로 Ag/AgCl (Model Re-1 BAS) 및백금 보조전극을
마개에구멍에고정하며Fig. 1와같다. 일정전압에서
전류측정은 EG&G Princeton Applied Research Model 264A Sacanning Potentiostat를사용하였으며, Kipp &
Zonnen recorder를사용하였다. 마이크로피펫(100 µL)
은 Gilson 사의것을사용하였다. Graphite powder는 Kanto Chemical Co. Inc. 제품을, 완충용액을만드는
데사용한 KH2PO4및 K2HPO4는 Shinyo 사의시약을,
기질로사용한 dopamine은 Aldrich 사의제품을사용
하였다. 전극을제작하는데사용된 mineral oil, ferrocene
및 chloroform은 Aldrich 사의제품을사용하였다. 방
해물질의효과를알기위하여사용된 ascorbic acid은
화공순약공업주식회사의제품을, glucose는순정화학
주식회사(일본)제품, potassium tartrate, sodium bicarbonate,
glycine은임순약공업주식회사(일본, GR)제품을, urea
는 Osaka Hayashi Pure Chemical Industries Ltd., Japan
제품을사용하였다. 전극제작에사용된근대뿌리는 충북대학교사범대학건물의주변밭에서재배한것 을사용하였으며, 4oC 이하로유지된냉장고에깨끗 이씻은상태로밀폐시켜보관하면서필요시사용하 였다. 완충용액은 pH는 0.050 M KH2PO4용액과 0.050M
K2HPO4용액의부피비를적절히조합하여결정하였
으며, 완충용액의 pH 측정을 위하여 digital pH/ion meter(Model DP-215)가사용되었다. 모든용액은증 류수를이용하여제조되었으며, 항상실험직전에새 로만들어사용하였다.
전극의 제조 및 신호 측정
10%의근대뿌리조직과 9%의 ferrocene을포함하 는전극의제조과정은다음과같다. 0.09 g의 ferrocene
을 20 mL의 CHCl3에녹인후 0.91 g의 graphite powder
와균일하게혼합시킨다음 hot plate위에서용매를증
발시켰다. 혼합물 0.60 g을취하여 mineral oil 0.40 g
과혼합하여탄소반죽을만든후, 이반죽 0.110 g에
파쇄한근대뿌리조직 0.055 g을추가한후, 완전히
혼합시킨순수탄소반죽이채워진직경 6 mm, 길이
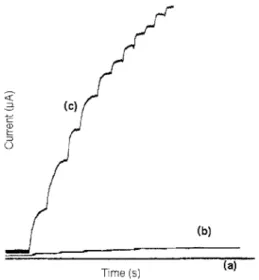
Fig. 1. Curremt-time recordings obtained at (a) 9% ferrocene modified carbon paste electrode, (b) 40% chard root tissue modified carbon paste electrode, (c) 40% chard root tissue and 9% ferrocene modified carbon paste electrode on increasing the dopamine substrate concentration. Successive increments of 0.010 M dopamine. Operating potential, -0.15 V.
pH=6.53, 0.010 M phosphate buffer. Stirred 300 rpm.
70 mm 원통형유리관끝부분 1 mm에충진시켜 Cu
도선으로연결하여제작하였으며Fig. 2과같다.
감응전류의 측정은 각각의 명시된전극전위에서,
10 mL의인산완충용액을포함하고있는유리 cell에
0.010 M의 dopamine 용액을 20µL씩첨가한후첨가 전후의신호크기를감응전류로간주하여측정하였다.
그리고전류가측정되는동안 시료용액은 300 rpm
의속도로저어주었다.
필요에따라서근대뿌리조직과 ferrocene의함량
을조절하였고, 제조된전극을사용하지않을때에는 완충용액에넣어 4oC에냉장보관 하였으며모든실 험은실온에서측정하였다.
결과 및 고찰
본연구에서사용한근대의뿌리조직으로만든바 이오센서의메커니즘은다음과같다.
즉, 전극에 고정된 근대 뿌리에 들어있는 효소인
peroxidase는 dopamine을 dopaminequinone으로 산화 시키고, 산화된 peroxidase는일정전위기(potentiostat)
에의해다시 dopamine으로다시환원된다. 본연구
에서는이환원전류를전류법으로측정하였다. 한편,
살아있는조직으로만든전극은순수한효소로만든 전극보다더오래사용할수있고, 유기체에존재하 는다른효소에의한간섭이나타나지않는장점이있다.
근대의각조직부위에따른감응전류의변화를조 사한결과 줄기(stem), 잎(leaf), 뿌리(root) 순으로감 응도가증가하였다. 특히뿌리는잎보다 3.4배정도 신호가크게나타났으며, 줄기보다는감도가약 7배 정도증가하였다. 따라서본연구에서는 dopamine 정 량실험에뿌리조직을사용하였다.
Dopamine의 농도 및 pH에 따른 감응 전류의 변화 Fig. 1은인산완충용액 (pH=6.53) 10 mL에 0.010 M
의 dopamine 용액 20 µL가누적적으로 10회첨가되 는동안에 40%의근대 뿌리조직과 9%의 ferrocene
을포함한전극(c), 40%의근대뿌리조직만을 포함
한전극(b), 9%의 ferrocene만을포함한전극(a)의반
응전류 (-0.15V vs. Ag/Agcl)의변화를보여주는전형
적인 예이다. Fig. 1(a)에서 계단이 시작되는 곳은
dopamine의첨가시점을나타낸다.
근대조직을포함하지않은전극 (a)의경우는거의
감응을보이지않았으며, 근대뿌리조직만을포함한 전극(b)는 (a)에비하여감응은나타났지만 (c) 전극에
비해좋은감응이라할수없다. 이것은 dopamine의
감응이 ferrocene보다는근대뿌리조직속에들어있
는효소에의한 것임을나타내고 있다. 근대조직과
ferrocene을포함한전극 (c)는기질의농도변화에대
해상당히좋은 감응을나타내고 있으며, 수초이내
에전류의정류상태를나타내고있다.
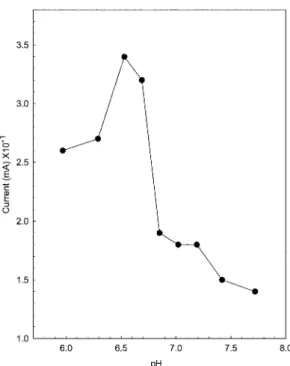
Fig. 2는인산완충용액에서근대조직전극의 pH의
존성을나타낸실험이다. Tu 등25은바이오센서의감
응은주로 pH와온도에의해영향을받는다고 보고
하였다. 이연구에서는 32oC, pH=6.0~8.0의범위에서 peak current가나타났다. Chen과 Tan26은각센서에
따라용액의 pH도달라졌는데, 감자는 pH=6.5, 사과
는 pH=5.56, 바나나는 pH=5.56, 버섯(mushroom)은
pH=7.4에서좋은감응전류를나타냈다고보고하였다.
본실험에서는작업전극의전위 -0.15 V에서인산
Fig. 2. Variation in current with pH. Other conditions were same as in Fig. 1.
완충용액(0.050 M KH2PO4: 0.050 M K2HPO4=8 : 2) pH
=6.53에서가장좋은감응전류를보여주고있었으며,
이값보다높거나낮은범위로갈수록반응전류값은 감소하고있었다. 따라서본실험에서안정적이면서 가장큰감응전류를나타낸 pH=6.53을선택하였다.
작업 전극의 전위에 대한 감응전류의 변화 Fig. 3은작업전극의전위에대한전류의의존도를
보여주고있다. pH=6.53인 0.010 M 인산완충용액에
0.010 M의 dopamine 용액 20 µL를넣었을때나타난 작업전극의전류를측정하였다. 본연구에서는작업 전극의전위를 0.00 V에서부터 -0.35 V까지 0.05 V씩
변화시킬때 -0.15 V의환원전위에서가장큰감응전
류를보인후감소하였다. 따라서본실험에서는감
응전류가높으면서잡음이적은 -0.15 V를작업전위
로선택하였다.
근대뿌리 조직의 함량변화에 따른 감응전류의 변화 전극의감응전류는조직의함량변화에크게의존하 고있다. 이것은탄소반죽의조직함량변화가전극의 효소함량변화를의미하기때문이다. 이때사용된탄
소반죽전극은예비실험을할때 9%의 ferrocene을넣 은전극을공통적으로사용하여실험하였다.
본연구에서는 15%에서 60%의넓은범위에서조 사한결과 Fig. 4에나타났듯이 40%의근대조직을 함유했을때가장좋은결과를나타내고있다. Fig. 4
에서 15%에서 40%까지는전류가증가하는것을볼 수있는데이것은근대조직의함량이증가함에따라 전극 표면의노출되는 촉매부위가증가하는것으로 볼수있으며27, Gunasingham 등은 일정량(여기서는
40%)이상에서전류가감소하는것은조직함량의증 가에따른전극의전도도감소로설명하고있다.28
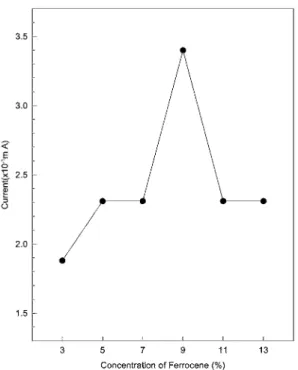
Mediator(ferrocene)의 함량의 변화에 따른 감응전 류의 변화
Fig. 6은 ferrocene의함량변화에 따른 감응전류의
변화를보여주고있다. pH=6.53인 0.010 M 인산완충 용액에근대뿌리조직은 40%로, 측정전위는 -0.15 V (vs. Ag/AgCl), dopamine 용액의농도는 0.010 M로고 정하였다.
Fig. 1에서보는 바와 같이순수한근대 조직만을 Fig. 3. Dependence of the biocatalytic current on the oper-
ating potential. Other conditions were same as in Fig. 1. Fig. 4. The effect of the tissue composition on the response the carbon paste electrode. Other conditions were same as in
Fig. 1.
함유했을때보다는이동매체인 ferrocene을함유했을 때더좋은감응전류를나타내고있었다. 즉, ferrocene
의함량이감응전류의크기에영향을미칠것으로예 상된다. 본연구에서는 ferrocene의함량을 3%에서
13%까지 2%씩변화시키면서측정해보았다. 그결과 예비실험에서와같이 9%를함유하였을때가장좋은 감응전류를나타내고있었다. Oungpipat 등은 ferrocene
을첨가하면근대조직이 ferrocene에대하여더넓은
접촉면적을제공하기때문에감응전류가증가한다고
설명하고있으며29, Senda 등은이동매체가다량첨가
될경우, 이동매체의농도변화가탄소반죽전극의전 도도를감소시키어감응전류가감소하는 것으로, 감 응전류가이동매체의농도에의존한다고하였다.30
방해물질의 영향
Table 1은방해물질의영향을살펴보기위하여, 분 석물질에존재할경우실험결과에영향을미칠수있 다고생각되는물질몇가지를선택하여조사한것이 다. Sotomayor 등31의연구에서 ascorbic acid, uric acid, acetaminophen은 dopamine을정량할때 ascorbic acid는 아주약간의방해가나타났으며, uric acid, acetaminophen
은신호의크기에영향을주지않았다고보고하였다.
본실험은지금까지알아본최적의조건에서실험 하였으며, 0.010 M의 dopamine용액을먼저첨가한후
여기에 0.010 M의방해물질용액을넣어주었다. 조사
결과 ascorbic acid, glucose, glycine, potassium tartrate, sodium bicarbonate, urea는 dopamine의신호크기에어
Fig. 5. Optimization of mediator concentration in the carbon paste electrode. Other conditions were same as in Fig. 1.
Fig. 6. Carlibration curve for dopamine. Other conditions were same as in Fig. 1.
Table 1. Interference studies of some important dopamine donors in the presence of dopamine
Compound* SX,dopamine/Sdopamine
Ascorbic acid 1
Glucose 1
Glycine 1
Potassium tartrate 1
Sodium bicarbonate 1
Urea 1
*Each injection changed in [interference] = 1.0×10-2M and [dopamine]=1.0×10-2M
**SX,dopamine: Steady-state sensitivity of interference in the presence of dopamine
Sdopamine : Steady-state sensitivity of dopamine
SX,dopamine/Sdopamine : Relative sensitivity
떠한영향도주지못하고있었다. 이것은 dopamine을 정량할때주위에이러한물질이들어있더라도영향 을미치지않으므로고려하지않아도됨을의미한다.
Dopamine의 정량에서 검정 곡선
Fig. 6에는 dopamine의정량실험에대한검정곡선
을나타내었다. Dopamine의양이 증가함에따라 전 류도비례하여증가함을 알수있다. 또한, Fig. 7은
dopamine의농도범위, 2×10-5~8×10-5에서의농도에대 한감응신호를나타낸것이다. 이농도 범위에서분 석물질의농도-전류의직선성이잘나타났음을알수 있다.
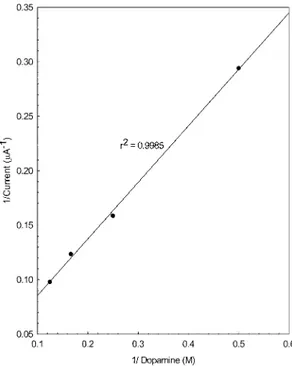
한편, Fig. 8은농도와전류의역수를도시한것으 로상관계수가 0.9985로좋은 직선성을나타내었다. Michaelis-Menten 식에 따라기질농도([S])를변화시 켜효소반응속도([ν])를실측하고 Lineweaver-Burk도 시를할때, 직선성이얻어지면 이반응은효소촉매 에의하여조절되는반응이다.29따라서Fig. 8의직선 성은전극의반응이촉매에의해조절되는효소반응 임을나타내고있다. 일반적으로따라서근대뿌리조
직을사용하여만든전극은 dopamine의농도를간편
하고정확하게측정할수있다. 최적조건에서분석시 료인도파민을가했을때신호의 95%가얻어질때까 지걸린시간, t95%는 12 s였으며, dopamine의검출한 계는 3×10-7 M이었다.
결 론
본연구에서는근대뿌리조직을탄소반죽에고정 시킨 바이오센서를 만들어, 수용액에서 dopamine을 정량할때의최적실험조건을제시하였다.
전극은 pH=6.53(0.01 M 인산 완충용액)에서가장
좋은감응을나타냈고, -0.15 V의환원전위에서가장
안정되고좋은감응을나타내었다. 또한, 40%의근대
뿌리조직과 9%의 ferrocene을포함한전극에서가장
좋은감응을나타내었다.
최적조건에서분석시료인도파민을가했을때신호 의 95%가얻어질때까지걸린시간, t95%는 12s였으며, dopamine의검출한계는 3×10-7 M이었다. 또한 dopamine
의양이증가함에따라전류도비례하여증가함을알 수있었고, 농도와전류의역수를도시한결과좋은 직선성이나타났다.
Fig. 7. Calibration curve for dopamine in range of 2×10-5M
~ 8×10-5M of dopamine. Other conditions were same as in
Fig. 1.
Fig. 8. Lineweaver-Burk plot of the same data as in Fig. 9.
Other conditions were same as in Fig. 1.
근대조직을이용한경우전극의우수한안정성과 감도를가지는것으로나타났으며, 전극을만들기가 쉽고, 순수한효소전극에비해매우저렴한가격으로
만들수있어 dopamine의정량에유용한바이오센서
이다.
본연구는 2006학년도충북대학교학술연구지원사
업연구비의지원에의해수행되었으며이에감사드 립니다.
인 용 문 헌
1. Clark, L. C.; Lyons, C.; Ann, N.Y. Acad. Sci. 1962, 102, 29.
2. Updike, S. J.; Hicks, G. P. Nature. 1967, 214, 986.
3. Mascini, M.; Jannello, M.; Palleschi, G. Anal. Chim.
Acta.1982, 138, 65.
4. Wang, J.; Naser N.; Kwon, H. S.; Cho, M. Y. Anal.
Chim. Acta1992, 2, 264, 7.
5. Gunasingham, H.; Tan, C. H. Analyst 1990, 115, 35.
6. Rosa, C. L.; Pariente, F.; Hernandez, L.; Lorenzo, E.
Anal. Chim. Acta1995, 308, 129.
7. Conrath, N.; Grundig, B.; Huwel, S.; Cammann, K. Anal.
Chim. Acta1995, 311, 281.
8. Lee, J. I.; Karube, I. Anal. Chim. Acta 1995, 313, 69.
9. Birkmayer, W.; Riederer, P. Understanding the Neu- rotransmitters, Springer, New York, 1989, p1-79. 10. Stenström, G.; Sjögren, B.; Waldenström, J. Acta Med.
Scand. 1983, 214, 145-152.
11. Cooper, J. R.; Bloom, F. E.; Roth, R. H. The Biochem- ical Basis of Neuropharmacology, Oxford University Press, New York,1986, p259-311.
12. Connor, M. P.; Sanchez, J.; Wang, J.; Smyth, M. R.;
Mannino, S. Analyst, 1989, 114, 1427-1429.
13. Petit, C.; Gonzalez-Cortes, A.; Kauffmann, J. M. Tal- anta, 1995, 42, 1783-1789.
14. Sidwell, J. S.; Rechnitz, G. A. Biotechnol. Lett. 1985, 7, 419-422.
15. Connor, M. P.; Wang, J.; Kubiak, W. Smyth, M. R.
Anal. Chim. Acta,1990, 229, 139-143.
16. Mazzei, F.; Botre, F.; Lanzi, M.; Lorenti, G.; Porcelli, F.; Botrè, C. Sens. Actuators B. 1992, 7, 427-430.
17. Tan, T. C.; Chen, Y. Sens. Actuators B. 1994, 17, 101-107.
18. Chen, Y.; Tan, T. C. Sens. Actuators B. 1995, 28, 39-48.
19. Horowitz, N. H.; Fling, M.; Horn, G. Methods in Enzy- mology, Academic press, New York, 1970,Vol.XVA, p615-620.
20. Ortega , F.; Domínguez, E. J. Biotechnol.1993, 31, 289- 21. Sidwell, J. S.; Rechnitz, G. A. 300. Biotechnol. Lett. 1985, 7, 22. Caruso, C. S.; Vieira, I. C.; Fatibello-Filho, O. 419. Anal.
Lett. 1999, 32, 39.
23. Pravda, M.; Petit, C; Michotte, Y.; Kauffmann, J. M.;
Vytras, K. J. Chromatogr. A. 1996, 727, 47.
24. Lupetti, K.O., Ramos, L.A., Vieira, I.C., and Fatibello- Filho, O. Il. Farmaco 2005, 60, 179-183.
25. Tu, Y. F.; Fu, Z. Q.; Chen, H. Y. Sensor and Actuators B. 2001, 80, 101.
26. Chen, Y. U.; Tan, T. C. Chemical Engineering Science, 1996, 7, 1027.
27. Wang, J.; Lin, M. S. Electroanalysis,1989, 1, 43.
28. Gunasingham, H.; Tan, C. H. Analyst, 1990, 115, 35.
29. Oungpipat, W.; Alexader, P. W.; Southwell-Keely, P. Anal.
Chim. Acta,1995, 309, 35.
30. Senda, M; Ikeda, T.; Miki, K.; Hasa, H. Anal. Sci. 1986, 2, 501.
31. Sotomayor, M. D. P. T.; Tanaka, A. A.; Kubota, A. T.
J. Electroanal. Chem., 2002, 536, 71-81.