789
비율을 이용한 병리학적 결과 예측 노모그램 개발과 기존 인자를 이용한 노모그램과의 비교
Development of Nomogram for Predicting Pathologic Outcome using Prostate-specific Antigen, Gleason Score, and the Percentage of Positive Core in the Clinically Confined Prostate Cancers, and Comparison with Nomogram using Existing Factors
Seong Jin Jeong, Byung Kyu Han, Ji Hyung Yu, June Hyun Han, In Ho Chang, Sung Kyu Hong, Seok Soo Byun, Sang Eun Lee
From the Department of Urology, Seoul National University Bundang Hospital, Seoul National University College of Medicine, Seongnam, Korea
Purpose: There have been reports that clinical stages do not reflect patients' postoperative prognosis well. On the contrary, the clinical application of the percentage of positive core (% (+) core), which predicts tumor volume has been increasing. We developed nomogram for predicting pathologic outcome using prostate-specific antigen (PSA), Gleason score and % (+) core based on data of radical prostatectomy and compared it with nomo- gram using clinical stage instead of % (+) core.
Materials and Methods: Two hundred and fifty nine patients with clini- cally confined prostate cancers were included in the study. Nomogram for predicting pathologic outcome was developed through multinominal logistic regression analysis, and pathologic outcomes were extracapsular invasion (ECE), seminal vesicle invasion (SVI) and bladder neck invasion
(BNI). The accuracy of each nomogram for predicting each pathologic outcome was compared on the basis of receiver operating characteristic
(ROC) curve analysis.
Results: The mean % (+) core was 24.6% and clinical stages T1c, T2a,b and T2c were 58.7%, 32.0% and 9.3%, respectively. ECE was observed in 45 (17.4%), SVI in 9 (3.5%), and BNI in 12 (4.6%). With an increase in PSA, Gleason score, clinical stage, or % (+) core, the incidence of extraprostatic involvement increased gradually. Two nomograms for predicting pathol- ogic outcome were developed. In quantifying expected predictive impro- vement, area under ROC curve for predicting ECE was greater in the nomogram using % (+) core than clinical stage (0.815 vs. 0.778). These values for predicting SVI were 0.886 and 0.760, respectively, and for predicting BNI, 0.743 and 0.764, respectively.
Conclusions: We developed nomogram for predicting pathologic outcomes using % (+) core instead of clinical stage. Nomogram using % (+) core pre- dicted ECE and SVI with greater accuracy than nomogram using clinical stage. (Korean J Urol 2007;48:789-796)
Key Words: Prostate cancer, Surgical pathology, Nomograms
대한비뇨기과학회지 제 48 권 제 8 호 2007
서울대학교 의과대학
분당서울대학교병원 비뇨기과학교실
정성진ㆍ한병규ㆍ유지형ㆍ한준현 장인호ㆍ홍성규ㆍ변석수ㆍ이상은
접수일자:2007년 5월 16일 채택일자:2007년 6월 29일
교신저자: 이상은
서울대학교 의과대학 분당서울대학교병원 비뇨기과 경기도 성남시 분당구 구미동 300
463-707
TEL: 031-787-7349 FAX: 031-787-4057 E-mail: selee@snubh.org
서 론
전립선암의 예측 병리학적 병기는 환자의 여명기간, 건강 상태와 함께 치료법 결정에 결정적인 요소이다. 전통적으 로 병리학적 병기는 임상적 국소 전립선암에서 시행되는 치료의 결과를 예측하는 데 가장 중요하기 때문에,1 치료 전에 이를 정확하게 예측하는 것이 필요하다. 수술 후의 병 리결과를 예측하고자, 지금까지 많은 노력이 있었고 대표 적인 것이 노모그램이다. 노모그램은 전통적인 예후 추정 방식과 달리, 다양한 수술 전 인자들을 조합하여 환자 개개 인의 병리결과나 생화학적 또는 국소 재발, 원격전이에 대 한 예후를 예측하는 방법으로, 결과가 일어날 개연성을 퍼 센트로 제시하는 확률 테이블 (probability table),2-4 연속적인 숫자로 표시되는 각 위험인자가 결과에 미치는 정도를 수 치로 표시하여, 그 합이 내포하는 퍼센트를 표시하는 확률 노모그램 (probability nomogram),5 artificial neural network6 등의 형식이 있다.
병리결과를 예측하는 노모그램은 전립선특이항원 (pros- tate-specific antigen; PSA), Gleason 점수, 임상적 병기를 조 합하여 1993년 Partin 등2이 처음 제안하였고 이후 많은 진 전이 있었다. PSA의 활용으로 전립선암이 조기에 발견되는 병기 이동 현상이 있기는 하지만, 노모그램 도입 초기인 1992-1998년에 임상적 국한암의 수술 후 병리 검사에서 실 제 국한암의 비율이 51.8%였으나, 노모그램 도입 10여 년이 흐른 2004-2005년에 73.7%로 상승하여,7 병리결과 예측 노 모그램은 그 효용성이 입증되고 있다. 그러나, 아직도 임상 적 국한암의 20-50%는 근치적 전립선적출술 후 병리 병기 T3 이상으로 밝혀지는 것을 감안하면,8 더 적절한 술 전 인 자를 이용한 노모그램의 발전이 필요하다고 생각한다.
최근 들어 임상적 병기 T1c의 비율이 60%를 넘고 있어,9 수술 환자의 예후에 임상적 병기의 중요성이 점차적으로 감소되고 있다.10 또 조기 진단으로 대개의 전립선암이 PSA 나 Gleason 점수가 비교적 낮은 상태에서 발견되기 때문에, 병리결과 예측 노모그램에 새로운 예측인자가 필요하다.
1990년대 후반부터 확대 생검법이 많이 사용되면서 과거 6 부위 생검 시대와 달리, 조직검사 소견의 여러 인자들을 최 종 병리결과 예측에 이용한 연구가 있었다.11 여러 조직검사 인자들 중에서 양성코어 비율 (전체 코어에서 양성 코어가 차지하는 비율)은 종양 용적의 유의한 예측인자이며,12 유 의한 예후인자로 보고되었다.11 저자들은 본 센터의 근치적 전립선적출술 자료를 이용하여 PSA, Gleason 점수, 양성코 어 비율을 이용하여 수술 후 병리결과 예측의 노모그램을 작성하고, 이를 기존의 인자 (PSA, Gleason 점수, 임상적 병
기)로 만든 노모그램과 비교하여 그 차이를 알아보고자 하 였다.
대상 및 방법
2004년 1월부터 2006년 6월까지 본원에서 전립선암의 초 기 치료로 개복 또는 복강경 근치적 후치골 전립선적출술 과 양측 골반 림프절 절제술을 시행 받은 임상적 병기 T2c 이하의 국한암 275례 중에서, 인구학적 특성, 경직장 조직 검사 소견 (종양의 유무, Gleason 점수, 양성코어 수, 양성코 어 비율), 그리고 최종 병리 병기를 모두 확인할 수 있었던 259례를 대상으로 하였다. 따라서 수술 전에 신보조요법을 받은 경우나, 임상 병기 T1a 또는 T1b는 제외하였다. 수술 전 PSA 측정은 방사면역측정법을 이용하였고 경직장 조직 검사는 필립스 메디칼시스템즈사의 HDI 5000 초음파 유도 하에 18 게이지 생검침을 이용하여 12코어를 기본으로 시 행하였다. 직장수지검사와 방사선학적 검사를 실시하여 임 상적 병기를 결정하였다. 조직검사와 수술 검체의 병리검 사는 모두 1명의 병리의가 실시하였다. 경직장 조직검사에 서 각 생검 코어의 종양 유무와 Gleason 점수를 평가하였으 며, 병리검사는 검체를 4mm 간격으로 연속적으로 횡단절 제하여, 2002년 AJCC TNM 병기를 기준으로, 종양의 위치, Gleason 점수, 피막외 침범, 절단면 양성, 정낭 침범, 방광목 침범, 림프절 침범 유무 등을 조사하였다. 피막외 침범은 병 리검사에서 전립선 피막 밖의 지방조직에서 암세포가 발견 되는 경우로 정의하였다. 환자의 나이, PSA, Gleason 점수, 전립선 용적, 병리학적 검사 등 임상병리학적 자료를 수집 하고 추가로 경직장 조직검사에서 양성코어 비율을 계산하 였다. 양성코어 비율은 전체 생검 코어수에서 종양 양성인 코어수가 차지하는 비율을 퍼센트로 표시하였다.
로지스틱 회귀분석을 실시하여 노모그램의 인자로 사용 될 임상적 병기, Gleason 점수, PSA, 양성코어 비율이 피막 외 침범, 정낭 침범, 방광목 침범 등 각각의 병리결과를 유 의하게 예측하는지 평가하였다. 임상적 병기는 T1c, T2a,b 그리고 T2c로 구분하였고 Gleason 점수는 6 이하, 7, 그리고 8 이상으로 구분하였으며, PSA는 3.0ng/ml 이하, 3.1-10.0ng/
ml, 10.1-20.0ng/ml 그리고 20.1ng/ml 이상으로 구분하였다.
양성코어 비율의 구분은 현재까지 제시된 임상적 기준은 없지만, 본 연구에서 각각의 병리결과를 통계적으로 유의 하게 예측하기 위해서 사등분 (quartile) 구분으로 25.0% 이 하, 25.1-50.0%, 50.1-75.0% 그리고 75.1% 이상으로 구분하 였다. PSA, Gleason 점수, 임상적 병기를 사용하여 다중명목 (multinominal) 로지스틱 회귀분석을 실시하였고, PSA, Gle- ason 점수, 양성코어 비율을 사용하여 같은 분석을 반복하
Table 1. General demographic and clinicopathological features of the patients in the study
No. of patients 259
Mean age (years) 64.6±7.0*
Mean PSA (ng/ml) 9.7±8.0*
Biopsy Gleason score
2-6 154 (59.5%)
7 86 (33.2%)
8-10 19 (7.3%)
Clinical T stage
T1c 152 (58.7%)
T2a,b 83 (32.0%)
T2c 24 (9.3%)
Mean % (+) core (%) 24.6%±19.2*
Extracapsular extension 45 (17.4%)
Seminal vesicle invasion 9 (3.5%)
Bladder neck invasion 12 (4.6%)
*continuous variables are expressed as mean±standard deviation.
PSA: prostate-specific antigen, % (+) core: percentage of positive core
Table 2. Clinicopathological parameters and pathologic outcomes after radical prostatectomy
Variables No. of patients ECE, No (%) SVI, No (%) BNI, No (%)
Clinical stage
T1c 152 21 (13.8) 5 (3.3) 6 (3.9)
T2a,b 83 17 (20.5) 4 (4.8) 2 (2.4)
T2c 24 7 (29.2) 0 (0.0) 4 (16.7)
Biopsy gleason score
2-6 154 12 (7.8) 4 (2.6) 4 (2.6)
7 86 26 (30.2) 2 (2.3) 6 (7.0)
8-10 19 7 (36.8) 3 (15.8) 2 (10.5)
Preoperative PSA (ng/ml)
0-3.0 12 0 (0.0) 0 (0.0) 0 (0.0)
3.1-10.0 160 18 (11.3) 3 (1.9) 4 (2.5)
10.1-20.0 67 17 (25.4) 2 (3.0) 6 (9.0)
≥20.1 20 10 (50.0) 4 (20.0) 2 (10.0)
% (+) core (%)
0-25.0 173 13 (7.5) 2 (1.2) 5 (2.9)
25.1-50.0 58 19 (32.8) 4 (6.9) 3 (5.2)
50.1-75.0 23 8 (34.8) 2 (8.7) 0 (0.0)
75.1-100 5 5 (100.0) 1 (20.0) 4 (80.0)
Total 259 45 (17.4) 9 (3.5) 12 (4.6)
ECE: extracapsular extension, SVI: seminal vesicle invasion, BNI: bladder neck invasion, PSA: prostate-specific antigen, % (+) core:
percentage of positive core
였다. 각각의 병리결과를 예측하는 회귀 모델의 내부 타당 도는 Pearson chi-square goodness-of-fit 분석13을 실시하여 평 가하였다. 회귀 모델에서 제시된 예측 가능성 (predictive probabilities)을 바탕으로 PSA, Gleason 점수, 임상적 병기를
이용한 노모그램과 PSA, Gleason 점수, 양성코어 비율을 이 용한 노모그램을 각각 제작하였다. 각각의 예측 병리결과 에 대해 수신자판단특성곡선하 면적을 비교하여 두 노모그 램의 예측 정확성을 비교하였다. 통계 처리는 Windows SPSS 13.0 프로그램을 이용하였고 통계적 유의성은 p값이 0.05 미만인 경우에 인정하였다.
결 과
환자들의 평균 나이는 64.6세 (43-78)였고 평균 PSA는 9.7ng/ml (0.7-65.0), 평균 Gleason 점수는 6.6이었다. 임상적 T 병기는 T1c, T2a, b, T2c가 각각 58.7%, 32.0%, 9.3%였고 평균 양성코어 비율은 24.6% (5.6-100.0)였다 (Table 1). 수술 후 병리검사 결과, 피막외 침범이 17.4% (n=45), 정낭 침범 이 3.5% (n=9), 방광목 침범이 4.6% (n=12)에서 확인되었다.
Table 2에 수술 전 임상병리학적 소견에 따라 각각의 병리 결과를 기술하였다. 임상적 병기 T1c의 13.8%에서 피막외 침범을 보였으며, T2c의 29.2%에서 피막외 침범을 보였다.
경직장 생검의 Gleason 점수 7인 경우, 30.2%에서 피막외 침범을 보였으며, Gleason 점수 8 이상인 경우의 36.8%에서 피막외 침범을 보였다. PSA가 20.1ng/ml 이상인 경우의 50%에서, 양성코어 비율이 75.1% 이상인 경우의 100%에서 피막외 침범을 보였다. 전체적으로 임상적 병기, Gleason 점
Table 3. Nomogram for the prediction of extracapsular extension, seminal vesicle invasion and bladder neck invasion according to preoperative prostate-specific antigen, biopsy-Gleason score and clinical stage
Biopsy-Gleason score
Clinical
Pathology PSA 0-3.0ng/ml PSA 3.1-10.0ng/ml PSA 10.1-20.0ng/ml PSA ≥20.1ng/ml
stage
≤6 7 ≥8 ≤6 7 ≥8 ≤6 7 ≥8 ≤6 7 ≥8
ECE T1c 1.7 7.1 4.5 17.4 17.0 11.5 36.8 36.2 26.4 61.1
T2a,b 1.9 7.9 5.1 19.2 18.9 12.8 39.7 39.1 29.0 64.6 64.0
T2c 4.3 16.7 11.0 35.7 25.6 60.6 60.0 81.0
SVI T1c 0.5 0.4 1.4 1.1 5.5 4.4 3.6 15.6 12.9 37.1
T2a,b 0.5 0.4 1.5 1.2 5.7 4.6 3.7 16.1 13.3 10.9 37.9
T2c 0 0 0 0 0 0 0 0
BNI T1c 0.6 1.2 1.6 3.3 4.7 4.2 8.5 11.8 10.6 26.6
T2a,b 0.2 0.5 0.6 1.3 1.9 1.7 3.5 5.0 4.4 9.0 12.5
T2c 3.1 6.4 8.0 15.6 19.0 33.4 41.9 57.7
PSA: prostate-specific antigen, ECE: extracapsular extension, SVI: seminal vesicle invasion, BNI: bladder neck invasion
Table 4. Nomograms for the prediction of extracapsular extension, seminal vesicle invasion and bladder neck invasion according to preoperative prostate-specific antigen, biopsy-Gleason score and percentage of positive core
Biopsy-Gleason score
% (+)
Pathology PSA 0-3.0ng/ml PSA 3.1-10.0ng/ml PSA 10.1-20.0ng/ml PSA ≥20.1ng/ml
core (%)
≤6 7 ≥8 ≤6 7 ≥8 ≤6 7 ≥8 ≤6 7 ≥8
ECE 0-25.0 1.8 4.7 4.2 10.6 9.4 9.7 22.3 20.1 20.6 37.9
25.1-50.0 10.7 9.8 22.5 20.3 20.8 41.3 38.2 38.9 63.0 59.9
50.1-75.0 9.9 21.0 41.6 63.3 60.2 80.7
75.1-100 63.6 78.8 91.1
SVI 0-25.0 0.4 0.1 1.1 0.3 1.7 3.2 0.8 4.9 9.1 13.6
25.1-50.0 0.2 2.8 0.7 4.3 7.9 2.0 12.0 20.7 5.8 29.3
50.1-75.0 2.4 6.9 1.7 5.0 26.3 13.8
75.1-100 4.3 48.3 29.6
BNI 0-25.0 0.9 1.1 1.6 1.9 2.2 2.8 3.3 3.8 4.9 6.5
25.1-50.0 2.5 3.7 4.3 5.0 6.4 7.4 8.5 10.9 12.4 14.1
50.1-75.0 4.9 8.4 9.6 15.9 17.9 25.1
75.1-100 20.1 34.1 44.2
PSA: prostate-specific antigen, % (+) core: percentage of positive core, ECE: extracapsular extension, SVI: seminal vesicle invasion, BNI:
bladder neck invasion
수, PSA, 양성코어 비율이 높아질수록 피막외 침범, 정낭 침범, 방광목 침범의 빈도도 증가하였다. 단변량 로지스틱 회귀분석에서 임상적 병기, Gleason 점수, PSA, 양성코어 비 율은 모두 유의하게 피막외 침범, 정낭 침범, 방광목 침범을 예측하였다. 그러나 다변량 분석에서 피막외 침범의 예측 에는 임상적 병기 (p=0.121), 정낭 침범의 예측에는 임상적 병기 (p=0.207)와 Gleason 점수 (p=0.052), 방광목 침범의 예 측에는 Gleason 점수 (p=0.054)가 각각 통계적 유의성을 상
실하였다.
각각의 병리결과를 예측하는 노모그램을 만들기 위하여 다중명목 로지스틱 회귀분석을 실시하였다. 각각의 병리결 과 예측에 있어 PSA, Gleason 점수, 임상적 병기를 이용하여 만든 회귀 모델은 Pearson chi-square goodness-of-fit 결과, 자 료에 적합한 것으로 확인되어 회귀 모델의 내부 타당도를 확인하였다. PSA, Gleason 점수, 양성코어 비율을 이용하여 만든 회귀 모델도 각각의 병리결과 예측에 내부 타당도가
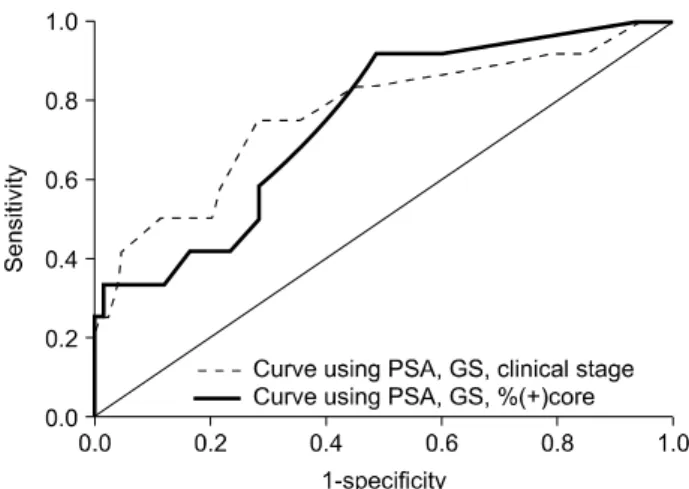
Fig. 2. Receiver operating characteristic curve analysis for com- parison of two nomograms for predicting seminal vesicle invasion in clinically confined tumor. Substantial improvement of 12.6% for the nomogram using % (+) core (AUC 0.886) compared with the nomogram using clinical stage (AUC 0.760) was noted. PSA: pros- tate-specific antigen, GS: Gleason score, % (+) core: percentage of positive core, AUC: area under curve.
Fig. 3. Receiver operating characteristic curve analysis for com- parison of two nomograms for predicting bladder neck invasion in clinically confined tumor. Accuracy of the nomogram using % (+) core (AUC 0.743) decreased by 2.1% compared with the nomo- gram using clinical stage (AUC 0.764). PSA: prostate-specific anti- gen, GS: Gleason score, % (+) core: percentage of positive core, AUC: area under curve.
Fig. 1. Receiver operating characteristic curve analysis for com- parison of two nomograms for predicting extracapsular extension in clinically confined tumor. Substantial improvement of 3.7% for the nomogram using % (+) core (AUC 0.815) compared with the nomogram using clinical stage (AUC 0.778) was noted. PSA: pros- tate-specific antigen, GS: Gleason score, % (+) core: percentage of positive core, AUC: area under curve.
적합하였다. 회귀 모델에서 제시된 예측 가능성을 바탕으 로 노모그램을 작성하였다. Table 3에 PSA, Gleason 점수, 임상적 병기를 이용하여 만든 노모그램이, Table 4에 PSA, Gleason 점수, 양성코어 비율을 이용하여 만든 노모그램이 제시되어 있다. 예를 들어, 수술 전 PSA 9.0ng/ml, Gleason 점수 7, 양성코어 비율 41.6%, 임상 병기 T2a,b인 경우, 기존 의 인자를 사용한 노모그램과 양성코어 비율을 이용한 새 노모그램을 비교해 보면, 피막외 침범의 예상 확률이 각각 19.2%와 22.5%, 정낭 침범의 예상 확률이 각각 1.2%와 0.7%, 방광목 침범의 예상 확률이 각각 1.3%와 4.3%였다.
수신자판단특성곡선하 면적으로 예측 정확성을 평가하였 을 때, 피막외 침범과 정낭 침범의 예측은 양성코어 비율을 이용한 새 노모그램이 더 우수하였다 (Fig. 1, 2). 방광목 침 범의 예측은 임상적 병기를 이용한 기존의 노모그램이 더 우수하였으나 새 노모그램과 예측 정확도의 차이는 크지 않았다 (Fig. 3).
고 찰
Walsh와 Donker14의 선구자적 업적 이후로, 근치적 전립 선적출술은 현재 임상적 국한암 치료에서 가장 많이 행해 지고 있는 치료법이다. 최근에 임상적 병기 T3라도 일부 환 자군의 경우는 근치적 전립선적출술이 유용하다는 적극적 인 보고15가 있기는 하지만, 원칙적으로 근치적 전립선적출 술은 병리 병기 T2 이하에서 유용성이 입증된 치료방법이 다. 따라서 환자에게 가장 적절한 치료 방법을 제시하기 위
해, 치료를 시행하기 전에 미리 정확히 병리결과를 예측하 는 것은 중요하다.
병리결과를 예측하는 대표적인 노모그램은 PSA, Gleason 점수, 임상적 병기를 이용하여 각각의 특정 병리결과를 예 측한 확률 테이블이다.2-4 그러나 최근 들어, PSA의 활용으 로 새로 발견되는 대부분의 전립선암의 임상적 병기가 T1c 이고16 PSA나 Gleason 점수 또한 비교적 낮은 범위에 모여 있다. Partin 등4은 이러한 환자군의 변화를 감안하여, PSA
와 Gleason 점수를 이전보다 더 세분하여 예측의 정확도를 높이려 하였다. 그러나, 임상적 병기는 그 자체가 20-50%에 서 병리결과와 일치하지 않고,8 예후 예측에도 중요성이 감 소하여,10 임상적 병기를 대신하여 노모그램에 사용할 새로 운 수술 전 인자를 찾아, 병리결과 예측의 정확성을 높이는 것이 중요하다고 생각한다. 본 연구에서는 임상적 병기 대 신 양성코어 비율을 사용하여 노모그램을 작성하였으며 이 를 임상적 병기를 이용하여 작성한 노모그램과 비교하였 다. 최근 들어, 종양 용적은 병리 병기와 환자의 예후에 매 우 중요한 인자임이 증명되고 있다.17 그리고 양성코어 비율 이 종양 용적의 유의한 예측인자임이 보고되면서18 양성코 어 비율이 실제로 병리결과나 환자의 예후에 유의한 인자 인지 연구가 되었다. Sebo 등11은 수술 후 병리 병기를 예측 하는 유의한 인자라고 주장하였고, D'Amico 등19과 Ravery 등20은 생화학적 재발에 유의한 예측인자라고 보고하였다.
따라서 저자들은 병리결과 예측 노모그램에 기존의 임상적 병기 대신에 양성코어 비율을 조합함으로써 예측의 정확성 을 높일 수 있을 것으로 기대하고 본 연구를 계획하였다.
피막외 침범과 정낭 침범의 예측에는 양성코어 비율을 이 용하여 제작한 새 노모그램이 더 우수하였고, 방광목 침범 의 예측에는 임상적 병기를 이용한 기존의 노모그램이 더 우수하였으나, 새 노모그램과 정확도의 차이는 크지 않았 다. 수신자판단특성곡선하 면적으로 계산하였을 때, 피막외 침범의 예측에 양성코어 비율을 이용한 새 노모그램은 기 존의 노모그램보다 정확도가 3.7% 상승하였으며, 정낭 침 범의 예측에는 12.6% 정확도가 상승하였다. 그러나 방광목 침범의 예측에는 새 노모그램의 정확도가 2.1% 더 낮았다.
새로 개발된 노모그램이 기존의 노모그램보다 비록 몇 %의 정확성을 향상시킨다고 해도, 이는 실제 임상 진료에서 의 미있게 많은 환자들에게 혜택이 돌아갈 수 있다. 저자들이 알기에 본 연구는 처음으로 양성코어 비율을 이용하여 제 작한 새 노모그램을 기존의 노모그램과 비교를 한 것이고, 피막외 침범과 정낭 침범의 예측에 기존의 노모그램보다 더 정확하다고 보고를 한 것이다.
동일한 병리결과를 예측하는 데 다양한 형태의 노모그램 들이 있지만, 예측의 정확성을 통계적으로 측정하거나, 서 로 비교하는 것은 수학적으로 쉽지 않다. Ross 등21의 연구 에서 보여주듯이, 작성된 노모그램의 45%가 통계적인 예측 정확성 측정을 하지 않았다는 것이 이를 대변해 준다고 할 수 있다. 본 연구에서는 Pearson chi-square goodness-of-fit 분 석을 실시하여 노모그램의 내부 타당도를 확인하였다. 기 존의 노모그램과 새 노모그램 모두 세가지 병리결과 예측 에 내부 타당성을 확인할 수 있었다.
노모그램을 작성하고 평가하는 데 고려해야 할 사항은
일반적으로, 예측의 정확성 확보, 통계적 검증 실시, 일반화 검증, 복잡성의 정도 확인, 기존 노모그램과 비교 등이 있 다.22 예측의 정확성은 일반적으로 70-80%가 유지되면 수용 할 수 있는데, 본 연구에서 양성코어 비율을 이용한 새 노모 그램은 피막외 침범과 정낭 침범의 예측에 모두 80% 이상 의 정확도를 보였다. 일반화 검증은, 노모그램이 일반적으 로 작성된 코호트 집단의 특성에 의존성이 크므로, 다른 코 호트 집단에서 적용될 수 있는지 알아보는 것이다. 본 연구 에서는 실시하지 않았지만, Song 등23은 단일 센터의 254례 의 근치적 전립선적출술 자료를 이용하여 노모그램을 만들 고, 이를 Partin 등3의 서양인 노모그램과 Egawa 등13의 일본 인 노모그램과 비교하였다. 다반복선형분석 결과, 각각의 노모그램을 타 집단에까지 일반화시키기에는 무리가 있어 한국인의 전립선암 자료를 이용한 독자적인 노모그램이 필 요할 것으로 판단하였다. 저자들의 생각도 그러한데, 한국 인은 서양인에 비해 같은 연령대에서 PSA의 수치가 낮고, 전립선용적도 작으며, 동일 PSA대에서 전립선암 발견율이 낮음23을 감안하면 동서양인에 동일한 노모그램을 적용하 는 것은 정확도 면에서 문제가 있을 수 있다고 생각한다.
일반화 검증에서 또 고려해야 하는 것이 노모그램 작성에 사용된 자료의 시대성이다. 즉, 과거의 자료에 기초해서 만 들어진 노모그램이 현재의 환자들의 예후를 얼마나 잘 예 측할 것인가를 생각해야 한다. 현재 진단되는 전립선암의 PSA나 Gleason 점수, 임상적 병기가 과거에 비해 더 낮기 때문에, 과거의 노모그램을 이용하면 정확도의 감소가 올 수 있다.
본 연구에서 임상적 병기 T1c가 전체의 58.7%를 차지하 였고, PSA 10ng/ml 이하가 66.4%를 차지하였다. 이전에 국 내의 다기관 연구로 보고된 45.7%와 51%24와 비교하면 10%
이상 상승한 수치이다. 이는 본 연구의 환자군이 2004년도 부터 수집되어 PSA 측정의 활성화로 인한 병기 이동이 있 었기 때문으로 생각한다. Gleason 점수 7 이상의 저분화도 암은 전체의 40.5%를 차지하여 기존에 보고된 58.6%24와 비 교하여 감소하였다. Song 등24은 한국인에서 Gleason 점수 7 이상의 저분화도암은 임상적 병기나 PSA에 상관없이 50% 이상을 차지하여 병기의 진행에 상관없이 원래 분화도 가 높았다고 보고하였다. 본 연구에서 임상적 병기와 PSA 에 따라서 Gleason 점수를 구분하였을 때, 임상적 병기 T1c 의 34.8%, PSA 3.0ng/ml 이하 환자의 41.7%, 3.1-10.0ng/ ml 환자의 31.9%가 Gleason 점수 7 이상의 저분화도암으로 판 명되어 역시 같은 조건의 서구의 종양25보다 더 분화도가 나쁨을 확인할 수 있었다.
본 연구에서 임상적 국한암의 피막외 침범은 17.4%, 정낭 침범은 2.5%로, 이전의 보고24보다 낮았다. 이는 본 연구가
PSA의 활용이 많아진 가장 최근에 실시된 점도 있지만, 본 병원에서 경직장 조직검사를 위한 PSA의 절단치를 3.0ng/
ml으로, 다른 연구보다 낮게 잡은 데서도 기인된 것으로 생 각한다. 본 병원은 이전의 보고대로,26 PSA 3.0ng/ml 이상에 서 조직검사를 시행하고 있으며, 전립선암의 발견율을 높 이기 위하여 12 부위 조직검사를 기본으로 하고 있다. 본 연구에서는 림프절 침범이 단지 3례에서만 발견되어 통계 적 어려움이 있어 병리학적 결과에서 제외하였는데, 3례 모 두 PSA 10.1ng/ml 이상, Gleason 점수 8 이상이었다. 다변량 분석에서, 정낭 침범과 방광목 침범의 예측에 Gleason 점수 가 유의성을 상실하였는데, 실제로는 p값이 거의 유의성에 도달하는 값이고, 정낭 침범과 방광목 침범의 숫자가 각각 9례와 12례로 적어서, 확정적으로 의미를 두기는 어려웠다.
방광목 침범의 예후적 의의는 아직 논란이 있는데,27 본 연 구에서는 12례에서 현미경적 침범이 확인되었다. 피막외 침범과 정낭 침범과 달리, 양성코어 비율을 이용한 새 노모 그램의 예측 정확도가 기존의 노모그램보다 낮았다. 그러 나 그 차이가 2.1%로 적어서, 피막외 침범과 정낭 침범의 예측에 새 노모그램이 보여준 3.7%와 12.6%의 정확도 향상 을 상쇄하지는 못하였다.
본 연구에서 사용된 양성코어 비율은, 아직까지 경직장 조직검사 코어 숫자나 방법에 대한 완전한 지침이 없기 때 문에, 임상 진료에서의 사용을 일반화하는 데 무리가 있을 수 있다. 그러나 본 연구에서는 2명의 진단방사선과 전문의 가 기본적으로 이전에 보고한 방식28으로 12 부위 조직검사 를 실시하였으므로, 이에 대한 일관성이 유지되었다고 생 각한다. 임상적 국한암에서 환자의 예후를 예측하는 데 여 러 경직장 조직검사 인자들이 기존의 PSA나 Gleason 점수 보다 우월하여, 이러한 경직장 조직검사 소견을 조직검사 보고에 정식적인 항목으로 추가하여야 한다는 주장이 있기 는 하지만,20 여기에 대해서도 아직 논란이 진행 중이다. 경 직장 조직검사 소견을 자세히 보고하는 것은, 확실히 시간 과 수고가 더 커지는 것이므로 이와 관련된 더 많은 연구로 적절한 임상적 지침이 제시되어야 하겠다. 본 연구의 새 노 모그램은 단일 센터의 자료를 바탕으로 하였기 때문에, 비 록 타당성을 검증했기는 하지만 일반화시키기에 무리가 있 을 수 있고, 수술 환자를 대상으로 하였기 때문에 전체 전립 선암 환자를 대변할 수 없다는 제한점이 있다. 양성코어 비 율을 이용한 본 노모그램을 일반적으로 적용하기 위해서는 다기관의 더 많은 환자를 대상으로 한 검증이 필요하다.
PSA의 보편화로 초기 전립선암이 증가하면서 환자의 임 상병리학적 특성이 변화하고 있다. 좋은 노모그램은 이러 한 시대적인 변화를 반영할 수 있어야 한다. PSA의 활용으 로 초기 전립선암이 증가하고 임상적 병기의 중요성이 감
소하고 있는 시대적인 변화에 맞추어, 기존의 임상적 병기 대신에 양성코어 비율 등 새로운 인자를 활용하여 노모그 램을 제작하는 것은 앞으로 임상 진료에서 많은 환자들에 게 도움을 줄 수 있을 것으로 생각한다.
결 론
기존의 임상적 병기 대신에 양성코어 비율을 이용하여 병리결과 예측 노모그램을 작성하였으며, 이는 기존의 임 상적 병기를 이용한 노모그램보다 임상적 국한암에서 피막 외 침범과 정낭 침범의 예측에 더 우수하였다.
REFERENCES
1. Pound CR, Partin AW, Epstein JI, Walsh PC. Prostate-specific antigen after anatomic radical retropubic prostatectomy. Pat- terns of recurrence and cancer control. Urol Clin North Am 1997;24:395-406
2. Partin AW, Yoo J, Carter HB, Pearson JD, Chan DW, Epstein JI, et al. The use of prostate specific antigen, clinical stage and Gleason score to predict pathological stage in men with localized prostate cancer. J Urol 1993;150:110-4
3. Partin AW, Kattan MW, Subong EN, Walsh PC, Wojno KJ, Oesterling JE, et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update.
JAMA 1997;277:1445-51
4. Partin AW, Mangold LA, Lamm DM, Walsh PC, Epstein JI, Pearson JD. Contemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology 2001;58:843-8
5. Kattan MW, Eastham JA, Stapleton AM, Wheeler TM, Scar- dino PT. A preoperative nomogram for disease recurrence following radical prostatectomy for prostate cancer. J Natl Cancer Inst 1998;90:766-71
6. Han M, Snow PB, Brandt JM, Partin AW. Evaluation of artificial neural networks for the prediction of pathologic stage in prostate carcinoma. Cancer 2001;91:1661-6
7. Chun FK, Briganti A, Gallina A, Hutterer GC, Shariat SF, An- tebie E, et al. Prostate-specific antigen improves the ability of clinical stage and biopsy Gleason sum to predict the patholo- gic stage at radical prostatectomy in the new millennium. Eur Urol 2007;[Epub ahead of print]
8. Prezioso D, Galasso R, Di Martino M, Iapicca G, Iacono F.
Role of surgery in treatment of locally advanced prostate can- cer. Anticancer Res 2006;26:3151-8
9. Rioux-Leclercq NC, Chan DY, Epstein JI. Prediction of out- come after radical prostatectomy in men with organ-confined Gleason score 8 to 10 adenocarcinoma. Urology 2002;60:666-9
10. Hull GW, Rabbani F, Abbas F, Wheeler TM, Kattan MW, Scardino PT. Cancer control with radical prostatectomy alone in 1,000 consecutive patients. J Urol 2002;167:528-34 11. Sebo TJ, Bock BJ, Cheville JC, Lohse C, Wollan P, Zincke
H. The percent of cores positive for cancer in prostate needle biopsy specimens is strongly predictive of tumor stage and volume at radical prostatectomy. J Urol 2000;163:174-8 12. Cagiannos I, Karakiewicz P, Eastham JA, Ohori M, Rabbani
F, Gerigk C, et al. A preoperative nomogram identifying de- creased risk of positive pelvic lymph nodes in patients with prostate cancer. J Urol 2003;170:1798-803
13. Egawa S, Suyama K, Arai Y, Matsumoto K, Tsukayama C, Kuwao S, et al. A study of pretreatment nomograms to predict pathological stage and biochemical recurrence after radical prostatectomy for clinically resectable prostate cancer in Japanese men. Jpn J Clin Oncol 2001;31:74-81
14. Walsh PC, Donker PJ. Impotence following radical pros- tatectomy: insight into etiology and prevention. J Urol 1982;
128:492-7
15. Ward JF, Slezak JM, Blute ML, Bergstralh EJ, Zincke H.
Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing:
15-year outcome. BJU Int 2005;95:751-6
16. Rioux-Leclercq NC, Chan DY, Epstein JI. Prediction of outcome after radical prostatectomy in men with organ-con- fined Gleason score 8 to 10 adenocarcinoma. Urology 2002;
60:666-9
17. Nelson BA, Shappell SB, Chang SS, Wells N, Farnham SB, Smith JA, et al. Tumour volume is an independent predictor of prostate-specific antigen recurrence in patients undergoing radical prostatectomy for clinically localized prostate cancer.
BJU Int 2006;97:1169-72
18. Rubin MA, Mucci NR, Manley S, Sanda M, Cushenberry E, Strawderman M, et al. Predictors of Gleason pattern 4/5 prostate cancer on prostatectomy specimens: can high grade tumor be predicted preoperatively? J Urol 2001;165:114-8 19. D'Amico AV, Whittington R, Malkowicz SB, Schultz D,
Fondurulia J, Chen MH, et al. Clinical utility of the percentage of positive prostate biopsies in defining biochemical outcome
after radical prostatectomy for patients with clinically localized prostate cancer. J Clin Oncol 2000;18:1164-72
20. Ravery V, Chastang C, Toublanc M, Boccon-Gibod L, Delmas V, Boccon-Gibod L. Percentage of cancer on biopsy cores accurately predicts extracapsular extension and biochemical relapse after radical prostatectomy for T1-T2 prostate cancer.
Eur Urol 2000;37:449-55
21. Ross PL, Scardino PT, Kattan MW. A catalog of prostate cancer nomograms. J Urol 2001;165:1562-8
22. Chun FK, Karakiewicz PI, Huland H, Graefen M. Role of nomograms for prostate cancer in 2007. World J Urol 2007;25:131-42
23. Song C, Kim J, Chung H, Kim CS, Ro JY, Ahn HJ. Nomo- grams for the prediction of the pathological stage of the clinically localized prostate cancer in Korean men. Korean J Urol 2003;44:753-8
24. Song C, Kang T, Lee M, Ro JY, Lee SE, Lee E, et al. Clini- co-pathological characteristics of prostate cancer in Korean men and nomograms for the prediction of the pathological stage of the clinically localized prostate cancer: a multi-ins- titutional update. Korean J Urol 2007;48:125-30
25. Freedland SJ, Mangold LA, Walsh PC, Partin AW. The prostatic specific antigen era is alive and well: prostatic speci- fic antigen and biochemical progression following radical pro- statectomy. J Urol 2005;174:1276-81
26. Park HK, Hong SK, Byun SS, Lee SE. Comparison of the rate of detecting prostate cancer and the pathologic characteristics of the patients with a serum PSA level in the range of 3.0 to 4.0ng/ml and the patients with a serum PSA level in the range 4.1 to 10.0ng/ml. Korean J Urol 2006;47:358-61 27. Yossepowitch O, Sircar K, Scardino PT, Ohori M, Kattan
MW, Wheeler TM, et al. Bladder neck involvement in pa- thological stage pT4 radical prostatectomy specimens is not an independent prognostic factor. J Urol 2002;168:2011-5 28. Kim YJ, Chang IH, Gil MC, Hong SK, Byun SS, Lee SE.
Concordance of Gleason scores between prostate needle biopsy and radical prostatectomy specimens according to the number of biopsy cores. Korean J Urol 2006;47:482-8