대한소화기학회지 2002;39:79 - 87
서 론
프로그램된 세포사(programmed cell death, PCD)라 정의되 는 세포사멸은 모든 다세포 기관의 정상발달과 항상성에 필 수적인 자연적 세포사를 말한다 .1이 과정은 손상되고, 감염 된 세포 또는 잠재적 종양성 세포를 제거하는 중요한 과정 이다 . 그러나 과소 또는 과대한 세포사멸은 생물학적 부작
용을 초래하게 된다.2 즉 류마치성 관절염과 암종은 과소사 멸의 잘 알려진 예이며 허혈성 심근질환, AIDS 그리고 퇴행 성신경질환 즉, Alzheimer병 그리고 파킨슨병 등은 과도한 세포사멸의 좋은 예이다.2 -5 세포사멸은 세포괴사와는 분명 히 다른 세포사 과정이다 . 세포괴사에서는 세포막의 장애 및 손상에 의해 세포 부종과 세포 용해가 일어난다. 이에 반 해 세포사멸에서는 단세포 수준에서 일어나며 이 과정 중에 각 세포는 세포사의 능동적 과정을 수행하게 되고 유전적 프로그램이 작동되어 DNA절편과 세포사멸체 형성의 정점 에 이른다. 초기 세포사멸 세포와 세포사멸체는 원형질막의 통합성을 유지하여 세포물질의 유출을 막게 되고 염증성 반 응과 국소 조직손상을 일으키게 된다 . 원형질외막의 생화학 적 변화는 조직 탐식세포나 다른 주위 세포들에 의해 인지
위장관 질환과 세포사멸
전북대학교 의과대학 내과학교실
김 대 곤
Ap o p t o s i s a n d Ga s tr o i n t e s t i n a l D i s e a s e D a e -G h o n K i m , M .D .
Dep artment of Internal Medicine, Chonbuk National University Medical School, Chonj u, Korea
Apoptosis (programmed cell death) is essential for the normal development and homeostasis of most multi-cellular organism. The morphological and biochemical characteristics of apoptosis are highly conserved during the evolution.
This form of cell death can be induced by a wide range of cellular signals, which leads to activation of cell death machinery within the cell. It is generally belived that apoptosis can be divided into at least two functionally distinct pathway, i.e. extrinsic (receptor-mediated) and intrinsic (mitochondrial) pathways. Apoptosis is especially relevant in the gastrointestinal tract as the intestinal mucosa undergoes a process of continual cell turnover that is essential for maintenance of normal function. Cell proliferation is confined to the crypts, while differentiation occurs during a rapid, orderly migration up to the villus. The differentiated enterocytes, which make up the majority of the cells, then undergo a process of programmed cell death. Although apoptosis is essential for the maintenance of normal gut epithelial function, dysregulated apoptosis is seen in a number of pathological conditions. in the gastrointestinal tract and hepatobiliary system. The cellular mechanism regulating this tightly regimented process have not been clearly defined and this topic represents an area of active investigation as delineation of this process will lead to a better understanfding of normal gut and hepatobiliary system. (Korean J Gastroenterol 2002;39 :79-87)
Key Words: Apotposis, Homeostsis, Extrinsic pathway, Intrinsic pathway, Gastrointestinal disease
접수 : 2002년 2월 2일
연락처: 김대곤, 561-712, 전북 전주시 덕진구 금암동 634-18 전북대학교병원 소화기내과
Tel: (063) 250-1681, Fax: (063) 254-1609 E-mail: daeghon @moak.chonbuk.ac.kr
종 설
대한소화기학회지 :제39권 제2호, 2002
되어 세포사멸세포는 2-4시간 이내에 효율적으로 항원 과정 에 의해 생체 내에서 제거된다.1,3 ,5 아포토시스는 수용체매 개성 신호, 성장인자의 제거, 항암 화학제, 반응성 산소기 (reactive oxygen species, ROS), 그리고 DNA 손상 등1- 6의 다 양한 인자들에 의해 유발되며 이들 각 자극은 사포사멸 과 정을 활성화하는 자체의 특이 경로를 갖고 있으나 결국은 공통된 결과로 수렴하게 된다 . 이때 caspase가 이 세포사멸 의 중심축에 있게 된다 . 세포사멸 경로는 크게 2가지로 대 별된다. 즉 수용체매개성(외인성) 세포사멸경로와 미토콘리 아매개성(내인성) 세포사멸경로가 있다. 세포표면수용체(대 표적인 Fas 수용체, 그 외 TNF-R 1, CAR 1, DR3, DR4 및 DR5)에 리간드가 결합하게 되어 활성화가 일어나게 되면 세포질 내 도메인이 아댑터 단백 FADD와 결합하게 되고 다음으로 caspase-8과 연결되어 세포사유도신호복합체 (DISC)를 형성하게 된다 (Fig. 1).7 미토콘드리아 경로에 있
어서는 먼저 주로 산화성 스트레스에 의해 비특이적 막투과 성이 증가되고 미토콘드리아 막전위의 점진적 감소의 특징 적 변화를 초래하게 된다 .8 이때 미토콘드리아의 막간격에 존재하는 호흡연쇄의 구성요소인 cytochrome c의 세포질 내 의 유출이 있게된다 .9 , 10이때 미토콘드리아에 위치한 항세포 사멸단백인 Bcl-2에 의해 유출 억제가 있게 되며1 1Bax 라는 친세포사멸단백은 세포질에서 미토콘드리아로 이동하여 cytochrome c 유출을 유도하기도 한다.12 ,13 최근 미토콘드리 아의 세포사멸 유도 인자(apoptosis inducing factor, AIF)가 미토콘드리아에서 유출되는 것으로 밝혀지고 있다(Fig. 2).14 여기까지를 신호기(signaling phase)라고 하며 다음으로는 세 포사멸 실행기(execution phase)에 들어가게 된다. 최종사멸 실행인자는 caspase이며 모든 세포타잎에서 세포사멸시 활 Fig. 1. Signalling pathways induced by CD95 (Fas). CD95
signalling pathway (including DISC formation) used in type I and type II cells (see text). TPA, 12-O-tetradecanoylphorbol- 13-acetate; PKC, protein kinase C; MAPK, mitogen-activated protein kinase; CASP, caspase; AIF, apoptosis-initiating factor;
CAP3, cytotoxicity-dependent Apo-1-associated protein 3).
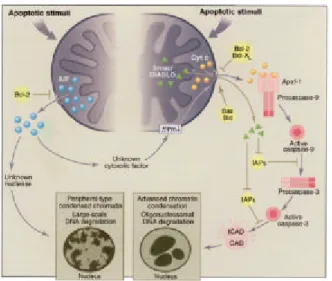
Fig. 2. The caspase-dependent and AIF-dependent apoptotic pathways. (Right) Upon apoptotic stimulation, permeabilization of the mitochondrial outer membrane allows the release of cytochrome c into the cytosol, where it induces, together with the adaptor molecule Apaf-1, dimerization and activation of the caspase-9 proenzymes. Active caspase-9 subsequently activates caspase-3, one of the main effector caspases, which in turn cleaves several cellular targets including the inhibitor of the caspase-activated deoxyribonuclease (ICAD), thereby leading to deinhibition of CAD and nuclear apoptosis characterized by advanced chromatin condensation and oligonucleosomal DNA degradation. The caspase-dependent apoptotic pathway is subj ect to multiple regulatory systems. These include the proapoptotic (Bax, Bid) and antiapoptotic (Bcl-2, Bcl-XL) Bcl-2 family members that promote or block cytochrome c release, respectively; the inhibitors of apoptosis (IAPs) that block caspase catalytic acivity; and the mitochondrial protein Smac/DIABLO that relievels IAPs' inhibition. (Left) Mitochondrial AIF released in the cytosol upon apoptotic stimulation can trigger caspase-independent apoptosis through an as yet unknown nuclease. In certain circumstances, AIF can act upstream of cytochrome c release through an unknown cytosolic factor, thereby regulating the caspase-dependent apoptotic pathway.
8 0
김대곤 . 위장관 질환과 세포사멸
성화되는 시스틴함유 아스팔테이트 특이 단백분해효소이 다.15 이들 단백분해 효소는 전효소로 합성되고 세포사멸시 단백분해에 절단되어 활성화되며16 많은 세포기질 즉 poly(ADP-ribose)폴리머레이제, Lamin B 그리고 DNA topoisomerase Ⅰ 및 Ⅱ 등을 분해시킨다.17 DISC에 의해 활 성화된 수용체 경유성 caspase-8은 2가지 주요 경로를 갖고 있다. 즉 제1형은 직접 하향 caspase-3를 활성화하여 최종 세 포사멸형태를 유도하거나1 8 제2형은 미토콘드리아 경로를 자극하게 되는 Bid를 활성화함으로써 절단된 Bid(tBid)는 세 포질에서 미토콘드리아로 이동하여 미토콘드리아에서 cytochrome c를 유출시키게 된다.19그러나 최근 본 연구자들 을 비롯한 일군의 연구자들은 비수용체매개성 또는 비DISC 의존성 caspase-8 활성화 경로가 하향 caspase 활성과 연결되 는 제3형을 제시하고 있다.2 0미토콘드리아 경로에 있어서는 방출된 cytochroma c가 세포사멸활성화인자-1 (Apaf-1) 아댑 터 단백질 및 procaspase-9과 함께 결합하여 apotosome을 형 성하게 되어 활성화 caspase-9를 유도하고 하향 caspase를 활 성화시킨다. 이때 미토콘드리아 단백인 smac/DIABLO는 세 포질 내에 있는 활성 caspase-9, 또는 활성 caspase-3 차단인 자인 IAPs (inhibitors of apoptosis)와 결합하여 세포사멸억제 를 차단한다고 알려졌다.2 1 마지막단계로는 주요 effector caspase에 의하여 세포사멸기질들의 분해가 있게 되는데 즉 ICAD (inhibitor of the caspase activated deoxyribonuclease)에 분해에 의한 CAD의 탈억제가 일어나 염색체 응축과 DNA 올리고 분해 등이 일어난다(Fig. 3).2 2
위장관에서 세포사멸
위장관 상피세포에는 고도의 세포 교체가 일어나며 정
상세포나 사멸세포 평형은 형태와 기능의 유지에 중요하다.
소장 융모는 분화된 흡수세포로서 소장 크립트에서 유래되 Fig. 3. Schematic representation of the intestinal epithelium in
(a) normal and (b) pathological conditions. Normally, the differentiated villus cells at the tip undergo apoptosis (■) in order to maintain homeostasis as the rapidly proliferating cells are at the crypt. In pathological conditions, excessive apoptosis of villus cells can cause shortening of the villi.
Table 1. Gastrointestinal Diseases in Which Apoptosis May Be Important
Organ Diseases Esophagus Barrett's disease
Reflux disease Esophageal cancer Stomach Peptic ulceration
Atrophic gastritis Gastric ulcer
Liver Disease targeting hepatocytes Cholestasis
Ethanol Toxins Viral illness
Hepatocellular carcinoma Disease targeting cholangiocytes Primary sclerosing cholangitis Primary biliary cirrhosis AIDS-associated cholangitis Cholangiocarcinoma Pancreas Acute pancreatitis
Chronic pancreatitis Pancreatic cancer Small bowel Malabsorption syndrome
Radiation enteritis
Colon Inflammatory bowel diseases Colon cancer
Radiation proctitis
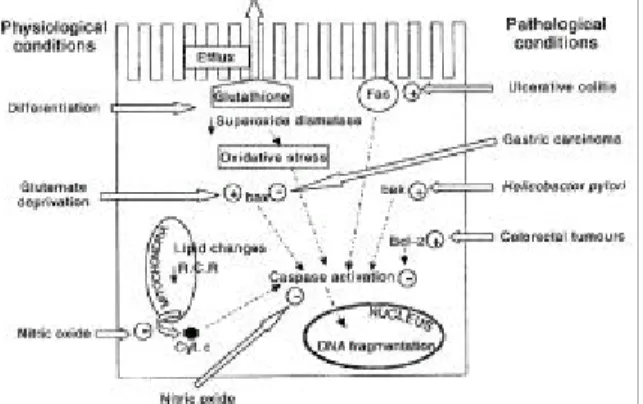
Fig. 4. Epithelial cell apoptosis in the gastrointestinal tract.
Apoptosis can be induced in the epithelial cell under both physiological and pathophysiological conditions and these are mediated by various effector molecules in the cell. RCR, respiratory control ratio; Cyt. c, cytochrome c.
8 1
The Korean Journal of Gastroenterology : Vol. 39. No. 2. 2002
었고 이 크립트 줄기세포는 증식하여 상피세포를 생산한다.
이 세포들은 상향 이동하고 증식하여 융모에 도달하여 분화 된 상피세포가 된다(Fig. 3). 이때 세포사멸은 역평형작용을 하게 된다. 만일 이 세포사멸이 장애가 있게 되면 전암단계 세포손상에 의해 세포사 유도에 실패가 있게 되어 질병이 악화되고 또는 암세포의 치료가 불가능해진다. 융모에서 크 립트 세포에 이르는 피드백 신호가 있게 되어 크립트 줄기 세포의 분열을 조절하는데 이는 성장인자 즉 EGF TGF 등 이 관여한다. TGF-α는 증식을 촉진하고 TGF-β는 증식을 억제하며2 3 TGF-β 내성세포는 세포접촉억제를 상실하고 부칠산(butyrate)유도 세포사멸에 내성을 갖게 된다.2 4 세포 사멸은 주로 융모 첨단(villus tip)에서 일어나고 이때 탐식세 포나 임파구의 침윤에 의해 사멸세포의 제거가 일어난다.2 5 TNF는 위장관에서 세포사멸에 주요한 역할을 하는 cytokine 의 하나이다. TNFR-1수용체에 작용하여 상피세포의 융모 첨단 탈락과 세포사멸을 유도시킨다고 한다.2 6 더불어 융모 상피세포에서 산화성 스트레스 역시 세포사멸에 관여한 다.2 7 또한 세포탈락유도세포사멸(anoikis)현상이 일어나는데 이는 세포탈막 그 자체만으로도 상피세포의 세포사멸을 일 으킨다는 것이다.2 8
분화유도와 세포사멸의 연계가 장상피세포에서 잘 알려 져 있다. 즉 대장암 HT-29 세포에서 인터페론 감마는 저농 도에서 분화를 유도하고 고농도에서는 암세포사멸을 유도 하며2 9 부틸산 역시 유사한 작용을 보인다. 세포대사를 위한 영양결핍 역시 장세포 세포사멸을 유도하는데 글루타민3 0과 부칠산 등3 1이 그 예이다. 부칠산 제거는 bax 발현과 관련되 어 장상피세포 세포사멸을 일으킨다. 즉 이런 물질의 결핍 은 정상 대장세포의 사멸을 초래하게 된다.
위장관에서 병적 세포사멸
위장관에 다양한 병적 조건 하에서 세포사멸은 중요한 역할을 하며 세포사의 속도를 증가 또는 감소시켜 조절하게 된다. 예를 들면 coeliac 질환에서 장세포의 세포사멸이 증 가하여 융모 아트로피를 가져오며3 2 궤양성 대장염에서는 세포사멸이 주로 병변 및 그 주위 크립트에서 일어나며 이 예기치 않은 세포사멸은 Fas-FasL의 autocrine 또는 paracrine 작용에 의해 일어난다.3 3 궤양성 대장염에서 수용성 FasL 매개성 상피세포사멸은 상피방어 기능을 파손시키고 병적 인 미생물의 침입을 촉진하여 세포사멸을 일으킨다.3 4 또한 위암에서 세포사멸의 억제가 병인에 관련되며 이때 Bax유 전자의 변이가 흔히 발견되어 Bax가 위에서 세포사멸유 도와 암억제에 중요한 인자임을 시사하고 있다고 하겠다 (Fig. 4).3 5 위장관 질환에서 세포사멸이 관련된 질환은 Table 1과 같다.
1. 허혈-재관류 유도성 세포사멸
허혈-재관류는 특히 이식에서 중요한 조직 손상기전이다.
간 및 소장은 이 허혈-재관류 손상에 예민하며 이때 미토콘 드리아 경유성 산화성 스트레스가 중요한 역할을 한다고 보
여진다.3 6 ,3 7
2 . 위장관 암
암종에서는 강화된 세포증식 또는 억제된 세포사멸에 의 해 조절되지 암의 세포증식이 있게 된다. 정상 대장점막에 서도 Bcl-2 양성세포는 크립트 기저부에 Bax 및 Bak 양성세 포들은 내강면에 위치하게 된다.3 8 Bcl-2는 항세포사멸단백 으로 caspase이 의존성 세포사멸까지도 억제한다고 한다.3 9 많은 대장직장암에서는 Bcl-2가 증가되어 있으며 이 Bcl-2 조절장애가 암발생에 관련된다고 본다.4 0 p53 변이 역시 상 피세포 암에서 암세포사멸을 억제한다. 그러나 p53 변이는 대장직장암에서 흔하지는 않으며 대신 p53 하향 단계에 있 는 Bax라는 친아포토시스 단백의 프레임 이동변이가 발견 된다. 이는 특히 가족성 비용종성 대장직장암 발암 과정에 서 선종 상피암 이행단계에 관련되리라 본다.4 1 대장직장암 의 예후표지자로 사용되기도 하는 Bax 발현은4 2 p53 비의존 성 대장직장암 억제 유전자로 간주되며4 3 또한 Bcl-2 멤버인 Bak 역시 정상 장상피세포 세포사멸에 중요조절유전자로서 대장직장암에 흔히 발현감소가 관찰된다.4 4 Ras 발암유전자 의 활성은 Bak의 하향 조절을 유도하고 이는 Ras 발암유전 자의 형질전환능력에 중요한 역할을 한다고 보여진다.4 5
3 . 염증성 장질환에서 세포사멸
Coeliac질환과 크론병, 그 외 궤양성 대장염 같은 면역매 개성 장질환에서 가속화된 상피세포의 교체와 세포사멸이 특징적이다. 이 변화는 크립트 융모의 형태적 변화와 기능 적 장애를 초래하고 침윤된 염증성 세포 또는 상피세포에 의해 분비되는 cytokine에 의해 autocrine 형식으로 영향을 받게 된다. 다형핵중성구 축적과 활성화된 탐식세포의 세포 사멸이 억제되고4 6 크론병 및 궤양성 대장염 또는 다른 염증 성 상태에서 분리된 T세포는 세포사멸이 억제되어 있으며 이는 Bcl-2의 증가에 의한다.4 7 또한 Bcl-2/Bax 비율이 크론 병에서는 높고 궤양성 대장염에서 낮아 크론병에서는 세포 증식이 세포사보다 월등하여 T세포사멸이 감소하고 비정상 T세포 축적이 일어나 관용과 만성염증이 진행된다고 본 다.4 8 Fas 결합이 대장상피세포사멸을 유도하고 궤양성 대장 염에서는 상피손상에 관여되어 Fas-FasL 상호작용은 복잡한 신호전달단계를 거쳐 세포사멸을 일으킨다.4 9 Fas는 기본적 으로 대장상피세포에서 발현되고 FasL은 침윤성 CD3 임파 구에 발현되어 궤양성 대장염 점막손상을 일으키고5 0 이런 8 2
Kim. Apoptosis and Gastrointestinal Disease
만성염증에 의해 가속화된 상피세포 교체와 상피세포 손상 은 DNA변이를 일으켜 dysplasia나 상피세포암을 유도한다.5 1 대장암은 기능적 FasL를 발현하고 면역회피에 관여하게 된 다. 즉 암세포는 Fas 매개성 세포독성에 내성을 보이나 기능 적 FasL을 발현하여 본래 감수성이 있는 활성화된 T세포에 사멸신호를 주게된다.5 2
4 . 박테리아 감염과 세포사멸
대장상피세포는 장내 병적인 살모넬라, 장침습성 E. coli 등에 의한 침입 후 세포사멸을 일으킨다. 박테리아 감염 후 6시간 이내에 발생하는 이 세포사멸에서 TNF-α와 nitric oxide (NO)가 세포사멸의 중요한 매개물질이다.5 3 Verotoxin 생산 E. coli, 이질균의 Shiga 독소, 장출혈성 E. coli의 Shiga-like 독소 등5 4도 장상피세포의 세포사멸을 유도한다.
이질균의 침입은 주로 임파절관련상피인 M세포에서 이루 어지며 이때 follicular dome에 위치한 탐식세포의 사멸이 야 기되고 IL-1β을 유리하여 염증이 시작되며 상피구조의 불 안정성이 유도된다.5 5 혐기성 세균인 독성 Clostridium diff icile는 항생제관련 설사와 장염을 일으키는 2가지의 대 단쇄단백인 외독소를 생산하는바 toxin B는 장상피세포의 아포토시스를 유발하고 toxin A는 장상피세포의 탈락과 아 포토시스를 일으킨다.5 6 ,5 7 Helicobacter pylori (H. pylori) 역시 위상피세포에서 아포토시스로 유발되며 그 기전은 불명확 하다.5 8 유착,5 9 H. pylori LPS5 8 또는 major histocompatibility class Ⅱ분자 등6 0이 관여되며 염증성 매개체인 IFN-γ와 TNF-α 등이 H. pylori 유도성 세포사멸을 강화시킨다고 알 려졌다. IFN-γ는 위상피세포에서 Fas 수용체 발현을 상향 조절한다.6 1즉 H. pylori 감염에 의해 점막세포에 Fas 수용체 발현이 증가하고 동시에 FasL 발현 임파구가 증가되어 위궤 양이나 십이지장궤양의 병인이 된다.6 2 또한 H. pylori 감염 상피세포에서는 Bak 발현이 증가되고 Bak 의존성 세포사멸 이 있게 된다.5 9
5 . 방사선 조사 세포사멸
증식성 크립트 상피세포의 방사선 감수성은 복강종양의 방사선 치료의 주요 장애요인이다. 적은 용량의 방사선 주 사는 크립트 줄기세포에서 p53을 경유하여 방사선 조사 세 포손상을 인지하여 세포사멸을 촉발시킨다. 이 세포사멸 과 정은 잠재력 발암성 손상세포를 제거하고 항상성을 유지하 는데 중요한 역할을 한다.6 3 방사선 조사 3-6시간 후에 세포 사멸이 특히 크립트 줄기세포에서 증가되며6 4 p53의 기능장 애가 있게 되면 방사선내성이 유발된다.6 5 다른 연구에서는 8 Gy 이상의 방사선조사에서 보다 늦게 작동하는 p53 비의 존성 세포사멸이 존재하기도 한다고 보고하고 있다.6 6 대장 보다는 소장의 크립트 줄기세포가 조기에 p53 발현과 세포
사멸에 민감하다고 하겠다.
6 . NO와 위관장 세포사멸
NO는 caspase의 s-nitrosylation에 의해 세포사멸억제효과 가 있으며6 7 Fas 유도성 아포토시스를 억제하기도 한다.6 8 NO는 또한 장상피세포의 호흡의 가역성 억제와 Bcl-2 수준 을 증가시키며 이 Bcl-2 단백의 발현증가는 NO의 세포독성 에 대해 장상피세포를 보호한다. 또한 NO는 혐기성 장내강 에 Bcl-2 증가 점막의 사멸 없이 항박테리아 작용을 나타내 며6 9 B세포의 항원매개성 세포사멸을 막는데 이는 Bcl-2 하향 조절을 억제하여 작용한다.7 0 NO는 간세포에서 cGMP-의존성 기전이나 caspase의 s-nitrosylation에 의해 caspase-3 활성을 억 제하여 세포사멸을 억제한다고 한다.7 1 최근 NO는 미토콘드 리아의 ATP 의존성 상향 또 하향 단계에서 세포사멸을 억제 하며 cytohrome c 유리를 지연시키거나 유리된 cytochrome c 에 의한 procaspase-3 또는 -7의 경로를 차단한다고 알려졌 다.7 2 또한 장허혈재관류 손상도 억제한다고 한다.7 3
7 . 간이식에서 Fa s/ Fa s L
간질환에서 Fas/FasL는 간항상성 유지에 중요한 역할을 한다. 즉 마우스에 anti-Fas 항체의 주입은 간부전과 치사에 이른다.7 4 또한 간은 밀초 임파구의 사멸과 제거 기관뿐만 아니라 자가 반응성 또는 비정상 활성화 임파구의 표적기관 이 되기도 한다.7 5 간은 Fas 매개성 손상에 대해 매우 예민하 고 이식거부에서는 cytotoxic T lymphocyte (CTL)가 주역할 을 하기 때문에 간이식 거부에서 Fas/FasL은 중요한 역할을 할 것으로 추정되었다.7 6 ,7 7 최근 비장에 간세포 이식은 주인 비장 FasL에 의해 공여간세포의 거부가 일어난다고 하나 이 기전만이 전부는 아니다.7 7 Fas 매개성 세포사에 감수성 높 은 공여 간세포에도 FasL이 있으며 이 FasL은 거부반응을 억제할수 있기 때문이다. 그러나 실제로 공여 간세포에 아 데노바이러스매개성 유전자전이에 의한 FasL의 과다 발현 은 오히려 다량의 간염과 치사를 가져왔다.7 8 liposome을 이용 한 낮은 수준의 FasL 발현은 간염을 일으키지 않았으며 생 존율을 증가 시켰다.7 9 간에서 생산되는 수용성 Fas(sFas)는 Fas-FasL 상호작용을 막아 Fas 매개성 세포사멸를 억제한다.
따라서, sFas가 Fas 매개성 간손상을 막으며 간에서 생산되 는 sFas의 감소는 간이식의 거부반응과 관련된다고 하겠다.
8 . B형 및 C형 간염
간세포는 조직염색에서 비교적 낮은 Fas 수준을 발현하 나 Fas 매개성 세포사에 매우 예민하다.8 0 B형이나 C형 간염 시 간세포에서 Fas 발현은 증가되어 있으며 Fas 발현의 증 가정도와 간염증의 정도와 부위는 상관관계를 갖는다.8 1, 82 그 기전은 불명하나 간암세포 HCV core 단백의 발현은 Fas 8 3
대한소화기학회지 :제39권 제2호, 2002
매개성 세포사멸을 증가시킨다는 보고가 있다.8 3 바이러스 성 간경변에서 발견되는 임파구는 FasL을 발현하고8 4 이때 Fas+ 간세포의 세포사멸을 유도하고 결국 간손상을 일으킨 다. 이와 일치하게 간세포에 HBsAg 과다 발현 유전자전이 마우스에서 HBsAg 특이 CTL은 Fas 매개성 기전에 의해 간 손상을 일으킨다고 한다.85
9 . 알코올성 간질환
알코올성 간질환에서도 Fas가 약간 증가한다고 보고되어 있으나 알코올성 간경변 말기에서 연구가 이루어졌다.8 0 급 성 염증에 의한 급성 간질환에서는 아직 보고되지 않았으나 Fas 발현의 증가가 추정된다. 알코올성 간경변에서는 FasL 발현의 증가가 관찰되었다.86
10 . Wils on병
구리는 cytochrome c oxidase나 superoxide dismutase 등의 효소에 미량 필요한 물질로 과량시 단백 및 지질산화를 일 으키고 그 결과 ROS를 생성하게 된다. Wilson병은 체염색 체 열성으로 구리 과부하가 초래되는 바 초기에 hepatolen- ticular 퇴행과 뇌구리 침착에 의한 운동조절장애가 속발한 다. 과다 구리부하가 있는 세포는 자유기 생성이 관찰되고 산화성 스트레스가 유발되며 이때 Fas 매개성 세포사멸이 있게 된다.87 Hep G2 간암세포에 과다한 구리처리는 FasL 발현을 증가시킨다.
1 1 . 담도계 질환
담즙염이나 간담도 결찰은 설치류 간세포에서 Fas 매개 성 세포사멸을 유도한다고 한다.8 8 , 89 담관상피세포에서는 Cryptospordia 감염시 부분적으로 Fas 경유성 또는 FasL 상 향조절에 의해 세포사멸이 일어난다.9 0
12 . 간암
Fas 결핍마우스에게 악성 B임파종 유발은 Fas가 암억제 작용을 갖고 있음을 시사한다.9 1 그러나 간암 및 위장관암 유발은 보고되지 않았다. FasL 양성 암침윤임파구(tumor infiltrating lymphocyte, TIL)에 의한 Fas 매개성 세포사에 대 한 내성이 관여되는 면역회피에 의해 간암 및 대장암이 발 생하리라는 가설이 있으며 실제 몇 주의 간암과 대장암 세 포주에서 Fas 매개성 세포사멸에 내성을 보였다.9 2 대장암에 서는 FasL과 결합하여 차단하는 decoy 수용체가 Fas 매개성 세포사멸내성을 유발하기도 한다.9 3 최근 Fas 역공격(Fas counterattack)이론이 부상하고 있는 바 즉 암세포가 FasL을 발현하고 활성화된 Fas+ T세포에 세포사멸을 유도하여 면 역파괴를 우회하는 기전으로 실제 몇 주의 대장암세포에서 는 기능적 FasL 발현이 관찰되었다.5 2 또한 FasL은 원발성
대장암에서 Fas 반응성 간내 침윤이 용이하게 하는데 작용 할 수 있다.9 4
결 론
장상피세포교체의 정상 역동적 과정에서 세포사멸은 중 요한 역할을 담당한다. 세포증식은 크립트에서 일어나며 분 화는 신속하고 순서적으로 이동하여 융모에서 일어나게 된 다. 증식은 같은 속도의 세포사에 의해 역균형을 유지하게 된다. 융모첨단에서 일어나는 분화장상피세포 세포사멸은 세포 항상성을 유지하게 되고 허혈재관류 손상, 염증성 장 질환 등에서 세포사멸의 증가는 세포손상에 중요한 역할을 하며 방사선조사나 박테리아 감염에 의한 손상된 세포를 제 거하는 중요한 기전이다. 간질환에서 Fas/FasL 시스템은 간 이식 거부 반응, B형, C형 간염 바이러스성 간염, 담도계 질 환에서 염증반응과 관련하여 세포사멸이 관련된다. 또한 위 장관암 및 간암에서 세포사멸의 장애는 발암기전에 관련된 다고 본다. 따라서 이러한 위장관 질환에서 세포사멸에 대 한 병인의 연구는 장차 진단 및 치료에 있어 새로운 접근을 가능하게 할 것이다.
참 고 문 헌
1. Schwartzman RA, Cidlowski JA. Apoptosis: the biochemistry and molecular biology of programmed cell death. Endocr Rev 1993;14:133-151.
2. Nagata S. Fas-mediated apoptosis. Adv Exp Med Biol 1996;
406:119-124
3. Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy. Cancer 1994;73:
2013-226.
4. Duke RC, Ojcius DM, Young JD. Cell suicide in health and disease. Sci Am 1996;275:80-87.
5. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics.
Br J Cancer 1972;26:239-257.
6. Buttke TM, Sandstrom PA. Oxidative stress as a mediator of apoptosis. Immunol Today 1994;15:7-10.
7. Muzio M, Chinnaiyan AM, Kischkel FC, et al. FLICE, a novel FADD-homologous ICE/CED-3-like protease, is recruited to the CD95 (Fas/APO-1) death--inducing signaling complex. Cell 1996;85:817-827.
8. Zamzami N, Marchetti P, Castedo M, et al. Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death. J Exp Med 1995;182:367-377.
9. Liu X, Kim CN, Yang J, Jemmerson R, Wang X. Induction of 8 4
김대곤 . 위장관 질환과 세포사멸
apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell 1996;86:147-157.
10. Luo X, Budihardj o I, Zou H, Slaughter C, Wang X. Bid, a Bcl2 interacting protein, mediates cytochrome c release from mitochondria in response to activation of cell surface death receptors. Cell 1998;94:481-490.
11. Yang J, Liu X, Bhalla K, et al. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked.
Science 1997;275:1129-1132.
12. Wolter KG, Hsu YT, Smith CL, Nechushtan A, Xi XG, Youle RJ. Movement of Bax from the cytosol to mitochondria during apoptosis. J Cell Biol 1997;139:1281-1292.
13. Jurgensmeier JM, Xie Z, Deveraux Q, Ellerby L, Bredesen D, Reed JC. Bax directly induces release of cytochrome c from isolated mitochondria. Proc Natl Acad Sci U S A 1998;
95:4997-5002.
14. Susin SA, Lorenzo HK, Zamzami N, et al. Molecular characterization of mitochondrial apoptosis-inducing factor.
Nature 1999;397:441-446.
15. Kidd VJ. Proteolytic activities that mediate apoptosis. Annu Rev Physiol 1998;60:533-573.
16. Martin SJ, Green DR. Protease activation during apoptosis:
death by a thousand cuts? Cell 1995;82:349-352.
17. Casiano CA, Martin SJ, Green DR, Tan EM. Selective cleavage of nuclear autoantigens during CD95 (Fas/APO-1)- mediated T cell apoptosis. J Exp Med 1996;184:765-770.
18. Srinivasula SM, Ahmad M, Fernandes-Alnemri T, Litwack G, Alnemri ES. Molecular ordering of the Fas-apoptotic pathway:
the Fas/APO-1 protease Mch5 is a CrmA-inhibitable protease that activates multiple Ced-3/ICE-like cysteine proteases. Proc Natl Acad Sci U S A 1996;93:14486-14491.
19. Kuwana T, Smith JJ, Muzio M, Dixit V, Newmeyer DD, Kornbluth S. Apoptosis induction by caspase-8 is amplified through the mitochondrial release of cytochrome c. J Biol Chem 1998;273:16589-16594.
20. You KR, Shin MN, Park RK, Lee SO, Kim DG. Activation of caspase-8 during N-(4-hydroxyphenyl)retinamide-induced apopto- sis in Fas-defective hepatoma cells.Hepatology 2001;34:1119- 1127.
21. MacKenzie A, LaCasse E. Inhibition of IAP's protection by Diablo/Smac: new therapeutic opportunities? Cell Death Differ 2000;7:866-867.
22. Sakahira H, Enari M, Nagata S. Cleavage of CAD inhibitor in CAD activation and DNA degradation during apoptosis. Nature 1998;391:96-99.
23. Ruifrok AC, Mason KA, Lozano G, Thames HD. Spatial and temporal patterns of expression of epidermal growth factor, transforming growth factor alpha and transforming growth
factor beta 1-3 and their receptors in mouse jejunum after radiation treatment. Radiat Res 1997;147:1-12.
24. Sheng H, Shao J, O'Mahony CA, et al. Transformation of intestinal epithelial cells by chronic TGF-beta1 treatment results in downregulation of the type II TGF-beta receptor and induction of cyclooxygenase-2. Oncogene 1999;18:855-867.
25. Iwanaga T. The involvement of macrophages and lymphocytes in the apoptosis of enterocytes. Arch Histol Cytol 1995;58:
151-159.
26. Guy-Grand D, DiSanto JP, Henchoz P, Malassis-Seris M, Vassalli P. Small bowel enteropathy: role of intraepithelial lymphocytes and of cytokines (IL-12, IFN-gamma, TNF) in the induction of epithelial cell death and renewal. Eur J Immunol 1998;28:730-744.
27. Madesh M, Benard O, Balasubramanian KA. Apoptotic process in the monkey small intestinal epithelium: 2. Possible role of oxidative stress. Free Radic Biol Med 1999;26:431-438.
28. Scheving LA, Jin WH, Chong KM, Gardner W, Cope FO.
Dying enterocytes downregulate signaling pathways converging on Ras: rescue by protease inhibition. Am J Physiol 1998;274:
C1363-1372.
29. Veldman RJ, Klappe K, Hoekstra D, Kok JW. Interferon- gamma-induced differentiation and apoptosis of HT29 cells:
dissociation of (glucosyl)ceramide signaling. Biochem Biophys Res Commun 1998;247:802-808.
30. Papaconstantinou HT, Hwang KO, Rajaraman S, Hellmich MR, Townsend CM Jr, Ko TC. Glutamine deprivation induces apoptosis in intestinal epithelial cells. Surgery 1998;124:152-160.
31. Hass R, Busche R, Luciano L, Reale E, Engelhardt WV. Lack of butyrate is associated with induction of Bax and subsequent apoptosis in the proximal colon of guinea pig. Gastroenterology 1997;112:875-881.
32. Moss SF, Attia L, Scholes JV, Walters JR, Holt PR. Increased small intestinal apoptosis in coeliac disease. Gut 1996;39:
811-817.
33. Iwamoto M, Koj i T, Makiyama K, Kobayashi N, Nakane PK.
Apoptosis of crypt epithelial cells in ulcerative colitis. J Pathol 1996;180:152-159.
34. Strater J, Wellisch I, Riedl S, et al. CD95 (APO-1/Fas)- mediated apoptosis in colon epithelial cells: a possible role in ulcerative colitis. Gastroenterology 1997;113:160-167.
35. Yamamoto H, Perez-Piteira J, Yoshida T, et al. Gastric cancers of the microsatellite mutator phenotype display characteristic genetic and clinical features. Gastroenterology 1999;116:1348- 1357.
36. Jeon BR, Yeom DH, Lee SM. Protective effect of allopurinol on hepatic energy metabolism in ischemic and reperfused rat liver. Shock 2001;15:112-117.
8 5
The Korean Journal of Gastroenterology : Vol. 39. No. 2. 2002
37. Sener G, Akgun U, Satiroglu H, Topaloglu U, Keyer-Uysal M.
The effect of pentoxifylline on intestinal ischemia/reperfusion injury. Fundam Clin Pharmacol 2001 ;15:19-22.
38. Ogura E, Senzaki H, Yamamoto D, et al. Prognostic significance of Bcl-2, Bcl-xL/S, Bax and Bak expressions in colorectal carcinomas. Oncol Rep 1999;6:365-369.
39. Okuno S, Shimizu S, Ito T, et al. Bcl-2 prevents caspase- independent cell death. J Biol Chem 1998;273:34272-34277.
40. Hague A, Moorghen M, Hicks D, Chapman M, Paraskeva C.
BCL-2 expression in human colorectal adenomas and carcinomas.Oncogene 1994;9:3367-3370.
41. Yagi OK, Akiyama Y, Nomizu T, Iwama T, Endo M, Yuasa Y. Proapoptotic gene BAX is frequently mutated in hereditary nonpolyposis colorectal cancers but not in adenomas.
Gastroenterology 1998;14:268-274.
42. Hirose Y, Yoshimi N, Suzui M, Kawabata K, Tanaka T, Mori H.Expression of bcl-2, bax, and bcl-XL proteins in azoxymethane-induced rat colonic adenocarcinomas. Mol Carcinog 1997;19:25-30.
43. Rampino N, Yamamoto H, Ionov Y, et al. Somatic frameshift mutations in the BAX gene in colon cancers of the microsatellite mutator phenotype.Science 1997;275:967-969.
44. Krajewska M, Moss SF, Krajewski S, Song K, Holt PR, Reed JC. Elevated expression of Bcl-X and reduced Bak in primary colorectal adenocarcinomas. Cancer Res 1996;56:2422-2427.
45. Rosen K, Rak J, Jin J, Kerbel RS, Newman MJ, Filmus J.
Downregulation of the pro-apoptotic protein Bak is required for the ras-induced transformation of intestinal epithelial cells.Curr Biol 1998;8:1331-1334.
46. Ina K, Kusugami K, Hosokawa T, et al. Increased mucosal production of granulocyte colony-stimulating factor is related to a delay in neutrophil apoptosis in Inflammatory Bowel disease.J Gastroenterol Hepatol 1999;14:46-53.
47. Boirivant M, Marini M, Di Felice G, et al. Lamina propria T cells in Crohn 's disease and other gastrointestinal inflammation show defective CD2 pathway-induced apoptosis. Gastro- enterology 1999;116:557-565.
48. Ina K, Itoh J, Fukushima K, et al. Resistance of Crohn 's disease T cells to multiple apoptotic signals is associated with a Bcl-2/Bax mucosal imbalance. J Immunol 1999;163:1081-1090.
49. Abreu-Martin MT, Palladino AA, Faris M, Carramanzana NM, Nel AE, Targan SR. Fas activates the JNK pathway in human colonic epithelial cells: lack of a direct role in apoptosis. Am J Physiol 1999;276:G599-605.
50. Ueyama H, Kiyohara T, Sawada N, et al. High Fas ligand expression on lymphocytes in lesions of ulcerative colitis. Gut 1998;43:48-55.
51. Arai N, Mitomi H, Ohtani Y, Igarashi M, Kakita A, Okayasu
I. Enhanced epithelial cell turnover associated with p53 accumulation and high p21WAF1/CIP1 expression in ulcerative colitis.Mod Pathol 1999;12:604-611.
52. O'Connell J, O'Sullivan GC, Collins JK, Shanahan F. The Fas counterattack: Fas-mediated T cell killing by colon cancer cells expressing Fas ligand. J Exp Med 1996;184:1075-1082.
53. Kim JM, Eckmann L, Savidge TC, Lowe DC, Witthoft T, Kagnoff MF. Apoptosis of human intestinal epithelial cells after bacterial invasion.J Clin Invest 1998;102:1815-1823.
54. Keenan KP, Sharpnack DD, Collins H, Formal SB, O'Brien AD. Morphologic evaluation of the effects of Shiga toxin and E coli Shiga-like toxin on the rabbit intestine. Am J Pathol 1986;125:69-80.
55. Bloom PD, Boedeker EC. Mucosal immune responses to intestinal bacterial pathogens. Semin Gastrointest Dis 1996;7:
151-166.
56. Fiorentini C, Fabbri A, Falzano L, et al. Clostridium difficile toxin B induces apoptosis in intestinal cultured cells.: Infect Immun 1998;66:2660-2665.
57. Mahida YR, Galvin A, Makh S, et al. Effect of Clostridium difficile toxin A on human colonic lamina propria cells: early loss of macrophages followed by T-cell apoptosis. Infect Immun 1998;66:5462-5469.
58. Wagner S, Beil W, Westermann J, et al. Regulation of gastric epithelial cell growth by Helicobacter pylori: offdence for a major role of apoptosis. Gastroenterology 1997 ;113:1836-1847.
59. Chen G, Sordillo EM, Ramey WG, et al. Apoptosis in gastric epithelial cells is induced by Helicobacter pylori and accompanied by increased expression of BAK. Biochem Biophys Res Commun 1997;239:626-632.
60. Fan X, Crowe SE, Behar S, et al. The effect of class II maj or histocompatibility complex expression on adherence of Helicobacter pylori and induction of apoptosis in gastric epithelial cells: a mechanism for T helper cell type 1-mediated damage. J Exp Med 1998;187:1659-1669.
61. Rudi J, Kuck D, Strand S, et al. Involvement of the CD95 (APO-1/Fas) receptor and ligand system in Helicobacter pylori-induced gastric epithelial apoptosis. J Clin Invest 1998;
102:1506-1514.
62. Houghton J, Korah RM, Condon MR, Kim KH. Apoptosis in Helicobacter pylori-associated gastric and duodenal ulcer disease is mediated via the Fas antigen pathway. Dig Dis Sci 1999;44:465-478.
63. Potten CS, Merritt A, Hickman J, Hall P, Faranda A.
Characterization of radiation-induced apoptosis in the small intestine and its biological implications. Int J Radiat Biol 1994;65:71-78.
64. Potten CS, Grant HK. The relationship between ionizing 8 6
Kim. Apoptosis and Gastrointestinal Disease
radiation-induced apoptosis and stem cells in the small and large intestine. Br J Cancer 1998;78:993-1003.
65. Merritt AJ, Potten CS, Kemp CJ, et al. The role of p53 in spontaneous and radiation-induced apoptosis in the gastrointestinal tract of normal and p53-deficient mice. Cancer Res 1994;54:614-617.
66. Merritt AJ, Allen TD, Potten CS, Hickman JA. Apoptosis in small intestinal epithelial from p53-null mice: evidence for a delayed, p53-independent G2/M-associated cell death after gamma-irradiation. Oncogene 1997;14:2759-2766.
67. Melino G, Bernassola F, Knight RA, Corasaniti MT, Nistico G, Finazzi-Agro A.S-nitrosylation regulates apoptosis. Nature 1997;388:432-433.
68. Mannick JB, Miao XQ, Stamler JS. Nitric oxide inhibits Fas-induced apoptosis. J Biol Chem 1997;272:24125-24128.
69. Nishikawa M, Takeda K, Sato EF, Kuroki T, Inoue M. Nitric oxide regulates energy metabolism and Bcl-2 expression in intestinal epithelial cells. Am J Physiol 1998;274:G797-801.
70. Genaro AM, Hortelano S, Alvarez A, Martinez C, Bosca L.
Splenic B lymphocyte programmed cell death is prevented by nitric oxide release through mechanisms involving sustained Bcl-2 levels. J Clin Invest 1995;95:1884-1890.
71. Kim YM, Talanian RV, Billiar TR. Nitric oxide inhibits apoptosis by preventing increases in caspase-3-like activity via two distinct mechanisms. J Biol Chem 1997;272:31138-31148.
72. Leist M, Single B, Naumann H, et al. Inhibition of mitochondrial ATP generation by nitric oxide switches apoptosis to necrosis. Exp Cell Res 1999;249:396-403.
73. Madesh M, Ramachandran A, Pulimood A, Vadranam M, Balasubramanian KA. Attenuation of intestinal ischemia/
reperfusion injury with sodium nitroprusside: studies on mitochondrial function and lipid changes. Biochim Biophys Acta 2000;1500:204-216.
74. Ogasawara J, Watanabe-Fukunaga R, Adachi M, et al. Lethal effect of the anti-Fas antibody in mice. Nature 1993;364:806-809.
75. Huang L, Soldevila G, Leeker M, Flavell R, Crispe IN. The liver eliminates T cells undergoing antigen-triggered apoptosis in vivo. Immunity. Immunity. 1994;1:741-749.
76. Kawahara T, Kasai S, Yagita H, et al. Critical role of Fas/Fas ligand interaction in CD28-independent pathway of allogeneic murine hepatocyte rejection. Hepatology 1997 ;26:944-948.
77. Li XK, Kita Y, Tamura A, Enosawa S, Amemiya H, Suzuki S.
Activation of Fas and perforin pathways in rat liver allograft rejection. Transplant Proc 1998;30:19-21.
78. Muruve DA, Nicolson AG, Manfro RC, Strom TB, Sukhatme VP, Libermann TA. Adenovirus-mediated expression of Fas ligand induces hepatic apoptosis after Systemic administration and apoptosis of ex vivo-infected pancreatic islet allografts and
isografts. Hum Gene Ther 1997;8:955-963.
79. Li XK, Okuyama T, Tamura A, et al. Prolonged survival of rat liver allografts transfected with Fas ligand-expressing plasmid.
Transplantation 1998;66:1416-1423.
80. Galle PR, Hofmann WJ, Walczak H, et al. Involvement of the CD95 (APO-1/Fas) receptor and ligand in liver damage. J Exp Med 1995;182:1223-1230.
81. Galle PR, Krammer PH. CD95-induced apoptosis in human liver disease. Semin Liver Dis 1998;18:141-151.
82. Hayashi N, Mita E. Fas system and apoptosis in viral hepatitis.
J Gastroenterol Hepatol 1997;12:S223-226.
83. Ruggieri A, Harada T, Matsuura Y, Miyamura T. Sensitization to Fas-mediated apoptosis by hepatitis C virus core protein.
Virology 1997;229:68-76.
84. Mita E, Hayashi N, Iio S, et al. Role of Fas ligand in apoptosis induced by hepatitis C virus infection. Biochem Biophys Res Commun 1994;204:468-474.
85. Kondo T, Suda T, Fukuyama H, Adachi M, Nagata S.
Essential roles of the Fas ligand in the development of hepatitis. Nat Med 1997;3:409-413.
86. Pinkoski MJ, Brunner T, Green DR, Lin T. Fas and Fas ligand in gut and liver. Am J Physiol Gastrointest Liver Physiol 2000;278:G354-366.
87. Strand S, Hofmann WJ, Grambihler A, et al. Hepatic failure and liver cell damage in acute Wilson 's disease involve CD95 (APO-1/Fas) mediated apoptosis. Nat Med 1998;4:588-593.
88. Faubion WA, Guicciardi ME, Miyoshi H, et al. Toxic bile salts induce rodent hepatocyte apoptosis via direct activation of Fas.
J Clin Invest 1999103:137-145.
89. Miyoshi H, Rust C, Roberts PJ, Burgart LJ, Gores GJ.
Hepatocyte apoptosis after bile duct ligation in the mouse involves Fas. Gastroenterology 1999;117:669-677.
90. Chen XM, Levine SA, Tietz P, et al. Cryptosporidium parvum is cytopathic for cultured human biliary epithelia via an apoptotic mechanism. Hepatology 1998;28:906-913.
91. Peng SL, Robert ME, Hayday AC, Craft J. A tumor-suppressor function for Fas (CD95) revealed in T cell-deficient mice. J Exp Med 1996;184:1149-1154.
92. Tillman DM, Harwood FG, Gibson AA, Houghton JA.
Expression of genes that regulate Fas signalling and Fas- mediated apoptosis in colon carcinoma cells. Cell Death Differ 1998;5:450-457.
93. Pitti RM, Marsters SA, Lawrence DA, et al. Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer. Nature 1998;396:699-703.
94. Shiraki K, Tsuji N, Shioda T, Isselbacher KJ, Takahashi H.
Expression of Fas ligand in liver metastases of human colonic adenocarcinomas. Proc Natl Acad Sci U S A 1997;94:6420-6425.
8 7