대한소화기학회지 2003;42:12-19
서 론
1)접수: 2002년 12월 16일, 승인: 2003년 5월 6일
연락처: 정인식, 137-040, 서울특별시 서초구 반포동 505번지 가톨릭대학교 의과대학 소화기내과, 강남성모병원 Tel: (02) 590-1656, Fax: (02) 590-2387
E-mail: isc@cmc.cuk.ac.kr
※본 논문은 가톨릭대학교 성빈센트병원 임상의학연구비 지원으 로 이루어졌음.
Helicobacter pylori (H. pylori)는 만성 활동성 위염 및 소 화성 궤양의 중요한 원인이며,1,22)여러 역학조사에서 위암
Correspondence to: In Sik Chung, M.D.
Department of Internal Medicine, Kangnam St. Mary's Hospital 505 Banpo-dong, Seocho-gu, Seoul 137-040, Korea
Tel: +82-2-590-1656, Fax: +82-2-590-2387 E-mail: isc@cmc.cuk.ac.kr
위암화과정에서 Helicobacter pylori 감염이
위점막 세포 역동학과 아포토시스 관련 단백질 발현에 미치는 영향
가톨릭대학교 의과대학 내과학교실, 임상병리학교실*, 서울대학교 보건통계학교실†
이강문·이동수·양진모·안병민·이은희*·유진영*·김유정
†·정인식·선희식·박두호
Effect of Helicobacter pylori on Gastric Epithelial Cell Kinetics and Expression of Apoptosis-related Proteins in Gastric Carcinogenesis
Kang Moon Lee, M.D., Dong Soo Lee, M.D., Jin Mo Yang, M.D., Byung Min Ahn, M.D., Eun Hee Lee, M.D.*, Jin Young Yoo, M.D.*, You Joung Kim, M.P.H.†, In Sik Chung, M.D.,
Hee Sik Sun, M.D., and Doo Ho Park, M.D.
Departments of Internal Medicine and Clinical Pathology*, College of Medicine,
The Catholic University of Korea; Division of Biostatistics, Seoul National University†, Seoul, Korea
Background/Aims: We investigated apoptosis, cell proliferation and the expression of apoptosis-related proteins in the gastric epithelial cells of Helicobacter pylori (H. pylori)-negative and positive patients. Methods: TUNEL staining, immunohistochemical staining for Ki-67, p53, Bcl-2, Bcl-X
Land Bax were performed on paraffin-embedded specimens obtained from 11 H. pylori-negative controls, 20 H. pylori-positive chronic gastritis, 10 chronic gastritis with intestinal metaplasia (IM), 11 adenoma, and 7 adenocarcinoma patients. Apoptosis and proliferation were expressed as apoptosis index (AI) and proliferation index (PI). Results: In H. pylori-positive groups, apoptosis and proliferation were increased compared with controls. However, an AI/PI ratio was highest in chronic gastritis cases and then gradually reduced according to the progress from IM to cancer. p53 was expressed in 28.6% of adenocarcinoma cases. Expression of Bax was significantly increased in chronic gastritis and IM patients compared with controls. Conclusions: H. pylori infection induces marked increase in apoptosis and proliferation of gastric mucosa. In the premalignant lesions, the balance between apoptosis and proliferation is altered, and this imbalance may play a key role in the gastric carcinogenesis. (Korean J Gastroenterol 2003;42:12-19)
Key Words: Helicobacter pylori; Apoptosis; Gastric carcinogenesis; Protein p53; Bax
이강문 외 9명. Helicobacter pylori 감염이 위점막 세포 역동학에 미치는 영향
발생과 관련이 있는 것으로 알려져 있다.3-5 WHO에서는 H.
pylori를 명확한 발암인자(group 1 carcinogen)로 분류하였다.6 H. pylori 감염이 지속되면 위점막의 만성 염증이 유발되고, 음식이나 환경, 유전적 요인과의 상호작용을 통해 위암이 발 생할 것으로 생각되나,7,8 아직도 H. pylori가 위암의 발생에 관여하는 명확한 기전은 규명되지 않고 있는 실정이다.
아포토시스는 유전적으로 조절되는 계획된 세포사 (programmed cell death)로 정의되며, 다세포 생물의 배아발 생과정(embryogenesis) 혹은 정상적인 조직에서 과도하거나 손상받은 세포를 제거하는 기능을 한다. 아포토시스는 염 증반응을 동반하지 않는 단일세포의 사멸로, 염색질의 농 축, DNA의 분절화, 세포 사멸체(apoptotic body) 형성 등의 조직학적 특징을 나타내므로 또 다른 세포사인 괴사와 구 분된다.9 아포토시스는 세포증식에 대해 상호 보완적이면서 반대 역할을 하여 세포 수를 조절하고 항상성을 유지하는 데, 아포토시스의 증가 혹은 감소로 인해 아포토시스-세포 증식의 균형이 깨어지면 종양, 자가면역질환 등 여러 질환 이 발생하는 것으로 알려져 있다.10-12
H. pylori 감염에 의한 위점막의 아포토시스가 보고13되 면서, 이러한 아포토시스의 증가가 과도한 증식반응을 초 래하여 위암 발생에 기여할 것이라고 제시되었으며, 이후 소화성 궤양, 위염, 장상피화생, 이형성, 위암 환자를 대상 으로 한 여러 보고14-21에서 H. pylori에 의한 위점막의 아포 토시스 증가가 확인되었다.
H. pylori가 감염되면 위점막의 만성 염증이 유발되고, 지속적인 만성 염증이 점막의 위축 및 장상피화생으로 진 행하며 이형성을 거쳐 암으로 발전한다는 위암의 다단계 모델이 제시되었고,22 이러한 위암화과정에서 위점막의 세 포 역동학(cell kinetics)의 변화 및 여러 암유전자 및 종양 억제 유전자의 작용에 대해 관심이 모아지고 있으나, 세포 역동학 혹은 암유전자 발현의 어느 한쪽에 치우친 연구가 대부분이고, 이 둘의 연관성을 살펴본 연구는 드물다. 또한 연구 결과들 간에 차이를 보이고 있다.
저자들은 H. pylori 음성군과 H. pylori 양성인 만성 위염, 장상피화생, 이형성, 위암 등 위암화과정의 각 단계에서 위 점막의 아포토시스 및 세포증식의 변화와 차이를 조사하고, 각 단계에서 아포토시스에 관여하는 단백질들의 발현 양상 을 동시에 알아보았다.
대상 및 방법
1. 대상
건강검진 또는 소화불량 증상으로 2001년 3월부터 2001 년 12월까지 가톨릭대학교 의과대학 대전성모병원에서 내 시경검사를 받은 환자들을 대상으로 하였다. 최근에 항생
제나 비스테로이드성 소염진통제, 비스무스제제 등을 복용 한 경우는 제외하였다. 내시경을 하면서 위전정부에서 2점, 체부에서 2점 등 모두 4점의 생검을 하여 전정부 및 체부의 각각 1점씩은 CLO test 및 조직학적 검사에 이용하였고, 이 형성군 및 위암군의 경우는 병변 부위 생검과 함께 전정부, 체부에서 각각 1점의 생검을 하여 H. pylori 검사에 이용하 였다. H. pylori 감염 여부는 조직검사 및 CLO test 둘 중 하나에서 양성일 경우 감염된 것으로 판정하였다.
모두 59명을 H. pylori 음성군, H. pylori 양성인 만성 위 염군, 만성 위염+장상피화생군, 이형성군, 위암군의 5군으 로 나누어 등록하였다(Table 1). H. pylori 음성군 중 5명에 서 조직학적으로 위염이 없었으며, 나머지 6명에서도 경한 위염만이 있었다. 이 중 5명에서는 grade 1의 경한 위축성 변화가 관찰되었다. 반면에 H. pylori 양성인 만성 위염군은 경한 위염 7명, 중등도 위염 11명, 심한 위염 2명이었고, 3 명을 제외한 모든 예에서 위축성 변화(grade 1-2)가 있었으 며, 장상피화생군은 경한 위염 1명을 제외하고 9명이 중등 도 위염 소견을 보였다. 이형성군은 11명 모두 관상선종 (tubular adenoma)이었다. 위암군은 장형암(intestinal type cancer)만을 대상으로 하였으며 7명 중 조기 위암 4명, 진행 위암 3명이었다.
2. 방법 1) 조직학적 평가
Updated Sydney system23에 의거하여 급성 염증, 만성 염 증, 위축, 장상피화생 정도를 평가하였다. 급성 염증의 지표 로서 점막 고유층, 소와(foveolae) 및 표층 상피에 있는 중 성구의 침윤 정도를 정상, 경증, 중등증, 중증으로 등급을 나누고 각각을 0, 1, 2, 3으로 점수화하였고, 만성 염증의 지표로서는 점막 고유층의 림프구 및 형질세포의 침윤 정 도를 역시 같은 방법으로 0에서 3까지 등급화하였다. 위염 의 정도는 급성 염증과 만성 염증의 점수를 합한 점수가 1-2이면 경한 위염, 3-4이면 중등도 위염, 5-6이면 심한 위 염으로 평가하였다.20
Table 1. Demographic Characteristics of Patients
Groups No. Sex (M:F) Age (yr) H. pylori (-)
H. pylori (+) Gastritis IM Dysplasia Carcinoma
11 20 10 11 7
4 : 7 7 : 13 5 : 5 6 : 5 4 : 3
45.2±16.3 40.0±14.9 63.3± 8.7*
58.0± 8.4*
53.7±12.1 IM, intestinal metaplasia.
* p<0.05 (compared with gastritis group).
13
The Korean Journal of Gastroenterology: Vol. 42, No. 1, 2003
2) 아포토시스검사(TUNEL method)
Apoptag (in situ apoptosis detection kit, Intergen, Purchase, NY, USA)을 이용하여 아포토시스검사를 시행하 였다. 위생검 조직을 파라핀에 포매하여 만든 4 µm 두께의 절편에서 파라핀을 제거한 후 proteinase K (20 µg/mL)로 실온에서 15분 동안 처리하고 증류수로 세척하여 조직절편 에서 단백질을 제거하였다. 실온에서 5분 동안 3% H2O2/ phosphate-buffered saline (PBS)에 처리하여 endogenous peroxidase를 불활성화시킨 후 working-strength terminal deoxynucleotidyl transferase (TdT) 55 µL을 조직에 떨어뜨 리고 한 시간 동안 37℃의 온도로 유지시켰다. PBS로 세척 하고 두 방울의 anti-digoxigenin-peroxidase를 떨어뜨린 후 30분 동안 실온에서 유지시키고 PBS로 다시 3번 세척 후 diaminobenzidine (Sigma, St. Louis, MO, USA)으로 발색시 켰다. 양성 대조군으로는 편도선의 조직을 이용하였고, 염 색 과정 중 TdT를 빼고 염색한 조직을 음성 대조군으로 삼 았다. 대상 환자군을 모르는 병리의사가 염색된 조직을 광 학현미경으로 관찰하여 위소와가 장축으로 보이는 부위에 서 최소 500개 이상의 상피세포를 센 후 상피세포 100개에 대한 TUNEL 양성 세포의 백분율을 구하여 아포토시스 지 수(apoptosis index, AI)로 하였다.
3) Ki-67 및 p53, Bcl-2, Bcl-XL, Bax 단백질에 대한 면역 조직화학염색검사
세포증식을 평가하기 위해 Ki-67에 대한 면역조직화학염 색을 시행하였다. Ki-67은 세포증식과 관련된 비히스톤 (non-histone) 단백질로 세포증식의 표지자로 널리 이용되 고 있다. 4 µm 두께의 조직 절편에서 파라핀을 제거하고 함수과정을 거친 후 항원성 회복을 위해 구연산 완충용액 (10 mM, pH 6.0)에 슬라이드를 담가 10분간 autoclave한 후 30분이 초과하지 않도록 실온에 방치하였다. 3% H2O2에 처리하여 내인성 과산화효소(endogenous peroxidase)를 불활성 화시키고 10% normal goat serum (Zymed, San Francisco, CA, USA)으로 비특이적 결합을 차단하였다. 1:100으로 희석한 mouse anti-human Ki-67 단클론성 항체(Clone MIB-1, DAKO, Glostrup, Denmark)를 첨가하여 상온에서 1시간 동 안 반응시켰다. Biotinylated 이차 항체와 streptavidine- peroxidase (HistostatinⓇ-Plus Bulk Kits, Zymed)로 처리한 후 AEC (Zymed)로 발색시켰다. 대조염색에는 10% hematoxylin 을 이용하였다. AI와 같은 방법으로 최소 500개 이상의 상 피세포를 센 후 상피세포 100개에 대한 Ki-67 양성 세포의 백분율을 구하여 세포증식 지수(proliferation index, PI)로 하였다.
p53, Bcl-2, Bcl-XL, Bax 단백질에 대한 면역조직화학염 색을 위해서 NeoMarkers사 (Fermont, CA, USA)의 1:100으로
희석한 mouse anti-p53 단클론성 항체(Clone DO-7), mouse anti-Bcl-2 단클론성 항체(Clone 8C8), mouse anti-Bcl-XL 단 클론성 항체(Clone 7D9), mouse anti-Bax 단클론 성항체 (Clone 2D2)를 이용하였으며, Ki-67에서와 같이, Histostatin
Ⓡ-Plus Bulk Kits (Zymed)로 처리 후 AEC로 발색시켜 관찰 하였다. 양성 대조로는 p53은 유방암 조직, Bcl-2는 편도 조 직을 이용하였고, Bcl-XL와 Bax는 Hodgkin's 림프종을 이용 하였다. 염색 결과의 판정은 염색이 안 된 경우 음성(0)으 로, 양성 대조와 같은 강도를 강양성(2), 미미한 정도를 약 양성(1)으로 하였다.
4) 통계
자료의 분석을 위해서 SAS package (version 8.1)를 이용 하였다. 각각의 수치는 평균±SD로 나타내었다. 각 5개군 간의 비교를 위해선 백분율 점수를 가지는 PI와 AI의 경우 는 ANOVA를 이용하였고, 0부터 2 이하의 grade를 값으로 하는 p53, Bcl-2, Bcl-XL, Bax에 대해서는 Kruskal-Wallis test 및 Fisher's exact test를 사용하였으며 이 중 대조군과 각각의 군과의 비교를 위해서는 Wilcoxon rank sum test를 이용하였다. p값 0.05 미만을 통계적으로 유의한 것으로 판 정하였다.
결 과
1. 아포토시스 및 세포증식 1) 각 군 간의 AI 및 PI
H. pylori 양성군에서 H. pylori 음성군에 비해 TUNEL
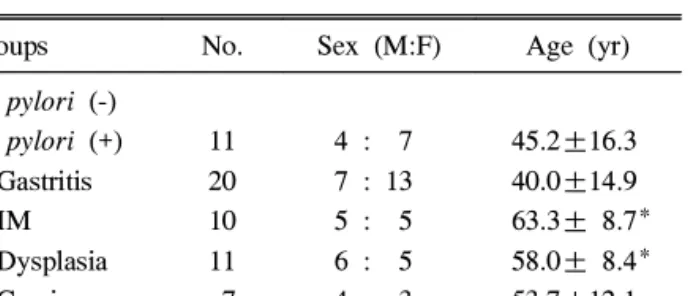
Fig. 1. Microscopic finding of the gastric mucosa. (A, B) Nuclear immunostaining of Ki-67 in gastric tissue from chronic gastritis and adenocarcinoma patients (×400). (C, D) TUNEL positive apoptotic cells are identified in the gastric tissue from chronic gastritis and adenocarcinoma patients (arrows) (×400).
14
A B
C D
Lee KM, et al. Helicobacter pylori and Gastric Epithelial Cell Kinetics
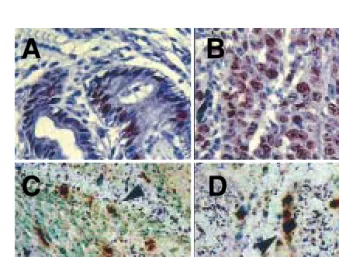
Table 2. Apoptosis and Proliferation Indices in Gastric Mucosal Lesions
Groups No. AI* PI† AI/PI H. pylori (-)
H. pylori (+) Gastritis IM Dysplasia Carcinoma
11 20 10 11 7
0.18±0.40 1.30±0.98‡ 1.33±0.70§ 1.55±1.13¶ 2.00±2.00∥
7.55±6.41 11.90±9.10 17.50±6.70∥ 22.27±11.18∥ 36.57±11.72#
0.03±0.07 0.11±0.10# 0.08±0.05 0.07±0.10 0.06±0.06 AI, apoptosis index; PI, proliferation index; IM, intestinal metaplasia.
* p<0.005 (compared by group).
†p<0.0001 (compared by group).
‡p<0.005 (compared with control).
§ p=0.02 (compared with control).
∥p<0.01 (compared with control).
¶ p<0.001 (compared with control).
#p<0.0001 (compared with control).
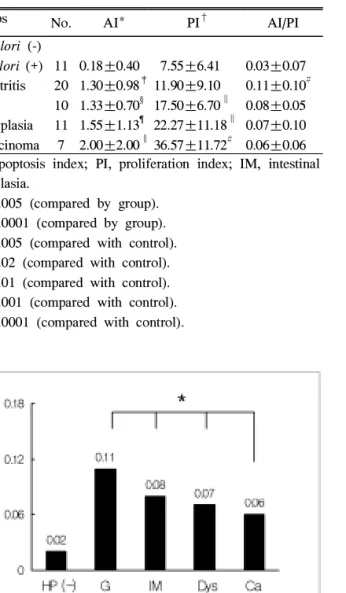
Fig. 2. Ratio of apoptosis to proliferation (AI/PI) in gastric mucosal lesions. AI/PI ratio was significantly increased in H.
pylori-positive chronic gastritis cases and then gradually reduced according to the progress from intestinal metaplasia to dysplasia, then to cancer.
HP, H. pylori; G, gastritis; IM, intestinal metaplasia; Dys, dysplasia; Ca, carcinoma.
* Regression coefficient=-0.02, p=0.02 (by univariate regression).
양성 세포 및 Ki-67 양성 세포가 더 빈번히 관찰되었다(Fig.
1). 만성 위염군에서 음성군에 비해 아포토시스(AI, 1.30±
0.98 vs. 0.18±0.40, p<0.005)가 증가되었으며, 장상피화생, 이형성, 위암군으로 진행하면서 지속적으로 유의하게 증가 하였다(p<0.005). 세포증식은 만성 위염군에서는 음성군과 유의한 차이가 없었으나(PI, 11.90±9.10 vs. 7.55±6.41, p=0.08), 장상피화생, 이형성, 위암군으로 진행하면서 전반 적으로 유의하게 증가하였다(p<0.0001, Table 2). 그러나 아
Table 3. Apoptosis and Proliferation Indices in Chronic Gastritis Patients
Severity of
gastritis No. AI* PI† AI/PI‡ H. pylori (-) 11 0.18±0.40 7.55±6.41 0.03±0.07 H. pylori (+) gastritis
Mild 7 0.71±0.76 9.28±4.38 0.08±0.08 Moderate 11 1.55±1.04 12.36±7.26 0.14±0.11 Severe 2 2.0 ±0.0 18.50±2.12 0.11±0.01 AI, apoptosis index; PI, proliferation index.
* p<0.0001 (compared by severity).
† p<0.05 (compared by severity).
‡ p=0.01 (compared by severity).
포토시스와 세포증식의 상대적 증가를 나타내는 AI/PI는 만성 위염군에서는 음성군에 비해 유의하게 증가하였으나 장상피화생, 이형성, 위암으로 진행할수록 오히려 점차 감 소하는 양상(회귀계수=-0.02, p=0.02)을 보여 상대적으로 과도한 세포증식을 나타냈다(Table 2, Fig. 2).
2) 위염 정도에 따른 AI, PI 및 AI/PI
H. pylori 양성 만성 위염군을 위염 정도에 따라 경한 위 염, 중등도 위염, 심한 위염 3군으로 나누어 각각의 AI, PI, AI/PI를 조사하였다. H. pylori 음성군과 비교할 때 염증이 심할수록 이에 비례하여 AI와 PI 모두 증가하였으나 AI/PI 는 경한 위염에서 중등도 위염까지 증가하다가 심한 위염 에서는 감소하였다. 그러나 전반적으로는 염증이 심해짐에 따라 AI/PI도 증가하였다(회귀계수=0.05, p=0.01, Table 3).
2. p53, Bcl-2, Bcl-XL, Bax 단백질의 발현
p53은 H. pylori 음성군 및 H. pylori 양성 만성 위염, 장 상피화생군에서는 거의 발현되지 않았으며 이형성군 (18.2%)과 위암군(28.6%)에서 주로 발현되었다. 만성 위염 군(70%)과 장상피화생군(80%)에서 대조군(36.4%)에 비해 Bax 발현이 유의하게 증가되었으며, 발현 강도도 증가되었 다(p<0.05). 반면 위암군에서는 전혀 Bax가 발현되지 않았 다. Bcl-2는 위암군에서 42.9% 발현되었으나 다른 군과의 차이는 없었다. Bcl-XL은 모든 군에서 발현되었으나 각 군 간에 뚜렷한 발현 양상의 차이는 없었다(Fig. 3, Table 4).
고 찰
최근 아포토시스의 감소 및 아포토시스-세포증식의 불균 형이 종양 발생과 관계 있다는 것이 밝혀지면서10,24,25 아포 15
대한소화기학회지: 제42권 제1호, 2003
Fig. 3. Microscopic findings of the gastric mucosa. Cytoplasmic immunostaining of (A) Bcl-2, (B) Bax, (C) Bcl-XL in chronic gastritis, and (D) nuclear p53 staining in adenocarcinoma are shown (×100).
토시스와 암 발생과의 연관성에 대해 관심이 집중되고 있다.
본 연구에서 H. pylori 음성 대조군에 비해 H. pylori 양 성인 만성 위염, 장상피화생, 이형성, 위암군 등 위암화과정 의 각 단계에서 아포토시스가 증가되어 있었다. 또한 병변 이 진행함에 따라 지속적으로 증가하는 양상을 보였다. 이 에 비례해서 세포증식도 점차 증가하였는데 이는 아포토 시스에 의한 세포소실을 보상하기 위한 보상성 반응 (compensatory response)으로 생각하고 있다.13 이러한 결과
는 H. pylori 양성인 만성 위염군 및 만성 위염+장상피화 생군에서 H. pylori 음성군에 비해 아포토시스와 세포증식 이 증가하며 이러한 증가가 위염의 정도에 비례한다는 최 근의 연구20와 일치한다. 그러나 같은 연구에서 장상피화생 부위(foci of intestinal metaplasia)만을 따로 구별하여 관찰 하였을 때 세포증식은 지속적으로 증가하는 반면, 아포토 시스는 정상 점막 수준으로 현저히 감소하였다. 즉, 장상피 화생 단계에서 세포증식은 계속 증가하는 반면, 아포토시 스는 급격히 감소하여 아포토시스-세포증식의 불균형이 일 어났으며, 이러한 변화가 세포 수의 증가를 초래하고 돌연 변이 세포의 축적을 가능케 함으로써 위암 발생을 촉진할 것이라고 하였다.20 또한 세포 역동학의 변화에 Bcl-2와 같 은 단백질들이 관여할 것이라고 추정하였다.20본 연구에서 는 장상피화생 부위만을 따로 구분하여 아포토시스 혹은 세포증식을 조사하지는 않았으며, DNA 손상이 점차 증가 하며 축적되리라고 생각되는 진행된 병변(이형성, 위암)에 서 아포토시스가 증가함을 관찰할 수 있었다. 그러나 아포 토시스와 세포증식의 상대적 증가를 나타내는 AI/PI 비는 만성 위염군에서 점차 증가하다가 장상피화생군에서부터 감소하기 시작하여 이형성, 위암군으로 갈수록 유의하게 감소하였다. 이는 H. pylori 감염 초기엔 아포토시스가 우세 하게 증가하나 병변이 진행할수록 상대적으로 세포증식이 더 과도하게 나타나 세포 수의 증가 및 DNA 손상이 축적 될 수 있음을 시사한다. 즉 전암병변(precancerous lesion)에 서 아포토시스의 감소(억제)를 관찰할 수는 없었으나 세포 Table 4. Expression of Apoptosis-Related Proteins in Gastric Mucosal Lesions
Groups No.
Bcl-2 Bcl-XL Bax p53
Number of positivity (%) Immunointensity H. pylori (-) 11 4 (36.4)
0.37±0.50
2 (18.2) 0.27±0.65
4 (36.4) 0.46±0.70
0 (0) 0
H. pylori (+)
Gastritis 20 5 (26.3) 0.26±0.45
7 (38.9) 0.39±0.50
14 (70.0)*
0.7±0.47
2 (10.0) 0.10±0.31
IM 10 5 (55.6)
0.56±0.53
2 (22.2) 0.22±0.44
8 (80.0)*
0.8±0.42
0 (0) 0 Dysplasia 11 3 (27.3)
0.27±0.47
2 (20.2) 0.20±0.42
7 (63.6) 0.64±0.50
2 (18.2) 0.36±0.81 Carcinoma 7 3 (42.9)
0.43±0.53
1 (14.3) 0.14±0.38
0 (0) 0
3 (28.6)*
0.43±0.79 IM, intestinal metaplasia.
* p<0.05 (compared with control).
16
A B
C D
이강문 외 9명. Helicobacter pylori 감염이 위점막 세포 역동학에 미치는 영향
증식에 비해 아포토시스의 상대적 감소가 있었고 이는 아 포토시스-세포증식의 불균형이 위암 발생과 연관된다는 가 설에 부합하는 것이다.
이러한 세포 역동학의 변환점이 언제인지는 논란이 있 다. H. pylori 제균치료 후 위염 부위의 과증식은 정상화되 는 반면 장상피화생 부위의 과증식은 지속되었다는 보고26 는 장상피화생 단계에서 아포토시스-세포증식에 의한 정상 적인 세포 수 조절 기능이 상실됨을 시사하나, H. pylori가 이형성 단계에서 아포토시스를 억제한다는 보고21도 있다.
한편 본 연구에서는 H. pylori 음성군과 H. pylori 양성인 각 단계의 질병군 사이를 비교하였으나 위암 발생 과정에 서 아포토시스 및 세포증식의 변화가 실제로 H. pylori 감 염에 의한 것인가를 증명하기 위해서는 각 질병군 내에서 H. pylori 양성군와 음성군 사이를 비교하는 것이 타당할 것으로 생각된다. 최근 H. pylori 양성군에서 H. pylori 음성 군에 비해 각 단계에서의 변화가 더욱 현저히 나타난다는 보고가 있으며,21추후 이에 대한 보다 많은 연구가 필요할 것으로 생각된다.
H. pylori가 위점막의 아포토시스를 일으키는 기전은 아직 확실치 않다. H. pylori 자체의 세균 요소(bacterial factor) 및 H. pylori에 의해 유발된 위점막의 염증반응이 아 포토시스에 관여할 것이라고 추측되고 있다. 위염의 정도 와 아포토시스가 비례하지 않는다는 보고들13,27은 세균 요 소 자체가 아포토시스에 관여함을 시사해 주는 반면, H.
pylori 감염에 의한 위점막의 염증시에 생산되는 질소산화 물이나 염증 매개물질(TNF-α, INF-γ)이 위점막의 아포토 시스를 일으킨다고 보고들7,28,29과 위염 정도와 아포토시스 가 비례한다는 여러 보고들도 있다.19,20,29 본 연구에서는 만 성위염군에서 위염의 정도에 비례하여 아포토시스가 증가 하여 세균 요소뿐만 아니라 H. pylori 감염에 의한 위점막 의 염증반응이 아포토시스에 관여함을 시사하였다.
H. pylori에 의한 아포토시스와 세포증식과의 관계에 대 해서 논란이 있다. 일부 보고16,17에서는 cagA 음성 균주 감 염시 H. pylori 음성군에 비해 아포토시스는 증가하나 세포 증식은 변화가 없었던 반면, cagA 양성 균주 감염시엔 아포 토시스의 증가 없이 세포증식을 초래하여 아포토시스와 세 포증식이 비례하지 않는다고 하였다. 그러나 사람 위암세 포주(HM02)와 H. pylori를 함께 배양하면 아포토시스에 의 한 세포 수 감소에 대한 보상으로 DNA 합성이 증가한다는 보고가 있고,30 BALB/C 생쥐에 cagA 양성 균주를 접종한 뒤 4, 6, 12, 18, 24주에 관찰한 결과 위점막 아포토시스는 접종 6주 후부터 나타난 반면, 세포증식은 12주째에야 나타 나기 시작하여 H. pylori 감염시 관찰되는 세포증식은 아포 토시스 증가에 따른 보상성 반응이라는 연구도 있다.31
한편 이러한 위암화과정에 따른 세포 역동학의 변화에
많은 암유전자와 종양억제유전자의 산물들(단백질)이 관여 하는 것으로 알려져 있다. 특히 아포토시스에 관여하는 단 백질들 중 p53, Bax, Bak, Bcl-XS, c-Myc 등은 아포토시스 를 촉진하는 기능을 하며, Bcl-2, Bcl-XL, Mcl-1 등은 아포 토시스를 억제하는 기능을 한다.32
p53은 종양억제유전자이며 변이로 인해 이의 기능이 상 실되면 DNA의 손상이 축적되고 종양 발생의 위험이 증가
한다.33,34 위암의 약 60%에서 p53 발현을 보이며,35-37 이형
성은 물론 장상피화생에서도 이미 p53 변이가 나타남이 보 고되었다.36,37 이로써 p53 유전자 변이는 장상피화생, 이형 성 등 위암의 전암병변이 위암으로 진행하는 데 중요한 역 할을 할 것으로 생각된다.38본 연구에서도 H. pylori 양성인 이형성군(18.2%) 및 위암군(28.6%)에서 발현율이 높았다.
정상 점막이나 만성 위축성 위염에 비해 이형성 및 위암 에서 Bcl-2의 발현이 더 높다는 보고들39,40은 Bcl-2가 위암 화과정의 진행에 관여함을 시사한다. 그러나 정상 점막은 물론 위암에서도 Bcl-2가 전혀 발현되지 않아 Bcl-2가 위암 의 발생과 관계없을 것이라는 보고가 있고,36 정상점막 및 만성 위염군에서 Bcl-2가 100% 발현되었으나, 진행 위암에 서는 발현되지 않았다는 연구 결과41도 있어 차이를 보인 다. 본 연구에서 위암군의 42.9%에서 Bcl-2가 발현되었으 나 대조군 및 다른 군과 유의한 차이는 없었다.
Bcl-XL에 관한 보고는 적으며 위선종의 55-95.7%, 조기 위암의 63-100%, 진행 위암의 50-63.3%에서 발현하는 것으 로 보고되었다.42,43 본 연구에서는 특징적인 발현 양상을 관 찰할 수 없었다.
H. pylori 양성 십이지장궤양 환자에서 음성 대조군에 비 해 위점막의 Bax mRNA 및 단백질의 발현이 현저히 증가 하며, 제균치료 후 의미 있게 감소하였다는 보고가 있다.18 반면 같은 보고에서 Bcl-2의 발현은 음성 대조군에 비해 현 저히 감소하였다. 즉, H. pylori는 Bax의 발현을 증가시키고 Bcl-2의 발현을 억제함으로써 위점막의 아포토시스를 유발 하는 것으로 생각된다. 본 연구에서도 유사하게 Bax는 H.
pylori 양성 만성 위염군 및 장상피화생군에서 음성군에 비 해 유의하게 증가하였다. 이는 이번 연구에서 함께 관찰한 아포토시스 및 세포증식의 증가 양상과 일치하여 H. pylori 에 의한 초기 위점막 세포 역동학의 변화에 Bax의 발현 증 가가 관여함을 시사한다.
결론적으로 H. pylori 감염은 위점막의 아포토시스 및 세 포증식을 증가시키며, 위암화과정이 진행할수록 상대적으 로 더 과도한 세포증식을 유발하여 아포토시스-세포증식 간의 불균형을 초래함으로써 위암 발생에 관여할 것으로 생각된다. p53 변이는 이형성, 위암 등에서 높은 발현을 보 이며, Bax는 H. pylori 감염 초기 아포토시스의 급격한 증 가에 관여하는 것으로 보인다. 이와 같은 결과는 H. pylori 17
The Korean Journal of Gastroenterology: Vol. 42, No. 1, 2003
감염에 의한 위점막 세포 역동학의 변화에 대한 중요한 정 보를 주며 위암화과정을 이해하는 데 도움이 될 것이다.
요 약
목적: H. pylori는 위암의 명확한 발암인자로 인정되었으 나 그 정확한 기전은 아직 밝혀지지 않았다. 저자들은 위암 화과정 각 단계에 있어 H. pylori 감염으로 인한 위점막 세 포 역동학의 변화 및 아포토시스 관련 단백질의 발현을 조 사하였다. 대상 및 방법: 건강검진 혹은 소화불량증으로 내 시경검사를 받은 59명을 H. pylori 음성군 11명, H. pylori 양성인 만성 위염군 20명, 만성 위염+장상피화생군 10명, 이형성군 11명, 위암군 7명으로 나누었다. 만성 위염군은 updated Sydney system에 따라 경한 위염, 중등도 위염, 심 한 위염 세 군으로 분류하였다. 내시경 생검 혹은 절제 표 본을 이용하여, 아포토시스는 TUNEL 방법으로, 세포증식 은 Ki-67에 대한 면역조직화학염색법으로 검사하였다. 아 포토시스 지수(AI) 및 세포증식 지수(PI)로 그 정도를 나타 냈으며, 상대적인 증식 정도를 알아보기 위해 AI/PI를 구하 였다. 아포토시스 및 세포증식에 작용하는 것으로 알려진 p53, Bcl-2, Bcl-XL, Bax 단백질의 발현 정도는 면역조직화 학염색법으로 알아보았고 각 군에서의 양성도(%) 및 발현 강도(0, 1, 2)를 알아보았다. 결과: H. pylori 음성군에 비해 양성군에서 아포토시스 및 세포증식이 증가되었으며, 만성 위염, 장상피화생, 이형성, 위암군으로 진행하면서 지속적 으로 증가하였다(AI, p<0.005, PI, p<0.0001). 그러나 아포 토시스와 세포증식의 상대적 증가를 나타내는 AI/PI는 H.
pylori 양성인 만성 위염군에서 음성군에 비해 높았으나 장 상피화생, 이형성, 위암으로 진행하면서 오히려 점차 감소 하였다. 만성 위염군에서 AI와 PI는 염증이 심할수록 이에 비례하여 증가하였으나, AI/PI는 경한 위염에서 중등도 위 염까지 증가하다가 심한 위염에서는 감소하였다. p53은 이 형성군(18.2%) 및 위암군(28.6%)에서 주로 발현되었다.
Bax의 발현은 H. pylori 음성군(36.7%)에 비해 만성 위염군 (70%) 및 만성 위염+장상피화생군(80%)에서 유의하게 증 가되었으며, 그 발현 강도도 증가되었다(p<0.05). 결론: H.
pylori 감염은 위점막의 아포토시스 및 세포증식을 증가시 키며, 위암화과정이 진행할수록 상대적으로 과도한 세포증 식을 유발하여 아포토시스-세포증식 간의 불균형을 초래함 으로써 위암 발생에 관여할 것으로 생각된다.
색인단어: Helicobacter pylori, 아포토시스, 세포증식, p53, Bax
REFERENCES
1. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration.
Lancet 1984;1:1311-1315.
2. Hentschel E, Brandstatter G, Dragosics B, et al. Effect of ranitidine and amoxicillin plus metronidazole on the eradication of Helicobacter pylori and the recurrence of duodenal ulcer. N Engl J Med 1993;328:308-312.
3. Parsonnet J, Friedman GD, Vandersteen DP, et al. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991;325:1127-1131.
4. Nomura A, Stemmermann GN, Chyou PH, Kato I, Perez-Perez GI, Blaser MJ. Helicobacter pylori infection and gastric carcinoma among Japanese Americans in Hawaii. N Engl J Med 1991;325:1132-1136.
5. The Eurogast Study Group. An international association between Helicobacter pylori infection and gastric cancer.
Lancet 1993;341:1359-1362.
6. World Health Organization. IARC monographs on the evaluation of carcinogenetic risks to humans. Vol 61, p. 177, Lyon, 1994.
7. Ernst P. Review article: the role of inflammation in the pathogenesis of gastric cancer. Aliment Pharmacol Ther 1999;13(suppl 1):13S-18S.
8. Asaka M, Takeda H, Sugiyama T, Kato M. What role does Helicobacter pylori play in gastric cancer? Gastroenterology 1997;113:S56-60.
9. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics.
Br J Cancer 1972;26:239-257.
10. Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science 1995;267:1456-1462.
11. Watson AJM. Necrosis and apoptosis in the gastrointestinal tract. Gut 1995;37:165-167.
12. Que FG, Gores GJ. Cell death by apoptosis : basic concepts and disease relevance for the gastroenterologist. Gastroen- terology 1996;110:1238-1243.
13. Moss SF, Calam J, Agarwal B, Wang S, Holt PR. Induction of gastric epithelial apoptosis by Helicobacter pylori. Gut 1996;38:498-501.
14. Chung SS, Park HJ, Chung BC, et al. Relation of apoptosis and cell proliferation in Helicobacter pylori infection. Korean J Gastroenterol 1998;32:427-434.
15. Bhang CS, Choi MG, Kim JI, et al. Effect of Helicobacter pylori infection on apoptosis, Bcl-2 and cell proliferation.
Korean J Gastroenterol 1999;34:10-20.
16. Peek RM Jr, Moss SF, Tham KT, et al. Helicobacter pylori cagA+ strains and dissociation of gastric epithelial cell proliferation from apoptosis. J Natl Cancer Inst 1997;89: 863-868.
18
Lee KM, et al. Helicobacter pylori and Gastric Epithelial Cell Kinetics
17. Rokkas T, Ladas S, Liatsos C, et al. Relationship of Helicobacter pylori CagA status to gastric cell proliferation and apoptosis. Dig Dis Sci 1999;44:487-493.
18. Konturek PC, Pierzchalski P, Konturek SJ, et al. Helicobacter pylori induces apoptosis in gastric mucosa through an upregulation of Bax expression in humans. Scand J Gastroenterol 1999;34:375-383.
19. Jang TJ, Kim JR. Proliferation and apoptosis in gastric antral epithelial cells of patients infected with Helicobacter pylori. J Gastroenterol 2000;35:265-271.
20. Scotiniotis IA, Rokkas T, Furth EE, Rigas B, Shiff SJ.
Altered gastric epithelial cell kinetics in Helicobacter pylori-associated intestinal metaplasia: implication for gastric carcinogenesis. Int J Cancer 2000;85:192-200.
21. Zhang Z, Yuan Y, Gao H, Dong M, Wang L, Gong YH.
Apoptosis, proliferation and p53 gene expression of H. pylori associated gastric epithelial lesions. World J Gastroenterol 2001;7:779-782.
22. Correa P. Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol 1995;19(suppl 1):S37-S43.
23. Dixon MF, Genta RM, Yardley JH, Correa P, and the Participants in the International Workshop on the Histopathology of Gastritis. Classification and grading of gastritis: the updated Sydney system. Am J Surg Pathol 1996;20:1161- 1181.
24. Bursch W, Oberhammer F, Schulte-Hermann R. Cell death by apoptosis and its protective role against disease. Trends Pharmacol Sci 1992;13:245-251.
25. Hoffmann B, Liebermann DA. Molecular controls of apoptosis:
differentiation/growth arrest primary response genes, proto-oncogenes, and tumor suppressor genes as positive
& negative modulators. Oncogene 1994;9:1807-1812.
26. Ierardi E, Francavilla A, Balzano T, et al. Effect of Helicobacter pylori eradication on gastric epithelial proliferation. Relationship with ras oncogene p21 expression.
Ital J Gastroenterol Hepatol 1997;29:214-219.
27. Jones NL, Shannon PT, Cutz E, Yeger H, Sherman PM.
Increase in proliferation and apoptosis of gastric epithelial cells early in the natural history of Helicobacter pylori infection. Am J Pathol 1997;151:1695-1703.
28. Mannick EE, Bravo LE, Zarama G, et al. Inducible nitric oxide synthase, nitrotyrosine, and apoptosis in Helicobacter pylori gastritis: effect of antibiotics and antioxidants. Cancer Res 1996;56:3238-3243.
29. Hahm KB, Lee KJ, Choi SY, et al. Possibility of chemoprevention by the eradication of Helicobacter pylori:
oxidative DNA damage and apoptosis in H. pylori infection.
Am J Gastroenterol 1997;92:1853-1857.
30. Wagner S, Beil W, Westermann J, et al. Regulation of gastric epithelial cell growth by Helicobacter pylori: evidence for a major role of apoptosis. Gastroenterology 1997;113:1836- 1847.
31. Yamaguchi T, Nakajima N, Kuwayama H, Ito Y, Iwasaki A, Arakawa Y. Gastric epithelial cell proliferation and apoptosis in Helicobacter pylori-infected mice. Aliment Pharmacol Ther 2000;14(suppl 1):S68-S73.
32. Staunton MJ, Gaffney EF. Apoptosis. Basic concepts and potential significance in human cancer. Arch Pathol Lab Med 1998;122:310-319.
33. Fritsche M, Haessler C, Brandner G. Induction of nuclear accumulation of the tumor-suppressor protein p53 by DNA-damaging agents. Oncogene 1993;8:307-318.
34. Donehower LA. Effects of p53 mutation on tumor progression: recent insights from mouse tumor models.
Biochem Biophys Acta 1996;1242:171-176.
35. Hurlimann J, Saraga EP. Expression of p53 protein in gastric carcinomas. Am J Surg Pathol 1994;18:1247-1253.
36. Wang JIE, Chi DS, Kalin GB, et al. Helicobacter pylori infection and oncogene expressions in gastric carcinoma and its precursor lesions. Dig Dis Sci 2002;47:107-113.
37. Shiao YH, Rugge M, Correa P, Lehmann HP, Scheer WD.
p53 alteration in gastric precancerous lesions. Am J Pathol 1994;144:511-517.
38. Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol 2001;96:16-26.
39. Lauwers GY, Scott GV, Hendricks J. Immunohistochemical evidence of aberrant bcl-2 protein expression in gastric epithelial dysplasia. Cancer 1994;73:2900-2904.
40. Gao HJ, Yu LZ, Bai JF, et al. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions: H. pylori infection, histological types and staging. World J Gastroenterol 2000;6:848-854.
41. Nardone G, Staibano S, Rocco A, et al. Effect of Helicobacter pylori infection and its eradication on cell proliferation, DNA status, and oncogene expression in patients with chronic gastritis. Gut 1999;44:789-799.
42. Kondo S, Shinomura Y, Kanayama S, et al. Over-expression of Bcl-xL gene in human gastric adenoma and carcinomas.
Int J Cancer 1996;68:727-730.
43. Lee DS, Lee KM, Ahn BM, et al. Bcl-xL protein expression in gastric adenoma and adenocarcinoma. Korean J Gastroenterol 2000;36:745-751.
19