黃連解毒湯이 Collagenase에 의한 흰쥐의 뇌출혈 및 뇌부종에 미치는 영향
구자승*, 이준석*, 신정원*, 김성준*, 손낙원*
*경희대학교 동서의학대학원 한의과학전공
Original Article
Effects of Hwangnyeonhaedok-tang on Cerebral Hemorrhage and Edema in Collagenase Induced-ICH Rats
Ja-Seung Ku, O.M.D.*, Joon-Suk Lee, O.M.D.*, Jung-Won Shin, Ph.D.*, Seong-Joon Kim, O.M.D.*, Nak-Won Sohn, O.M.D.*
*Div. of Oriental Medical Science, Graduate School of East-West Medical Science, Kyung Hee University Objectives: Brain edema is brain swelling that occurs due to the accumulation of excess water in the brain parenchyma. AQP4 and AQP9 are water-channel proteins expressed strongly in the brain and control water fluxes into and out of the brain parenchyma. This study was conducted to evaluate effect of Hwangnyeonhaedok-tang on brain edema and intracerebral hemorrhage.
Methods: Intracerebral hemorrhage was induced by intrastriatal injection of type IV collagenase(0.23 U/μl, 0.1 μ l/min) into Sprague-Dawley rat brains. Hwangnyeonhaedok-tang water extract(1,000 mg/kg) was administered orally three times every 20 hours from 4 hours after ICH operation. Then hematoma volume, brain edema percentage, and water content of brain tissue were measured. Immuno-histochemistry was performed for AQP4 and AQP9 expressions in the brain sections and area % of immuno-labeling was analyzed with image analyzing system.
Results:
1. Water extract of Hwangnyeonhaedok-tang reduced hematoma volume of ICH induced rat.
2. Water extract of Hwangnyeonhaedok-tang reduced MPO positive neutrophils in the perihematoma of the ICH induced rat.
3. Water extract of Hwangnyeonhaedok-tang reduced brain edema percentage and water content of brain tissue of ICH induced rat.
4. Water extract of Hwangnyeonhaedok-tang reduced AQP4 immuno-positive cells in the perihematoma of the ICH induced rat.
5. Water extract of Hwangnyeonhaedok-tang reduced AQP9 immuno-positive cells in the perihematoma of the ICH induced rat.
Conclusions: These results suggest that Hwangnyeonhaedok-tang decreases intracerebral hemorrhage and brain edema by means of downregulating AQP4 and AQP9 expressions in the brain.
Key Words : Intracerebral hemorrhage, Hwangnyeonhaedok-tang, brain edema, MPO positive neutrophil, AQP4, AQP9.
⋅Received:31 August 2011 ⋅Revised:19 September 2011 ⋅Accepted:19 September 2011
⋅Correspondence to:손낙원(Nak-Won Sohn)
경기도 용인시 기흥구 서천동 1번지 경희대학교 전자정보관 444호
Tel:+82-31-201-2747, Fax:+82-31-204-6832, E-mail:sohnnw@khu.ac.kr
서 론
뇌부종은 뇌실질 내에 과도한 수분이 축적되어
발생하며
1), 뇌의 용적을 증가시킴으로써 뇌압상승의
이차적 악화요인이 된다
2). 뇌부종은 수분이 유입되
는 경로에 따라 세포독성 부종 (cytotoxic edema)과
재료와 방법
혈관성 부종(vasogenic edema)으로 나누어진다
3). 뇌
출혈이 발생되면 혈종이 형성되며, 혈종에 의한 직 접적인 압박이나 누출된 혈액내의 혈관수축 물질에 의해 주변부위 혈류공급에 장애를 일으켜서 세포 허 혈을 초래하여 초기에는 세포독성 부종이 나타나고 이후에는 혈관성 부종이 나타난다
4). 혈관성 부종은 혈액뇌장벽(blood-brain barrier, BBB)의 손상으로 혈장 성분이 유출되어 발생하고, 세포독성 부종은 세포의 기능부전으로 인해 다량의 수분이 세포 내부 로 유입되어 세포 하나하나가 부풀어서 총 부피가 증가하는 것으로 혈액뇌장벽의 손상과 관계없이 발 생할 수 있다
4,5). 이러한 세포부종의 발생 기전에 관 여하는 가장 중요한 인자 중 하나가 세포막의 water channel인 aquaporins (AQPs)이다
6). AQPs는 뇌부종 을 형성하는 각종 질병 상태에서 뇌조직의 미세혈관 과 뇌실질 사이에서 수분이동을 조절하고
7), 특히 혈 관 내피세포와 함께 BBB를 형성하는 성상아교세포 의 종말반(astrocytic end-feet)에서 강하게 발현하여 중추신경계의 수분평형에 관여하는 것으로 알려져 있다
8).
黃連解毒湯은 葛洪의《肘後備急方》에 처음 제시 된 처방으로 黃芩, 黃蓮, 黃柏, 梔子로 구성되어 있 다
9). 황련해독탕은 瀉火解毒의 효능이 있어, 일체의 實熱火毒이 三焦에 가득차서 나타나는 大熱煩燥 口 燥咽乾 言語錯亂 不眠 등 증상과, 혹은 熱病으로 인 한 吐血, 衄血 및 심한 熱로 인한 發斑 또는 身熱下 痢 濕熱黃疸 癰疽疔毒 등 질환을 치료한다
10). 약리 작용으로는 혈압강하작용
11), 항산화작용
12), 혈관이
완작용
11,13)과 항염증효과
14)등이 보고된 바 있다.
특히 黃芩과 黃連은 뇌출혈 시 혈액뇌장벽 손상을 억제하고 뇌부종을 억제하는 효과가 알려져 있다
15,16). 이들을 주 재료로 하는 황련해독탕이 뇌출혈에 의한 뇌부종을 억제하는 효과가 있을 것으로 생각되나 이 에 대한 연구보고는 없었다.
그러므로 본 연구에서는 황련해독탕 물추출물이 뇌출혈에 의한 뇌부종에 미치는 영향과, 뇌부종에 관여하는 주요인자인 AQPs 발현에 대한 작용을 관 찰하고자 하였다. 흰쥐의 선조체 내에 콜라겐분해효
소 (collagenase)를 주입하는 방법으로 뇌출혈을 유 발하였고, 황련해독탕 물추출물을 경구투여한 후 뇌 출혈 크기와 이에 따른 호중성백혈구의 침윤, 뇌부 종 비율과 뇌조직 수분함량 등에 대한 영향을 관찰 하였으며, 뇌부종 발생에 관여하는 인자인 AQP4와 AQP9 발현의 변화를 관찰한바 유의한 결과를 얻었 기에 이에 보고하는 바이다.
1.
실험동물실험동물은 샘타코(Samtako, Korea)에서 구입한 11주령, 약 300 g 전후의 Sprague-Dawley계 수컷 흰 쥐를 사용하였다. 흰쥐는 온도(21-23℃), 습도 (40-60%), 조명 (12시간 명/암)이 자동적으로 유지되 는 사육실에서 무균음수와 사료를 자유롭게 공급하 며 사육되었고, 실험실 환경에 1주 이상 적응시킨 후 사용하였다. 또한 실험동물의 수술과 관리 및 처 치는 경희대학교 국제캠퍼스 동물실험윤리위원회의 승인(승인번호 KHUASP-10-008)과 지침에 따라 이 루어졌다.
2.
약물의 제조 및 투여본 실험에 사용한 한약물은 황련해독탕 Hwang- nyeonhaedok-tang(HuanglianJiedu-tang, HHT)으로 (주)허브메디에서 구입한 황련(Coptidis rhizoma), 황금(Scutellariae radix), 황백(Phellodendri cortex), 치자(Gardeniae fructus) 각 5 g으로 구성하였으며, 총 200 g의 약재에 3,000 ml의 물을 가하여 90분간 전탕하고, 여과액을 rotary evaporator로 감압 농축한 후 동결건조 하였다. 추출물 30.5 g을 얻어 수율은 15.3% 이었으며, 1,000 mg/kg을 실험동물의 1회 투 여량으로 하여 뇌출혈 유발 4시간 후부터 약 20시간 간격으로 3회 경구투여하였다.
3.
실험군의 구분뇌출혈에 대한 황련해독탕의 효능을 관찰하기 위
해 실험군은 다음과 같이 구분하였다. 마취와 두정 부의 피부절개 및 두개골 천공 후 선조체에 needle 을 삽입하였으나 collagenase를 주입하지 않은 정상 대조군 (Sham)과 이러한 사전준비에 이어 선조체에 collagenase를 주입하여 뇌출혈을 유발시킨 대조군 (ICH)으로 나누었다. 특히 대조군은 뇌출혈 유발 후 24, 48 및 72 시간째에 희생하여 뇌출혈의 크기를 측정한 군은 각각 ICH24, ICH48 및 ICH72로 표시 하였다. 또한 대조군과 같이 뇌출혈을 유발한 다음 48시간 동안에 황련해독탕 물추출물을 3회 경구투 여한 군은 황련해독탕투여군 (ICH48+HHT)으로 하 였다. 실험동물은 총 60마리를 사용하였다.
4.
뇌출혈의 유발뇌출혈의 유발은 Rosenberg 등의 방법
17)에 따랐 으며, 수술과정은 electronic temperature controller (CMA150, CMA, Sweden)를 통하여 정상체온(37±
0.5℃)이 유지되는 상태에서 2% isoflurane을 포함한 70%
N2O와 30% O
2gas의 흡입마취를 사용하였고, 필요한 경우 추가적으로 pentobarbital sodium(50 mg/kg)을 복강주사 하였다. 수술과정을 간단히 서술 하면 다음과 같다.
마취된 흰쥐의 머리를 뇌정위고정장치(Stoelting, USA)에 고정한 다음 두정부의 정중선을 따라 피부 를 절개하고 두개골이 드러나게 하였다. 두개골의 bregma로부터 전방으로 0.2 mm, 우측으로 3.5 mm 위치에 전기드릴을 사용하여 약 1 mm 직경으로 두개 골을 천공하고, 뇌정위고정장치에 장착된 Hamilton 주사기(26-gauge, 10 μl, Hamilton, USA)를 뇌경막 (dura mater)으로부터 5.5 mm 깊이로 선조체에 삽 입하였다. 선조체의 정위는 Paxonis와 Watson의 rat brain atlas
18)를 참고하였다. 이어서 0.23 U의 bacterial collagenase type IV(C1889, Sigma-Aldrich, USA) 용액 1 μl를 Hamilton 주사기에 연결된 micropump (Model 310, Kd Scientific Inc, USA)를 작동하여 0.1 μl/min의 속도로 주입하였다. Collagenase 용액 의 주입이 끝난 후에도 약 10분간 Hamilton 주사기 를 유지하여 collagenase 용액의 역류를 방지하였으
며, 이후 Hamilton 주사기를 제거하고 두개골의 구 멍은 bone wax로 메운 다음 절개한 두정부의 피부 를 봉합하고 마취에서 깨어나게 하였다.
5.
뇌출혈 체적 및 뇌부종 비율의 측정뇌출혈 유발 24, 48 및 72시간 후에 실험동물을 과용량의 pentobarbital sodium 복강주사로 희생시킨 후 즉시 단두하고 뇌를 적출한 다음 흰쥐용 brain matrix (ASI Instruments, USA)를 사용하여 1 mm 두께의 뇌 절편을, collagenase 주입 위치를 기준으 로 하여 전후로 총 6장의 절편을 만들었다. 염색 없 이 즉시 뇌 절편을 digital camera로 촬영한 다음 ImageJ software(ver. 1.41, NIH)를 사용하여 각 뇌 절편 영상으로부터 정상측 대뇌반구(intact hemis- phere)와 출혈측 대뇌반구(hemorrhagic hemisphere) 및 뇌출혈 부위의 면적을 측정하고, 각각의 면적에 뇌 절편의 6장의 두께를 곱하여 체적을 계산하였다.
그러므로 실험결과 자료로 제시된 대뇌반구의 체적 은 좌우 대뇌반구의 총체적이 아니라 collagenase 주 입 위치를 기준한 6장 뇌 절편의 대뇌반구 체적이 다. 뇌부종 비율은 뇌출혈 유발 48시간 후에 정상측 대뇌반구 체적에 대한 출혈측 대뇌반구 체적의 증가 비율로 계산하였다.
6.
뇌조직 수분함량의 측정뇌출혈 유발 48시간 후 실험동물을 과용량의 pen- tobarbital sodium 복강주사로 희생시킨 후 즉시 단 두하고 뇌를 적출한 다음 소뇌와 뇌간을 제거하고 뇌를 정상측과 출혈측 대뇌반구로 이등분 하였다.
각 대뇌반구의 무게를 chemical balance(Mettler,
AM100, Switzerland)로 측정한 다음 120℃의 dry
oven(Daeil Engineering, DMC121, Korea)에서 48시
간동안 건조한 후 다시 무게를 측정하였다. 수분함
량은 각 대뇌반구의 건조 전후 무게 차이를 비율로
계산하여 자료로 사용하였다.
7.
뇌조직의 처리각 실험동물을 pentobarbital sodium의 복강주사 로 깊게 마취한 다음 개흉하고 심장을 통하여 0.05 M phosphate buffered saline (PBS)과 4% para- formaldehyde로 충분히 관류하였다. 이후 뇌를 적출 한 다음 24시간 정도 post-fixation하고, sucrose 용 액에 담가 침전시켰다. 다음 뇌를 -40℃의 dry ice- isopentane 용액으로 동결시키고 조직절편을 제작할 때까지는 -80℃에 보관하였다. 뇌조직은 cryocut으 로 20 μm 두께의 관상절편으로 제작하여 염색에 사용하였다.
8.
면역조직화학염색뇌조직을 0.05 M PBS로 5분간 3회 씻어내고, 1% H
2O
2에서 10분간 반응시킨 다음 다시 3회 씻어 낸 뒤 10% normal horse serum(Vectastain, USA)과 bovine serum albumin(Sigma-Aldrich, USA)를 PBS 에 섞은 blocking solution에 한 시간 정도 반응시켰 다. 이후 3회 씻어 낸 후 1차항체를 처리하였다.
Aquaporin(AQP) 발현 관찰을 위해서 anti-AQP4(1:
500, SC-20812, SantaCruz, USA) 및 anti-AQP9 (1:
500, AQP91-A, ADI, USA)를 사용하였으며, PBS와 Triton X-100을 섞은 용액으로 희석한 후 4℃에서 반응시켰다. 다음 biotinylated anti-rabbit secondary antibody (1:200, Vector Laboratories, USA)에 실온 에서 1시간동안 반응시키고, 조직을 PBS로 씻어낸 후 avidin-biotin immuno-peroxidase의 방법에 따라 각각 1시간씩 반응시켰다. 다음 0.05% 3,3'-diamino- benzidine tetrachloride (DAB, Sigma-Aldrich, USA) 에서 2분간 발색 반응시키고, 수세한 다음 탈수, 봉 입하여 조직표본을 제작하였다.
9. AQP4
와GFAP
및lectin
의 이중면역형광염색 및 관찰면역형광염색을 위한 조직처리 및 기본적인 염색 과정은 위의 기술과 동일하며, 호중성백혈구침윤 관 찰을 위해 호중성백혈구 표식자인 myeloperoxi-
dase (MPO)에 대해서 1차항체는 anti-MPO (1:250, A-0398, DAKO, USA)를, 2차항체는 Cy5-conjugated goat anti-rabbit(1:200, ab6564, Abcam, UK)를 사용 하였다. 또한 AQP4와 GFAP 및 lectin의 이중 면역 형광염색에서 1차항체는 anti-rabbit AQP4(1:200, SC- 20812, SantaCruz, USA)와 anti-mouse GFAP (1:100, G3893, Sigma-Aldrich, USA) 및 FITC-conjugated tomato lectin(1:100, L0401, Sigma-Aldrich, USA)를 사용하였다. 2차항체는 AQP4에 대하여 Cy5-conju- gated goat anti-rabbit(1:200, ab6564, abcam, UK)를, GFAP에 대하여는 FITC-conjugated goat anti-mouse (1:100, ab6785, abcam, UK)을 사용하였다. 형광염 색된 뇌조직은 confocal laser-scanning microscopy (LSM510 META, CarlZeiss, Germany)를 사용하여 관찰하였다.
10.
양성반응 세포의 관찰면역형광염색된 MPO 발현은 confocal laser- scanning microscopy(LSM510 META, CarlZeiss, Germany)를 사용하여, 면역조직화학법으로 염색된 AQP4 및 AQP9 발현은 CCD카메라 (DP70, Olympus, Japan)가 장착된 광학현미경(BX51, Olympus, Japan) 을 사용하여 관찰하였다. 각각의 발현 정도는 양성 반응 세포 수를 측정하여 비교하였다. 양성반응 세 포 수 측정을 위해서 각각의 영상을 영상분석시스템 에 저장하고, ImageJ software(ver. 1.41, NIH, USA) 를 사용하여 뇌출혈 주변부에서 양성반응 세포 수를 측정한 다음 일정면적(10
5μm
2)으로 보정하여 자료 로 사용하였다.
11.
통계처리측정된 자료는 ICH48군과 ICH48+HHT군 사이,
또는 Sham군, ICH48군 및 ICH48+HHT군 사이에서
일원분산분석 (one-way ANOVA)을 통해 P<0.05의
유의수준으로 검정하였다.
결 과
1.
뇌출혈에 대한 영향황련해독탕이 뇌출혈에 미치는 영향을 ICH를 유 발한 흰쥐에 48시간 동안 황련해독탕을 투여하여 뇌출혈 크기의 변화와 뇌출혈 주변조직의 호중성백 혈구 침윤의 변화를 통해 관찰하였다.
1) 뇌출혈 크기의 변화
흰쥐의 선조체 내에 뇌출혈을 유발한 다음 24, 48 및 72시간째에 뇌출혈 크기를 측정한 결과 ICH24군 은 30.9±3.2mm
3, ICH48군은 38.1±5.9mm
3, ICH72 군은 22.5±3.6mm
3로 뇌출혈의 크기가 48시간 후에 가장 크게 형성되었다가 72시간에는 감소하기 시작 하였다. 이에 비하여 ICH48+HHT군은 30.4± 4.8mm
3로 ICH48군에 비해 P<0.05의 유의성 있는 뇌출혈 크기의 감소를 나타내었다(Fig. 1, Fig. 2).
ICH24 ICH48 ICH72 ICH48+HHT 50
45 40 35 30 25 20 15 10 5 0 Hematoma Volume(mm 3)
Fig. 1. Effect of Hwangnyeonhaedok-tang(HHT) on the hematoma volume of ICH-induced rats.
HHT significantly reduced the hematoma volume compared with ICH48 group (*, P<0.05; n=6; Mean and Standard deviation).
ICH48 ICH48+HHT
Fig. 2. Representative brain slices of ICH-induced rats.
Red colored regions on slices indicate the area of hematoma induced by collagenase injection.
Hwangnyeonhaedok-tang (HHT) treated rat (ICH48+HHT) showed a reduction in hematoma volume compared with ICH48 group.
2) 호중성백혈구 침윤의 변화
뇌출혈 유발 48시간 후에 뇌출혈 주변조직에서 MPO의 형광염색에 양성반응을 보이는 호중성백혈 구의 침윤을 관찰한 바 Sham군에서는 관찰되지 않 았으며, ICH48군은 103.8±22.6 개가 관찰되었고, 이 에 비하여 ICH48+HHT군은 63.2±20.7 개가 관찰되 어 P<0.01의 유의성 있는 호중성백혈구 침윤의 감 소를 나타내었다(Fig. 3, Fig. 4).
2.
뇌부종에 대한 영향황련해독탕이 뇌부종에 미치는 영향은 뇌부종 비 율의 변화와 뇌조직 수분함량의 변화를 통해 관찰하 였다.
1) 뇌부종 비율의 변화
뇌출혈 흰쥐에 황련해독탕을 투여한 후 정상측 대뇌반구에 대한 출혈측 대뇌반구의 면적 증가율을 계산하여 뇌부종 비율을 측정한 결과, Sham군은 102.4±1.4% 이었으며, ICH48군은 118.7±3.8%로 증 가하였다. ICH48+HHT군은 112.1±4.6% 증가하여 ICH48군에 비해 P<0.05의 유의성 있는 뇌부종 비율 의 감소를 나타내었다(Fig. 5).
2) 뇌조직 수분함량의 변화
뇌출혈 흰쥐에 황련해독탕을 투여한 후 출혈측 대뇌반구의 무게와 건조 무게의 차이로 수분함량을 측정한 결과, Sham군은 78.32±1.07% 이었으며,
ICH48 ICH48+HHT
140
120
100
80
60
40
20
0
Fig. 3. Effect of Hwangnyeonhaedok-tang(HHT) on MPO positive cells in peri-hematoma of ICH-induced rats.
HHT significantly reduced the MPO positive cells compared with ICH48 group (†, P<0.01; n=6; Mean and Standard deviation).
Fig. 4. Representative sections of MPO positive cells in peri-hematoma of ICH-induced rats.
Arrows indicate MPO positive cells. Hwangnyeonhaedok-tang treated ICH48+HHT group showed a decrease of the MPO positive cells compared with ICH48 group.
Sham ICH48 ICH48+HHT 125
120
115
110
105
100
Edema Percent(%)
Fig. 5. Effect of Hwangnyeonhaedok-tang(HHT) on brain edema percentage of ICH-induced rats.
HHT significantly reduced the edema percentage of hemorrhagic hemisphere compared with ICH48 group (*, P<0.05; n=6;
Mean and Standard deviation).
ICH48군은 80.65±1.12%로 증가하였다. ICH48+HHT 군은 78.93±1.36%로 ICH48군에 비해 P<0.05의 유 의성 있는 뇌조직 수분함량의 감소를 나타내었다 (Fig. 6).
3. Aquaporin
발현에 대한 영향황련해독탕이 뇌부종 유발 관련인자인 aquaporin
(AQP) 발현에 미치는 영향은 뇌출혈 주변조직에서 발현되는 AQP4 및 AQP9의 변화를 통해 관찰하였다.
1) AQP4 발현의 변화
뇌조직내출혈이 유발된 대뇌반구의 뇌출혈 주변 부에서 AQP4 발현을 면역조직화학염색을 통하여 관찰한 결과 Sham군은 양성반응을 관찰할 수 없었
Sham ICH48 ICH48+HHT
83
82
81
80
79
78 77
76
75
Water Contents(%)
Fig. 6. Effect of Hwangnyeonhaedok-tang(HHT) on water contents of hemorrhagic hemisphere in ICH-induced rats.
HHT significantly reduced the brain tissue water contents of hemorrhagic hemisphere compared with ICH48 group (*, P<0.05; n=6;
Mean and Standard deviation).
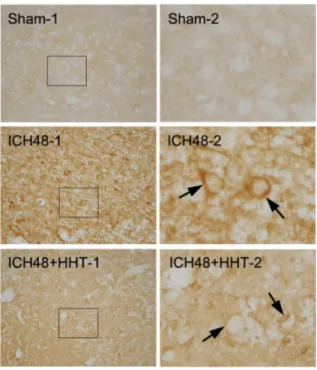
다(Fig. 7, Sham-1, 2). ICH48군은 뇌출혈 주변부에 서 강한 AQP4 양성반응을 나타내는 세포들이 많이 관찰되었다(Fig. 7, ICH48-1, 2, arrows). 이에 비하 여 ICH48+HHT군은 뇌출혈 주변부에서 AQP4 양성 반응의 세포들이 관찰되었으나 발현의 강도와 양성 반응 세포 수가 ICH48군에 비하여 현저히 감소되었 다(Fig. 7, ICH48+HHT-1, 2, arrows). 면역조직화학 염색의 DAB 양성반응에서 AQP4가 발현된 세포들 이 신경세포인지 신경아교세포인지 또는 혈관세포 인지 명확히 구분할 수 없었으므로, AQP4가 주로 발현되는 것으로 보고된 성상아교세포의 표지인 GFAP와 AQP4를 이중 면역형광염색을 실시하여 관 찰하였다. 그 결과 GFAP가 발현된 성상아교세포 (Fig. 8, red)와 AQP4 발현(Fig. 8, green)이 뇌조직 의 혈관(Fig. 8, white asterisk) 주위에서 일치하는 것으로 관찰되어 AQP4가 성상아교세포에서 발현되 는 것이 확인되었다.
2) AQP9 발현의 변화
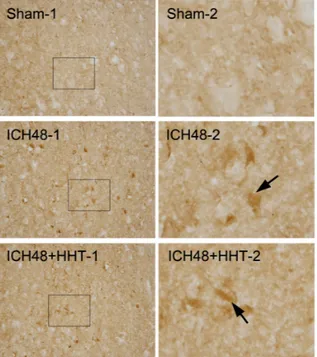
뇌출혈이 유발된 대뇌반구의 뇌출혈 주변부에서 AQP9 발현을 면역조직화학염색을 통하여 관찰한 결과 Sham군은 양성반응을 관찰할 수 없었다(Fig.
9, Sham-1, 2). ICH48군은 뇌출혈 주변부에서 강한 AQP9 양성반응을 나타내는 세포들이 많이 관찰되 었다(Fig. 9, ICH48-1, 2, arrows). 이에 비하여 ICH 48+HHT군은 뇌출혈 주변부에서 AQP9 양성반응의 세포들이 관찰되었으며, 발현의 강도는 비슷하나 양 성반응 세포 수가 ICH48군에 비하여 감소되었다(Fig.
9, ICH48+HHT-1, 2, arrows).
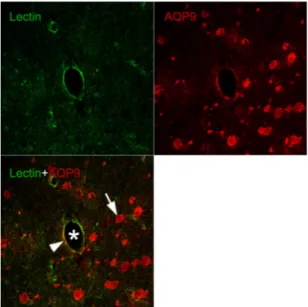
AQP9 발현세포의 특성을 관찰하기 위해서 AQP9가 주로 발현되는 것으로 보고된 혈관내피세 포의 표지인 lectin과 AQP9를 이중 면역형광염색을 실시하여 관찰하였다. 그 결과 lectin에 표지된 혈관 내피세포(Fig. 10, green)와 AQP9 발현(Fig. 10, red) 이 뇌조직 혈관 (Fig. 10, white asterisk)의 내피
Fig. 7. Representative sections of AQP4 positive cells in peri-hematoma of ICH-induced rats.
Arrows indicate AQP4 positive cells. Hwangnyeonhaedok-tang treated ICH48+HHT group showed a decrease of the density and number of AQP4 positive cells compared with ICH48 group.
Fig. 8. Representative double-immunofluorescence sections of AQP4 and GFAP positive cells in peri-hematoma of ICH-induced rats.
AQP4 immuno-labeled cells (green) were coincided with GFAP immuno-labeled astrocytes (red) around the vessel (asterisk).
Fig. 9. Representative sections of AQP9 positive cells in peri-hematoma of ICH-induced rats.
Arrows indicate AQP9 positive cells. Hwangnyeonhaedok-tang treated ICH48+HHT group showed a decrease of the number, not on the density, of AQP9 positive cells compared with ICH48 group.
고 찰
세포에서 발현이 일치하는 것을 관찰할 수 있었으며 (Fig. 10, white arrowhead), 또한 혈관 주위의 뇌조 직 세포들에서도 AQP9가 발현되는 것이 확인되었 다(Fig. 10, white arrow).
황련해독탕은 葛洪의《肘後備急方》에 처음 제시 된 처방으로 황금, 황련, 황백, 치자로 구성되어 있 다
9). 주요 구성 약재인 황금은 호중성백혈구의 침윤 과, metrix metalloproteinase(MMP)의 발현을 감소 시키고 성상아교세포 활성화를 조절하여 혈액뇌장 벽 손상을 줄여서 뇌출혈과 뇌부종을 억제하고
15), 황련은 호중성백혈구의 침윤과 inducible nitric oxide synthase(iNOS) 및 tumor necrosis factor-α (TNF-α)의 발현을 감소시켜서 항염증작용을 하여 뇌부종을 억제하는 효과가 있음이 보고되어 있다
16). 이렇게 황련해독탕과 그 구성 약재들에 대한 다양하 게 연구가 이루어져 왔으나 뇌출혈과 뇌부종에 대한
효과에 대해서는 아직 보고된 바가 없었다. 그러므 로 본 연구에서는 황련해독탕 물추출물이 뇌출혈에 의한 뇌부종에 미치는 영향을 살펴보고, 뇌부종 형 성에 관여하는 것으로 알려진 AQPs 발현에 미치는 작용을 관찰하고자 하였다.
이 실험에서는 흰쥐의 두개골 천공을 통해 선조 체에 collagenase를 주입하여 뇌출혈과 뇌부종을 유 발시켰다. 혈관의 기저막이 type IV collagen으로 구 성되어 있으므로 collagenase를 주입하면 기저막이 파괴되어 출혈이 일어난다
17). Collagenase를 주입한 다음 뇌출혈 크기가 언제 가장 명확하게 최고에 달 하는가를 관찰하기 위해서 24, 48 및 72시간째에 뇌 출혈 크기를 관찰하였으며, 그 결과 뇌출혈 유발 후 48시간째에 뇌출혈이 가장 크게 형성되는 것으로 나타났다. 따라서 본 실험에서는 황련해독탕을 투여 한 다음 뇌출혈 유발 후 48시간째에 그 효능을 관찰 하였다. 뇌출혈을 유발시킨 후 황련해독탕 물추출물 을 경구투여한 다음 뇌출혈 크기를 측정하였고, 그 결과 ICH48+HHT군은 ICH48군에 비하여 유의하게
Fig. 10. Representative double-immunofluorescence sections of AQP9 and lectin positive cells in peri-hematoma of ICH-induced rats.
AQP9 immuno-labeled cells (red) were coincided with lectin immuno-labeled endotherial cells (green) on the vessel wall (white arrowhead). And numerous AQP9 immuno-labeled cells (white arrow) are distributed separately around the vessel (asterisk).
뇌출혈 크기를 감소시키는 것으로 확인되었다(Fig.
1, Fig. 2). 이는 황련해독탕이 뇌조직출혈 손상에 대하여 유의한 효과가 있음을 보여준다.
뇌출혈에는 호중성백혈구의 침윤이 동반되는데, 호중성백혈구는 백혈구 중 가장 수가 많으며, 세균 살해과정과 탐식작용을 통해 초기 면역반응에 중요 한 역할을 한다. 그러나 과도한 호중성백혈구의 활 성은 급만성 염증반응 모두에서 reactive oxygen species와 protease 같은 세포독성 산물을 분비하므 로, 이것이 혈액뇌장벽을 손상시키고 조직손상을 악 화시키는 요인으로 작용한다
19,20). 따라서 일차적으 로 호중성백혈구의 침윤을 억제하거나 침윤된 호중 성백혈구를 빠르게 제거하는 것이 염증반응을 완화 시키는 방법이다
21). 호중성백혈구의 1차과립에는 MPO가 존재하는데, 이 MPO가 살균성 reactive oxidant인 hypochlorous acid와 hypochlorite를 생산 하여 염증반응을 지속시키고 확장시킨다
22). 그러므 로 MPO는 염증질환의 진단지표와 함께 호중성백혈 구의 면역염색 표식자로도 활용되고 있다
23). 본 실 험에서 호중성백혈구 침윤을 관찰한 결과, ICH48+
HHT군에서는 ICH48군에 비하여 뇌출혈 주변부에 침윤된 호중성백혈구의 수가 유의하게 감소된 것으 로 나타났다 (Fig. 3, Fig. 4). 이러한 결과는 황련해 독탕이 뇌조직의 염증반응을 억제하는 작용이 있음 을 보여준다.
뇌부종은 뇌의 외상, 종양, 감염, 대사성질환 및 뇌졸중의 발생 및 진행과정에 중요한 역할을 담당하 며, 심한 경우 사망의 원인이 되기도 한다
1). 뇌부종 은 뇌 실질 내에 과도한 수분의 축적으로 인해 발생 하는데, 수분이 유입되는 경로에 따라 세포독성 부 종과 혈관성 부종으로 구분되며
1), 세포독성 부종과 혈관성 부종은 대부분 두 형태가 복합되어 나타난 다. 세포독성 부종은 혈액뇌장벽의 손상과 상관없이 세포 내부로 다량의 수분이 유입되어 발생된다. 혈 액공급이 줄어들면 ATP가 고갈되고, Na
+-K
+AT- Pase 활성이 저하되어 세포내의 Na
+, Cl
-농도와 삼 투압이 증가되면 세포내로 수분이 유입되어 부종이 생긴다
24). 이때 세포막에 위치하는 water channel인
aquaporin이 중요한 역할을 한다
25). 이러한 세포독 성 부종과 달리 혈관성 부종은 혈액뇌장벽의 기능적 이상 혹은 구조적인 손상으로 인해 혈관의 혈장 성 분들이 뇌실질 내로 유입되어 일어나는 것이며, 뇌 수종, 외상, 뇌졸중 등의 뇌질환에서 흔히 나타난다
3,25)
.
본 실험에서는 황련해독탕이 뇌부종에 미치는 영 향을 관찰하기 위해 뇌부종 비율의 변화와 뇌조직 수분함량의 변화를 측정하였다. 뇌부종의 비율적 변 화를 보기 위해 뇌출혈 흰쥐에 황련해독탕 물추출물 을 투여한 후 정상측 대뇌반구에 대한 출혈측 대뇌 반구의 면적 증가율을 계산하였으며, 그 결과 ICH48+HHT군은 ICH48군에 비해 유의성 있는 뇌 부종 비율의 감소를 나타내었다(Fig. 5). 수분함량의 변화는 뇌출혈 흰쥐에 황련해독탕 물추출물을 투여 한 후 출혈측 대뇌반구의 무게와 건조 무게의 차이 로 수분함량을 측정하여 확인하였으며, ICH+HHT군 은 ICH군에 비해 유의성 있는 뇌조직 수분함량의 감소를 나타내었다(Fig. 6). 이러한 결과를 통해 황 련해독탕이 뇌부종을 억제하는 효과가 있음을 알 수 있다.
AQP는 세포막을 통한 Na
+, K
+, Cl
+및 glutamate 등의 이동에 수반되는 수분 이동을 담당한다
26,27). AQP은 AQP1이 적혈구막에서 처음 발견된 후
28)현 재까지 11개의 AQP family가 밝혀져 있고, 각 아형 에 따라 AQP0에서 AQP10으로 명명되었다
26,29). 중 추신경계에는 지금까지 AQP1, AQP3, AQP4, AQP5, AQP8, AQP9이 분포하는 것으로 알려져 있 으며 주로 AQP1, AQP4, AQP9이 중추신경계에서 중요한 역할을 담당하고 있다
8,30).
AQP1은 주로 맥락얼기 상피세포에서 발현되므 로 맥락얼기에서의 주된 수분 수송 단백질로 생각된
다
31,32). AQP4는 뇌의 다양한 부위에서 발현되는데,
특히 중간뇌수도관(cerebral aqueduct) 주위와 지주 막하강과 연접한 뇌의 표면에서 많이 발현된다.
AQP4는 특히 혈관과 맞닿아있는 성상아교세포의
종말반(astrocytic end-feet)에서 강하게 발현되므로
혈관과 뇌세포 사이의 수분이동에 중요한 역할을 한
결 론
다고 할 수 있다
7,33). 정상적인 상태에서는 AQP4의 발현을 감소시키면 뇌부종이 발생하지만, 뇌부종 상 태에서 AQP4의 발현을 감소시키면 뇌부종이 감소 된다
34). 이러한 결과는 AQP4가 뇌부종의 발생과 제 거에 중요한 작용을 한다는 것을 보여준다. AQP9은 시상하부 내측바닥의 띠뇌실막세포(tanycyte)와 뇌 실 주변의 뇌실막세포(ependymal cell)에서 발현된 다. 뇌실 주변, 표면아교경계막(glia limitans)과 지주 막하공간의 성상아교세포에서도 발현된다. 그 외에 뇌들보(corpus callosum), 앞맞교차(anterior com- missure), 시신경교차(optic chiasma), 해마(hippo- campus) 등에서도 발현된다. 이러한 분포는 AQP4 와 비슷하기 때문에 AQP9도 혈장삼투압과 수분평 형 조절에 역할을 할 것으로 생각된다
30,35).
본 연구에서는 황련해독탕이 AQP4와 AQP9의 발현에 미치는 영향을 면역조직화학염색을 통해 관 찰하였다. 그 결과 뇌조직내출혈이 유발된 대뇌반구 의 뇌출혈 주변부에서 강한 AQP4 양성반응을 나타 내는 세포들이 많이 관찰된 것에 비해 ICH48+HHT 군에서는 AQP4 양성반응 세포들의 발현 강도와 세 포 수가 ICH48군에 비하여 현저히 감소되었다. 또 한 ICH48+HHT군에서는 ICH군에 비해 AQP9 발현 세포 수도 감소되었다. 이는 황련해독탕이 AQP4와 AQP9 발현을 감소시켜서 뇌부종을 억제하는 결과 를 얻을 수 있었다.
본 연구에서는 황련해독탕이 뇌출혈에 의한 뇌부 종과 뇌부종 형성에 중요한 역할을 하는 aquaporin 발현에 미치는 영향을 관찰하였다. 이를 위해 흰쥐 의 선조체에 collagenase를 주입하여 뇌출혈에 의한 뇌부종을 유발하였으며, 황련해독탕 물추출물을 경구 투여한 후 뇌출혈 부위의 크기와 호중성백혈구 침윤 의 변화, 뇌부종의 비율, 뇌조직 수분함량 등에 대한 영향을 관찰하였으며, 뇌부종 발생에 관여하는 주요 인자인 AQP4와 AQP9 발현의 변화를 면역조직화학 염색을 통해 관찰하여 다음과 같은 결과를 얻었다.
1. 황련해독탕 물추출물은 뇌출혈 체적을 유의하 게 감소시켰다.
2. 황련해독탕 물추출물은 뇌출혈로 인한 호중성 백혈구의 침윤을 유의하게 감소시켰다.
3. 황련해독탕 물추출물은 뇌출혈로 인한 뇌부종 비율을 유의하게 감소시켰다.
4. 황련해독탕 물추출물은 뇌출혈로 인하여 증가 된 뇌조직 수분함량을 유의하게 감소시켰다.
5. 황련해독탕 물추출물은 뇌출혈 주변부에서 AQP4 양성반응 세포수를 유의하게 감소시켰 다.
6. 황련해독탕 물추출물은 뇌출혈 주변부에서 AQP9 양성반응 세포수를 유의하게 감소시켰 다.
이상의 결과로 보아, 황련해독탕은 뇌출혈 체적을 줄이고 AQP4와 AQP9의 발현을 감소시켜서 뇌부종 을 억제하는 것으로 생각된다.
참고문헌