Received: November 8, 2015 / Accepted: November 24, 2015
Address for correspondence: Nam-Hee Kim, MD, PhD
Department of Neurology, Dongguk University Ilsan Hospital, 27 Dongguk-ro, Ilsandong-gu, Goyang 10326, Korea Tel: +82-31-961-7200, Fax: +82-31-961-7212, E-mail: nheekim8@hanmail.net
자가면역 신경근육질환의 면역치료
동국대학교 의과대학 일산병원 신경과
김 남 희
Immunotherapy for Autoimmune Neuromuscular Diseases
Nam-Hee Kim, MD, PhD
Department of Neurology, Ilsan Hospital, Dongguk University College of Medicine, Goyang, Korea
KEYWORDS Immunotherapy, Autoimmune nervous
system disease, Neuromuscular diseases
Rational targets for autoimmune neuromuscular disease have been identified with the progress of our understanding of the cellular and molecular process underlying autoimmune neuromuscular disease. Although antigen-specific immunotherapy is not available, effective immunotherapy for most autoimmune disorders is provided with old and new immunomodulatory treatments, alone or in combination. The achievements of more specific yet largely experimental therapeutic tools need to be tested in the human diseases. Here we review the principles and targets of immunotherapy for autoimmune neuromuscular disorders, applications, and practical guidelines, and give an outlook on future developments.
서 론
자가면역 신경근육질환의 병인들은 매우 다양하다. 지 난 수십 년간 자가면역성질환의 분자세포적 기전에 대한 연구의 큰 발전으로 원인인자들에 대한 특이적인 면역치 료의 가능성이 열렸으나, 현재도 전통적인 면역억제제들 이 치료에 있어 주축으로서 적용되고 있다. 동시에 T세포 의 활성화와 증식 , 그리고 항원인식의 과정을 효과적으로 억제하는 새로운 면역억제제들의 개발에 따라 치료제 선 택의 범위와 유효성이 점차로 넓어지고 있다. 본고에서는 자가면역 신경근육질환에 대한 면역치료의 원칙, 치료대 상인 원인인자들, 현재 약물 적용의 상황, 추천되는 약물 치료의 가이드라인, 면역치료의 전망에 대해 알아보고자 한다.
본 론
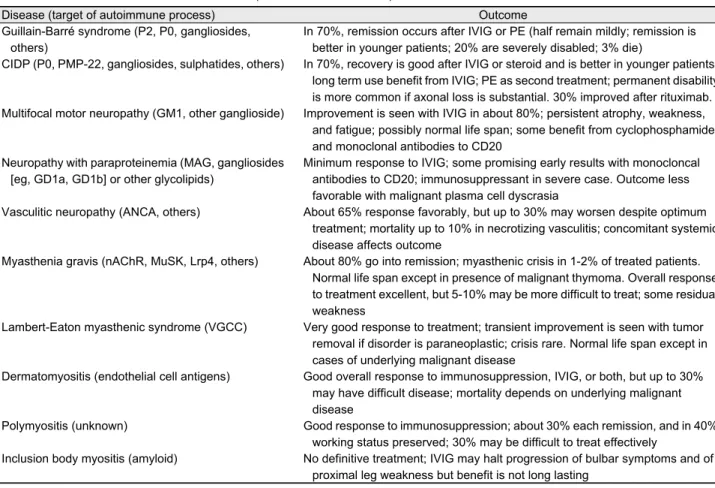
현재의 주요한 자가면역질환에 대한 면역치료약물과 그 치료 결과들에 대해 간략히 Table 1에 정리하였다.
1. 자가면역성질환의 기전: 면역관용(immune tolerance)의 파괴
자가 반응하는 T세포와 B세포가 면역계에 존재하며,
주로 면역 감시(surveillance)의 근간을 이루며 정상적으로
는 면역관용의 상태로 존재한다. 자가면역질환의 핵심은
이러한 '면역관용'의 파괴이다. 내인성 단백질과 항원결정
기가 비슷한 감염체가 존재하거나, 전신적인 감염성 질환
또는 생백신과 같은 예방접종에 의해 심각한 면역 자극이
Table 1. Outcomes of neuromuscular disorders (revised from reference 1)
Disease (target of autoimmune process) Outcome
Guillain-Barré syndrome (P2, P0, gangliosides, others)
In 70%, remission occurs after IVIG or PE (half remain mildly; remission is better in younger patients; 20% are severely disabled; 3% die)
CIDP (P0, PMP-22, gangliosides, sulphatides, others) In 70%, recovery is good after IVIG or steroid and is better in younger patients;
long term use benefit from IVIG; PE as second treatment; permanent disability is more common if axonal loss is substantial. 30% improved after rituximab.
Multifocal motor neuropathy (GM1, other ganglioside) Improvement is seen with IVIG in about 80%; persistent atrophy, weakness, and fatigue; possibly normal life span; some benefit from cyclophosphamide and monoclonal antibodies to CD20
Neuropathy with paraproteinemia (MAG, gangliosides [eg, GD1a, GD1b] or other glycolipids)
Minimum response to IVIG; some promising early results with monocloncal antibodies to CD20; immunosuppressant in severe case. Outcome less favorable with malignant plasma cell dyscrasia
Vasculitic neuropathy (ANCA, others) About 65% response favorably, but up to 30% may worsen despite optimum treatment; mortality up to 10% in necrotizing vasculitis; concomitant systemic disease affects outcome
Myasthenia gravis (nAChR, MuSK, Lrp4, others) About 80% go into remission; myasthenic crisis in 1-2% of treated patients.
Normal life span except in presence of malignant thymoma. Overall response to treatment excellent, but 5-10% may be more difficult to treat; some residual weakness
Lambert-Eaton myasthenic syndrome (VGCC) Very good response to treatment; transient improvement is seen with tumor removal if disorder is paraneoplastic; crisis rare. Normal life span except in cases of underlying malignant disease
Dermatomyositis (endothelial cell antigens) Good overall response to immunosuppression, IVIG, or both, but up to 30%
may have difficult disease; mortality depends on underlying malignant disease
Polymyositis (unknown) Good response to immunosuppression; about 30% each remission, and in 40%
working status preserved; 30% may be difficult to treat effectively
Inclusion body myositis (amyloid) No definitive treatment; IVIG may halt progression of bulbar symptoms and of proximal leg weakness but benefit is not long lasting
IVIG, intravenous immunoglobulin; PE, plasma exchange; CIDP, chronic inflammatory demyelinating polyradiculoneuropathy; CD, cluster of differentiation; MAG, myelin-associated glycoprotein; ANCA, anti-neurtophil cytoplasmic antibody; nAChR, nicotinic acetylcholine receptor; MuSK, muscle specific kinase; Lrp4, low-density lipoprotein receptor-related protein 4; VGCC, voltage-gated calcium channel.
유도되면 면역 관용이 파괴될 수 있다 .
1,270%의 환자에서 감 염과 연관되어 발병한다고 알려진 길랑바레증후군 (Guillain- Barré syndrome, GBS)이 대표적인 면역관용이 파괴된 예 이며, 만성염증성수초탈락여러신경병(chronic inflammatory demyelinating polyradiculoneuropathy, CIDP)이나, 중증근 무력증(Myasthenia gravis, MG)의 경우에도 면역 관용의 파괴가 재발을 유도한다 . 악성종양과 말초신경 또는 운동 종판의 항원 사이에 항원결정기의 분자적 유사성(molecular mimicry)이 있는데, 부수종양성 CIDP나 램버트이튼근무 력증후군(Lambert-Eaton myasthenic syndrome, LEMS) 또 는 흉선종을 동반한 MG의 발생과 관련된다.
3-5감염에서 회복하거나 또는 신생물딸림증후군의 종양에 관련된 항 원이 제거되어도 자가공격적인 상태가 반드시 사라지는 것은 아닌데, 이를 통해 최초 원인인자가 아닌 침범된 해 당 장기의 항원결정기에 대해서 만성적 면역반응이 유지 되고 있으며, 이에 따라 자가면역 질환이 진행됨을 알 수 있다.
동물모델은 면역매개 손상의 주요한 기전을 이해하는 데 매우 중요하다. MG 환자의 니코틴 아세틸콜린 수용체 (nicotinic acetylcholine receptor, nAChR)에 대한 항체를 주입한 마우스는 인간의 MG와 같은 전기생리학적인 상 태와 조직상태를 보인다.
6nAChR은 MG의 결정적인 자 가항원이며,
7이 항체는 신경연접 후 부위에 손상을 일으 킨다 .
6LEMS의 경우 환자의 전위매개칼슘통로(voltage- gated calcium channel, VGCC) 수용체에 대한 항체를 주 면, 신경연접 전의 신경전달과정에 문제를 일으키는데, 아직까지 적극적 면역반응을 통해 유도된 동물모델은 없 다.
8실험적인 자가면역신경염은 다른 종의 동물에게 수초
단백질을 이용한 면역반응을 유도시켜 만들어질 수 있으
며, T세포와 B세포가 매개한 면역반응의 특성을 나타낸
다. 면역활성화가 일어나면, T세포가 말초신경을 침범하
여 신경내부로 이동하고 CD8 세포, 자연살해세포 및 항
체 의존성 세포독성 효과에 의해 신경섬유들의 파괴가 발
생되고, 이 과정에 세포독성 염증관련 물질들과 B세포의 활성화에 따른 항체생성과 보체의 공격이 관련된다.
9,10실험적인 자가면역 근염의 경우, 동물모델에서 염증 반응 관련기전은 잘 연구가 되고 있지만, 대부분의 모델에서 뚜렷한 근위약이 나타나지 않는 관계로 동물모델로서 만 족스러운 수준은 아니다.
11이러한 동물모델을 통하여 실험적으로 면역매개공격의 순서를 정확하게 알아내어, 각 단계에 따른 점진적인 치 료방법의 접근을 이끌어낼 수 있다.
2. 자가면역질환의 발병 기전
1) 면역매개 신경병증
다양한 말초신경병들이 포함되며, 가장 흔한 것으로 급 성염증성수초탈락여러신경병증(AIDP)와 만성염증성수초 탈락여러신경병증(CIDP), 다초점운동신경병(multifocal mo- tor neuropathy, MMN)이 있다. AIDP는 말초신경주위에 림프구와 단핵구, 대식세포의 침윤이 특징이다.
12강글리 오시드(gangliosides, GM1, GD1a, GD1b)를 포함하는 수 초당지질에 대해 자가항체들이 발견되며 보체 결합에 의 해 유도되는 항체매개 수초탈락 현상을 신경조직에서 관 찰할 수 있다 .
13,14혈장치환술로 호전되며, 환자 혈청을 실 험동물에 투여 시 말초신경 수초탈락이 유발되는 것으로 보아 일차적으로 항체매개질환으로 생각된다.
14AIDP는 Campylobacter. jejuni, Herpes Simplex Virus, Mycoplasma pneumonia 등의 바이러스나 세균 감염과 관련이 있는데, 이러한 병원체의 항원이 말초신경의 항원과 유사성이 있 어 질병의 발병에 관여할 것으로 추정된다.
14CIDP의 경 우는 AIDP와 병리조직 소견은 비슷하나, 염증세포의 침 윤이 다소 적은 편이며, 신경 생검에서 수초탈락과 축삭 손상이 혼재된 소견이 나타난다.
15항체매개성의 연구결과 는 별로 없으나 혈장치환술로 증상의 호전을 보이며 , T세 포매개성 면역반응과 관련된 증거들이 있으며 이에 대한 연구들이 진행 중이다 .
13,16MMN은 GBS나 CIDP에 비해 발 생이 휠씬 적어 , 아직까지 병인에 대해 연구가 미흡하다.
17정맥면역글로블린(intraveouns immunoglobulin, IVIG)이 증상을 호전시키며,
18강글리오시드 GM1, GD1a GD1b에 대한 항체가 60%에서 관찰된다.
19전도차단이 있는 곳에 축삭 소실이 관찰되며 , 수초의 현저한 변화는 관찰되지 않는다.
202) 중증근무력증(myasthenia gravis, MG)
항아세틸콜린수용체 (nAChR) 항체에 의해 유발되며, 환
자의 혈청을 실험동물에 주사하면 신경근접합부의 전도 차단이 발생된다.
6항체가 신경 증상을 유발하는 기전에 대해서는 아직 논란이 있으며 , IgG 항체가 nAChR에 결 합 후 보체 공격으로 수용체가 손상되고 신경근접합부 차 단이 유발되는 것으로 생각된다.
21,22B세포가 항체를 생 산하지만, 발병에는 자가반응 T세포도 관련된다.
22흉선 제거로 인해 80-90%의 근무력증 환자들이 호전되나, 흉 선의 정확한 역할은 아직 불분명하다 .
23흉선에는 nAChR 을 발현하는 유사근육세포와 상피세포가 존재하며, 과형 성된 흉선의 T세포가 자가면역 반응에 관여하는 것으로 추정되고 있다 .
233) 염증성 근육병증
다발근염(polymyositis, PM), 피부근염(dermatomyositis, DM), 포함체근염(inclusion body myositid, IBM)은 모두 염증매개성 근질환이다.
24PM은 세포면역의 이상에 따라 발생하며, 다른 자가면역질환을 흔히 동반하고, 결체조직 질환, 그리고 바이러스나 세균감염증, 암 등과 연관되어 발생하기도 한다.
25PM은 병리소견에서 근섬유막 부위에 주로 CD8+ T세포의 침윤이 특징이며, 혈관은 대부분 침 범하지 않는다.
26DM은 미세혈관의 손상으로 근육다발 주변부에 관류저하가 발생하고 이어서 해당 부위의 근섬 유에 허혈 변성이 유발된다 .
26미세경색을 유발하는 모세 혈관의 손상은 보체에 매개되어 발생된다 .
26면역조직염 색을 하면 혈관내피에 면역복합체의 침착이 관찰되는데 , 이는 항체매개질환임을 의미한다 .
26DM과 PM은 임상양 상은 유사하나 면역기전은 상당히 다름을 알 수 있다 .
26IBM은 CD8+T세포 매개로 유발되며, 근육조직에서는 특 징적인 테를 두른 공포(rimmed vacuole)가 보인다.
26그리 고 알츠하이머병과 비슷하게 아밀로이드 침착이 근육에 서 나타나는데 , 이 두 질환 간 발병기전에 있어서 유사성 이 있을 가능성이 추정되고 있다 .
263. 근육신경계질환에서의 실질적인 면역치료
자가면역성의 기본적 기전에 대한 현재의 지식과 실제
로 이용되는 치료법들 사이에는 아직까지 큰 간격이 존재
한다 .
1따라서 작용기전에 따른 분류보다는 질환 또는 치
료약제에 따른 내용으로 정리하였다. 다양한 치료약제들
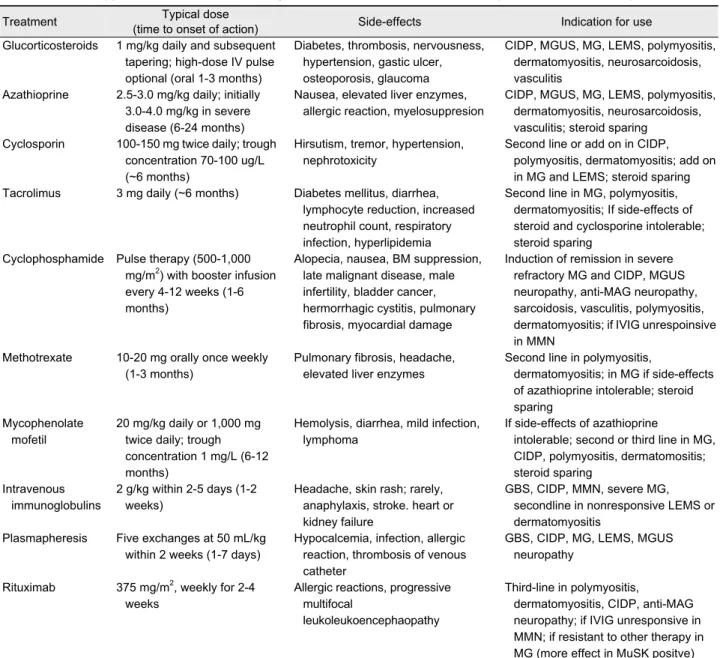
이 Table 2에 정리되어 있으며, 아직까지 일부의 치료에
대해서만 제대로 검증된 연구결과가 있는 상태로, 기존치
료법들의 체계적 치료단계는 아직 명확하지 않다. 치료법
은 이중 맹검, 무작위, 대조군 비교 연구를 통한 근거를
Table 2. Immunosuppressive and immunomodulatory treatments in neuromuscular disorders (revised from reference 1)
Treatment Typical dose
(time to onset of action) Side-effects Indication for use
Glucorticosteroids 1 mg/kg daily and subsequent tapering; high-dose IV pulse optional (oral 1-3 months)
Diabetes, thrombosis, nervousness, hypertension, gastic ulcer, osteoporosis, glaucoma
CIDP, MGUS, MG, LEMS, polymyositis, dermatomyositis, neurosarcoidosis, vasculitis
Azathioprine 2.5-3.0 mg/kg daily; initially 3.0-4.0 mg/kg in severe disease (6-24 months)
Nausea, elevated liver enzymes, allergic reaction, myelosuppresion
CIDP, MGUS, MG, LEMS, polymyositis, dermatomyositis, neurosarcoidosis, vasculitis; steroid sparing
Cyclosporin 100-150 mg twice daily; trough concentration 70-100 ug/L (~6 months)
Hirsutism, tremor, hypertension, nephrotoxicity
Second line or add on in CIDP, polymyositis, dermatomyositis; add on in MG and LEMS; steroid sparing Tacrolimus 3 mg daily (~6 months) Diabetes mellitus, diarrhea,
lymphocyte reduction, increased neutrophil count, respiratory infection, hyperlipidemia
Second line in MG, polymyositis, dermatomyositis; If side-effects of steroid and cyclosporine intolerable;
steroid sparing Cyclophosphamide Pulse therapy (500-1,000
mg/m2) with booster infusion every 4-12 weeks (1-6 months)
Alopecia, nausea, BM suppression, late malignant disease, male infertility, bladder cancer, hermorrhagic cystitis, pulmonary fibrosis, myocardial damage
Induction of remission in severe refractory MG and CIDP, MGUS neuropathy, anti-MAG neuropathy, sarcoidosis, vasculitis, polymyositis, dermatomyositis; if IVIG unrespoinsive in MMN
Methotrexate 10-20 mg orally once weekly (1-3 months)
Pulmonary fibrosis, headache, elevated liver enzymes
Second line in polymyositis,
dermatomyositis; in MG if side-effects of azathioprine intolerable; steroid sparing
Mycophenolate mofetil
20 mg/kg daily or 1,000 mg twice daily; trough concentration 1 mg/L (6-12 months)
Hemolysis, diarrhea, mild infection, lymphoma
If side-effects of azathioprine
intolerable; second or third line in MG, CIDP, polymyositis, dermatomositis;
steroid sparing Intravenous
immunoglobulins
2 g/kg within 2-5 days (1-2 weeks)
Headache, skin rash; rarely, anaphylaxis, stroke. heart or kidney failure
GBS, CIDP, MMN, severe MG, secondline in nonresponsive LEMS or dermatomyositis
Plasmapheresis Five exchanges at 50 mL/kg within 2 weeks (1-7 days)
Hypocalcemia, infection, allergic reaction, thrombosis of venous catheter
GBS, CIDP, MG, LEMS, MGUS neuropathy
Rituximab 375 mg/m2, weekly for 2-4 weeks
Allergic reactions, progressive multifocal
leukoleukoencephaopathy
Third-line in polymyositis,
dermatomyositis, CIDP, anti-MAG neuropathy; if IVIG unresponsive in MMN; if resistant to other therapy in MG (more effect in MuSK positve) IV, intravenous; CIDP, chronic inflammatory polyradiculoneuropathy; MGUS, monoclonal gammopathy of undetermined significance;
MG, myasthenia gravis; LEMS, Lambert-Eaton myasthenic syndrome; BM, bone marrow; MAG, myelin-associated glycoprotein; IVIG, intravenous immunoglobulin; MMN, multifocal motor neuropathy; GBS, Guillain-Barré syndrome; MuSK, muscle specific kinase.
토대로 추천된 치료법이 선호되지만, 대부분의 면역치료 법들에 대해서 특히 이미 과거부터 정립된 치료법의 경우 에서는 코호트나 증례-대조군 연구, 증례보고에 의한 결 과들만 있는 경우가 많다. 심지어는 이러한 연구결과도 없이, 몇몇 약물들이나 시술들은 이미 경험적으로 임상적 유효성이 널리 인정되어 사용되고 있다.
1예를 들어 근무 력증 위기에서의 혈장치환술 또는 일부 신경근육질환에 서의 스테로이드 치료 등이 있다.
1헬싱키선언에 따른 윤 리적인 문제와 연구에 따른 대규모의 비용 소모 등의 측
면에서 기존에 널리 인정되어 있는 치료법에 대해서는 새 로운 대조군연구를 시행하는 것은 거의 불가능하다 . 그러 나 새로운 치료법들의 경우에는 무작위비교연구 등이 시 행되어 검증되고 있다.
11) 급성 질환 또는 재발 시
자가면역 신경근육질환의 진단이 내려지고 근위약이
뚜렷해지면 되도록 빨리, 염증성 공격을 중단시키거나,
차단항체를 제거하는 것을 목적으로 치료가 시작된다.
1치료의 목표는 근력의 회복을 통하여 일상생활이 가능해 지도록 호전시키는 것이다.
1대조군 비교연구가 부족한 관계로 치료법의 판단은 증례 보고들이나 전문가의 의견 등에 따라 이뤄지는 경우가 대부분이다.
1치료법의 선택 은 약물이 그 나라에서 사용 가능하느냐 등에 따라 나라 마다 달라지기도 한다.
1GBS나 MMN을 제외하고는 스테로이드가 주요 치료이 거나, 중요한 치료제 중의 하나이다.
1스테로이드는 경구 요법(경미하거나 중등도의 증례들에서는 환자의 kg 당 1-2 mg의 프레드니솔론 또는 비슷한 제형)으로 투여하는 경우가 많으며, 고농도 단기 정주요법을 시행할 때는 500-1,000 mg의 메틸프레드니솔론을 매일 3-5일에 걸쳐 서 투여한다.
1,27혈청검사나 흉부영상을 통하여 동반된 감염 여부를 반드시 배제하여야 한다.
1스테로이드 고농 도 단기 정주요법 시 비유전자적(non-genomic) 기전에 의 한 세포사멸을 통해 염증의 제거를 촉진한다.
28MG에서 는 스테로이드가 투여 초기 신경학적 증상을 악화시키기 도 하는데, 아마도 면역치료와는 조금 다른 기전을 통한 작용일 것으로 추정된다 .
29,30따라서 일부 전문가들은 매 일 용량을 조금씩 올려 약물을 조절하기도 하며, 임상증 상이 호전된 이후에는 장기적인 면역억제치료 또는 면역 조절치료를 하면서 스테로이드는 점차 감량해 나간다.
1,31MMN의 경우에 있어서는 스테로이드는 효과가 없고, 아 직 밝혀지지 않은 기전에 의해 심지어 일시적으로 증상을 악화시키기도 한다.
32GBS의 경우에도 스테로이드 치료 는 효과가 없으며,
33한 개의 무작위비교연구에 의하면 스 테로이드가 IVIG와 함께 사용된다면 추가적인 항염증효 과가 있다고 하였으나,
34후속 연구를 통한 입증이 필요하 다.
1또한 신생물딸림신경병의 경우에는 면역억제제가 스 테로이드와 함께 사용되나 결과는 그리 만족스럽지 못하 다.
1스테로이드에 의한 치료 효과가 있는 경우에는 스테 로이드 용량을 줄이기 위한 추가적인 면역억제요법이 고 려된다.
16순환하는 인체면역인자가 주로 병인으로서의 역 할을 하는 경우 (예: MG, GBS) 혈장치환술이 유용하다.
22일반적인 방식은 5 × 50 mL/kg의 용량으로 1주일에 2-3회 시행한다.
1혈장치환술의 유효성은 GBS, CIDP에서는 대 조군 연구를 통해 입증되었다.
1,35,36IVIG의 경우 성인과 소아에서 일반적으로 혈장치환술 과 동등한 정도로 효과가 있다고 알려져 있다. 그러나 근 무력증 위기에서는 다소 효용이 떨어질 수도 있다.
37-39IVIG는 2 g/kg을 2-5일 내에 정주하는 것이 일반적으로 사용되는 방식이며, 장기간 유지 시에는 3-6주마다 1-2 g/kg을 유지하는 것이 통상적이다.
40그러나 최근 연구에
서 3-6주마다 정주하는 것보다는 7-10일마다 정주하거나 1주일마다 피하로 사용할 경우 IgG를 항상 높게 유지할 수 있다는 결과와 피하주사가 정주에 비해 부작용이 적었 던 점으로 볼 때 향후 피하주사 요법이 더 선호될 가능성 이 높다.
40CIDP의 경우, 혈장치환술, IVIG, 스테로이드가 거의 동 등하게 효과적이나 일부의 환자들은 이 치료 중의 한 가 지에 더 잘 반응하는 경향을 보이기도 한다.
41치료법은 개인별로 임상적 이용가능성, 정맥 접근성, 나이, 연관된 질환 등의 경우를 감안하여 선택되어야 한다. IVIG는 다 방면의 작용기전을 나타내 매우 유용하며 , 급성작용(대식 세포의 면역글로블린의 Fc 수용체에 대한 경쟁)과 만성작 용(항체생산을 감소시킴)이 있으나, 이 중 단지 몇몇 작용 기전만이 질환에서 명확하게 확인되었다 .
40GBS에서는 IVIG가 신경전기적으로 막고 있는 항체의 작용을 중화하 며,
42DM에서는 보체 소비를 억제하고, 근막을 공격하는 복합체의 침착을 막는다 .
43GBS에서 초기치료(혈장치환 술 또는 IVIG) 후 호전된 상태에서 이차적으로 다시 악화 된 경우 같은 치료가 다시 반복적으로 이뤄져야 한다 .
12) 만성유지요법
만성 또는 만성재발성 자가면역 신경근육질환에서는 성공적인 급성 면역치료기법과 함께 장기적인 치료가 고 려되어야 한다.
1스테로이드나 IVIG에 급속한 치료반응을 보이면 재발방지를 위한 유지요법으로서 선택되며, 경우 에 따라서는 개인별로 용량을 점차 줄여나가면서 유지시 킨다.
1스테로이드의 다양한 작용을 감안하여, 10 mg의 프레드니솔론을 매일 유지하거나 20 mg으로 이틀에 한 번 유지하는 요법이 안전한 단독 장기유지요법으로 사용 된다.
1대부분의 만성 신경근육질환에서 면역억제제가 관 해를 유지하기 위해 사용되며, 면역억제제가 작용을 시작 하는데 길게는 수개월의 시간이 필요하여, 초기부터 스테 로이드와 병용하는 것이 좋다. 스테로이드 단독 저용량 요법만으로는 관해를 유지하기에 불충분한 경우가 많다.
1모든 면역억제제는 원칙적으로 남녀 모두에서 사용 중에 는 피임하는 것이 안전한데, 임신 전 적어도 6개월 전에 약물을 중단하는 것이 추천된다 .
1IVIG에 반응하는 만성 질환의 경우에는 유지용량은 환자마다 다른데, 어떤 환자 들에서는 1 g/kg까지 감량하여도 되고, 또 다른 환자에서 는 2 g/kg으로 2-3개월마다 투여하는 것으로 관해 유지가 되기도 한다. IVIG가 고가인 관계로 대체로 효과 있는 가 장 작은 용량을 쓰는 것이 일반적이다.
1,44면역억제제가 신경계 질환의 치료를 위해 도입된 것이
1960년대 초이며, 비록 전향적인 대조군 비교 연구가 빈 약하기는 하지만, 현재 표준치료로 널리 인정되고 있으 며, 대체로 장기적인 면역 억제요법은 암의 위험성을 약 간 상승시킨다.
1Azathioprine의 경우 MGD와 다발성경화 증(multiple sclerosis, MS)에서 수년간 복용할 경우 2-4배 정도 암의 발생위험도가 증가된다고 보고되고 있지만 여 전히 일부 연구자들은 그 위험성은 낮다고 믿고 있다.
1,45Cyclophosphamide의 경우, 혈액암의 위험이 매년 1-5%씩 상승하며, 전체 투여된 농도와 상관관계가 있는 것으로 알려져 있다.
46그러나 실제적인 위험도에 관한 자료는 제 한적이며, 위험성에 관한 대조군비교 연구는 미미한 실정 이다.
1Azathioprine은 퓨린대사의 다른 여러 단계에서 억제제 로 작용하며, 순응도가 좋고, 다양한 자가면역성질환에서 사용 시 장기적인 부작용들이 이미 잘 확인되어 있다.
1Azathioprine의 이화작용에는 enzymatic thiomethylation의 과정이 포함되는데, 이 효소는 유전적 요인으로 인해 5-10%의 백인과 아시아 인종에서 낮은 효소 활성도를 보 이며, 이러한 차이가 초기에 나타나는 특발성 부작용의 이유가 될 수 있다.
47환자가 표준 용량(2.5-3.0 mg/kg)에 대해서 견디지 못하면 이보다 더 적은 용량으로 하루에 여러 번 나누어서 사용할 수 있다.
1,47Allopurinol을 사용 하는 환자에서는 동시 사용이 금지되며, 심한 소화기계 증상이나 알러지 반응이 있는 경우 methotrexate 또는 mycophenolate mofetil이 대체약물로 고려될 수 있다.
1Methotrexate는 엽산 대사의 길항제로 작용하는 항암제 로, 저용량에서는 면역억제 작용을 가지며, 염증부위에 아데노신이 축적되는 등의 면역조절 효과가 추가적으로 있는 것으로 알려져 있다.
1,481주에 1회 경구, 피하, 또는 근육주사로 투여되며 신장 또는 간의 이상과 폐섬유화가 있는 경우가 약물금기사항이다 .
1,48신경계질환의 경우 근 염 또는 azathioprine에 부작용을 보이는 경우 스테로이드 보조요법으로 1차 선택제로 추천될 수 있으며, 현재 MG 또는 CIDP에서 널리 사용되고 있지는 않지만 유용하게 사용될 수 있다.
1,48일반적인 용량은 매주 10-20 mg을 사 용한다. 약물 사용에 따른 신경계부작용을 줄이기 위해서 경구로 저용량 엽산(매일 2 mg 또는 주 5 mg)을 투여한 다.
1,48,49Cyclosporin은 tacrolimus와 비슷한 기전으로 immunophilin 에 결합하는 계열의 약물로, Cyclophilin에 결합하여 cy- closporin이 calcineurin 의존성 신호전달계를 억제하고, 이 에 따라 interleukin 2와 기타 T세포 관련 싸이토카인의 생성을 감소시킨다.
50부작용이 많은 편이라 MG와 심한
CIDP에서 이차적 치료제로 사용되며, azathioprine에 추가 요법으로 사용되기도 한다 .
1,31100-150 mg을 하루 2번 투 여하여 70-100 ug/L의 혈중농도를 유지한다.
1Azathioprine 이나 methotrexate보다 빠르게 작용하기 때문에 스테로이 드가 금기사항이거나 부작용으로 순응도가 떨어질 때 2 차적 치료제로 선호된다 .
1Mycophenolate mofetil는 퓨린 생합성의 과정을 조정하 여 T세포와 B세포에서의 guanosine nucleotide의 결핍을 유도한다.
18,51매일 2 g 정도의 농도까지는 일반적으로 잘 유지되며, cyclosporin처럼 농도가 혈액검사로 측정이 가 능하다.
1MG와 근염에서의 치료 효과에 관한 첫 보고들 은 적정 혈중농도를 1-2 mg/L로 제안하고 있다.
51부작용 은 드물고 , 대부분 하루 2 g 이상 사용할 경우 부작용이 발생하며, CMV 감염의 위험성이 올라간다.
51암 관련성 에 대해서는 알려진 것이 없으며 , MG에 대해 대조군 연 구가 진행되어 있다. 각기 다른 위치에서 T세포 활성화를 조절하기 때문에, Azathioprine 또는 mycophenolate mofe- til을 cyclosporin과 병용하여 사용할 수 있다.
1Cyclophophamide는 alkylating 항암제로 강력한 면역억제 작용이 있다 .
1심한 혈관염, mixed connective tissue disorder, 그리고 일부 면역매개성 신경병증 (혈관염신경병, MMN, 심 한 CIDP 등)의 경우 사용하면 도움이 된다. 관해가 오면 azathioprine 또는 mycophenolate로 변경이 가능하다.
10.5-1.0 g/m
2로 정맥투여를 4-6주마다 시행하며, 질환의 활성도가 매우 높은 경우에는 초기 유도요법으로 350 mg/m
23회 투여를 고려한다 .
1항구토제가 오심을 줄이기 위해 추천되 고 방광보호약물도 필수적이다 .
1Cyclophosphamide pulse 치료는 장기적인 경구요법에 비해 더 순응도가 높으며 , 암발생 위험도를 증가시키는 총량(50 g 이상)에 도달하기 까지는 오래 걸리며 , 매년 1.5%의 암 발생 위험도가 증가 된다 .
1Tacrolimus는 cyclosporin과 비슷한 기전으로 immunophilin
에 결합하는 계열의 약물로, immunophilin FKBP12에 결
합하여 , calcineurin 의존성 신호전달계를 억제하고, 이에
따라 interleukin 2와 기타 T세포 관련 싸이토카인의 생성
을 감소시킨다 T세포의 활성화에 작용하는 calcineurin에
대한 억제제이다 .
52MG에서 스테로이드의 용량을 줄이며,
일부 연구에서는 스테로이드를 중단해도 효과적으로 면
역억제기능을 보여주었으며, cyclosporin과 스테로이드 병
합요법 실패 시에 tacrolimus로 대체하여 효과를 보였으
며, 5년 정도 장기 사용 시 안정성을 보여 주어 향후 MG의
주요 면역억제제로서 사용될 가능성이 높다 .
53하루 3 mg
저녁 때 사용하며 , 적정 혈중농도는 7-8 ng/mL이며, cyclo-
sporin과 마찬가지로 작용이 다른 면역제에 비해 작용시 간이 빠르다.
53경험적으로 독성작용이 최소로 나타나는 용량으로 시 작하고, 가능한 약물들을 적절히 조합하여 사용하며, 독 성작용이 큰 약물의 경우 필요한 경우에만 단계적으로 사 용하도록 한다.
1새로운 면역억제제의 적용은 다른 약물 치료가 실패한 경우 고려될 수 있다.
19MG에서는 수술적 접근이 장기적인 예후를 호전시킬 수 있다.
54이 질환을 가진 젊은 환자의 많은 수가 흉선 비대 또는 흉선종을 가진다.
55흉선제거술이 자가항체와 T세포 생산의 주요 근원을 제거하는 작용이 있다고 여겨 진다.
55대조군연구 결과가 부족하기 때문에 시술의 유효 성에 의문을 제기하는 경우도 있으나, 대규모의 메타분석 에 의하면 시술이 더 유리한 것으로 나타난다 .
54흉선제거 술은 nACh 수용체 항체를 가진 50세 미만의 젊은 환자, 전신형 MG에서 일시적 증상 완화를 위한 전처치 후에 시행이 고려된다.
1악성흉선종에 대해서는 연령에 관계없 이 제거되어야 하며 방사선항암요법이 종양의 침습적 확 장에 대해 고려된다.
14. 면역치료의 새로운 방향