REVIEW ARTICLE
췌장 낭성 병변의 내시경적 치료
이상협
1,2서울대학교 의과대학 내과학교실 및 간연구소1, 서울대학교병원 내과2
Endoscopic Treatment for Pancreatic Cystic Lesions
Sang Hyub Lee1,2
Department of Internal Medicine and Liver Research Institute, Seoul National University College of Medicine1, Department of Internal Medicine, Seoul National University Hospital2, Seoul, Korea
The decision of the appropriate treatment for pancreatic cystic lesions (PCLs) is becoming increasingly important as the number of incidentally found PCLs increases. A range of modalities have been attempted because there has been an increasing demand for minimally invasive treatment for PCLs due to the large burden of a surgical resection. Endoscopic treatment using endoscopic ultra- sonography (EUS), a representative of minimally invasive therapy, can be categorized into two types: ablation therapy by the injection of drugs and topical thermal coagulative therapy through the high topical energy. A number of studies reported the feasibility and efficacy of these treatments; the most common is EUS-guided ablation for PCLS with ethanol alone or in combination with anticancer drugs. Although ablation therapies with drug injection have proven safety and feasibility, there is no consensus regarding the actual treatment effects and indications of these modalities. EUS-guided radiofrequency ablation was recently attempted as a representa- tive method of local thermal coagulation, but further studies will be needed because of the lack of evidence of its feasibility and safety.
In addition, a range of treatments for malignant tumors rather than PCLs have been attempted, such as EUS-guided photodynamic therapy, EUS-guided neodymium-doped yttrium aluminum garnet laser, and high-intensity focused ultrasound, based on the data from animal experiments. Through further study, endoscopic treatment is expected to become established as a useful treatment mo- dality for PCLs. (Korean J Gastroenterol 2018;71:10-17)
Key Words: Pancreatic cyst; Endosonography; Therapy
Received December 16, 2017. Revised December 22, 2017. Accepted December 22, 2017.
CC This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/
by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Copyright © 2018. Korean Society of Gastroenterology.
교신저자: 이상협, 03080, 서울시 종로구 대학로 101, 서울대학교병원 내과
Correspondence to: Sang Hyub Lee, Department of Internal Medicine, Seoul National University Hospital, Seoul National University College of Medicine, 101 Daehak-ro, Jongno-gu, Seoul 03080, Korea.
Tel: +82-2-2072-4892, Fax: +82-2-762-9662, E-mail: gidoctor@snuh.org Financial support: None. Conflict of interest: None.
서 론
췌장의 낭성 병변(pancreatic cystic lesion, PCLs)은 매우 흔하게 발견되는 소견으로, 최근 전산화단층촬영(computed tomography)과 자기공명영상(magnetic resonance imag- ing)의 사용이 늘어나며 증상 없이 우연히 발견되는 PCLs가 더욱 많아지고 있다.1 PCLs는 악성 병변으로의 진행이 가능 한 점액성 낭종(mucinous cystic neoplasm, MCN), 췌관내
유두상점액종(intraductal papillary mucinous neoplasm, IPMN)을 비롯하여 양성 질환인 장액성 낭종(serous cystic adenoma, SCA), 가성낭종(pseudocyst) 그리고 고형 종양인 가유두상종양(solid pseudopapillary tumor), 췌장의 신경내 분비종양(pancreatic neuroendocrine)의 낭성 변화 등의 이 질적인 구성을 이룬다. PCLs의 치료는 일반적으로 수술적 절 제 혹은 경과 관찰을 하는 두 가지 전략만이 있는데, 췌장의 병변에 대한 수술은 수술 후 합병증이 상당 수준 발생하기에
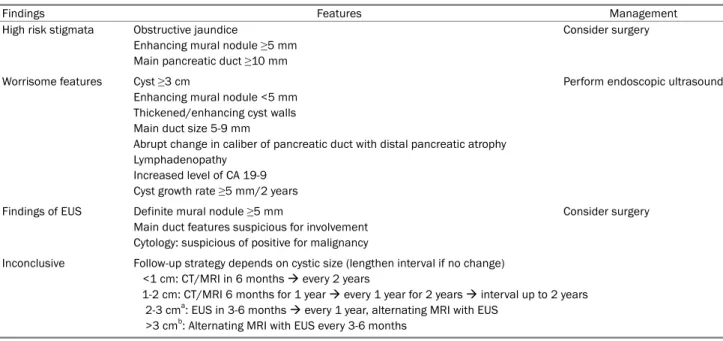
Table 1. Suggested Management of Suspected BD-IPMN Modified from the Fukuoka Guideline Revised in 20172
Findings Features Management
High risk stigmata Obstructive jaundice
Enhancing mural nodule ≥5 mm Main pancreatic duct ≥10 mm
Consider surgery
Worrisome features Cyst ≥3 cm
Enhancing mural nodule <5 mm Thickened/enhancing cyst walls Main duct size 5-9 mm
Abrupt change in caliber of pancreatic duct with distal pancreatic atrophy Lymphadenopathy
Increased level of CA 19-9 Cyst growth rate ≥5 mm/2 years
Perform endoscopic ultrasound
Findings of EUS Definite mural nodule ≥5 mm
Main duct features suspicious for involvement Cytology: suspicious of positive for malignancy
Consider surgery
Inconclusive Follow-up strategy depends on cystic size (lengthen interval if no change) <1 cm: CT/MRI in 6 months every 2 years
1-2 cm: CT/MRI 6 months for 1 year every 1 year for 2 years interval up to 2 years 2-3 cma: EUS in 3-6 months every 1 year, alternating MRI with EUS
>3 cmb: Alternating MRI with EUS every 3-6 months
BD-IPMN, branch duct type intraductal papillary mucinous neoplasm; CA 19-9, carbohydrate antigen 19-9; CT, computed tomography; MRI, magnetic resonance imaging; EUS, endoscopic ultrasonography.
aConsider surgery in young, fit patients with need for prolonged surveillance; bStrongly consider surgery in young, fit patients.
덜 침습적인 치료에 대한 요구가 있어왔다. 최근 PCLs의 자 연경과에 대한 이해가 조금씩 깊어짐에 따라 수술의 적응증에 대한 기준을 점차 엄격하게 적용하는 방향으로 진료 가이드라 인의 추천사항들이 변화하고 있으며,2 이러한 변화에 발맞추 어 PCLs를 치료하는 방법으로 시도되고 있는 최소 침습적인 치료는 초음파 내시경(endosonography, EUS)을 이용한 치료 로, 본고에서는 PCLs에 대한 내시경적 치료에 대하여 고찰해 보고자 한다.
본 론
1. 췌장 낭성 병변의 치료 지침 및 내시경적 치료의 도입 배경 증상을 나타내거나 악성 혹은 악성으로의 진행 가능성이 높은 PCLs는 적극적인 치료의 대상이 된다. IPMN의 경우 폐쇄나 협착 의 증거 없이 주췌관이 5 mm보다 늘어나는 경우 주췌관형 IPMN (main duct type IPMN, MD-IPMN)으로 분류하며, 크기가 5 mm 이상이면서 주췌관과의 연결성이 확인되는 경우는 분지췌관형 IPMN (branch duct type IPMN, BD-IPMN)으로 분류하되 췌장 염의 과거력이 있는지 확인하여 가성낭종에 대한 가능성을 우선 배제해야 하고, 두 특성을 모두 가지는 경우에는 혼합형 IPMN (mixed type IPMN, MX-IPMN)으로 분류한다.2여러 연구들을 통 하여 MD-IPMN은 38-68%의 악성률을 보이지만 주췌관 5-9 mm 는 악성의 가능성이 떨어지고, BD-IPMN은 12-47%의 악성률을 보이며, MX-IPMN은 38-65%의 악성률을 보인다고 알려져 있다.1 따라서 주췌관 확장이 심한 MD-IPMN과 MX-IPMN의 경우는 수
술적 절제를 적극 고려하게 되나, BD-IPMN의 경우는 다양한 임상 양상과 추가 검사를 고려하여 치료를 결정하게 된다. 가장 널리 받아들여지고 있는 ‘The International Association of Pan- creatology’의 2012년 발표되었던 가이드라인3은 올해 소폭 개정 된 바 있고, ‘high-risk stigmata’를 ‘1) obstructive jaundice in a patient with cystic lesion of the head of the pancreas, 2) enhancing mural nodule >5 mm, 3) main pancreatic duct
≥10 mm’로 정의하여 mural nodule의 크기 기준을 추가하였고,
‘worrisome feature’를 췌장염을 비롯하여 ‘1) cyst ≥3 cm, 2) en- hancing mural nodule <5 mm, 3) thickened/enhancing cyst walls, 4) main duct size 5-9 mm, 5) abrupt change in caliber of pancreatic duct with distal pancreatic atrophy, 6) lym- phadenopathy, 7) increased serum level of carbohydrate an- tigen 19-9, 8) cyst growth rate >5 mm/2 years’로 정의하여 기존에 비해 5 mm 미만의 enhancing mural nodule에 대한 기준 을 완화시켰고, 혈중 carbohydrate antigen 19-9의 상승 및 2년 에 5 mm 이상의 크기 증가를 보이는 경우를 추가하였다. ‘High risk stigmata’가 있다면 수술을 바로 고려하고, ‘worrisome fea- ture’를 보이면 EUS를 시행하여 5 mm 이상의 mural nodule, 주 췌관의 침범, 세포 검사(cytology)에서 악성의 가능성이 있는지 여부를 확인하여 수술 여부를 결정하는 것을 추천하고 있어 이전 가이드라인에 비해 mural nodule에 대한 기준이 완화되었다 (Table 1).2한편, American Gastroenterological Association 에서 2015년 발표한 가이드라인4의 경우, 수술적 절제를 하는 기 준으로 주췌관의 확장과 낭종내의 고형병변이 모두 있는 경우로
Table 2. Literature Review of Studies of EUS-guided Ablation in PCLs
Author (year) n Agents Median follow-up (month) CR (%) Diagnosis (n/% of CR) Malignant
transformation Total AE SAE
MCN IPMN Others
Gan et al.
(2005)10 23 E 6-12 34.8 14/35.7 3/0.0 6/50.0 - 0 0
DiMaio et al.
(2011)12 13 E 13.4 38.5 - 13/38.5 - - 1 0
Caillol et al.
(2012)13 13 E 26 (4-118) 84.6 13/84.6 - - - 0 0
Park et al.
(2016)6 91 E 40 (13-117) 45.1 12/50.0 9/11.1 70/48.6 - 21 0
Gómez et al.
(2016)8 23 E 45.8 (14.7-90.8) 8.7 4/0.0 15/6.7 4/25.0 1 2 1
Oh et al.
(2011)16 47 E+P 21.7 (2-44) 61.7 9/33.3 - 38/94.7 - 5 0
DeWitt et al.
(2014)17 21 E+P 27 (17-42) 47.6 6/- 12/- 4/- - 9 4
Choi et al.
(2017)5 158 E+P 69 (48-81) 72.2 71/76.1 11/50 82/55 - 16 1
Moyer et al.
(2017)7
18 E+G+P
12 61.0
9/44.4 27/70.4 3/66.7 NA 5 1
21 G+P 67.0 0 0
EUS, endoscopic ultrasonography; PCLs, pancreatic cystic lesions; CR, complete remission; E, ethanol; G, gemcitabine; P, paclitaxel; NA, not applicable; AE, adverse events; SAE, severe adverse events; MCN, mucinous cystic neoplasm; IPMN, intraductal papillary mucinous neoplasm.
제시하고 있고, 추적 관찰 기간을 5년으로 제시하고 있다. 하지 만 이러한 방식의 접근은 근거가 부족하여 많은 비판에 직면해 있어 수술적 절제와 경과 관찰만으로는 치료 방침의 결정에 미 흡한 점이 남아있다. 많은 임상 의사들은 PCLs의 크기나 특성에 맞추어 추적 관찰 기간 및 검사 방법 등을 결정하지만, 결국 주 요 의사결정은 수술을 하느냐 그렇지 않느냐의 두 가지 선택지 에 불과하기에 실제 환자 진료에 있어서는 그 득과 실을 놓고 어려운 선택을 반복하게 된다. 결국 PCLs에 내시경적 치료는 이 러한 배경에서 앞에서 기술한 치료 방침 결정에 있어 부족한 부 분을 보완할 수 있는 치료 방법으로 시도되었다. 최근에는 PCLs 에 대한 내시경적 치료는 이전에 보고된 연구들을 토대로 내시 경적 치료를 많이 시행한 몇몇 센터에서는 불필요한 수술적 치 료로 인한 삶의 질 저하가 걱정되고, 경과 관찰을 하는 경우 불 안감 및 반복되는 고비용 검사에 대한 경제적 부담이 있을 때 적용 가능한 치료로서, 신체활동도가 좋지 않아 수술적 치료를 받기 어려운 환자, 악성의 가능성이 매우 낮지만 경과 관찰하기 에는 부담스러운 환자나 양성 낭종이 의심되나 MCN이나 BD-IPMN이 완전히 배제되지 않아 진단 목적의 EUS 및 낭액분 석을 계획하는 환자들에게서 정확한 수술적 적응증에 해당하지 않는 경우 등에 주치료 방법으로 시행할 수 있다고 제시하고 있 다.5,6 비록 PCLs에 내시경적 치료가 충분히 실행 가능한 치료 방법이라는 것은 증명이 되었지만, 실제적인 치료 효과와 정확한 적응증에 대해서는 여전히 전문가들 사이에 이견이 있다.5-8
2. 췌장 낭성 병변의 내시경적 치료의 현재
내시경을 통해 시도되고 있는 PCLs의 치료는 EUS 유도하
에 병변을 정확히 선택하여 약제를 주입하여 상피세포를 소작 하는 방식의 치료(ablation) 혹은 고에너지를 통한 국소적 열 응고술(thermocoagulation)을 시행하여 괴사를 유도하는 방 식으로 구분할 수 있다. 대표적인 PCLs의 내시경적 치료는 소 작술(ablation)로, 에탄올을 이용한 방식이 있고, 에탄올과 항 암제를 함께 사용하는 방식이 있으며 최근에는 항암제만을 사 용한 방식의 효용성에 대해 보고된 바가 있다. Table 2에 지금 까지 발표된 연구 결과를 정리해보았다.
1) 초음파내시경 유도하 에탄올 소작술
(EUS-guided ethanol ablation or lavage) 에탄올은 낮은 점도를 가지고 있어 작은 두께의 바늘을 통 해 쉽게 주입이 가능하며, 타 장기의 낭종이나 고형 종괴에 대 한 치료로 사용되고 있는 화학물질로, 비교적 가격이 저렴하며 조직의 괴사를 일으키고 섬유화, 작은 혈관의 혈전, 육아종성 조직 형성을 유도하는 효과를 나타낸다.9 PCLs에 대하여 에탄 올을 이용한 치료의 프로토콜은 연구마다 조금씩 다르지만, PCLs를 22 G 바늘로 찌른 후 낭액을 모두 제거하고 에탄올 (농도는 5-99%)을 3-5분 가량 저류시켜 소작술을 시행한 뒤 넣었던 에탄올을 모두 제거하고 시술을 종료하는 것이다.
Gan 등은 2005년 이 시술에 대한 결과를 처음 보고한 바 있고,10시술 후 6-12개월 추적 관찰이 가능하였던 23명 중 8명 (35%)에서 완전 관해(complete remission, CR)가 확인되었 다. 이 연구에서는 적정한 에탄올 농도에 대한 확인을 위해 농도를 점차 올려가며 그 효과의 차이를 확인해보았는데, 저 농도 에탄올(농도 5-40%)을 사용한 그룹에서 25%의 CR, 고
농도 에탄올(농도 50-80%)을 사용한 그룹에서 38%의 CR이 확인되어 농도에 따른 유의미한 차이는 확인하지 못하였다.
실제로 CR에 도달하지 못하여 수술적 절제를 시행한 5명의 환자들에서 확인한 결과, 낭액 분석을 통해 예상하였던 진단 과 조직학적 진단은 MCN으로 일치하였고 상피의 소작 정도 는 매우 다양하게 관찰되었는데, 완전한 상피소작을 보이는 경우도 확인할 수 있었다. 이러한 보고는 에탄올을 통한 시술 후 완전한 상피소작이 일어났으나 영상 검사에서는 여전히 cyst 형태가 관찰되어 CR에 도달하지 못한 상태로 평가될 가 능성이 있음을 시사한다. 이 연구에서는 모든 환자가 72시간 이내에 어떠한 사소한 합병증도 일어나지 않았음을 보고하며 이 시술이 매우 안전함을 강조하였다.
하지만 PCLs의 치료에 에탄올을 이용하는 소작술이 실제 효 과가 있는 것인지, 단순히 세척을 시행하고 낭액을 모두 제거 해주는 것만으로도 PCLs의 크기가 줄어든 것이 아닌지에 대한 의문점이 있었고, 이에 대하여 DeWitt 등은 에탄올과 식염수 를 비교한 전향적 무작위 이중맹검 임상 시험을 실시하였다.11 이 연구에서는 최종적으로 25명의 환자가 에탄올을 이용한 소 작술을 받고 17명의 환자가 식염수를 이용한 시술을 받았다.
시술 3개월 뒤 EUS 추적 검사를 시행하였을 때, 에탄올을 이용 하여 소작술을 받은 환자들에서 28.1%의 크기 감소가 있었고, 식염수를 이용하여 시술 받은 환자들에서 6.9%의 크기 감소가 확인되어 유의미한 차이를 나타내었다(p=0.005). 이 연구에서 는 모든 환자에 대하여 3개월 뒤 EUS 추적 관찰을 하면서 두 번째 시술을 시행하였고, 처음 에탄올을 이용한 소작술을 받은 환자들 중 18명에게 두 번째 에탄올 소작술을 시행하여 58%의 크기 감소가 확인되었고, 처음 식염수를 이용한 시술을 받은 환자들 중 13명에게 에탄올을 이용하여 소작술을 시행하여 48.2%의 크기 감소가 확인되었으며, 유의미한 차이를 보이지 않았다(p=0.54). 또한, 수술을 시행받은 검체를 통해 확인한 결 과 식염수를 이용한 소작술을 시행받은 경우는 상피의 소작이 전혀 관찰되지 않았으나 에탄올을 이용한 소작술을 시행받은 경우는 50-100% 정도의 상피소작이 조직학적으로 관찰됨을 보고하고 있다. 이 연구를 통해 단순히 세척을 시행하는 것이 의미 있는 것이 아니라, 에탄올을 사용하는 소작술이 PCLs의 치료에 실질적인 효과를 나타냄이 증명되었다. 다만, 그 추적 관찰 기간이 도합 6개월에 불과한 연구로 장기간 효과에 대한 것은 확인하기 어려운 단점이 있었고, 1차 평가 변수를 PCLs 의 CR로 본 것이 아니라 크기의 감소로 보았다는 점에서 임상 적인 의미를 확인하는 데에는 한계가 있었다.
이후 소규모 환자들을 대상으로 한 연구 결과들이 추가 보고 되었다. DiMaio 등은 99% 에탄올을 이용한 소작술을 3-6개월 의 간격을 두고 2회 시행한 후향적 연구 결과를 보고하였고,12 총 13명의 BD-IPMN 환자에게 소작술을 반복 시행할수록 크
기의 감소가 뚜렷함을 보고하여 반복적인 소작술이 효과적일 수 있음에 대하여 언급하였다(소작술 전 평균 크기 20.1 mm, 첫 소작술 후 17.0 mm, 두 번째 소작술 후 12.8 mm, p=0.06, p=0.0002). 이 연구에서는 5명(38%)의 환자에서 CR이 확인되 었으며, 모두 두 번째 소작술 이후에 확인된 것으로 추적 관찰 기간은 3-6개월 정도에 불과한 단기간 추적 관찰 연구라는 점 에서 그 의미가 제한적이다. 또한 Caillol 등은 수술을 거부하 거나, 수술을 할 컨디션이 되지 않는 환자들을 대상으로 14개 의 점액낭종(mucinous cysts, 낭액 carcinoembryonic anti- gen >400 UI/L 혹은 조직학적 확정)에 대해 99% 에탄올을 이용한 소작술의 후향적 연구 결과를 보고하였고,13 시술 6개 월 후부터 전산화단층촬영으로 추적 관찰하였다. 이 연구에서 는 11개의 PCLs에서 CR이 확인되었음을 보고하였으며 재발 한 경우는 없었다. 추적 관찰 기간은 평균 26개월(4-118개월) 인 비교적 장기간 추적 관찰 결과로, 점액낭종으로 예측되는 PCLs에 대한 에탄올을 이용한 소작술의 비교적 장기적인 효 과에 대하여 확인이 가능하였지만 대상 수가 적었다. 이러한 연구 결과들을 종합하여 Kandula 등은 2015년까지 발표된 7개 의 연구를 이용한 메타분석의 결과를 보고하였고, CR은 56%, 부분관해는 24%로 보고되었으며 합병증은 복통이 6.5%, 췌장 염이 3.9% 정도로 확인되었다.14
이후 PCLs의 느린 성장 및 변화 속도를 고려하였을 때, 이 러한 에탄올을 이용한 소작술의 확실한 효과를 인정하기 위해 서는 기존에 보고된 연구 결과들보다 더욱 많은 수의 환자를 대상으로 한 장기 추적 관찰에 대한 결과가 필요하였고, 이에 Park 등은 91명을 대상으로 99% 에탄올을 이용한 소작술을 시행한 이후, 중앙값 40개월을 추적 관찰한 결과를 발표하였 다.6 이 연구에서 CR은 45%에 이르렀고, 최소 12개월 이상 추적 관찰한 결과를 대상으로 하였기에 장기간 효과를 확인할 수 있었다. 다만 낭액 분석을 통하여 MCN이나 IPMN과 같이 점액낭종으로 확실히 예상된 경우는 21명에 불과하여 다수의 비점액낭종에 대한 시술 결과일 수 있다는 제한점이 있으며, 이들 중 IPMN의 경우 CR이 1명(11%)에서만 확인되어 에탄 올을 이용한 소작술의 효과가 뚜렷하지 않을 수 있음을 확인 할 수 있었다. 이에 대해서 연구자들은 점액이 상피를 덮고 있고, 상피가 유두상의 성장패턴을 보이면서 주췌관과 연결성 이 있기 때문에 에탄올의 저류가 잘 되지 않아 에탄올의 효과 가 저하되므로 IPMN에서의 효과가 좋지 않을 것이라고 설명 하고 있다. 다만, MCN의 경우 SCA와 유사한 수준의 CR 비 율(50%)이 확인되고 있기에 MCN은 IPMN과 달리 에탄올을 이용한 소작술의 좋은 대상이 될 수 있음을 제시하고 있다.
한편, Gómez 등이 최근 보고한 연구에서는 23명의 MCN 및 BD-IPMN 환자를 대상으로 80% 농도의 에탄올을 이용하 여 소작술을 시행하여 평균 40개월을 추적 관찰한 결과 2명
(9%)의 환자에서만 CR이 확인되었으며, 시술 후 시술 전에 비 해 부피의 80% 이상이 감소한 것은 전체 12명의 환자(52.2%) 에서 확인되어, 장기간 관찰 시 점액낭종에 대한 CR을 기대하 기 어렵다는 결과를 보고하였다.8또한, 이 연구에서 1명의 환 자에서 에탄올을 이용한 소작술을 시행받은 낭종으로부터 췌 장선암이 발생하였음을 보고하였다. 이 환자는 4.9 cm 크기 의 췌장 두부의 PCLs이며 BD-IPMN이었고, 소작술 후 잔여 낭종에 대하여 수술적 절제를 권유하였으나 환자가 거부하였 고, 최종적으로는 소작술 시행 41개월 후 췌장 선암이 진단되 어 수술은 하였으나 원격전이가 동반되어있어 진단 8개월만 에 사망한 케이스였다. 즉, 에탄올 소작술을 시행하더라도 적 절한 추적 관찰이 필수적이며, 향후 에탄올을 이용한 소작술 의 정확한 적응증과 추적 관찰에 대한 기준을 설정할 필요가 있음을 알 수 있다.
2) 에탄올 및 항암제를 이용한 초음파 내시경 유도하 소작술 (EUS-guided ablation with ethanol and chemoagent) 에탄올을 이용한 소작술의 효과가 보고된 이후, 2008년 Oh 등 은 99% 에탄올과 paclitaxel (1:1 희석, 1.5-18 mg 사용)을 순차적으로 사용하여 PCLs에 대한 소작술을 14명의 환자에 시행한 후 중앙값 9개월의 추적 관찰 데이터를 보고하였는데, 11명의 환자에서 CR이 확인되었다.15 저자들은 paclitaxel의 소수성과 높은 점도로 인해 PCLs 내부에 paclitaxel이 잘 저 류되어 유출이 잘 되지 않을 것으로 기대되어 시술로 인한 합 병증 역시 잘 일으키지 않을 것이라고 생각하였기에 이 항암 제를 선택하였다고 한다. 에탄올을 먼저 주입하여 낭종의 상피 에 변형을 일으키고 paclitaxel을 저류시키는 이 시술 방법은 paclitaxel이 손상된 상피세포들을 통해 더욱 잘 침투하고 세 포자멸사 등을 더욱 잘 유도할 수 있을 것으로 기대된다. 이후 같은 연구진에서 에탄올과 paclitaxel을 이용한 소작술을 시 행한 47명의 환자에 대한 12개월 이상의 추적 관찰(중앙값 21.7개월) 결과를 보고하였는데, CR은 29명(61.7%)에서 확인 되었다.16 이 연구에 따르면, 해당 시술 이후 수술적 절제술을 시행받은 환자들의 조직학적 소견에 따르면 상피의 소작 정도 는 0-100%로 다양하게 보고되었기에 실질적인 소작 효과가 에탄올을 사용하는 소작술에 비해 뛰어나는 것인지, 또 절대 적인 효과가 뛰어난 것인지에 대해서는 추가적인 증명이 필요 할 수 있겠다. 이 연구진은 올해 158명의 환자에 대한 중앙값 72개월의 장기간 추적 관찰한 결과를 제시하였고, CR은 전체 PCLs 중 72%에서 확인되었다.5낭액 분석에 근거한 기준으로 확인해본 바, MCN의 76.1% 및 IPMN의 50%에서 CR이 확인 되는 등 점액낭종에 대한 성적도 좋았으며 CR 후 재발률은 1.7%에 불과하였다. 하지만 이들의 연구에서는 CR의 정의를 시술 전 부피 대비 5% 미만으로 줄어든 것으로 설정하였고,
이를 길이의 변화로 계산해보면 64% 정도의 길이가 줄어든 것으로 평가되기에 CR에 도달하였다는 평가는 에탄올을 이용 한 소작술에 비해 과평가되었을 수 있고, 추적 영상 검사에서 는 PCLs가 여전히 관찰되고 있는 상태임을 유의하여 해석해 야 한다. 이 연구에서 제시하고 있는 CR에 잘 도달하는 특성 은 EUS로 측정한 크기가 35 mm 미만인 것과 단방성 PCLs인 경우로 확인되었다. 한편, 저자들은 내시경 초음파 유도하 소 작술의 적응증을 다음과 같이 제시하고 있다: 1) 2-3.5 cm uni- locular or oligolocular cysts without communication be- tween cyst and main pancreatic duct on imaging studies, 2) for which fine-needle aspiration is required for detailed categorization because the specific type may not be de- termined using imaging findings alone, 3) cysts that in- creases in size during the follow- up, 4) cysts in patients who refuse surgery or who have high surgical risk.
이러한 에탄올 및 paclitaxel을 이용한 소작술이 효과적인 것을 확인한 후, 이를 분자수준에서 확인하려는 시도가 있었 다. DeWitt 등은 20명의 환자들을 대상으로 에탄올 및 pacli- taxel을 사용한 소작술의 결과를 보고하였는데, 중앙값 27개 월의 추적 관찰 결과 50%에서 CR (부피기준)이 확인되었다.17 이들은 에탄올 및 paclitaxel을 통한 소작술의 효과를 분자수 준으로 확인하기 위해 시술 전 낭액에서 추출한 DNA로부터 K-ras 및 loss of heterozygosity 돌연변이 검사를 시행하였 고, 두 번째 EUS를 3개월 뒤에 계획하여 추가 소작술 여부를 결정하고 돌연변이 검사를 위한 낭액분석을 시행하였다. 시술 전 확인된 돌연변이가 시술 후 사라지는 경우가 8명의 환자에 서 확인되었고, 없던 돌연변이가 생기는 경우도 3명에서 확인 되었다. 사실 이러한 유전자 수준의 돌연변이 변화가 임상적 으로 어떤 의미가 있는지 명확히 밝혀진 것은 아니지만, 저자 들은 에탄올 및 paclitaxel을 사용한 소작술의 결과로 돌연변 이를 없앨 수 있다는 것은 악성으로의 진행을 억제하는 효과 를 기대할 수 있는 증거가 될 수 있다고 제시하고 있다.
한편, 소작술을 에탄올 없이 항암제만으로 시행하는 것이 효과는 비슷하고 합병증을 줄일 수 있을 것이라는 시범 연구 가 제시되었고,18 Moyer 등은 점액낭종에 대하여 에탄올, gemcitabine, paclitaxel을 이용한 소작술을 시행한 군과 식 염수, gemcitabine, paclitaxel을 이용한 군의 전향적 무작위 이중맹검 임상 시험 결과를 보고하였다.7 이들은 기존의 소작 술에서 에탄올이 합병증을 일으키는 주원인으로 보았고, 특수 제작한 항암제 병합용액(gemcitabine+paclitaxel)과 에탄올 을 함께 사용한 군과 사용하지 않은 그룹의 임상 성적을 비교 하였다. 양군의 CR (부피기준)은 시술 후 12개월 시점에 61%
와 67%로 큰 차이를 보이지 않았고, 중증 합병증은 에탄올을 사용한 군에서 1예(입원이 필요한 급성 췌장염) 발생하였으
며, 경증 합병증 역시 에탄올을 사용한 군에서만 4예(경미한 복통) 발생하였음을 보고하였다. 다만, 이 연구는 환자수가 많 지 않고 추적 관찰 기간이 시술 후 12개월에 불과한 단기간 치료 효과를 비교한 연구이며, 기존 보고된 연구들을 바탕으 로 살펴보면 에탄올을 사용하는 시술의 안전성에 의문을 제기 하기 어렵다는 점을 고려하여 해석해야겠다.
3) 초음파 내시경 유도하 고주파열절제술(EUS-guided ra- diofrequency ablation; EUS-guided RFA)
국소적 열응고술을 이용한 대표적인 치료 방법인 RFA는 국소에 높은 열을 주어 세포에 손상을 주고 자멸사를 유도하 고 괴사를 일으키는 방식으로 종양을 치료한다. 현재까지 다 양한 암종에 대한 국소 치료 혹은 고식적 치료로 사용되어 왔 으며, 최근에는 다양한 동물실험 결과를 바탕으로19,20 실제 환 자의 PCLs에 대한 적용도 시도되고 있다. Pai 등은 8명의 환 자를 대상으로 EUS-guided RFA를 시행하였고, 그중 4명은 MCN, 1명은 IPMN, 1명은 SCA, 2명은 pancreatic neuro- endocrine이었으며, 모든 환자에서 중증 합병증 없이 시술에 성공하였고 3-6개월 후 추적 관찰 결과 2명의 환자는 CR이 확인되고 3명의 환자는 크기가 절반 정도 감소하였다고 보고 한 바 있다.21 Barthet 등은 30명의 환자에 대해 EUS-guided RFA를 시행하였고, 그중 17명은 IPMN, 1명은 MCN에 대해 치료를 받았으며 6개월 이상 추적 관찰한 10명의 환자에서 CR은 5명에서 보고되었고, mural nodule이 있던 8명 중 7명 에서 mural nodule이 사라지는 결과를 확인하였다.22 이들의 보고에 따르면 EUS-guided RFA 후 3예의 합병증이 발생하 였는데, 경증의 췌장염이 발생한 경우, 소장천공으로 인해 수 술을 받은 경우, 췌관 협착으로 인한 내시경적 치료가 필요하 였던 경우가 있었다고 하여 안전성에 대해서는 지속적인 연구 결과를 확인할 필요가 있어 보인다. 또한, 췌장의 악성 종양에 대한 EUS-guided RFA를 시행한 소수의 환자들의 결과들을 바탕으로 그 실행 가능성이 보고되고 있으므로 향후 다수의 환자에 대한 안전성 평가 및 장기간 임상 성적을 주목하여 췌 장의 낭성 종양에서의 효과를 가늠해 볼 수 있겠다.23
4) 췌장 낭성 병변의 내시경적 치료의 임상적 이득과 안정성 PCLs의 소작술의 실제 효과의 확인은 많은 수의 환자를 장 기간 추적 관찰한 후향적 연구에 기대고 있는데, PCLs에 대 한 소작술을 통해 일정 수준의 CR을 기대할 수 있으므로 이 를 소작술 없이 치료하지 않은 환자들과 전향적 무작위 배정 임상 시험을 통해 비교하는 것은 윤리적으로 받아들여지기 어 렵다. 또한, 수술적 절제와 EUS 유도하 소작술을 비교하는 것 역시 완전히 CR을 가능하게 하는 수술이라는 치료법과 비교 를 한다는 윤리적 문제를 내포하게 되어 연구의 수행이 어렵
다. 이에 대하여 우리 교실에서 PCLs에 대해 추적 관찰을 하 다 적절한 시점에 수술을 시행한 군과 EUS 유도하 에탄올 소 작술을 시행한 환자들의 임상 성적에 대하여 분석해 보았을 때, 에탄올 소작술을 시행하는 경우 그렇지 않은 경우에 비해 생존을 증가시키지는 못하지만 불필요한 수술적 절제를 시행 하게 되는 비율은 명확히 줄여주면서 30% 정도의 CR을 기대 할 수 있음을 확인한 바 있다. 이러한 연구 결과를 바탕으로 PCLs 치료의 한 방안으로 에탄올 소작술을 적극 고려해 볼 수 있다고 보여진다.24
다만 아직까지 PCLs에 대한 소작술의 효과는 제한적이기 때문에 시술의 안전성이 담보되어야 선택 가능한 치료법으로 서 역할을 할 수 있기에 시술의 합병증에 대한 논의가 중요하 다. 기존에 합병증을 보고한 연구들에서 에탄올과 항암제를 이용한 내시경적 소작술의 중증 합병증은 총 7예(2.0%) 정도 이므로 이는 비교적 안전한 시술로 보여지며 시술 후 췌장염 과 관련된 중증 합병증의 보고가 가장 많았다.5-8,12,17본 교실 에서 췌장의 낭성 병변에 대해 내시경적 에탄올 소작술을 시 행 받은 188명의 데이터를 분석하여 합병증을 보고한 발표에 따르면, 중증 합병증은 급성 췌장염의 악화가 길어져 장기간 입원 및 추가 내시경적 시술이 필요하였던 1명(0.5%)에서 발 생하였고, 급성 췌장염은 전체 17명(9.0%)에서 발생한 것으로 확인되었다. 가장 흔히 발생한 합병증은 경미한 복통으로 45명 (23.9%)에서 발생하였으며, 이들 중 진통제가 필요하였던 경 우는 이들 중 30% 정도였다. 이 외에 출혈 1명(0.5%), 담관염 1명(0.5%)이 발생하였음을 확인할 수 있었다. 이 연구에 따르 면 시술 후 합병증을 나타낼 위험인자로는 IPMN, 다방성 (multilocular) 낭종, 외방성 부분(exophytic portion)을 가진 낭종, 크기가 30 mm 이상인 낭종으로 확인되었다.25
3. 췌장 낭성 병변에 대한 내시경적 치료의 새로운 시도들 몇몇 실험적 기술들이 시도되고 있으나 췌장의 낭성 병변을 대상으로 하는 연구보다는 췌장암을 대상으로 시행하고 있는 연구가 대부분이며, 뚜렷한 임상적 의미를 가지는 결과는 아 직 보고된 바 없어 대표적인 기술들에 대해서만 간단히 소개 하겠다.
EUS-guided cryothermal ablation은 RFA 기술과 한랭 요법 (cryotherapy)을 접목한 것으로 한랭가스를 통해 RFA의 효과 를 더욱 높이는 것이며, 췌장의 낭종에 대해 시도된 적은 없으 나 국소진행성 췌장암에 대한 예비 시험(pilot study)의 결과 가 보고된 바가 있으며 비교적 안전하게 시행될 수 있다는 가 능성을 제시하고 있어 향후 결과에 주목할 필요가 있다.26
EUS-guided photodynamic therapy는 그 안전성과 실행 가능성에 대해 동물실험 결과를 보고한 바 있으며, 최근 4명 의 췌담도계 악성 종양 환자에게 안전하게 시술이 성공하였던
보고가 있어 그 후속 연구가 기대된다.27-29
EUS-guided neodymium-doped yttrium aluminum gar- net laser는 간암이나 대장암의 간 전이 등에 적용된 바 있는 기술로 조직의 괴사를 유도하는 방식이며, 동물실험을 통해 초음파나 내시경 초음파를 통해 췌장실질에 실행 가능성과 적 절한 시술 방식에 대한 연구가 진행되고 있다.30,31
High-intensity focused ultrasound의 경우 췌장암에 대해 그 적용이 시도되고 있으며, 그 효과와 안전성에 대해 사람에 적용한 결과들이 보고되고 있다. 하지만 EUS를 통한 시도가 있었다고 하나 실제 그 결과의 보고는 이루어지지 않은 상태 이며, 향후 후속 연구들을 주목해볼만 하다.32-34
결 론
췌장의 낭성 병변에 대한 초음파 내시경 유도하 에탄올 혹 은 항암제 주입술로 대표되는 내시경적 치료는 최소 침습이 가능한 안전하고 실행 가능한 치료법이다. 향후 임상적 효과 에 대한 더욱 견고한 근거들과 적절한 적응증 설정에 대한 후 속 연구들이 필요하다. 초음파 내시경 유도하 고주파열절제술 은 효과는 매우 기대되지만 그 안전성에 대한 확보가 필요하 다. 그 이외의 기술들은 향후 후속 연구들을 근거로 점차 발전 해 나갈 수 있으리라 기대된다. 향후 이와 같이 효과적인 낭성 병변에 대한 내시경적 치료법이 발전한다면 췌장의 낭성 병변 에 대한 불필요한 수술을 피하고, 효과적인 최소 침습 방식의 치료가 가능할 것으로 기대한다.
REFERENCES
1. Stark A, Donahue TR, Reber HA, Hines OJ. Pancreatic cyst dis- ease: a review. JAMA 2016;315:1882-1893.
2. Tanaka M, Fernández-Del Castillo C, Kamisawa T, et al. Revisions of international consensus Fukuoka guidelines for the manage- ment of IPMN of the pancreas. Pancreatology 2017;17:738-753.
3. Tanaka M, Fernández-del Castillo C, Adsay V, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology 2012;12:183-197.
4. Vege SS, Ziring B, Jain R, Moayyedi P; Clinical Guidelines Committee; American Gastroenterology Association. American gastroenterological association institute guideline on the diag- nosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology 2015;148:819-822; quize12-13.
5. Choi JH, Seo DW, Song TJ, et al. Long-term outcomes after endo- scopic ultrasound-guided ablation of pancreatic cysts. Endoscopy 2017;49:866-873.
6. Park JK, Song BJ, Ryu JK, et al. Clinical outcomes of endoscopic ultrasonography-guided pancreatic cyst ablation. Pancreas 2016;45:889-894.
7. Moyer MT, Sharzehi S, Mathew A, et al. The safety and efficacy
of an alcohol-free pancreatic cyst ablation protocol. Gastroenter- ology 2017;153:1295-1303.
8. Gómez V, Takahashi N, Levy MJ, et al. EUS-guided ethanol lavage does not reliably ablate pancreatic cystic neoplasms (with vid- eo). Gastrointest Endosc 2016;83:914-920.
9. Gelczer RK, Charboneau JW, Hussain S, Brown DL. Complicati- ons of percutaneous ethanol ablation. J Ultrasound Med 1998;17:531-533.
10. Gan SI, Thompson CC, Lauwers GY, Bounds BC, Brugge WR.
Ethanol lavage of pancreatic cystic lesions: initial pilot study.
Gastrointest Endosc 2005;61:746-752.
11. DeWitt J, McGreevy K, Schmidt CM, Brugge WR. EUS-guided ethanol versus saline solution lavage for pancreatic cysts: a randomized, double-blind study. Gastrointest Endosc 2009;70:
710-723.
12. DiMaio CJ, DeWitt JM, Brugge WR. Ablation of pancreatic cystic lesions: the use of multiple endoscopic ultrasound-guided etha- nol lavage sessions. Pancreas 2011;40:664-668.
13. Caillol F, Poincloux L, Bories E, et al. Ethanol lavage of 14 muci- nous cysts of the pancreas: a retrospective study in two tertiary centers. Endosc Ultrasound 2012;1:48-52.
14. Kandula M, Moole H, Cashman M, Volmar FH, Bechtold ML, Puli SR. Success of endoscopic ultrasound-guided ethanol ablation of pancreatic cysts: a meta-analysis and systematic review.
Indian J Gastroenterol 2015;34:193-199.
15. Oh HC, Seo DW, Lee TY, et al. New treatment for cystic tumors of the pancreas: EUS-guided ethanol lavage with paclitaxel injec- tion. Gastrointest Endosc 2008;67:636-642.
16. Oh HC, Seo DW, Song TJ, et al. Endoscopic ultrasonography-guided ethanol lavage with paclitaxel injection treats patients with pancre- atic cysts. Gastroenterology 2011;140:172-179.
17. DeWitt JM, Al-Haddad M, Sherman S, et al. Alterations in cyst fluid genetics following endoscopic ultrasound-guided pancreatic cyst ablation with ethanol and paclitaxel. Endoscopy 2014;46:
457-464.
18. Moyer MT, Dye CE, Sharzehi S, et al. Is alcohol required for effec- tive pancreatic cyst ablation? The prospective randomized CHARM trial pilot study. Endosc Int Open 2016;4:E603-E607.
19. Paiella S, Salvia R, Ramera M, et al. Local ablative strategies for ductal pancreatic cancer (radiofrequency ablation, irreversible electroporation): a review. Gastroenterol Res Pract 2016;2016:
4508376.
20. Signoretti M, Valente R, Repici A, Delle Fave G, Capurso G, Carrara S. Endoscopy-guided ablation of pancreatic lesions:
technical possibilities and clinical outlook. World J Gastrointest Endosc 2017;9:41-54.
21. Pai M, Habib N, Senturk H, et al. Endoscopic ultrasound guided radiofrequency ablation, for pancreatic cystic neoplasms and neuroendocrine tumors. World J Gastrointest Surg 2015;7:52-59.
22. Barthet M, Giovannini M, Lesavre N, et al. UEG week 2017 oral presentations-OP 315: EUS-guided radiofrequency ablation (RFA) for pancreatic neuroendocrine tumor (NET) and pre-malig- nant intraductal pancreatic mucinous tumor (IPMN): first results of prospective multicenter study. United European Gastroenterol J 2017;5(Suppl):A1-A160.
23. Song TJ, Seo DW, Lakhtakia S, et al. Initial experience of
EUS-guided radiofrequency ablation of unresectable pancreatic cancer. Gastrointest Endosc 2016;83:440-443.
24. Choi JH, Lee SH, Kim JS, et al. PBS24-comparison of natural course versus EUS-guided ethanol ablation for pancreatic cystic lesions. Proceedings of the 66th congress of the Korean Society of Gastrointestinal Endoscopy, Seoul, Korea, 2016.
25. Choi JH, Lee SH, Choi YH, et al. PB2-safety and adverse events of EUS-guided ethanol ablation for pancreatic cystic lesions: a single center experience with 188 patients. Proceedings of the 1st Korea Digestive Disease Week (KDDW), Seoul, Korea, 2017.
26. Arcidiacono PG, Carrara S, Reni M, et al. Feasibility and safety of EUS-guided cryothermal ablation in patients with locally ad- vanced pancreatic cancer. Gastrointest Endosc 2012;76:
1142-1151.
27. Chan HH, Nishioka NS, Mino M, et al. EUS-guided photodynamic therapy of the pancreas: a pilot study. Gastrointest Endosc 2004;59:95-99.
28. Yusuf TE, Matthes K, Brugge WR. EUS-guided photodynamic therapy with verteporfin for ablation of normal pancreatic tissue:
a pilot study in a porcine model (with video). Gastrointest Endosc
2008;67:957-961.
29. Choi JH, Oh D, Lee JH, et al. Initial human experience of endo- scopic ultrasound-guided photodynamic therapy with a novel photosensitizer and a flexible laser-light catheter. Endoscopy 2015;47:1035-1038.
30. Di Matteo F, Martino M, Rea R, et al. US-guided application of Nd:YAG laser in porcine pancreatic tissue: an ex vivo study and numerical simulation. Gastrointest Endosc 2013;78:750-755.
31. Di Matteo F, Martino M, Rea R, et al. EUS-guided Nd:YAG laser ablation of normal pancreatic tissue: a pilot study in a pig model.
Gastrointest Endosc 2010;72:358-363.
32. Sofuni A, Moriyasu F, Sano T, et al. Safety trial of high-intensity fo- cused ultrasound therapy for pancreatic cancer. World J Gastroenterol 2014;20:9570-9577.
33. Sung HY, Jung SE, Cho SH, et al. Long-term outcome of high-in- tensity focused ultrasound in advanced pancreatic cancer.
Pancreas 2011;40:1080-1086.
34. Suzuki R, Irisawa A, Bhutani MS. Endoscopic ultrasound-guided oncologic therapy for pancreatic cancer. Diagn Ther Endosc 2013;2013:157581.