106
서 론
위암은 최근 전 세계적으로 감소하는 추세이나 아직까지 암으로 인한 사망의 가장 많은 원인 질환 중의 하나이다.(1) 또한 조기 위암의 경우는 진단 내시경의 발달과 국가적인 선별검사, 건강 검진에 대한 일반인의 관심 증가로 전체 위 암 중 차지하는 비율이 계속 증가하고 있다.(2)
복강경 수술은 1987년 담낭 절제술에 처음 이용되었 다.(3) 이후 전 세계로 퍼져 1990년대에 국내에도 정착되었 는데 절개창이 작아 통증이 적고, 회복이 빠르며, 입원 기간 이 짧고, 미용상 우수하다는 여러 장점들로 인해 최근에는 복강경 담낭 절제술이 담낭 결석 수술의 표준 술식이 되었 다. 이러한 복강경 수술이 위암 환자에 적용된 것은 1992년 3월 Kitano 등(4)이 시행한 복강경 보조하 원위부 위아전절 제술이 최초이다. 그 후 많은 연구자들이 위암 환자에서 복 강경을 이용한 근치적 위절제술이 술기상 가능하다는 것 (4-8)과 후향적 연구이긴 하지만 개복술과 비교한 연구들을 발표하였다.(9-11) 특히 최근에는 위암의 복강경 보조하 위 절제술과 환자의 비만도에 대한 연구(12)와 환자의 삶의 질 에 대한 연구(13)가 이루어지기도 하였다. 하지만 위암 환 자에서 복강경을 이용한 근치적 위절제술에서 합병증을 중 점적으로 한 연구는 드물다.
이에 저자들은 본 교실에서 시행된 위암 환자의 복강경 보조하 위절제술 117예에 대하여 후향적 분석을 통하여 수 술의 안정성을 알아보고자 하였다.
위암 환자의 복강경 보조하 위절제술 117예에 대한 분석
동아대학교 의과대학 외과학교실 및 1서울대학교 분당병원 외과
이태무․권 욱․김민찬․정갑중․김형호1
책임저자:김민찬, 부산광역시 서구 동대신동 3가 1번지 ꂕ 602-714, 동아대학교 의과대학 외과학교실 Tel: 051-240-5146, 2596, Fax: 051-247-9316 E-mail: mckim@donga.ac.kr
접수일:2004년 3월 8일, 게재승인일:2004년 5월 17일
Operative Outcome of Laparoscopy-assisted Gastrectomy with Lymph Node Dissection in 117 Consecutive Patients with Gastric Cancer:
A Single-center Experience
Tae-Mu Lee, M.D., Yuk Kwon, M.D., Min-Chan Kim, M.D., Ghap-Joong Jung, M.D. and Hyung-Ho Kim1
Purpose: The aim of this study was to determine the feasibility and safety of laparoscopy-assisted gastrectomy (LAG) with lymph node dissection for gastric cancer according to the analysis of postoperative complications.
Methods: The authors attempted LAG with lymph node dissection in 117 consecutive patients with gastric cancer.
The clinicopathologic characteristics of the patients, operative outcomes, preoperative comorbidities and postoperative morbidities and mortalities were evaluated using the stomach cancer database of Dong-A university hospital and medical charts.
Results: Among the 114 successful patients, 100 had early gastric cancer and 14 had advanced gastric cancer. The mean operation time was 259.2 minutes (range 150∼415).
The mean number of retrieved lymph nodes was 23.4 (range 6∼66). The mean time to the first flatus and postoperative hospital stay were 3.7 and 10.0 days, respectively. The overall operative mortality rate, hospital death rate and the overall rate of postoperative complications were 0, 1.7 and 14.7%, respectively. The major and minor complication rate were 4.3 and 10.4%, respectively.
Conclusion: LAG with lymph node dissection is technically feasible and receptive as surgical treatment for patients with gastric cancer, although various postoperative complications can arise in LAG as they do in open gastrectomy. (J Korean Surg Soc 2004;67:106-111)
Key Words: Gastric cancer, Laparoscopy-assisted gastrec- tomy, Lymph node dissection, Postoperative morbidity
중심 단어: 위암, 복강경 보조하 위절제술, 림프절 곽 청술, 수술 후 합병증
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ Departments of Surgery, Dong-A University College of Med- icine, Busan and 1Seoul National University, Bundang Hos- pital, Gyeonggi-do, Korea
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
방 법
1998년 5월에서부터 2004년 1월까지 동아대학교병원 외 과에서 위암으로 복강경 보조하 위절제술을 시행받은 117 명을 대상으로 하였다. 본 교실은 2002년부터 위암 테이터 베이스를 구축하였으므로 2002년 1월에서 2004년 1월까지 의 95명은 테이터 베이스의 자료를 통해 분석이 이루어졌 고 그 이전 환자 22명은 후향적으로 환자의 의무기록을 조 사하였다. 저자들은 이 수술의 적응을 2002년까지는 수술 전 병기 조사에서 점막암이나 점막하암으로 하였고 2003년 부터는 조기 위암과 크기가 3 cm가 넘지 않은 고유 근육층 (proper muscular layer, T2)까지로 하였다.
임상 병리학적 인자로서 나이, 성별, T category, N cate- gory, 술 전 내시경 초음파 검사의 정확성 등을 조사하였으 며 수술과 관련된 결과들로서는 개복술 전환빈도, 수술의 형태, 재건술, 근치도, 수술 시간, 절제된 림프절 수, 수혈 받은 환자 수, 가스배출 시간, 술 후 입원 기간 등을 조사하 였고 그 외 환자들의 술 전 동반 질환과 술 후 합병증을 조 사하였다.
1) 위아전절제술의 술기
환자는 전신 마취 하에 두 다리를 벌린 절석술(lithotomy) 자세로 하여 술자는 환자의 오른편에 제1조수는 환자의 왼 편에 위치하고 제2조수는 다리 사이에 서서 복강경 카메라 를 조작하였다. 카메라 투관침은 하손방법(open technique) 으로 주로 배꼽 아래에 거치하고 환자의 복부 오른편에 12 mm와 5 mm 투관침 두 개를 왼편에 12 mm와 10 mm
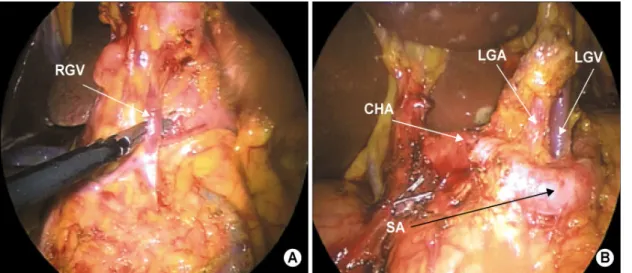
투관침 두 개를 복강경의 도움을 받아 각각 거치시켰다. 처 음 복강경은 25도를 이용하였고 림프절 7, 8a, 9번을 절제할 때 50도로 바꾸어 사용하였다. 이산화탄소를 이용한 기복 압은 환자의 동반 질환 유무와 수술 중 ETCO2의 수치, 수술 공간 확보를 고려하여 10∼14 mmHg로 조절하였으며 위대 망혈관으로부터 4 cm 가량 떨어져 복강경용 지혈기구(The LigasureTM Vessel Sealing System, Valleylab, Boulder, Colo- rado, USA)를 이용하여 대망을 절제하여 비장의 하극까지 이르러 좌위대망 동정맥을 근위부에서 절단하였다. 림프절 4sb (좌위대망 동정맥)을 위의 대만곡(greater curvature)에서 ultrasonic dissector (Autosonix, Tyco/US Surgical Inc., Norwalk, CT)을 이용하여 분리시켰다. 그 후 우위대망 동정 맥을 근위부에서 확인하고(Fig. 1A) 각각 이중 clips 후 절단 하였다. 림프절 6번을 십이지장에서 ultrasonic dissector을 이 용하여 분리시켰다. 우위동맥을 확인하고 소낭(lesser sac)을 연 뒤 복강경 자동문합기(Endo cutter 45 staple; Ethicon, Ohio, USA)를 이용하여 유문 하부 1 cm에서 십이지장을 절 단한다. 우위동맥을 근위부에서 처리하고 림프절 8번과 9 번을 절제하고 좌위정맥(left gastric vein)을 확인하여 clip하 여 자르고 좌위동맥을 이중 cilps하고 자른다(Fig. 1B). 때때 로 림프절 11p, 12a, 8p, 14v를 절제하기도 하였다. 좌위동맥 을 자른 후 근위부를 향하여 위식도연결부까지 위의 소만 에 있는 림프절을 절제한다. 복부 절개는 흉골절흔(sternal notch)에서 약 손가락 세 마디 하방의 복부 정중선에서 시작 하여 B-I 재건술인 경우는 오른쪽으로 5 cm, B-II 재건술인 경우는 약 1ccm 더 하방에서 왼쪽으로 5 cm 시행하였다.
절개창을 통하여 위를 끄집어내어 자동 문합기(Proximate linear cutter 100 mm; Ethicon, Ohio, USA)를 이용하여 위를
Fig. 1. Intraoperative findings of laparoscopy-assisted gastrectomy (LAG) with lymph node dissection for gastric cancer (A) Right gastroepiploic vein (RGV) is identified. (B) After no. 8 and 11p lymph nodes were dissected, the common hepatic artery (CHA), splenic artery (SA), left gastric artery (LGA) and vein (LGV) were exposed.
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ 절제하고 B-I 재건술은 원형자동문합기(Proximate CDH 25;
Ethicon, Ohio, USA)을 이용하여 위십이지장 문합을 시행하 였으며 B-II 재건술은 복강경 자동 문합기(Endo cutter 45 staple; Ethicon, Ohio, USA) 2개를 이용하여 위공장문합술과 공장공장 문합술을 각각 시행하였다. 복부 절개창을 닫고 복강경하에서 출혈 여부를 확인한 후 폐쇄형 배액관 하나 를 문합부 주위에 거치시켰다.
2) 수술 전후 관리
초기 환자들을 제외하고 대부분의 환자들은 수술 후 표 준화된 관리로 치료되었는데 술 전 비위관 삽입과 장세척 을 시행하지 않았고 수술 중 위 내용물의 배출을 최소화하 였으며 배액관은 폐쇄형으로 위아전절제술에서는 하나, 위 전절제술에서는 두 개를 각각 문합부 주위에 삽입하였다.
또한 수술 후 48시간부터 소량의 물을 섭취하게 하였고 가 스배출 후 식이를 시작하였으며 수술 후 혈색소 수치가 8 g/dl 이상이고 빈혈에 대한 증상이 없으면 수혈은 시행하지 않았다. 모든 환자는 자가통증 조절장치를 이용하여 경막 외 혹은 정맥을 통해 수술 후 3일간 통증을 조절하였고 그 이후에는 2일간의 정맥 진통제를 하루 2회 투여하였으며 식이가 원만함에 따라 경구 진통제로 전환하였다.
결 과
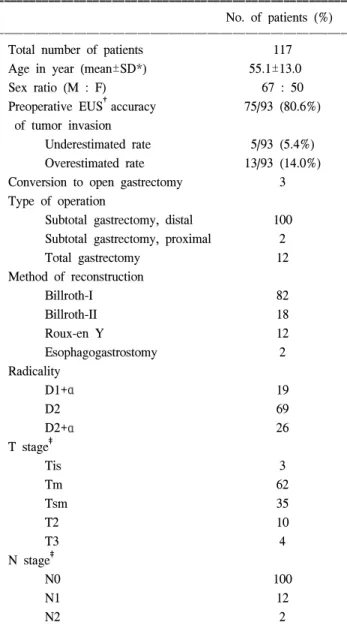
연도별 수술 건수를 살펴보면 1998년과 1999년에는 각각 1명과 2명이었고, 2000년과 2001년에 각각 3명과 16명이었 으며 총 117명 중 2002년 이후 95명이었다(Fig. 2). 임상병리 학적 인자들(Table 1) 가운데 T category를 보면 114명 중 조 기 위암 100명, 진행성 위암이 14명이었다. 수술 전 내시경 초음파는 93명에서 시행되었는데 진단 정확도가 80.6%이 었고 과평가율은 14.0%, 저평가율은 5.4%로 나타나 복강경 보조하 위절제술의 측면에서 내시경 초음파는 유용한 술
전 검사였다. 복강경 보조하 위절제술이 시도된 117명 가운 데 3명이 수술 중 개복술로 전환되었는데 2명은 과다한 복 강 내 비만이 원인이었고 1명은 복강 내 유착이 원인이었 다. 수술 결과들(Table 2)을 살펴보면 수술 시간은 평균 259.2분으로 최소 150분에서 최대 415분까지 소요되었고 제거된 림프절수의 평균은 23.4개였고, 이는 수술 근치도 (radicality)에 따라 비례하였는데 D1+α가 시행된 환자에서 평균 15.6개, D2와 D2+α에서는 각각 평균 24.9개와 25.0개 이었다. 수술 후 환자는 대부분 6일 혹은 7일째 퇴원하였으 며 합병증이 있었던 환자까지 포함한 평균 술 후 입원 기간 은 10.0일이었다. 수술 전 동반 질환은 심혈관 질환이 12명 으로 가장 많았으며 내분비질환, 폐질환, 위장관질환 순이
Fig. 2. Distribution of patients classified by year.
Table 1. Clinicopathologic characteristics
ꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚ No. of patients (%) ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Total number of patients 117
Age in year (mean±SD*) 55.1±13.0
Sex ratio (M : F) 67 : 50
Preoperative EUS†accuracy 75/93 (80.6%) of tumor invasion
Underestimated rate 5/93 (5.4%)
Overestimated rate 13/93 (14.0%) Conversion to open gastrectomy 3 Type of operation
Subtotal gastrectomy, distal 100 Subtotal gastrectomy, proximal 2
Total gastrectomy 12
Method of reconstruction
Billroth-I 82
Billroth-II 18
Roux-en Y 12
Esophagogastrostomy 2
Radicality
D1+α 19
D2 69
D2+α 26
T stage‡
Tis 3
Tm 62
Tsm 35
T2 10
T3 4
N stage‡
N0 100
N1 12
N2 2
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
*SD = standard deviation; †ESU = endoscopic ultrasonography;
‡ = successful 114 patients.
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
었다(Table 3).
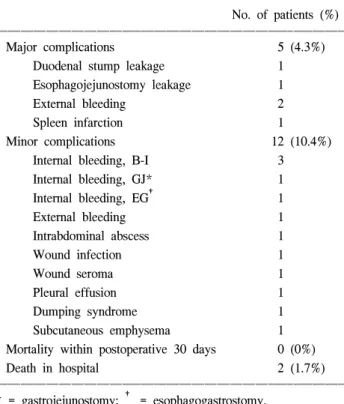
수술 후 합병증(Table 4)은 17명(14.7%)에서 발생하였는데 재수술이 필요하였던 대합병증은 5명(4.3%)이었고 보존적 치료로 회복된 소합병증은 12명(10.4%)이었다. 재수술은 십 이지장 단단부 누출 1명, 식도공장 문합부 누출 1명, 복강 내 출혈 2명 그리고 비장 경색 1명 등 총 5명에서 시행되었 다. 이 중 복강 내 출혈이 있었던 환자는 여러 번의 재수술 로 인하여 다발성 장기부전과 폐혈증으로 첫 수술 후 510일 만에 병원에서 사망하였으며 비장 경색이 있었던 환자는 위아전절제술(B-II)을 시행하였던 자로 재수술 시 위전절제 술을 시행하였고 수술 후 폐부전으로 기관지절개술 후 호 흡기 치료 도중 기도 폐색으로 술 후 44일 만에 사망하였다.
그 외 3명의 환자들은 재수술 후 회복되어 각각 술 후 23일, 45일, 50일 만에 퇴원하였다. 소합병증은 대부분 개복 위절 제술에 발생하는 다양한 합병증들이 발생하였는데 문합부 출혈이 5명에서 발생하여 그중 B-I 문합부 출혈 3명은 내시 경적 치료로 출혈이 조절되었고 B-II문합부와 근위부 위아 전절제술 후 식도위문합부의 출혈이 있었던 2명은 혈변과 혈색소 감소로 문합부 출혈을 의심하여 내시경 검사를 시 행하였으나 이미 출혈은 멈춰 있어 더 이상의 치료는 필요 하지 않았다. 복부 절개창의 감염이 1명에서 있었는데 이 환자는 심한 천식으로 수술 전후로 스테로이드가 투여되었 던 환자였다. 75세 여자 환자 1명에서는 배꼽 투관침으로 이산화탄소의 피부하 누출이 있어 얼굴과 목, 상반신에 전 반적인 피하기종이 발생하였다. 그러나 개복술로의 전환 없이 수술을 마쳤으며 수술 후 보조적 치료로 회복되어 술 후 7일 만에 퇴원하였다.
고 찰
최근 국내에서는 정책적인 선별검사와 정기 건강 검진에 대한 국민들의 인식 변화에 따라 조기 위암의 발생 빈도가 지속적으로 늘어나 본 교실의 경우 2002년과 2003년에 444 명의 위암 환자가 수술을 받았는데 그중 조기 위암은 209명 (47.1%)이었다. 이러한 상황 가운데 많은 외과 의사들이 복 강경 위 수술에 많은 관심을 가지고 있으나 현실적으로 고 가의 복강경 장비와 술 후 합병증 발생의 우려로 인하여 섣불리 시작하지 못하고 있다.
위암에서 복강경 혹은 보조하 위절제술의 적응증은 대부 분 조기 위암이다. 그러나 Adachi 등(14)은 4 cm 이하의 고 유 근육층(proper muscular layer, T2)까지 복강경 수술에 적 응이 될 수 있다고 제시하였고 Tanimura 등(15)은 크기에 상관없이 고유 근육층(proper muscular layer, T2)까지 복강 경 수술의 적응으로 삼아 160명의 결과를 보고하였다. 저자 들은 2003년부터 3 cm 이하의 고유 근육 층 위암까지 적응 증을 삼고 있다.
복강경 혹은 복강경 보조하 위절제술에 대한 연구들은 주로 소수의 환자에서 위암의 여러 종류의 개복 위절제술 술기들이 복강경에서도 가능하다는 점에서 이루어졌다.
그 외에 후향적으로 개복 위절제술과 비교한 연구들이 있 고(9-11) 50예 이하의 복강경 보조하 위절제술의 분석이 세 Table 2. Operative outcomes in successful 114 cases
ꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚ Operation time (minute) 259.2 (150∼415) Retrieved LN number 23.4 (6∼66) Number of transfused patients (%) 26/114 (22.8%) Time to first flatus (day) 3.7 (1∼7) Postoperative hospital stay (day) 10.0* (4∼50) ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
* = excluded two deaths in hospital. Values are mean (range).
Table 3. Preoperative comorbidities
ꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚ No. of patients (%) ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Cardiovascular disease 12 (10.5%)
Endocrinologic disease 5 (4.4%)
Pulmonary disease 3 (2.6%)
Gastrointestinal disease 3 (2.6%)
Musculoskeletal disease 2 (1.8%)
Others 4 (3.5%)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Table 4. Postoperative morbidity and motality ꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚꠚ
No. of patients (%) ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Major complications 5 (4.3%)
Duodenal stump leakage 1
Esophagojejunostomy leakage 1
External bleeding 2
Spleen infarction 1
Minor complications 12 (10.4%)
Internal bleeding, B-I 3
Internal bleeding, GJ* 1
Internal bleeding, EG† 1
External bleeding 1
Intrabdominal abscess 1
Wound infection 1
Wound seroma 1
Pleural effusion 1
Dumping syndrome 1
Subcutaneous emphysema 1
Mortality within postoperative 30 days 0 (0%)
Death in hospital 2 (1.7%)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
* = gastrojejunostomy; † = esophagogastrostomy.
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ 편이 있으나 합병증에 대한 언급은 미비하다.(2,13,16) 2003
년에 들어와 Tanimura 등(15)은 hand-assisted laparoscopic surgery (103예)와 totally laparoscopic gastrectomy (57예)에 대한 결과를 보고하였는데 합병증으로는 문합부 누출이 2명, 췌장 누출이 4명이었다고 보고하였다. Noshiro 등(12) 은 환자의 과체중이 복강경 위 수술에 미치는 영향에 관하 여 과체중 환자는 복강경 보조하 위절제술 시행 시 수술 시간이 많이 걸리고 장운동의 회복이 늦다고 보고하였고 합병증은 문합부 누출이 3명, 복강 내 농양이 5명 그리고 술 후 출혈이 1명이었다. 국내에서는 2002년 이 등(17)이 위 암 환자 26명에서 복강경 보조하 위절제술과 hand-assisted laparoscopic surgery을 시행하여 보고하였는데 합병증은 장 피누공 1명과 위무력(gastric atony) 1명이었다.
복강경 혹은 복강경 보조 위절제술의 수술 후 합병증과 사망률을 개복 위절제술의 결과들과 비교하여 보면 최근 유럽에서 시행된 전향적 연구들(18-20)의 술 후 합병증 발 생률과 사망률이 각각 25∼46%와 4∼13%였고 또 다른 연 구(21)인 996명의 환자들에서는 D2 림프절 절제술이 D1 림 프절 절제술보다 술 후 합병증 발생률과 사망률이 높게 나 타났는데 각 군에서 합병증 발생률은 각각 43%와 25%, 사 망률은 각각 10%와 4%로 나타났다. 그에 반해 일본(22)에 서는 술 후 합병증 발생률과 사망률 그리고 병원 내 사망률 이 각각 10.2%, 1.2% 그리고 2.0%로 유럽의 수술 성적과는 큰 차이를 보이고 있다. 본 연구의 술 후 합병증 발생률과 사망률 그리고 병원 내 사망률은 각각 14.7%, 0% 그리고 1.7%로 이러한 결과는 유럽에서 시행된 D1 림프절 절제술 군 보다 좋은 성적이며 일본의 D2 림프절 절제술 군의 성적 과 거의 유사함을 알 수 있다. 또한 본 교실에서 시행된 개 복 위절제술과 비교하여 보면 2002년과 2003년 동안 총 444 명의 위암 수술 환자들 중 복강경 보조하 위절제술을 시행 했던 2명의 술자가 시행한 근치적 개복 위절제술 310명에 서 대합병증과 소합병증 발생률, 술 후 사망률은 각각 2.3%, 19.0% 그리고 0.7%이었다. 복강경 환자들의 성적(4.3%, 10.4%, 0%)과 비교하면 대합병증은 개복 위절제술 310명 중 7명(2.3%), 복강경 보조하 위절제술은 114명 중 5명 (4.3%)으로 통계학적으로 차이가 없었고(P=0.32, Fisher's exact test) 소합병증은 개복 위절제술은 310명 중 59명 (19.0%), 복강경 보조하 위절제술은 114명 중 12명(10.4%)으 로 통계학적으로 의미가 있게(P<0.05, Fisher's exact test) 복 강경 보조하 위절제술을 시행 받은 환자에서 적게 발생하 였다. 이러한 결과는 수술 후 입원 기간에 영향을 미쳐 개복 위절제술 환자들의 평균 12.1일에 비하여 복강경 보조하 위 절제술 환자는 평균 10.0일로 나타나(P<0.01, unpaired t test) 조기 퇴원이 가능하였다. 술 후 사망률은 차이가 없었다.
복강경 보조하 위 절제술이 시행된 114명의 추적 기간은 15개월(2∼70개월)로 2명을 제외하고 재발이나 전이 소견 없이 생존하여 있었다. 술 후 2명이 사망하였는데 한 명은
복강경 보조하 근치적 위전절제술을 시행 받은 남자로 최 종 병리조직검사상 T3N1M0 (stage IIIa)이었으며 양성 림프 절은 5개로 모두 위 주위림프절(N1)이었다. 이 환자는 술 후 9개월에 다발성 골전이가 발견되어 항암 치료를 권유하 였으나 모든 치료를 거부하고 지내다 술 후 10개월에 사망 하였다. 또 다른 한명은 복강경 보조하 근치적 위전절제술 을 시행 받은 여자로 최종 병리조직검사상 T2N0M0 (stage Ib)이었다. 수술 후 8개월째 시행한 검사상 전이나 재발의 증거는 없었으나 원인 미상의 사망 상태로 응급실로 내원 하였다.
결 론
위암 환자에 있어서 복강경 보조하 위절제술은 기술적인 면과 수술 후 합병증적인 면을 고려하여 볼 때 충분히 가능 한 술기이지만 개복 위절제술에서 생길 수 있는 다양한 합 병증이 유발되므로 세심한 수술과 함께 복강경 수술 전반 에 걸친 이해가 요구되는 술기라고 생각된다. 향후 다기관 전향적 연구를 통하여 개복 위절제술과의 비교 연구가 필 요할 것으로 생각된다.
REFERENCES
1) van de Velde CJ, Peeters KC. The gastric cancer treatment controversy. J Clin Oncol 2003;21:2234-6.
2) Asao T, Hosouchi Y, Nakabayashi T, Haga N, Mochiki E, Kuwano H. Laparoscopically assisted total or distal gastrec- tomy with lymph node dissection for early gastric cancer. Br J Surg 2001;88:128-32.
3) Chekan EG, Pappas TN. Minimally invasive surgery. In:
Townsend CM, Beauchamp RD, Evers BM, Mattox KL, ed.
Sabiston Textbook of surgery. 16th ed. Philadelphia: WB Saunders 2001:209-310.
4) Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy- assisted Billroth I gastrectomy. Surg Laparosc Endosc 1994;
4:146-8.
5) Kitano S, Shimoda K, Miyahara M, Shiraishi N, Bandoh T, Yoshida T, et al. Laparoscopic approaches in the management of patients with early gastric carcinomas. Surg Laparosc Endosc 1995;5:359-62.
6) Ballesta-Lopez C, Bastida-Vila X, Catarci M, Mato R, Ruggiero R. Laparoscopic Billroth II distal subtotal gastrectomy with gastric stump suspension for gastric malignancies. Am J Surg 1996;171:289-92.
7) Uyama I, Sugioka A, Fujita J, Komori Y, Matsui H, Soga R, et al. Completely laparoscopic extraperigastric lymph node dissection for gastric malignancies located in the middle or lower third of the stomach. Gastric Cancer 1999;2:186-90.
8) Tanimura S, Higashino M, Fukunaga Y, Osugi H. Laparos-
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ copic gastrectomy with regional lymph node dissection for
upper gastric cancer. Gastric Cancer 2003;6:64-8.
9) Adachi Y, Shiraishi N, Shiromizu A, Bandoh T, Aramaki M, Kitano S. Laparoscopy-assisted Billroth I gastrectomy com- pared with conventional open gastrectomy. Arch Surg 2000;
135:806-10.
10) Reyes CD, Weber KJ, Gagner M, Divino CM. Laparoscopic vs open gastrectomy. A retrospective review. Surg Endosc 2001;15:928-31.
11) Weber KJ, Reyes CD, Gagner M, Divino CM. Comparison of laparoscopic and open gastrectomy for malignant disease. Surg Endosc 2003;17:968-71.
12) Noshiro H, Shimizu S, Nagai E, Ohuchida K, Tanaka M.
Laparoscopy-assisted distal gastrectomy for early gastric can- cer: is it beneficial for patients of heavier weight? Ann Surg 2003;238:680-5.
13) Adachi Y, Suematsu T, Shiraishi N, Katsuta T, Morimoto A, Kitano S, et al. Quality of life after laparoscopy- assisted Billroth I gastrectomy. Ann Surg 1999;229:49-54.
14) Adachi Y, Oshiro T, Mori M, Maehara Y, Sugimachi K.
Tumor size as a simple prognostic indicator for gastric carci- noma. Ann Surg Oncol 1997;4:137-40.
15) Tanimura S, Higashino M, Fukunaga Y, Osugi H. Laparos- copic distal gastrectomy with regional lymph node dissection for gastric cancer. Surg Endosc 2003;17:758-62.
16) Shiraishi N, Adachi Y, Kitano S, Bandoh T, Katsuta T, Mor-
imoto A. Indication for and outcome of laparoscopy- assisted Billroth I gastrectomy. Br J Surg 1999;86:541-4.
17) Lee NJ, Kim YW, Han HS. Laparoscopy-assisted Billroth I gastrectomy compared with Hand-assisted laparoscopic sur- gery for early gastric cancer- A prospective study-. J Korean Surg Soc 2002;62:57-63
18) Cuschieri A, Fayers P, Fielding J, Craven J, Bancewicz J, Joypaul V, et al. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomized controlled surgical trial. Lancet 1996;
347:995-9.
19) Bonenkamp JJ, Hermans J, Sasako M, van de Velde CJH, Dutch Gastric Cancer Group. Extended lymph-node dissection for gastric cancer. New Engl J Med 1999;340:908-14.
20) Cuschieri A, Weeden S, Fielding J, Bancewicz J, Craven J, Joypaul V, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Br J Cancer 1999;79:1522-30.
21) Bonenkamp JJ, Songun I, Hermans J, Sasako M, Welvaart K, Plukker JTM, et al. Radomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients.
Lancet 1995;345:745-8.
22) Moriwaki Y, Kobayashi S, Kunisaki C, Harada H, Imai S, Kasaoka C. Is D2 lymphadenectomy in gastrectomy safe with regard to the skill of the operator? Dig Surg 2001;18:111-7.