대한소화기학회지 1999;33:97 - 103
1)
접수: 1998년 3월 31일, 승인: 1998년 5월 23일
연락처: 김해련, 138-736, 서울시 송파구 풍납동 388-1, 서울중앙병원 내과 Tel: (02) 2224-3180, Fax: (02) 476-0824
※ 본 연구는 1997년도 아산생명과학연구소 연구비 지원으로 이루어졌음.
췌장 Mu cin ou s Du ct a l E ct a s ia 에서 점액유전자 관련 항원 발현에 관한 연구
울산대학교 의과대학 서울중앙병원 내과학교실, 진단병리학교실*
김해련・김명환・이경아・박소영*・유은실*・민영일
Im m u n o h i s t o c h e m i c a l S t u d y o f Mu c i n G e n e As s o c i a t e d An t i g e n s i n Mu c i n o u s D u c t a l E c t a s i a
H a e Ry u n Kim , M.D., Myu n g H w a n Ki m , M.D., Kyu n g Ah Le e , M.D., S o Yo u n g P a rk , M.D.*, E u n S i l Yu , M.D.* a nd Yo u n g Il Mi n , M.D.
Departments of Internal Medicine and Pathology*,
University of Ulsan College of Medicine, Asan Medical Center, Seoul, Korea
Background/Aims: Mucinous ductal ectasia (MDE) of the pancreas is defined as diffuse dilatation
of pancreatic duct with extrusion of mucin through patulous papilla of Vater. However, the histologic spectrum of MDE is various to include hyperplasia, adenoma and adenocarcinoma. Mucins are high molecular weight glycoproteins. Aberrant and incomplete glycosylations of mucin have been described in cancer. In the present study, we investigated the expression of six different mucin gene in MDE and compared the expression with that in other types of pancreatic disease. Methods:Surgically resected specimens were stained using streptavidin-peroxidase immunohistochemical techniques with following antibodies: Mab JT10e (sTn), Mab 91S8 (Tn), Mab SNH3 (sLex), Mab 139H2 (MUC1), polyclonal anti-MRP (MUC2) and anti-M3P (MUC3). Results: In normal pancreas MUC1 antigen was expressed in the ductal epithelium and acini. MUC2 antigen was expressed only in acinar cells, while Tn, sTn, sLex and MUC3 antigens were not expressed. In MDE, Tn, sTn and sLex antibodies did not stain hyperplastic tissue but stained tumor cells of adenoma and adenocarcinoma with MDE. The expression of MUC 1, 2, and 3 showed striking contrast between MDE and ductal adenocarcinoma. Conclusions: The results from this study suggest that the expression of mucin gene is related to histologic spectrum and biological behavior of pancreatic tumor. (Kor J Gastroenterol 1999;33:97 - 103)
Key Words: Pancreas, Mucinous ductal ectasia, Mucin gene, Immunohistochemical staining
98 대한소화기학회지 : 제 33 권 제 1 호 1999
서 론
췌장에서 점액을 분비하는 종양성 병변인 muci- nous ductal ectasia (MDE)는 점액성 낭포선종(mu- cinous cystadenoma)이나 낭포선암(mucinous cysta- deno-carcinoma)과는 다른 독특한 십이지장경 소견 과 췌관조영 소견을 보이는데 그 용어가 나타내듯이 점액(mucin)을 과분비하며 이로 인한 췌관의 확장이 관찰되는 질환이다. 그러나 원인 질환은 병리조직학 적으로 과형성(hyperplasia)에서부터 선종(adenoma), 선암에 이르기까지 다양하다. 암의 전구병변(prema- lignant lesion)으로 여겨지는 특성이 있으며 선암으 로 밝혀지더라도 일반적인 췌관암(pancreatic ductal carcinoma)에 비하여 예후가 좋은 것으로 알려져 있 다.1,2 소화기관 점막, 호흡기 점막 등에서 분비되는 고분자량의 당단백인 점액은 이들 기관이 병적인 상 태로 변하면 점액의 생성과 분비에 변화가 나타날 뿐만 아니라 조직 특이적인 점액유전자 발현도 나타 난다고 한다.3-7 췌장암은 조기 발견이 어려우며 예 후가 매우 나쁘고 양성 질환과 악성의 감별이 힘든 경우가 많다. CA 19-9,8-10 DU-PAN-2,11 Y Panc-1 등 12과 같은 여러 종류의 췌장암 관련 항원이 점액에 존재하고 이들은 모두 탄수화물 특이항원이다. 그러 나 여러 가지 췌장 질환에서 점액 탄수화물 특이항 원인 Tn, sialosyl-Tn (sTn), sialyl-Lex (sLex)의 발현 에 대해서는 알려진 바 없으며 특히 췌장 질환에서 의 여러 점액 유전자 발현 양상에 대한 보고는 매우 드물다. 이에 본 연구에서는 췌장의 MDE를 대상으 로 하여 3가지 점액당 항원(Tn, sTn, sLex)과 3가지 점액 단백질(apomucin) 관련 항원(MUC1, 2, 3)의 면 역조직학적 발현을 살펴보고 이를 정상 췌장조직, 만성 췌장염, 점액성 낭포선암 및 췌관암과 비교함 으로써 MDE의 과형성-선종-선암 변환 과정에 따른 점액 유전자 발현의 변화를 알아보고자 하였다. 또 통상의 췌관암과 달리 좋은 예후를 보이는 MDE 선 암에서 이들 항원의 발현 양상을 비교하여 점액유전 자 관련 항원의 발현이 췌장 종양의 생물학적 행태 와 연관이 있는지 알아보고자 하였다.
대상 및 방법
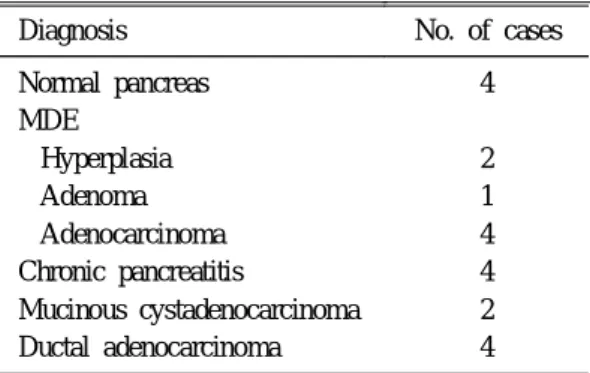
1. 대 상( T a ble 1)
1994년 1월부터 1996년 4월까지 서울중앙병원에 서 외과적 췌장절제술을 받았던 환자 중 내시경적 역행성 췌관 조영술(endoscopic retrograde pancreato- graphy; ERP로 약함)과 조직병리 검사에서 MDE에 합당한 소견13-18을 보이는 7예를 대상으로 하였다.
이들의 십이지장경 소견은 전 예에서 유두 개구부가 벌어져 있으며 다량의 점액이 흘러나오는 것이 육안 으로 보이면서 ERP에서 췌관 확장이 관찰되었다.
MDE는 과형성 2예, 선종 1예, 선암 4예로 모두 7예 였는데 남자 6명, 여자 1명이었고 평균 나이는 58세 (40-72)였다. 정상 췌장 4예, 만성 췌장염 4예, 점액 성 낭포선암 2예, 췌관암 4예를 선택하여 대상에 포 함시켰는데 정상 췌장조직은 간외담도암으로 휘플 수술을 받았던 환자 중 췌장 침습이 없었던 환자들 로부터 얻었다.
2. 방 법 1) 조직 표본
수술로 얻은 췌장 조직을 포르말린에 고정한 후 만들어진 파라핀에 포매한 조직에서 5 μm 두께로 박절한 절편을 슬라이드에 부착시킨 후 통상적인 헤 마톡실린-에오진 염색과 면역조직 화학적 염색을 시행하였다.
Table 1. Histologic Diagnosis of Cases
Diagnosis No. of cases Normal pancreas
MDE Hyperplasia Adenoma Adenocarcinoma Chronic pancreatitis
Mucinous cystadenocarcinoma Ductal adenocarcinoma
4 2 1 4 4 2 4 MDE, mucinous ductal ectasia.
김해련 외 5인. 췌장 Mucinous Ductal Ectasia에서의 점액유전자 관련 항원 발현 99
2) 항체(T a ble 2)
1차 항체로는 비교적 초기 당화 과정에서 나타나 는 Tn,19 sTn7 항원과 혈액형 관련 항원인 sLex 항원 20에 대한 항체와 점액단백질 관련 항원 중 유방형 (mammary)인 MUC1,21 장형인 MUC2,22 MUC323 항 원에 대한 항체를 사용하였다.
3) 면역조직 화학적 염색
Streptavidine peroxidase 방법을 이용하였는데 간 단하게 요약하면 다음과 같다. 조직 절편을 poly-D- lysine-coated slide에 부착시킨 후 xylol에 넣어 탈파 라핀화하고 알콜에 세척하여 함수화시켰다. 3%
H2O2에 10분간 담궈 내인성 peroxidase 활성을 제거 하고 1차 항체의 비특이적 결합을 억제하기 위하여 정상 염소나 토끼 혈청을 작용시킨 후 1차 항체와
반응시켰다. 1시간 후 biotinylated 2차 항체 용액과 30분 동안 반응시키고 다시 avidin-biotin-peroxidase complex (Dako Co.)와 반응시켰다. Diaminoben- zidine 용액으로 발색 반응을 일으킨 후 헤마톡실린 으로 반대 염색하였다. 대조군으로는 각각의 경우마 다 1차 항체 대신 정상 생쥐 혈청을 사용하였으며 나머지 과정은 모두 동일하게 시행하였다.
4) 염색 결과 판독
전체 병소 면적의 5% 이상에서 면역 염색이 관찰 되는 경우를 양성으로 하였다. 광학현미경 저배율 (100배)에서 매우 선명한 염색상을 보이면(+++), 겨 우 판독 가능한 염색상을 보이면(+), 그 중간을(++) 로 판정하였다.
Table 2. Mucin Core Peptide and Carbohydrate Antigens
Antigens Name Type Specificity Positive control MUC1
MUC2 MUC3 Tn Sialosyl-Tn Sialosyl-Lex
139H2 MRP M3P 91S8 JT10e SNH3
Mouse mAb Rabbit pAb Rabbit pAb Mouse mAb Mouse mAb Mouse mAb
MUC1 core protein
Synthetic MUC2 tandem repeat peptide Synthetic MUC3 tandem repeat peptide GalNAc-R
Sia -2, 6 GalNAc-R
Sia -3 Galβ4 (Fuc -3) GlcNAc-R
Breast cancer Normal colon
Normal small intestine Colon cancer
Colon cancer Colon cancer
mAb, monoclonol antibody; pAb, polyclonal antibody; GlcNAc, N-acetylglucosamine; GalNAc, N- acetylgalactosamine; Sia, sialic acid; Gal, galactose; Fuc, fucose.
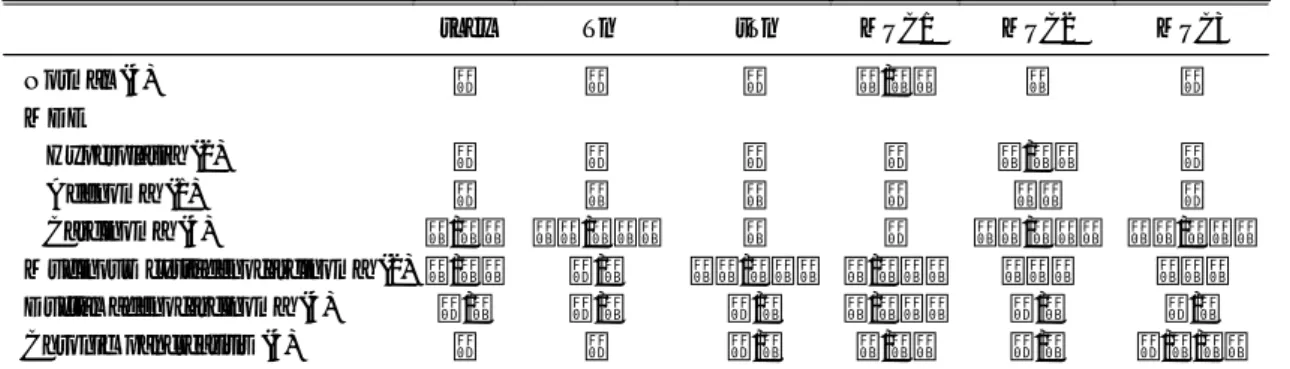
Table 3. Immunohistochemical Expression of Mucin Antigen
sLex Tn sTn MUC1 MUC2 MUC3 Normal (4)
MDE
Hyperplasia (2) Adenoma (1) Carcinoma (4)
Mucinous cystadenocarcinoma (2) Ductal adenocarcinoma (4) Chronic pancreatitis (4)
-
-
-
+/++
+/++
-/+
-
-
-
+
++/+++
-/+
-/+
-
-
-
+
+
++/+++
-/+
-/+
+/++
-
-
-
+/+++
+/+++
+/++
+
+/++
++
++/+++
+++
-/+
-/+
-
-
-
++/+++
+++
-/+
-/+/++
Number in parenthesis indicates number of cases. MDE, mucinous ductal ectasia.
100 The Korean Journal of Gastroenterology : Vol. 33, No. 1, 1999
결 과(Table 3)
1. 정상 췌장조직에서의 점액 유전자 항원 발현 MUC1 항원은 정상 췌장의 췌관 상피세포와 포도 상선세포에서 발현되었고 MUC2항원은 포도상선세 포와 소포세포에서 나타났으나 Tn, sTn, sLex 및 MUC3 항원은 전혀 발현되지 않았다.
2. M DE 에서의 점액유전자 항원 발현 Tn, sTn, sLex 항원은 과형성 MDE에서는 발현되 지 않았으나 선암 MDE에서는 강하게 발현하였고 선종 MDE에서는 그 중간 단계의 발현 양상을 보였 다. MUC1 유전자 항원에 대한 염색은 모두 음성이 었으나 MUC2 유전자 항원에 대한 염색은 과형성, 선종, 선암 모두 강한 양성 반응을 나타냈으며
MUC3 유전자 항원에 대한 반응은 MDE 선암에서 만 양성을 보였다(Fig. 1).
3. 췌관암에서의 점액유전자 항원 발현 Tn, sTn, sLex 항원은 췌관암 4예 중 2예(50%)에 서 약한 양성 반응을 보였다. MUC1 항원에 대해서 는 4예 모두(100%)에서 양성 반응을 보였으며 MUC2, MUC3 항원에 대한 반응은 75% (3/4)에서 약한 양성을 나타내어 MDE 선암과 매우 대조적인 반응을 보였다(Fig. 1).
4. 만성 췌장염에서의 점액유전자 항원 발현 Tn 항원은 만성 췌장염 4예 모두에서 발현되지 않았으나 sTn항원은 췌관 상피세포, 포도상선세포 및 소포세포의 일부(50%)에서 발현되었고, sLex는 췌관 상피세포에서만 약한 반응을 보였다. MUC1, Fig. 1. Immunohistochemical staining of MDE adenocarcinoma (A, B) and ductal adenocarcinoma (C, D). MUC1 antigen was expressed in every ductal adenocarcinoma but not in MDE, whereas MUC3 antigen was expressed in all of MDE adenocarcinoma, but weakly or not in ductal adenocarcinoma. A, MUC1 (-), ×100; B, MUC3 (++), ×40; C, MUC1 (+++), ×100; D, MUC3 (-), ×40.
Kim et al. Mucin Gene Associated Antigenes in Mucinous Ductal Ectasia 101
MUC2, MUC3 유전자 항원은 모든 췌관 상피세포에 서 강하게 발현되었고 포도상선세포에서는 MUC1 과 MUC2 항원만이, 소포세포에서는 MUC2 항원만 이 발현되었다.
고 찰
당화(glycosylation)는 가장 흔한 단백질의 전사 후 변형의 한 유형이며 단백질에 탄수화물이 첨가되 는 것은 단백질의 물리적 성상을 변형시키는 중요한 요인이다. 당단백은 O-linked 당단백, N-linked 당단 백의 2가지 유형으로 나뉘는데, O-linked 당단백은 대부분 세포 표면과 분비물에서 발견되며 특징적으 로 탄수화물 함량의 과다 및 serine과 threonine이 많 이 포함된 영역을 갖는다.1 이 당화가 많이 일어난 O-linked 당단백 중 대표적인 것이 점액인데 분비된 점액은 이황화(disulfide) 결합으로 중합체(polymer) 를 이루게 되어 점도가 높아진다. 점액은 상피세포 가 마찰이나 소화효소, pH 등에 저항하는데 필요한 점성액(mucus)을 이루는 단백질의 주요 성분이다.24 점액의 대부분은 소화기관의 상피세포나 호흡기 점 막 및 생식기관의 점막에서 생성되는데, 이들 조직 이 염증, 종양 등에 의하여 병적인 상태로 바뀌면 점 액 단백질의 변화가 특징적으로 일어나25,26 진단 및 치료와 관련된 암특이항원이 출현하게 된다. 그중에 서 Tn, sTn, sLex 항원은 점액 당화 경로 중 초기에 나타나는 탄수화물 항원으로 정상 조직에서는 발현 되지 않으나 90% 이상의 선암세포와 전이암 세포에 서 발현된다.3,5,7 반면에 MUC1, 2, 3 등 apomucin 관 련 항원은 정상 조직에서도 나타나나27 병적인 상태 가 되면 그 발현 양상이 변화한다고 알려져 있다.28,29 본 연구에서는 Tn, sTn, sLex 모두 정상 췌장조직에 서는 발현하지 않았고 췌관암, 낭포선암, MDE의 선 종과 선암에서 발현되어 위와 같은 보고들과 일치하 였으나, 만성 췌장염 환자에서 sTn 항원이 일부 (50%) 발현되며 sLex 항원도 췌관 상피세포에서 약 하게 발현되는 새로운 사실을 보여 주었다.
Itzkowitz 등3은 대장암환자의 75%에서 Tn과 sTn 항 원이 동시에 발현되지만 정상 대장 조직에서는 전혀 발현하지 않는다고 보고하였는데 췌장의 악성 질환
도 비슷한 발현양상을 보이는 것으로 생각되어 대 장, 췌장 조직 모두 악성화되면 불완전당화와 2, 6 sialylation을 보인다는 것을 알 수 있었다. 그러나 MDE 선종에서도 Tn, sTn 항원이 발현되는 것을 볼 때 Tn과 sTn항원의 출현이 암의 특징적인 소견은 아 닌 것으로 생각된다. MDE 선암은 주로 주췌관내에 서 팽창되면서 커지는 형태를 취하고 혈관과 림프관 침윤이 거의 없어 췌관암에 비하여 예후가 좋은 것 으로 알려져 있는데,17 이번 연구에서도 MDE 선암 은 췌관암과 비교하여 점액유전자 발현이 크게 다른 것을 알 수 있었다. Tn, sTn, sLex 등 탄수화물 관련 점액유전자는 이 두가지 선암에서 비슷한 발현 양상 을 보였지만 apomucin항원(MUC1, 2, 3)은 전혀 다 른 발현 양상을 나타내었다. 즉, 췌관암은 유방형 apomucin항원인 MUC1이 발현하는데 반하여 MDE 선암에서는 MUC1 항원은 발현되지 않으면서 장형 (intestinal type) apomucin항원인 MUC2와 MUC3가 발현되었다. 이러한 발현 양상 차이로 미루어 이 두 종양을 이루는 세포의 특성이 서로 다를 것으로 추 정할 수 있으며 췌관암 세포는 장형 apomucin을 생 성하지 않을 것으로 생각된다. 이 연구에서는 만성 췌장염 환자에서도 점액유전자 관련 항원 발현 양상 을 관찰하였는데 이는 지금까지 보고된 바 없다. Tn 항원은 발현되지 않고 sTn항원과 sLex 항원이 일부 에서 약하게 반응하는 것과 MUC2와 MUC3항원 역 시 발현되는 것을 관찰하였는데 이들 항원 발현 의 미에 대해서는 앞으로 좀더 연구가 필요할 것으로 생각된다. 요약하면 Tn, sTn, sLex 항원 및 MUC3 항 원의 발현과 MUC1 항원의 소실이 MDE 병변의 악 성 변환과 관련이 있으며 또한 점액유전자 관련 항 원 발현이 췌장 종양의 생물학적 행태와 연관이 있 을 것으로 추측된다. 이 연구에서는 특히 예후가 현 저하게 다른 MDE선암과 췌관암에서 유방형, 장형 apomucin 관련 항원이 서로 상반되게 발현됨을 보 여 주었는데 앞으로 생화학적 특성과 점액유전자 항 원 발현에 관한 더 많은 연구가 필요할 것으로 생각 된다.
102 대한소화기학회지 : 제 33 권 제 1 호 1999
요 약
목적: 췌장에서 점액을 분비하는 종양성 병변인 mucinous ductal ectasia (MDE)는 그 용어가 나타내 듯이 점액을 과분비하여 그로 인한 췌관의 확장이 관찰되는 질환이다. 그러나 병리조직학적으로는 과 형성에서부터 선종, 선암에 이르기까지 다양하고 과 형성, 선종도 암의 전구병변으로 여겨지는 특성이 있다. 그런데 소화기관 점막, 호흡기 점막 등에서 분 비되는 고분자량의 당단백인 점액은 이들 기관이 병 적인 상태로 변화하면 점액의 생성과 분비에 변화가 나타날 뿐만 아니라 조직 특이적인 점액유전자 발현 도 변화한다고 알려져 있다. 이 연구에서는 췌장의 MDE를 대상으로 하여 과형성-선종-선암 변환 과정 에 따른 점액의 항원 변화와 점액유전자 발현의 변 화를 조사하고자 하였다. 대상 및 방법: 정상 췌장 조직 4예, 만성 췌장염 4예, 점액성 낭포선암 2예, 췌 관암 4예를 대조군으로 사용하였으며 MDE는 7예로 과형성 2예, 선종 1예, 선암 4예가 포함되었다. 이들 모두는 췌장 적출술로 얻었으며 포르말린에 고정한 후 파라핀에 포매하였다. Labelled streptavidine biotin kit (Dako Co.)를 사용하여 면역병리학적 염색 을 하였으며 각각은 병소의 5%이상이 염색되었을 때를 양성으로 하여 염색 강도에 따라(+), (++), (+++)로 구별하였다. 일차 항체는 Mab 91S8 (Tn), MAb JT10e (Sialyl Tn), MAb SNH3 (Sialyl Lex), MAb 139H2 (MUC1), polyclonal anti-MRP (MUC2), anti-M3P (MUC3)를 사용하였다. 결과: 정상 췌장 조직에서는 MUC1, MUC2 항원만이 발현하였다.
MDE 과형성에서는 Tn, sTn, sLex 항원이 모두 발현 되지 않았으나 MDE 선암에서는 이들 항원이 모두 강하게 발현되었으며 MDE 선종은 그 중간 단계를 취하였다. 점액 단백질 관련 항원은 MDE 선암과 췌 관암 사이에 큰 차이점이 발견되었는데 MDE 선암 은 MUC2와 MUC3 항원이 강하게 발현된 반면 췌 관암에서는 MUC1 항원만이 강하게 발현하였다. 결 론: 이상의 결과로 볼 때 Tn, sTn, sLex 항원 및 MUC3 항원의 발현과 MUC1 항원의 소실이 MDE 병변의 악성 변환과 연관이 있으며 또한 점액유전자
관련 항원 발현이 췌장종양의 생물학적 행태와 관련 이 있을 것으로 생각된다.
색인단어: 췌장, Mucinous ductal ectasia, 점액유전 자, 면역조직화학적 염색
참 고 문 헌
1. Raijman I, Kortan P, Walden D, Kandel G, Marcon NE, Haber GB. Mucinous ductal ectasia: cholangio pancreatographic and endoscopic findings. Endos copy 1994;26:303-307.
2. Maguchi H. Clinicopatholgical and diagnostic study of mucin producing pancreatic tumors. Nippon Shokakibyo Gakkai Zasshi 1994;91:1003-1006.
3. Itzkowitz SH, Yuan M, Montgomery CK, et al Expression of Tn, Sialosyl-Tn, and T antigens in human colon cancer. Cancer Res 1989;49:197-204.
4. Springer GF. T and Tn: general carcinoma autoan tigens. Science 1984;224:1194-1206.
5. Yonezawa S, Tachikawa T, Shin S, Sato E. Sialosyl Tn antigen: its distribution in normal human tissues and expression in adenocarcinomas. Am J Clin Pathol 1992;98:167-174.
6. Takahashi HK, Metoki R, Hakomori S. Immuno globulin G3 monoclonal antibody directed to Tn antigen (tumor-associated alpha-N-acetylgalactosa- minyl epitope) that does not cross-react with blood group A antigen. Cancer Res 1988;48:4361-4367.
7. Kjeldsen T, Clausen H, Hirohashi S, Ogawa T Iijima H, Hakomori S. Preparation and characteriza tion of monoclonal antibodies directed to the tumor associated O-linked sialosyl-2----6 alpha-N-acetyl- galactosaminyl (sialosyl-Tn) epitope. Cancer Res 1988;48:2214-2220.
8. Magnani JL, Stepiewski Z, Koprowski H, Ginsburg V. Identification of the gastrointestinal and pancrea tic cancer-associated antigen detected by monoclonal antibody 19-9 in the sera of patients as a mucin Cancer Res 1983;43:5489-5492.
9. Matsunou H, Konishi F, Shimoda T. Immunohisto chemical localization of CA 19-9 and Lewis anti
김해련 외 5인. 췌장 Mucinous Ductal Ectasia에서의 점액유전자 관련 항원 발현 103
gens in pancreatic tumors and tumor-like lesions. J Bil Tract Panc 1986;7:671-682.
10. Ichihara T, Nagura H, Nakao A, Sakamoto J Watanabe T, Takagi H. Immunohistochemical locali zation of CA 19-9 and CEA in pancreatic carcinom and associated diseases. Cancer 1988;61:324-333.
11. Lan MS, Khorrami A, Kaufman B, Metzgar RS Molecular characterization of a mucin-type antigen associated with human pancreatic cancer: the DU- PAN-2 antigen. J Biol Chem 1987;262:12863-12870 12. Ho JJL, Chung Y, Fujimoto Y, et al. Mucin-like
antigens in human pancreatic cancer cell lines identified by murine monoclonal antibodies Span-1 and Ypan-1. Cancer Res 1988;48:3924-3931.
13. Ohhashi K, Takagi K. ERCP and imaging diagnosis of pancreatic cancer. Gastroenterol Endosc 1980;22 1493-1495.
14. Kuroda A, Morioka T. Recent trends in cystic diseases of the pancreas: classification and problems J Bil Tract Panc 1990;11:1-8.
15. Yamao K, Nakazawa S, Hoshino J, et al. Curren concepts of mucus producing pancreatic tumor. J Bi Tract Panc 1990;11:61-66.
16. Morohoshi T, Kanda M, Asanuma K, Kloppel G Intraductal papillary neoplasms of the pancreas: a clinicopathological study of six patients. Cancer 1989;64:1329-1335.
17. Stömmer P, Gebhardt C, Schultheiss KH. Adenocar cinoma of the pancreas with a predominant intraduc tal component: a special variety of ductal adenocar cinoma. Pancreas 1990;5:114-118.
18. Takizawa Y, Aoyama T, Oota Y, et al. A case o intraductal papillary pancreatic tumor [in Japanese with English abstract]. J Bil Tract Panc 1991;12 431-435.
19. Huang J, Byrd JC, Siddiki B, Yuan M, Lau E, Kim YS. Monoclonal antibodies against partially degly cosylated colon cancer mucin that recognize Tn antigen. Dis Markers 1992;10:81-94.
20. Sawada T, Ho JJL, Chung YS, Sowa M, Kim YS E-selectin binding by pancreatic cancer tumor cells is inhibited by cancer sera. Int J Cancer 1994;57 901-907.
21. Hilkens J, Buijs F, Ligtenberg M. Complexity o MUC-6, an epithelial sialomucin associated with carcinomas. Cancer Res 1989;49:786-793.
22. Gum JR, Byrd JC, Hicks JW, Toribara NW, Lam port DT, Kim YS. Molecular cloning of human intestinal mucin cDNAs. Sequence analysis and evidence for genetic polymorphism. J Biol Chem 1989;264:6480-6487.
23. Gum JR, Hicks JW, Swallow DM, et al. Molecula cloning of cDNAs derived from a novel human intestinal mucin gene. Biochem Biophys Res Com mun 1990;171:407-415.
24. Forstner JF, Forstner GG. Gastrointestinal mucus:
structure, biosynthesis and intracellular storage. In:
Johnson LR, ed. Physiology of the gastrointestina tract. Volume 2, 3rd ed. New York: Raven, 1994 1256-1264.
25. Correa P. A human model of gastric carcinogenesis Cancer Res 1988;48:3354-3358.
26. Kuan SF, Byrd JC, Basbaum CB, Kim YS. Charac terization of quantitative mucin variants from a human colon cancer cell line. Cancer Res 1987;47 5715-5718.
27. Chang SK, Dohrman AF, Basbaum CB, et al Localization of mucin (MUC2 and MUC3) messen ger RNA and peptide expression in human norma intestine and colon cancer. Gastroenterology 1994;
107:28-32.
28. Yonezawa S, Byrd JC, Dahiya R, et al. Differentia mucin gene expression in human pancreatic and colon cancer cells. J Biochem 1991;276:599-605.
29. Byrd JC, Ho JJL, Lamport DTA, et al. Relationship of pancreatic cancer apomucin to mammary and in testinal apomucins. Cancer Res 1991;51:1026-1033.