대한소화기학회지 2006;47:260-267 □REVIEW □
서 론
최근 들어 고형 종양의 생물학적인 특성이 보다 명확히 밝혀짐에 따라 외과 치료에 대한 개념도 많이 변화하고 있 다. 이러한 변화의 주된 흐름의 하나로서 가능한 한 보존적 인 외과 접근을 목표로 하고 있는데, 유방암과 흑색종에서 의 외과 치료 개념의 변화가 가장 대표적인 경우라 할 수 있다.1,2 그러나 하부 직장암에서의 외과 치료 개념은 아직 까지는 대부분의 예에서 광범위한 절제가 권고되며 술식 선 택에서 가장 심각하게 고려되는 요소 중의 하나가 종양학적 인 안정성을 확보하면서 항문 기능을 보존하는 것으로 이를 위한 다양한 수술 방법이 현재까지도 새로이 고안되고 있 다.
상부 직장암에서는 실제 이론적으로나 기술적으로 대부분 항문을 보존하면서 원위부 절제연을 안전하게 확보할 수 있 기 때문에 영구 장루를 설치할 필요가 없는데, 1940년대 처 음으로 Dixon3에 의해 전방절제술(anterior resection)이 보편 화됨으로써 가능하게 되었다. 그러나 원래 상부 직장암 환 자만을 대상으로 시행된 이 수술은 1980년에 와서 Parks 등4 이 결장항문문합술(coloanal anastomosis)을 소개함으로써 중 하부 직장암 환자에서도 전방절제술 개념에 의한 괄약근 보 존 수술의 가능성을 열었다. 괄약근 보존술은 중하부 직장 암에서 그 중요성이 거론되는데, 이는 종양학적으로 안전한 원위부 절제연을 외과적으로 충분히 확보하는 것은 중하부 직장암에서 중요한 관심 사항이기 때문이다.
중하부 직장암에서의 괄약근 보존술은 종양학적으로는
직장암의 항문 괄약근 보존술
동아대학교 의과대학 외과학교실
최 홍 조
Sphincter-preserving Surgery for Rectal Cancer
Hong-Jo Choi, M.D.Department of Surgery, Dong-A University College of Medicine, Busan, Korea
Although optimal treatment of tumors at mid and distal rectum continues to be a matter of great debate to oncologic surgeons, a surgical goal of sphincter preservation should be considered in all patients with an intact sphincter. There are growing evidences and indications that sphincter-preserving procedure might be a valid alternative to conventional modality in tumors of the mid or lower rectum. Traditionally, an abdominoperineal resection with permanent colostomy would be the sole surgical option. Recently, a variety of sphincter-preserving procedures are performed in majority of distal rectal cancers with acceptable oncologic and optimal functional results. Several recent advances may further influence future treatment strategies and many issues are, at present, under evaluation. Here, some of the most relevant topics regarding current methods of sphincter-preserving procedures with their oncologic and functional results are discussed to establish the guideline of surgical treatment in rectal cancer. (Korean J Gastroenterol 2006;47:260-267)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Key Words: Rectal cancer; Sphincter-preserving surgery
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
연락처: 최홍조, 602-715, 부산광역시 서구 동대신동 3가 1번지 동아대학교 의과대학 외과학교실
Tel: (051) 240-5146, Fax: (051) 247-9316 E-mail: colonch@donga.ac.kr
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ Correspondence to: Hong-Jo Choi, M.D.
Department of Sugery, Dong-A University College of Medicine, 3-1 Dongdaesin-dong, Seo-gu, Busan 602-715, Korea
Tel: +82-51-240-5146, Fax: +82-51-247-9316 E-mail: colonch@donga.ac.kr
최홍조. 직장암의 항문 괄약근 보존술 261
근치 수술 후의 직장암 파급에서 직장간막(mesorectum)의 중요성이 확인되고,5 배변기능 측면에서는 직장 절제 후 직 장의 저장능을 복원시키는 수술이 고안됨으로써 개념 발전 이 가능하였다.6,7 뿐만 아니라, 기술적으로는 좁은 골반강 내에서 힘든 수지문합을 대신할 수 있는 우수한 자동봉합기 (stapling devices)가 개발됨으로써 결장과 저위 직장과의 문 합이 가능해졌으며 최근에는 괄약근간 절제술(intersphinc- teric resection)이라는 개념의 수술로까지 발전하였다.8-10 이 러한 결과로 현재 중하부 직장암 환자의 대부분에서는 괄약 근 보존수술이 가능하게 되어 정상 배변기능의 보존이 가능 하고 종양학적으로 국소재발의 위험도 최소화할 수 있게 되 었다. 지금도 하부 직장암에서 수술 후 괄약근 보존을 극대 화하기 위한 외과 노력으로서 전술한 괄약근간 절제술의 개 념을 임상연구를 통해 발전시키고 있으며,11 저장능을 복원 하기 위한 외과 방법,12 신보조요법(neoadjuvant therapy) 즉, 술 전 항암화학방사선치료(preoperative chemoradiation) 개
념,13,14 그리고 초기 직장암에서의 국소절제술의 의의와 역
할15을 정립시켜 가고 있다.
여기서는 중하부 직장암의 수술 치료로서 현재 이용되고 있거나 활발히 연구되고 있는 방법들을 종양학적인 성적과 기능적인 결과를 중심으로 살펴보기로 한다.
본 론
1. 환자의 선택중하부 직장암 환자에서 괄약근 보존술의 적응을 결정하 기 위해서는 다음의 두 요인이 중요하다. 우선 기능적인 고 려 사항으로서 항문 괄약근 기능이 정상이라야 한다. 그러 므로 술 전에 병력을 통해 변실금(fecal incontinence) 유무를 확인해야 하며 이때 항문을 포함한 회음부의 수술력을 파악 하며 특히 여자에서는 난산과 같은 출산 병력을 확인해야 한다. 임상적으로 항문 괄약근의 기능 이상이 의심되면 항 문내압검사나 경항문초음파와 같은 정밀 검사가 필요하며, 만일 괄약근에 직접적으로 종양이 침습되었다면 근치 절제 술로서의 괄약근 보존술은 금기이다. 종양 침습은 없으나 괄약근 기능이 불완전한 경우로서 환자가 괄약근 보존술을 강력히 원하는 경우에는 수술 후 배변 기능 악화의 가능성 에 대해 술 전에 충분히 주지시키고 동의를 구하는 것이 중 요하다. 이 경우 수술 시 결장낭(colonic pouch)을 함께 만들 어 신직장(neorectum) 용적을 충분히 확보하는 것이 도움이 될 수 있다.
다음으로 괄약근 보존술의 선택을 위해 종양학적인 요인 을 고려해야 하는데 이때 항문연과 종양과의 거리가 중요하 다. 우선 직장암에서 ‘안전한 원위부 절제연은 5 cm 이상’이 라는 고전 원칙은 1980년대에 와서 도전을 받게 되는데, 대
표적으로 Williams16에 의하면 직장암의 76%에서는 종양세 포의 원위부 벽내전파(intramural spread)가 없었으며 원위부 전파가 확인된 14%의 환자에서도 종양으로부터 1 cm 미만 내로 국한되어 있었다. 그리고 1 cm 이상의 원위부에 종양 세포 파급이 있었던 경우는 10%로서 이들은 모두 저분화 (poorly differentiated) 종양이었다. 다른 보고에서도 3.8%의 환자에서만 원위부의 종양 파급이 확인되었을 뿐만 아니라 파급범위도 모두 1 cm 이내에 국한되어 있었으며, 원위부 파급이 확인되었던 환자들의 대부분은 생존율이 낮았으나 종양 관련 사망 원인은 국소재발이 아닌 원격전이에 의한 것이었다.17 또한 안전한 원위부 절제연의 거리는 1 cm로 충 분하며,18 원위부 1 cm 이상의 종양세포 파급은 드물고 1 cm 이상 파급이 있는 경우는 상당히 진행되었거나 병리조 직학적으로 악성도가 높은 종양으로서 이러한 경우에서는 절제연의 길이를 늘려도 예후의 향상을 기대할 수 없다는 사실을 강조하였다.19 이러한 연구 결과들은 초저위 직장암 에서의 괄약근 보존술의 이론적인 근거가 되고 있는데, 이 론적으로 치상선 2 cm 상방에 위치한 저위 직장암에서도 종양학적인 안전성을 확보하면서 괄약근 보존술을 시행할 수 있으며, 2000년 미국 국립암연구소의 지침에서도 1 cm의 원위부 절제연으로도 적절하다고 권고하였다.20
최근에는 항문 내괄약근(internal anal sphincter)의 일부 또 는 전부를 절제하는 괄약근간 절제술의 개념이 소개되어 보 다 더 하방에 위치한 직장암에서도 종양의 근치 절제 후 영 구 장루 설치가 필요없이 항문을 보존할 수 있게 되었다. 괄 약근간 절제술의 기능과 종양학적인 결과는 뒤에서 자세히 살펴보기로 한다.
2. 신보조(항암화학)방사선치료[neoadjuvant (chemo) radiation therapy]
직장암에서 신보조방사선치료의 종양학적인 효과는 잘 알려져 있다.13,14 최근의 보고에서도 하부 직장암 환자에서 장기 신보조방사선치료(5주간 40-45 Gy) 후 40%에서 down- staging이 관찰되었으며 이들 환자의 80%에서 괄약근 보존 술이 가능하였고,21 이때 함께 항암화학요법을 병합하는 신 보조항암화학방사선치료로서 R0 절제, 즉 잔류종양 음성 절 제의 가능성을 더 증가시키고 국소 완치율을 극대화할 수 있었다.22 다기관 연구를 통한 단기 신보조방사선치료(5일간 25 Gy)의 결과를 보면 전직장간막절제술(total mesorectal excision, TME) 단독 군에 비해 downstaging의 효과는 차이 가 없었으나 국소재발률은 현저히 낮았다.14
저위 직장암으로서 종래의 개념으로 볼 때 복회음절제술 (abdominoperineal resection; 일명 Miles' operation)이 불가피 한 환자에서 괄약근 보존술의 가능성을 높이기 위해서 신보 조요법으로서 고용량 방사선치료(60 Gy)를 고려할 수 있
262 The Korean Journal of Gastroenterology: Vol. 47, No. 4, 2006
다.23 즉, 표준 장기 신보조방사선치료(40 Gy) 완료 2주 후 방사선 병기를 치료 전과 비교하여 30% 이상의 종양 감소 가 있는 경우 추가 용량을 투여하여 총 60 Gy를 조사한 후 괄약근 보존술을 시행하며, 종양 감소 효과가 없는 환자에 서는 추가 방사선 조사 없이 복회음절제술을 고려한다. 이 요법으로 70%의 환자에서 괄약근 보존 수술이 가능하였으 며 국소재발률은 13%였다.
술 전 방사선치료로 인해 술 후 이환율, 특히 감염 합병 증의 빈도가 증가할 수 있으나 사망률이 증가하지는 않는 데, 방사선치료에 의한 이러한 부작용은 생물학 조사량이 30 Gy 이상일 때 증가한다.24 뿐만 아니라, 술 후 배변자제 력이 저하되어 배변횟수가 증가될 수 있는데, 이러한 부작 용은 항문 괄약근과 하부 직장의 방사선 손상에 의한 것으 로서 항문 괄약근을 방사선 조사범위에서 배제시키고 수술 시 직장을 절제한 후 결장낭을 조성하여 결장낭-항문문합술 을 시행함으로써 수술 후 직장항문 기능저하를 최소화할 수 있다.25
3. 저위전방절제술(low anterior resection)과 전직장 간막절제술
중하부 직장암의 근치적 외과 절제의 종양학적인 원칙은 직장과 직장을 둘러싸는 직장간막을 골반저까지 완전히 절 제하여 원위부와 측방의 절제연을 안전하게 확보하는 것이 다(Fig. 1). 이는 Heald26에 의해 정립된 TME이라 하는 외과 개념으로서, 직장암의 외과 치료에 한 이정표가 되었다. 수 술 방법은 벽측골반근막(parietal pelvic fascia)과 장측골반근 막(visceral pelvic fascia) 사이의 무혈관면을 정교하게 박리 하는데, 전방으로는 Denonvillier 근막과 복막반전부를 포함 하여 절제한다. 자율신경은 우선 대동맥 전방에서 골반을 향해 달리는 상하복신경얼기(superior hypogastric plexus)와
제1천골과 대동맥 분지수준에서 좌우 가지로 나뉘는 하복 신경(hypogastric nerve), 그리고 이 신경이 골반의 전방 외측 에서 천골 부교감신경과 만나 형성하는 하하복신경얼기 (inferior hypogastric plexus) 등을 확인하면서 보존한다.27 TME의 종양학적인 우수성은 이미 입증되었는데, 이 수술 후 보조치료 없이도 국소재발률은 10% 미만으로 보고되고
있으며,28-30 신보조방사선치료를 시행한 경우 국소재발률은
더욱 감소한다.14 상부 직장암에서의 TME의 역할에 대해서 는 논란이 있는데, 이 경우에는 절제의 규모를 줄여 종양의 원위부 경계로부터 5 cm 하방에서 직장간막을 절제하는 부 분직장간막절제술(partial mesorectal excision, PME)을 시행 한 후 결장직장문합을 하는 것이 일반적이다.
TME 후 환자의 예후를 예측하고 보조요법 시행 유무를 결정하기 위해 병리조직 결과로 림프절 전이 유무와 측방 절제연의 종양 침습 유무를 파악하는 것이 대단히 중요하 다. 측방절제연에 종양 침습이 양성인 경우 이는 불량한 예 후인자로서, 민감도, 특이도 그리고 양성 예측도는 각각 92%, 95%, 85%였으며, 측방절제연 1 mm 미만에서의 원격 전이의 위험은 1 mm 이상에 비해 3배 정도 높았으며(37.6%
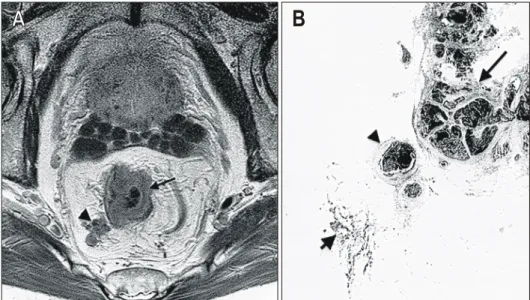
vs. 12.7%), 측방절제연 2 mm 이하에서의 국소재발의 위험 도 약 3배 높았다(16% vs. 5.8%).31 직장간막의 외측연 즉, 측방연의 종양 침습 유무의 술 전 진단은 magnetic reson- ance imaging (MRI)이 매우 정확도가 높으며(Fig. 2),32 이를 통해 외측연의 종양 침습이 의심되는 환자에서는 신보조방 사선치료를 계획하여 종양학적인 근치율을 극대화할 수 있 다.
TME는 TME를 하지 않은 경우에 비해 문합부 누출의 빈 도가 높은데, 한 보고에 의하면 문합부 누출에 대한 저위험 군 환자에서 TME 후의 문합부 누출은 12.6%에서 관찰되었 으며 문합 후 일시적인 우회 장루를 설치한 경우 빈도는 3.3%로 감소하였다.33 최근의 한 보고에서도 TME 후의 문 합부 누출은 8.1%로서 상부 직장암 환자에서 PME 후의 1.3%에 비해 월등히 높았다.34 문합부 누출이 높은 이유로는 직장간막의 제거로 인한 혈류 장애가 흔히 거론되어 왔으나 확실치는 않다. 임상 분석에 의하면 남자에서와 우회 장루 를 설치하지 않았던 경우에 유의하게 빈도가 높았는데,35 성 별에 따른 빈도의 차이는 남자에서는 골반이 좁아 외과 조 작이 어렵다는 점이 배경이 될 수 있다. 우회 장루는 성별과 는 관계없이 문합이 항문과 근접한 원위부에 조성되는 경우 에 고려를 하는 것이 타당하며 특히 TME 시술에 대한 학습 곡선 기간 내에 있는 외과의가 시술하는 경우에는 적극적으 로 고려하는 것이 좋다.
4. 괄약근간 절제술(intersphincteric resection, ISR)
종양이 항문관으로까지 파급된 경우 적절한 원위부 절제 Fig. 1. Total excision of mesorectum.5
Choi HJ. Sphincter-preserving Surgery for Rectal Cancer 263
연을 확보하고 항문을 보존하기 위한 수술로서 항문 내괄약 근의 일부 또는 모두를 절제하는 괄약근간 절제술(inter- sphincteric resection, ISR)이 소개되어 최근 적응에 따라 그 시술 빈도가 증가하고 있다(Fig. 3).8-11,36 수술 적응 환자의 선택에서 가장 중요한 인자는 항문 외괄약근 또는 골반저 근육으로의 종양 침윤 유무로서 만일 종양 침윤이 술 전에 확인되면 일반적으로 이 수술은 금기다. 이를 진단하기 위 해 가장 추천되는 검사는 MRI로서 괄약근 침윤 음성 진단 율의 민감도는 100%, 특이도는 94%로 알려져 있다.37 최근 Rullier 등22은 T3 초저위 직장암에서도 신보조방사선 또는
화학방사선치료를 통해 downstaging을 유도하여 ISR을 시행 함으로써 안전하게 측방절제연을 확보하여 양호한 결과를 얻었다. 그러나 T3-4 직장암에서의 신보조방사선치료와 ISR 의 종양학 성적에 대해서는 더 많은 결과를 기다려야 할 것 으로 보인다. 그리고 현재 미분화 또는 점액 종양에서는 ISR을 금할 것을 권하고 있다.9,36
수술은 경복부와 경항문 접근으로 이루어지는데, 수술의 복부, 골반부 조작은 TME와 본질적으로는 동일하다. 경항 문 조작은 일반적으로 Lloyd-Davis 체위에서 시행되는데, 적 절한 견인기(일반적으로 Lone Star RetractorⓇ, Lone Star Medical Products Inc, Houston, TX, USA)를 이용하여 항문관 을 노출시킨 후 종양 하연으로부터 1-2 cm 원위부 또는 괄 약근간구(intersphincteric groove)에서 내괄약근을 원주형으 로 정교하게 외괄약근과 분리한다. 이때 안전한 절제 측방 연의 확보를 위해 괄약근간면(intersphincteric plane)을 따라 정교하게 박리를 진행하는 것이 중요하며 근위부로 진행하 면 골반부 박리면과 쉽게 만나게 된다. 일반적으로 재건술 로는 결장과 항문을 수기로 문합하는데, 술 후 배변기능 이 상을 최소화하기 위해 J-결장낭을 조성하거나 결장성형술을 함께 시행하며 문합의 안정성을 위해 일시적인 우회 장루를 설치하는 것이 바람직하다. ISR의 종양학적인 성적은 매우 고무적이다. 금년에 발표된 대규모 연구 결과에 의하면 약 73개월의 추적기간 동안 국소재발률을 5.3% (6/113)였으며, 배변자제력은 86.3%의 환자에서 완전하게 유지되었으며 변 실금은 단 1예의 환자에서만 관찰되어서 술 후 배변기능도 비교적 양호하며 환자의 만족도도 우수하였다.11
그러므로 ISR은 적응에 따르는 초저위 직장암 환자의 괄 약근 보존술로서 매우 가치 있는 수술로 보이며 전향 연구 를 통한 장기적인 종양학적, 기능적인 결과를 기대한다. 그 Fig. 3. Technique of intersphincteric resection.22 The tumor reaches
the anal ring lying close to the dentate line. Transanal division of the internal anal sphincter is connected with pelvic dissection, allowing with adequate distal margin.
IS, internal sphincter; ES, external sphincter; PR, puborectalis.
Anal ring
Anal verge
PR
ES
Fig. 2. T3 rectal cancer with a tumor deposit in the mesor- ectum.32 (A) Axial contrast-en- hanced T1-weighted turbo spin echo image shows a tumor in the rectal wall (arrow) slightly invading the mesorectum. A tu- mour deposit is seen in the me- sorectum (arrowhead). (B) Cor- responding histology confirms the extramural extension of the tumor (thin arrow) with meso- rectal deposit (arrowhead), lo- cated only 2 mm from the inked resection plane (thick ar- row).
B
264 대한소화기학회지: 제47권 제4호, 2006
러나 T3-4 환자에서의 신보조방사선치료 후의 ISR의 역할 과 성적에 대해서는 더 많은 연구가 뒤따라야 할 것으로 생 각한다.
5. 하부 직장암의 국소절제술(local excision)
초기 직장암의 외과 근치술로서 국소절제를 고려할 수 있 는데, 이는 항문을 통해 직접 종양을 절제하거나, 경항문 내 시경미세수술(transanal endoscopic microsurgery, TEM)로서 시행한다. 이 수술은 항문 괄약근과 배변기능을 온전하게 보존할 수 있을 뿐 아니라 복부 수술에 따르는 위험을 피할 수 있는 장점이 있다. 그러나 국소절제술의 종양학적 타당 성을 조사하기 위한 대규모 전향 무작위 연구 결과는 아직 까지 발표되지 않고 있다. 종양학적인 결과로서 국소재발률 은 T1 종양 17-18%, T2 종양 26-47%로,15,38,39 기존의 근치 광 범위 수술에 비해 종양학 성적이 떨어지는 것으로 보인다.
무작위 연구는 아니나 T1 환자만을 대상으로 한 최근의 연 구에서 경항문 국소절제술이 기존의 근치 경복부 수술에 비 해 국소재발률이 높고(5년 재발율, 12% vs. 6%) 생존율이 낮 았다(5년 생존율, 70% vs. 80%).40 이러한 요인으로서 가장 많이 거론하는 것이 영역림프절의 절제가 불가능하다는 점 일 것이다. 그러므로 이 술식을 고려할 경우 술 전에 반드시 영역림프절의 전이 유무를 확인하는 것이 중요한데, 이를 위해 가장 보편적으로 이용하는 검사는 경직장초음파나 골 반 MRI로서 이들 검사의 정확도 또한 여전히 한계가 있 다.41 그러므로 이 수술은 일부의 직장암 치료로서만 이용되 어야 할 것으로 보이는데, 고도 혹은 중등도의 분화도를 가 지면서 혈관 또는 림프관 침습이 없는 크기가 3 cm 미만인 T1 종양에서 고려할 수 있다.
6. 괄약근 보존 절제술 후의 재건 방법
절제 후 장의 연속성 유지를 위한 재건술 방법에는 직선 결장직장문합(straight colorectal anastomosis), 직선 결장항문 문합(straight coloanal anastomosis), 결장낭-항문 문합(colonic pouch-anal anastomosis), 그리고 결장성형술(coloplasty) 등이 있다. 수술 후 신직장의 기능을 최적화하기 위해 가장 적절 한 재건법을 선택하기 위해서는 몇 가지의 인자를 고려해야 한다. 직장의 절제 후에는 배변횟수 증가, 변절박증(urgency), soiling 등을 특징으로 하는 “전방절제증후군(anterior resection syndrome)”이 발생할 수 있는데, 이는 유순도(compliance)의 감소와 함께 절제 후 남은 직장이 용적이 적어 저장소로서 의 역할이 소실되기 때문이다. 그러므로 이는 문합의 위치 가 결정 요인으로서 일반적으로 문합의 위치가 낮을수록 기 능 저하가 심하다. 술 후 기능 저하는 직선 결장직장문합을 시행한 환자와 술 후 방사선치료를 받았거나 술 전 방사선 치료를 받고 잔존 직장에 문합이 이루어진 환자에서 두드러
진다.25 특히 결장항문문합이 직선형으로 재건된 경우 기능 저하가 특히 심할 수 있는데, 배변횟수 증가, 변절박증, 야 간배변 증가나 변실금 등을 심하게 호소할 수 있다.
직선 결장직장문합이나 직선 결장항문문합 후의 이러한 기능 저하를 최소화하기 위해 결장낭과 결장성형술이 고안 되었다.6,7,12,42,43
이들 수술의 이론 배경은 신직장의 저장 용 적을 증가시키고 유순도를 회복시킴으로써 배변기능을 개 선시키고자 함이다. 결장낭은 주로 6-7 cm 길이로 J 형태로 만들어 수지 또는 자동봉합기를 이용하여 항문과 문합하는
Fig. 4. Colonic-J-pouch-anal anastomosis. (A) The pouch is con- structed either by a hand-sewn or by a stapler (as shown). (B) The double-stapled anastomosis is being completed (from Corman ML. Colon & rectal surgery. 5th ed. Philadelphia: LWW, 2005).
A B
Fig. 5. Coloplasty. (A) Linear incision is made between the taeniae. (B) Guide sutures are placed to prepare the closure. (C) Pouch is made completly (from Corman ML. Colon & rectal surgery. 5th ed. Philadelphia: LWW, 2005).
A B C
최홍조. 직장암의 항문 괄약근 보존술 265
데(Fig. 4), 이 수술의 기능적인 우수성과 안전성은 여러 문 헌을 통해 확인되고 있으며,6,7,44,45 2003년 저자의 무작위 연 구를 통해서도 그 기능적인 우수성을 확인하였다.46 결장성 형술은 문합할 결장의 근위부에 결장띠(taenia)를 따라 세로 로 6-10 cm 절개를 넣은 후 이를 위의 Heineke-Mikulicz 유 문성형술(pyloroplasty)에서와 같이 가로로 봉합하는 방법으 로(Fig. 5),12,42,43 이 방법은 골반이 좁아 J-결장낭-항문문합이 힘든 경우 고려할 수 있으며 J-결장낭에 비해 기술적으로 용이하고 시간이 단축될 뿐만 아니라 기능적으로도 뒤떨어 지지 않는 재건술로 알려져 있다.42,47
7. 괄약근 보존술 후의 비뇨생식 기능
직장암 수술 후 특히 남자에서 성기능 장애가 커다란 후 유증으로 문제되었으나 TME와 자율신경보존술 개념이 도 입됨으로서 대부분의 환자에서 수술 후에도 온전한 성기능 의 보존이 가능하게 되었다.48,49 직장암 수술 전후의 성기능 을 연구한 결과를 보면 표준 직장암 수술에 비해 TME를 시 행한 경우에서 극치감(orgasm)과 사정능이 유의하게 높게 보존되었다.48 여자에서는 직장암 수술 후 85%에서 질내 분 비를 경험했으며 91%에서 극치감을 느꼈다고 하였으나,50 직장암에서 술 후 여자의 성기능에 대한 평가와 특히 TME 의 효과에 대해서는 더 연구되어야 할 것으로 보인다.
직장암에서 괄약근 보존수술 후 방광의 기능 이상은 성기 능 장애만큼 흔히 경험하는 문제는 아니다. 한 전향 연구 결 과를 보면 TME 후 방광 배출 곤란이 두드러졌다고 하나,48 다른 보고들에서는 TME 후의 배뇨장애는 없었거나,50 있더 라도 일시적이었으며51 TME 후의 배뇨장애는 큰 문제가 되 지 않았다.
결 론
최근 항문관 근처에 존재하는 초저위 직장암도 항문을 온 전히 보존하면서 근치 절제가 외과적으로 가능하게 되었다.
항문 괄약근의 기능이 정상이고 종양의 위치가 최소한 치상 선 2 cm 상방에 위치하는 모든 직장암 환자에서는 우선적 으로 괄약근 보존 수술을 고려하는 것이 바람직하다. 항문 괄약근 보존술을 위해서는 술 전 검사를 통해 적응 환자를 선택하는 것이 중요하며 이러한 선택된 적응 환자에서 수술 후의 국소재발과 생존율은 항문을 함께 절제하는 복회음절 제술과 동등하거나 우수한 것으로 밝혀지고 있다. 뿐만 아 니라, 기능적으로도 초저위 직장결장문합 또는 결장항문문 합에서 결장낭을 조성하거나 결장성형술을 병행함으로써 배변기능의 장애를 최소화할 수 있다. 그러므로 초저위 직 장암에서도 외과 근치술로써 술식의 선택에 있어서 종양학 적으로 안전하며 기능적으로 우수한 괄약근 보존술을 우선
적으로 고려하는 것이 바람직하다.
참고문헌
1. Veronesi U, Banfi A, Salvadori B, et al. Breast conservation is the treatment of choice in small breast cancer: long-term results of a randomized trial. Eur J Cancer 1990;26:668-670.
2. Veronesi U, Cascinelli N, Adamus J, et al. Thin stage I pri- mary cutaneous malignant melanoma. Comparison of excision with margins of 1 or 3 cm. N Engl J Med 1988;318:1159-1162.
3. Dixon CF. Anterior resection for malignant lesions of the upper part of the rectum and lower part of the sigmoid. Ann Surg 1948;128:425-442.
4. Parks AG, Percy JP. Resection and sutured colo-anal anasto- mosis for rectal carcinoma. Br J Surg 1982;69:301-304.
5. Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery: the clue to pelvic recurrence? Br J Surg 1982;
69:613-616.
6. Parc R, Tiret E, Frileux P, Moszkowski E, Loygue J. Resec- tion and colo-anal anastomosis with colonic reservoir for rectal carcinoma. Br J Surg 1986;73:139-141.
7. Lazorthes F, Fages P, Chiotasso P, Lemozy J, Bloom E. Re- section of the rectum with construction of a colonic reservoir and colo-anal anastomosis for carcinoma of the rectum. Br J Surg 1986;73:136-138.
8. Rullier E, Laurent C, Bretagnol F, Rullier A, Vendrely V, Zerbib F. Sphincter-saving resection for all rectal carcinomas:
the end of the 2-cm distal rule. Ann Surg 2005;241:465-469.
9. Teramoto T, Watanabe M, Kitajima M. Per anum intersphinc- teric rectal dissection with direct coloanal anastomosis for lower rectal cancer: the ultimate sphincter-preserving opera- tion. Dis Colon Rectum 1997;40(suppl 10):43S-47S.
10. Shafik A. A new concept of the anatomy of the anal sphinc- ter mechanism and the physiology of defecation. XII. Anorec- tal mobilization: a new surgical access to rectal lesions.
Preliminary report. Am J Surg 1981;142:629-635.
11. Schiessel R, Novi G, Holzer B, et al. Technique and long- term results of intersphincteric resection for low rectal cancer.
Dis Colon Rectum 2005;48:1858-1865.
12. Mantyh CR, Hull TL, Fazio VW. Coloplasty in low colorectal anastomosis: manometric and functional comparison with straight and colonic J-pouch anastomosis. Dis Colon Rectum 2001;44:37-42.
13. Improved survival with preoperative radiotherapy in resectable rectal cancer. Swedish Rectal Cancer Trial. N Engl J Med 1997;336:980-987.
14. Kapiteijn E, Marijnen CA, Nagtegaal ID, et al. Preoperative
266 The Korean Journal of Gastroenterology: Vol. 47, No. 4, 2006
radiotherapy combined with total mesorectal excision for re- sectable rectal cancer. N Engl J Med 2001;345:638-646.
15. Paty PB, Nash GM, Baron P, et al. Long-term results of local excision for rectal cancer. Ann Surg 2002;236:522-529.
16. Williams NS. The rationale for preservation of the anal sphincter in patients with low rectal cancer. Br J Surg 1984;
71:575-581.
17. Shirouzu K, Isomoto H, Kakegawa T. Distal spread of rectal cancer and optimal distal margin of resection for sphincter- preserving surgery. Cancer 1995;76:388-392.
18. Andreola S, Leo E, Belli F, et al. Adenocarcinoma of the lower third of the rectum surgically treated with a <10-MM distal clearance: preliminary results in 35 N0 patients. Ann Surg Oncol 2001;8:611-615.
19. Chandler PJ, Orkin BA. Rectal carcinoma: operative treatment.
In: Beck DE, Wexner SD, eds. Fundamentals of anorectal surgery. 2nd ed. London: Saunders, 1998:301-367.
20. Nelson H, Petrelli N, Carlin A, et al. Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst 2001;93:
583-596.
21. Bozzetti F, Andreola S, Baratti D, et al. Preoperative che- moradiation in patients with resectable rectal cancer: results on tumor response. Ann Surg Oncol 2002;9:444-449.
22. Rullier E, Goffre B, Bonnel C, Zerbib F, Caudry M, Saric J.
Preoperative radiochemotherapy and sphincter-saving resection for T3 carcinomas of the lower third of the rectum. Ann Surg 2001;234:633-640.
23. Rouanet P, Saint-Aubert B, Lemanski C, et al. Restorative and nonrestorative surgery for low rectal cancer after high- dose radiation: long-term oncologic and functional results. Dis Colon Rectum 2002;45:305-315.
24. Camma C, Giunta M, Fiorica F, Pagliaro L, Craxi A, Cottone M. Preoperative radiotherapy for resectable rectal cancer: a meta-analysis. JAMA 2000;284:1008-1015.
25. Dehni N, McNamara DA, Schlegel RD, Guiguet M, Tiret E, Parc R. Clinical effects of preoperative radiation therapy on anorectal function after proctectomy and colonic J-pouch-anal anastomosis. Dis Colon Rectum 2002;45:1635-1640.
26. Heald RJ. Total mesorectal excision is optimal surgery for rectal cancer: a Scandinavian consensus. Br J Surg 1995;82:
1297-1299.
27. Heald RJ. The ‘holy plane’ of rectal surgery. J R Soc Med 1988;81:503-508.
28. Martling AL, Holm T, Rutqvist LE, Moran BJ, Heald RJ, Cedemark B. Effect of a surgical training programme on out- come of rectal cancer in the County of Stockholm. Stockholm Colorectal Cancer Study Group, Basingstoke Bowel Cancer
Research Project. Lancet 2000;356:93-96.
29. Shirouzu K, Ogata Y, Araki Y. Oncologic and functional re- sults of total mesorectal excision and autonomic nerve-pre- serving operation for advanced lower rectal cancer. Dis Colon Rectum 2004;47:1442-1447.
30. Piso P, Dahlke MH, Mirena P, et al. Total mesorectal exci- sion for middle and lower rectal cancer: a single institution experience with 337 consecutive patients. J Surg Oncol 2004;
86:115-121.
31. Nagtegaal ID, Marijnen CA, Kranenbarg EK, et al. Circum- ferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol 2002;26:350-357.
32. Beets-Tan RG, Beets GL, Vliegen RF, et al. Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet 2001;357:
497-504.
33. Poon RT, Chu KW, Ho JW, Chan CW, Law WL, Wong J.
Prospective evaluation of selective defunctioning stoma for low anterior resection with total mesorectal excision. World J Surg 1999;23:463-467.
34. Law WL, Chu KW. Anterior resection for rectal cancer with mesorectal excision: a prospective evaluation of 622 patients.
Ann Surg 2004;240:260-268.
35. Karanjia ND, Corder AP, Bearn P, Heald RJ. Leakage from stapled low anastomosis after total mesorectal excision for carcinoma of the rectum. Br J Surg 1994;81:1224-1226.
36. Schiessel R, Karner-Hanusch J, Herbst F, Teleky B, Wunderlich M. Intersphincteric resection for low rectal tumours. Br J Surg 1994;81:1376-1378.
37. Holzer B, Urban M, Holbling N, et al. Magnetic resonance imaging predicts sphincter invasion of low rectal cancer and influences selection of operation. Surgery 2003;133:656-661.
38. Garcia-Aguilar J, Mellgren A, Sirivongs P, Buie D, Madoff RD, Rothenberger DA. Local excision of rectal cancer with- out adjuvant therapy: a word of caution. Ann Surg 2000;231:
345-351.
39. Mellgren A, Sirivongs P, Rothenberger DA, Madoff RD, Garcia-Aguilar J. Is local excision adequate therapy for early rectal cancer? Dis Colon Rectum 2000;43:1064-1071.
40. Endreseth BH, Myrvold HE, Romundstad P, Hestvik UE, Bjerkeset T, Wibe A; The Norwegian Rectal Cancer Group.
Transanal excision vs. major surgery for T1 rectal cancer. Dis Colon Rectum 2005;48:1380-1388.
41. Heriot AG, Grundy A, Kumar D. Preoperative staging of rectal carcinoma. Br J Surg 1999;86:17-28.
42. Z’graggen K, Maurer CA, Buchler MW. Transverse coloplasty
Choi HJ. Sphincter-preserving Surgery for Rectal Cancer 267
pouch. A novel neorectal reservoir. Dig Surg 1999;16:363-366.
43. Fazio VW, Mantyh CR, Hull TL. Colonic “coloplasty”: novel technique to enhance low colorectal or coloanal anastomosis.
Dis Colon Rectum 2000;43:1448-1450.
44. Ho YH, Tan M, Seow-Choen F. Prospective randomized con- trolled study of clinical function and anorectal physiology after low anterior resection: comparison of straight and colon- ic J pouch anastomoses. Br J Surg 1996;83:978-980.
45. Joo JS, Latulippe JF, Alabaz O, Weiss EG, Nogueras JJ, Wexner SD. Long-term functional evaluation of straight coloanal anastomosis and colonic J-pouch: is the functional superiority of colonic J-pouch sustained? Dis Colon Rectum 1998;41:740-746.
46. Choi HJ, Kim SH, Park KJ. Clinical and physiologic anorec- tal function after low anterior resection in patients with rectal cancer: a prospective randomized comparison of straight and colonic J-pouch anastomoses. J Korean Soc Coloproctol 2003;
19:101-107.
47. Mantyh CR, Hull TL, Fazio VW. Coloplasty in low colorectal
anastomosis: manometric and functional comparison with straight and colonic J-pouch anastomosis. Dis Colon Rectum 2001;44:
37-42.
48. Maurer CA, Z'Graggen K, Renzulli P, Schilling MK, Netzer P, Buchler MW. Total mesorectal excision preserves male genital function compared with conventional rectal cancer surgery. Br J Surg 2001;88:1501-1505.
49. Pocard M, Zinzindohoue F, Haab F, Caplin S, Parc R, Tiret E. A prospective study of sexual and urinary function before and after total mesorectal excision with autonomic nerve preservation for rectal cancer. Surgery 2002;131:368-372.
50. Havenga K, Enker WE, McDermott K, Cohen AM, Minsky BD, Guillem J. Male and female sexual and urinary function after total mesorectal excision with autonomic nerve pres- ervation for carcinoma of the rectum. J Am Coll Surg 1996;
182:495-502.
51. Nesbakken A, Nygaard K, Bull-Njaa T, Carlsen E, Eri LM.
Bladder and sexual dysfunction after mesorectal excision for rectal cancer. Br J Surg 2000;87:206-210.