대한소화기학회지 2005;45:387-393
서 론
점막하 종양은 임상에서 흔히 보는 질환으로 간엽 종, 양이 가장 흔하다 최근. Kit tyrosine kinase 억제제인 imatinib (GlivecⓇ)이 간질 종양의 치료로 이용되면서 간
엽 종양의 진단 및 치료에 대한 연구가 더 활발해지고 있다.1-3
간엽 종양의 기원이 완전히 규명되기 전에는 여러 가 지 명칭으로 보고되었는데‘smooth muscle tumor’로 처음 보고되었다 그러나 평활근에서 분화된 증거가 없다고.
모든 상부 위장관 간엽 종양 (Mesenchymal Cell Tumor) 의 침습 접근이 필요한가?
영남대학교 의과대학 내과학교실 병리학교실, *
이은주․김태동․오현아․이형철․김준환․장병익․김태년․정문관․배영경*
Is the Invasive Approach for All the Upper Gastrointestinal Mesenchymal Tumors Necessary?
Eun Ju Lee, M.D., Tae Dong Kim, M.D., Heun Ah Oh, M.D., Hyeung Chul Lee, M.D., Jun Hwan Kim, M.D., Byung Ik Jang, M.D., Tae Nyeun Kim, M.D.,
Moon Kwan Chung, M.D., and Young Kyeong Bae, M.D.*
Departments of Internal Medicine and Pathology*, Yeungnam University College of Medicine, Daegu, Korea
Background/Aims: Mesenchymal tumors are the most frequent submucosal tumors in gastrointestinal trail. We reviewed the mesenchymal tumors which are confirmed by pathology to examine whether the invasive approach of all mesenchymal tumors is necessary. Methods: This study was performed on fifty-nine patients who has mesenchymal tumors confirmed by endoscopic or surgical resection from January 2000 to June 2004. Results:
Mesenchymal tumors consisted of thirty-six gastrointestinal stromal tumors (GISTs), 20 leiomyomas and 3 schwannomas. All the esophageal tumors were leiomyoma (12/12, 100%). In stomach, there were 32 GISTs (76.2%), 7 leiomyomas (16.7%) and 3 schwannomas (7.1%). And there were 4 GISTs (80.0%) and 1 leiomyoma (20.0%) in duodenum. Tumors less than 1 cm in maximal diameter were leiomyoma or GISTs with very low risk of aggressive behavior. 56.1% of the tumors larger than 1 cm consisted of low, intermediate or high risk GISTs. Conclusions: Biopsy must be considered according to its size and anatomic location of mesenchymal tumors. The invasive approach for every esophageal submucosal tumor is not necessary unless the size is very large, because most of them are benign in nature. However, the gastric submucosal tumor with more than 1 cm in diameter should be carefully and regularly followed up or biopsied because it cannot be assumed to be benign for any GIST more than 1 cm in size at the present time, safely. (Korean J Gastroenterol 2005;45:387-393) Key Words: Submucosal tumor; Mesenchymal tumor; Gastrointestinal stromal tomor; Biopsy
접수: 2004년 10월 5 ,일 승인: 2005년 3월 30일
연락처 정문관: , 705-717, 대구광역시 남구 대명 5동 317-1 영남대학교병원 내과
Tel: (053) 620-3830, Fax: (053) 654-8386 E-mail: mkchn@med.yu.ac.kr
Correspondence to: Moon Kwan Chung, M.D.
Department of Internal Medicine, Yeungnam University College of Medicine, 317-1 Daemyeong 5-dong, Nam-gu, Daegu 705-717, Korea Tel: +82-53-620-3830, Fax: +82-53-654-8386
E-mail: mkchn@med.yu.ac.kr
388 대한소화기학회지 제: 45권 제 호6 , 2005
해서gastric stromal tumor로 명명되거나,4자율신경조직 에서 분화된 것이라고 해서 plexosarcoma로 명명되기도 하였다.5 이후1998년Hirota등6이 명의 간질 종양 환자5 에서c-kit유전자 돌연변이를 보고한 이후 면역조직화학 염색의 발달과 전자 현미경의 발달에 힘입어 Cajal 간질 세포가 기원이라는 것이 밝혀지면서 간엽 종양이 세분화 되어 이 분야에 많은 연구가 있었다 최근 간엽 종양을. 위장관 간질 종양 평활근 종양 평활근종 평활근육종, ( , ), 신경 종양 신경초종 신경섬유종 신경절신경종( , , ),혈관 종 양 혈관종 림프관종( , ), 지방 종양 지방종 지방육종 등으( , ) 로 세분화하지만 좁게는 위장관 간질 종양 평활근 종양, , 신경 종양 세 가지로 분류한다.7
간엽 종양 분류에 면역조직화학 염색을 이용한 것이 불과 5년 정도밖에 되지 않았기 때문에 간엽 종양의 발 생 빈도 발생 위치 치료 효과와 예후에 대한 정확한 정, , 보가 적어 치료 계획을 세우기가 어려운 것이 현실이다.
식도의 간엽 종양에서 간질 종양은 그다지 크지 않아도 악성화 가능성이 많지만 평활근종이 악성화된 것은 거의 없어 간질 종양과 평활근종의 감별진단이 중요하다.8 또 한 어떤 간질 종양도 양성이라 단정 지을 수 없으며 다 른 점막하 종양과 마찬가지로 간엽 종양도 정상 점막으 로 덮여 있어 일반적인 조직 생검으로 조직 진단이 용이 하지 않고 내시경 초음파 검사로도 위장관 간질 종양 평, 활근 종양 신경 종양의 구별이 불가능하다, .
이에 저자들은 수술이나 내시경 절제술로 조직 진단이 가능하였던 상부 위장관 간엽 종양을 임상적으로 분석하 여 향후 상부 위장관 간엽 종양의 치료 계획에 도움이 되고자 하였다.
대상 및 방법
년 월부터 년 월까지 영남대학교 의과대학 2000 1 2004 6
부속병원에서 수술이나 내시경 절제술로 상부 위장관 간 엽 종양으로 진단된 환자를 대상으로 하여 환자의 성별, 나이 조직 검출 방법을 조사하였고 내시경 소견 내시경, , 초음파검사 소견 조직 소견을 후향 조사하였다 상부 내, . 시경 검사 때 얻은 종양의 위치 크기 모양 표면의 상태, , , 등의 자료를 분석하였다 조직 소견은. CD117 (Kit), CD34, 단백 등 면역조 smooth muscle actin (SMA), desmin, S-100
직화학 검사 결과에 근거하여 분류하였다 간질 종양의. 활성도는 2002년 합의 도출 회의에서 제시한 분류에 따 라 세분하였다.9
결 과
임상양상 1.
이번 연구의 대상 환자는59명이었다 이들의 평균 연. 령은57.0±11.9 (21-76)세 였고 성별분포는 남자26명(44.1%), 여자 33 (55.9%)명 이었다.
이 중 38명은 점막하 종양을 외과 수술로 제거하고 7 명은 내시경 절제술로 제거하여 조직 진단을 하였다 나. 머지 14명은 다른 이유로 수술한 후 제거된 검체에서 간 엽 종양이 발견되어 이를 조직 검사로 진단한 경우였다.
이들 14명의 수술 이유는 13명은 위암이었고 명은 하부1 식도암이 위를 침범한 경우였다 이들 중. 3명은 수술 전 시행한 내시경 검사에서 병변이 발견되었지만, 11명의 환자에서는 수술 전 시행한 내시경 검사에서 관찰되지 않았고 수술 때 얻은 검체에서 발견되어 조사하였다.
위치와 크기 2.
간엽 종양의 위치는 식도12 (20.3%),예 위42 (71.2%),예 십이지장 예5 (8.5%)였고(Table 1), 내시경을 통한 육안 크 기는 평균 2.6±3.4 cm, 내시경 초음파에서의 크기는 평
GIST LeiomyomaSchwannoma Total Esophagus 0 (0%) 12 (100%) 0 (0%) 12 (100%) Stomach 32 (76.2%) 7 (16.7%) 3 (7.1%) 42 (100%) Duodenum 4 (80.0%) 1 (20.0%) 0 (0%) 5 (100%) Total 36 (61.0%) 20 (33.9%) 3 (5.1%) 59 (100%) GIST, gastrointestinal stromal tumor.
Table 1. Location of Mesenchymal Tumors
GIST (n=36)
Leiomyoma (n=20)
Schwannoma (n=3) Age (yrs) 59.8±9.8 52.4±14.9 54.7±3.2 Sex (M/F) 16/20 9/11 1/2 Size (cm) 2.8±3.8 2.2±2.4 2.4±0.6 C-kit 36 (100%) 0 (0%) 0 (0%) CD34 28 (77.7%) 0 (0%) 0 (0%) SMA 10 (27.8%) 20 (100%) 0 (0%) S-100 4 (11.1%) 1 (5.0%) 3 (100%) Recurrence or
metastasis None None None GIST, gastrointestinal stromal tumor; SMA, smooth muscle actin.
Table 2. Clinicopathologic Features of Mesenchymal Tumors
이은주 외 인 모든 상부 위장관 간엽 종양8 . (Mesenchymal Cell Tumor)의 침습 접근이 필요한가? 389
균 2.8±1.1 cm였다.
식도 12예의 경우 모두 양성 평활근종이었고 크기는 였다 위 예의 경우 간질 종양 예 2.1±2.6 cm . 42 32 (76.2%), 평활근종 예7 (16.7%),신경초총 예3 (7.1%)였다 크기는 간. 질 종양2.8±4.0 cm, 평활근종2.5±0.0 cm였고 신경초, 종이 2.4±0.6 cm였다 십이지장에서 발견된. 5예는 간질 종양 예4 (80.0%)와 평활근종 예1 (20.0%)로 모두 위암 수 술 후 얻은 검체에서 우연히 발견되었다.
면역조직화학 염색 3.
간엽 종양을 면역조직화학 염색을 이용하여 세분화해 보면 간질 종양이, 36예로 가장 많았는데 평균 연령 59.8
세였고 남자가 명 이었다 크기는
±9.8 16 (44.4%) . 2.8±3.8 였고 위에 가장 많았다 평활근종은 예였는데 평균
cm . 20
연령은52.4±14.9세였고 남자가 명9 (45.0%)이었으며 크 기는 2.2±2.4 cm였고 식도에 가장 많이 분포해 있었다. 신경초종은 3명에서 발견되었고 평균 연령은 54.7±3.2
세였고 남자가 1명(33.3%)이었으며 크기는2.4±0.6 cm 이었고 모두 위에 분포해 있었다(Table 2, 3).
면역조직화학 염색에서 간질 종양은 모두 Kit염색 양 성이었고CD34에 양성인 경우가28 (77.7%), SMA예 에 양 성인 경우가 10예(27.8%), S-100에 양성인 경우가4예 였다 평활근종은 모두 와 에 음성이었고 (11.1%) . Kit CD34
에는 모두 양성이었다 신경초종 예 모두 에
SMA . 3 S-100
양성이었으나 Kit, CD34, SMA에는 모두 음성이었다 (Table 2).
간질 종양의 활성도 4.
간질 종양의 활성도에 따라 분류하였을 때 초저위험군
명 저위험군 명 중등도 위험군 명
13 (36.2%), 8 (22.2%), 6 고위험군 명 이었다 위의 간질종양 명 (16.6%), 9 (25.0%) . 32 중12 (37.6%)명 이 초저위험군에, 7 (21.8%)명 이 저위험군 에, 5 (15.6%)명 이 중등도 위험군에, 8 (25.0%)명 이 고위험 군에 속하였다 십이지장의 간질 종양. 4예는 초저위험군
Size (cm)
Location ≤1.0 1.0-2.0 2.0-3.0 >3.0 Total
Esophagus 6 (50.0%) 4 (33.3%) 0 (0%) 2 (16.7%) 12 (100%) Stomach 4 (57.1%) 0 (0%) 3 (42.9%) 0 (0%) 7 (100%) Duodenum 1 (100%) 0 (0%) 0 (0%) 0 (0%) 1 (100%) Total 11 (55.0%) 4 (20.0%) 3 (15.0%) 2 (10.0%) 20 (100%) Table 3. Location and Size of Leiomyoma
Risk
Location Very low Low Intermediate High Total Stomach 12 (37.6%) 7 (21.8%) 5 (15.6%) 8 (25.0%) 32 (100%) Duodenum 1 (25.0%) 1 (25.0%) 1 (25.0%) 1 (25.0%) 4 (100%) Total 13 (36.2%) 8 (22.2%) 6 (16.6%) 9 (25.0%) 36 (100%) GIST, gastrointestinal stromal tumor.
Table 4. Risk of Aggressive Behavior according to Location of GIST
Risk
Size (cm) Very low Low Intermediate High Total 1.0
≤ 7 (100%) 0 (0%) 0 (0%) 0 (0%) 7 (100%)
1.0-2.0 5 (55.6%) 2 (22.2%) 0 (0%) 2 (22.2%) 9 (100%) 2.0-3.0 0 (0%) 2 (22.2%) 5 (55.6%) 2 (22.2%) 9 (100%)
3.0
> 1 (9.0%) 4 (36.4%) 1 (9.0%) 5 (45.6%) 11 (100%) Total 13 (36.2%) 8 (22.2%) 6 (16.6%) 9 (25.0%) 36 (100%) GIST, gastrointestinal stromal tumor.
Table 5. Risk of Aggressive Behavior according to Size of GIST
390 The Korean Journal of Gastroenterology: Vol. 45, No. 6, 2005
Pathology
Location Leiomyoma Schwannoma
GIST
Total Very low Low Intermediate High
Esophagus 12 (100%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 12 Stomach 7 (16.7%) 3 (7.1%) 12 (28.6%) 7 (16.7%) 5 (11.9%) 8 (19.0%) 42 Duodenum 1 (20.0%) 0 (0%) 1 (20.0%) 1 (20.0%) 1 (20.0%) 1 (20.0%) 5 GIST, gastrointestinal stromal tumor.
Table 7. Pathology according to Location Pathology
Size (cm) Leiomyoma Schwannoma GIST
Total Very low Low Intermediate High
1.0
≤ 11 (61.1%) 0 (0%) 7 (38.9%) 0 (0%) 0 (0%) 0 (0%) 18 (100%) 1.0
> 9 (21.9%) 3 (7.3%) 6 (14.7%) 8 (19.5%) 6 (14.7%) 9 (21.9%) 41 (100%) GIST, gastrointestinal stromal tumor.
Table 6. Pathology according to Size
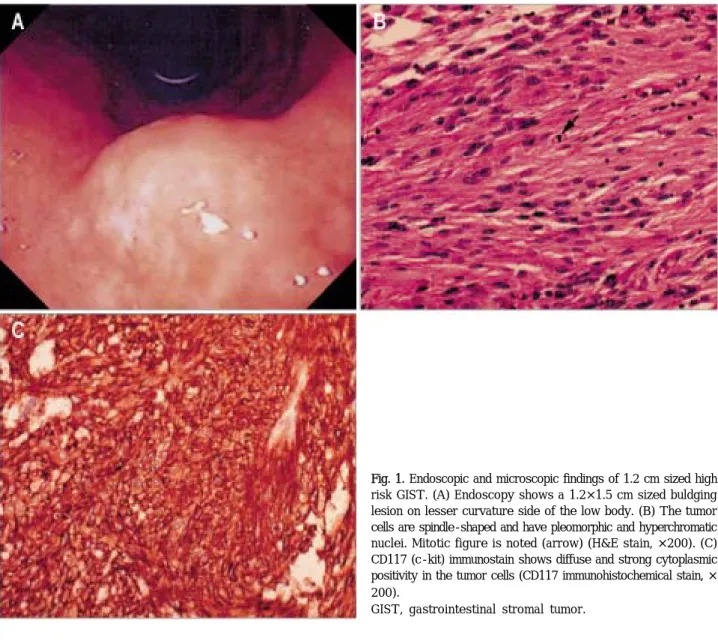
Fig. 1. Endoscopic and microscopic findings of 1.2 cm sized high risk GIST. (A) Endoscopy shows a 1.2×1.5 cm sized buldging lesion on lesser curvature side of the low body. (B) The tumor cells are spindle-shaped and have pleomorphic and hyperchromatic nuclei. Mitotic figure is noted (arrow) (H&E stain, ×200). (C) CD117 (c-kit) immunostain shows diffuse and strong cytoplasmic positivity in the tumor cells (CD117 immunohistochemical stain, × 200).
GIST, gastrointestinal stromal tumor.
Lee EJ, et al. Is the Invasive Approach of All Upper Gastrointestinal Mesenchymal Tumors Necessary? 391
명 저위험군 명 중등도 위험군 명 고위험군이 명
1 , 1 , 1 , 1
이었다(Table 4). 1.0 cm 이하의 간질 종양 예는 모두 초7 저위험군이었고, 3.0 cm보다 큰 간질 종양 11명의 경우 초저위험군 위험군 1 ,명 저위험군 4 ,명 중등도 위험군1 명 고위험군 명이었다, 5 (Table 5).이 중1.2 cm의 간질 종 양의 2예가 고위험군이었다(Fig. 1).
점막하 병변을 1 cm를 기준으로 나누어 보면 1 cm이 하인 것은 평활근종이거나 초저위험군의 간질 종양이었 으나 1 cm보다 큰 종양은 56.1%가 저위험군 중등도 또, 는 고위험군의 간질 종양이었다(Table 6).
또 식도의 경우, 100%모두 평활근종이었으나 위의 경 우 47.6%가 저위험군 중등도 또는 고위험군의 간질 종, 양이었다(Table 7). 평활근종의 크기는0.2-9.5 cm였지만 전례에서 양성이었고 크기가, 2.0 cm, 2.1 cm, 3.1 cm인 신경초종 3예도 모두 양성이었다.
고 찰
상부 위장관의 점막하 종양은 내시경 검사 때 비교적 흔히 보는 종양이다 이 중 가장 흔한 것이 간엽 종양이. 다 앞서 기술한 바와 같이 간엽 종양은 다양한 이름으로. 명명되었고 그 분류에 대해서 논란도 많다.3,10-13 따라서 과거 상부 위장관 평활근 종양이라고 진단된 간엽 종양 의 일부분은 면역조직화학 염색을 시행하면 간질 종양일 가능성이 많기 때문에 평활근 종양과 간질 종양의 정확 한 임상상을 알기 어려운 것은 당연한 일이다.
등
Kwon 14이191명의 간엽 종양을 분석하여 보고한 바 에 따르면 식도의 간엽 종양 6명 중 5 (83.3)명 이 평활근 종이었고 1명이 신경초종이었다. 많은 보고에서 식도의 간엽 종양은 평활근종이 가장 흔하고 평활근육종이나 신 경초종은 드물며15-17 이번 연구에서도 식도 간엽 종양은 모두 평활근종이었다 뿐만 아니라 기존의 보고. 8와 같이 이번 연구에서도 악성 변화한 것은 없었다.
위에서 발견된 간엽 종양은 c-kit 유전자 돌연변이가 보고되기 이전과 이후 보고들에는 상당한 차이가 있다.
년 한 보고에서는 명의 위 점막하 종양 환자 중
1991 24
평활근종이15 (32.5%),예 평활근육종이 예3 (12.5%)로 평 활근 종양이 가장 많았는데18 이는 아마도 간질 종양이 상당 부분을 차지했기 때문이다 과거 악성 평활근종으. 로 진단 받았던 환자 17예 간질 종양으로 진단 받았던, 환자 7예와 평활근종으로 진단 받았던 5예를 대상으로 다시SMA와S-100단백질의 발현 유무를 검사한 연구에 서13명이SMA와S-100 항체에 모두 염색되지 않았다.19 년 한 보고에 따르면 위의 간엽 종양 명 중 평활
2002 40
근종은 명7 (17.5%),간질 종양은22 (55%),명 신경초종이
명 으로 간질 종양이 가장 많은 비율을 차지한 11 (27.5%)
점은 이번 결과와 비슷하였다.14
간엽 종양의 악성변화에 대한 기준에서 1993년 Amin 등20은 크기와 관계없이 유사분열의 수가 5/50 high power 이상이면 악성으로 분류하였고 이하 간
field (HPF) , 6 cm
질 종양에서는 전이가 거의 없고 6 cm과 10 cm 사이에 서는 30%에서, 10 cm이상에서는60%에서 전이가 있었 다.21 면역화학염색으로 간질 종양을 감별하기 시작한 이 후 간질 종양의 악성화에 대한 연구가 많이 진행되고 있 는데 간엽 종양인 평활근 종양과 신경 종양은 악성 변화, 가 적은 데 비해 간질 종양은 악성화된 것이 10-30%나 된다.22또5-10 cm보다 큰 경우와10 HPF당2-5이상의 유사분열이 있는 경우를 악성이라고 하기도 하며23 국내 보고는 5 cm이하에서는 수술 후10%에서, 5 cm이상에 서는71.4%에서 재발한다 유사분열의 수가. 5/50 HPF이 하일 때는 18.2%에서 그 이상에서는, 69.2%에서 재발된 다.24일부에서 종양의 크기가 1 cm보다 큰 경우 어떤 간 질 종양도 양성이라고 단정할 수가 없는 것처럼25 향후 재발 등의 가능성이 있으며 양성 악성으로 나누기보다, 는 하나의 연속선상에 있다고 본다.1 예후에 영향을 주는 인자로는 종양의 크기와 위치 유사분열의 수 진단 당시, , 전이 여부이지만 통일된 기준이 없다가 최근 간질 종양 의 예후 예측에 대해 합의를 도출하였고 지금은 이 분류 법을 대부분 이용하고 있다 이번 연구에서도 간질 종양. 환자36명을 이 기준대로 분류해 보았을 때 초저위험군, 저위험군 중등도 위험군과 고위험군이 모두 존재하였고, 십이지장의 경우도 초저위험군 저위험군 중등도 위험군, , 과 고위험군이 모두 존재하였다 간질 종양의 크기로 보. 았을 때1 cm이하의 작은 종양은 모두 초저위험군에 속 하였고, 1 cm에서2 cm사이에는 초저위험군이55.6%,저 위험군이22.2%였으며 고위험군도, 22.2%였다 주목할 만. 한 것은1.2 cm 크기의 두 간질 종양이 고위험군이었다 는 점이다 이는 양성 악성을 나눌 때 기준으로 삼았던. , 에 비해 매우 작은 편이어서 내시경검사 중 발견된
5 cm ,
작은 점막하 종양을 어떻게 치료하고 추적할 것인가 하 는 점에서 고려해야 할 사항이다 이는. 1 cm 미만의 매 우 작은 위장관 간질 종양을 제외하고는 어떤 간질 종양 도 양성으로 불리기 어렵다는 보고와 일치하지만9 비용 효과면에서는 다시 연구해 보아야 할 사항이다 하지만.
이하의 작은 간엽 종양은 모두 평활근종이거나
1 cm 5%
미만의 낮은 전이율을 보이는 초저위험군의 간질 종양이 었다 점막하 종양의 크기를. 1 cm를 기준으로 했을 때 1 보다 큰 간엽 종양의 가 저위험군 중등도 위험
cm 56.1% ,
군 고위험군이었다, .
점막하 종양에서 종양의 크기가 중요하지만 내시경으
392 대한소화기학회지 제: 45권 제 호6 , 2005
로 관찰한 크기가 실제 종양의 크기를 얼마나 반영하는 지도 고려해야 한다 이번 연구에서 내시경 계측치와 내. 시경 초음파의 크기 차이가 0.3±0.6 cm였고 내시경 계측 치와 실제 제거된 종양 검체의 크기 차이는 0.3±0.8 cm 로 유의한 차이가 없었다 그러나 내시경 계측치가. 1 cm 미만이었으나 실제 크기가 1 cm 이상인 경우도 있었다. 비록 이 차이에 대한 연구는 없으나 아직까지는 내시경 검사 중 생검 겸자의 크기를 기준으로 하여 세심히 크기 를 측정하고 내시경 초음파를 이용하는 것이 중요하다.26 간엽 종양을 분류하고 간질 종양의 악성 위험도를 따 지는 것은 조직 검사를 시행할 수 있는 조직을 얻었을 때 가능한 일이다 우연히 점막하 종양을 발견하였을 때. 일반적인 생검 겸자로 조직 검사를 시행하여 간엽 종양 의 조직을 얻는 것은 어려운 일이며 또 어떤 점막하 종 양일 때 침습 검사나 근치 치료가 필요한지에 대한 가이 드라인이 없는 실정이다.
이번 연구 결과를 바탕으로 하면 점막하 종양 중 식도 는 평활근종이 많고 평활근육종이나 간질 종양일 가능성 이 낮으므로 크기가 아주 큰 경우가 아니면 조직 확진과 치료를 위한 수술을 적극적으로 권유할 필요가 없다 위. 에서 발견된 간엽 종양은 간질 종양이 가장 많고1 cm보 다 작으면 양성일 가능성이 크지만 이보다 큰 경우는 양 성이라고 단정하기 어렵고 활성도가 고위험군일 가능성 도 있기 때문에, 1 cm보다 큰 경우 적극적인 조직 검사 나 엄격한 추적 관찰이 필요하다 또한 최근에는 내시경. 초음파검사의 발달과 보편화로 점막층과 점막하층에서 원발한 점막하 종양의 내시경 절제술에 대한 많은 보고 들이 있으며 비교적 안전하고 우수한 성적을 보고하고 있으므로 좀 더 적극적으로 침습 접근을 할 필요가 있다.
더 많은 데이터를 확보한 연구와 실제 임상에서 1 cm보 다 큰 점막하 종양을 모두 내시경 절제나 수술을 하는 것이 비용 효과적인지에 대해서도 추후 연구가 이루어져 야 하겠다 또 작은 크기의 점막하 종양까지 모두 제거하. 는 것이 현실적으로 어려운 점임을 고려할 때, Guillotine 생검 겸자 같이 조직을 얻기 위한 여러 가지 방법과 현 실적으로 쉽게 이용될 수 있는 장치의 개발이 있어야 할 것이다 또한 이번 연구의 디자인에서 해결이 어려웠던. , 선택 오차 문제를 극복하여 보다 확실한 결론을 도출할 수 있는 연구가 필요하다.
요 약
목적: 점막하 종양은 상부 위장관 내시경 중 우연히 발견되는 경우가 많으며 그 중 간질 종양은 악성화 가능 성이 있기 때문에 최근 중요성이 커지고 있다 이에 저자.
들은 모든 상부 위장관 간엽 종양의 침습 접근이 필요한 지 알아보기 위해 수술이나 내시경 절제술로 조직 진단 이 가능하였던 상부 위장관 간엽 종양을 분석해 보았다.
대상 및 방법:2000년 월부터1 2004년 월까지 수술이나6 내시경 절제술로 상부 위장관 간엽 종양으로 진단된 환 자59명을 대상으로 내시경 소견 조직 소견을 조사했다, . 결과: 전체59명의 환자 중 식도, 12예의 경우 모두 양성 평활근종이었고 위는 간질 종양이32 (76.2%),예 평활근종
예 신경초종 예 였으며 십이지장은 간질
7 (16.7%), 3 (7.1%)
종양 예4 (80.0%),평활근종 예1 (20.0%)였다 내시경 계측. 치가1 cm 이하인 경우 평활근종 또는 초저위험군의 간 질 종양이었으나1 cm보다 큰 경우의56.1%가 저위험군 또는 중등도 위험군 고위험군의 간질 종양이었다, . 결론:
식도의 점막하 종양의 접근에서 평활근종이 많으므로 크 기가 큰 경우가 아니면 조직 확진과 치료를 위한 수술을 적극적으로 권유할 필요는 없다 또. 1 cm보다 큰 경우일 때는 양성이라고 단정 짓기 어렵기 때문에 적극적인 추 적 관찰이나 조직 검사를 하는 것이 좋을 것으로 생각되 며 향후 더 많은 환자를 대상으로 하여 비용효과 면에 대한 연구가 필요하다.
색인단어: 점막하 종양 간엽, 종양 간질 종양 조직 검사, ,
참고문헌
1. Kang YK. Prediction of malignant potential of gastrointestinal stromal tumors. Korean J Gastroenterol 2004;43:380-382.
2. DeMatteo RP. The GIST of targeted cancer therapy: a tumor (gastrointestinal stromal tumor), a mutated gene (c-kit), and a molecular inhibitor (STI571). Ann Surg Oncol 2002;9:831- 839.
3. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinal stromal tumors (GISTs): a review.
Eur J Cancer 2002;38:39-51.
4. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenetics. Am J Surg Pathol 1983;7:507-519.
5. Herrera GA, Pinto de Moraes H, Grizzle WE, Han SG.
Malignant small bowel neoplasm of enteric plexus derivation (plexosarcoma). Light and electron microscopic study confirm origin of the neoplasm. Dig Dis Sci 1984;29:275-284.
6. Hirota S, Isozaki K, Moriyama Y, et al. Gain of fuction mutations of c-kit in human gastrointestinal stromal tumors.
Science 1998;279:577-580.
7. Nishida T, Hirota S. Biological and clinical review of stromal tumors in the gastrointestinal tract. Histol Histopathol 2000;
15:1293-1310.
이은주 외 인 모든 상부 위장관 간엽 종양8 . (Mesenchymal Cell Tumor)의 침습 접근이 필요한가? 393
8. Miettinen M, Sarlomo-Rikala M, Sobin LH, Lasota J. Eso- phageal stromal tumors: a clinicopathologic, immunohisto- chemical, and molecular genetic study of 17 cases and com- parison with esophageal leiomyomas and leiomyosarcomas.
Am J Surg Pathol 2000;24:211-222.
9. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gas- trointestinal stromal tumors: a consensus approach. Hum Pathol 2002;33:459-465.
10. Lee EJ, Lee OJ, Kim TH, Jung WT. A clinical and immuno- histochemical study on gastrointestinal stromal tumor. Korean J Gastroenterol 2003;42:204-211.
11. Park KJ, Kim MC. Alimentary tract: clinical prognostic fac- tors in malignant gastrointestinal stromal tumors. Korean J Gastroenterol 2002;40:307-312.
12. Pidhorecky I, Cheney RT, Kraybill WG, Gibbs JF. Gastro- intestinal stromal tumors: current diagnosis, biologic behavior, and management. Ann Surg Oncol 2000;7:705-712.
13. Miettinen M, Lasota J. Gastrointestinal stromal tumors-defini- tion, clinical, histological, immunohistochemical, and mole- cular genetic features and differential diagnosis. Virchows Arch 2001;438:1-12.
14. Kwon MS, Lee SS, Ahn GH. Schwannomas of the gastroin- testinal tract: clinicopathological features of 12 cases in- cluding a case of esophageal tumor compared with those of gastrointestinal stromal tumors and leiomyomas of the gas- trointestinal tract. Pathol Res Pract 2002;198:605-613.
15. Hatch GF 3rd, Wertheimer-Hatch L, Hatch KF, et al. Tumors of the esophagus. World J Surg 2000;24:401-411.
16. Choong CK, Meyers BF. Benign esophageal tumors: introduc- tion, incidence, classification, and clinical features. Semin Thorac Cardiovasc Surg 2003;15:3-8.
17. Murase K, Hino A, Ozeki Y, Karagiri Y, Onitsuka A,
SugieS. Malignant schwannoma of the esophagus with lymph node metastasis: literature review of schwannoma of the esophagus. J Gastroenterol 2001;36:772-777.
18. Kim JH, Cho JY, Lee MS, Cho SW, Shim CS. Endoscopic ultrasonography (EUS) in the diagnosis of submucosal tumor (SMT) of the upper digestive tract. Korean J Med 1991;
41:313-323.
19. Kim HC, Kim WS, Yook JW, et al. Gastrointestinal stromal tumor in stomach: a clinicopathologic and immunohisto- chemical study. Korean J Gastroenterol 1998;32:320-331.
20. Amin MB, Ma CK, Linden MD, Kubus JJ, Zarbo RJ. Prog- nostic value of proliferating cell nuclear antigen index in gastric stromal tumors. Correlation with mitotic count and clinical outcome. Am J Clin Pathol 1993;100:428-432.
21. Appelman HD. Mesenchymal tumors of the gut: historical perspectives, new approaches, new results, and dose it make any difference? Monogr Pathol 1990;31:220-246.
22. Miettinen M, Sarlomo-Rikala M, Lasota J. Gastrointestinal stromal tumors: recent advances in understanding of their biology. Hum Pathol 1999;30:1213-1220.
23. Miettinen M, El-Rifai W, H L Sobin L, Lasota J. Evaluation of malignancy and prognosis of gastrointestinal stromal tu- mors: a review. Hum Pathol 2002;33:478-483.
24. Ha DW, Park CH. Gastrointestinal stromal tumors; clinico- pathological features and prognostic factors. J Korean Surg Soc 2001;61:295-299.
25. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gas- trointestinal stromal tumors: a consensus approach. Int J Surg Pathol 2002;10:81-89.
26. Hwang JH, Kimmey MB. The incidental upper gastrointestinal subepithelial mass. Gastroenterology 2004;126:301-307.