폐경기 여성에서 동맥경화증의 치료 또는 예방을 위한 호르몬 대치요법
전체 글
(2) 그 이전의 연구들에 비하여 많은 것으로 지적되기는 하. 받은 폐경기 여성에서도 생존율을 증가시키는 것으로. 지만 HERS 연구의 결과는 많은 실망을 안겨주었다.. 보고되었는데, 1,091명의 관동맥우회술을 시행받은 여. 따라서 이러한 호르몬 대치요법에 대한 항동맥경화. 성들을 대상으로한 Sullivan 등13)의 보고에 의하면 에. 효과에 대한 기전들을 이해하고 그에 따른 부작용들을. 스트로젠 대치요법을 받은 92명의 여성들의 10년 생. 검토하며 또한 근래 들어 시도되고 있는 여러 전향적. 존율이 59.3%로 999명의 에스트로젠 대치요법을 시. 임상연구들과 호르몬 대치요법의 대안들에 관하여 검. 행 받지 않은 여성들의 10년 생존율 46.3%보다 의미. 토하여 봄으로써 폐경기 여성에서 항동맥경화 치료에. 있게 높았다고 보고하였다.. 종사하는 임상의들에게 도움을 주고자 한다.. 에스트로젠의 항동맥경화 효과의 기전. 본. 문 에스트로젠의 지단백에 대한 효과. 여성 호르몬 대치요법과 심혈관 질환. 폐경기 여성에게 에스트로젠 제제를 경구투여시 LDL. 폐경기 여성에서 에스트로젠 대치요법을 실시하였을. 콜레스테롤 수치를 약 15% 정도 낮추며, HDL 콜레스. 경우 심혈관 질환의 발병이 줄어들었음은 이미 여러. 테롤 수치를 약 15% 정도 증가시키는 것으로 알려져. 역학 연구들에서 발표되었다. Lipid Research Clinics. 있다.14-16) LDL 콜레스테롤의 저하는 hepatic 콜레스. Follow-up Study에서는 40세에서 69세 까지의 고지. 테롤의 담즙산(bile acid)으로 전환의 증가17)와 세포. 혈증이 있는 2,270명의 백인 여성들을 대상으로 평균. 표면에서의 LDL 수용체의 증가에 따른 LDL 제거의. 8.5년의 추적관찰 결과 에스트로젠 사용 여성들에서 심. 항진에 기인한다.18) 에스트로젠에 의한 HDL 콜레스테. 혈관 질환에 의한 사망률의 연령-교정 상대적 위험도. 롤의 증가는 apolipoprotein A-I 생성 증가와 hepatic. 가 0.34였으며, 연령이나 고혈압, 흡연 등의 다른 요인. lipase 활동성의 저하에 의한 때문인데,15)19) 이는 역. 들을 교정한 후에도 이 위험도가 낮았다고 한다.10). 콜레스테롤 운송(reverse cholesterol transport)에. 심혈관 질환이 없는 48,470명의 폐경기 여성들을 대. 가장 강력한 작용을 하는 HDL의 subparticle인 HDL2. 상으로한 Nurses’ Health Study의 보고에 따르면 현. 치를 증가시키기 때문이다. 또한 에스트로젠 치료는 혈. 재 에스트로젠을 복용 중인 여성에서 심각한 관동맥 질. 청 lipoprotein(a)치를 저하시키는 것으로 알려져 있는. 환의 상대적 위험도는 0.5이었으며, 심혈관 질환에 의. 데,14)20) 폐경기 이후에 증가하는 것으로 알려진21) 이. 한 사망률의 상대적 위험도는 0.72이었다고 한다.3) 이. lipoprotein(a)는 plasminogen과 상이한 구조를 가지. 와 같은 호의적인 효과는 흡연, 당뇨, 고혈압, 비만, 가. 고 있는 proenzyme이다. Plasminogen은 혈관 내피세. 족력, 피임약 복용의 과거력 등 관동맥 위험 요소들을. 포에서 분비되는 plasminogen activator에 의해 내피. 교정 후 10년 추적 관찰 경우에도 계속적인 효과를 나. 세포 표면에서 활성화되어 fibrin함유 응혈(clot)을 용. 11). 타내었다. O’Keefe 등 은 처음으로 경피적 관동맥 확. 해시키는 작용을 하는데, 이 lipoprotein(a)가 내피세. 장술을 받은 337명의 폐경기 여성에서 호르몬 대치요. 포 활성화 부위에 plasminogen과 상호 경쟁적으로 작. 법이 재협착, 심근 경색증, 뇌졸중, 사망등 장기 결과에. 용하여 plasminogen의 작용을 방해함으로써 proathe-. 대한 효과를 측정하였는데, 7년 생존율이 에스트로젠. rogenic, antithrombolytic 효과를 나타내게 된다.22). 복용 군에서 93%, 대조군에서 75%로 나타났으며, 또. 여러 동물실험들에 의하면 LDL 콜레스테롤은 혈관. 한 심혈관 질환에 의한 사고 역시 에스트로젠 복용 군. 벽의 free radical에 의해 산화된 후23)에 내피세포 산. 에서 12%로 대조군의 35% 보다 의미있게 낮았다고. 화 질소의 생성과 생활성에 중요한 영향을 미치는 것으. 보고하였다. Coronary Angioplasty Versus Excisional. 로 알려져 있다.24)25) 여러 치료에 의해 혈중 LDL 콜. Atherectomy Trial(CAVEAT)에서도 관동맥 질환이. 레스테롤을 저하시키면 이러한 LDL 콜레스테롤의 통. 있는 여성에서 죽상반 절제술 후 에스트로젠을 복용하. 과와 세포외 간질(extracellular matrix)에 의한 포획. 였을 경우에 재협착의 지표인 최소 혈관 직경의 손실이. 을 저하시켜 산화 LDL콜레스테롤의 농도가 감소하게. 적었다고 한다.12) 에스트로젠은 또한 관동맥 우회술을. 된다. 산화 LDL 콜레스테롤은 여러 가지 proathe-. 640. Korean Circulation J 1999;29(6):639-651.
(3) rogenic 특성을 가지고 있는데, 조직 대식세포에 의해. 의 연구에 따르면 17β-estradiol을 좌측 관동맥으로. 섭취된 후 포말세포(foam cell)로의 전환(동맥경화증의. 투여하였을 경우에 내피의존성 혈관 확장제인 아세틸. 초기 조직학적 지표) 된 후, 동맥경화반의 지질 pool을. 콜린에 대한 심외막 그리고 미세혈관 반응이 항진 되었. 구성한다.. 는데, 이는 에스트로젠에 의해 관동맥 내피세포에서 혈. 산화 LDL 콜레스테롤은 또한 proinflammatory cy-. 관확장 인자의 분비가 자극되었음을 의미한다. 이러한. tokines과 chemoattractant peptide의 유전자를 발현. 아세틸콜린 매개 혈관 확장능의 항진은 기저상태에서. (gene expression) 시켜, monocyte의 혈관벽으로의. 아세틸콜린에 대한 혈관확장능이 가장 저하되어 있는. 이동 및 대식세포(macrophage)로의 전환을 일으키며,. 즉 가장 심한 내피세포 기능장애를 보여준 경우에서 특. adhesion molecule의 유전자를 발현시켜 염증세포들의. 히 잘 나타났다. 또한 adenosine이나 nitroprusside와. 26-28). 유인을 촉진하고 혈관벽내로의 이동을 촉진시킨다.. 같은 내피세포 비의존성 확장능의 항진에 의한 유량의. 산화 LDL 콜레스테롤 특히 lysophosphatidylcholine. 증가가 관찰되지 않았다는 사실은 estradiol이 생리적. 과 같은 oxidized phospholipid component는 산화 질. 농도하에서 선택적으로 내피세포 의존성 혈관확장을 강. 소 합성효소(nitric oxide synthase)의 활동을 억제하. 화시켰음을 의미한다고 하겠다.. 고, 혈관 내피세포에서 생성된 산화 질소를 비활성화. Lieberman 등35)은 13명의 폐경기 여성에게 경구. 시킨다.24)25) 미국 국립 보건원 심장내과 Cannon 등29). estradiol을 9주간 복용시 내피세포와는 독립적으로 혈. 은 17β-estradiol을 폐경기 여성에게 3주 투여시 LDL. 관을 확장시키는 나이트로 글리세린에 의한 혈관 확장. 콜레스테롤의 산화를 방지함을 보고한 바 있는데, 이와. 의 증가 없이 내피세포 산화질소 분비 정도를 측정하는. 같은 산화 방지 효과가 결국은 항동맥경화(antiathe-. 반동충혈(reactive hyperemia)시 혈류 매개 상완 동. rogenic) 효과를 가지는 것으로 여겨진다.. 맥 확장능이 증가되었음을 보고하였는데, 이와 같이 에 스트로젠이 상완동맥 확장 반응에 미치는 효과는 전신 순환계의 유도 동맥(conduit artery)에서 내피세포에. 에스트로젠의 산화 질소 및 혈관 이완에 대한 효과 산화 질소는 혈관 내피세포에서 산화 질소 합성효소. 서 유래한 산화질소 분비에 선택적으로 영향을 주었기. 에 의해 지속적으로 생성되어 기체형태나 다른 미립자. 때문으로 여겨진다. Koh 등14)은 conjugated equine. 의 부가물 형태로 혈관벽이나 혈관내로 분비된다. 산화. estrogen 0.625 mg을 28명의 고지혈증이 있는(평균. 질소는 혈관긴장도를 변형시키거나 혈관벽의 세포구성. LDL cholesterol 163 mg/dL) 폐경기 여성에게 투여. 을 조절하거나 혈소판과 염증세포가 내피세포에 부착. 하였을 경우 상완동맥의 혈류 매개 확장능이 증가되었. 하는 것을 억제하는 등의 작용으로 혈관내 항상성을 유. 음을 관찰하였는데, 이와같은 효과는 LDL 콜레스테롤. 지한다.30) 에스트로젠에 의한 혈중 LDL 콜레스테롤의. 치를 에스트로젠 보다 더욱 낮춘 simvastatin 10 mg. 저하는 산화 LDL 콜레스테롤의 조직내 농도를 감소시. 을 매일 복용한 경우에 필적하는 결과였다(Fig. 1).. 켜 산화 질소의 합성, 분비, 생활성을 촉진하게 된다.. Gerhard 등36)은 17명의 고지혈증이 있는 폐경기 여성. 또한 에스트로젠에 의한 lipoprotein(a)치의 저하 역. 에게 경피용 estradiol과 질내 micronized progeste-. 시 혈관벽에서 산화 질소의 생활성을 억제하는 산화. rone을 투여한 후 상완동맥의 내피세포 의존성 혈관확. lipoprotein(a)의 농도를 저하시켜 결국 산화 질소의 생. 장을 측정하였다. estradiol 경우 위약군보다 혈류 매개. 31). 활성을 촉진하게 된다.. 에스트로젠에 의해 그 수치가. 확장능이 증가되었음을 관찰하였고 또한 progesterone. 증가하는 것으로 알려진 HDL 콜레스테롤은 LDL 콜레. 은 estradiol의 혈류 매개 확장능의 증가를 약화시키지. 스테롤이 paraoxonase나 platelet activating factor. 않았다고 보고하였다.. acetyl hydrolase와 같은 세포막 관련 효소계에 의해 LDL 콜레스테롤이 산화되는 것을 방지하는데32-34) 이 또한 에스트로젠은 lipoprotein에 대한 효과와는 독립 8). 에스트로젠의 염증 반응에 대한 효과 동맥경화증에 의한 여러 증상들의 발현은 그 기전이. 는 간접적으로 산화 질소의 생활성을 촉진한다. 8). 적으로 산화 질소의 생활성을 촉진한다. Cannon 등. 만성 염증성 과정에 의한 것으로 여겨지고 있으며,37-39) 혈관벽으로 들어가서 산화된 LDL 콜레스테롤이 이와 641.
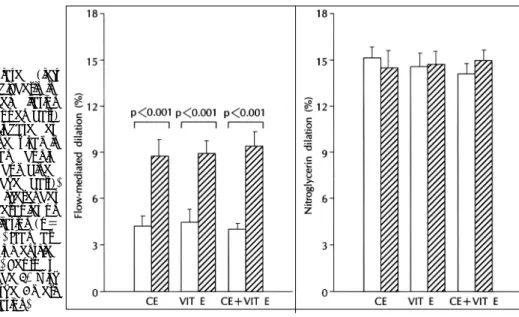
(4) 같은 염증반응을 발현시키고 지속 시키는 것으로 추정 26). molecule 등은 정상인보다 관동맥 질환이 있는 환자들. 산화 LDL 콜레스테롤과 여러 세포막 구성성. 에서 높은 것으로 보고되었다.40)41) VCAM-1, ICAM-1. 분들이 순환 염증세포들을 내피세포에 메어두면서 혈. 과 같은 여러 cell adhesion molecule이나 염증반응을. 관 벽내로의 이동을 촉진시키는 것으로 알려진 혈관내. 증대시키는 내피세포 유발 cytokine들의 유전자 전사. 피세포 표면의 adhesion molecule의 유전자 전사와. 는 이와 같은 핵결합 단백 유전자(nuclear binding. 발현(gene transcription and expression)을 촉진하는. protein gene)의 촉진부위(promotor region)인 NF-. 것으로 알려져 있다.26-28) 혈청의 vascular cell ad-. κB(Nuclear Transcription Factor)의 결합에 의해. hesion molecule(VCAM)-1, intercellular adhesion. 조절된다. 이 NF-κB는 정상적으로 proinflammatory. molecule(ICAM)-1, L-selectin과 같은 adhesion. cytokine이나 산화 LDL 또는 다른 길항제에 의해 활. 된다.. 성화 되기 전까지 비활성화 상태로 세포질(cytosol)내 에서 산화-환원반응 감작 기전(redox-sensitive mechanism)에 의하여 유지된다.42) 최근의 Physicians’ Health Study에서는 ICAM-1 치가 사분위수 최상위 군의 남성들이 최하위 군의 남 성들에 비하여 심혈관 질환에 의한 사고가 많았다고 한다.43) Koh 등14)의 연구 결과에서는 conjugated equine estrogen 단독 혹은 simvastatin과 복합 처방 한 경우에만 E-selectin, ICAM-1, VCAM-1 수치를 치료전에 비하여 의미있게 낮추었다(Fig. 2). 이와같은 소견은 Caulin-Glaser 등44)의 최근 보고, 즉 관동맥 조영술상 관동맥 질환이 있는 남성과 폐경기 여성에 서 호르몬 대치요법을 받지 않은 경우에 수용성 cell adhesion molecule 수치가 높았던 결과와도 일치한다. Koh 등45)은 최근의 임상연구에서 건강한 폐경기 여성 Fig. 1. Flow-mediated dilation before therapies (open bars) and following (hatched bars)CEE 0.625 mg daily for 6 weeks (left), simvastatin 10 mg daily for 6 weeks (center), and the combination of therapies daily for 6 weeks (right) in 28 hypercholesterolemic postmenopausal women. Standard error of the mean is identified by the error bars. Reproduced from reference 14 with permission from the American Heart Association.. 에서 에스트로젠의 항염증효과가 심방어기전 중의 한 중요한 기전임을 처음으로 보고한 바 있다. 에스트로젠의 혈액 응고 및 섬유소용해에 대한 효과 심근경색이 있었던 남성에게 에스트로젠을 복용시켰. Fig. 2. Percent change in the E-selectin (A), vascular cell adhesion molecule (VCAM-1)(B), and intercellular adhesion molecule (ICAM-1) levels (C) following conjugated estrogen (CE) alone, simvastatin (statin) alone, and combination therapies. Standard error of the mean is identified by the bars. Reproduced from reference 14 with permission from the American Heart Association.. 642. Korean Circulation J 1999;29(6):639-651.
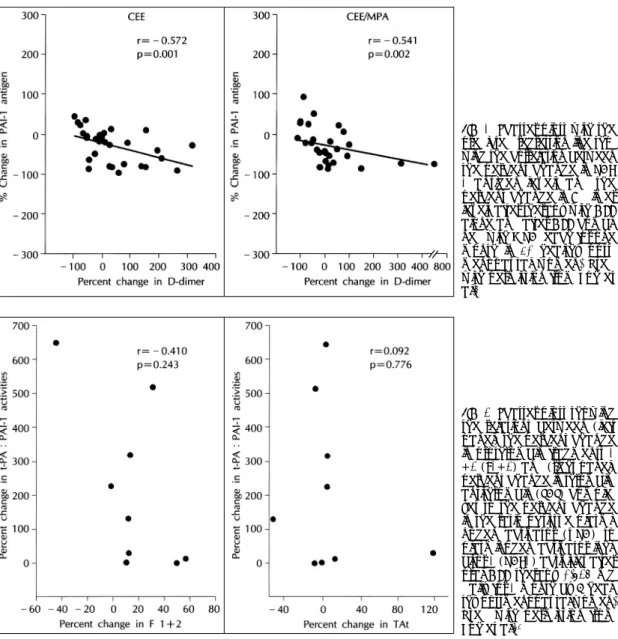
(5) 을 경우에 심근경색의 재발이나 정맥 혹은 폐 혈전색전. 증가는 심근 경색증의 위험을 증가시켰다는 보고55) 뿐. 증의 빈도가 증가하였다든지,46-49) 고용량의 에스트로. 만 아니라 여러 연구들에서 주된 섬유소 용해의 억제인. 젠을 함유한 피임약을 복용하였을 경우에 혈전색전증. 자인 PAI-1활성의 증가와 동맥경화증의 위험도 그리. 의 빈도가 높았다고 보고되어 왔지만,50-52) 일반적으로. 고 그에 따른 허혈성 질환의 발현간에는 관련이 있는. 호르몬 대치요법을 받는 폐경기 여성에서 혈전색전증. 것으로 보고되고 있다.56-61) 이러한 PAI-1 수치는 폐. 의 빈도는 낮았다. 하지만 최근 에스트로젠을 복용후. 경 전에 비하여 폐경 후에 높은 것으로 알려져 있는. 정맥 혈전색전증의 빈도를 관찰한 여러 관찰연구들에. 데,62) 에스트로젠을 복용하였을 경우에 복용하지 않는. 서 에스트로젠 복용 후에 혈전색전증의 빈도가 비복용. 폐경기 여성에 비하여 plasma PAI-1치가 의미 있게. 자에 비해 2~4배 높다고 보고되었다.46-49) 하지만 혈. 낮았다고 한다. Koh 등5) 역시 최근의 연구에서 에스트. 전색전증의 유병율은 에스트로젠 비복용자인 경우 매. 로젠 단독 치료나 프로제스테론과 복합 치료할 경우. 해 10,000명당 1명으로 매우 낮다. 하지만 최근 연구. PAI-1치가 약 50% 까지 감소하는 것을 보고하였고. 에 의하면 에스트로젠은 혈액 응고 경로를 활성화 시킨. (Fig. 3), 또한 PAI-1치의 감소는 plasmin에 의한. 53). 다. Caine 등 은 건강한 폐경기 여성에 에스트로젠을. cross-linked fibrin의 분해 산물인 D-dimer치의 증. 복용시켰을 경우에 용량의존적으로 thrombin 생성지표. 가와 역상관 관계가 있음을 즉 섬유소 용해 능력을 증. 인 prothrombin fragment 1+2(F1+2)와 활성 지표. 진 시킴을 보고 한 바 있다(Fig. 4). 경피용 estradiol. (fibrinopeptide A)를 상승시켰고, thrombin생성 억. 은 PAI-1치의 의미있는 변화를 일으키지 않았다. 이. 제인자(protein S)를 저하시킨다고 보고하였고, 다른. 는 경구로 투여한 estrogen제제 만이 간에서 PAI-1. 보고들에서도 에스트로젠을 복용한 폐경기 여성에서. 의 합성과 배설에 영향을 주었기 때문으로 생각된다.. factor Ⅶ 항원과 활성 그리고 F1+2의 수치를 증가시켰 54). 다고 보고하였다.. 최근 Koh 등63)은 에스트로젠이 용량 의존적으로 혈 액 응고 경로를 활성화 시킨다는 점에 착안하여 가장. Plasminogen activator inhibitor(PAI)-1는 혈관. 많이 사용되고 있는 용량의 호르몬 대치요법을 사용하. 내피세포, 혈소판, 간세포에서 생성되는 당단백으로 내. 는 폐경기 여성에서 혈액 응고와 섬유소 용해 경로와의. 피세포 유발 plasminogen activator와 공유결합하여. 상관 관계를 연구한 바 있다. 에스트로젠 투여 후 섬유. 혈전형성과 진행을 억제하는 기전을 불활성화 시킨다.. 소 용해 능력을 대변하는 t-PA:PAI-1 비율이 통계. 비록 남성들을 대상으로한 연구들이지만 PAI-1치의. 적으로 유의하게 모든 참여 폐경기 여성에서 6%에서. Fig. 3. Changes in plasma levels of plasminogen activator inhibitor (PAI-1) before and after therapy with oral conjugated equine estrogen (CEE) 0.625 mg daily for 1 month, or the combination of CEE 0.625 mg with medroxyprogesterone acetate (MPA) 2.5 mg daily taken for 1 month by 30 healthy postmenopausal women. Mean values are identified by open circles. Used with permission from Koh et al.5. 643.
(6) Fig. 4. Scatter plots with the predicted regression line showing the correlation between the percent change in PAI1 antigen levels and the percent change in D-dimer levels after therapy with CEE alone and after CEE combined with MPA, each for one month in 30 healthy postmenopausal women. Used with permission from Koh et al.5. Fig. 5. Scatter plots showing the relations between (left panel) the percent change in prothrombin fragments 1 +2 (F1+2) and (right panel) percent change in thrombinantithrombin (TAT) complexes to the percent change in the ratio of tissue plasminogen activator (t-PA) to plasminogen activator inhibitor-1 (PAI-1) activities after oral CEE therapy 0.625 mg daily for 1 month by 9 healthy postmenopausal women. Used with permission from Koh et al.63. 650%까지 증가를 보였다(p=0.008). 하지만 tPA:. 용은 자궁내막 이형성이나 암 발생율을 증가시킨다는. PAI-1 비율의 증가와 F1+2 혹은 thrombin-antith-. 것이다.64)65) PEPI 보고에 의하면 에스트로젠의 사용으. rombin(TAT) 백분율 변화와는 상관 관계가 없었다. 로 약 6배정도 자궁내막암 발생의 위험성이 높아졌다. (Fig. 5). 고 등의 연구 결과는 에스트로젠은 혈액 응고. 고 보고16) 하였으며, 자궁내막암의 전구체(precursor). 경로와 섬유소 용해에 다같이 영향을 미치지만 비교적. 인 adenomatous 또는 atypical 자궁내막증식이 3년동. 적은 용량의 호르몬 대치요법을 사용하는 경우에는 비. 안 약 33%정도 높았다고 보고하였다. 이러한 에스트. 사용 폐경기 여성보다 정맥 혹은 폐 혈전색전증의 빈도. 로젠 사용에 의한 위험성을 낮추기 위하여 에스트로젠/. 가 왜 많이 높지 않은지를 설명해 주는 연구이다.. 프로제스테론 복합 처방을 선호하게 되었으며 많은 보 고들에서 이러한 복합처방으로 에스트로젠 단독 처방. 호르몬 대치요법과 자궁내막 및 유방암 현재 사용되는 에스트로젠 대치요법의 가장 큰 부작 644. 에 의한 자궁내막암의 위험성을 많이 낮출 수 있었다고 보고하였다.66-69) 하지만 근래에 들어서 이러한 프로제 Korean Circulation J 1999;29(6):639-651.
(7) 스테론의 추가가 에스트로젠 치료에 의한 심혈관 질환. 택하여 무작위적으로 복용하게 한 후 최소 9년동안 추. 의 위험성을 낮추는 효과들을 감소시킨다는 보고들이 나. 적 관찰을 하면서 호르몬 대치요법에 의한 관동맥 질환. 70-72). 오고 있다.. 73). 그렇지만 Grodstein 등 의 Nurses’. Health Study 59,337명의 여성들을 16년간 추적 관. 의 발생, 뇌졸중, 정맥 혈전색전증, 골절, 암의 발생등 에 대한 장기 효과들을 검증하게 된다.. 찰한 결과에 따르면, 호르몬 요법을 시행 받지 않은 여 성들에 비하여 주된 관동맥 심질환의 빈도가 큰 폭으로. 호르몬 대치요법의 대안. 감소하였는데, 에스트로젠과 프로제스테론을 투여 받은 여성들에서는 다변량 보정 상대적 위험도(multivariate. 선택적 에스트로젠 수용체 조절제(Selective estrogen. adjusted relative risk)가 0.39(95% 신뢰구간 0.19. receptor modulators). ~0.78), 에스트로젠 단독으로 투여 받은 여성들에서는. 에스트로젠의 복용은 호르몬에 민감한 유방이나 자. 상대적 위험도가 0.60(95% 신뢰구간 0.43~0.83)을. 궁과 같은 조직에 암을 유발할 위험성이 있기 때문에. 보여 에스트로젠과 프로제스테론을 투여받은 여성들에. 이와같은 위험성이 없는 에스트로젠 복합제의 개발에. 서 상대적 위험도가 더 낮았다. 호르몬 제제의 사용으. 관심을 가지게 되었다. 선택적 에스트로젠 수용체 조절. 로 뇌졸중 빈도의 의미있는 상승은 보이지 않았다고 한. 제가 그것으로 처음에는 유방암에 대해 에스트로젠 길. 다. 이와 같은 결과로 프로제스테론의 추가가 폐경기. 항작용을 가지므로 항-에스트로젠 제제로 분류되었었. 여성에서 에스트로젠 치료에 의한 심장보호 효과를 약. 다. tamoxifen은 유방과 같은 몇몇 조직에서는 에스트. 화시킨다는 증거는 없었다고 하였다. 또한 에스트로젠. 로젠의 작용을 억제하는 반면 자궁이나 뼈에서는 에스. 은 유방암을 발생 시킬 수 있는 것으로 알려져 있다.. 트로젠과 같은 효과를 나타내는 것으로 밝혀졌다. Ta-. 74). Colditz 등 은 Nurses’ Health Study에서 에스트로. moxifen은 에스트로젠처럼 LDL 콜레스테롤을 낮추고. 젠을 단독으로 사용할 경우 상대적 위험도가 1.32, 프. LDL이 산화되는 것을 방지한다.75) 하지만 tamoxifen. 로제스테론과 함께 사용할 경우 상대적 위험도가 1.41. 은 정맥 혈전색전증의 빈도를 증가시키고 자궁암도 증. 로 보고하였고, 5년 이상 복용할 경우 보정된 상대적. 가시키는 것으로 알려져 있다.76). 위험도가 1.46으로 보고하였다.. Raloxifen은 유방과 자궁에 에스트로젠 효과가 없는 제제로 골다공증의 예방제로 FDA의 인가를 받은 약. 현재 진행중인 폐경기 여성에서 호르몬 대치요법에 관. 제이다. 390명의 건강한 폐경기 여성을 대상으로 한. 한 연구들. Walsh 등77)의 보고에 따르면 raloxifen은 LDL cho-. 비록 HERS 연구의 결과가 관동맥 심장 질환 사건에. lesterol을 12%낮추었으며 호르몬 대치요법의 경우는. 대한 호르몬 치료 효과를 측정하기 위한 첫 번째의 무. 14%를 낮추었다고 보고하였다. lipoprotein(a)는 호르. 작위 임상 연구였지만, National Institute of Health. 몬 대치요법시 19%의 저하가 있었으나 raloxifen 복. (NIH)에서는 관동맥 질환을 가진 여성에서 Women's. 용군에서는 약 8%의 저하가 관찰되었다고 한다. 호르. Angiographic Vitamin and Estrogen(WAVE) 연구,. 몬 대치요법 군에서 HDL cholesterol을 11%, 중성지. Women’s Estrogen/Progestin and Lipid-Lowering. 방을 20% 증가시키고 PAI-1을 약 29% 감소시킨데. Hormone Atherosclerosis Regression Trial(WELL-. 반해, raloxifen은 HDL cholesterol과 중성지방, PAI-. HART) 그리고 Estrogen Replacement and Athe-. 1수치의 의미있는 변화는 없었으나 fibrinogen은 12-. rosclerosis(ERA) 연구 등 다른 여러 이차 예방에 대. 14%를 감소시켰다고 한다. 현재 폐경기 여성에서 심. 한 연구들을 지원하고 있다. NIH에서는 또한 대규모의. 혈관 위험도에 관한 임상적 연구들이 진행되고 있으므. 일차예방에 관한 연구인 Women’s Health Initiative. 로 효과와 부작용에 대하여는 좀 더 그 결과를 지켜보. (WHI)도 역시 같이 지원하고 있는데, WHI에서는. 아야 할 것으로 생각된다.. 27,500명의 관동맥 질환의 과거력이 없는 폐경기 여성 들을 대상으로 에스트로젠, 에스트로젠과 프로제스테론 의 복합처방 또는 위약중 한가지를 자궁의 상태에 따라. 지질 저하제 HMG-CoA reductase 억제제(statin)를 복용한 경 645.
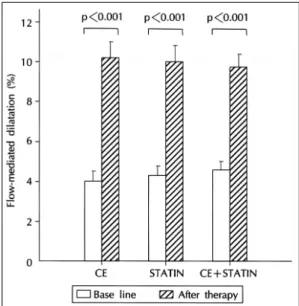
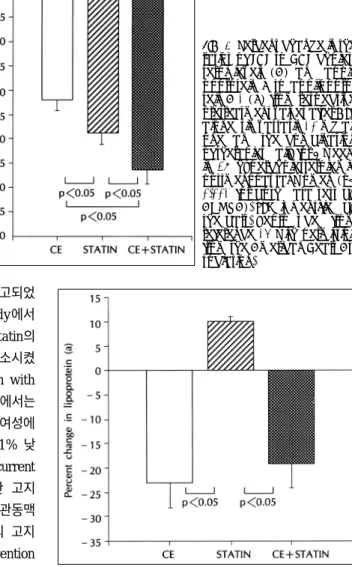
(8) Fig. 6. Percent change in the ratios of LDL to HDL cholesterol levels (A) and apolipoprotein B to apolipoprotein A-1 (B) from respective pretreatment values after CEE alone, simvastatin 10 mg alone, and the combination of therapies daily for 6 weeks in 28 hypercholesterolemic postmenopausal women (p< 0.001 for both data sets by ANOVA). SEM is identified by the bars. Reproduced from reference 14 with permission from the American Heart Association.. 우 심혈관 질환이 줄었다고 여러 연구들에서 보고되었 는데, Scandinavian Simvastatin Survival Study에서 는 고지혈증을 가진 827명의 여성에서 simvastatin의 복용은 심근경색과 같은 관동맥 질환을 35%감소시켰 다고 보고하였으며,78) Long-term Intervention with Pravastatin in Ischemic Disease(LIPID) 연구에서는 심근경색과 불안정형 협심증을 가진 1516명의 여성에 서 pravastatin 복용후 관동맥 질환의 위험이 11% 낮 추었다고 보고하였다.79) 또한 Cholesterol and Recurrent Events(CARE) 연구에서는 심근경색을 경험한 고지 혈증을 가진 여성들에서 pravastatin 복용 후 관동맥 질환을 54% 낮추었다고 보고하였고,. 80. 997명의 고지. 혈증이 있는 여성들을 대상으로 한 primary prevention trial인 Air Force/Texas Coronary Atherosclerosis Prevention Study에 따르면 lovastatin 복용 후 46% 의 관동맥 질환의 저하가 보였다고 한다.81) statin계통의 지질 저하제는 지단백에 대한 효과에서 에스트로젠 제제와는 기전이 다르기 때문에 Koh 등14). Fig. 7. Percent change in lipoprotein (a) from respective pretreatment values after CEE alone, simvastatin alone, and combination of therapies daily for 6 weeks in 28 hypercholesterolemic postmenopausal women (p<0.001 by ANOVA). SEM is identified by the bars. Reproduced from reference 14 with permission from the American Heart Association.. 은 simvastatin과 에스트로젠 각각의 단독 처방과 복. 가진 폐경기여성에서 지질 저하제를 이미 복용하고 있. 합 처방이 지단백에 미치는 영향을 연구하였다. sim-. 다 할지라도 에스트로젠 제제의 독특한 특성을 감안하. vastatin 10 mg과 conjugated equine estrogen의 복. 면 에스트로젠의 첨가가 동맥 경화증에 대한 혈관 예방. 합 처방은 LDL/HDL cholesterol의 비를 simvastatin. 효과에 좀 더 많은 이득을 줄 수 있을 것으로 여겨진다.. 단독 처방 보다 더 낮추고(Fig. 6), lipoprotein(a)(Fig. 7), PAI-1(Fig. 8), 염증 지표(Fig. 2)들을 simvastatin. 비타민 E. 단독 처방 보다 많이 낮추었다. 따라서 에스트로젠을. Vitamin E제제의 사용은 Nurses’ Health Study와. 포함한 경우에만 lipoprotein(a), 섬유소용해와 혈관. 여러 역학적 연구에서 심혈관 질환의 위험성을 낮추는. 염증 지표들을 개선 시켰음을 볼 때 비록 고지혈증을. 것으로 알려져 있다.82-85) 최근 Cambridge Heart. 646. Korean Circulation J 1999;29(6):639-651.
(9) Antioxidant Study(CHAOS)에서 vitamin E 400 혹. 억제하며, 혈소판에서의 thromboxane A2의 분비를. 은 800 IU를 복용한 군이 평균 510일 추적관찰한 결. 감소시키고 대식세포의 산화성 세포 독성효과를 저하. 과 위약군에 비해 비치명적 심근경색증 발병이 77%. 시키고 평활근 세포의 증식을 억제하고, LDL cholesterol. 감소되었다.86) Vitamin E는 HDL을 증가시키고 LDL. 의 산화를 방지하는 등의 여러 작용에 의해 동맥경화의. 87). 을 낮춘다는 보고가 있다.. Vitamin E(alpha-toco-. pherol)는 생체막에 가장 풍부한 지용성 항산화제로. 예방에 일조하게 된다.88)89) 실험결과에 의하면 항산화 제는 동맥경화를 지연시키는 것으로 알려져 있다.90)91). 산화성 내피세포 손상(oxidative endothelial injury)을. Conjugated equine estrogen은 직접적으로 산화질. 억제하고, phospholipase A2의 활성과 혈소판 응집을. 소의 분비를 자극하지만 LDL이 산화되는 것을 예방하 지 못한다.5) 따라서 conjugated equine estrogen과 비타민 E 치료는 산화질소의 생활성과 그에 따른 혈역 학적 효과와 염증반응, 혈전 생성 잠재력(thrombogenic potential)을 다르게 나타내리라 생각된다. 또한 이러 한 치료들의 생물학적 효과 역시 다르기 때문에 복합처 방은 상보적으로 작용하리라 생각할 수 있다. 따라서 동맥경화성 질환이 있는 경우나 위험성이 높은 폐경기 여성들에서 중요한 역할을 가질 것으로 생각된다. 최근 Koh 등92)은 폐경기 여성을 대상으로 하여 conjugated equine estrogen 0.625 mg과 비타민 E 1000 IU를 6 주씩 단독 혹은 복합 사용하는 연구를 시행하였다. 비 타민 E 사용은 에스트로젠과 마찬가지로 내피세포 의 존성 이완 반응을 유의하게 향상(Fig. 9) 시켰지만 지 단백, 염증반응, 혈전 생성 능력에 변화를 야기하지 않. Fig. 8. Percent change in the plasminogen activator inhibitor type-1 (PAI-1) following conjugated estrogen (CE) alone, simvastatin (statin) alone, and combination therapies. Standard error of the mean is identified by the bars. Reproduced from reference 14 with permission from the American Heart Association.. 았다. 따라서 비타민 E를 복용하는 폐경기 여성에서도 에스트로젠 제제의 독특한 특성을 감안하면 에스트로 젠의 첨가가 동맥 경화증에대한 혈관 예방 효과에 좀 더 많은 이득을 줄 수 있을 것으로 여겨진다.. Fig. 9. Flow-mediated (left panel) and nitroglycerin-induced (right panel) dilation before therapies (open bars) and following conjugated estrogen (CE) alone, vitamin E (VIT E) alone, and conjugated estrogen combined with vitamin E (hatched bars). There were no differences in the effect of therapies on flow-mediated dilation (p= 0.267 by ANOVA). Standard error of the mean is identified by the error bars. Reproduced from reference 92 with permission from the American Heart Association.. 647.
(10) Table 1. Guide to risk reduction for women Pharmacological Goal(s) Screening Recommendations interventions Hormone 1. Initiation or continuation of 1. Review menstrual status of 1. Counsel all women about the replacement therapy in women for whom women >40 y old potential benefits and risks therapy the potential benefits may of HRT, beginning at age 40 exceed the potential risks of 2. If menopausal status is unor as requested. therapy (Short-term therapy clear, measure FSH level. is indicated for treatment of 2. Individualize decision based menopausal symptoms.). on prior history and risk factors for CVD as well as risks 2. Minimize risk of adverse side of thromboembolic disease, effects through careful patigallbladder disease, osteoent selection and appropriate porosis, breast cancer, and choice of therapy. other health risks.. 법을 현재하고 있으며, 40대인 경우 59.8%가 사용중. 결. 론. 인 것으로 보고되었다.98) 따라서 앞으로 더 많은 여성 들이 호르몬 대치요법을 사용할 것으로 예견된다. 하지. 여러 관찰 연구들을 통해 폐경기 여성에서 비록 pro-. 만 대단위의 무작위적인 임상 연구들 결과들이 나오기. gestin을 병용할지라도 에스트로젠은 심혈관 방어 효과. 전까지는 개별 환자들의 여러 가지 임상적인 소견들과. 가 가짐이 보고되었다. 에스트로젠은 혈관 손상과 동맥. 현재까지의 임상자료들에 기초한 에스트로젠 대치요법. 경화증이 있는 동물들을 대상으로 한 연구나, 사람에서. 의 상대적인 이득-위험에 관하여 환자들과 충분히 논. 지질에 대한 효과, 혈관 기능에 대한 작용 그리고 섬유. 의한 후 그 치료 여부를 1999년 5월에 발표된 Guide. 소 용해 작용에 대한 연구들을 통하여 그 이로운 효과. to Preventive Cardiology for Women의 지침99)(Ta-. 가 보고되고 있다.93) 그렇지만 관동맥 질환이 있는 폐. ble 1)에 따라 결정하는 것이 바람직하다고 생각된다.94)96). 경기 여성에서 이차예방에 대한 호르몬 대치요법의 효 과를 검증한 최초의 무작위 임상 연구(HERS 연구)의. 중심 단어:동맥경화증 호르몬 대치요법・폐경기 여성.. 결과를 통하여 동맥경화성 심혈관 질환이 이미 발현된. REFERENCES. 여성들에서 호르몬 대치요법의 효과에 관한 관심을 불. 1) Suh SK. Practical guide in geriatric medicine for clini-. 러 오게 되었다. 현재 진행중인 여러 임상 연구들을 통 해 폐경기 여성에서 에스트로젠 단독 혹은 progestin. cians. 1st ed. Seoul: Korea Medical Press;1996.. 2) Lerner DJ, Kannel WB. Patterns of coronary heart. 과의 병용이 일차 또는 이차 예방을 함에 있어 위험성 을 능가하는 이득을 가져올 지에 대한 의문점들이 풀어. 3). 질 것으로 기대된다. 또한 선택적 에스트로젠 수용체 조절제가 심혈관 질환에 의한 위험성을 낮추는데 유용 하다는 것이 증명되기 위해서는 앞으로 이득 효과에 대 한 임상적인 연구 결과가 반드시 필요하다.94) 한편, 호르몬 대치요법이 혈액응고 경로를 활성화시 켜 정맥 혹은 폐 혈전색전증을 일으키기 때문에 혈액응. 4) 5). 고 위험인자(암, 부동, 흡연 혹은 선천성 혈액응고 방어 인자 결핍)를 가지고 있는 여성들에서는 호르몬 대치요 법을 피하는 것이 바람직하다고 생각된다.95-97) 최근 Women Physicians’ Health Study에서 1466 명의 폐경기 여성 의사들 중 47.4%가 호르몬 대치요 648. 6) 7). disease morbidity and mortality in the sexes: A 26-year follow-up of the Framingham population. Am Heart J 1986;111:383-90. Stampfer MJ, Colditz GA, Willett WC, Manson JE, Rosner B, Speizer FE, et al. Postmenopausal estrogen therapy and cardiovascular disease: Ten-year follow-up from the Nurses’ Healthy Study. N Engl J Med 1991;325: 756-62. Stampfer MJ, Colditz GA. Estrogen replacement therapy and coronary heart disease: A quantitative assessment of the epidemiologic evidence. Pre Med 1991;20:47-63. Koh KK, Rita Mincemoyer, Minh N. Bui, Gyorgy Csako, Frank Pucino, Victor Guetta, et al. Effects of hormone therapy on fibrinolytic potential in postmenopausal women. N Engl J Med 1997;336:683-90. Hayashi T, Yamada K, Esaki T. Estrogen increases endothelial nitric oxide by a receptor-mediated system. Biochem Biophys Res Commun 1995;214:847-55. Arnal JF, Clamens S, Pechet C. Ethinylestradiol does not enhance the expression of nitric oxide synthase in. Korean Circulation J 1999;29(6):639-651.
(11) 8). 9). 10). 11) 12). 13) 14). 15). 16). 17) 18) 19). 20). 21). 22). bovine endothelial cells but increases the release of bioactive nitric oxide by inhibiting superoxide anion production. Proc Natl Acad Sci USA 1996;93:4108-13. Guetta V, Quyyumi AA, Prasad A, Panza JA, Waclawiw M, Cannon RO III. The role of nitric oxide in coronary vascular effects of estrogen in postmenopausal women. Circulation 1997;96:2795-801. Hulley S, Grady D, Bush T, Furberg C, Herrington DM, Riggs B, Vittinghoff E, for the Heart and Estrogen/ progestin Replacement Study (HERS) Research Group. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. JAMA 1998;280:605-13. Bush TL, Barret-Connor E, Cowan LD. Cardiovascular mortality and noncontraceptive use of estrogen in women: Results from the Lipid Research Clinics Program Followup Study. Circulation 1987;75:1102. O’keefe JH, Kim SC, Hall RR, et al. Estrogen replacement therapy after coronary angioplasty in postmenopausal women. J Am Coll Cardiol 1997;29:1-5. O’brien JE, Peterson ED, Keeler GP, et al. Relation between estrogen replacement therapy and restenosis after percutaneous coronary interventions. J Am Coll Cardiol 1996;28:1111-8. Sullivan JM, El-Zeky F, Vander Awaag R, et al. Estrogen replacement therapy after coronary artery bypass surgery: Effect on survival. J Am Coll Cardiol 1994;23:7A. Koh KK, Cardillo C, Bui MN, Hathaway L, Csako G, Waclawiw M, et al. Vascular effects of estrogen and cholesterollowering therapies in hypercholesterolemic postmenopausal women. Circulation 1999;99:354-60. Walsh BW, Schiff I, Rosner B, Greenberg L, Ravnikar V, Sacks FM. Effects of postmenopausal estrogen replacement on the concentrations and metabolism of plasma lipoproteins. N Engl J Med 1991;325:1196-204. The Writing Group for the PEPI Trial. Effects of estrogen or estrogen/progestin regimens on heart disease risk factors in postmenopausal women. The postmenopausal Estrogen/ Progestin Interventions (PEPI) Trial. JAMA 1995;273: 199-208. Kushwahu RS, Bjorn KM. Effect of estrogen and progesterone on the hepatic cholesterol 7β-hydroxylase activity in ovariectomized baboons. Biophys Acta 1991;1084:300-1. Windler E, Kovanen PT, Chao YS, Brown MS, Havel RI, Goldstein JL. The estradiol-stimulated lipoprotein receptor of rat liver. J Biol Chem 1980;225:10464-71. Tikkamen MJ, Nikkila EA, Kussi T, Sipinens S. High density lipoprotein-2 and hepatic lipase: Reciprocal changes produced by estrogen and norgestrel. J Clin Endocrinol Metab 1982;54:1113-7. Soma MR, Osnago-Gadda I, Paoletti R, Fumagalli R, Morrisett JD, Meschia M, et al. The lowering of lipoprotein(a) induced by estrogen plus progesterone replacement therapy in postmenopausal women. Arch Intern Med 1993; 153:1462-8. Jenner SL, Orodovas JM, Lamon-Fava S, Schaefer MM, Wilson PFW, Castelli WP, et al. Effects of age, sex, and menopausal status on plasma lipoprotein(a) levels. The Framingham Offspring Study. Circulation 1993;87:1135-41. Loscalzo J. Lipoprotein(a). A unique risk factor for atherothrombotic disease. Arteriosclerosis 1990;10:672-9.. 23) Steinberg D, Parasarathy S, Carew TE, Khou JC, Witz-. 24). 25) 26). 27) 28). 29) 30) 31). 32) 33). 34) 35). 36). 37) 38) 39). 40). tum JL. Beyond cholesterol. Modification of low-density lipoprotein that increases its atherogenicity. New Engl J Med 1989;320:915-24. Shimokawa H, Flavahan NA, Vanhoutte PM. Loss of endothelial pertussis toxin-sensitive G protein function in atherosclerotic porcine coronary arteries. Circulation 1991; 83:652-60. Ohara Y, Peterson TE, Harrison DG. Hypercholesterolemia increases superoxide anion production. J Clin Invest 1993; 91:2546-51. Berliner JA, Navab M, Fogelman AM, Frank JS, Demer LL, Edwards PA, et al. Atherosclerosis: Basic mechanisms. Oxidation, inflammation and genetics. Ciculation 1995;91: 2488-96. Cybulsky MI, Gimbrone MA. Endothelial expression of a mononuclear leukocyte adhesion molecule during atherogenesis. Science 1991;252:788-91. Huang YH, Ronnelid J, Frostegard J. Oxidized LDL induces enhanced antibody formation and MHC class IIdependent IFN-g production in lymphocytes from healthy individuals. Arterioscler Thromb Vasc Biol 1995;15:1577-83. Sack MN, Rader DJ, Cannon RO. Oestrogen and inhibition of oxidation of low-density lipoproteins in postmenopausal women. Lancet 1994;343:269-70. Cooke JP, Tsao PS. Cytoprotective effects of nitric oxide. Circulation 1993;88:2451-5. Galle J, Bengen J, Schollmeyer P, Wanner C. Impairment of endothelium-dependent dilation in rabbit renal arteries by oxidized lipoprotein(a). Role of oxygen-derived radicals. Circulation 1995;92:1582-9. Parasarathy S, Barnett J, Fong LG. High-density lipoprotein inhibits the oxidative modification of low-density lipoprotein. Biochem Biophys Acta 1990;1044:275-83. Matsuda Y, Hirata K, Inoue N, Suematsu M, Kawashima S, Akita H, et al. High density lipoprotein reverses inhibitory effect of oxidized low density lipoprotein on endotheliumdependent arterial relaxation. Circ Res 1993;72:1103-9. Mackness MI, Durrington PN. High density lipoprotein, its enzymes and their potential to influence lipid peroxidation. Atherosclerosis 1995;115:243-53. Lieberman EH, Gerhard MD, Uehata A, Walsh BW, Selwyn AP, Ganz P, et al. Estrogen improves endotheliumdependent, flow-mediated vasodilation in postmenopausal women. Ann Intern Med 1994;121:936-41. Gerhard M, Walsh BW, Tawakol A, et al. Estradiol therapy combined with progesterone and endotheliumdependent vasodilation in postmenopausal women. Circulation 1998;98:1158-63. Ross R. The pathogenesis of atherosclerosis: A perspective for the 1900s. Nature 1993;362:801-9. Ross R. Atherosclerosis-an inflammatory disease. N Engl J Med 1999;340:115-26. Fuster V, Badimon L, Badimon JJ, Chesebro JH. The pathogenesis of coronary artery disease and the acute coronary syndromes. N Engl J Med 1992 ;326 :242-50, 310-8. Nakai K, Itoh C, Kawazoe K, Miura Y, Sotoyanagi H, Hotta K, et al. Concentration of soluble vascular cell adhesion molecule-1 (VCAM-1) correlated with expression of VCAM-1 mRNA in the human atherosclerotic aorta.. 649.
(12) Coronary Art Dis 1995;6:497-502.. 41) Haught WH, Mansour M, Rothlein R, Kishimoto TK,. 42). 43). 44). 45). 46) 47). 48). 49) 50) 51) 52) 53). 54) 55). 56). 57). Mainolfi EA, Hendricks JB, et al. Alterations in circulating intercellular adhesion molecule-1 and L-selectin: Further evidence for chronic inflammation in ischemic heart disease. Am Heart J 1996;132:1-8. Marui N, Offerman MK, Swerlick R, Kunsch C, Rosen CA, Ahmad M, et al. Vascular cell adhesion molecule-1 (VCAM-1) gene transcription and expression are regulated through an antioxidant-sensitive mechanism in human vascular endothelial cells. J Clin Invest 1993;92:1866-74. Ridker MP, Hennekens CH, Roitman-Johnson B, Stampfer MJ, Allen J. Plasma concentration of soluble intercellular adhesion molecule 1 and risks of future myocardial infarction in apparently healthy men. Lancet 1998;351:88-92. Caulin-Glaser T, Farrell WJ, Pfau SE, Zaret B, Bunger K, Setaro JF, et al. Modulation of circulating cell adhesion molecules in postmenopausal women with coronary artery disease. J Am Coll Cardiol 1998;31:1555-60. Koh KK, Bui MN, Rita Mincemoyer, Cannon RO III. Effects of hormone therapy on inflammatory cell adhesion molecules in postmenopausal women. Am J Cardiol 1997; 80:1505-7. Daly E, Vessey MP, Hawkins MM, et al. Risk of venous thromboembolism in users of hormone replacement therapy. Lancet 1996;348:977-80. Jick H, Derby LE, Myers MW, Vasilakis C, Newton KM. Risk of hospital admission for idiopathic venous thromboembolism among users of postmenopausal oestrogens. Lancet 1996;348:981-3. Medical Research Councils General Practice Research Framework. Randomised comparison of oestrogen versus oestrogen plus progestogen hormone replacement therapy in women with hysterectomy. BMJ 1996;312:473-8. Grodstein F, Stampfer MJ, Goldhaber SZ, et al. Prospective study of exogenous hormones and risk of pulmonary embolism in women. Lancet 1996;348:983-7. The Coronary Drug Project Research Group. The Coronary Drug Project: Initial findings leading to modifications of its research protocol. JAMA 1970;214:1303-13. Mann JI, Vessey MP, Thorogood M, Doll R. Myocardial infarction in young women with special references to oral contraceptive practice. BMJ 1975;2:241-5. Mammen EF. Oral contraceptives and blood coagulation: A critical review. Am J Obstet Gynecol 1982;142:781-90. Caine YG, Bauer KA, Barzegar S, Cate HT, Sacks FM, Walsh BW, et al. Coagulation activation following estrogen administration to postmenopausal women. Thromb Haemost 1992;68:392-5. Kroon U-B, Silfverstolper G, Tengborn L. The effects of transdermal estradiol and oral conjugated estrogens on haemostasis variables. Thromb Haemost 1994;71:420-3. Cortellaro M, Confracesco E, Boschetti C. Increased fibrin turnover and high PAI-1 activity as predictors of ischemic events in atherosclerotic patients. A case-control study. Arterioscler Thromb 1993;13:1412-7. Meade TW, Ruddock V, Stirling Y, Chakrabarti R, Miller GJ. Fibrinolytic activity, clotting factors, and long-term incidence of ischaemic heart disease in the Northwick Park Heart Study. Lancet 1993;342:1076-9. Salomaa V, Stinson V, Kark JD, Folsom AR, Davis CE,. 650. 58). 59) 60). 61). 62). 63). 64) 65) 66) 67) 68). 69) 70) 71). 72). 73). 74). Wu KK. Association of fibrinolytic parameters with early atherosclerosis: the ARIC Study. Circulation 1995;91: 284-90. Ridker PM, Vaughan DE, Stampfer MJ, Manson JE, Hennekens CH. Endogenous tissue-type plasminogen activator and risk of myocardial infarction. Lancet 1993; 341:1165-8. Hamsten A, de Faire U, Walldius G, et al. Plasminogen activator inhibitor in plasma: Risk factor for recurrent myocardial infarction. Lancet 1987;2:3-9. Cortellaro M, Cofrancesco E, Boschetti C, et al. for the PLAT Group. Increased fibrin turnover and high PAI-1 activity as predictors of ischemic events in atherosclerotic patients: A case-control study. Arterioscler Thromb 1993; 12:1412-7. Juhan-Vague I, Pyke SDM, Alessi MC, et al. Fibrinolytic factors and the risk of myocardial infarction or sudden death in patients with angina pectoris. Circulation 1996; 94:2057-63. Gebara OCE, Mittleman MA, Sutherland P. Association between increased estrogen status and increased fibrinolytic potential in the Framingham Offspring Study. Circulation 1995;91:1952-8. Koh KK, Horne MK III, Csako G, Waclawiw M, Cannon RO III. Relation of fibrinolytic potentiation by estrogen to coagulation pathway activation in postmenopausal women. Am J Cardiol 1999;83:466-9. Smith DC, Prentice R, Thompson DJ, Hermann WL. Association of exogenous estrgogen and endometrial cancer. N Engl J Med 1975;293:1164-7. Ziel HK, Finkle WD. Increased risk of endometrial carcinoma among users of conjugated estrogen. N Engl J Med 1975;293:1167-70. The Endometrial Cancer Collaborative Group. Estrogen replacement therapy and endometrial cancer risk: Unresolved issues. Obstet Gynecol 1993;81:256-71. Gambrell RD Jr. Prevention of endometrial cancer with progestogens. Maturitas 1986;8:159-68. Voigt LF, Weiss NS, Chu J, Daling JR, McKnight B, can Belle G. Progestagen supplementation of exogenous oestrogens and risk of endometrial cancer. Lancet 1991; 338:274-7. Jick SS, Walker AM, Jick H. Estrogen, progesterone, and endometrial cancer. Epidemiology 1993;4:20-4. Miller VM, Vanhoutte PM. Progesterone and modulation of endothelium-dependent responses in canine coronary arteries. Am J Physiol 1991;261:R1022-7. Williams JK, Honore EK, Washburn SA, Clarkson TB. Effects of hormone replacement therapy on reactivity of atherosclerotic coronary arteries in cynomolgus monkeys. J Am Coll Cardiol 1994;24:1757-61. Levine RL, Chen SJ, Durand J, Chen YF, Oparil S. Medroxyprogesterone attenuates estrogen-mediated inhibition of neointima formation after balloon injury of the rat carotid artery. Circulation 1996;94:2221-7. Grodstein F, Stampfer MJ, Manson J, Colditz GA, Willett WC, Bosner B, et al. Postmenopausal estrogen and progestin use and the risk of cardiovascular disease. N Engl J Med 1996;335:453-61. Colditz GA, Hankinson SE, Hunter DJ, Willett WC, Manson JE, Stampher MJ, et al. The use of estrgens and. Korean Circulation J 1999;29(6):639-651.
(13) 75). 76). 77). 78). 79) 80). 81). 82). 83). 84). 85). progestins and the risk of breast cancer in postmenopausal women. N Engl J Med 1995;332:1589-93. Guetta V, Lush RM, Figg WD, Waclawiw MA, Cannon RO III. Effects of the antiestrogen tamoxifen on lowdensity lipoprotein concentrations and oxidation in postmenopausal women. Am J Cardiol 1995;76:1072-3. Fisher B, Constatino JP, Wickerham DL, Redmond CK, Kavanah M, Cronin WM, other National Surgical Adjuvant Breast and bowel Project Investigators, et al. Tamoxifen for prevention of breast cancer: Report of the National Surgical Adjuvant Breast and Bowel P-I Study. J Natl Cancer Inst 1998;90:1371-88. Walsh BW, Kuller LH, Wild RA, Paul S, Farmer M, Lawrence JB, et al. Effects of raloxifene on serum lipids and coagulation factors in healthy postmenopausal women. JAMA 1998;279:1445-51. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 participants with coronary heart disease: The Scandinavian Simvastatin Survival Study. Lancet 1994;344:1383-9. The Long Term Intervention with Pravastatin in Ischemic Disease Study Group. N Engl J Med 1998;338:1349-57. Sacks FM, Pfeffer MA, Moye LA, et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996;335:1001-9. Downs JR, Clearfield M, Weis S, Whitney E, Shapiro DR, Beere PA, for the AFCAPS/TexCAPS Research Group. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: Results of AFCAPS/TexCAPS. JAMA 1998;279: 1615-22. Stampfer MJ, Hennekens CH, Manson JE, Colditz GA, Rosner B, Willett WC. Vitamin E consumption and the risk of coronary disease in women. N Engl J Med 1993; 328:1444-9. Hodis HN, Mack WJ, LaBree L, Cashin-Hemphill L, Sevanian A, Hohnson R. Serial coronary angiographic evidence that antioxidant vitamin intake reduces progression of coronary artery atherosclerosis. JAMA 1995;273: 1879-54. Knekt P, Reunanen A, Jarvinen R, Seppanen R, Heliovaara M, Aromaa A. Antioxidant vitamin intake and coronary mortality in a longitudinal population study. Am J Epidemiol 1994;139:1180-9. Kushi LH, Folsom AR, Prineas RJ, Mink PJ, Wu Y, Bostick RM. Dietary antioxidant vitamins and death from. 86). 87) 88) 89) 90) 91). 92). 93) 94) 95) 96). 97) 98). 99). coronary heart disease in postmenopausal women. N Engl J Med 1996;334:1156-62. Stephens NG, Parsons A, Schofield PM, Kelly F, Cheeseman K, Mitchinson MI. Randomized controlled trial of vitamin E in patients with coronary disease: Cambridge Heart Antioxidant Study (CHAOS) . Lancet 1996 ;347 : 781-6. Hermann WJ, Ward K, Faucett J. The effect of tocopherol on high-density lipoprotein cholesterol. Am J Clin Pathol 1979;72:848-52. Janero DR. Therapeutic potential of vitamin E in the pathogenesis of spontaneous atherosclerosis. Free Radical Biol Med 1991;41:129-44. Meydani M. Vitamin E. Lancet 1995;345:170-5. Parthasarathy S, Young SF, Witztum JL, Pittman RC, Steinberg D. Probucol inhibits oxidative modification of low density lipoprotein. J Clin Invest 1986;77:641-4. Morel DW, Di Corleto PE, Chisolm GM. Endothelial and smooth muscle cells alter low density lipoprotein in vitro by free radical oxidation. Arteriosclerosis. 1984;4: 357-64. Koh KK, Blum A, Hathaway L, Csako G, Waclawiw M, Panza JA, et al. Effects of estrogen and vitamin E therapies on vascular function in postmenopausal women. Circulation 1999 (in press). Mendelsohn ME, Karas RH. The protective effects of estrogen o the cardiovascular system. N Engl J Med 1999; 340:1801-11 Blum A, Koh KK, Cannon RO III. Hormone replacement therapy for prevention or treatment of atherosclerosis in postmenopausal women. Am J Geriactrics 1999 (in press). Koh KK, Cannon RO III. N Engl J Med (Letters) 1997; 337:201-2. Koh KK, Horne MK III, Cannon RO III. Effects of hormone replacement therapy on coagulation and fibrinolysis in postmenopausal women. Thromb Haemost 1999 (in press). The British Committee for Standards in Haematology. Guildelines on the investigation and management of thrombophilia. J Clin Pathol 1990;43:703-9. McNagny SE, Wenger NK, Frank E. Personal use of postmenopausal hormone replacement therapy by women physicians in the United States. Ann Intern Med 1997 ; 127:1093-6. Mosca L, Grundy SM, Judelson D, King K, Limacher M, Oparil S, et al. Guide to preventive cardiology for women. Circulation 1999;99:2480-4.. 651.
(14)
수치

관련 문서
surveillance study of patients with Emergency Department injuries under the control of the Korea Centers for Disease Control and Prevention (KCDC).Statistical
The secondary outcomes were CFU counts per milliliter of the needle wash samples in anaerobic culture, fever within 24 hours following EBUS- TBNA, and infectious
1 John Owen, Justification by Faith Alone, in The Works of John Owen, ed. John Bolt, trans. Scott Clark, "Do This and Live: Christ's Active Obedience as the
Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in
consumer's behavior behavior behavior behavior of of of of using using using using nail nail nail nail shop shop shop for shop for for women for women
Impact of age at first childbirth on glucose tolerance status in postmenopausal women: the 2008-2011 Korean National Health and Nutrition Examination
Surge Tank for prevention of
Prevalence of Undiagnosed Diabetes and Related Factors in Korean Postmenopausal Women:.. The 2011-2012 Korean National Health and