저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
의학 석사학위 논문
만성골수백혈병에서
tyrosine kinase
inhibitor의 치료효과 모니터링을
위한
major BCR-ABL1정량 검사;
LightCycler t(9;22) quantification
kit과 BCR-ABL Mbcr
I
S-MMR Dx ki
t비교
아 주 대 학 교
대 학 원
의학과/
의학전공
안 선 현
만성골수백혈병에서
tyrosine kinase
inhibitor의 치료효과 모니터링을
위한
major BCR-ABL1 정량 검사;
LightCycler t(9;22) quantification
kit과 BCR-ABL Mbcr
I
S-MMR Dx ki
t비교
지도교수
조 성 란
이 논문을 의학 석사학위 논문으로 제출함.
2013년
2월
아 주 대 학 교
대 학 원
의학과/
의학전공
안 선 현
안선현의 의학 석사학위 논문을 인준함.
심사위원장
이
위
교
인
심 사 위 원
임
영
애
인
심 사 위 원
조
성
란
인
아 주 대 학 교
대 학 원
2012년 12월 14일
i
- 국문요약 -
만성골수백혈병에서
tyrosine kinase inhibitor 의 치료효과
모니터링을
위한 major BCR-ABL1 정량 검사; LightCycler
t(9;22) quantification kit 과 BCR-ABL Mbcr IS-MMR Dx kit 비교
배경 : 만성골수백혈병 (chronic myelogenous leukemia, CML)은 골수증식 종양의 하나로 Philadelphia 염색체 (Ph)에 의한 BCR-ABL1 융합 유전자의 발생을 특징으로 한다. 최근 BCR-ABL1 정량 검사의 방법과 보고 방식의 통일을 위하여 정량 검사법의 표준화와 international scale (IS)이 제안되었으며, 이에 맞추어 BCR-ABL Mbcr IS-MMR Dx kit (IS-kit; IPSOGEN, France)가 개발되었다. 본 연구에서는 IS-kit 를 평가하고, IS 에 기반을 두지 않은 기존의 LightCycler t(9;22) quantification kit (LC kit; Roche)와 비교함으로써 CML 환자의 모니터링에 있어 IS-kit 의 유효성을 알아보고자 하였다. 대상 및 방법 : 2008 년 6 월부터 2011 년 9 월까지 아주대학교 병원에서 CML 로 처음 진단받은 24 명의 환자를 대상으로 하였으며, 환자들의 진단 시 RNA 검체와 약물 치료 3 개월에서 6 개월 뒤 추적 검사 시의 RNA 검체를 이용하여 IS-kit 로 BCR-ABL1 을 정량 하였고 의무 기록을 통하여 진단 시와 추적 검사 시 LC kit 로 시행되었던 결과를 수집하였다. 결과 : 진단 시와 추적 검사 시 LC kit 로 검사한 BCR-ABL1 정량 결과는 0.000343 ~ 0.35 (median 0.02)와 0 ~ 0.09 (median 0.000525) 이었으며, IS-kit 로 검사한 결과는 각각 0.017905 ~ 100.153 (median 61.125)와 0 ~ 66.390 (median 0.805) 이었다. Major molecular response (MMR, BCR-ABL1 < 0.1%) 상태를 결정함에 있어
IS-kit 와 LC kit 의 일치율은 92% (22/24)를 보였으며, 두 환자에서 LC kit 는 MMR 에 해당하는 수치를 보였으나 IS-kit 는 No MMR 에 해당하는 수치를 보였다. 차이를 보였던 두 환자의 의무기록을 검토한 결과 추적관찰 3 개월째에는 LC kit 로 시행한 검사 결과가 MMR 상태에 해당하였으나 6 개월과 9 개월에는 mRNA 값의 증가하여 No MMR 에 해당하였으며, 6 개월과 9 개월 검체를 IS-kit 로 검사 했을 때 역시 No MMR 상태로 나타났다. 결론 : IS-kit 는 MMR 상태 평가에 있어 LC kit 와 높은 일치율을 보일 뿐만 아니라 보다 더 정확하게 MMR 상태 도달을 판단할 수 있을 것으로 보인다. __ 핵심어 : CML, BCR-ABL1, RQ-PCR, MMR, IS
iii
차
례
국문요약 --- i 차례 ---iii 그림 차례 ---iv 표 차례 ---v Ⅰ. 서론 ---1 Ⅱ. 연구대상 및 방법 ---3 A. 연구 대상 ---3 B. 방법 ---4 1. LC kit 를 이용한 BCR-ABL1 정량---4 2. IS-kit 를 이용한 BCR-ABL1 정량 ---5 Ⅲ. 결과 ---9 A. 대상 환자군의 특징 ---9 B. MMR 에 대한 검사법 사이의 일치율 ---11 C. 검사법 사이의 상관관계 ---13 Ⅳ. 고찰---14 Ⅴ. 결론 ---19 참고문헌 ---20 ABSTRACT ---26그림
차례
그림 1. ABL 유전자의 Standard curve (예) --- 7 그림 2. BCR-ABL1 유전자의 Standard curve (예) ---7 그림 3. LC kit와 IS-kit에 의한 BCR-ABL1 정량(예) ---12 그림 4. LC kit 에 의한 BCR-ABL1 감소 정도(Log)와 IS-kit 로 측정한
v
표
차례
표 1. LC kit의 역전사 master mix 시약--- 4
표 2. LC kit의 RQ-PCR 반응 시약---5 표 3. LC kit의 RQ-PCR 주기---5 표 4. IS-kit의 역전사 반응 시약---6 표 5. IS-kit의 RQ-PCR 반응 시약---6 표 6. IS-kit의 RQ-PCR 주기---6 표 7. MMR 판정 기준---8 표 8. 대상 환자군의 특징---10 표 9. 각각의 kit에 의한 MMR 판정 결과---11
I.
서
론
만성골수백혈병 (chronic myelogenous leukemia, CML)은 모든 단계의 골수계 세포가 증식하는 골수증식 질환의 하나로 9 번과 22 번 염색체 장완의 상호 균형 전위에 의한 Philadelphia 염색체 (Ph)의 형성을 특징으로 한다(Ren, 2005). Ph 는 CML 환자의 약 99%와 성인 급성림프구백혈병 (acute lymphoblastic leukemia, ALL) 환자의 약 20% 가량에서 양성을 보이는 것으로 알려져 있어(Shtivelman 등, 1985; Westbrook 등, 1992) 고전적 염색체 검사가 CML 의 진단과 치료 후 모니터링에 사용되어 왔다. Ph 는 8.5kb 의 BCR-ABL1 mRNA 를 만들어 종양 세포들이 증가된 tyrosine kinase activity 를 갖게 한다(Baccarani 등, 2009; 2006). CML 의 치료 약제로 tyrosine kinase 의 activity 를 감소시키는 대표적 tyrosine kinase inhibitor (TKI)로 imatinib 이 1980 년대에 발명 되었으며, The International Randomized Study of Interferon and STI571 (IRIS) 연구를 통해 CML 의 만성기로 처음 진단된 환자들의 치료에 있어 유효성을 증명 받았다(Hughes 등, 2010; National Comprehensive Cancer Network, 2010). TKI 로 치료를 받은 많은 환자들은 염색체 검사상 정상 소견을 보이는 complete cytogenetic response (CCyR)에 도달하게 되고(Druker 등, 2006; O’Brien 등, 2003), 치료를 진행할수록 분자유전학적 검사에서도 정상소견을 보이는 complete molecular response (CMR)를 보이게 된다. 따라서 CML 환자의 모니터링을 위해 민감도가 높은 polymerase chain reaction (PCR)에 기반한 검사법이 필요하게 되었고, real-time quantitative PCR (RQ-PCR)은 minimal residual disease 를 판단할 수 있는 가장 우수한 방법으로 보고되었다(Hughes 등, 2003; Press 등, 2007; 2006).
2
-그러나, 현재 시행되고 있는 RQ-PCR 은 표준화 되어 있지 않고 검사실마다 보고 방식이 달라(Cross, 2009; Müller 등, 2007; Zhang 등, 2007) 검사실 간 상호 비교 가능한 정량법을 설립하기 위하여 2005 년 미국의 National Institutes of Health (NIH)에 CML 전문가들이 모여 표준화된 검사법을 제안하였고 MMR 에 대한 international scale (IS, BCR-ABL1 load < 0.1%)을 제안하였다(White 등, 2010).
최근 이러한 IS 에 기반을 둔 BCR-ABL Mbcr IS-MMR Dx kit (IS-kit; IPSOGEN, France)가 개발 되었으며 본 연구에서는 IS-kit 를 평가하고, 기존의 LC t(9;22) quantification kit (LC kit; Roche)와 비교함으로써 CML 치료 효과 모니터링에 있어 이들 검사법의 임상적 유용성을 평가해 보고자 하였다.
II. 연구 대상 및 방법
A.
연구 대상 2008년 6월부터 2011년 9월까지 아주대학교 병원에서 CML로 처음 진단받은 환자 중 진단 후 지속적으로 아주대학교 병원에서 약물 치료를 받으며 추적 관 찰 중인 24명의 환자들을 대상으로 하였다. -75℃에 보관 되어 있던 환자들의 RNA 검체 중 진단 당시와 약물 치료 3개월에서 6개월 뒤 추적 검사 시의 RNA 검체를 사용하였으며 농도를 1㎍/㎕로 맞춘 후 사용하였다. 본 연구는 아주대학 교 병원 임상시험 심사위원회(IRB)의 승인을 받았다.4
-B. 방법
IS-kit의 비교 평가를 위해 LC kit를 이용 하였으며 환자들의 진단 당시와 추 적 관찰 시 채취한 mRNA를 사용하였다.
1. LC kit를 이용한 BCR-ABL 정량
LC kit를 이용한 BCR-ABL의 정량을 위하여 -75℃에 보관되어 있던 mRNA를 해동하여 농도를 1㎍/㎕로 맞춘 후 10㎕의 mRNA와 아래 표 1에 따라 준비한 역 전사 master mix 10㎕를 튜브에 혼합하였다. cDNA를 합성하기 위해 위의 혼합물을 37℃ 온열기에 60분 동안 유지 한 후, 65℃에 10분 동안 넣어 활성화 되었던 역 전사 효소를 변성 시킨 후 0℃에 보관하였다.
표 1. LC kit의 역전사 master mix 시약.
Component Volume per single reaction 5X Reverse transcription buffer 4.0㎕
Random primer 0.2㎕ DNTP 0.4㎕ Reverse transcriptase 0.4㎕ RNase inhibitor 0.6㎕ H2O sterile, PCR Grade 4.4㎕ Total volume 10㎕
합성된 cDNA 5㎕에 표 2에 따라 준비된 RQ-PCR master mix 15㎕를 첨가 한 후 LC instrument에 넣어 BCR-ABL1 mRNA를 합성하였다. 합성은 95℃에서 30 초 동안 초기 변성 단계를 거쳐 3단계의 증폭기를 통해 이루어졌으며 증폭기는 표 3과 같은 주기를 45 주기 동안 반복하여 시행되었다(표 3).
표 2. LC kit의 RQ-PCR 반응 시약.
Component Volume per reaction t(9;22) or G6PDH detection mix 6.2㎕ 10X Reaction mix 2.0㎕ H2O, PCR grade 9.2㎕ Total volume 15㎕ 표 3. LC kit의 RQ-PCR 주기. 단계 온도 시간 Ramp rate Denaturation 95℃ 30초 20 ℃/s Amplification 95℃ 1초 20 ℃/s 64℃ 10초 20 ℃/s 72℃ 26초 20 ℃/s Cooling 40℃ 60초 20 ℃/s 2. IS-kit를 이용한 BCR-ABL1 정량
IS-kit를 사용한 BCR-ABL1의 정량을 위하여 -75℃에 보관되어 있던 mRNA 농도를 1㎍/㎕로 맞추어 사용하였다. 표 4와 같이 제조사의 지침에 따라 RT premix를 제조한 후 15㎕의 premix와 10㎕의 RNA를 혼합하여 cDNA를 합성 하 였으며, 표 5와 같이 RQ-PCR premix를 준비하여 15㎕의 premix와 5㎕의 cDNA와 혼합한 후 RQ-PCR을 시행하였다.
6
-표 4. IS-kit의 역전사 premix 시약.
RT Premix Volume for reaction 5X Reverse transcriptase buffer 5.0㎕ Random nonamer 5.25㎕ DNTP 2.0㎕ Reverse transcriptase 1.0㎕ RNase inhibitor 0.5㎕ DTT 1.25㎕ Total volume 15㎕ 표 5. IS-kit의 RQ-PCR 반응 시약.
RQ-PCR premix Volume for reaction Premix Ex Taq 10㎕ H2O, PCR grade 4.2㎕
25X Primer & Probe mix 0.8㎕
Total volume 15㎕ 표 6. IS-kit의 RQ-PCR 주기. 단계 온도 시간 Ramp rate Denaturation 95℃ 10 sec 20 ℃/s Amplification 95℃ 5초 20 ℃/s 60℃ 30초 20 ℃/s Cooling 36℃ 60초 20 ℃/s
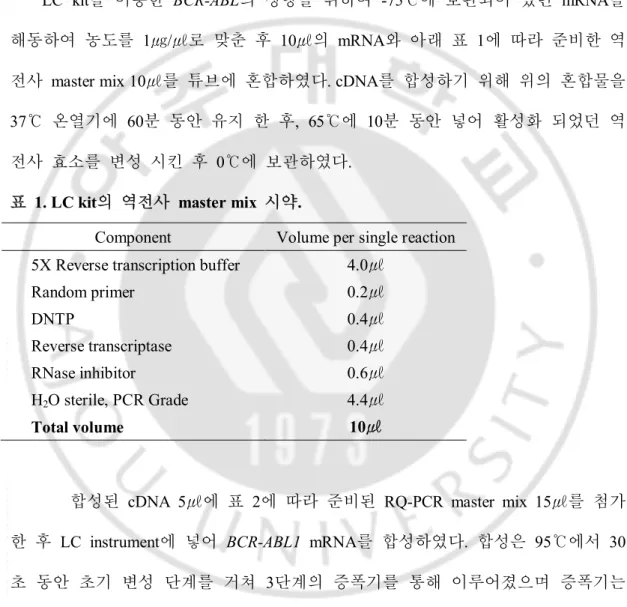
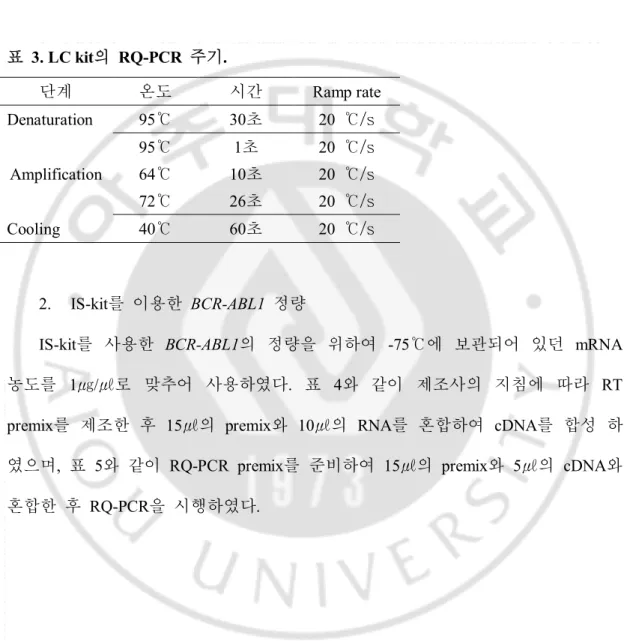
환자 검체와 같은 batch에서 standard plasmid (SP)를 사용하여 역전사와 RQ-PCR 시행 후 표준 곡선을 작성하였다. 모든 SP는 IS-kit에 포함되어 있으며, SP3, SP4, SP5와 SP6를 사용하여 ABL 유전자의 표준 곡선을 그리고 SP1, SP2, SP3, SP5와 SP6를 사용하여 BCR-ABL1 유전자의 표준 곡선을 작성하였다.
그림 1. ABL 유전자의 Standard curve (예).
그림 2. BCR-ABL1유전자의 Standard curve (예).
y = -3.237x + 39.30 R² = 0.998 0 10 20 30 40 1 2 Log (CN)3 4 5 6 y = -3.494x + 39.76 R² = 0.993 0 10 20 30 40 1 2 3 4 5 6 Log (CN) C t C t C t C t
8
-환자 검체로부터 얻은 Ct값을 표준 곡선에 대입하여 Log10 copy number
(Log CN) 를 구하였으며 IS-kit이 제공하는 아래의 수식에 근거하여 ABL 유전자 100 copy당 normalized copy number (NCN)를 구하였다.
NCN = (MbcrCN/ABLCN) ´ 100
각각의 IS-kit 에 제공되는 IS-Cal Value를 아래 수식에 대입하여 IS-NCN 을 계산 하였다.
IS-NCNsample = NCNsample ´ IS-Cal value/NCNcal
MMR은 아래의 표에 따라 결정 되었다.
표 7. MMR 판정 기준.
IS-NCNsample ≤ 0.05 0.05 < IS-NCNsample <0.15 IS-NCNsample ≥0.15 Major Molecular Response Grey zone around the MMR
cut-off: inconclusive result
No Major Molecular Response
LC kit와 IS-kit의 MMR 판정 결과를 비교하여 서로 차이를 보이는 검체에 대 해서는 재검을 시행하였다.
3. 통계 분석
MMR 판정 비교를 위해 chi-square 검정을 사용하였으며, 정량 결과 상관성 분석을 위해 회귀 분석을 사용하였다.
III.
결
과
A. 대상 환자군의 특징 환자들의 나이는 16세부터 77세까지 분포하였고 평균연령은 45.2세였으 며, 여자가 10명, 남자가 14명이었다. 환자 중 6명은 가속기에 속하였고 1명은 모 세포기, 그리고 17명은 만성기에 속하였다. 24명의 환자 모두 imatinib을 복용하고 있었으며 22명은 하루에 400mg을 1회 복용하였고 2명은 600mg을 복용하였다.- 10 -
표 8. 대상 환자군의 특징.
환자번호 성별 연령 병기 LC kit 정량결과 IS-kit 정량결과
Initial Follow-up Initial Follow-up 1 F 30 모세포기 0.29 0.02 67.450992 6.8840097 2 M 68 가속기 0.03 0.000256 61.125034 0.0990178 3 M 29 만성기 0.04 0.000035 43.880909 0.2591142 4 M 77 만성기 0.00396 0 37.290804 0 5 M 24 만성기 0.15 0.01 67.997259 0.8047523 6 F 53 만성기 0 0.00006 0.3636104 0.147177 7 M 37 가속기 0.02 0.00113 41.042285 0.4444724 8 M 69 만성기 0.02 0 36.970425 0 9 M 40 만성기 0.02 0 41.39795 0 10 M 35 만성기 0.07 0 68.208205 0.04017513 11 F 53 가속기 0.02 0 37.640251 0 12 F 52 만성기 0.06 0 64.256766 66.390761 13 M 37 가속기 0.03 0.01 64.258871 17.717469 14 M 41 만성기 0.18 0.09 100.1565 17.226468 15 M 36 만성기 0.01 0.02 63.025184 18.157738 16 F 42 만성기 0.00148 0.00145 48.792143 9.2073768 17 F 47 만성기 0.03 0.00294 70.390039 13.754333 18 F 38 만성기 0.00113 0 79.415068 0.040449 19 M 16 가속기 0.000666 0.0055 67.920254 9.3050317 20 M 51 만성기 0.04 0.00163 89.122342 4.7585798 21 F 63 만성기 0.35 0.06 34.602147 19.004845 22 M 37 가속기 0.05 0.000169 49.294207 0.5559604 23 F 52 만성기 0.000343 0.00361 62.305077 3.5879839 24 M 58 만성기 0.003 0 0.0588181 0
B. MMR에 대한 검사법 사이의 일치율
진단 시와 추적 검사 시 LC kit로 검사한 BCR-ABL1 RQ-PCR 결과는 0.000343 ~ 0.35 (median 0.02)와 0 ~ 0.09 (median 0.000525) 이었으며, IS-kit로 검사한 결과는 각각 0.017905 ~ 100.153 (median 61.125)와 0 ~ 66.390 (median 0.805) 이었다. MMR 상태를 결정함에 있어 IS-kit와 LC kit의 일치율은 92% (22/24)였으 며 P < 0.001로 두 검사법 사이에 유의한 차이가 있는 것으로 나타났다. 두 kit로 비교 시 서로 상이한 결과를 보인 환자들은 LC kit로 시행한 검사에서는 MMR 상태를 보였으나 IS-kit로 시행한 검사에서는 No MMR 상태로 나타났다. 표 9. 각각의 kit 에 의한 MMR 판정 결과. IS-kit LC kit MMR No MMR MMR 7 2 No MMR 0 15
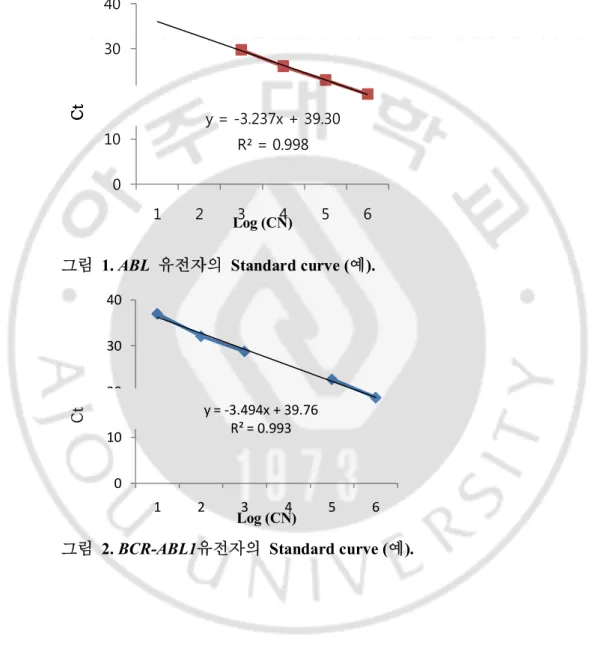
- 12 - A. B. C. D. E. F.
그림 3. LC kit와 IS-kit에 의한 BCR-ABL1 정량(예). LC kit를 사용하여 진단 시 BCR-ABL1 정량 (A와 B)을 시행 하였고 3개월 후 추적 검사 시 (C와 D) 정량 결
과는 3 log 이상 감소를 보여 MMR 상태를 보였으나 추적 검사 검체를 IS-kit로 검사 시 (E와 F) IS-NCN 수치는 No MMR 상태를 보였다.
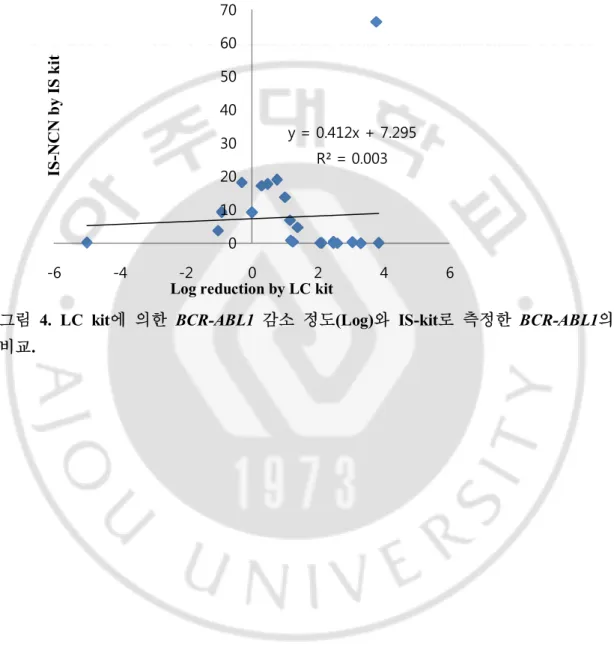
C. 검사법 사이의 상관관계
LC kit로 검사한 BCR-ABL1 정량 수치에 대하여 진단 시를 기준으로 추 적 관찰 시의 감소 정도를 Log로 표시한 결과와 추적 관찰 시 검체를 IS-kit로 검사한 결과의 상관관계를 구하였으며 이 때 R2은 0.0033이었다.
그림 4. LC kit에 의한 BCR-ABL1 감소 정도(Log)와 IS-kit로 측정한 BCR-ABL1의
비교. y = 0.412x + 7.295 R² = 0.003 0 10 20 30 40 50 60 70 -6 -4 -2 0 2 4 6
Log reduction by LC kit
IS -N C N b y IS k it
- 14 -
IV.
고
찰
Ph는 CML 환자의 99% 이상에서 발견되며 BCR-ABL1 융합유전자를 만든다.
BCR 유전자의 절단부위가 exon 1-2이면 minor-BCR (m-BCR)을 만들어 p190이 생
성되며 Ph 양성 ALL 또는 단구 증가를 보이는 CML을 나타내며, 절단부위가 exon 12-16에 있을 경우는 major-BCR (M-BCR)이 되어 p210을 생성하고 tyrosine kinase 활성을 증가 시킴으로써 종양 세포의 분열을 가속화 하여 CML을 유발하 게 된다(Baccarani 등, 2009; 2006; Ren, 2005; Shtivelman 등, 1985; Westbrook 등, 1992).
Ph 양성 CML 또는 ALL 환자의 치료에 있어 tyrosine kinase의 활동을 억제하 는 TKI의 출현은 이들 질환의 예후에 획기적인 변화를 가져왔다. 기존 약제나 골수 이식을 받은 CML 환자의 5년 생존률이 20%에 그쳤던 반면 TKI의 대표 약 제인 imatinib으로 치료한 환자의 5년 생존률은 89%에 이르는 것으로 보고되었다. IRIS 연구에 의하면 imatinib을 12개월 복용한 환자의 69%와 60개월 복용 환자의 87%가 CCyR에 도달하였고 12개월 이나 18개월에 CMR을 보인 환자들은 예후도 더 좋은 것으로 나타났다(Hughes 등, 2003; Iacobucci, 2006; Kantarjian, 2006).
이처럼 imatinib 치료 시 CCyR에 도달하는 확률이 높아 고식적 염색체 검사 에 의한 모니터링이 불가능하여 보다 더 정밀한 정량 검사의 필요성이 대두되었 다. CML 환자의 모니터링을 위한 기존 방법은 fluorescent in situ hybridization (FISH), Southern blot, Western blot, 그리고 reverse transcription polymerase chain reaction (RT-PCR) 등이 있는데, 이러한 방법들은 민감도가 낮을 뿐만 아니라 검 사 절차가 복잡하며 정량이 불가능하고 골수 검체를 사용하여야 한다는 단점이 있다. 이에 반해 RQ-PCR은 100,000개 이상의 정상 세포에서 한 개의 종양 세포
를 검출할 수 있을 정도로 민감도가 높으며 골수 검체와 말초 혈액의 RQ-PCR 결과의 연관성이 높아 말초 혈액으로도 질환의 모니터링이 가능한 방법이다 (Vigil 등, 2010). RQ-PCR은 BCR-ABL1의 정량을 위해 대부분의 세포들이 갖고 있 다고 여겨지는 하우스키핑 유전자를 내부 대조 유전자로 사용하며, 이들 대조 유 전자에 비해 BCR-ABL1 융합 유전자의 수치를 상대적으로 표현하는 방법이다 (Hughes 등, 2006). 그 동안 BCR-ABL1 mRNA의 정량 검사에 대해 표준화된 프로토콜을 확립하 려는 많은 노력이 있어왔지만(Gabert 등, 2003), RQ-PCR이 시행되는 방법과 결과 보고 방식에 있어 검사실 마다 많은 차이가 있음이 보고되었다(Cross, 2009; Müller 등, 2007; Zhang 등, 2007). 2005년 10월 NIH에 CML 전문가들이 모여 RQ-PCR의 표준화된 프로토콜을 제안하였고 그 내용에는 세 가지 하우스 키핑 유전자와 calibrated reference materials (CRM)의 사용을 포함한다. 현재까지 모든 세포들이 갖 고 있다고 확인된 대조 유전자가 존재하지 않아 전세계적으로 다양한 대조 유전 자를 사용하여 왔으나 CML 전문가들은 ABL, BCR 또는 GUSB를 사용할 것과 표 준화된 calibration을 위해 CRM을 사용할 것을 제안하였으며 이들 CRM은 WHO 의 승인을 받았다. 또한, 기존에 MMR의 정의가 진단 시 BCR-ABL1 유전자의 정 량 값에서 3 로그 이상의 감소를 보일 때로 되어있는데 반해 CML 전문가들은 검사 시기와 관계없이 BCL-ABL1 수치가 IS < 0.1%로 정의하였다(Hughes 등, 2006; Radich 등, 2006). 이러한 국제적 표준화에 맞추어 최근 kit가 개발되었고 본 연구에서는 IS-kit와 표준화 이전에 개발된 LC kit을 비교하였다. LC kit는 glucose-6-phosphate
- 16 -
도를 정량하는 방법으로 PCR이 진행되는 매 주기 마다 LC Instrument의 광학 장 치에서 표적 서열에 결합하는 교잡 탐색자의 양을 지속적으로 측정하여 형광 신 호를 감지한다. IS-kit는 ABL 대조 유전자 발현에 비해 BCR-ABL1 유전자의 발현 여부를 검출하고 정량하는 원리를 이용한다. 표준 곡선을 그리기 위한 표준 물질 은 BCR-ABL1 유전자와 ABL 유전자를 동시에 갖고 있는 단일 plasmid를 사용하 였고 표준 곡선을 국제 표준에 맞추기 위해 CRM을 바탕으로 제조된 IS-MMR calibrator를 사용하여 교정을 해준다.
본 연구는 2008년 6월부터 2011년 9월까지 아주대학교 병원에서 CML로 처음 진단받은 24명의 환자들을 대상으로 하였으며 환자들의 진단 당시와 약물 치료 3개월이나 6개월 뒤 추적 검사 시의 RNA 검체를 이용하였다. 진단 시와 추 적 검사 시 LC kit로 검사한 BCR-ABL1 정량 결과는 0.000343 ~ 0.35 (median 0.02) 와 0 ~ 0.09 (median 0.000525) 이었으며, IS-kit로 검사한 결과는 각각 0.017905 ~ 100.153 (median 61.125)와 0 ~ 66.390 (median 0.805) 이었다. 각각의 검사법에 의한 진단 시와 추적 검사 시 수치들 사이에는 R2=0.0361과 0.0598으로 상관관계가 없
는 것으로 나타났다. LC kit로 MMR 상태를 판정하기 위해서는 진단 시보다 추적 관찰 시 BCR-ABL1 수치가 3 로그 이상 감소를 보여야 한다. 따라서, MMR 상태 의 판정에 있어 LC kit와 IS-kit의 상관 관계를 판정하기 위하여 LC kit에 의한 진 단 시와 추적 관찰 시 수치의 감소 정도를 log로 환산한 후 IS-kit의 IS-NCN과 비교하였으나 R2=0.0033으로 역시 상관 관계가 없는 것으로 나타났다. 이처럼 두
검사법에 차이를 보이는 요인으로는 서로 다른 대조 유전자를 사용하고 있는 점 과 IS-kit는 IS-Calibrator로 표준 곡선을 교정 해준다는 점을 생각해볼 수 있을 것 이다.
MMR 상태를 결정함에 있어 IS-kit는 기존의 LC kit의 결과와 92% (22/24) 의 높은 일치율을 보였지만 chi-square 검정법으로 분석하였을 때 p < 0.001로 두 검사법간에 유의한 차이가 있는 것으로 나타났다. IS-kit와 LC kit 모두 7명의 환자 에 대해서는 MMR 상태에 도달한 것으로 나타났다. 그러나, 두 환자에서 IS-kit는 No MMR에 해당하는 수치를 보였으나 LC kit는 MMR에 해당하는 수치를 보였다.
IS-kit와 LC kit 중 어떠한 kit가 MMR에 대해 위양성을 보이는가를 알아 보기 위해 두 환자에 대해 LC kit로 3개월 이 후 시행 한 추적 검사 결과를 검토 하였고 두 환자의 6개월과 9개월 추적 검사 시 mRNA를 사용해서 IS-kit로 검사 를 시행하였다. IS-kit는 두 환자의 3개월 이 후 추적 관찰 검체에서도 모두 No MMR에 해당하는 수치를 보였으며 LC kit로 검사한 결과도 추적관찰 3개월째 MMR 상태에 도달한 이 후 6개월과 9개월에는 다시 BCR-ABL1의 수치가 증가했 던 것으로 나타났다. 또한, 현재까지 두 환자는 2년여에 걸쳐 LC kit로 추적 검사 를 시행하고 있는데 그 수치가 지속적으로 감소하거나 증가하기 보다는 2 로그 이상의 증감을 보이며 변동을 나타냈다. 2009년에 M.D Anderson Cancer Center에서 시행한 임상 시험에 의하면 ABL1의 증가는 주로 CML의 재발이나 BCR-ABL1 유전자의 변이에 의해서 나타난다고 보고하였다(Kantarjian 등, 2006). 두 환 자는 BCR-ABL1 유전자 변이에 대한 검사를 시행하지 않았지만 imatinib으로 치료 를 지속하여도 다시 BCR-ABL1 수치가 감소하며 CCyR을 유지하는 것으로 볼 때 유전자 변이의 가능성이나 CML의 재발 보다는 3개월째에 LC kit에 의한 결과가 MMR에 대해 위양성을 보였을 가능성이 높은 것으로 판단된다. CML의 모니터링을 위해서 RQ-PCR이 표준 검사법으로 사용되어짐에 따 라 BCR-ABL1을 검사한 지역과 시기에 관계없이 검사 결과를 비교하기 위하여
- 18 - RQ-PCR의 표준화와 IS가 제안 되었으며 IS-kit는 2005년 CML 전문가들이 제안 한 표준화된 프로토콜과 IS에 기반하여 제작되었다. 본 연구는 단일 기관에서 24명의 환자를 대상으로 IS-kit와 표준화 이전 에 개발된 LC kit를 비교하였으며, 새롭게 개발된 IS-kit는 MMR 상태 평가에 있 어 기존의 검사 kit와 높은 일치율을 보일 뿐만 아니라 보다 더 정확하게 MMR 상태 도달을 판단할 수 있을 것으로 보여 기존 kit를 대체 할 수 있을 것으로 보 인다.
V.
결
론
본 연구는 IS 에 기반을 두고 최근 개발된 BCR-ABL Mbcr IS-MMR Dx kit 와 기존의 LightCycler t(9;22) quantification kit 을 비교하였으며 BCR-ABL Mbcr IS-MMR Dx kit 는 LightCycler t(9;22) quantification kit 와 비교 시 MMR 상태 평가에 있어 높은 일치율을 보일 뿐만 아니라 보다 더 정확하게 MMR 상태 도달을 판단할 수 있을 것으로 보인다.
- 20 -
참고문헌
1. Baccarani M, Cortes J, Pane F, Niederwieser D, Saglio G, Apperley J, Cervantes F, Deininger M, Gratwohl A, Guilhot F, Hochhaus A, Horowitz M, Hughes T, Kantarjian H, Larson R, Radich J, Simonsson B, Silver RT, Goldman J, Hehlmann R: Chronic myeloid leukemia: An update of concepts and management recommendations of European Leukemia Net. J Clin Oncol 27: 6041–6051, 2009 2. Baccarani M, Saglio G, Goldman J, Hochhaus A, Simonsson B, Appelbaum F,
Apperley J, Cervantes F, Cortes J, Deininger M, Gratwohl A, Guilhot F, Horowitz M, Hughes T, Kantarjian H, Larson R, Niederwieser D, Silver R, Hehlmann R: Evolving concepts in the management of chronic myeloid leukemia: Recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 108: 1809–1820, 2006
3. Cross NCP: Standardisation of molecular monitoring for chronic myeloid leukaemia.
Best Pract Res Clin Haematol 22(3): 355-365, 2009
4. Druker BJ, Guilhot F, O’Brien SG, Gathmann I, Kantarjian H, Gattermann N, Deininger MW, Silver RT, Goldman JM, Stone RM, Cervantes F, Hochhaus A, Powell BL, Gabrilove JL, Rousselot P, Reiffers J, Cornelissen JJ, Hughes T, Agis H, Fischer T, Verhoef G, Shepherd J, Saglio G, Gratwohl A, Nielsen JL, Radich JP, Simonsson B, Taylor K, Baccarani M, So C, Letvak L, Larson RA: Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 355:
2408–2417, 2006
5. Gabert J, Beillard E, van der Velden V, Bi W, Grimwade D, Pallisgaard N, Barbany G, Cazzaniga G, Cayuela JM, Cavé H, Pane F, Aerts JL, De Micheli D, Thirion X, Pradel V, González M, Viehmann S, Malec M, Saglio G, van Dongen JJ: Standardization and quality control studies of ‘realtime’ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia - a Europe Against Cancer program. Leukemia 17: 2318-2357, 2003
6. Hughes T, Deininger M, Hochhaus A, Branford S, Radich J, Kaeda J, Baccarani M, Cortes J, Cross NC, Druker BJ, Gabert J, Grimwade D, Hehlmann R, Kamel-Reid S, Lipton JH, Longtine J, Martinelli G, Saglio G, Soverini S, Stock W, Goldman JM: Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: Review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results. Blood 108: 28–37, 2006
7. Hughes TP, Hochhaus A, Branford S, Müller MC, Kaeda JS, Foroni L, Druker BJ, Guilhot F, Larson RA, O'Brien SG, Rudoltz MS, Mone M, Wehrle E, Modur V, Goldman JM, Radich JP: Long-term prognostic significance of early molecular response to imatinib in newly diagnosed chronic myeloid leukemia: an analysis from the International Randomized Study of Interferon and STI571 (IRIS). Blood 116(19):
- 22 -
3758-3765, 2010
8. Hughes TP, Kaeda J, Branford S, Rudzki Z, Hochhaus A, Hensley ML, Gathmann I, Bolton AE, van Hoomissen IC, Goldman JM, Radich JP: Frequency of major molecular responses to imatinib or interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 349: 1423–1432, 2003
9. Iacobucci I, Saglio G, Rosti G, Testoni N, Pane F, Amabile M, Poerio A, Soverini S, Bassi S, Cilloni D, Bassan R, Breccia M, Lauria F, Izzo B, Merante S, Frassoni F, Paolini S, Montefusco E, Baccarani M, Martinelli G: Achieving a major molecular response at the time of a complete cytogenetic response (CCgR) predicts a better duration of CCgR in imatinib-treated chronic myeloid leukemia patients. Clin
Cancer Res 12: 3037–3042, 2006
10. Kantarjian H, O’Brien S, Shan J, Huang X, Garcia-Manero G, Faderl S, Ravandi-Kashani F, Verstovsek S, Beth Rios M, Cortes J: Cytogenetic and molecular responses and outcome in chronic myelogenous leukemia – need for new response definitions. Cancer 112: 837-845, 2008
11. Kantarjian H, Shan J, Jones D, O'Brien S, Rios MB, Jabbour E, Cortes J. Significance of increasing levels of minimal residual disease in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in complete cytogenetic response. J Clin Oncol 27: 3659-3663, 2006
Ravandi F, Rios MB, Shan J, Cortes J: Survival benefit with imatinib mesylate versus interferon-based regimens in newly diagnosed chronic-phase chronic myelogenous leukemia. Blood 108: 1835-1840, 2006
13. Müller MC, Saglio G, Lin F, Pfeifer H, Press RD, Tubbs RR, Paschka P, Gottardi E, O'Brien SG, Ottmann OG, Stockinger H, Wieczorek L, Merx K, König H, Schwindel U, Hehlmann R, Hochhaus A : An international study to standardize the detection and quantitation of BCR-ABL transcripts from stabilized peripheral blood preparations by quantitative RT-PCR. Haematologica 92(7): 970-973, 2007
14. National Comprehensive Cancer Network. NCCN: Clinical Practice Guidelines in Oncology. Chronic Myelogenous Leukemia, Version 2, 2010. Available at http://www.nccn.org/professionals/physician_gls/f_guidelines.asp.
15. O’Brien SG, Guilhot F, Larson RA, Gathmann I, Baccarani M, Cervantes F, Cornelissen JJ, Fischer T, Hochhaus A, Hughes T, Lechner K, Nielsen JL, Rousselot P, Reiffers J, Saglio G, Shepherd J, Simonsson B, Gratwohl A, Goldman JM, Kantarjian H, Taylor K, Verhoef G, Bolton AE, Capdeville R, Druker BJ: Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 348: 994–1004, 2003
16. Press RD, Galderisi C, Yang R, Rempfer C, Willis SG, Mauro MJ, Druker BJ, Deininger MW: A half-log increase in BCR-ABL RNA predicts a higher risk of relapse in patients with chronic myeloid leukemia with an imatinib-induced complete
- 24 -
cytogenetic response. Clin Cancer Res 13: 6136–6143, 2007
17. Press RD, Love Z, Tronnes AA, Yang R, Tran T, Mongoue-Tchokote S, Mori M, Mauro MJ, Deininger MW, Druker BJ: BCR-ABL mRNA levels at and after the time of a complete cytogenetic response (CCR) predict the duration of CCR in imatinib mesylate-treated patients with CML. Blood 107: 4250–4256, 2006
18. Radich JP: How I monitor residual disease in chronic myeloid leukemia. Blood 114: 3376–3381, 2006
19. Ren R: Mechanisms of BCR-ABL in the pathogenesis of chronic myelogenous leukaemia. Nat Rev Cancer 5: 172–183, 2005
20. Shtivelman E, Lifshitz B, Gale RP, Canaani E: Fused transcript of abl and bcr genes in chronic myelogenous leukaemia. Nature 315: 550–554 , 1985
21. Vigil CE, Griffiths EA, Wang ES, Wetzler M: Interpretation of cytogenetic and molecular results in patients treated for CML. Blood Rev 25: 139–146, 2010
22. Westbrook CA, Hooberman AL, Spino C, Dodge RK, Larson RA, Davey F, Wurster-Hill DH, Sobol RE, Schiffer C, Bloomfield CD: Clinical significance of the BCR-ABL fusion gene in adult acute lymphoblastic leukemia: a Cancer and Leukemia Group B Study (8762). Blood 80: 2983–2990, 1992
23. White HE, Matejtschuk P, Rigsby P, Gabert J, Lin F, Lynn Wang Y, Branford S, Müller MC, Beaufils N, Beillard E, Colomer D, Dvorakova D, Ehrencrona H, Goh HG, El Housni H, Jones D, Kairisto V, Kamel-Reid S, Kim DW, Langabeer S, Ma
ES, Press RD, Romeo G, Wang L, Zoi K, Hughes T, Saglio G, Hochhaus A, Goldman JM, Metcalfe P, Cross NC: Establishment of the first World Health Organization international genetic reference panel for quantitation of BCR-ABL mRNA. Blood 116: 111-117, 2010
24. Zhang T, Grenier S, Nwachukwu B, Wei C, Lipton JH, Kamel-Reid S. Inter-laboratory comparison of chronic myeloid leukemia minimal residual disease monitoring: summary and recommendations. J Mol Diagn. 9(4): 421-430, 2007
- 26 -
-
ABSTRACT-Quantification of Major BCR-ABL1 Fusion Gene Transcripts for
Monitoring Therapeutic Response to Tyrosine Kinase Inhibitors in
Chronic Myelogenous Leukemia; Comparison of LightCycler t(9;22)
Quantification Kit and BCR-ABL1 Mbcr IS-MMR Dx Kit.
Sunhyun Ahn
Department of Laboratory Medicine The Graduate School, Ajou University
(Supervised by Associate Professor Sung Ran Cho)
Background : CML is in >90% of cases characterized by the presence of the Philadelphia
chromosome (Ph) and the corresponding fusion gene, BCR-ABL1. For disease monitoring, standardize BCR-ABL1 quantification and International Scale (IS) has been suggested, and this study is to compare IS-based IS-kit with non-IS-based LightCycler-t(9;22) Quantification kit (LC kit; Roche, Germany) for determination of MMR status.
Methods: We used stored RNA samples from 24 patients who had been newly diagnosed
with CML in Ajou university hospital from Jun 2008 to Sep 2011. We reviewed the patients’ medical records including age at diagnosis, gender, phase of the disease, medication, and
Results: The mean age at diagnosis was 45 (16~77) and M:F ratio was 1.4:1. BCR-ABL1
transcript levels by the LC kit at diagnosis and follow-up were 0.000343~0.35 (median 0.02) and 0~0.09 (median 0.000525), respectively. IS-NCN by the IS-kit at diagnosis and follow-up were 0.017905~100.156 (median 61.125) and 0~66.390 (median 0.805). The IS-kit and the LC kit showed a concordance rate of 92% (22/24) for determination of MMR status. Two patients with discrepancies were determined to achieve MMR by LC kit, but not by IS-kit. When reviewing further follow-up samples of the 2 patients, BCR-ABL1 transcript levels increased thereafter, meaning they might not truly achieve MMR.
Conclusions: Despite of a good concordance between the IS-kit and non-IS-based kit, our
data suggest that the standardized IS-based kit would be more promising for accurate determination of MMR in CML.