혈류 역학 이해를 위한 동시 획득
T
1
/T
2
*
강조 경사 자장 펄스열을
이용한 MRI 방법
연세대학교 대학원
의과학사업단
김 은 주
혈류 역학 이해를 위한 동시 획득
T
1
/T
2
*
강조 경사 자장 펄스열을
이용한 MRI 방법
지도교수 서 진 석
이 논문을 박사학위 논문으로 제출함
2002 년 12 월 일
연세대학교 대학원
의과학사업단
김 은 주
김은주의 박사학위논문을 인준함
심사위원 인
심사위원 인
심사위원 인
심사위원 인
심사위원 인
연세대학교 대학원
2002 년 12 월 일
감사의 글
아무것도 모르고 시작했던 것이 부족하나마 하나의 논문으로
나왔습니다. 지금까지 지켜봐 주신 모든 분들께 감사 드립니다.
언제나 한결같으신 모습으로 하나 하나 세심하게 지도해 주시고,
늘 연구하는 자세를 보여주신 서진석 교수님께 감사 드립니다. 바
쁘신 중에도 논문을 검토해주신 박용구 교수님, 김동익 교수님,
양우익 교수님, 그리고 경북대 장용민 교수님께 감사 드립니다.
팬텀 실험을 도와주신 생리학 교실 안덕선 교수님, 권성춘 교수
님, 신장내과 최규헌 교수님께 감사 드립니다. 처음 MRI를 시작
할 수 있게 도와주신 이화여대 물리학과 신승애 선생님께 감사
드립니다.
밤늦게까지 실험 도와주시고 조언 아끼지 않은 김대홍 선배님
께 감사 드립니다. 먼저 졸업한 최상훈, 김미나, 그리고, 졸업 논
문에 바쁜 이희조에게 감사인사 전합니다. 같은 실험실에서 많은
시간 같이하진 못했지만 한 식구 같은 이대 물리학과 실험실의
안지영, 추명자, 백미영에게도 감사인사 전합다. 이상훈 선생님,
허용민 선생님께도 감사 드립니다.
바쁜 중에도 격려 잊지 않은 은민, 변함 없는 우정으로 격려해
준 현정, 태선, 숙, 영주, 문숙, 진희, 영, 지연, 계영, 지영에게 사
랑과 고마운 마음 전합니다.
누구보다도 막내 투정 다 받아주신 가족들과 주말이면 작은 고
모와 놀아준 수현이, 그리고 새로 한 가족이 된 식구들께 감사 드
리며 작게나마 논문으로 인사드립니다.
차 례
그림 및 표 차례 국문 요약 ···1 I. 서 론 ···3 II. 이론적 배경 ···6 1. 자기 공명의 기본 이론 ···6 가. Larmor 주파수 ···6 나. Boltzman 분포에 의한 핵자기 ···9 다. 이완 (Relaxation) ···112. 자기 공명 영상 (Magnetic Resonance Imaging ; MRI) ···14
가. 자기 공명 영상의 특징 ···14
나. 펄스열 (Pulse sequence) ···16
다. k-공간 (k-space) ···20
3. 관류 자기 공명 영상 (Perfusion MRI) ···22
가. 관류 자기 공명 영상 ···22
나. 2구획 모델 (Two compartments model) ···25
III. 방 법 ···27 1. 동시 획득 T1/T2* 강조 경사 자장 펄스열 ···27 가. 펄스열 개발 ···27 나. 영상 획득 ···29 2. 실험 장치와 팬텀 (Phantom) ···30 가. Sephadex 팬텀 ···31 나. 투석기 (Dialyzer) ···35
3. 영상 후처리 ···37 IV. 결 과 ···41 1. Key-hole 방법 ···41 2. 숙임각과 신호 강도 ···43 3. Gd-DTPA 농도와 ΔR1, ΔR2, ΔR*2의 비례 ···44 가. 스핀에코 펄스열 사용 ···44 나. 동시 획득 T1/T2* 강조 경사 자장 펄스열 사용 ···46 4. Sephadex 관류 팬텀 - 관류량 ···51 5. 투석기 관류 팬텀 - 투과도 ···59 V. 고 찰 ···65 VI. 결 론 ···70 참고 문헌 ···71 부록 ···76 부록1. Sephadex의 SQUID 측정 결과 ···76 부록2. 투석기 용어 해설 ···77 부록3. 영상 후처리 과정 프로그램 (일부) ···79 영문 요약 ···85
그림 차례
그림1. 자기장 내에 있는 스핀. ···6
그림2. z축에 평행한 외부 자기장 내에서의 자화. ···11
그림3. T
1와 T
2이완 곡선. ···13
그림4. 자기 공명 영상 기기의 간단한 모식도. ···15
그림5. 스핀 에코 펄스열. ···17
그림6. 스핀 에코 펄스열에서 살펴본 T
2와 T
2*. ···17
그림7. 경사 자장 에코 펄스열. ···19
그림8. k-공간에서의 위상 부호화 경사 자장의 크기와 신호의
크기. ···21
그림9. 균일한 자기장 내에 있는 상자성체에 의한 자기장 변화. 23
그림10. 2구획 모델 모식도. ···25
그림11. 동시 획득 T
1/T
2*강조 경사 자장 펄스열. ···28
그림12. 일반적인 경우와 key-hole 방법을 사용한 경우의 k-공
간. ···28
그림13. 관류 실험 장치 모식도. ···30
그림14. 수분 흡수로 팽창한 Sephadex의 wet bead 크기와
pore 크기의 모식도. ···32
그림16. Sephadex를 XK 16/20 column에 패킹하여 extremity 코일
에 장착한 사진. ···34
그림17. 실험에 사용한 hollow fiber 형태의 투석기 모식도. ·· 36
그림18. 조영제 주입으로 T
2*가 1/2로 감소하는 경우 첫번째,
두번째 신호의 크기 변화. ···38
그림19. 동시 획득 T
1/T
2*강조 경사 자장 펄스열을 이용하여 얻
은 k-공간 데이터. ···42
그림20. k-공간을 전부 채워 얻은 영상과 key-hole 방법을 사용
하여 얻은 영상의 비교. ···42
그림21. 동시 획득 T
1/T
2*강조 경사 자장 펄스열의 숙임각을
달리하면서 Sephadex 팬텀에서 얻은 신호. ···43
그림22. 스핀 에코 펄스열로 구한 Sephadex 팬텀의 T
2의 변화
량(
ΔR
2)과 Gd-DTPA 농도와의 관계. ···45
그림23. 스핀 에코 펄스열로 구한 Sephadex 팬텀의 T
1의 변화
량(
ΔR
1)과 Gd-DTPA 농도와의 관계. ···45
그림24. 동시 획득 T
1/T
2*강조 경사 자장 펄스열을 사용하여
구한
ΔR
*2와 Gd-DTPA 농도와의 관계. ···47
그림25. 동시 획득 T
1/T
2*강조 경사 자장 펄스열을 사용하여
구한
ΔR
1와 Gd-DTPA 농도와의 관계. ···49
그림26. 동시 획득 T
1/T
2*강조 경사 자장 펄스열을 사용하여
구한
ℜ
*2,
ℜ
1값으로 컴퓨터 가상 실험한 Gd-DTPA
의 농도에 따른
ΔR
*2변화와
ΔR
1변화의 보정 전 후
의 비교. ···50
그림27. 동시 획득 T
1/T
2*강조 경사 자장 펄스열을 이용하여
얻은 Sephadex G10 팬텀의 관류 영상. ···52
그림28. Sephadex 관류 팬텀의 관심 영역에서 얻은 시간에 따
른 첫번째 에코 T
1강조 신호(S
1)와 두번째 에코 T
2*강조 신호(S
2) 강도 곡선. ···53
그림29. Sephadex 관류 팬텀의 관심 영역에서 얻은 시간에 따
른 T
1, T
2*두개의 에코 신호로부터 구한 보정 전 후
의
ΔR
*2와
ΔR
1곡선. ···54
그림30. 보정한
ΔR
1곡선의 γ-variate fitting. ···56
그림31. 투석기의 관류영상. ···60
그림32. 투석기의 관심 영역에서 얻은 시간에 따른 첫번째 에
코 T
1강조 신호(S
1)와 두번째 에코 T
2*강조 신호(S
2)
강도 곡선. ···61
그림33. 투석기의 관류 영상에서 구한 시간에 따른
ΔR
1과 보
정한
ΔR
1곡선. ···62
그림34. 보정하지 않은
ΔR
1과 T
1감소 효과만을 분리하여 보
정한
ΔR
1의 비(uncorrected
ΔR
1/corrected
ΔR
1). · 62
그림35. 투석기의 hollow fiber 외부로부터 hollow fiber 내부로
의 보정 전 후의 투과도 k
ev. ···64
그림36. 투석기의 hollow fiber 내부의 관류 속도를 다르게 했
을 때 외부에서 내부 쪽으로의 보정 전 후의 투과도
k
ev. ···64
표 차례
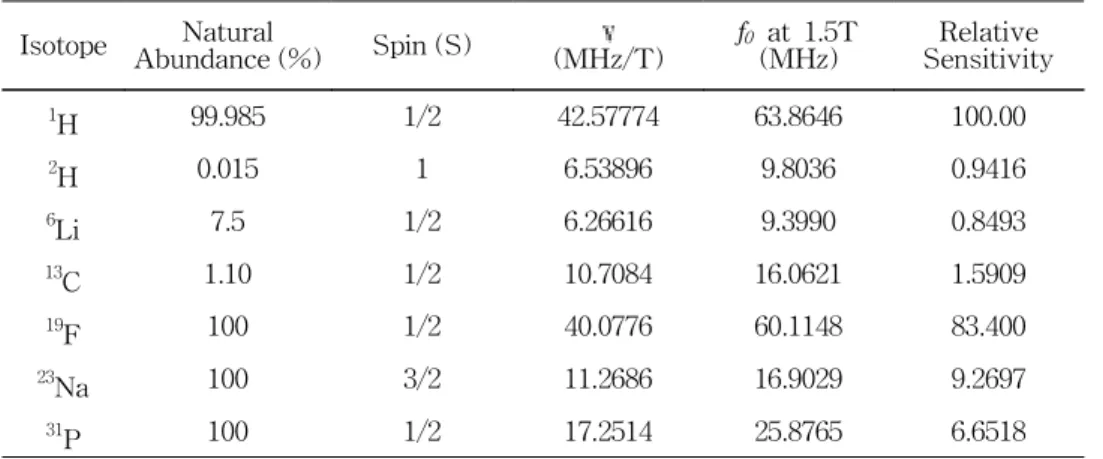
표1. 특정 원자핵들의 자기 회전율과 자연 존재비 ···8
표2. 정상 조직에서의 T
2와 T
1···13
표3. Sephadex의 technical specifications ···31
표4. 투석기(dialyzer) F5의 특성 ···36
표5. 스핀 에코 펄스열을 사용하여 측정한 Sephadex 팬텀의 T
2와 T
1···44
표6. 스핀 에코 펄스열을 사용하여 측정한 Gd-DTPA 농도에
따른 Sephadex 팬텀의 T
2, T
1의 변화로부터 구한 단위
농도당 이완도(
ℜ
2,
ℜ
1) ···45
표7. 동시 획득 T
1/T
2*강조 경사자장 펄스열을 사용하여 측정
한
ΔR
*2와 Gd-DTPA 농도와의 관계에서 구한
ℜ
*2값의
보정 전 후의 차이 ···47
표8. 동시 획득 T
1/T
2*강조 경사자장 펄스열을 사용하여 측정
한
ΔR
1과 Gd-DTPA 농도와의 관계에서 구한
ℜ
1값의
보정 전 후의 차이 ···49
표9. Sephadex 팬텀의 부피 구성. ···55
표10. 시간에 따른
ΔR
1,
ΔR
*2곡선의 적분값의 Sephadex 팬텀
G25와 G10의 비 (G25/G10) ···58
표11. Sephadex 팬텀에서 보정하지 않은
ΔR
1곡선과 보정한
국문요약
혈류 역학 이해를 위한 동시 획득 T
1/T
2*강조 경사 자장 펄스열을
이용한 MRI 방법
관류 자기 공명 영상은 혈류 역학과 미소 순환의 이상을 살펴보는데 유용 한 방법으로 뇌의 허혈성 부위 감별, 신장 기능 평가, 종양의 등급 평가와 예 후 판단 등에 유용한 정보를 제공하여 많은 연구가 진행 중이나, 아직까지 기 초적인 원리 이해가 부족하다. 본 논문에서는 자화율 대조법을 사용한 관류 영상의 실질적인 기초적 원리의 이해를 위해 동시 획득 T1/T2* 강조 경사 자장 펄스열, 영상 후처리 과정을 개발하였고, 이들을 새로 고안한 관류 팬텀을 사 용한 실험으로 증명하고자 하였다. 동시 획득 T1/T2* 강조 경사 자장 펄스열은 기존의 이중 경사 자장 에코 펄 스열을 기반으로 하여, 역동적 영상화를 위한 multi-phase 방법과 시간 해상도 를 높이기 위한 key-hole 방법을 추가하였다. 기존의 방법에서는 Gd-DTPA에 의한 T2* 감소 혹은 T1 감소 효과 중 하나만을 강조하여 각각 따로 관류 정보 를 얻었으나, 본 논문에서는 동시 획득 T1/T2* 강조 경사 자장 펄스열을 사용 하여 Gd-DTPA를 한번만 일시 주입해서 T2* 감소와 T1 감소 효과를 모두 얻 을 수 있었다. 영상 후처리 과정에서 이 두가지 효과를 수학적으로 분리하여 T2* 감소만을 분리하여 보정한 ΔR* 2(=1/T2 * ,t-1/T2*,0)와 T1 감소 효과만을 분리한 보정한 ΔR1 (=1/T1,t-1/T1,0)를 산출하였다. 보정한 ΔR*2-, ΔR1-Gd 농도 곡선은 Gd-DTPA 의 농도와 선형 비례 관계를 만족하였고, 단위 농도당 이완도 ℜ2*, ℜ1 (mM-1sec-1)은 보정한 ΔR* 2-, ΔR1-Gd 농도 곡선에서 얻은 값이 보정하지 않은 곡선에서 얻은 값에 비해 큰 값을 보였다. 관류 팬텀으로 Sepadex 팬텀과 투석기를 사용하였다. Gd-DTPA를 일시 주입하여 얻은 Sephadex 팬텀의 관류 영상으로부터 관류량인 ⌠⌡ΔR1dt을 구했다. ⌠
⌡( correcte d ΔR1)dt의 Sephadex G25 팬텀과 G10 팬텀 사이의 적분값의 비
(G25/G10)는 오차 범위 내에 이론적으로 구한 비가 포함되었다.
투과도를 구하기 위해서는 hollow fiber 형의 투석기를 혈관 모형으로 사용 하여 hollow fiber 외부는 높은 농도의 Gd 용액 (약 4mM)으로 채우고, fiber 내부로 이보다 낮은 농도의 Gd 용액 (1.0~2.0 mM)을 관류 시켰다. 보정하지
않은 ΔR1값은 보정한 값에 비해 작았고, 이는 Mathematica
Ⓡ
4를 이용한 컴퓨 터 가상 실험 (computer simulation)에서도 확인할 수 있었다. Fiber의 외부에 서 내부 쪽으로의 투과도는 2구획 모델을 기반으로 한 biexponential 함수로 fitting하여 구했다. Fiber 내부의 관류 속도가 클수록 투과도는 크게 나왔고, 관류 용액의 농도와는 상관없는 값을 보였다. 보정한 ΔR1-시간 곡선으로부터 구한 투과도가 보정하지 않은 경우에 비해 큰 값을 가졌다. 본 실험에서는 동시 획득 T1/T2* 강조 경사 자장 펄스열을 이용하여 Gd-DTPA에 의한 T2* 감소와 T1 감소 효과를 구별하여 얻을 수 있었다. 기존 의 방법에서 사용되었던 T1 감소 효과를 무시한 ΔR*2 혹은 T2* 감소 효과를 무시한 ΔR1은 본 논문에서 사용한 방법으로 두 효과를 구별하여 구한 보정한 ΔR*2 혹은 보정한 ΔR1보다 작은 값을 가졌고, 이들로부터 구한 관류량, 투과 도도 마찬가지로 보정하지 않은 경우의 값이 작았다. 기존의 방법에서 하나의 효과를 단순 강조하고 다른 하나는 무시하여 작게 측정된 것을 본 논문에서는 두가지 효과를 구별하여 기존의 방법으로 얻은 값보다 큰 값을 얻었다. 따라 서 본 실험에서 개발한 방법을 사용한다면 관류량과 투과도와 같은 미세한 혈 류 변화에 관한 좀더 실질적인 정보를 얻을 수 있을 것으로 판단된다. ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ 핵심되는 말 : 동시 획득 T/T* 강조 경사 자장 펄스열, Gd-DTPA, 관류량,
혈류 역학 이해를 위한 동시 획득 T
1/T
2*강조 경사 자장 펄스열을
이용한 MRI 방법
<지도교수 서진석> 연세대학교 대학원 의과학사업단김 은 주
I. 서론
관류 자기 공명 영상을 얻는 방법에는 특정 부위로 공급되는 동맥 혈액내의 수소 분자를 labeling하여 영상을 얻는 arterial spin labelling (ASL) 방법과 외부에서 상자성체인 조영제를 주입하여 T1, T2* 감소 효과를 이용하여 시간에 따른 신
호 변화를 얻는 자화율 대조법이 있다.
Rogerts 등1이 처음으로 사람 뇌에서 실험한 ASL 방법의 경우 외부로부터 조
영제 주입 없이 관류 영상을 얻을 수 있다는 장점이 있으나 신호대 잡음비가 떨 어지는 단점이 있다. 자화율 대조법에서는 조영제로 gadopentetate dimeglumine
(gadolinium diethylentriaminepentaacetic acid dimeglumine ; Gd-DTPA,
Magnevist®, Schering AG, Berlin, Germany)이 일반적으로 많이 사용된다. 일시
주입된 Gd-DTPA는 상자성 물질로 혈액을 따라 흐르면서 주변 자기장을 변화시켜 T2*를 감소시키고, 주변 조직의 물분자와 충분히 가까운 거리에서는 T1 감소 효 과를 보인다. Gd-DTPA 농도에 비례하는 T2* 감소 효과를 이용한 관류 영상을 얻 기 위해서는 Gd-DTPA가 혈관 내에만 머물러야한다는 조건을 만족해야하므로 주 로 blood-brain barrier (BBB)가 있는 뇌 부위의 진단에 주로 이용되고 있다2-4. 종양의 등급 평가는 고식적인 조영 강조 영상만으로는 부족한 점이 많아 역동 적 조영 강조 영상이 필요하다. 이때, 경사 자장 에코 펄스열이 사용되어왔으며5,
고등급(hjigh-grade)의 신경 교종(glioma)의 경우 뇌 관류량 영상(relative Cerebral
에 의해 BBB가 깨진 부분에서 Gd-DTPA가 조직내로 빠져나가서 발생하는 T1 감 소 효과를 무시할 수 없다. Donahue 등7의 실험에서 밝혀졌듯이 T1 효과 보정을 하지 않은 경우 T2* 강조 영상으로부터 얻은 rCBV는 종양 등급과 일치하지 않았 다. T1 감소 효과를 보정하기 위한 방법으로는 소량의 Gd-DTPA를 미리 주입하고 수분 후에 일반적으로 관류 영상을 얻을 때 사용하는 double dose로 일시 주입하 여 영상을 얻는 방법이 주로 많이 사용되고 있다7,8. 또 다른 방법에는 경사 자장
이중 에코 (gradient double echo) 펄스열을 이용하여 T1, T2* 강조 신호를 둘 다
얻어 T1 효과를 보정하는 것이 있다9,10.
Gd-DTPA가 혈관 밖으로 빠져나가는 경우에는 시간에 따른 상대적인 신호강도
변화 정도를 얻을 수 있고11-13, T1 감소 효과를 이용하여 혈관의 투과도에 대한 정
보를 구했으며 이를 위해서 주로 스핀 에코 T1 강조 신호가 이용되었다14-16.
Shamens 등14과 Brasch 등15은 혈액 저류(blood pool) 조영제로 잘 알려진 거대분
자 조영제 albumin-Gd-DTPA35를 사용하여 얻은 T1 강조 자기 공명 신호로부터
모세혈관 투과도를 Renkin-Drone model17-18에 기초하여 구하는 방법을 제시하였
다. 혈관 투과도의 변화는 종양의 angiogenesis를 반영하는 것으로 증명하였던 연 구에서 유방암 세포를 이식한 nude rat에게 VEGF(vascular endothelial growth factor)를 억제시키는 anti-VEGF를 가하면 종양 성장이 억제되고 조영제의 혈관 투과도가 감소했다는 보고19, 전립선 종양에서 항남성호르몬 요법(antiandrogen therapy)을 시행한 후 조영제의 혈관 투과도가 감소했다는 보고가 있다20. 즉, 이러 한 보고는 종양에서 혈관 투과도 증가는 신생혈관에 의해 발생한다는 것을 뒷받 침하며, 이를 조영제를 사용한 자기 공명 영상으로 측정할 수 있다. 뇌종양을 지 닌 설치류 실험에서 angiogenesis 억제 후에도 관류량 감소가 나타나지 않았다는 실험 결과도 보고되었다21. 이와 같이 자기 공명 영상을 이용한 관류 정보는 혈류 역학과 미소 순환의 시 상을 살펴보는데 유용하여 많은 연구가 진행 중이나 실질적인 기초적 이해는 부 족한 점이 많다. 본 논문에서는 이전에 제시되었던 문제점들을 해결하여 정확한
강조 경사 자장 펄스열을 개발하여 Gd-DTPA를 이용한 관류 영상을 얻고, 둘째로,
이로부터 T1, T2* 감소 효과를 구별하는 영상 후처리 과정을 제시하고, 이를 새로
II. 이론적 배경
1. 자기 공명의 기본 이론
가. Larmor 주파수
핵자기 공명은 자기모멘트와 각운동량 사이의 자기적 현상이다. 원자핵의 양성 자수가 홀수면, 그 핵은 핵 스핀과 자기 모멘트를 갖는다. 스핀값이 0이 아닌 원 자핵이 외부 자기장내에 있을 때는 이 외부 자기장을 중심으로 세차운동을 한다. 자기모멘트 (magnetic dipole moment, μ )의 크기와 각운동량 (spin angular momentum, S ) 크기의 비는 핵마다 다르다. 이를 γ로 나타내며 자기 회전율 (gyromagnetic ratio)이라고 한다. 이들 사이의 관계는 다음 식 (II.1)으로 나타낼 수 있다. μ = γ S (II.1) 핵이 자기장( H0) 내에 있으면, 핵이 갖는 자기모멘트에 의해서 torque를 받는다 (그림 1). Torque는 각운동량의 시간에 따른 변화율과 같다. ℑ = d S dt = μ× H0 (II.2) 위의 식 (II.1), (II.2) 에 의해 다음이 성립된다. d μ dt = γ ( μ× H0) (II.3) Z µ M a g n e tic M o m e n t N u c le u s H0식 (II.3)에서 자기 모멘트의 시간에 따른 변화는, 기준 좌표계가 정지해 있으면, d μ dt = ∂μx ∂t ˆi+ ∂μy ∂t ˆj+ ∂μz ∂t ˆk (II.4) 이고, 기준 좌표계가 정지해있지 않으면, d μ dt =
(
∂μx ∂t ˆi+ ∂μy ∂t ˆj+ ∂μz ∂t ˆk)
+ μx ∂ iˆ ∂t + μy ∂ jˆ ∂t + μz ∂ kˆ ∂t = ∂ μ ∂t + μx ∂ iˆ ∂t + μy ∂ jˆ ∂t + μz ∂ kˆ ∂t (II.5) 이다. 기준 좌표계가 z축을 중심으로 각속도 ω로 회전하고 있다면, 정지 좌표계 에서 본 단위 벡터는 i ˆ( t)= iˆ( 0) cos (ωt) + jˆ( 0) sin (ωt) j ˆ( t)= - iˆ( 0) sin (ωt) + jˆ( 0) cos (ωt) k ˆ( t) = kˆ( 0) (II.6) 으로 쓸 수 있고 이를 각각을 시간 t에 대해 미분하여 식 (II.5)을 정리하면, d μ dt = ∂ μ ∂t + ω( μxˆj- μyˆi) = ∂ μ ∂t + ω kˆ× μ = ∂ μ ∂t + ω× μ (II.7) 와 같다. 식 (II.3)과 (II.7)로부터 ∂ μ ∂t = γ μ× H0- ω× μ = γ μ×( H0+ ω γ ) (II.8) 을 얻을 수 있다. ω =-γ H0이면 ∂ μ∂t = 0가 되어 회전 좌표계에서 정지한 것처 럼 보이며, 이를 on-resonance라고 한다. 이때 주파수 ω = ω0=- γH0가 Larmor 주파수로서 외부 자기장 H0 내에 있는 스핀의 세차주파수이다 23-25. 특정 원자핵의 고유 상수인 자기 회전율은 원자핵에 따라 다른 값을 가지며(표 1), 이 값이 클수록 NMR 주파수 f0(=ω0/2π)가 크고, 측정되는 NMR 신호의 세기도 크다. 의료용 자기 공명 영상은 생체내 존재하는 원자핵 중에 자기 회전율
이 크고, 함유량이 많은 양성자 (1H)를 이용한다.
표 1. 특정 원자핵들의 자기회전율과 자연 존재비(natural abundance) Isotope Abundance (%)Natural Spin (S) (MHz/T)γ f0 at 1.5T
(MHz) SensitivityRelative 1 H 99.985 1/2 42.57774 63.8646 100.00 2 H 0.015 1 6.53896 9.8036 0.9416 6 Li 7.5 1/2 6.26616 9.3990 0.8493 13 C 1.10 1/2 10.7084 16.0621 1.5909 19 F 100 1/2 40.0776 60.1148 83.400 23 Na 100 3/2 11.2686 16.9029 9.2697 31 P 100 1/2 17.2514 25.8765 6.6518
나. Boltzman 분포에 의한 핵자기
양성자는 세차 방향에 따라 자기장에 같은 방향(1/2)과 그 반대 방향(-1/2)의 두 방향의 방향 벡터로 표시될 수 있다. 열평형 상태에서의 시료내의 핵 스핀은 자기장이 없을때는 완전히 흩어져 있으나, 일정한 자기장 H0을 걸어주면 자기 모 멘트는 자기장 하에서 방향에 따른 위치 에너지 ( U =- μ⋅H0)를 갖기 때문에 어느 정도는 자기장 방향으로 정렬한다. 여기서 위치에너지는 U =- μ⋅H0, H0= H0ˆk이고, 핵자기 모멘트와 kˆ축이 이루는 각을 θ라고 했을 때 , 핵들의 방 향 분포 함수 f( θ)는 Boltzman 법칙을 따른다. f(θ) = Ae- U / kT= Ae- μ⋅H / kT (II.9) T는 시료의 절대 온도이며, 인체의 경우 310 K에 해당한다. 이를 규격화하면 다음 과 같다. ⌠ ⌡ π 0 f(θ)dΩ = 1 (II.10) ⌠ ⌡ π 0 Ae μH0cosθ / kT 2π sin θ dθ = 1 (II.11) 여기서 cos θ≡t, μH0 kT ≡α 라 두고 풀면, 2π ⌠⌡ π 0 Ae + α t d( - t) = 2πA1 α e αt|
1- 1 = 2πA α ( e α -e- α) = 1 (II.12) 이고, 따라서 상수 A는 다음과 같이 쓸 수 있다. A = α 2π 1 eα-e- α = 1 2π μHo kT 1 eμHo/kT -e- μHo/kT (II.13) 우리가 측정하게 되는 거시적 크기의 시료는 Avogadro 수인 1023개 정도의 원자핵을 가지고 있으며, 시료가 N개의 핵으로 이루어져 있다면, 핵자기 모멘트에 의 한 평형상태에서의 거시적인 자화 M0 (magnetization)는 M0 = N⌠⌡ π 0 μ f( θ) 2π sin θdθ = NA ⌠⌡ π 0 μe
α cos θ2π cos θ sin θdθ ( cos θ≡t)
= NA μ 2π ⌠⌡ - 1 1 e αtt( -dt) = NA μ 2π
[
eα(
1 α -1 α2)
- e - α(
- 1α -1 α2)]
= NA μ 2π[
1 α ( e α + e- α) + 1 α2 (-e α + e- α)]
(II.14) 이다. 그런데, α≪1이면, eα= 1 + eα……, e- α= 1 - e- α……인 관계가 있으므로, 앞에서 A = 12π α 1 eα- e- α 를 식 (II.14)에 대입하여 정리하면 다음과 같다. M0 = N 2πα 1 eα- e- α μ 2π[
1 α ( e α+e- α)- 1 α2 (e α-e- α)]
= μ N{
e α+ e- α eα-e- α -1 α}
= μ N{
coth (α) - 1 α}
(II.15)여기서, coth(α)를 Taylor expansion하여
(
coth ( b) = 1b
{
1 + 1 3 b 2……})
다시 쓰 면, M0= N μ α3 = N μ2H0 3kT (II.16) 와 같다. μ2 = γ2ℏ2I(I+1)의 관계로부터 평형상태에서의 자화 M0는 M0= N γ2ℏ2I(I+1)H0 3kT (II.17) 이 된다. 고전적 모델로 구한 이 값은 양자모델과 일치한다. 공명방법을 사용하여 이 자화의 시간에 따른 변화를 측정한 것이 NMR 신호이다. 이완 (Relaxation)
시료내 많은 NMR 원자핵에 의해 형성된 자화 M을 외부 자기장과 같은 방향 인 종축 (longitudinal) 성분과 그에 수직한 횡축(transverse) 성분으로 나누어 생각 할 수 있다. 열평형 상태 (thermal equilibrium)에서 자화는 외부 자기장에 평행하 게 있고, 이에 수직인 평면에는 없다 (그림 2(a)). 자기 공명 실험에서 신호를 얻기 위해서 RF (radio frequency) 펄스를 가해 외 부 자기장과 같은 방향 (z)의 자화를 숙임각 (flip angle ; α°) 만큼 xy평면으로 내 린다 (그림 2(b)). 이후의 자화의 각 성분의 변화는 Bloch 방정식으로부터 구할 수 있다. 그림 2. z축에 평행한 외부 자기장 내에서의 자화. (a) 열평형 상태에서의 자화, (b) 숙임각 α°의 RF 펄스를 가한 후의 자화.α°
Mz≠M0 Mxy ≠0 Mz= M0 Mxy= 0(a)
(b)
α°
Mz≠M0 Mxy ≠0 Mz= M0 Mxy= 0(a)
(b)
Bloch 방정식에서 주자장과 평행한 성분인 그림 2(b)에서 자화의 z성분을 Bloch 방정식에서 보면, dMz dt = ( M0- Mz) T1 (II.18) 이고, 이를 풀면 아래와 같다. Mz(t) = M0(1-e - t/T1 ) (II.19)식 (II.19)에 보인 것과 같이 자화의 z성분, 종자화 (longitudinal magnetization)는
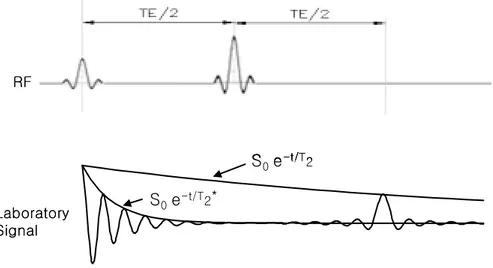
는 시간 상수로, 숙임각이 90°일 때(α°= 90°) 크기가 0이었던 종자화( Mz= 0)가
RF 펄스 차단한 후 열평형 상태 자화 크기의 63 %가 될 때까지의 시간을 의미한 다(그림 3(a)).
그림 2(b)에 생긴 자화의 xy 성분, 횡자화 (transverse magnetization)는 xy평면상 에서 회전하게 된다. 이때 각 스핀들의 회전 속도와 위상이 모두 같으며 이를 동 위상 (in phase)이라고 한다. 그러나 시간이 지남에 따라 각각 스핀들의 세차주파 수 차이에 의한 위상 퍼짐 (dephase) 때문에 그 크기가 줄어든다. 이를 아래의 Bloch 방정식(식 (II.20))을 풀면 식 (II.21)로 나타낼수 있다.
dMxy dt =-Mxy T2 (II.20) Mxy(t) = M0 e - t/T2 (II.21) 여기서 T2는 숙임각이 90°일 때(α°= 90°), RF 펄스를 차단한 후에 처음 자화의
37 %(≈1/e)가 되는 시간으로 spin-spin relaxation time이라 한다 (그림 3(b)). 일반
적으로 물질이 단단할수록 T2 값이 짧고, 액체인 경우에 길다. 정상 조직에서의 T2
와 T1값은 표 2와 같다. T1값은 외부 자기장의 크기에 따라 그 값이 다르며, 표 2
에 보인 것은 1.5 T에서의 값이다.
횡자화에 영향을 미치는 요인은 크게 두 가지가 있다. 순수한 T2 영향인 스핀
사이의 dipole-dipole moment와 외부 자기장의 비균일성(inhomogeneity) 등의 외부 적 요인이 있다. 실제 실험에서는 이 두 가지 영향이 함께 나타나며, 이 때의 시 간 상수를 T2*라고 한다. T2와 T2*와는 다음과 같은 관계가 성립한다. 1 T*2 = T1 2 + ( T 1 2)inhomo (II.22)
그림 3. T1와 T2 이완 곡선. (a) T1 회복 곡선 ① T1 = 10 ② T1 = 30, (b) T2 감 쇄 곡선 ① T2 = 10 ② T2 = 30. 20 40 60 80 100 0.2 0.4 0.6 0.8 1 20 40 60 80 100 0.2 0.4 0.6 0.8 1
(a)
(b)
① 20 ②40 60 80 100 ① ② 0.2 0.4 0.6 0.8 1 20 40 60 80 100 0.2 0.4 0.6 0.8 1(a)
(b)
① ② ① ② 표 2. 정상 조직에서의 T2와 T1Tissue T2 (msec) T1 (msec) at 1.5 T
gray matter 100 920 white matter 92 787 fat 85 260 kidney 58 651 liver 43 492 CSF 2,500 대한방사선사협회 편, 자기공명기술학, 고문사, 1996, p36
2. 자기 공명 영상 (Magnetic Resonance Imaging ; MRI)
가. 자기 공명 영상의 특징
자기 공명 영상은 자장과 라디오파 (radio frequency wave)를 이용하여 체내의 원자핵에 핵자기 공명 현상을 일으켜 원자핵의 밀도 및 물리화학적 특성을 영상 화한 것이다. 기존의 의학 영상인 X-ray나 CT에 비교해서 여러 가지 영상 변수 (parameter)를 가지며, 단 한가지의 parameter에 의해서 영상의 음영도가 좌우되 는 특징이 있다. 이들 영상 변수의 각각에 대한 정보를 여러 가지의 펄스열 (pulse sequence) 방법에 의해 다양하게 영상화할 수 있다. 이러한 자기 공명을 이용한 영상화는 외부 자기장인 주 자기장 ( H0 ), RF 펄 스가 관여하는 RF 자기장 ( H1) 이외에 선형 경사 자기장 ( ( G⋅r) zˆ)이 있어 가 능하다. 균일한 외부 자기장에 선형 경사 자기장을 걸어 주면 자기장이 위치에 따 라 선형적으로 증가 혹은 감소한다. 위치에 따른 자기장은 H( x) = H0+G x이고, 중심으로부터 좌표 x에 있는 양성자는 ω(x) = γ(H0+ Gx)/2π = ω0+ Δω( x)의 주 파수로 세차 운동한다. 즉, 위치에 따라서 세차 주파수가 다르게 되어 자기장 내 물질의 원하는 부분을 선택하여 정보를 얻을 수 있다26. 간단한 자기 공명 영상 기기의 모식도가 그림 4이다. 외부 자기장 H0를 형성 하는 자석(magnet), 공간상의 세 방향으로 경사 자기장을 형성하는 경사 코일 (gradient coil), RF 펄스를 가하고 NMR 신호를 받는 RF 코일(RF coil)이 있다. 경
사 자기장 코일은 각각의 방향으로 균일한 자기장에 선형 경사를 형성한다24. 자기
장의 방향은 z축 방향이고, 세 방향으로 자장의 크기가 선형 경사를 이룬다. 자기 공명 영상 장치에서 신호를 얻기위해서는 주 컴퓨터에서 펄스열을 조절, pulse programmer에서 경사 코일과 RF 펄스를 제어하여 RF 펄스를 가하고, RF 코일에 획득된 신호를 analog to digital converter (ADC)를 거쳐서 주 컴퓨터에 저장되는 일련의 과정을 거치게 된다.
그림 4. 자기 공명 영상 기기의 간단한 모식도. RF : radio frequency, T/R switch : transmit and receive switch, ADC : analog-to-digital converter, AMP : amplifier. Magnet Magnet Gradient Coils Gradient Coils RF Coils RF Coils Gradient Amp Pulse Programmer Host Computer T/R switch ADC Pre Amp RF Amp Magnet Magnet Gradient Coils Gradient Coils RF Coils RF Coils Gradient Amp Pulse Programmer Host Computer T/R switch ADC Pre Amp Pre Amp RF Amp
나. 펄스열 (Pulse sequence)
자기 공명 영상을 얻기 위해선 RF 펄스와 경사 자장의 조합이 필요하고, 이를 조절하는 것이 펄스열이다. 먼저 단면을 선택하기 위하여 절편 선택 (slice selection) 경사 자장을 걸어 주면 단면 위치에 따라 공명 주파수가 달라진다. 원하 는 위치의 특정 주파수를 선택하여 RF 펄스를 가한다. 나머지 두 방향으로는 각각 위상 부호화 (phase encoding), 주파수 부호화 (frequency encoding)를 하여 위치를 구분한다. x축 방향을 주파수 방향으로 하고, 경사 자장을 걸어 주어 위치별 주파수가 ω( x) = γ( H0+Gx)/2π 로 다르게 만드는 것을 주파수 부호화라고 한다. 각 위치 에서 스핀은 주파수 외에도 위상 (phase)을 가지고 있다. y축 방향을 위상 부호화 방향으로 하여 경사 자장 (ΔGy)을 시간 τy 만큼 걸어 주면 위치 y에서의 위상은 φ( y) = γ ΔGyτ y 로 위치마다 다른 위상을 갖게 된다.
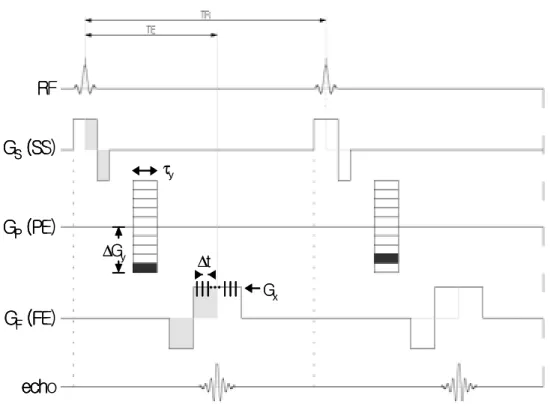
자기 공명 신호를 얻는 데에는 크게 스핀 에코 (spin echo ; SE) 펄스와 경사 자 장 에코 (gradient echo ; GE) 펄스가 있다. 그림 5에 나타낸 스핀 에코에서는 90° RF 펄스에 의해 형성된 횡자화의 위상이 퍼지다가 180°RF 펄스에 의해 다시 동 위상이 되어 에코를 만든다. 90°RF 펄스와 180°RF 펄스 사이의 시간만큼 지나 서 자기 공명 신호인 에코를 얻게 되고 첫 90°RF 펄스부터 에코까지의 시간을 echo time (TE)이라고 한다. 하나의 자기 공명 신호를 얻은 후에는 다른 위상에서
신호를 얻는다. 90°RF 펄스간의 시간을 TR (repetition time)이라 한다. T2 감쇄와
그림 5. 스핀 에코 펄스열. RF : radio frequency, GS (SS; slice selection) : 절편 선 택 경사 자장, GP (PE; phase encoding) : 위상 부호화 경사 자장, GF (FE;
frequency encoding) : 주파수 부호화 경사 자장, ΔGy : 위상 부호화 경사 자장의
크기, τy: 위상 부호화를 걸어주는 시간 간격, Gx: 주파수 부호화 경사 자장의 크
기, Δt: 신호 획득 시간 간격, TR : repetition time, TE : echo time. RF GS (SS) GP (PE) GF(FE) echo 90° 180° ∆Gy τy Gx ∆t RF GS (SS) GP (PE) GF(FE) echo 90° 180° ∆Gy ∆Gy τy τy Gx ∆t Gx ∆t
그림 6. 스핀 에코 펄스열에서 살펴본 T2와 T2*. RF : radio frequency, TE : echo time. S0 e-t/T2 S0 e-t/T2 * RF Laboratory Signal S0 e-t/T2 S0 e-t/T2 * S0 e-t/T2 S0 e-t/T2 * S0 e-t/T2 S0 e-t/T2 * RF Laboratory Signal
하나의 RF 펄스를 가하고 경사 자장 펄스 (gradient pulse)를 이용하여 에코를 얻는 방법을 경사 자장 에코라고 한다 (그림 7). 즉, 주파수 부호화 방향으로 반전 경사 자장 펄스를 가해 스핀들을 다시 동위상으로 만들어 에코를 만든다. 이 경우 는 스핀 에코 펄스와 비교해 볼 때, 180°펄스가 없어서 TE를 짧게 할 수 있다. 그러나 외부 자기장의 비균일성 등에 민감한 단점이 있다. 스핀 에코와 경사 자장 에코 펄스열에서는 90°RF 펄스를 가할 때마다 크기가 다른 위상 부호화 경사 펄스를 가하여 원하는 단면으로부터 하나의 자기 공명 영 상 신호를 얻는다. 전체 스캔 시간은 TR과 위상 부호화 수의 곱에 비례한다.
그림 7. 경사 자장 에코 펄스열. RF : radio frequency, GS (SS; slice selection) : 절편 선택 경사 자장, GP (PE; phase encoding) : 위상 부호화 경사 자장, GF (FE; frequency
encoding) : 주파수 부호화 경사 자장, ΔGy : 위상 부호화 경사 자장의 크기, τy: 위상 부
호화를 걸어주는 시간 간격, Gx: 주파수 부호화 경사 자장의 크기, Δt: 신호 획득 시간
간격, TR : repetition time, TE : echo time.
RF
G
S(SS)
G
P(PE)
G
F(FE)
echo
Gx τy ∆t ∆GyRF
G
S(SS)
G
P(PE)
G
F(FE)
echo
RF
G
S(SS)
G
P(PE)
G
F(FE)
echo
Gx Gx τy τy ∆t ∆t ∆Gy ∆Gy다. k-공간 (k-space)
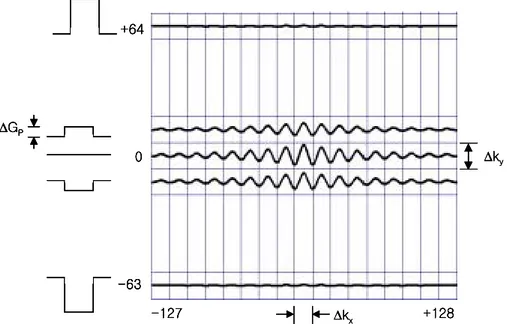
위의 펄스열을 이용하여 얻게되는 RF 코일로 수신한 신호의 공간이 k-공간이 다. 이를 Fourier 변환(Fourier transform ; FT)하여 영상을 얻게된다. k-공간을 나타
낸 것이 그림 8이다. 영상 행렬이 128×256인 경우, 위상 부호화 경사 자장 ΔGy을 ΔGp 간격으로 ΔGy=- 63 ΔGp부터 ΔGy=+ 64 ΔGp까지 변화시키면서 신호를 얻게 된다. 위상 부호화 경사 자장이 0인 k-공간의 중심에서 신호가 가장 크고, 주 변으로 갈수록 신호가 감소한다. 그림에서 k-공간에서의 간격, Δkx, Δky는 그림 5,7의 스핀 에코, 경사 자장 에코 펄스열에서 주파수 부호화 경사 자장의 크기 Gx, 위상 부호화 경사 자장의 크기 ΔGy, 신호 획득 시간 간격 Δt, 위상 부호화 를 걸어주는 시간 간격 τy과의 다음과 같은 관계가 있다. Δkx= γ 2π GxΔt , Δky= γ 2π ΔGyτy (II.23) k-공간에서 중심부위는 대부분의 신호를 제공하며 주변 부위는 영상의 세부묘 사와 관계가 있다. 즉, 주변 부위의 신호를 제외하고 영상을 재구성하면 영상의 세부묘사 정도인 영상의 공간 해상도는 감소한다.
그림 8. k-공간에서의 위상 부호화 경사 자장의 크기와 신호의 크기. 0 +64 -63 -127 +128 ∆GP ∆ky ∆kx 0 +64 -63 -127 +128 ∆GP 0 +64 -63 -127 +128 0 +64 -63 -127 +128 ∆GP ∆GP ∆ky ∆ky ∆kx ∆kx
3. 관류 자기 공명 영상 (Perfusion MRI)
가. 관류 자기 공명 영상
관류 영상을 얻기 위해 이용되는 자화율 대조법은 상자성체(paramagnet) 또는 초상자성체(superparamagnet) 조영제에 의한 주변 조직의 T1, T2, T2* 이완 시간의 변화를 그 원리로 하고 있으며11, 주로 사용되는 Gd-DTPA는 상자성체이다. 조영제에 의한 T1, T2 이완 시간의 변화는 1940년대 후반, 1950년대 중반에 Solomon27과 Bloembergen28,29 에 의해 이론적으로 설명되었다. 상자성 물질의 전 자 스핀과 원자핵의 스핀간의 dipole-dipole interaction이 T1과 T2 이완 시간에 미 치는 영향을 둘 사이의 거리와 관련 있는 dipole-dipole coupling과 원자핵의 스핀 밀도(spin density)와 관련 있는 scalar coupling으로 설명하였다. Solomon은 순수 양성자와 전자의 dipole-dipole interaction에 대해서, Bolembergen은 여기에 상자 성 이온 용액에서 핵의 scalar coupling 항을 더하였다. 스핀 1/2, 자기 회전율 γ 인 핵의 T1과 T2 이완 시간은 다음의 Solomon-Bloembergen 식으로 쓸 수 있다. 1 T1M = 2 15 S( S + 1)γ2g2β2 r6(
3τc 1+ω2Iτ2c + 7τc 1+ω2Sτ2c)
+ 2 3 S( S + 1)A2 ℏ2(
τe 1+ω2sτ2e)
1 T2M = 1 15 S( S + 1)γ2g2β2 r6(
4τc+ 3τc 1+ω2Iτ2c + 13τc 1+ω2Sτ2c)
+ 1 3 S( S + 1)A2 ℏ2(
τe+ τe 1+ω2sτ 2 e)
(II.24)여기서 S는 전자스핀양자수 (electron spin quantum number), g는 electronic g factor, β는 Bohr magneton, r은 상자성 물질의 전자 스핀과 원자핵의 스핀간
의 거리, ωI와 ωs(= 657 ωI)는 각각 핵스핀(nuclear spins)과 전자 스핀(electrons
spins)의 Larmor 주파수 (Larmor angular precession frequency), A는 hyperfine
coupling 상수, 그리고 τc와 τe는 dipolar interaction과 scalar interaction의
는 식 (II.22)에서 1 ( T2)inhomo = γ | ΔB|이므로 다시 쓰면 아래 식과 같다. 1 T*2 = 1 T2 + γ| ΔB| (II.25) 여기서 상자성체에 의한 외부 자기장의 섭동 (perturbation) ΔB은 다음과 같다30. ΔBz(r, θ) B0 = 4π 3 Δχ
(
R r)
3 (3 cos2θ - 1) (II.26) r과 θ는 보통의 구좌표계 변수로, r은 식 (II.24)에서와 마찬가지로 상자성 물질 의 전자 스핀과 주변 조직의 원자핵 스핀 사이의 거리이고, θ는 그 사이 각도이 다. R은 구 모양의 상자성체 반지름이고, Δχ는 자화율 차이이다. 이 상자성체에 의한 자기장의 변화는 그림 9와 같다31. 그림 9. 균일한 자기장 내에 있는 상자성 체에 의한 자기장 변화.식 (II.24), (II.26)에서 살펴보면 T1과 T2 감소는 Gd-DTPA와 조직의 원자핵과의 거
리를 r이라고 했을 때, 1/r6에 비례하고, T 2* 감소는 1/r3에 비례함을 알 수 있 다. 즉, Gd-DTPA와 주변 조직의 거리가 멀면 상대적으로 Gd-DTPA에 의한 T2* 감소 효과가 주로 나타난다. 상자성체인 Gd-DTPA의 농도가 T1, T2 및 T2* 감소에 주는 영향을 수소 원자의 이완도(relaxivity)에서 살펴보면, 조영제의 농도를 C라고 했을 때 다음과 같은 관 계가 있다32. R1≡T1 1, t = 1 T1, 0 + ℜ1[C], ΔR1=T1 1, t - 1 T1, 0 (II.27)
R2≡T1 2, t = 1 T2, 0 + ℜ2[C], ΔR2=T1 2, t - 1 T2, 0 (II.28) R*2≡ 1 T*2,t = 1 T*2,0 + ℜ*2[C], ΔR * 2= 1 T*2,t - 1 T*2,0 (II.29) 여기서 아래 첨자 t와 0는 각각 Gd-DTPA가 들어있을 때와 없을 때를 의미한다. 농도의 비례상수 ℜ1,ℜ2,ℜ*2는 단위 농도당 이완도로 단위는 mM -1sec-1이다. Pedersen 등33에 의하면 사람의 혈장(22℃)에서의 ℜ1, ℜ2 값은 ℜ1=4.42±0.07
mM-1sec-1 (R2 >0.98), ℜ2=5.75±0.17 mM-1sec-1 (R2 >0.98)이다. Hendrick 등34은
ℜ1=4.5 mM -1 sec-1, ℜ2=6.0 mM-1sec-1 (0.5-1.5 T)을 이용하여 상자성 조영제 Gd-DTPA의 농도 C의 변화가 T1 ,T2 감소에 미치는 영향을 비교하였다. 이에 의 하면, 농도가 0 일 때 각각 1000 msec, 100 msec 이던 T1 ,T2가 비교적 낮은 농도 인 0.2 mM일 때는 526 msec, 89 msec로 각각 47 %, 11 % 감소하여 T1 감소 효과 가 상대적으로 크며, 비교적 높은 농도인 2 mM일 때는 T1 ,T2가 100 msec, 46 msec로 각각 90 %, 54 % 감소하였다. 경사 자장 에코로 얻게 되는 T2* 감소에 의한 신호 감소는 동물 실험에서 혈관 내 조영제 농도와 작은 혈관 (3∼10 ㎛)의 분포 정도에 관계가 있다고 발표되었다 35,36. 식 (II.29)에 보인바와 같이 혈관내의 조영제 농도가 높을수록 국소 자장의 비 균일성은 커져 조직의 T2* 신호는 더욱 감소하게 되며 이러한 신호 감소는 혈류량 에 비례하게 된다3,37,38. 즉, 조영제의 농도에 비례하여 신호변화가 증가하며 이는 혈류량의 증가를 의미한다3.
나. 2구획 모델 (Two compartments model)
조영제를 사용한 관류 영상에서 혈관 투과도를 구하는 방법은 여러 가지 모델 을 기반으로 하고 있다39-43. 그 중에 일반적으로 많이 사용되는 2구획 모델을 본 실험에서 사용하였다. 2구획 모델을 그림으로 나타내면 그림 10과 같다. 그림 10. 2구획 모델 모식도. Vv: 혈관 부피, Ve: 혈관외 공간 부피, F : 혈관내 혈액의 흐름.V
eV
vF
k
vek
evV
eV
vF
k
vek
ev여기서, Vv는 혈장 부피 (plasma volume), Ve는 혈관외 공간 부피 (extravascular
volume), 그리고 Xe는 혈관외 공간의 조영제(tracer in the extracellular space)를
의미한다. 혈관외 공간의 조영제의 시간에 따른 변화를 살펴보면, dXe dt = K( cv- ce) = kveXv- kevXe (II.30) 와 같이 쓸 수 있고, 여기서 두 구획 사이의 경계면 사이의 조영제의 교환 비율 (rate of exchange in the tracer concentration due to exchanges across the vessel
walls)은 각각 kve= K/Vv, kev= K/Ve이며 이들의 방향은 그림 10에 나타낸 것
마찬가지로 혈관내의 조영제( Xv)의 시간에 따른 변화를 식으로 나타내면 다음 과 같다. dXv dt = K( ce- cv) - F cv = kevXe-kveXv-kvXv (II.31) 여기서 kv는 혈류에 의한 변화정도를 나타내는 값으로, kv= F/Vv로 쓸 수 있다. 전체 조직에서의 조영제의 양 X는 혈관내, 혈관외의 조영제 양의 합이며(식 (II.32)), 이는 biexponential 함수로 나타낼 수 있다(식 (II.33)).
X = Xe+ Xv (II.32) X = A e- αt+B e- βt (II.33) 위의 식 (II.33)과, 위에서 살펴본 혈관 내와 혈관외 조영제의 시간에 따른 변화로 나타낸 식 (II.30), (II.31)과의 관계로부터 아래와 같은 식이 성립한다. kve+ kev+ kv= α + β (II.34) kvkev= α β (II.35) 이들로부터, 조영제의 혈관 투과도 kev와 kve를 구할 수 있다 44 .
III. 방법
1. 동시 획득 T
1/T
2* 강조 경사 자장 펄스열
가. 펄스열 개발
General Electric (GE)사의 펄스개발용 프로그램인 EPIC (Environment for Pulse Programing in C, version ; genesis 5.8, General Electric Medical System, Milwaukee, Wisconsin, USA)을 이용하여 제작했다. 기존의 경사 자장 이중 에코 펄스열을 수정하여 같은 부위를 연속해서 스캔하는 역동적 영상화가 가능한 동시 획득 T1/T2* 강조 경사 자장 펄스열을 새로이 개발하였다. 동시 획득 T1/T2* 강조 경사 자장 펄스열을 그려보면 그림 11과 같다. TE1에서 T1 강조 신호를 얻고, TE2 에서 T2* 강조 신호를 얻는다. T1 강조 신호를 얻는 시간 TE1을 줄이기 위하여 부 분 에코(fractional echo)로 하였다. 관류 정보를 얻기 위해서는 하나의 영상을 얻는데 걸리는 영상획득 시간이 짧 아야하고 이를 위하여 key-hole 방법22을 사용하여 시간 분해능을 증가시켰다. 일 반적인 경우에는 그림 12의 (a)와 같이 k-공간을 전부 채워 영상을 얻으나, key-hole 방법을 사용하면 그림 12(b)에 보인 것과 같이 중심 일부만 신호를 얻어 영상 획득시간을 단축시킨다. 즉, key-hole 방법이란 위상 부호화 회수를 줄여 영 상을 얻는데 걸리는 시간을 감소시켜 시간 분해능을 높이는 방법이다. k-공간에서 중심부로부터 떨어진 부위에서의 신호는 주로 영상의 선명도에 영향을 미친다. 따 라서, key-hole 방법을 사용하면 영상의 공간 해상도는 떨어지나 관류 영상과 같 이 시간 해상도가 중요한 경우 유용하게 이용된다. 본 실험에서는 k-공간의 중심 50 %만을 채웠다.
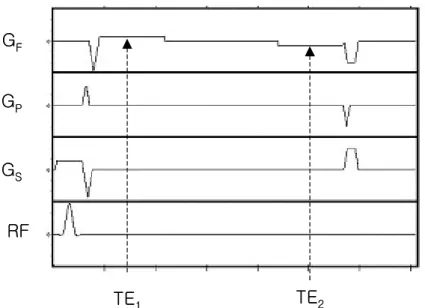
그림 11. 동시 획득 T1/T2* 강조 경사 자장 펄스열. GF: 주파수 부호화 경사 자장, GP: 위상 부호화 경사 자장, GS: 절편 선택 경사 자장, RF : radio frequency, TE : echo time.
TE
1TE
2RF
G
FG
PG
STE
1TE
2RF
G
FG
PG
S 그림 12. 일반적인 경우와 key-hole 방법을 사용한 경우의 k-공간. (a) 일반적인 경우, (b) key-hole 방법을 사용한 경우. 일반적인 경우 에는 k-공간을 전부 채워 신호를 얻고, key-hole방법을 사용한 경우 에는 k-공간의 중심부에서만 신호를 얻는다.(a)
(b)
(a)
(b)
나. 영상 획득
GE사의 임상용 자기 공명 영상 기기인 Horizon (1.5T) (GE Medical System,
Milwaukee, Wisconsin, USA)을 이용했다. 앞에서 개발한 동시 획득 T1/T2* 강조
경사 자장 펄스열을 사용하여 팬텀 영상을 얻었다. 영상 변수는 TR 40 ms,
TE1/TE2는 4/20 ms, 영상행렬 128×256으로 하였다. 시간 해상도를 높이기 위해
key-hole 방법으로 얻은 k-공간 데이터는 MR scanner에서 바로 영상 재구성하지 못하고 raw data를 저장하여 IBM (International Business Machines Corporation) 호환 컴퓨터로 옮겨 영상 재구성을 했다. 영상 재구성을 위한 소프트웨어는 IDL (Interactive Data Language; Research Systems Inc., Boulder, Colorado, USA)로 자체 제작한 프로그램을 이용하였다.
하나의 영상을 얻는데 걸리는 시간은 key-hole 방법을 사용하지 않을 경우, 5.12 sec(=128×40 ms) 걸리지만, key-hole 방법을 사용할 경우 2.56 sec (=128× 0.5×40 ms) 소요된다. 한번의 역동적 영상을 얻는데 80개 영상을 약 3분 28초 동 안 얻었다.
Sephadex 팬텀의 T2와 T1 측정은 스핀 에코 펄스열을 사용하였다. T2 측정은
TR은 1500 msec로 고정하고, 식 (II.21)에서 t=TE로서 TE를 14, 24, 34, 44, 54, 64,
74, 84, 148 ms로 변화시키면서 영상을 얻었다. T1 측정은 TE는 가장 짧은 14
msec로 고정하고, 식 (II.19)에서 t=TR로서 TR을 33.3, 50, 66.7, 100, 133, 166, 233, 300, 400, 600, 1000, 2000 ms로 변화시키면서 영상을 얻었다.
2. 실험 장치와 팬텀(Phantom)
관류 실험 장치는 그림 13과 같다. 팬텀으로 사용한 Sephadex column 또는 투 석기(dialyzer)를 정량 펌프(peristaltic pump)와 연결하여 NaCl 용액 혹은 Gd-DTPA 용액을 관류 시켰다. 정량 펌프는 자기 공명 영상실 밖에 위치하고, 그 사이는 Sephadex column은 내경, 외경이 2, 4 mm인 실리콘 튜브로, 투석기의 경 우에는 4, 6 mm 튜브로 연결하였다. 실험에 사용한 정량 펌프는 EYELA사의 MP-3N(EYELA, Tokyo, Japan)이다.
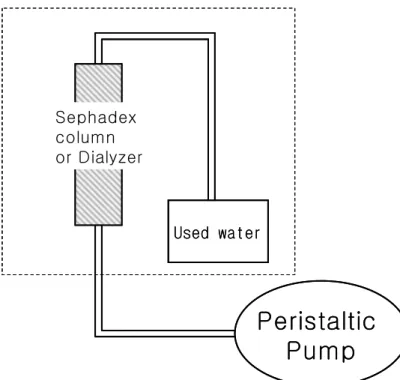
그림 13. 관류 실험 장치 모식도. 점선 안쪽 부분은 자기 공명 영 상실 내부이다. 정량 펌프(peristaltic pump)는 영상실 밖에 위치 하고 있다.
Peristaltic
Pump
Used water Sephadex column or DialyzerPeristaltic
Pump
Used water Sephadex column or Dialyzer가. Sephadex 팬텀
팬텀 구성 물질로 사용한 Amersham biosciences사의 Sephadex(Amersham biosciences, Uppsala, Sweden)는 dextran으로 이루어져있다. Dextran과 같은 생체 적합성 고분자는 약한 반자성을 가지며, Sephadex도 마찬가지로 약한 반자성을
가져부록[1] Sephadex의 물성 자체가 Gd-DTPA를 이용한 실험 결과에 영향을 미치
지 않을 것이다. 이외의 Sephadex의 자세한 특징은 표 3에 나타내었다. 표 3. Sephadex의 technical specifications
Dry Particle diameter [㎛] Wet Particle diameter [㎛] Fractionation ranges
[mol. mass] Waterregain [㎖ H2O /g dry gel] Bed volume [㎖/g dry gel] Density of swollen particles [g/㎖] Peptides and globular proteins G10 40-120 55-165 < 700 1.0±0.1 2-3 1.24 G25 (superfine) 10-40 17-80 1,000-5,000 2.5±0.2 4-6 1.13
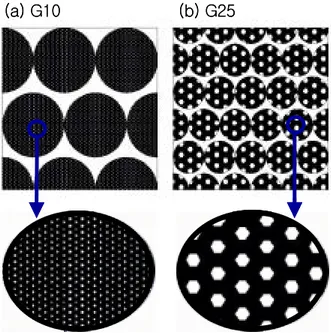
Amersham Biosciences 2002. p488 Technical specifications 여기서 water regain이란 마른 Sephadex 분말 1 g이 흡수하는 물의 부피를 의미하 며 이에 값에 따라 Sephadex의 이름이 정해졌다. 이것은 Sephadex의 구조 등의 특성을 결정하는 값이다. 실험에 사용한 Sephadex인 G10, G25 superfine을 물에 팽창(swelling) 시켰을 때 bead의 크기는 55~165, 17~80 ㎛로 약 2배 차이나며(그 림 14), pore 크기는 표 3의 fractionation range로 추정해 볼 수 있는 값으로 G25 이 G10에 비해 약 4배정도 크다(그림 14의 확대 부분).
Gd-DTPA의 농도에 따른 신호 세기의 변화를 알아보기 위한 고정 팬텀으로, Sephadex를 그림 15에 보인 것과 같이 직경 1.5 cm, 높이 3 cm의 5 ml 병에서 수 분 흡수 후 팽창된 부피가 약 5 ml가 되도록 각각 2.0, 1.0 g 넣고, 다양한 농도의 Gd-DTPA 용액으로 팽창시켰다.
그림 14. 수분 흡수로 팽창한 Sephadex의 wet bead 크기와 pore 크기의 모식도. (a) G10은 (b) G25에비해 bead 크기는 2배이고, pore 크기는 1/4 이다. (위 그림 에서 pore 크기는 bead 크기에 비해 과장되게 그려졌 다.) (a) G10 (b) G25 (a) G10 (b) G25 그림 15. Sephadex 고정 팬텀 실물 사 진. 팽창 후 부피가 약 5 ml가 되도록 다양한 농도의 Gd- DTPA 용액에서 팽 창시켰다.
5 ml
5 ml
관류 팬텀으로는 증류수로 하루이상 팽창시킨 Sephadex를 그림 16에서와 같이 XK 16/20 column에 약 52, 48 mm 높이로 채운 것을 이용하였다. Sephadex column을 정량 펌프와 연결하여 0.15 M NaCl 용액을 화살표 방향으로 분당 약 3.6 ml로 관류시켜 영상을 얻었다. 관류액이 지나가는 Sephadex bead의 외부는 전체 부피의 33 %를 차지하므로, 관류 속도는 약 0.9 mm/sec가 된다. 영상을 얻 을 때, 고정 팬텀으로 2 % agar를 사용하였다. Sephadex 관류 팬텀을 자기 공명 영상기기 내에 세워서 넣고, extremity 코일을 이용하여 관류 방향에 수직인 단면 인 coronal 영상을 얻었다. 동시 획득 T1/T2* 강조 경사 자장 펄스열을 이용하여 영상을 얻기 시작한 후 약 20초 경과 후에 25 mM Gd-DTPA 0.1 ml를 일시 주입 하여 약 3분 동안 영상을 얻었다. 이때 0.15 M NaCl 용액을 사용한 것은, 전하를 띤 Gd가 Sephadex에 결합하는 것을 막기 위해서이다.
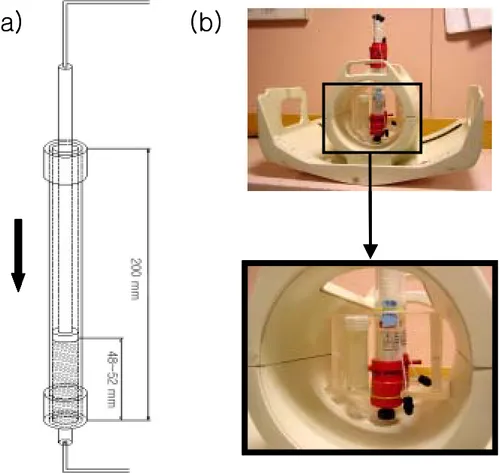
그림 16. Sephadex를 XK 16/20 column에 패킹하여 extremity 코일에 장착한 사진. (a) Sephadex를 XK 16/20 column에 높이 약 5 cm로 패킹한 모습, (b) Sephadex column을 extremity 코일에 장착한 모습.
(a)
(b)
나. 투석기 (Dialyzer)
동시 획득 T1/T2* 강조 경사 자장 펄스열을 이용하여 막의 투과도를 측정하기
위한 팬텀으로 hollow fiber형 투석기(dialyzer ; F5( conventional therapy dialyzer), Fresenius Medical Care AG, Bad Homburg, Germany)를 사용하였다(그림 17). 실 험에 사용한 투석기 F5의 특성은 표 4와 같다.
그림 17에서 hollow fiber 내부로 들어가는 혈액이 들어가는 부분(②)은 막고, 투석액이 들어가는 부분(①)을 통해 500 mM Gd-DTPA 2 ml를 넣고 약 3일 이상 경과 후에 실험하였다. Gd-DTPA는 fiber의 pore를 충분히 통과하기 때문에, 투석 기 전체에 고루 퍼지고, 그때의 농도는 약 4 mM이 된다. 관류 영상을 얻을 때에 는 hollow fiber의 외부로 연결된 그림 17의 ①은 막고, ②를 통해 hollow fiber 내 부로 4 mM 보다 낮은 농도인 1.0∼2.0 mM의 Gd-DTPA 용액을 약 26, 30 ml/min 속도로 관류시키면서 영상을 얻었다. 관류 용액이 지나가는 투석기의 fiber 내부는 전체 부피 중 약 30 %를 차지하므로, 이때의 관류 속도는 각각 1.6, 1.8 mm/sec가 된다. 자기 공명 영상장치의 축에 평행하게 투석기를 놓고, extremity 코일을 이용하여 물의 흐름에 수직되는 단면인 axial 영상을 약 3분 30 초씩 5분 간격으로 약 1시간 동안 얻었다.
그림 17. 실험에 사용한 hollow fiber 형태의 투석기 모식도. 관류 영상을 얻는 동 안에는 투석액이 들어가는 부분(①)은 막고, 혈액이 들어가는 부분(②)으로 낮은 농도의 Gd-DTPA 용액을 관류시켰다. 1 2 1 2 표 4. 투석기 (dialyzer) F5의 특성 F5 surface Area [㎡] 1.0 Prime Volume [㎖] 63 UFR [㎖/min/mmHg]* 4.0
Membrane Fresenius Polysulfone
Membrane wall thickness [㎛] 40
inner diameter [㎛] 200
http://www.pitt.edu/~patzer/dialysis/dialyzers.htm Fresenius, Lexington, Massachusetts, USA
3. 영상 후처리
관류 자기 공명 영상으로부터 여러 가지 관류 정보를 얻기 위하여 IDL을 이 용하여 자체 개발한 소프트웨어를 사용하였다. 먼저, 동시 획득 T1/T2* 강조 경사 자장 펄스열을 이용하여 얻은 데이터를 영상으로 재구성한다. Key-hole 방법으로 k-공간의 중심 50 %에서만 신호를 측정하였고, 그 외의 공간은 0으로 채워 discrete Fourier 변환을 이용하여 영상으로 재구성했다. 처음 2개의 영상에서는 key-hole 방법을 사용하지 않았고, 이때에는 자화가 steady-state에 도달하도록 처 음 46번의 에코는 저장하지 않았다. Steady-state 신호는 TE에서 ρ0 ˆ( α,TE) = ρ 0sinα ( 1 - e - TR/T1 ) ( 1 - cos α e- TR/T1 ) e - TE /T* 2 (III.1) 와 같이 쓸 수 있으며26, 여기서 ρ0는 voxel의 스핀 밀도, α는 숙임각, TR은 반복 시간이다. 동시 획득 T1/T2* 강조 경사 자장 펄스열에서 Gd-DTPA에 의한 T1, T2* 감소와신호의 크기 변화를 MathematicaⓇ4 (Wolfram Research, Inc., Champaign, Illinois,
USA)를 이용하여 살펴본 것이 그림 18이다. 그림 18에서 (a)는 조영제 주입 이전의 신호로 이때의 T2*는 T2*,0라고 하고, (b)~(e)는 조영제 주입 후 시간 t에서의 신호로 이때의 T2*는 T2*,t= 0.5 T2*,0로 조영제 주입이전의 T2*에 비해 1/2로 감소하였다고 가정하였다. T2* 감소에 의한 T1 강조 신호 S1과 T2* 강조 신호 S2의 변화를 하나씩 살펴보면, 초기 신호 S0가 조영제 주입 이전과 같은(S0= S0,t= 1) (b)에서는 S1, S2 모두 감소하였으나 실제로 S0는 Gd-DTPA에 의한 T1 감소에 의해 증가하게된다. S0가 1.1배인 (c)에서 S1, S2 모두 감소하였고, S0가 2배인 (d)에서는 S1은 증가, S2는 감소하였고, S0가 4배인 (e)에서 S1, S2 모두 증가하였다. 이와같이 T2* 감소 혹은 T1 감소 중 하나만을 강조하고 다른 하나에 의한 영향을 무시하면, 경우에 따라서 는 잘못된 신호 변화 곡선을 얻게 된다. 따라서, 정확한 관류 정보를 얻기 위해서 는 단순한 T2* 강조, T1 강조가 아니라, T2* 감소와 T1 감소의 분리가 필요하다.
그림 18. 조영제 주입으로 T2*가 1/2로 감소하는 경우 첫번째, 두번째 신호의 크기변 화. (a) 조영제 주입 이전(t=0)의 신호로 초기 신호 S0, 0=1이라 하였다. (b∼e) 조영 제 주입 후 시간 t에서의 신호로 초기 신호 S0,t를 다르게 하였다. (b) S0,t=1, (c) S0,t=1.1, (d) S0,t=2, (e) S0,t=4. 10 20 30 40 0.2 0.4 0.6 0.8 1 10 20 30 40 0.5 1 1.5 2 2.5 3 3.5 4 10 20 30 40 0.2 0.4 0.6 0.8 1 1.2 1.4 10 20 30 40 0.25 0.5 0.75 1 1.25 1.5 1.75 2 10 20 30 40 0.2 0.4 0.6 0.8 1
TE
1TE
2S
1,tS
2,t▼
▼
S
0,t= 1
(b)
TE
1TE
2S
1,0S
2,0(a)
S
0,t=1.1
▼
▼
(c)
S
0,t= 2
▼
▲
(d)
S
0,t= 4
▲
▲
(e)
S
0,0= 1
10 20 30 40 0.2 0.4 0.6 0.8 1 10 20 30 40 0.5 1 1.5 2 2.5 3 3.5 4 10 20 30 40 0.2 0.4 0.6 0.8 1 1.2 1.4 10 20 30 40 0.25 0.5 0.75 1 1.25 1.5 1.75 2 10 20 30 40 0.2 0.4 0.6 0.8 1TE
1TE
2S
1,tS
2,t▼
▼
S
0,t= 1
(b)
TE
1TE
2S
1,0S
2,0(a)
S
0,t=1.1
▼
▼
(c)
S
0,t= 2
▼
▲
(d)
S
0,t= 4
▲
▲
(e)
S
0,0= 1
한번의 TR 내에서 TE1, TE2에서의 신호를 식으로 표현하면 아래와 같다. S1, 0= S0, 0e - TE1/T* 2,0 S2, 0= S0, 0e - TE2/T* 2,0 (III.2) S1,0, S2,0의 첫번째 아래 첨자 1, 2는 각각 TE1, TE2에서 얻은 첫번째, 두번째 신호 를 의미하고, 두번째 아래 첨자 0는 조영제 주입 이전을 의미한다. S0,0, T2*,0의 두 번째 아래 첨자 0도 마찬가지로 조영제 주입 이전을 의미하며, S0는 초기값이다. 한번의 TR내에서 동시 획득 T1/T2* 강조 경사 자장 펄스열을 이용하여 T1, T2* 강조 신호를 둘 다 얻어 아래와 같이 S0와 1/T2*에 대한 2차 방정식의 해를 구할 수 있다. S0, 0= exp TE2ln[S1, 0] - TE1ln[S2, 0] TE2-TE1 (III.3) 1 T*2,0 = ln [S1, 0]- ln [S2, 0] TE2- TE1 (III.4) 조영제 주입 후 시간 t 만큼 경과 후에는 t=0인 위 식 (III.2)의 경우와 마찬가 지로 쓸 수 있으므로, 각각의 시각에서 재구성한 T1 강조, T2* 강조 영상에서 관심
영역(ROI ; region of interest)을 선택하여 S0와 1/T2*를 식 (III.3), (III.4)와 같이 구 할 수 있다. 식 (III.3)을 이용하여 얻은 S0의 시간에 따른 변화는 순수하게 조영제 주입에 의한 T1 감소의 영향만 받은 신호이고, 식 (III.4)에서 얻은 T2*의 시간에 따른 변화 는 T1 감소 영향을 보정하여 T2* 감소만을 구별한 값이다. 윗 식들로부터 T1 감소 와 T2* 감소를 물리적으로 완벽하게 구별하여 정확한 관류 정보를 얻을 수 있다. T1 감소 효과만을 구별한 초기 신호 S0로부터 steady-state에서의 신호, 식 (III.1)을 이용하여 보정한 ΔR1(=1/T1,t-1/T1,0)을 구했다. 마찬가지로 T2 * 감소만 구별하여 보정한 ΔR* 2(=1/T2 * ,t-1/T2*,0)를 구했다. Sephadex 팬텀의 관류 영상으로부터 관류량 영상을 얻기 위하여 Gd-DTPA의 농도에 선형 비례하는 시간에 따른 ΔR1 곡선을 적분하였다. 이 적분값은 적분 구 간 동안의 관류량을 의미하며, γ-variate 함수로 fitting하여 적분하였다45. ΔR1 곡
선으로부터 얻은 관류량과 비교하기 위하여 Sephadex의 특성으로부터 영상을 얻 은 부분의 물의 부피를 구했다.
투석기의 관류 영상으로부터 얻은 ΔR1 곡선을 bi-exponential 함수로 fitting하