저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
이학 석사학위 논문
NPFFR2와 이의 리간드 NPFF가
암의 진행에 미치는 영향 연구
아 주 대 학 교 대 학 원
의생명과학과/분자의학전공
정 원 희
NPFFR2와 이의 리간드 NPFF가
암의 진행에 미치는 영향 연구
지도교수 강
엽
이 논문을 이학 석사학위 논문으로 제출함.
2015년 8월
아 주 대 학 교 대 학 원
의생명과학과/분자의학전공
정 원 희
- 국문요약
-NPFFR2와 이의 리간드 NPFF가
암의 진행에 미치는 영향 연구
G-protein coupled receptor family의 일종인 NPFFR2 (Neuropeptide FF receptor2) 는 RFamide peptide ligand에 의해 활성화된다. 이 수용체는 통 증 조절과 관련된 신경학적 세포 신호 전달에 기능을 하는 것으로 알려져 있지만, 발암과 연관하여 작용기전이나 기능은 아직까지 정확히 알려지지 않았다. 이번 연구에서는 NPFF가 간암 세포주 SNU739, SNU475에서 NPFFR2를 활성화시켜, PKC/ERK 신호를 증가시키고, 간암 세포주의 인공 적 기질 내 침윤 능력 및 간암 세포주의 이동을 증가시킨다는 것과 수용체 의 과발현 역시 간암 세포주의 침윤 능력을 증가시킨다는 것을 밝혔다. 간 암 세포주에서 수용체인 NPFFR2의 발현억제에 의해 세포의 생존 및 침윤 능력이 억제되고, NPFF에 의한 침윤 능력이 억제되는 것을 확인하였다. 이 러한 일련의 실험결과는 NPFFR2가 간암 발생의 중요한 신호 전달에 기여 한다는 것을 시사한다.
차 례
국문요약 ··· ⅰ 차례 ··· ⅱ 그림 차례 ··· ⅲ Ⅰ. 서론 ··· 1 Ⅱ. 재료 및 방법 ··· 5 A. 간암 세포주 및 세포배양 ··· 5 B. RNA 분리 및 RT-PCR ···5 C. 발현 조절 및 펩티드를 이용한 수용체 활성화 ···6 D. Western blot ··· 6 E. Invasion assay ···7F. Wound healing assay ··· 7
G. Colony formation assay ··· 8
Ⅲ. 결과 ···9
Ⅳ. 고찰 ···26
Ⅴ. 결론 ···30
참고문헌 ···31
그림 차례
Fig. 1. Up-regulation of NPFFR2 expression in cancer cell lines ··· 9
Fig. 2. Activation of ERK signaling by NPFF ··· 11
Fig. 3. Increase of Invasion rate by addition of NPFF ··· 13
Fig. 4. Increase of cell migration by addition of NPFF ··· 15
Fig. 5. Decrease of cell invasion by depletion of NPFFR2 ··· 17
Fig. 6. NPFF-induced invasion requires NPFFR2 ··· 19
Fig. 7. Increase of invasion rate by NPFFR2 overexpression ··· 21
Ⅰ. 서론
간암은 전 세계적으로 여섯 번째로 많이 발생하는 암종으로, 예후가 좋지 않아 암으로 인한 사망 원인의 3위를 차지하고 있다. 특히, 한국을 비롯한 아시아 국 가에서 가장 흔하며, 최근 서구에도 발생률이 증가하고 있는 추세이다 (Siegel 등, 2013). 간암의 위험 인자로는 HBV, HCV와 같은 간염 바이러스, 알코올 섭취 로 인한 간경변증 그리고 지방간으로 인한 만성적인 간의 손상, 비만이나 당뇨와 같은 대사성 질환 등이 있다(Forner 등, 2012; El-Serag와 H. B, 2012; Yu 등, 2013). 최근 만성 간염과 간경변을 포함한 간암 발생의 고위험군 환자에 대한 복 부 초음파 검사와 혈청 태아 단백뇨 검사를 비롯한 여러 가지 선별 검사를 통한 조기 진단의 가능성이 높아졌으며, 외과적 수술 혹은 약물학적 치료로 인하여 과 거에 비해 예후가 많이 개선되었다 (Ali 와 Gangan, 2014; Hanshen 와 El-serang, 2011) 하지만, 간암의 재발률 및 사망률이 높은 원인은 조기발견이 어려우며, 전이성암을 포함하는 진행성 간암 (advanced HCC)에 대해서 아직까 지 효과적인 치료 타겟이 존재하지 않기 때문이다. 최근 분자적 암치료 타겟용 신약들이 간암 치료 타겟으로 주목받았지만, 임상시험단계에서 진행성 간암에 치 료효과가 미미하여 (Gan-Lu Deng 외, 2015) 간암에 대한 근본적인 분자적 기작 에 대한 이해와 이를 바탕으로 새로운 치료 타겟의 발굴이 필요한 상황이다. 현 재까지 분자적 암 치료 타겟으로 G 연결 단백질이 많이 연구되고 있다(Lappano 와 Maggiolini, 2011). G 단백질 연결 수용체 (G protein-coupled receptor, GPCR)는 리간드를 통해 세포 외부의 신호를 세포 안으로 전달시켜주는 세포 표면 단백질로써 현재까지 약 800여종의 GPCR 관련 유전자가 존재하는 것으로 알려져 있다. GPCR은 7개의 특징적인 transmembrane이 안 밖으로 구부러져 있는 α-helix를 공유하고 있 다(Pierce 등 2002). 세포 외부의 다양한 리간드 자극에 의해 GPCR이 활성화되 면 구조적으로 변화하고 GEF (guanine nucleotide exchage factor) 로 작용해 세 포막 안쪽에서 결합해 있는 G protein을 활성화시킨다. G protein은 α, β, γ 세 가지의 subunit으로 구성되어 있다. 활성화된 GPCR에 의해 GDP가 α subunit에 서 떨어져 나와 GTP가 그 자리를 대신하게 되고, α subunit으로부터 βγ subunit 이 분리되어 여러 가지 하위 effector를 자극한다 (Neves 등 2002). 각각의 subunit은 외부 자극을 세포내 신호로 다양한 방법을 통해 전달한다. α subunit은 세포 내부의 여러 가지 효소 혹은 이온채널을 활성화시키거나 억 제한다. α subunit은 아미노산 서열의 유사도와 그 기능에 따라 Gs, Gi/o, Gq/11, G12/13으로 구분된다. Gs는 adenylate cyclase (AC)를 활성화시켜 세포 내 cAMP의 농도를 증가시키지만, Gi/o는 AC의 작용을 억제시켜 cAMP 농도를 감 소시킨다. Gq/11은 phospholipase C (PLC)를 활성화시켜 phophatidylinositol bisphophate (PIP2)를 cleavage하여 diacylglycerol과 inositol tripohosphate (IP3) 를 생성한다. 또한 세포 내 칼슘 농도를 증가시킨다 (Werry 등 2003; C.R 등 2005). G12/13은 small G protein Rho 혹은 Na+/H+ ion exchanger 신호전달 경 로를 활성화 시킨다 (Lin X 등 1996; Le Page 등 2003). βγ 복합체는 GPCR 신 호 전달 체계의 중앙 매개자로써, 매우 안정적인 구조를 가지고 있어 하나의 기 능적 단위로 여겨진다. 복합체가 PLCβ에 작용하여 mitogen-activated protein (MAP) kinase 경로를 활성화시키는 것이 잘 알려져 있다 (Katz 등 1992; Murthy 등 1996; Clapham 등 1997; Wess 등 1998; A. V. Smrcka. 2008).
GPCR에 의한 세포의 외부 환경 제어 및 세포내부 신호전달기능은 암세포의 생존과도 밀접한 연관이 되어있기 때문에 (Dorsam과 Gutkind, 2007) 암 신호전
달을 제어하는 antagonist, agonist를 스크리닝 하여 저해제 용도로의 항체, 또는 백신으로의 개발이 가능하고, 타게팅 방식이 다른 약물 스크리닝에 비해 훨씬 용 이할 뿐 아니라 암의 증식, 전이, 이동 등과 관련한 암치료와 관련되어 치료 타 겟 가능성이 높다 (Xu와 Xiao, 2012).
FMRF amide (Phe-Met-Arg-PheNH2)-like neuropeptides의 family에 속하는 유전자로 단일 유전자에서 C-terminal에 RF-amid를 공유하는 펩티드로는 Neuropeptide FF (NPFF)와 neuropeptide AF (NPAF) 두가지가 있다 (Roumy와 Zajac, 1998). 그 중 GPCR 자극 리간드중 하나인 NPFF는 opioid 계열에 속하는 신경 펩티드로 중추신경계에서 진통 및 모르핀등의 마약 반응성, 체온과 관련된 조절시스템과 관련된 기능을 하는 것이 보고되었다 (Panula 등, 1999; Hsiu-Ying 등, 2008). NPFF에 의해서 활성화되는 GPCR로 NPFFR1과 NPFFR2 두 가지의 수용체가 존재하며 (Bonini 등, 2000; Zajac, 2001), 50%의 유전적 일치도를 보인 다. NPFF receptor를 활성화시키는 리간드는 Neuropeptide FF-like peptides 펩 티드인 NPSF (RFRP-1)와 NPVF (RFRP-3) 등이 있으며 이들은 NPFFR1을 활 성화 시키고, NPFF는 NPFFR2를 더 친화적으로 활성화 시킨다고 알려져 있다 (Liu 등, 2001).
신경 펩티드 일부는 Vasopression, GRP (Gastrin releasing peptide) 와 같이 성장인자로도 역할을 하기 때문에, 암세포성장에도 중요한 기능을 하는 것으로 연구되고 있고 (Lynn 등, 2001), 다양한 신경펩티드가 각종 암에서 생성되어 암 세포 생장에 중요한 기능을 하는 것으로 알려져 있다 (Enrique 등, 2002). 신경 펩티드가 활성화시키는 수용체는 c-Jun N –terminal kinase (JNK), p38 그리고 ERK5와 같은 mitogen-activated protein kinase (MAPK) superfamily나 Rho GTPase와 같은 여러 pathway에 의해서 extracellular signal-regulated kinase
(ERK)를 자극한다. 따라서 신경 펩티드 수용체의 autocrine 또는 paracrine 자극 을 통하여 암세포의 통제 불가능한 생장과 생존을 촉진하는 유전적 프로그래밍 의 발현을 조절하게 된다 (Marinissen 등, 2001). NPFF와 함께 통증조절과 관련한 Opioid에 속하는 신경펩티드인 β-endorphin 은 소세포암, 유방암에서 암세포생장을 촉진 하는 것으로 보고된 바 있다 (Jakub와 Anna, 2004). NPFF는 암에서는 보고된 바 없지만, 신경세포에서 성장 인자로의 가능성이 알려진 바 있고 (Jack 등, 2002), NPFF는 Gq/11-protein coupled receptor와 상호작용 하는 것으로 알려져 있다 (Elshourbagy 등, 2000;
Hinuma 등, 2000; Parker 등, 2000). 최근에 모르핀이 암성장을 촉진하는 보고
(Kuraishi Y, 2001; Katarzyna Gach 등, 2011)가 있었으므로 모르핀 통증조절기
전과 연관이 있는 NPFF 및 이의 수용체가 암과도 연관이 있을 가능성이 있다고 판단된다. 본 연구의 목적은 NPFFR2가 암세포의 침윤과 전이와 관련하여 어떠한 연관 성이 있는지를 밝히는 것이다. NPFFR2는 암의 치료 타겟 가능성이 높은 GPCR 중 하나이며, 이러한 GPCR에 의해 조절되는 세포의 외부 환경 제어 및 세포내 부 신호전달기능이 암세포의 생존과도 밀접한 연관성이 되어있다. 따라서 이의 발현이 정상 세포주와 간암 세포주에서의 발현이 차이가 있을 것으로 판단된다. 또한 NPFFR2 수용체를 활성화시키는 NPFF 신경펩티드의 처리하고, 그 수용체 를 siRNA를 이용하여 저해시켰을 때 간암 세포주의 침윤과 이동에 미치는 영향 및 이러한 영향이 세포의 어떠한 신호 전달 기작을 통하여 이루어지는지를 밝힌 다.
Ⅱ. 재료 및 방법
A. 간암 세포주 및 세포배양사람 간암 세포주 SNU475, SNU739, SNU709, SNU449, Hep3B 세포를 5% 이 산화탄소와 37℃의 조건의 세포 배양기에서 10 % FBS (JRS, CA) 와 1% (w/v) penicillin/streptomycin (Gibco, CA)이 첨가된 RPMI (Welgene, Korea)와 MEM (Welgene, Korea) 배지에서 배양하였다.
B. RNA 분리 및 RT-PCR
Ribospin columns (GeneAll, Korea)을 이용하여 RNA를 추출하였고, RNA 농 도는 ND-1000 spectrophotometer (NanoDrop Technologies, Inc., Wilmington, DE, USA)을 이용하여 측정하였다. 그리고 Maxime RT PreMix kit (Intron Biotechnology, Korea)를 이용하여 Complementary DNA (cDNA)를 합성하였고,
Maxime PCR PreMix kit (i-StarTaq; Intron Biotechnology)를 이용하여 Rever
se transcriptase-polymerase chain reaction (RT-PCR)을 수행하였다.
NPFFR2 RT-PCR primer forward5′-TTTTTGTGCATGATGGGAAA-3′ reverse 5′-TATTCCCTGGACCAATCCAC –3′;Real time PCR primer, forward 5′-ACTGCGA AAAGTAGCTGGAG –3’ reverse 5’-CTGAAGAGT TTG TGTCCCATTTC –3’ ;B2M primer, forward 5’-CCTGAATTGCTATGT GTCTGGG-3’ reverse 5’-TGATGCTGCTTACATGTCTCGA-3’ ; β-actin, forward 5′-AGCGAGCATCCCCCAAAGTT-3′and reverse 5′-GGGCACGA AGGCTCATCATT-3′
C. 발현 조절 및 펩티드를 이용한 수용체 활성화
NPFFR2의 발현을 억제하기 위하여 NPFFR2-siRNA#1 (GGAAUAUCUGUCG CAGCUU), NPFFR2-siRNA#2 (GGAAUUAGUGAUGGAAGAA)를 주문제작하 였고 control siRNA를 구입하였다 (Mbiotech, Seoul ,Korea). Lipofectamine RNAi MAX reagent (Invitrogen, CA)와 Opti MEM (Invitrogen, CA)을 이용하 여 transfection을 수행하였다.
NPFFR2을 과발현 시키기 위해 Flag이 tagging 되어 있는 pcDNA3.1-NPFFR2 를 기증받아 사용하였다 (Frédéric Simonin, Institut de Génétique et de Biologie Moléculaire et Cellulaire, France). 2μg의 plasmid DNA를 SNU475, Huh7 간암 세포주에 Turbofect transfection reagent (Invitrogen, CA)를 이용하 여 transfection을 수행하였다.
NPFF는 수용체를 활성화시키기 위해 사용하였으며, 펩티드 서열은 다음과 같 다. Ser-Gln-Ala-Phe-Leu-Phe-Gln-Pro-Gln-Phe-NH2. 펩티드를 주문 제작하여 (Peptron,Korea), 2mM의 농도로 DMSO에 녹여 deep freezer에 보관하였다. D. Western blot
세포를 TNN buffer [120 mM NaCl, 40 mM Tris–HCl, pH 8.0, 0.5% (w/v) NP-40, 1 mM PMSF, phosphatase inhibitor cocktail, 5 mM EDTA, 50 mM NaF, 1 mM DTT]로 세포를 lysis 시켜 원심분리하고 정량하여, 동량의 단백질 을 10% (w/v) SDS–PAGE gel에서 전기영동하고, Nitrocellulose membrane (Whatman, Maidstone, UK)에 80V로 2시간 transfer 한 후, membrane은 TBST 에 5% (w/v) non-fat dry milk에 넣어 실온에서 1시간동안 shaking 하였다. 항 체는 NPFFR2(P-16) (Santacruze, Califonia, USA), pERK (cell signaling,
Beverly, MA, USA), pAKT (cell signaling, Beverly, MA, USA), β-actin (Santacruze, Califonia, USA), MMP9(2C-3) (Santacruze, Califonia, USA), MMP2 (H-76) (Santacruze, Califonia, USA), pP38/MAPK (cell signaling, Beverly, MA, USA), pPKAα/βII (cell signaling, Beverly, MA, USA)를 사용하 였고, chemiluminescence kit (Santa Cruz Biotechnology, Califonia, USA)를 이 용하여 현상하였다.
E. Invasion assay
Matrigel invasion assay는 polycarbonate Nucleopore membrane (Corning, Corning, NY)을 이용하여, Precoated filter (6.5 mm in diameter, 8μm pore size) 에 0.85μg/μl Matrigel을 20μl씩 코팅하였다. 120 μL serum-free RPMI로 세포를 suspension 하여 챔버 내부에 배양하고, 챔버 밖은 2% FBS를 포함한 배지에 NPFF 펩티드나 DMSO를 첨가하여 750μl씩 넣었다. 38시간이 지난 후, Hemacolor® for microscopy Staining set for hematological and clinical specimens (Merck, Germany)로 고정 및 염색을 하였고, 침윤되지 않은 세포는 면봉으로 닦아 제거하고, 염색된 침윤된 세포는 현미경으로 구역을 나누어 갯수 를 세었다.
F Wound healing assay, migration assay
세포의 이동성은 배양접시를 이용하는 wound healing assay와 invasion assay 에 사용된 transwell을 이용하는 migration assay로 확인하였다. Wound healing
assay를 하기 위하여 1x105/well의 세포를 6well plate에 배양한 후, 세포가
또는 2%의 FBS가 포함된 성장배지에 3uM의 NPFF 펩티드를 처리하였다. 긁은
부분을 0, 12, 20, 36 시간 동안 현미경으로 관찰하며 사진을 찍었다. migration
assay는 polycarbonate Nucleopore membrane (Corning, Corning, NY)을 이용하 여, Precoated filters (6.5 mm in diameter, 8μm pore size)를 24well plate에 넣
고, 120 μL serum-free RPMI로 SNU475를 suspension 하여 챔버 내부에 배양하
고, 챔버 밖은 2% FBS를 포함한 배지에 NPFF 펩티드나 DMSO를 넣어 750μl씩 넣었다. 38시간 후 Hemacolor® for microscopy Staining set for hematological and clinical specimens(Merck, Germany)로 고정 및 염색을 하여, 이동하지 않은 세 포는 면봉으로 닦아 제거하고, pore를 뚫고 이동한 세포는 현미경으로 이동한 세 포를 구역을 나누어 측정하였다.
G. Colony formation assay
간암 세포주 (SNU739, SNU475, Hep3B, Huh7)를 1.5 × 105으로 60mm배양
접시에 배양한 후 siRNA를 이용하여 유전자를 24시간 동안 발현 억제시킨 후에, trypsin으로 세포를 떼어 60mm 배양 접시에 2 × 103로 배양하였다. 1주일정도
지나 colony가 형성이 되면 이를 10% formaldehyde로 1시간동안 고정시킨 다음, 메탄올에 녹인 0.5% crystal violet으로 염색하였다.
Ⅲ.결과
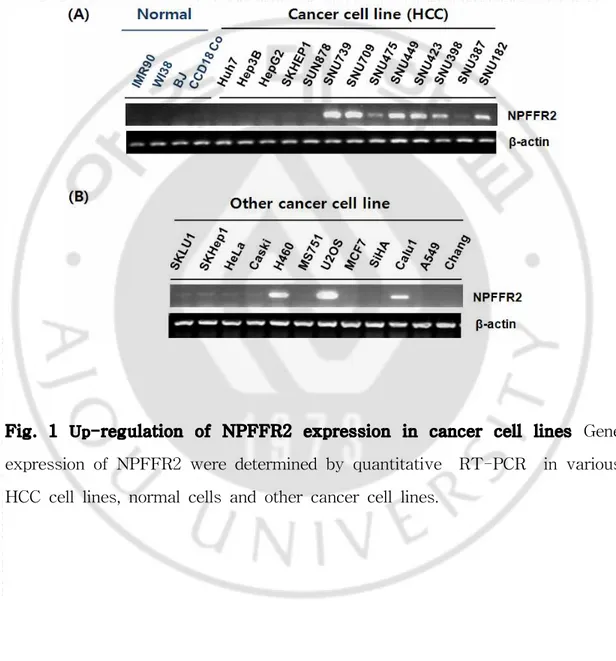
Fig. 1 Up-regulation of NPFFR2 expression in cancer cell lines Gene expression of NPFFR2 were determined by quantitative RT-PCR in various HCC cell lines, normal cells and other cancer cell lines.
A. 여러 가지 암 세포주에서 높은 발현을 보이는 NPFFR2
quantitative RT-PCR 분석을 통하여 mRNA 수준에서의 정상 세포와 간암 세 포주 간의 NPFFR2의 발현 패턴을 비교하였다(Fig. 1 A). 정상 폐세포인 IMR90, WI38, 정상 표피 세포인 BJ, 정상 장 세포인 CCD18co와 같은 정상 세포보다는 Hep3B, SNU739, SNU709와 같은 간암 세포주에서의 발현이 높게 나타났다. 특 히, Hep3B와 SNU739, SNU709에서 NPFFR2의 발현이 모두 정상 세포주보다 높 은 것을 확인하였다. NPFF의 또다른 수용체인 NPFFR1의 mRNA 수준에서의 발현확인을 시도하였으나 PCR이 확인되지 않아 암세포주에서는 발현이 되지 않
는 것으로 판단하였다. 또한 페암 세포인 H460, 골육종세포 U2OS, 폐암세포
Fig. 2. Activation of ERK signaling by NPFF SNU739 and SNU475 cells were pre-incubated at low serum condition for 4hours, then NPFF peptide was treated with indicated concentration and the cells were harvested after 30min and 1hr. Immunoblotting were performed using the cell lysate with antibodies detecting p-ERK, p-AKT and β-actin.
B. 간암 세포에서 NPFF 처리에 의한 ERK의 활성 증가
여러 가지 간암 세포주에서 NPFFR2의 발현이 증가되어 있기 때문에 이 GPCR에 간암 세포주의 생존이나 암화기전에 역할이 있을 것으로 판단하였다. 해당 GPCR이 기존의 신경세포에서 ERK 신호전달을 촉진하는 것이 보고된 바 있고(Ankö와 Panula, 2006), 암세포에서 ERK는 중요한 신호전달 기전이기 때문 에 NPFFR2의 리간드인 RFamide 펩티드를 제작하였고, 간암 세포주 SNU739와 NPFF를 0.1uM, 0.3uM, 1uM, 3uM의 5가지 농도를 30분과 1시간을 처리하였다. 또한 SNU475 에는 1uM, 3uM ,10uM로 30분과 처리하였다. 암세포 주요 생존 기전인 ERK 및 AKT 활성도를 western blotting 을 통해 확인하였다. 그 결과 두 가지 세포주에서 펩티드 처리에 의한 ERK의 인산화가 증가하였다.
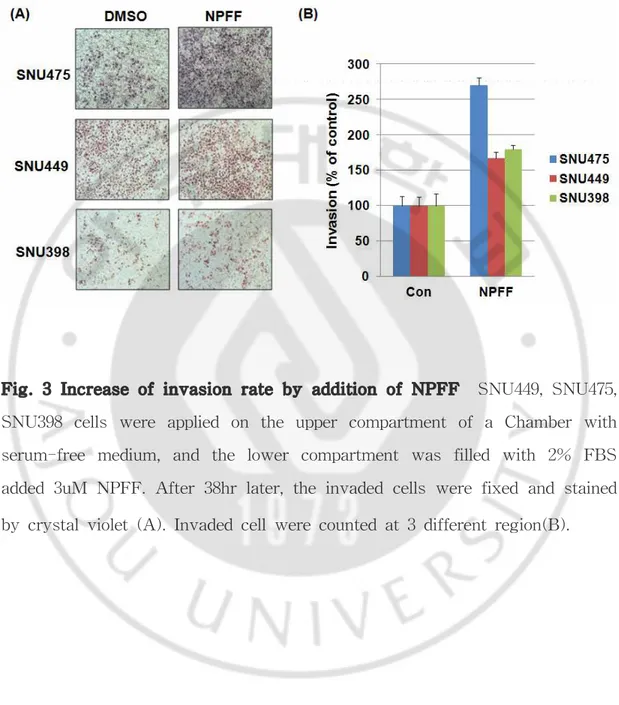
Fig. 3 Increase of invasion rate by addition of NPFF SNU449, SNU475, SNU398 cells were applied on the upper compartment of a Chamber with serum-free medium, and the lower compartment was filled with 2% FBS added 3uM NPFF. After 38hr later, the invaded cells were fixed and stained by crystal violet (A). Invaded cell were counted at 3 different region(B).
C. NPFF 처리에 의한 간암 세포주의 세포 침윤도 증가
ERK 및 AKT는 암세포의 침윤 및 생존 등에 중요한 신호전달 기전으로 알려 져 있다. 따라서 NPFF에 의해 증가한 ERK 신호전달이 간암 세포주에 어떠한 영향을 미치는지 확인하였다. 먼저 NPFF에 의한 간암 세포주 침윤도를 조사하 였다. NPFFR2의 발현이 낮은 세 가지 간암 세포주 SNU475, SNU449, SNU398
을 transwell에 배양하고 well 밖의 배지에는 2% FBS가 포함되어 있는 RPMI에
3uM의 NPFF를 처리 한 후, 38hr 후 침윤된 세포를 염색하여 현미경으로 관찰
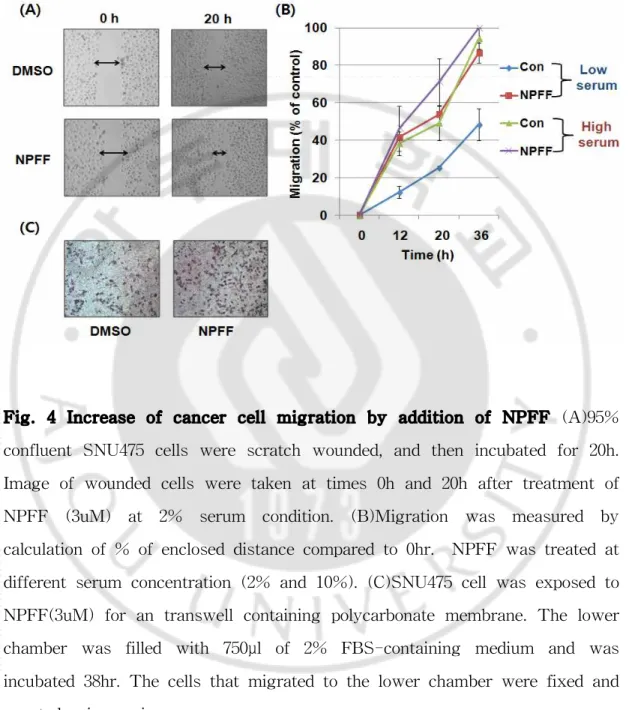
Fig. 4 Increase of cancer cell migration by addition of NPFF (A)95% confluent SNU475 cells were scratch wounded, and then incubated for 20h. Image of wounded cells were taken at times 0h and 20h after treatment of NPFF (3uM) at 2% serum condition. (B)Migration was measured by calculation of % of enclosed distance compared to 0hr. NPFF was treated at different serum concentration (2% and 10%). (C)SNU475 cell was exposed to NPFF(3uM) for an transwell containing polycarbonate membrane. The lower chamber was filled with 750μl of 2% FBS-containing medium and was incubated 38hr. The cells that migrated to the lower chamber were fixed and counted using microscope.
D. NPFF 처리에 의한 간암 세포주의 세포 이동 증가
Wound healing assay을 수행하여 NPFF에 의한 세포의 전이성을 확인하였다. 6well에 SNU475 간암 세포주를 6 × 105/well씩 배양한 후, 세포가 100% 자라면,
성장 배지를 제거하고, 200ul 팁으로 일정한 굵기가 되도록 긁어주었다. 그 후 PBS로 두 세 번 닦아준 후 2% FBS가 포함되어 있는 배지로 갈아주고, 3uM의 펩티드를 처리하여 0시간과 20시간에 현미경으로 세포의 이동을 관찰하였다. 펩 티드를 처리한 실험군의 세포 이동이 더 크며 (Fig4. A), 특히, 혈청의 농도가 높 을 때보다 낮은 농도일 때 NPFF에 처리에 의한 세포의 이동의 차이가 상대적으 로 더 커지는 것으로 나타났다 (Fig4. B). 또한 transwell을 이용한 SNU475의 세 포 이동 역시 NPFF 펩티드를 처리한 실험군이 더 증가하였다 (Fig4. C).
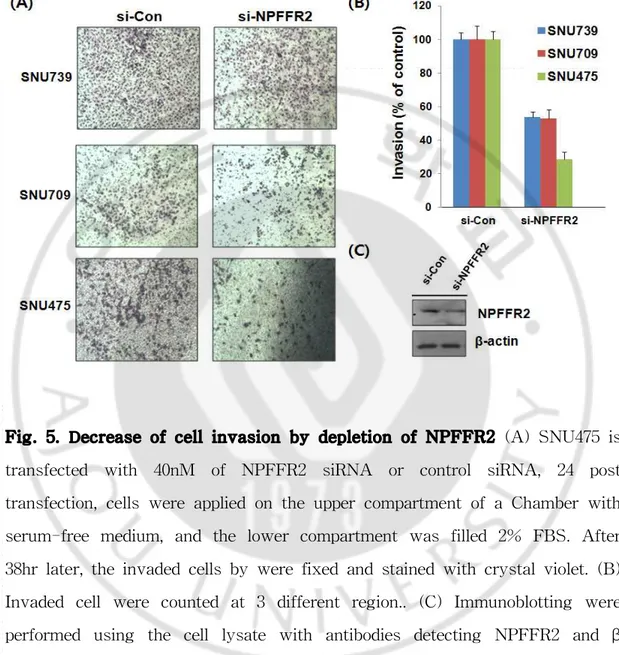
Fig. 5. Decrease of cell invasion by depletion of NPFFR2 (A) SNU475 is transfected with 40nM of NPFFR2 siRNA or control siRNA, 24 post transfection, cells were applied on the upper compartment of a Chamber with serum-free medium, and the lower compartment was filled 2% FBS. After 38hr later, the invaded cells by were fixed and stained with crystal violet. (B) Invaded cell were counted at 3 different region.. (C) Immunoblotting were performed using the cell lysate with antibodies detecting NPFFR2 and β -actin.
E. NPFFR2의 발현 저해에 의한 세포 침윤도 감소
NPFFR2 발현 억제에 의한 간암세포주의 침윤도 변화를 확인하였다. SNU739, SNU709, SNU475 세 가지 간암 세포주에 NPFFR2를 siRNA를 이용하여 knockdown 시키고, transwell 밖은 2% FBS가 포함되어 있는 배지에 3uM에 NPFF를 처리한 결과 실험군의 침윤도가 대조군보다 감소하였다. 이것은 수용체 의 발현 억제로 인하여 펩티드에 의한 수용체의 민감도가 감소하여 침윤도가 감 소한 것으로 판단된다. 또한 SNU475 세포주에서 siRNA를 이용하여 NPFFR2의 단백질 수준에서의 발현이 저해된 것을 western blot을 이용하여 확인하였다.
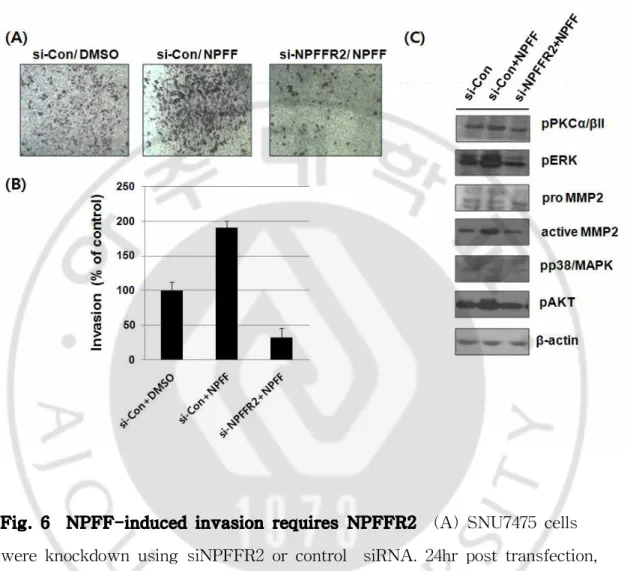
Fig. 6 NPFF-induced invasion requires NPFFR2 (A) SNU7475 cells were knockdown using siNPFFR2 or control siRNA. 24hr post transfection, cell were applied on the upper compartment of a Chamber with serum-free medium, and the lower compartment was filled 2% FBS with NPFF. After 38hr later, the invaded cells were fixed and stained with crystal violet (B) Invaded cell were counted at 3 different region. (C) Immunoblotting were performed using the cell lysate with antibodies detecting p-PKCα/β II, phospho-p38/MAPK, MMP9, MMP2, p-ERK, p-AKT and β-actin.
F. siNPFFR2에 의한 NPFF 민감도 감소에 따른 간암 세포 침윤도 감소 NPFF에 의한 간암 세포주의 침윤도가 NPFFR2 수용체의 활성화와 연관되어 있을 것으로 예상된다. 이를 검증하기 위하여 NPFF에 의한 침윤도가 NPFFR2의 발현억제에 의해 영향을 받는지를 확인하였다. SNU475에 NPFFR2 siRNA를 이 용하여 발현을 억제시킨 후, NPFF 펩티드를 처리한 결과 SNU475의 침윤도가 대조군에 비하여 증가하였고, NPFFR2의 발현억제에 의하여 NPFF에 의한 SNU475의 침윤도가 영향을 받아 감소하는 것을 확인하였다. 또한 관련 신호 전 달인자인 p-PKCα/β II와 ERK 및 MMP2 활성이 감소하였으며, MMP9과 phospho-p38/MAPK에는 변화가 없었다.
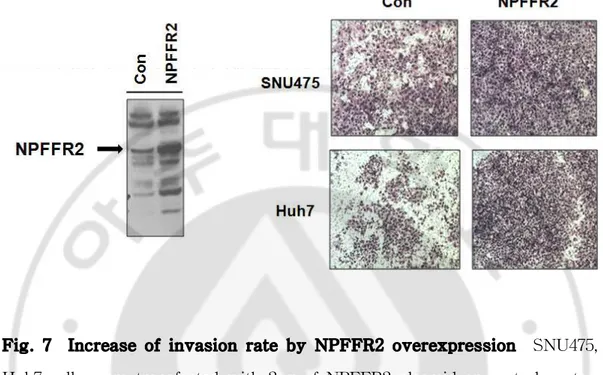
Fig. 7 Increase of invasion rate by NPFFR2 overexpression SNU475, Huh7 cells were transfected with 2μg of NPFFR2 plasmid or control vector After 24hr later, cells were trypsinized and applied on the upper compartment of a Chamber with serum-free medium, and the lower compartment was filled with cultured media. After 38hr later, the invaded cells by were fixed and stained with crystal violet.
G. NPFFR2의 과발현에 의한 암세포 침윤 증가
NPFF에 의해 활성화된 수용체에 의해 암세포의 침윤이 증가했으므로 NPFFR2 과발현 또한 증가할 것으로 생각하였다. 먼저, NPFFR2의 발현이 낮은 세포주인 SNU475와 Huh7에 NPFFR2 plasmid를 각각 2μg씩 transfection 하고 48시간 후에 harvest하여, 수용체의 과발현 또한 암세포의 침윤 능력을 증가시킨 것을 확인하였다.
Fig. 8 Inhibition of clonal survival by NPFFR2 depletion SNU739, Hep3B, SNU7475, Huh7 cells were transfected with 40nM of NPFFR2 siRNA or control siRNA. After 24hr later, cells were trypsinized and plated 2000 cell/dish and the plates were incubated at 37℃. Seven to eleven days later, the cells were fixed and stained with cystal violet in methanol.
H. siNPFFR2에 의한 세포 생존 억제
간암 세포주에서 NPFFR2가 증가하였고 과발현 및 발현억제에 의해 세포의 침윤성에 영향을 주었기 때문에, NPFFR2 발현억제가 간암세포의 생존에 영향을 줄 가능성을 확인하였다. 먼저, NPFFR2의 발현이 낮은 세포주인 SNU475와 Huh7 그리고 발현이 높은 세포주인 SNU739, Hep3B 총 네 가지 세포주에 siRNA를 transfection 하고 NPFFR2의 발현을 Real time PCR을 통해 확인한 결 과 siRNA에 의해 NPFFR2의 발현이 효율적으로 억제되는 것을 알 수 있었다 (Fig.8 A). 해당 간암 세포주에서 NPFFR2의 발현을 억제시킨 후, 세포 생존에 미치는 영향을 clonogenic assay를 통해 확인하였다. 그 결과 NPFFR2 발현 억 제에 의해 세포의 생존이 감소하는 것을 확인할 수 있었다 (Fig.8 B).
Ⅳ. 고찰
본 연구 결과는 간암세포의 생존 및 침윤에 NPFFR2가 중요한 기능을 하고 있다는 것을 처음으로 밝히는 내용이다. NPFFR2는 GPCR중 하나로 이의 비정 상적 발현은 여러 가지 질병과 관련이 있으며, 여러 다양한 암종에서의 비정상적 으로 높은 발현을 나타낸다. 그리고 이 GPCR과 결합하는 G protein은 G alpha subunit q/11 로 보고된 바 있으며 이러한 subunit의 돌연변이가 발생하여 종양 형성에 영향을 준다는 보고가 있다. 따라서 NPFFR2가 이러한 G protein과 결합 하여 세포내 신호 전달자로써 중요한 역할을 할 것으로 예상할 수 있다. (Morgan 등, 2013; M Dono 등, 2014). 또한 GPCR은 약물 타겟 개발이 용이하 기 때문에 암특이적인 발현과 암세포생존에 영향을 주는 GPCR인자의 발굴은 특 히 의미가 있을 것이다. 인체 간암조직의 RNA 발현 패턴 분석결과 NPFFR2가 간암에서 발현이 증가 해 있는 후보인자로 스크리닝한 바 있으며 이를 검증하기 위하여 다양한 실험을 수행 하였다. 정상 세포주와 간암 세포주에서의 NPFFR2의 발현의 차이가 있을 것으로 생각하여 정상 세포주와 간암 세포주 그리고 여러 가지 암세포주를에서 의 NPFFR2의 발현을 RT-PCR 을 통하여 확인하였고, 그 결과 정상 세포주에서 의 발현에 비하여 간암 세포주 및 암세포주에서 더 높은 발현을 나타내었으며 (Fig.1), 또한 발현 억제시 간암 세포의 생존에도 영향을 주었다 (Fig 8). NPFFR2의 발현은 간암 세포주에서 높았지만, NPFF의 발현을 간암 세포주에 서 발현을 확인할 수 없었고, 클로닝도 불가능하였다. 그 원인은 intron이 포함되 는 cDNA산물 (intron retained NPFF, GI : 219878493)이 클로닝 및 RT-PCR 과 정 중에 합성되었기 때문으로 이 산물은 펩티드를 합성할 수 없는 기능이 결여된 cDNA임을 밝혔다. 이 산물이 증폭되는 조건에서도 실제 NPFF는 증폭이 불 가능하였기 때문에 NPFF가 간암 세포주에서 발현되지 않는 것으로 판단하였다. 하지만, 세포내 NPFFR2의 발현을 억제시키면 세포생존에 영향을 주기 때문에, NPFFR2가 세포배양조건에서 중요한 역할을 하므로, 세포내부에 NPFFR2 를 자 극하는 다른 리간드가 존재할 것으로 판단된다. 신경펩티드인 NPFF에 의해 활성이 되는 NPFFR2는 (Liu 등, 2001), 여러 가지 세포 및 신경 세포에서 성장 인자로써의 가능성이 여러 실험을 통해 증명된 바 있다 (Hansel 등, 2001). 또한 많은 신경 펩티드가 autocrine/paracrine 성장 인자 로써 인간의 암에서 발견되고 있으며(Rozengurt 등, 2001) 대표적으로 SLCL가 있다 (Beekman 등, 1998). 하지만, NPFF가 간암 세포주에서 발현되지 않는 것으 로 판단하였기 때문에 본 연구에서는 NPFF를 수용체인 NPFFR2를 활성화 시키 는 activator로써 사용하였다. 암세포는 초기 국부적인 침윤을 통하여 세포 골격이나 세포 기질 그리고 세포 사이의 연접을 활성화 시키는 신호를 활성화 시키게 되는데 (Sahai , 2007), 이러 한 암세포의 침윤도와 관련한 기능을 확인하기 위하여 간암 세포주별 NPFFR2 의 발현을 확인하였다. 수용체의 발현을 저해 시켜 암세포의 침윤의 감소를 효과 적으로 보기 위한 실험에는 SNU739와 SNU709과 같은 수용체의 발현이 높은 간암 세포주를 사용하였고, NPFF 펩티드 처리에 의한 수용체의 활성을 통한 세 포의 침윤의 증가를 보기 위해서는 SNU475, SNU398, SNU449, Huh7과 같은 NPFFR2의 발현이 낮은 세포주를 사용하였다. 수용체의 활성화에 따른 세포 침 윤도 증가와 수용체의 억제에 의한 침윤도의 감소 두 현상을 보기에 가장 적합 한 간암 세포주는 SNU475라 판단된다. NPFF에 의해 간암 세포주의 침윤도가 증가하였을 뿐 아니라 세포의 이동이 증가하였다 (Fig. 2, 3, 4). 특히, serum이
낮은 상태였을 때 펩티드 처리에 의한 세포의 이동이 더 큰 차이를 보이는 것으 로 보아 serum내에 존재하는 여러 가지 성장인자에 의해 방해를 받았기 때문이 라고 생각된다. NPFFR2의 발현을 억제하면, 침윤도가 감소하였다 (Fig. 5). 특 히, NPFF에 의한 침윤성은 NPFFR2의 발현 억제에 의해 효과적으로 저해되었 다. 침윤성과 관련한 세포내 신호전달을 확인하는 과정에서 ERK, 칼슘신호 (PKCα/βll)가 활성화된 것을 발견하였고, MMP2과 관련되어있음을 확인하였다 (Fig. 6). 이러한 신호전달 기전 역시 NPFF에 의해 증가하고 NPFFR2 발현억제 에 의해 감소하였다. SNU475에서의 NPFFR2 수용체의 발현은 western blot을 통해 확인이 되었기 때문에 수용체의 발현이 높지 않음에도 세포 내에서 그 기 능을 하고 있다고 판단된다. 또한 다른 세포주에 비해 펩티드에 대한 반응성이 좋은 것은 암세포는 암세포주마다 침윤능력이 다르며, 각기 다른 이종의 돌연변 이가 존재하기 때문인 것으로 판단된다. 칼슘 신호는 G alpha q의 가장 중요한 신호전달기전으로 NPFFR2의 암세포내 기능이 G alpha q에 의해 전달되는 것을 의미한다. Gq는 PLCβ의 활성에 의해 세포에 특이적인 반응을 인식하는 수용체 로써 (Johnson 와 Dhanasekaran, 1989; Simon 등1991), 활성화된 PLC는 inositol triphosphate (IP3) 와 diacylglycerol (DAG)를 생성하기 위하여 phosphatidylinositol 4,5-bisphosphate (PIP2)를 hydrolyses 한다. IP3와 DAG는 세포 내부 칼슘의 저장과 방출을 통하여 직간접적인 경로를 통해 Protein kinase C (PKC)를 조절하고, PKC에 의하여 ERK의 활성이 일어나는데 PKC가 암의 진 행에 높은 연관성이 있고 (Jussi 등 2006), PKCα의 발현이 암세포에서 matrix metalloproteinase-2 (MMP-2)와 matrix metalloproteinase -9 (MMP-9) 등 MMP의 발현을 조절하는데 중요한 역할을 한다는 보고가 있는 것으로 보아 (Wu 등, 2008) NPFF 펩티드를 처리하였을 때, PKCα/βll의 인산화, MMP2의 증
가가 암세포의 침윤을 증가시켰을 것으로 판단 된다 (Fig.6). 이러한 일련의 실험 결과를 종합해 보면 간암 세포에서 수용체의 발현이 정상 세포에 비해 높아져 이것이 PKC를 활성화시켜 ERK 신호를 통해 간암 세포 의 침윤, 생존과 전이를 촉진할 가능성이 있는 것으로 판단된다. 향후 G protein 관련 돌연변이 벡터, 칼슘 및 ERK 관련 저해제를 이용하여 실 제 해당 신호전달기전이 세포의 침윤성과 관련성이 있는지를 추가적으로 연구할 필요가 있다. 또한 NPFFR2의 발현억제는 암세포 생존과 전이능을 모두 감소시 켰으나 전이능을 확인하는 단계는 생존에 영향을 주지 않는 초기단계에서 실험 을 진행하였고, 암세포 생존실험은 low density colony formation assay를 통해 서 진행하여 10일 정도 세포생존을 확인하였기 때문에 NPFFR2 발현억제에 의 한 전이 능력 억제가 암세포 생존에 영향을 받은 결과가 아닌 것으로 판단하였 다. 따라서 암세포의 생존에 관련한 NPFFR2의 기능을 추가적으로 연구할 필요 가 있다.
Ⅴ. 결론
간암 세포주에서 NPFF 펩티드에 의한 NPFFR2 활성화 및 siRNA를 이용한 NPFF 신호전달 기전 억제에 의해 ERK 및 MMP2 , PKCα/βⅡ의 활성이 영향 을 받는 것을 발견하였고, 이러한 세포 신호 전달의 변화가 암 세포주의 세포 이 동 및 침윤 능력에도 영향을 미치는 것을 발견하였다. 뿐만 아니라 수용체 단독 과발현만으로도 암세포의 침윤 능력이 증가하는 것을 발견하였다. 그리고 수용체 의 발현을 억제하였을 때, 세포의 생존이 감소하는 것은 세포 생존 및 생장 등 전반에 있어 관여하는 핵심적인 신호 전달 기작 중 하나인 ERK의 신호 전달과 도 관계가 있다고 판단된다. 향후 NPFFR2가 구체적으로 어떠한 상 ·하위 신호 전달을 거쳐 간암 세포의 침윤과 이동을 조절하는지에 대한 전반적인 기작을 규 명하게 되면 간암 치료의 실질적인 치료적 타겟이 될 것이라고 판단된다.참고문헌
1. Ali Raza, Gagan K sood, Hepatocellular carcinoma review : Current treatment, and evidence-based medicine, World J Gastroenterol 21; 20(15) : 4115-4127, 2014
2. Ankö & Panula, Regulation of endogenous human NPFF2 receptor by neuropeptide FF in SK-N-MC neuroblastoma cell line, Journal of Neurochemistry 96, 2, 573–584, 2006
3. A. V. Smrcka. G protein βγ subunits: Central mediators of G protein-coupled receptor signaling. Cell Mol Life Sci. 65(14): 2191–2214, 2008 4. Beekman,A.et al.Expression of catalytically inactive phospholipase Cb disrupts phospholipase Cb and mitogen-activated protein kinase signaling and inhibit small cell lung cancer growth.. Cancer Res 58,910-913,1998
5. Bonini, J. A., Jones, K. A., Adham, N., Forray, C., Artymyshyn, R., Durkin, M. M., Smith, K. E., Tamm, J. A., Boteju, L. W., Lakhlani, P. P., et al. Identification and characterization of two G protein-coupled receptors for neuropeptide FF. J. Biol. Chem 275, 39324–39331,2000
6. Clapham DE and Neer EJ: G protein beta gamma subunits. Annu Rev Pharmacol Toxicol 37:167-203,1997
7. C.R. McCudden, M.D. Hains, R.J. Kimple, D.P. Siderovski, F.S. Willard G-protein signaling: back to the future, Cell. Mol. Life Sci. 62 (5) 551-577 ,2005
8. Dorsam RT, Gutkind JS .G-protein-coupled receptors and cancer. Nat Rev Cancer 7(2):79–94,2007
9. Elshourbagy NA, Ames RS, Fitzgerald LR, Foley JJ, Chambers JK, Szekeres PG et al. Receptor for the pain modulatory neuropeptides FF and AF is an orphan G protein-coupled receptor. J Biol Chem 275: 25965– 25971,2000
10. El-Serag, H. B. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology 142, 1264–1273,2012.
11. Enrique Rozengurt, Neuropeptides as growth factors for normal and cancerous cells; TRENDS in Endocrinology & Metabolism 13, 128–134, 2002 12. Forner, A., Llovet, J. M. & Bruix, J. Hepatocellular carcinoma. Lancet 379, 1245–1255,2012.
13. Gan-Lu Deng, Shan Zeng and Hong Shen. Chemotherapy and target therapy for hepatocellular carcinoma: New advances and challenges. World Journal of Hepatology; 18; 7(5): 787-798,2015
14. Hansel,D.E. et al. Neuropeptide Y functions as a neuroproliferative factor.
Nature 410, 940-944, 2001
15. Hanshen B. El-serang , Hepatocellular carcinoma. N EnglJ Med.
365:1118-27,2011
16. Hinuma S, Shintani Y, Fukusumi S, Iijima N, Matsumoto Y,Hosoya M et al. New neuropeptides containing carboxy-terminal RFamide and their receptor
in mammals. Nat Cell Biol; 2: 703–708,2000 system in nociception and opiate analgesia, Neuropeptides 24, 1-18,2008
17. Hsiu-Ying T. Yang, Tao Tao, Michael J, Iadarola, Modulatory role of neuropeptide FF, Neuropeptides. ;42(1):1-18, 2008
18. Jack H. Jhamandas and David Mactavish, Central administration of neuropeptide FF (NPFF) causes increased neuronal activation and up-regulation of NPFF gene expression in the rat brainstem, Journal of Comparative Neurology ; 447, 300-307,2002
19. Jakub Fichna, Anna Janecka, Opioid peptides in cancer, Cancer and Metastasis Reviews; 23,351-366,2004
20. Johnson GL, Dhanasekaran N. The G-protein family and their interaction with receptors. Endocr Rev 10: 317–331, 1989
21. Jussi Koivunena, Vesa Aaltonena,Juha Peltonena, Protein kinase C (PKC) family in cancer progression, Cancer Letters;235,1,1-10, 2006
22. Katz A, Wu D and Simon MI: Subunits beta gamma of heterotrimeric G protein activate beta 2 isoform of phospholipase C. Nature 360:686-689, 1992 23. Katarzyna Gach ,Anna Wyrębska, Jakub Fichna, and Anna Janecka. The role of morphine in regulation of cancer cell growth, Naunyn Schmiedebergs
Arch Pharmacol; 384,2011
24 Kuraishi Y1. Effects of morphine on cancer pain and tumor growth and metastasis. Nihon Rinsho 59(9):1669-74,2001
25. Lappano R1, Maggiolini M. G protein-coupled receptors: novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10(1):47-60, 2011
26. Le Page SL, Bi Y and Williams JA: CCK-A receptor activates RhoA through G alpha 12/13 in NIH3T3 cells. Am J Physiol Cell Physiol 285:C1197-1206,2003
27. Liu, Q., Guan, X. M., Martin, W. J., McDonald, T. P., Clements, M. K., Jiang, Q., Zeng, Z., Jacobson, M., Williams, D. L., Jr., Yu, H., et al. Identification and characterization of novel mammalian neuropeptide FF-like
peptides that attenuate morphine-induced antinociception, J. Biol. Chem. 276,
36961–36969,2001
28. Lin X, Voyno-Yasenetskaya TA, Hooley R, Lin CY,Orlowski J and Barber DL: Galpha12 differentially regulates Na+-H+ exchanger isoforms. J Biol Chem 271:22604-22610,1996
29. Lynn E Heasley, Autocrine and paracrine signaling through neuropeptide receptors in human cancer, Oncogene; 20, 1563 ± 1569,2001
30. Marinissen, M. J. & Gutkind, J. S. G-protein-coupled receptors and signaling networks: emerging paradigms. Trends Pharmacol. Sci. 22, 368– 376,2001
31. Murthy KS, Coy DH and Makhlouf GM: Somatostatin receptor-mediated signaling in smooth muscle. Activation of phospholipase C-beta3 by Gbetagamma and inhibition of adenylyl cyclase by Gαi1 and Gαo. J Biol Chem 271:23458-23463,1996
32. M Dono, G Angelini, M Cecconi, A Amaro, A I Esposito, V Mirisola, I Maric, F Lanza, F Nasciuti, S Viaggi, M Gualco, R Bandelloni, M Truini, D A Coviello, S Zupo, C Mosci and U Pfeffer. Mutation frequencies of GNAQ, GNA11, BAP1, SF3B1, EIF1AX and TERT in uveal melanoma: detection of an activating mutation in the TERT gene promoter in a single case of uveal melanoma. British Journal of Cancer 110, 1058–1065, 2014
33. Morgan O'Hayre, José Vázquez-Prado, Irina Kufareva, Eric W. Stawiski, Tracy M. Handel, Somasekar Seshagiri & J. Silvio Gutkind,. The emerging mutational landscape of G proteins and G-protein-coupled receptors in cancer.
Nature Reviews Cancer 13, 412-424, 2013
34. Neves, SR., Ram, P.T.& lyengar, R. G, Protein pathways. Science 296, 1636-1639,2002.
35. Panula, P., Kalso, E., Nieminen, M., Kontinen, V. K., Brandt, A. &
Pertovaara, A. Neuropeptide FF and modulation of pain. Brain Res. 848, 191– 196,1999
36.. Parker RM, Copeland NG, Eyre HJ, Liu M, Gilbert DJ, Crawford Jet al. Molecular cloning and characterisation of GPR74 a novel G-protein coupled receptor closest related to the Y-receptor family. Brain Res Mol Brain Res ; 77: 199–208,2000
37. Pierce, K.L., Premont, R.T & Lefkowitz, R.J. seven-transmembrane receptors. Nature Rev. Mol. Cell Biol.3,,639-650,2002
activities of a human neuropeptide FF-related peptide. Eur. J. Pharmacol. 345, 1–11,1998
39. Rozengurt, E. and Walsh, J.H. Gastrin, CCK, signaling and cancer.
Annu.Rev. Physiol. 63, 49-76, 2001
40. Sahai, E. IIuminating the metastatic process. Nat.Rev.Cancer 7,737-749, 2007
41. Siegel R, Naishadham D, Jemal A. Cancer statistics, CA Cancer J Clin
63: 11–30,2013
42. Simon MI, Strathmann MP, Gautam N. (1991). Diversity of G proteins in signal transduction. Science 252: 802–808
43. Werry TD1, Wilkinson GF, Willars GB. Mechanisms of cross-talk between G-protein-coupled receptors resulting in enhanced release of intracellular Ca2+. ,Biochem J. 374(Pt 2):281-96,2003
44. Wess J: Molecular basis of receptor/G protein-coupling selectivity.
Pharmacol Ther 80:231-264,1998
45. Wu TT, Hsieh YH, Hsieh YS, Liu JY: Reduction of PKC alpha decreases cell proliferation, migration, and invasion of human malignant hepatocellular carcinoma. J Cell Biochem, 103:9-20,2008
46. Xu HE, Xiao RP, A new era for GPCR research: structures, biology and drug discovery. Acta Pharmacologica Sinica 33, 289-90,2012
47. Yu, J., Shen, J., Sun, T. T., Zhang, X. & Wong, N. Obesity, insulin resistance, NASH and hepatocellular carcinoma. Semin. Cancer Biol. 23, 483– 491 ,2013.
48. Zajac, J. M. Neuropeptide FF: new molecular insights .Trends Pharmacol. Sci. 22, 2001
ABSTRACT
-Identification of Neuropeptide FF receptor 2 (NPFFR2)
and its ligand NPFF as a factor to affect cancer
progression
Won Hee JungDepartment of Medical Sciences The Graduate School, Ajou University
(Supervised by Professor Yup Kang)
NPFFR2 belongs to a family of G-protein coupled receptor that is activated by RFamide peptide ligand, and plays a pivotal role in transduction of neurological signals in response to several hormones. In the present study, we show that NPFFR2 mediates cancer cell progression via regulation of invasion and migration. Analysis of semi-quantitative RT-PCR analysis showed that NPFFR2 was greatly upregulated in cancer cell lines, compared with that of normal cell lines. The depletion of NPFFR2 expression inhibited the invasion and migration of the cell lines. Conversely, addition of ligand peptide, a receptor activator, increased the rate of invasion and migration.
NPFFR2-mediated invasion was accompanied with activation of PKC/ERK signaling pathway. These findings indicate that NPFR2 over-expression contributes for cancer progression via modulation of invasion and migration. Further, inhibition of NPFFR2 activity may be a promising anticancer therapeutic strategy for the treatment of human cancer