J Health Tech Assess 2016;4(2):82-89 ISSN 2288-5811 Copyright © 2016 The Korean Association for Health Technology Assessment
서 론
우리나라에서 신의료기술평가는 2007년부터 도입이 되어 건강보험심사평가원에서 수행을 하다가 2010년부터 공식적 으로 한국보건의료연구원 신의료기술평가사업본부에서 수 행하고 있다. 이전에 국민건강보험에서 요양급여 대상여부 결정신청 시 신청행위에 대한 안전성, 유효성에 대한 관련학
회 의견서를 제출토록 하였으나, 각 학회에서 상이한 의견들 이 제시됨에 따라 의료기술에 대한 체계적, 객관적 검증을 통해 국민의 건강권을 보호하고 신의료기술의 발전을 촉진 하기 위해 신의료기술평가제도가 도입1)되었다. 신의료기술 평가의 법적 근거를 마련한 의료법 개정이 2006년10월에 공 포되었고, 이후 2007년 4월에 ‘신의료기술평가에 관한 규칙’
제정, 2011년 7월 ‘신의료기술평가의 절차와 방법 등에 관한 Original Article
JoHTA
New Health Technology Assessment for Market Access of Medical Device in Korea: Review of Medical Law, Medical Device Law, National Health Insurance Law
Sae Im Chun
Abbott Korea, Seoul, Korea
시장진입을 위한 치료재료 신의료기술평가 제도: 의료법, 의료기기법, 국민건강보험법 중심으로
한국애보트(주)
천 새 임
Received November 3, 2016 Revised November 21, 2016 Accepted December 6, 2016 Address for Correspondence:
Sae Im Chun Abbott Korea,
421 Yeongdong-dero, Gangnam-gu, Seoul 06182, Korea
Tel: +82-2-3429-3604 Fax: +82-2-3429-3775 E-mail: teresa.chun@abbott.com
The “New Health Technology Assessment” system for new health technology was first introduced in 2007 in Korea and there have been some gradual changes and improvements. The Health Tech- nology Assessment (HTA) is a process that is being implemented in major countries across Europe as well as Korea through which the safety and effectiveness of new health technology is evaluated using a systematic review methodology. Despite the fact that HTA is focused on assessment of tech- nology, rather than on individual medical devices, treatments are mostly caused by those newly-de- veloped medical devices. Accordingly, even if it’s an assessment on health technology, clinical evi- dence is for medical devices used in this technology. HTA is different from the point of view product approval that verifies safety and effectiveness of the product itself, since it assesses safety and effectiveness on health outcomes when the treatment with a medical device is operated for the patient. However, considering the opinion that the reimbursement application process of medical service for the right of access to health insurance circle needs a long period and has to take compli- cated procedures compared to the product approval by the Ministry of Food and Drug Safety (MFDS), there have been various adjustments to improve the process since 2013. Including the most recently implemented “MFDS product approval-HTA parallel review” system, there are five tracks for HTA as of present. It is essential that the applicant applying for nHTA should review the relevant provisions on the Medical Law, Medical Device Law and National Health Insurance Law for accurate understanding of the system and needs to make an effort to prepare materials suitable for the objective. The purpose of this review is to discuss the purpose and objective of current nHTA in Korea, to review similar process of other countries and to introduce relevant administrative pro- cess according to relevant laws to suggest further necessary improvements of the system.
Key Words Health technology assessment · Safety and effectiveness assessment · Medical device market access · National health insurance system.
규정’제정으로 진행되었다.
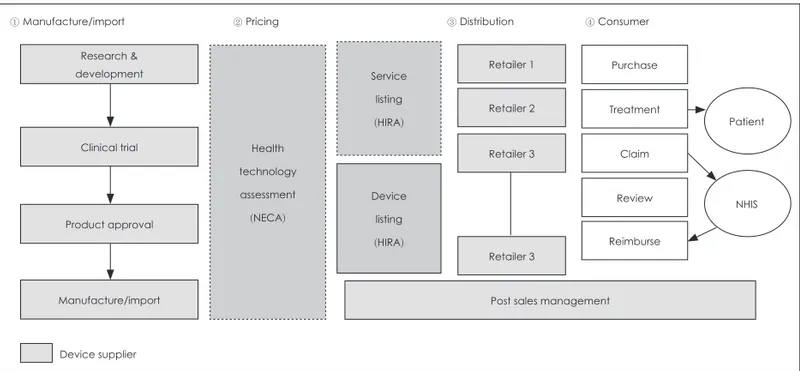
신의료기술평가는 새로운 의료기술에 대한 안전성・유효 성을 치우침 없이 검색, 분석, 고찰하는 ‘체계적 문헌고찰 방 법론’을 기본으로 하여 분야별 전문평가 소위원회에서 평가 를 하고 최종적으로 평가결과에 대해 신의료기술평가위원회 에서 심의2)하게 되어 있다. 따라서 새로운 의료기술에 의해 새롭게 건강보험 요양급여를 신청해야 하는 치료재료의 경 우 식품의약품안전처(식약처) 허가를 받고 신의료기술평가 를 거친 뒤 건강보험 요양급여에 대한 신청을 해야 환자에 게 치료 목적으로 사용할 수 있다(그림 1).
평가기간은 원래 1년 이내였다가, 2015년에 제도 개선의 일환으로 280일로 줄었고, 체외진단/유전자검사 부문에 대 해서는 140일로 단축하여 절차를 간소화하는 규정이 고시3) 되었다. 대부분 새로운 의료기기의 개발로 인해 신의료기술 평가의 대상이 되는 새로운 기술(행위)에 대한 부문은 여전 히 기존의 280일이 기준이다.
2013년 말경 신의료기술평가 원스톱 시범사업을 시작으로 하여 의료기기의 시장진입 장벽을 개선하기 위해 여러 제도 가 도입되었고 현재 신의료기술평가의 track으로는 다섯 가 지가 있다. 본 연구에서는 체외진단/유전자검사 부문이 아 닌 의료기기에 대한 신의료기술평가 절차를 설명하고 이를 규정하고 있는 법체계가 어떻게 구성되어 있는지 검토해 보 고자 한다.
우리나라에서 신의료기술평가의 목적과 의미
신의료기술평가 도입 당시 목적은 문헌의 체계적 고찰과
분석을 통하여 과학적이고 객관적으로 임상근거를 평가하 고 이를 공개하여 의료제공자와 소비자에게 안전하고 유효 한 기술을 사용토록 지원하며 평가 과정 중 생산된 객관적 정보를 연관 업무에 활용하여 의료기술평가 결과의 사회적 수용성을 제고4)하는 것이었다. 현재까지도 그 평가 대상에 대해 기술개발자(또는 제공자)와 평가자 사이에 이견이 있 는데, 현재로서는 건강보험 요양급여비용에 등재되어 있지 않은 모든 행위에 대해 신의료기술평가를 신청하는 것으로 이해하고 있다. 따라서 기존의 행위에서 사용방법이나 적응 증 등이 달라지는 경우를 포함하여 유사한 행위 또는 행위 코드가 있느냐 없느냐가 신의료기술평가 신청의 판단 기준 이 된다. 신의료기술평가의 목적은 새로운 유망한 의료기술 에 대한 임상적 안전성 유효성을 평가하는 것이다. 임상근거 를 통해 평가되고 전문가들 사이에 합의로 결정이 되면, 이 후 환자에게 적용이 가능하고 건강보험 요양급여비용 신청 을 할 수 있게 된다.
우리나라에서 의료기기에 대한 신의료기술평가가 가장 논란이 되었던 부분은 신의료기술평가로 안전하고 유효한 기술로 최종적으로 결정되지 않으면 시장에 진입조차 하지 못하고 환자에게 사용하지 못한다는 부분이다. 의료법과 국 민건강보험법에 의하여 안전성・유효성을 확인받지 못하면 환자에게 비용을 받고 사용할 수가 없어 결국은 제조(수입) 사가 병원에 판매할 수 없기 때문이다. 따라서 그간 행위 및 의료기기를 중심으로 하는 의료기술평가는 다단계 평가와 시장진입 지연이라는 업계의 불만이 자주 제기되어 왔다.
또한, 현재 신의료기술평가 신청 방법이 ‘원스탑 평가신청’,
‘제한적 의료기술평가 확대로 인한 신청’, ‘신의료기술평가
① Manufacture/import ② Pricing ③ Distribution ④ Consumer
Device supplier Product approval
Manufacture/import Clinical trial Research &
development
Health technology assessment (NECA)
Service listing (HIRA)
Device listing (HIRA)
Post sales management Retailer 1
Retailer 2 Retailer 3
Retailer 3
Purchase Treatment
Reimburse Review
Claim
Patient
NHIS
Fig. 1. Market access of new medical device in Korea. NECA: National Evidence-based Collaborating Agency, HIRA: Health Insurance Review & Assessment Service, NHIS: Natioanl Health Insurance Service.22)
유예 신청’, ‘허가-신의료기술평가 통합운영 신청’과 같이 점 점 여러 갈래로 구분되고 있다 보니 민원인 입장에서 어떤 방법으로 해야 하는지, 그리고 어떤 방법이 최적의 방법인지 판단하기도 어렵다. 신의료기술평가는 추후 보험 등재가 최 종 목표이므로 그 부분까지 고려하여 시작하여야 하는데 신 의료기술평가의 다양한 track으로 경우의 수가 많아졌다.
국가별 의료기술평가 제도
기존의 의료기술과 다른 새로운 기술에 대한 의료기술평 가제도는 사회보장제도를 채택하고 있는 유럽의 많은 국가 에서 활성화되어 있으며 특히 영국의 National Institute for Health and Care Excellence(이하 NICE)에서 행하는 의료 기술평가는 환자 및 시민을 포함한 이해관계자 참여가 가장
잘 제도화 되어 있다고 평가5,6)되고 있다. 각 국가별 의료기술 평가 기관(표 1)은 유사한 형태로 의료기술평가를 수행하고 있으며, 서로의 의료기술평가결과를 참고하기도 한다. 또한, 국제 의료기술평가학회인 Health Technology Assessment International(이하 HTAi)가 매년 개최되어 최근 의료기술 평가 현황, 경제성평가 등 다양한 사안에 대하여 학술대회를 개최하고 있다. 우리나라에서는 2013년 서울에서 HTAi를 주관한 바 있다.
호주, 영국, 캐나다, 미국등 주요 선진국에서는 의약품 등 에 대한 허가당국의 품목허가 이후 급여권 진입을 위해서는 의료기술에 대한 평가를 거쳐야 한다. 따라서 의료기술평가 를 수행하는 기관은 건강보험주체가 아닌 독립적인 연구기 관 또는 기구에서 수행하고 있으며 경제성평가를 함께 수행 하기도 한다. 영국에서는 NICE가 수행하는데, 의료기술 경제 Table 1. Product approval and health technology assessment by country23)
특징 영국 스웨덴 캐나다 호주 프랑스 독일 미국 한국
정치체계 입헌군주제 입헌군주제 연방의회제 입헌군주/
연방제
단일국가/
공화국
연방공화국/
내각제
연방제/
공화국
단일국가/
공화국 인허가제도
인허가기구 EMA, MHRA MCA/MDA
EMA, MPA Health Canada
TGA LNE/G-MED EMA /ANSM
EMA, BfArM /PEI
FDA/CDER MFDS
소요기간 150-210일 12개월 180일 180일 120일
의료기술평가
HTA기구 NETSCC (대학), (NICE)
의료기술 SBU/
의약품 TLV
CADTH 지방 RHAs, 병원
MSAC, PBAC PLAC
HAS DAHTA
IQWiG (G- BA)
AHRQ 민간보험사
의약품: HIRA 의료행위:
NECA 운영특성 National National/
County
Federal/
Provincial
National National National Federal National
평가항목 임상적효과, 비용효과
임상적효과, 비용효과
임상적효과, 비용효과
비교임상효과, 비용효과
임상편익/
임상편익개선/
비용효과성
추가편익/
경제성 (효율성)
안전성, 비교효과성, 적절성 등
안전성 유효성/
대체가능성, 비용효과성, 재정영향
소요기간 18-24 M 1-3 year 12-18 M 180일 9개월 1년 내*
경제성평가 ICER ICER ICER ICER ICER Efficiency
frontier
x ICER
급여결정 National- NHS
Local-county Local- province
National MoH
National MOH UNCAM
National G-BA
National (CMS/
NCD)
National MOHW 건정심
*보고서 당시 기준으로 기재. Source: 의료기술평가제도의 국제 비교연구 보고서(2015)에서 활용. EMA: European Medicines Agency, MHRA:
Medicines and Healthcare products Regulatory Agency, MCA/MDA: Medicines Controa Agency/Medical Devices Agency, NETSCC: NIHR Evaluation, Trials and Studies Coordinating Centre, NICE: The National Institute for Health and Care Excellence, ICER: Incremental cost-effectiveness ratio, NHS: National Health Service, MPA: Medical Products Agency, SBU: Swedish Agency for Health Technology Assessment and Assessment of Social Services, CADTH: Canadian Agency for Drugs and Technologies in Health, RHA: regional health authorities, TGA: Therapeutic Goods Administration, MSAC: Medical Services Advisory Committee, PBAC: Pharmaceutical Benefits Advisory Committee, PLAC: Prosthesis List Advisory Committee, MoH: Ministry of Health, UNCAM:
l’Union nationale des caisses d’assurance maladie, IQWiG: Institute for Quality and Economic Efficiency in Health Care, G-BA:
Gemeinsamer Bundesausschuss, Joint Federal Committee, FDA/CDER: Federal Drug Administration/Center for Drug Evaluation and Research, AHRQ: Agency for Healthcare Research and Quality, CMS: Center for Medicare and Medicaid Services, NCD:
National Coverage Determination, MFDS: Ministry of Food and Drug Safety, HIRA: Health Insurance Review and Assessment Ser- vice, NECA: National Evidence-based Healthcare Collaborating Agency, MOHW: Ministry of Health and Welfare, 건정심: 건강보험 정책심의위원회, TLV: Dental and Pharmaceutical Benefits Agency, LNE/G-MED: 의료기기 시험기관, ANSM: French National Agency for Medicines and Health Products Safety, BfArM/PEI: Federal Institute for Drugs and Medical Devices/Paul-Ehrlich-Institute, DAH- TA: German Agency for Health Technology Assessment
성평가 지침(Guide to the Methods of Technology Appraisal) 을 참고하여 의료기술의 경제성을 평가7)한다. 의료기술평가 의 기본인 임상근거 평가 방법론은 대부분의 경우 체계적 문헌고찰을 수행하며 따라서 어느 기관에서 평가를 하더라 도 평가 시기가 상이하지 않는 한 문헌고찰에 대한 결과값은 유사하다. 임상결과에 대하여 각 국가에서 해당 국가의 건강 보험체계와 급여적정성을 고려하여 최종적으로 비용에 대해 권고를 하기도 하고 경제성평가 없이 임상적 유용성에 대해 서 권고를 하기도 한다. 우리나라에서는 새로운 의료기술에 대해서는 현재 임상적 유용성까지만 평가하고 있으며, 이후 건강보험심사평가원에서 급여적정성과 경제성을 평가한다.
의료기술평가제도는 우리나라뿐 아니라 건강보험제도를 채택하고 있는 선진국에서 급여적정성에 대한 평가를 할 때 시행하고 있는 보편적인 절차이다. 의료기술평가의 결과가 건강보험급여 결정에 영향을 미치는 것도 동일8)하다. 다만, 우리나라의 신의료기술평가 제도와 외국의 동일한 제도의 차이점은 우리나라는 건강보험법 상 신의료기술평가에서 통과를 하지 못하면 요양급여를 청구할 수 없다는 것이다.
다시 말해 신의료기술평가에서 안전하고 유효하지 않은 것 으로 결정되면 우리나라에서는 환자에게 돈을 받고 치료 목 적으로 시술할 수 없다9)
최근 우리나라의 신의료기술평가 관련 제도 변화
우리나라에서의 신의료기술평가는 현실적으로 새로운 의
료기술의 진입장벽이 되고 있어 논란이 되어 왔다. 그러나 우 수한 기술이 개발되어도 임상적 유용성을 입증할 수 있는 근거창출 노력을 소홀히 할 경우 투자에 상응하는 적절한 가격산정은 물론 시장진입조차 어려워지는 것은 전 세계적 인 추세10)이다. 어쨌든 이러한 문제점의 개선을 위해 보건복 지부는 지난 2013년부터 “원스탑 신의료기술평가 신청”, “제 한적 의료기술평가”, “신의료기술평가 유예”, “허가-신의료기 술평가 통합운영”의 개선안 마련으로 유망한 기술에 대해서 는 가능하면 시장진입을 지원하는 방향으로 절차를 수정하 여 왔다(표 2).
“신의료기술평가 원스탑 서비스” 제도는 식약처 허가 신청 과 신의료기술평가 신청을 동시에 진행하는 절차로, 허가 완료 후 신청서를 접수하는 일반적인 신의료기기술평가와 구분된 다. 따라서 식약처와 한국보건의료연구원에 동시에 각각의 신청서를 접수하며, 동시에 건강보험심사평가원에서 기존기 술 여부를 검토한다.
“제한적 의료기술평가” 제도는 신의료기술평가에서 연구 단계 2-b 등급을 받은 기술 중 안전성이 확보된 의료기술로 서 대체기술이 없는 질환이거나 희귀질환의 치료・검사를 위해 신속히 임상에 도입할 필요가 있어 선정된 기술에 한 한다. 2016년 10월 현재 제한적 의료기술 평가로 진행되고 있는 기술은 네 가지11)가 있다. 제한적 의료기술평가는 의료 기관에서 비급여 진료를 허용하고 그 결과를 의과학적 근거 로 활용하여 추후 다시 평가하는 제도를 말한다. 대상은 보 건복지부가 정하여 고시하며, 승인된 의료기관에서만 시술 할 수 있다. 제한적 의료기술 대상 범위를 확대하겠다는 계 Table 2. Health technology assessment application track
Track 대 상 소요기간 접수기관
신의료기술평가 기존의 기술에서 사용목적, 사용대상 및 시술방법 등을 변경한 경우
280일 내 한국보건의료연구원 신의료기술평가사업본부
신의료기술평가 원스톱 기존의 기술에서 사용목적, 사용대상 및 시술방법 등을 변경한 경우
허가완료 후 고시
보건의료연구원 신의료기술평가사업본부
제한적 의료기술 신의료기술평가에서 연구단계 기술 II-b로 평가받은 기술 중 대체기술이 없는 질환이거나 신속히 임상에 도입할 필요가 있어 따로 정하여 고시하여 임상용도로 사용가능한 의료기술. 심의를 거쳐 선정된 의료기관에서 비급여 진료를 허용
3년 내지 4년 임상결과 및 추적조사 보고서 제출
보건의료연구원 신의료기술평가사업본부
신의료기술평가 유예 식약처 허가 시 특정 요건의 임상시험 자료를 첨부한 의료기기에 대해서는 신의료기술평가 1년 유예.
건강보험심사평가원의 급여비급여 대상 확인이 있어야 함.
1년 동안 유예 (건강보험심사평가원) 한국보건의료연구원
허가-신의료기술평가 통합운영
기존의 기술에서 사용목적, 사용대상 및 시술방법등을 변경한 경우로, 식약처 허가 시 임상시험 자료를 첨부하는 요건에 적합한 의료기기
280일 내 식품의약품안전처
획이 진행 중인데, 범위 확대와 더불어 근거창출을 위한 지 원도 확대될 수 있다. 그러나 그 대상에 대해서는 제한적 의 료기술 소위원회와 신의료기술평가위원회의 승인12)이 있어 야 한다.
“신의료기술평가 유예” 제도는 식약처 임상시험을 거쳐 허 가된 의료기기 중 요건이 충족된 의료기기를 사용하는 의료 기술의 조기 시장진입을 허용하여 신의료기술평가를 1년간 유예하는 제도이다. 다만, ‘국민건강보험 요양급여의 기준에 관한 규칙’13)에 의하여 평가 유예 신의료기술의 경우 평가 유 예 고시가 있은 후 환자에게 최초로 실시한 날로부터 30일 이내에 건강보험심사평가원에 요양급여 결정신청을 해야 한다.
정부는 특히 가장 최근인 2016년 7월에 고시된 ‘의료기기 허가-신의료기술평가 통합운영에 관한 규정’ 제정(안)14)을 통해 제4차 규제개혁장관회의(2015.11) 시 발표된 ‘신의료기 술평가 간소화・신속화’ 방안으로 식약처 허가와 신의료기술 평가를 통합하여 운영할 수 있도록 효율적인 통합운영을 위 해 필요한 절차와 방법 등에 대한 세부적인 사항을 규정한 바 있다.
관련 행정절차와 법: 의료법, 의료기기법, 국민건강보험법
신의료기술평가와 관련한 법 및 규칙은 상위법이 의료법인 반면, 행위수가와 치료재료 신청 관련한 법의 가장 상위법은 국민건강보험법이다. 본 연구에서 ‘치료재료’라 함은, 행위수 가에 비용이 포함되는 의료장비를 제외한 ‘치료재료급여비 급여목록’ 등재 대상인 의료기기를 말한다. 또한, 해당 의료
기술에서 사용하는 의료기기에 대한 안전성 및 유효성을 평 가하는 절차는 ‘의료기기법’ 하 ‘의료기기법 시행규칙’에서 명 시하고 있다. 이렇듯 서로 다른 법에 의해 신의료기술평가의 목적과 절차가 정의되고 있어 행정기관이 아닌 민원인이 신 의료기술평가 절차 전반에 대한 법을 완전히 이해하기 위해 서는 서로 다른 체계의 상위법에서부터 이해를 해야 하고 법 령을 찾아야 하는 구조로 되어 있다.
신의료기술평가의 목적과 대상, 절차, 이후 급여권 진입 절 차에 대해서는 의료법, 의료기기법, 국민건강보험법을 모두 검토해야 한다(표 3). 가장 최근 개정된 허가-신의료기술평 가 통합운영의 경우 의료기기 허가와 동시에 접수하게 되어 있는데, 모든 제출 자료를 식약처에서 접수하게 되어 있다.
이후 식약처에서 건강보험심평원에 자료를 전달하여 요양 급여비급여 여부에 대한 검토를 하고 식약처 허가와 신의료 기술평가가 동시에 진행된다.
원칙적으로 신의료기술평가의 대상은 기존의 기술에서 사용목적, 대상, 방법이 변경된 경우15)이다. 의료기기 허가가 끝난 이후 신청하게 되어 있었으므로 허가 상 사용목적이나 방법 등과 별도로 진행되었다. 한편 허가・신의료기술평가 통합운영에 따르면 의료기기의 사용목적과 의료기술의 사용 목적이 동일해야 하고 허가 시 임상적 성능시험 자료 제출 대 상이어야 한다. 따라서 식약처에 제출하는 임상시험 기준에 부 합하면서 새로운 기술로 기존 기술에서 사용방법이나 목적, 대 상이 다른 기술이어야 한다. 식약처에 제출하는 임상시험자 료에 대해서는 의료기기 허가・신고・심사 등에 관한 규정을 참고하여야 한다(표 4).
행정적인 절차로는 식약처 허가와 신의료기술평가, 보험등 재 모두 신청으로 각 담당기관에 접수하며, 허가-신의료기술
Table 3. Law system related to health technology assessment
의료법 국민건강보험법 의료기기법
시행령 의료법 시행령 국민건강보험법 시행령 의료기기법 시행령
시행규칙 신의료기술평가에 관한 규칙 국민건강보험 요양급여의 기준에 관한 규칙 의료기기법 시행규칙 행정규칙 - 신의료기술평가위원회 운영에 관한 규정
-0 (보건복지부)의료기기 허가신의료기술평 가 등 통합운영에 관한 규정
-0 신의료기술의 안전성유효성 평가결과 고시
-0 신의료기술평가의 절차와 방법 등에 관한 규정
-0 제한적 의료기술 평가 및 실시에 관한 규정
-0 행위 치료재 등의 결정 및 조정 기준 -0 건강보험 행위 급여비급여 목록표 및
급여 상대가치점수
-0 치료재료 급여비급여 목록 및 급여상한 금액표
-0 요양급여비용의 100분의 100 미만의 범위에서 본인부담률을 들리 적용하는 항목 및 부담률의 결정 등에 관한 기준
-0 (보건복지부)의료기기 허가신의료기술평 가 등 통합운영에 관한 규정
-0 (식품의약품안전처)의료기기 허가신의료 기술평가 등 통합운영에 관한 규정
위임 행정규칙
-0 의료기기 허가·신고·심사 등에 관한 규정(식품의약품안전처고시 제2016-96호, 201.8.31. 일부개정) 국가법령센터
평가 통합운영의 경우 의료기기 허가와 의료기술평가는 동 시에 검토되나, 최종결과물인 식약처의 허가증과 신의료기 술평가 고시는 각각 별도로 통보된다. 따라서 허가-신의료기 술평가 통합운영에서 신의료기술평가의 절차는 ‘신의료기술 평가에 관한 규칙’에 의하여 기존의 절차와 동일하게 신청서 접수 후 90일 내에 신의료기술평가 대상 여부 결정, 이후 소 위원회의 체계적 문헌고찰 평가 절차를 거쳐 신의료기술평 가위원회에서 최종 심의하여 280일 내에 결정하게 된다. 최 종적으로 보건복지부장관의 고시로 안전하고 유효한 기술로 결정되면 환자에게 치료 목적으로 실시할 수 있고, 건강보험 심사평가원에 요양급여결정신청서 접수를 통해 행위와 치 료재료의 보험등재 절차를 거쳐야 한다.
고 찰
현재 우리나라의 신의료기술평가제도가 활발하게 진행되 고 있고 국제적으로도 참고가 되며 체계적으로 진행되고 있 는 점은 사실이다. 그러나 제도의 한계에서 오는 제한점은 분명히 있다. 우선, 신의료기술평가의 큰 한계는 신의료기술 평가 절차를 시작하는 주체가 의료기기 제조(수입)사가 되 었다는 것이다. 신의료기술평가의 목표는 복지부가 평가가 필요하다고 지정하는 새로운 의료기술에 대한 임상근거를 체계적으로 분석하여 안전하고 유효하며 그에 따른 임상적 유용성이 있는지 평가하는 것이다. 신의료기술평가에서 안 전하고 유효한 기술로 평가되면 추후 보험등재 과정에서 비 용효과성과 급여적정성을 평가하여 급여 또는 비급여로 등 Table 4. MFDS-HTA parallel review related clauses in medical law, medical device law and national health insurance law
상위법 행정규칙 및 규정 조항
의료법 신의료기술평가에
관한 규칙24)
제2조(신의료기술평가의 대상 등) ① 「의료법」 (이하 “법”이라 한다) 제53조에 따른 신의료기술평가의 대상은 다음 각 호와 같다.
1. 안전성 유효성이 평가되지 아니한 의료기술로서 보건복지부장관이 평가가 필요하다고 인정한 의료기술
2. 신의료기술로 평가받은 의료기술의 사용목적, 사용대상 및 시술방법 등을 변경한 경우로서 보건복지부장관이 평가가 필요하다고 인정한 의료기술
의료기기 허가신의료기술평가 등 통합운영에 관한 규정25)
제4조(통합운영 대상 검토) ① 보건복지부장관과 식품의약품안전처장은 제3조제2항에 따른 신청일로부터 7일 이내에 통합운영 신청자가 허가를 받고자 하는 의료기기와 그 의료기기를 사용하는 의료기술이 다음 각 호의 요건을 모두 만족하는지 여부에 대하여 검토하고, 그 결과를 서로에게 통보하여야 한다.
2. 허가를 위해 [의료기기법 시행규칙] 제9조제2항제6호에 따른 임상시험에 관한 자료 또는 [의료기기 허가·신고·심사 등에 관한 규정] 제33조제2항제5호가목2에 따른
체외진단용의료기기의 임상적 성능시험에 관한 자료가 있을 것.
의료기기법 의료기기 허가·신고·심사 등에 관한 규정
제29조(첨부자료의 요건) 기술문서등의 심사를 위한 첨부자료의 요건은 다음 각 호와 같다.
12. 임상시험에 관한 자료
의료기기 허가를 위한 임상시험에 사용되는 의료기기의 안전성 및 유효성을 증명하기 위하여 사람을 대상으로 시험한 자료로서 다음 중 어느 하나에 해당되어야 한다. (이하 생략) 국민건강보험법 국민건강보험 요양급여의
기준에 관한 규칙
제9조의2(요양급여대상·비급여대상 여부 확인) ① 요양기관, 의약관련 단체, 치료재료의 제조업자·수입업자는 보건복지부장관에게 요양급여대상 또는 비급여대상 여부가 불분명한 행위에 대하여 「의료법」 제53조에 따른 신의료기술평가 및 「신의료기술평가에 관한 규칙」
제3조에 따른 신의료기술평가 유예 신청 전에 요양급여대상 또는 비급여대상 여부의 확인을 신청할 수 있다.
행위·치료재료 등의 결정 및 조정 기준26)
제8조(안전성 유효성의 확인 등) ① 심사평가원장은 제5조제1항의 규정에 의하여 행위·
치료재료등의 결정신청이 있는 때에는 필요한 경우 안전성·유효성에 관하여 다음 각 호의 어느 하나의 방법으로 확인할 수 있다.
1. 의료법 제53조에 따른 신의료기술평가 결과 안전성·유효성을 인정했는지 여부
②0 심사평가원장은 행위·치료재료 등이 제1항의 규정에 의하여 안전성·유효성이 없다고 확인하는 경우에는 제9조의 규정에 의한 평가를 하지 아니하고 그 결과를 장관에게 보고하여야 한다.
③0 장관은 행위·치료재료 등이 안전성·유효성이 없다고 확인한 경우에는 결정신청자에게 통보하고 안전성·유효성이 없는 행위·치료재료 등을 행한 결정신청자에 대하여는 관련 법령에 의한 필요한 조치를 할 수 있다.
국가법령센터. MFDS-HTA: Ministry of Food and Quality-The Health Technology Assessment
재되어 유망한 신기술을 환자에게 제공하게 하는 것이다. 또 한, 안전성과 유효성이 확보되지 못한 기술에 대해서는 임상 근거를 쌓을 수 있게 하는 것이었다.
신의료기술평가의 본래 기능을 아주 잘 보여주는 사례는 2016년 대법원 판결16)에서 찾을 수 있었다. 사건은 신의료기 술평가가 처음 시행되었던 2007년경에 우리나라에 도입된 시술로, 환자의 합병증으로 인해 2010년에 복지부가 지정하 여 신의료기술평가 절차를 거쳤다. 특히 우리나라에서 수술 받은 환자들에 대한 추적조사까지 실시하며 안전성과 유효 성을 평가하였는데, 추적조사에서 보고된 중증합병증 발생 율이 33.6%였다. 신의료기술평가위원회는 이 수술이 안전성 이 미흡한 의료기술이라고 최종 심의하였고, 복지부는 이 기 술이 국민건강에 중대한 위해를 초래할 우려가 있다는 이유 로 수술의 중단을 명하였다. 또한, 대법원은 “신의료기술의 안전성・유효성 평가나 신의료기술의 시술로 인해 국민보 건에 중대한 위해가 발생하거나 발생할 우려가 있는지에 대 한 판단은 고도의 의료・보건상의 전문성을 요하는 것이므 로, 행정청이 국민의 건강을 보호하고 증진하려는 목적에서 전문적인 판단을 하였다면 그 판단의 기초가 된 사실인정에 중대한 오류가 있거나 그 판단이 객관적으로 불합리하거나 부당하다는 등의 특별한 사정이 없는 한 존중되어야 할 것”
이라고 하였다. 특히, “시술을 행하는 원고(의료인)의 불이 익이 상당하더라도 이 불이익이 안전성이 검증되지 않은 의 료기술의 시행으로 국민건강이 침해될 위험을 예방할 공익 상의 필요보다 크다고 보기는 어렵다고 하며, 시술 중단 외 에 국민보건상의 위험을 효과적으로 통제할 다른 적절한 수 단을 찾기도 쉽지 않아 보인다”고 하였다.
위의 판결에서 설명되었듯이 안전성이 검증되지 않은 의 료기술에 대한 관련 행정청의 전문적인 판단은 전 국민건강 보험 체계를 가지고 있는 우리나라에서는 국민의 안전을 위 협할 수 있는 요인을 통제할 수 있는 매우 효과적인 수단이 될 수 있다. 그러나 현실은 보험등재를 위해 민원인의 신청 으로 이루어지는 행정상 절차가 되었고 이마저도 높은 수준 의 확실한 임상근거가 없으면 시장진입조차 불가능하다.
두 번째, 신의료기술평가보다는 의료기술평가가 되어야 한 다. 우리나라에서는 신의료기술평가, 즉 new Health Tech- nology Assessment로 사용하고 있으나 원래 유럽에서 활성 화된 용어는 의료기술평가이다. 이 의미는 새로운 기술뿐 아 니라 기존의 기술이라 하더라도 안전성과 유효성의 평가가 필요하면 평가하여야 한다는 뜻이다. 특히 의료기술평가 개념 이 정립되기 전에 보험권에 등재된 기술들에 대해서도 의료기 술평가가 필요하다는 뜻이다. 또한 의료기술평가 방법론에 있어서도 다양한 이해관계자(stakeholder)를 참여하게 하는
등의 변화를 모색할 필요17)도 있을 것이다.
셋째로, 신의료기술평가의 건수가 계속 증가하고 있다. 현 재 신의료기술평가에서 안전하고 유효한 기술로 고시된 기 술은 617개이며, 제한적 의료기술로 진행되고 있는 기술은 4개18)이다. 최종적으로 안전하고 유효한 기술로 평가된 기술 만 고시되므로 평가를 신청한 기술은 이보다 많다. 2014년 9 월을 기준으로 신의료기술평가가 신청된 건수는 1609건19)이 었고 연간 평균 약 220건의 기술이 신청된 것으로 계산된다.
기술별로는 처치 및 시술이 35.4%, 진단검사가 43.5%, 유전 자검사가 20.7%로 진단/유전자등 체외진단 분야가 가장 높 은 비중을 차지고 있다. 행위별수가제를 채택하고 있는 우리 나라에서 새로운 행위는 계속 생기게 될 것이고 의료자원 뿐 아니라 행정적인 비용도 계속 늘어날 것이다. 보건의료기 술평가(Health Technology Assessment)에 의하여 새롭게 소 개되는 의료기술에 대한 효과적인 의료자원 관리 방안에 대 한 연구가 영국에서는 시도20)되고 있으며 우리도 방안을 마 련할 시점이라고 보여진다.
다음으로, 제도 개선의 목적이라고는 하나 신의료기술평 가 제도가 복잡해졌다. 다섯 개의 track으로 인해 각각을 정 확하게 이해하기 위해서는 검토해야 할 규정의 범위가 넓어 졌고 이를 이해한다고 하더라도 다양한 경우의 수가 생겨 시장진입에 대한 정확한 예측이 오히려 더 어려워졌다고 보 인다. 신의료기술평가의 결과가 시장진입에 큰 영향을 미치 는 만큼, 이를 수행하는 기관에서 신개발 기술 업체들과의 임상단계에서부터의 상담을 통해 보다 정확하고 유용한 정 보를 제공하는 시장진입가능성 상담제도를 운영하는 방안 도 있을 것이다.
마지막으로 신의료기술평가 결과가 보험등재 과정에서 반영이 될 수 있는 현실적인 행정절차가 필요하다고 본다.
새로운 행위나 치료재료의 결정 시에는 신의료기술평가 결 과 안전성・유효성을 인정했는지 여부를 확인하게 되어 있으 며21) 이를 확인할 수 있는 자료는 신의료기술평가 고시문이 다. 이후 경제성과 급여적정성을 평가하여 급여・비급여 여 부와 상대가치점수와 상한금액을 결정하게 되어 있는데, 신 의료기술평가와 건강보험 요양급여 결정 검토를 서로 다른 두 기관에서 하다보니 신의료기술평가 고시문 만으로는 안 전성과 유효성의 내용을 확인할 수 없는 것이다. 결국에는 검토과정에서 임상근거를 다시 한 번 확인하게 되고 근거를 통해 안전성과 유효성이 확인되어야 경제성 검토를 진행하 게 된다. 신의료기술평가 보고서를 활용하여 안전성 유효성 검토를 대체하거나 갈음하고 바로 경제성과 급여적정성에 대한 검토를 진행하는 것이 효과적일 수 있다.
결 론
현재의 체계에서는 신의료기술평가를 신청할 수 있는 track은 다섯 가지가 있으며, 목표로 하는 최종 결과를 감안 하여 자료를 준비하고 신청을 할 수 있어야 한다. 의료법, 의 료기기법, 그리고 국민건강보험법의 각 규칙에 대해 자세히 검토하는 과정을 통해 신의료기술평가 제도에 대한 정확한 이해를 하는 것은 신청자의 책임이다. 그러나, 의료기술의 발 전이 점점 빨라지는 것과 함께 이를 반영하기 위한 행정절 차도 더 복잡해지고 정교해지고 있는 것도 사실이다. 따라서 계속적으로 기존의 행정규칙에 개선안을 추가하는 것보다 는 신의료기술평가 결과가 요양급여 결정 단계에서 적극 반 영될 수 있도록 하는 혁신적인 행정절차의 도입이 필요하다.
REFERENCES
1) 안정훈, 이선희, 박종연, 김민정, 신채민, 이 민 등. 신의료기술 평 가제도 발전방안 연구. 한국보건의료연구원 연구보고서. Seoul:
National Evidence-based healthcare Collaborating Agency;2012.
pp.1-105.
2) NECA. New Health Technology Assessment. Available from: http://
nhta.neca.re.kr/nhta/committee/nhtaU0201V.ecg. Accessed October 15, 2015.
3) Public notice of [Regulation on Process and Method of new Health Technology Assessment] adjustment. Ministry of Health and Welfare public notice number 2016-84.
4) Jun OC. The definition and present status of new health technology.
Korean J Clin Oncol 2008;4:4-15.
5) Lee WY. Review on the patient and public involvement in health tech- nology appraisals at NICE. J Crit Soc Policy 2012;34:47-75.
6) Choi JE, Kang MJ, Kim MJ, Kim JY, Park JY, Seo SW, et al. Social Utilization of HTA-2015 Report of the 3rd NECA annual conference.
National Evidence-based Healthcare Collaborating Agency. Pub- lished on Dec 2015.
7) Review and Assessment Center of Health Insurance Review & Assess- ment Service. Study on Evidence-based reimbursement decision of medical devices: Guideline on Cost-effectiveness assessment;2015.
8) Schmitz S, McCullagh L, Adams R, Barry M, Walsh C. Identifying and Revealing the Importance of Decision-Making Criteria for Health Technology Assessment: A Retrospective Analysis of Reimbursement Recommendations in Ireland. Pharmacoeconomics 2016;34:925- 9) National Law Center. Article 10 (reimbursement application of new 937.
health technology), Article 11 (reimbursement decision of new health technology) in [Rule on Standards of National Health Insurance Medical Services].
10) Lee SS. Medical technology development and globalization: the role
of the medical device industry. J Korean Am Med Assoc 2014;57:919- 11) NECA. Status of limited health technology assessment. Available 926.
from: http://nhta.neca.re.kr/nhta/application/nhtaU0504L.ecg. Ac- cessed September 22, 2016.
12) NECA. Presentation on the policy of expanding the limited health tech- nology assessment. Health Technology. Available from: http://nhta.
neca.re.kr/nhta/notice/nhtaU0400V.ecg?seq=2249. Accessed Septem- ber 22, 2016.
13) Article10 clause1 (application of service and medical device for na- tional health insurance medical services) in [Rule on Standards of National Health Insurance Medical Services].
14) Ministry of Health and Welfare public notice number 2016-144 (MFDS approval-HTA parallel review management) effective from 2016.7.29.
15) National Law Information Center. Regulation on Health Technology Assessment number 2 (Subject of Health Technology Assessment).
16) Supreme Court of Korea. 대법원2016.1.28.선고 2013두21120판결 [의료기술시행중단명령처분취소][공2016상,368]. Available from:
http://glaw.scourt.go.kr/wsjo/intesrch/sjo022.do. Assessed September 9, 2016.
17) Husereau D, Henshall C, Jivraj J. Adaptive approaches to licensing, health technology assessment, and introduction of drugs and devices.
Int J Technol Assess Health Care 2014;30:241-249.
18) Public notice of [Safety and Effectiveness evaluation result of new Health Assessment Technology] adjustment. Ministry of Health and Welfare public notice number 2016-150. Safety and Effectiveness eval- uation result of new Health Technology. List of safe and effective tech- nologies evaluated.
19) Lee M, Ahn J. The current status and future direction of Korean health technology assessment system. J Korean Med Assoc 2014;57:906-911.
20) Brockis E, Marsden G, Cole A, Devlin N. A Review of NICE Methods Across Health Technology Assessment Programmes: Differences, Jus- tifications and Implications. 2016. Available from: http://www.bdsp.
ehesp.fr/Base/502627/. Assessed September 9, 2016.
21) National Law Center. Standards of Decision and Adjustment of Ser- vice and Device.
22) Chun SI. Masters thesis of graduate school of public health Yonsei University. Study on Reimbuursement Pricing Calculation of Thera- peutic Materials. Methodological review of reimbursement system of therapeutic materials of other countries;2013.
23) Kim SY, Shin SJ, Park JS, Kim JH, Baek YJ, Ko EB, et al. Compara- tive study on the health technology assessment systems of major countries. National Evidence-based Healthcare Collaborating Agen- cy. Publshed on Dec. 2014.
24) National Law Information Center. Regulation of Health Technology Assessment. Ministry of Health and Welfare notice number 353.
2015.9.21. adjusted.
25) National Law Information Center (Ministry of Health and Welfare) Reg- ulation on MFDS License-HTA Parallel Review Process. MOHW Public notice 2016-144, established on 2016.7.29.
26) National Law Information Center. Standards of Decision and Adjust- ment of Service and Device. MOHW public notice number 2010-82.
2010.10.4. revised.