학 술 논 문
102
효과적인 약물전달 시스템을 위한 나노입자 유도 장치
이총명*·한현호*·장병한·오은설·기재홍
연세대학교 보건과학대학 의공학부
Nanoparticle Inducing Device for Effective Drug Delivery System
Chongmyeong Lee *, Hyeonho Han*, Byonghan Jang, Eunseol Oh and Jaehong Key
Department of Biomedical Engineering, College of Health Science, Yonsei University (Manuscript received 29 March 2017 ; revised 7 June 2017 ; accepted 14 June 2017)
Abstract: Cancer is one of the most challenging human diseases. Current clinical methods have limitations for early- stage cancer diagnosis and effective therapy. Moreover, current surgical methods to remove tumors are not precise enough and chemotherapy destroys normal tissues as well as malignant tumors, resulting in severe side effects such as hair loss, vomiting, diarrhea, and blood disorders. Recently, nanotechnology using nano-sized particles suggests advanced solutions to overcome the limitations. Various nanoparticles have been reported for more accurate diagnosis and minimized side effects. However, current nanoparticles still show limited targeting accuracy for cancer generally below 5% injection dosage. Therefore, herein we report a new nanoparticle inducing device(NID) to guide the nano- particles externally by using both variable magnetic fields and blood flows. NID can be a promising approach to improve targeting accuracy for drug delivery using iron oxide nanoparticles.
Key words: iron oxide nanoparticles, nanoparticle inducing device, drug delivery, cancer, magnetic guidance
I. 서 론
나노입자는 적혈구의 약 1/80배 크기로 합성된 나노미터 (nanometer) 크기의 입자를 의미한다. 이러한 나노입자의 넓은 표면적을 이용하면 다양한 생화학적 기능을 부여하는 것이 가능하다. 지금까지 다양한 나노입자들(리포솜, 마이셀, 폴리머, 금속, 단백질 나노입자 등)이 학계 및 연구 분야에 보고되었다[1]. 이러한 나노입자를 이용한 약물전달 시스템 은 약물을 직접 전달하는 약물전달 시스템보다 몸 속에서 더 오랜 시간 작용하고, 심장 독성도 더 낮은 것으로 알려 져 있다[2]. 이러한 장점에도 불구하고 나노입자를 이용한
약물전달 시스템은 생체 시스템 내의 원하는 위치에 나노입 자가 축적되는 양은 매우 낮다는 제한이 있다. 때문에 이를 보완하여 치료 효과를 극대화 시키는 나노입자 기반의 약물 전달 시스템 개발이 앞으로의 중요한 도전 과제라고 할 수 있다[3,4,5]. 따라서 본 연구에서는 나노입자의 전달 효과를 높이기 위한 새로운 디바이스를 제시하고자 한다. 본 연구 에서 개발한 NID(Nanoparticle Inducing Device)는 자석 과 이를 고정하는 회전하는 구조물로 자기장의 방향과 세기 를 변화시키는 기능을 가지고 있고, 또한 이러한 자기장의 변화를 이용하여 일정한 세기의 자기장을 특정 위치에 지속 적으로 노출시키는 것을 가능하게 한다. 특히 본 논문에서 제시하는 NID는 자기장에 민감하게 반응하여 자화되는 산 화철(Fe
3O
4, Fe
2O
3) 기반 나노입자의 외부적인 위치 조절 을 위한 기구로 사용하는 것이 가능하다. 자석을 이용한 기 존 자기유도방법은 자석을 실험체의 표면에 고정시키기 때 문에 표면에 대한 나노입자의 유도는 가능하나, 실험체 내 부에 나노입자를 집중시키는 것은 제한되었다.
본 연구에서 제시하는 NID는 자석을 다른 속도와 패턴 으로 회전시키기 때문에 실험체의 특정 위치에 산화철 나노
*Contributed equally to this work.
Corresponding Author : Key, Jaehong
Department of Biomedical Engineering, Yonsei University, 1 Yonseidae-gil, Wonju, Gangwon-do 220-710, South Korea TEL: +82-33-760-2587 / E-mail: jkey@yonsei.ac.kr
이 연구는 2017년도 정부(미래창조과학부)의 재원으로 한국연구재
단(No. 2015R1C1A1A01052592), 바이오의료기술개발사업(2016-
M3A9B4919711), 나노·소재기술개발사업(2009-0082580)과 정부
(교육부)의 한국과학창의재단(2016년도 학부생 연구프로그램)의 지
원을 받아 수행된 연구임.
Journal of Biomedical Engineering Research 38: 102-110 (2017)
103 입자를 유도할 수 있는 조건을 만드는 것이 가능하다. 이러
한 나노입자의 개선된 표적 효과는 환자가 적은 양의 약물 로 최대의 치료효과를 얻을 수 있고, 또한 약물의 부작용을 최소화할 수 있기 때문에 효과적인 약물전달을 위한 유용한 기술로 발전할 수 있을 것이라 기대한다.
II. 연구 재료 및 방법
1. 연구 재료
(1) Nanoparticle Inducing Device(NID) 구성 NID 는 크게 동작제어박스(box), 이동베드(bed), C-arm 및 회전모터로 나누어져 있다. C-arm 양 팔 끝에 한 개 혹 은 두 개의 네오디움 영구자석(Neodymium magnet)을 결 합시켜 다양한 형태의 자기장을 만들 수 있다. 자기장의 형 태는 스테핑모터(stepping motor)에 의한 회전속도와 회전 패턴으로 변화되며, 이러한 변화는 산화철 나노입자를 특정 위치에 유도할 수 있는 최적의 조건을 찾는데 도움을 준다.
이동베드는 3개의 모터로 혈관모델 또는 실험체를 x, y, z 의 3축으로 이동시켜 산화철 나노입자의 유도점에 실험체의 원하는 부위를 위치시킨다. 여기서 x, y 축은 모터와 래크 기어(rack gear)를 이용하여 설계하였으며, z 축은 서포트 잭(support jack)을 이용하여 구성하였다. 속도 및 패턴 조 작부는 마이크로프로세서(Arduino, NY, USA)를 이용하여 자석회전모터의 속도와 패턴을 제어하도록 설계하였고, 조 이스틱 입력을 받아 이동베드의 3축 이동을 제어한다. 또한 별도의 락-푸쉬버튼(lock-push button)을 이용하여 동작 모 드를 변경할 수 있도록 설계하였다. 상기된 세 파트는 아크 릴 재질의 베이스와 지지대로 통합되었으며, C-arm과 이 동베드를 포함한 서포트 잭 부분은 3D 프린터(Stratasys Connex3., Sungnam, Korea) 로 제작하였다.
(2) 산화철 나노입자(Iron Oxide Nanoparticle) 본 연구에서는 99.5+% purity의 산화철 나노입자 Iron Oxide Nanopowder Water Dispersion(US Research Nanomaterials Inc., TX, US) 을 NID 장비에 대한 평가 를 위하여 사용하였고, 크기 15-20 nm인 구형 나노입자이 다. 산화철 나노입자의 cell uptake 실험과 cell viability 실험은 10 nm 크기로 Rhodamine B dye로 코팅된 산화 철 나노입자(Ocean Nano tech., SD, US)를 이용하였다.
(3) 암세포(Cancer cell)
본 연구에서 사용된 MCF-7 cell은 사람의 유방암 세포 종으로 luminal epithelial의 표현형을 가지고 있다. FBS (Fetal Bovine Serum) 와 Penicillin을 각각 10%, 1% 비 율로 혼합한 DMEM(Dulbecco’s Modified Eagle’s Me- dium) 에 세포를 배양하였으며, 이 때 100pi cell culture dish 1 개 당 1,000,000개의 세포를 seeding하였다. 그리고 48시간 후 세포가 약 4,000,000개가 되면 Trypsin-EDTA 를 이용하여 바닥에서 분리한 후, 계대배양을 진행하였다.
배증시간은 약 24시간이었다.
(4) 자석을 이용한 산화철 나노입자의 유도
혈관 내 투여된 산화철 나노입자는 혈류를 따라 이동한다.
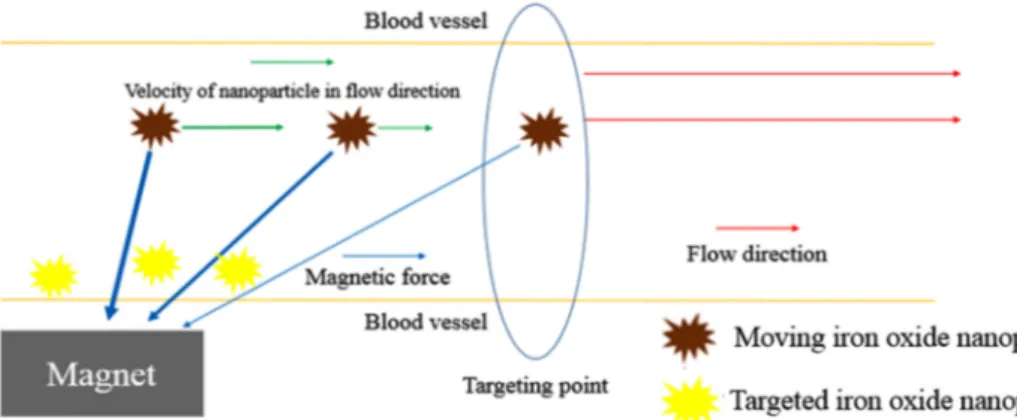
흐르는 산화철 나노입자 주위에 자석을 위치시키면 자석의 자기력으로 인해 산화철 나노입자는 자석방향으로 힘을 받 게 된다. 이때 자기력이 충분히 강하다면 산화철 나노입자 의 속도는 0까지 감소하고, 특정 지점(Targeting point)에 정지하여 혈액의 흐름에 영향을 받지 않는다. 그림과 같이 고정된 자석의 경우, 자석과 가까운 혈관벽에 산화철 나노 입자는 유도된다(그림 1).
(5) NID 의 자기유도 원리
고정된 자석과 달리 NID에서는 자석이 특정 속도와 패
그림 1. 산화철 나노입자의 자기유도 원리.
Fig. 1. Magnetic inducing effect of iron oxide nanoparticles.
104
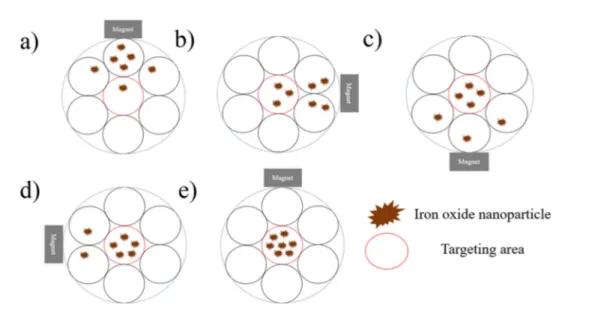
턴으로 회전하므로 자석의 회전궤도 내의 영역은 시간에 따 라 노출되는 자기력의 세기가 변화하게 된다. 본 연구에서 는 체내에서 지속적으로 흐르는 혈액을 모사하기 위하여 동 일한 양의 나노입자가 계속해서 순환할 수 있는 순환 시스 템을 고려하였다. 이 순환 시스템의 주위를 한 개의 자석이 90
o씩 4단계로 회전하게 되는 경우를 가정하면, 중심부는 자 석이 어느 방향에 위치하고 있어도 일정한 세기의 자기력에 영향을 받아 유도된 산화철 나노입자는 쉽게 방류되지 않는 다. 그 외의 외곽부는 자석의 단계별 위치에 따라 서로 다 른 세기의 자기력에 노출된다. 그 중 위치적으로 자석과 멀 리 떨어진 반대편 외곽부는 자기력의 세기가 작아져 산화철 나노입자를 방류하게 된다. 이를 반복하여 자석을 회전시키 면 외곽부에 위치한 영역에 유도되었던 산화철 나노입자는 대부분 방류되고 순환하던 산화철 나노입자들은 결국 지속 적인 자기장에 노출되는 Targeting area의 중심부에 모이 게 된다(그림 2).
2. 실험 방법
본 연구에서는 크게 세 가지 실험을 진행하였다. 먼저 암 세포 근처에 산화철 나노입자가 존재할 때, 암세포에 의해 내부로 흡수(endocytosis)되는지 여부를 확인하였다. 그리 고 약물이 포함되어 있지 않은 산화철 나노입자가 체내 다 른 곳에 축적되었을 경우를 가정하여, 나노입자 자체가 나 타내는 세포 유해성을 검증하였다. 마지막으로 혈류와 같은 유 동 흐름 속에서, NID의 동작 패턴에 따라 실제로 Targeting area 에 입자가 축적되는지를 확인하였다.
(1) 암세포 흡수(cancer cell uptake) 실험
유방암 세포 200,000개를 DMEM 배지 2 ml과 함께
confocal dish 에 seeding 후 24시간동안 인큐베이터에서 배양하였다. 24시간이 지난 뒤에 원래 있던 DMEM 배지 를 제거하고, 농도 별로 산화철 나노입자를 희석시킨 DMEM 배지로 교체하였다. 그 후 24시간 동안 산화철 나노입자와 암세포를 배양하였고, DMEM 배지를 제거한 다음 DAPI 로 세포핵을 염색 후 4% 포름알데히드로 고정시켰다. 산화 철 나노입자의 cell uptake는 형광 현미경(Nikon eclipse Ti-U., Tokyo, Japan) 으로 확인하였다. 산화철 나노입자의 농도 별 uptake 양은 image j 소프트웨어(National In- stitutes of Health, MD, US) 를 이용하여 형광 현미경으 로부터 얻은 이미지의 전체 형광 intensity를 측정하고, 세 포 수로 나눠서 세포 하나 당 평균 형광 intensity를 계산 하였다.
(2) Cell viability 실험
MCF-7 cell 을 96 well culture dish에 한 well 당 5,000 개를 배지와 함께 배양하였다. 24시간 후, 산화철 나노입자 를 0 µg/ml, 5 µg/ml, 50 µg/ml, 100 µg/ml 농도로 seeding 후 다시 24시간 동안 암세포와 배양하였다. 그리고 CCK-8 assay kit 을 사용하여 염색 시킨 후, plate reader를 이용 하여 형광 intensity를 측정함으로써 cell viability를 계산 하였다.
(3) Iron Oxide Nanoparticle Inducing 실험
그림 3, 4는 Syringe pump를 이용한 순환 모델과 NID 를 구현한 장비를 보여준다. 혈류 모델로 사용된 syringe pump는 물과 나노입자를 일정 속도로 주입하는 역할을 했 으며, 주입속도를 조절하여 혈류속도와 나노입자 축적률의 상관관계를 실험하였다(그림 3).
그림 2. 자석이 회전하는 순환시스템 단면에서의 산화철 나노입자의 유도량 변화의 원리.
Fig. 2. Magnetic inducing effect of iron oxide nanoparticles in the circulating system under the magnet rotation.
Journal of Biomedical Engineering Research 38: 102-110 (2017)
105
NID 는 동작제어박스(box), 이동베드(bed), C-arm 및 회 전모터로 나누어진다(그림 4). 동작제어박스는 이동베드를 움직여 원하는 위치로 이동하며, C-arm의 회전패턴과 속도 를 제어한다. 이동베드는 실험모델을 나노입자가 유도되는 C-arm 회전중심에 놓일 수 있도록 동작제어박스로 조작된 다. C-arm 및 회전모터는 회전하는 속도와 패턴에 따라 Targeting area 에 다양한 내부 자기장 조건을 형성 시킬 수 있다. 본 실험에서는 C-arm을 90
o씩 일정 주기로 회전시켜 C-arm 의 회전중심영역에서는 일정한 세기의 자기장을 유도 하고 그 외 가장자리영역에는 나노입자를 방류하게 하는 자 기장 조건을 형성하였다.
III. 연구 결과 및 고찰
1. NID 시뮬레이션 결과
회전속도와 회전패턴에 의해서 Targeting area에 노출 되는 자기장의 분포는 매우 다양하게 변할 수 있다. 이를 추 정하기 위해 자석의 노출시간과 패턴에 따른 나노입자 유도 의 조건을 COMSOL Multiphysics 시뮬레이션(COMSOL.,
Stockholm, Sweden) 으로 분석하였다. 혈류속도를 상쇄하 여 나노입자를 유도할 수 있는 최소의 자기력을 Critical magnetic force 라고 정의하고 자기력의 세기는 자속밀도에 비례하므로 그 때의 자속밀도를 Critical Magnetic flux density라고 정의한다. Critical magnetic flux density가 형성되는 거리보다 자석과 가까운 거리에 위치한 나노입자 들은 모두 혈관을 순환하지 않고 특정 영역에 모여 있게 된다.
식 (1)
위의 식(1)은 비자성 매질에서의 정자계의 기본 가정이다.
B 는 자속밀도이며 C는 폐곡선이며 I는 전류, u
0는 자유공 간의 permeability이다[6]. 이는 비자성체의 임의의 폐경로 를 따른 자속밀도의 순환은 경로에 의해 둘러싸인 표면을 통해 흘러나가는 총 전류에 u
0를 곱한 것과 같다는 것을 의 미하는데 영구자석에서 전류는 자기 모멘트에 의한 전류밀 도의 흐름들을 의미하기 때문에 자석과의 거리가 멀어지면 이 임의의 폐곡선의 길이는 길어지게 되지만 전체 전류량은 변화가 없기 때문에 자속밀도의 크기가 작아지고 자석의 개 수에 따라서 생기는 자기장 형태도 달라진다(그림 5).
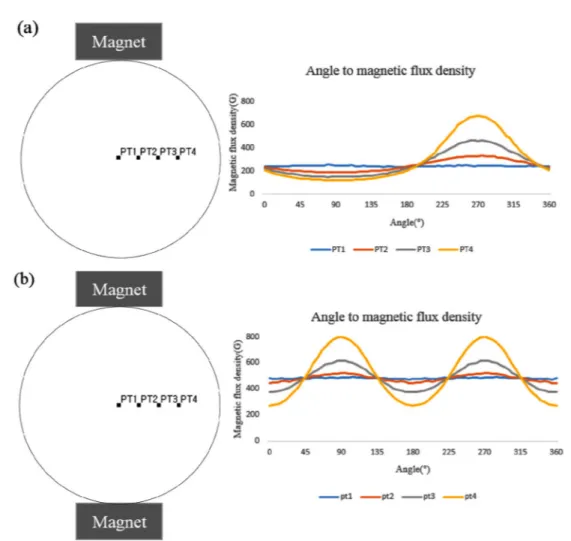
시뮬레이션 결과 표면 자속밀도의 평균이 5000G인 자석 을 회전 반지름 5 cm로 회전시키게 된다면 회전 중심인 PT1 에서 magnetic flux density의 최대값은 255G이고 최 소값은 230G이지만 중심에서 멀어진 PT4에서는 최댓값이 675G이고 최솟값은 118G이다. 회전 중심에서 멀어질수록 magnetic flux density 의 최대값은 높아지고 최소값은 낮 아진다(그림 6(a)). 표면 평균의 자속밀도가 5000G인 자석 2개를 회전 반지름 5 cm로 회전시키게 되는 경우, PT1에 서 magnetic flux density의 최대값은 491G, 최소값은 473G 이고 PT4에서 최댓값은 799G, 최솟값은 374G이다.
c
B
∫° • dl = u0I
그림 4. NID 장비.
Fig. 4. NID device.
그림 3. Syringe pump를 이용한 순환 모델.
Fig. 3. Circulation model using a syringe pump.
그림 5. (a) 하나의 자석 주위의 형성된 자속밀도, (b) 두 개의 자석 주위의 형성된 자속밀도(표면평균 자속밀도 = 5000G).
Fig. 5. (a) Magnetic flux density formed around a magnet, (b) Magnetic flux density formed around the two magnets (surface average magnetic flux density = 5000G).
106
즉, 자석 한 개를 회전시킬 때와 마찬가지로 PT1에서 PT4 로 갈수록 최댓값은 더 크게 증가하고 최소값은 더 크게 감 소한다(그림 6(b)).
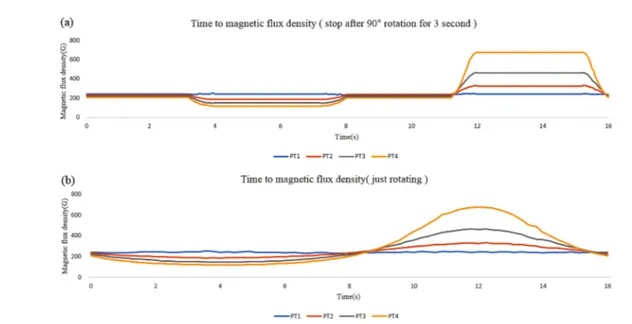
이전 시뮬레이션과 같은 연속 회전 이외에도 자석의 회전 패턴을 변경함에 따라 다양한 magnetic flux density를 얻 을 수 있다. 3초간 정지해 있다가 1초 동안 90도를 회전하여 16 초를 주기로 한 회전을 하는 패턴의 경우 자석이 PT4에 가장 가까운 상태인 12-15초 구간에서는 PT4에서 가장 큰 자속밀도를 나타내며, 회전하는 구간에서는 자석이 PT4에 가장 멀리 위치하여 자속밀도가 급격히 낮아지는 것을 알 수 있다. 이러한 결과는 혈관을 통해 지속적으로 순환하는 자성 나노입자가 자석의 회전패턴에 따라 유도되는 위치가 변화한다는 것을 예측하게 한다. 자석의 위치가 각 포인트 의 자속밀도에 직접적인 영향을 주는 PT2-4와 달리 PT1은 자석의 위치와 무관하게 지속적인 자속밀도를 나타냄을 알 수 있다(그림 7).
2. 산화철 나노입자에 대한 세포 실험 결과
그림 8(a)의 Cell uptake 실험은 세포 근처에 존재하는 산화철 나노입자의 양에 따라 얼마나 uptake가 일어나는지 를 확인하기 위함이다. 즉, NID장비로 원하는 부위에 산화 철 나노입자를 유도시켰을 때, 그 유도된 양이 많을수록 세 포가 더 많은 산화철 나노입자를 흡수할 수 있는지를 확인 하기 위함이다. 형광 물질로 코팅된 산화철 나노입자를 사 용하였기 때문에, 나노입자의 농도에 따라 세포의 intensity 가 변하였는데, 산화철 나노입자를 넣지 않은 control을 통 해서 형광 사진에서의 red light가 산화철 나노입자에 의한 것임을 확인하였다. 따라서 control을 제외한 두 농도의 red light 의 형광 intensity를 비교함으로써 산화철 나노입자 세 포 내 흡수량에 따른 형광영상을 비교할 수 있었다. 50 µg/
ml 의 저 농도의 산화철 나노입자를 배양한 샘플의 총 intensity 는 266.533이었고, 세포의 수는 29개였으므로, 세 포 하나 당 평균 intensity는 9.19임을 알 수 있었다. 100 µg/ml의 산화철 나노입자를 배양한 샘플의 총 intensity는
그림 6. (a) 하나의 자석이 회전할 때 위치별 자속 밀도의 변화(점과 점사이의 거리 = 1 cm), (b) 두 개의 자석이 회전할 때 자속밀도의 변화.Fig. 6. (a) Position dependent magnetic flux density using a magnet(distance between two points = 1 cm), (b) Position dependent magnetic flux density using two magnets.
Journal of Biomedical Engineering Research 38: 102-110 (2017)
107
2375.301 이었고, 세포의 수는 55개였으므로, 세포 하나 당 평균 intensity는 43.19임을 알 수 있었다. 이 둘의 intensity 를 비교했을 때 산화철 나노입자의 농도가 증가함에 따라 세포 안에 흡수되는 입자의 수가 함께 증가한다는 것을 알 수 있었다.
Cell viability 실험은 산화철 나노입자 자체의 독성을 평 가하기 위한 실험이다. NID장비로 원하는 부위로 유도되지 못한 채, 혈액 및 타 장기에 남아 있는 산화철 나노입자가 인체에 미칠 수 있는 독성을 확인하기 위함이다. 실험 결과, control 의 viability를 100%이라고 했을 때, 5 µg/ml을 넣 었을 때는 83.66%, 20 µg/ml을 넣었을 때는 98.54%, 50 µg/ml을 넣었을 때는 97.04%, 100 µg/ml을 넣었을 때는 107.50% 의 viability를 관찰하였다. 각 조건들을 서로 t-
test 해보았을 때 유의수준 0.05에서 5 µg/ml와 20 µg/ml, 5 µg/ml와 50 µg/ml을 제외한 나머지 결과들은 유의하지 않 은 것으로 밝혀졌고, 또한 산화철 나노입자의 농도와는 독 립적인 cell viability 결과를 얻었다. 따라서 본 실험에서 적용한 농도의 범위에서는 산화철 나노입자가 세포에 큰 독 성을 작용하지 않는다는 것을 알 수 있었다(그림 8(b)).
3. NID 산화철 나노입자 자기유도 결과
본 연구에서는 NID의 성능을 평가하기 위하여 Optical Density(OD) 를 활용하였다. OD는 물체가 빛을 흡수하는 정 도를 나타내는 지표로 값이 높을수록 불투명도가 높다는 것 을 의미한다. 즉 나노입자 수용액의 농도와 OD값은 비례한다.
다음은 나노입자 수용액이 0% 농도부터 2% 농도에 있을
그림 8. (a) 유방암세포와 산화철 나노입자의 형광현미경 이미지(scale bar : 50 µm)와 형광 intensity에 대한 그래프. A~C는 나노입자를 넣지 않은 control, D~F는 50 µg/ml, G~I는 100 µg/ml 농도의 나노입자를 함께 배양. A, D, G는 DAPI. B, E, H는 나노입자. C, F, I 는 세포핵과 나노입자를 merge한 결과, (b) 산화철 나노입자의 독성 평가 결과.Fig. 8. (a) Fluorescence images of MCF-7 breast cancer cells with iron oxide nanoparticles and fluorescence intensity. A~C : control, D~F : 50µg/ml of nanoparticle, G~I : 100 µg/ml of nanoparticle. A, D, G : DAPI staining. B, E, H : Nanoparticle images. C, F, I : Merged images, (b) Cell viability of Iron Oxide Nanoparticles.
그림 7. (a) 90o씩 4단계로 회전하는 패턴의 자기장 분포(T = 16s, 자석 1개), (b) 연속적으로 회전하는 패턴의 자기장 분포(T = 16s, 자석 1개).
Fig. 7. (a) Magnetic field distribution by 90o rotation pattern(T = 16s, 1 magnet), (b) Magnetic field distribution by continuous rotation pattern(T = 16s, 1 magnet).
108
때 700 nm 파장대역에 대하여 상응하는 OD값을 나타낸다 ( 그림 9). 이는 density를 OD에 관한 1차 방정식으로 나타 낼 수 있으며, 본 관계식을 이용하여 OD값에 따른 나노입 자의 density를 예측할 수 있다.
그림 10의 실험에서는 syringe pump와 튜브로 기본 혈 류모델을 구성하여 NID를 평가하였다. NID C-arm을 회 전중심(center point), 외곽(side point)에 각각 위치시켜 실험한 결과 side point에서는 모든 나노입자 유속에 의해
빠져나갔고, center point에서는 일부 나노입자가 자기력에 의해 축적됨을 관측할 수 있었다. 그림 11의 실험에서는 center point 와 side point가 모두 존재하는 통합 혈류모 델을 구성하여 동일하게 실험을 진행하였다. Syringe pump 에서부터 나오는 방향의 관을 자석과 가까운 side point로, 튜브를 꺾어 syringe pump쪽으로 돌아가는 방향의 관을 center point 로 구성했다(그림 11(a)). 그 결과 center point 에서 더 많은 나노입자가 관측 되었다(그림 11(b)).
기본 혈류모델을 구성하여 syringe pump의 주입속도(유 속), C-arm 모터의 회전속도, 나노입자 수용액의 농도를 변 화시키며 두 point에서의 자력으로 유도되는 나노입자의 위 치 별 농도를 측정하였다. 먼저 나노입자 수용액 3 ml를 튜 브에 주입하였으며 그 후 물을 튜브에 10 ml 주입하였다.
OD값 측정을 위한 파장으로는 700 nm의 파장 대역을 사 용하였으며 물이 흐르는 속도는 4 mm/sec부터 8 mm/sec까 지, 나노입자 수용액의 농도는 1%, 2%, 3%로 변화시켰다.
다음은 모터 속도와 나노입자 수용액 농도를 일정하게 유 지하고 유속만 변화시키며 그에 따른 center point와 side point 에서의 OD값을 측정한 것이다(표의 C-center point, S-side point)(Table 1).
여기서 center와 side를 비교하기 위하여 C/S ratio = C/
그림 9. 산화철 나노입자의 농도변화에 따른 흡광도 측정결과.
Fig. 9. Absorbance measurement according to the concen- tration of iron oxide nanoparticles.
그림 11. (a) Center point와 side point를 동시에 갖는 통합 혈류모델, (b) 혈류모델에서 자기유도 현상 결과.
Fig. 11. (a) Blood flow model testing both center and side, (b) Result of magnetic inducing effect in the blood flow model.
그림 10. (a) 혈류모델의 가장자리에 위치시킨 NID 동작 결과, (b) 혈류모델의 중심부에 위치시킨 NID 동작 결과.
Fig. 10. (a) NID result on the side under the blood flow model, (b) NID result at the center under the blood flow model.
Journal of Biomedical Engineering Research 38: 102-110 (2017)
109 (C+S) 를 구하였다. 유속이 빠를수록 두 point 모두 상대적
으로 자기력에 유도된 나노입자의 양이 적었다. Standard graph 에 의하면 유속이 4 mm/sec일 경우 가운데 영역에서 0.117% 의 농도를 보였으며 side영역에서 0.064%의 농도를 보였다. 8 mm/sec 인 가운데 영역에서는 0.041%의 농도를 사이드 영역에서 0.035%의 농도를 보였다. 또한 C/S ratio 는 4 mm/sec에서 가장 크게 나타나 두 point간의 농도 차 이가 가장 두드러지게 관측되었다. Side의 농도는 유속이 빨라질수록 낮아지는 경향을 보였으나. C/S ratio인 경우 4 mm/sec 와 6.4 mm/sec에서 크게 나타났다. 유속이 낮은 곳에서 center에 대한 나노입자의 유도가 더 용이하다는 것 은 암과 같은 작은 신생혈관으로 구성된 환경에서 유속이 낮다는 것을 고려했을 때, 이러한 NID 장비의 효율이 더 높 아질 수 있음을 예측할 수 있다.
다음은 유속을 일정하게 유지하고 나노입자 수용액의 농 도에 따른 center와 side point에서의 OD값을 측정한 것 이다(Table 2).
주입하는 나노입자 수용액의 농도가 높아질수록 두 point 모두 더 많은 양의 나노입자가 유도되었다. 3%의 나노입자 수용액을 주입했을 때, center point의 농도는 1.743%이었 으며 side point의 농도는 1.295%이었다. 1%의 나노입자 수용액을 주입했을 때, center의 농도는 0.224% side의 농 도는 0.134% 이었다. 즉, 입자의 주입량이 NID의 효율성 에 더 큰 영향을 줄 수 있음을 의미한다. 한편 C/S ratio를 더욱 향상시키기 위해서는 더욱 다양한 형태의 자석특성과 회전패턴에 대한 연구가 필요함을 알 수 있다.
IV. 결 론
본 논문은 자기장의 형태 변화를 이용하여 새로운 약물전
달시스템의 효율을 높이는 방법을 제시하였다. 또한 이러한 방법이 실제 나노입자에 적용을 했을 때 효과가 있는지를 확인하였다. 이 때 사용한 나노입자는 산화철 나노입자로, 이를 선택한 이유는 산화철 나노입자가 자기적 성질을 가지 고 있으면서, 일정 농도 이하에서 혈액세포나 내피세포 등 에 독성을 보이지 않아 Feridex 또는 Resovist 등 조영제 로 사용하고 있기 때문이다[8,9]. 본 실험결과는 자기장의 형태(자석의 개수와 배치), 자기장의 세기(Critical Magnetic flux density), 자기장이 회전하는 속도, 유속이 C/S ratio 를 변화시켜 약물전달시스템의 효율성에 큰 영향을 미칠 수 있다는 것을 확인할 수 있었다. 또한 혈류 모델과 자기장 유 도를 통하여 실험체의 표면이 아닌 심부에 나노입자를 더 많이 유도할 수 있음을 확인하였고, 산화철 나노입자를 운 반하는 유속이 느릴수록, 산화철 나노입자의 농도가 짙을수 록 Center-Side point의 유도율 차이가 증가한다는 점을 확 인할 수 있었다. 농도에 따른 산화철 나노입자의 uptake 실 험을 통해, NID를 이용하여 산화철 나노입자의 유도를 한 다면 더 많은 양의 입자가 세포 내로 들어가기 때문에 치료 에 도움이 될 수 있다는 것을 밝혔다. 또한 적정 농도에서 암세포에 대한 독성이 없다는 것을 보여주어, 암세포에 비 해 생존율이 낮다고 알려진 정상 세포의 viability에도 영 향을 주지 않는다고 보았다. 향후 연구로 다양한 종류의 산 화철 나노입자와 혈류모델의 추가요소(적혈구, 혈장 단백질, 혈관의 복잡한 구조 등)을 고려하여 실질적인 혈류조건에서 C/S ratio 를 증가시키기 위한 NID의 개발과 최적화 작업 을 진행할 예정이다. 앞으로 진행될 연구의 결과를 이용하 여 최종적으로는 in vitro 뿐만 아니라 in vivo 상에서 약 물이 포함된 나노입자 유도 실험을 진행하여 인체 내의 특 정 부분으로의 약물 전달 가능성을 입증할 것이다.
V. 요 약
본 논문은 자석을 회전시켜 실시간으로 자기장을 변화시 키고 그로 인해 특정 조건에서 산화철 나노입자를 side point( 피부)보다 center point(심부)에서 더 많이 유도할 수 있다는 가능성을 제시하였다. 향후 연구로 유속에 따른 Critical Magnetic flux density, 시간에 따른 나노입자 축 적량, 자기장과 산화철 나노입자의 상호작용을 고려한 실험
표 1. 유속의 변화에 따른 흡광도 비교.Table 1. Comparison of absorbance at different flow rates.
Velocity of flow 4 mm/sec 4.8 mm/sec 5.6 mm/sec 6.4 mm/sec 7.2 mm/sec 8 mm/sec
Position C S C S C S C S C S C S
Value of OD 0.19 0.12 0.159 0.146 0.132 0.128 0.108 0.08 0.088 0.075 0.09 0.083
C/S ratio 0.613 0.521 0.508 0.574 0.540 0.520
표 2. 나노입자 농도에 따른 흡광도 비교.
Table 2. Comparison of absorbance at different amounts of nanoparticles.
Concentration Low conc. Min conc. High conc.
Position C S C S C S
Value of OD 0.33 0.212 1.582 1.01 2.314 1.729
C/S ratio 0.609 0.610 0.572
110
설계, 전자석 등을 이용한 자기장조절을 연구하여 실질적인 혈관에서 본 실험을 진행할 계획이다.
Reference
[1] Fumihito Mishima, Shin-ichi Takeda, Yoshinobu Izumi and Shigehiro Nishijima, “Development of magnetic field con- trol for magnetically targeted drug delivery system using a superconducting magnet”, IEEE transactions on applied superconductivity, vol. 17, issue 2, pp. 2303-2306, 2007.
[2] Y. Hirota, Y. Akiyama, Y. Izumi and S. Nishijima, “Funda- mental study for development magnetic drug delivery sys- tem”, Physica C: Superconductivity, vol. 469, issue 15-20, pp. 1853-1856, 2009.
[3] Kinam Park, “Facing the truth about nanotechnology in drug delivery”, ACS nano, vol. 7, no. 9, pp. 7442-7447, 2013.
[4] S. Fukui, R. Abe, J. Ogawa, T. Oka, M. Yamaguchi and T.
Sato, “Study on optimization design of superconducting magnet for magnetic force assisted drug delivery system”,
Physica C: Superconductivity and its applications, vol. 463- 465, pp. 1315-1318, 2007.
[5] Jaehong Key, and James F. Leary, “Nanoparticles for multi- modal in vivo imaging in nanomedicine”, International jour- nal of nanomedicine, 2014.
[6] David k. Cheng, Fundamentals of Engineering Electromag- netics, Pearson, 1994, pp.188-193.
[7] Robby A. Petros and Joseph M. DeSimone, “Strategies in the design of nanoparticles for therapeutic applications”, Nature reviews Drug discovery, vol. 9, no. 8, pp. 615-627, 2010.
[8] Marta Kutwin, Ewa Sawosz, S awomir Jaworski, Natalia Kurantowicz, Barbara Strojny and Andre Chwalibog, “Hemol- ysis as expression of nanoparticles-induced cytotoxicity in red blood cells”, Biotechnol Mol Biol Nanomedicine BMBN, vol. 9, no. 1, pp. 257, 2014.
[9] Daniel Moersdorf, Pierre Hugounenq, Ingolf Bernhardt
“Influence of magnetic iron oxide nanoparticles on red blood cells and Caco-2 cells”, Advances in Bioscience and Biotech- nology, vol. 1, no. 5, pp. 439-443, 2010.
l′