인슐린 의존형 당뇨병 백서 모델에서 cox-2 길항제가 골대사에 미치는 영향
연세대학교 원주의과대학 내과학교실, 아주대학교 의과대학 내분비대사내과학교실1
이미영․고장현․남수민․정필문․신장열․신영구․정윤석1․정춘희
The Effects of cox-2 Inhibitor on Bone Metabolism in Insulin Dependent Diabetic Rats
Mi Young Lee, Jang Hyun Koh, Soo Min Nam, Pil Moon Jung, Jang Yel Shin, Young Goo Shin, Yoon-Sok Chung1, Choon Hee Chung
Department of Internal Medicine, Yonsei University Wonju College of Medicine, Wonju, Department of Endocrinology and Metabolism, Ajou University School of Medicine, Suwon, Korea1
Objectives: To assess the effects of rofecoxib, cycloxygenase-2 (cox-2) inhibitor, on bone mineral density (BMD) and bone metabolism marker in insulin dependent diabetic rat model.
Methods: Eight week-old Sprague-Dawley male rats were prepared. We administered intraperitoneal injection with streptozotocin (70 mg/kg) to induce diabetes in 11 male rats and injected citrate buffer solution to 7 normal controls. One week later, a glucose level exceeding 11.1 mmol/L (200 mg/dL) was considered as diabetes. In diabetic rats, 6 were received rofecoxib orally in a volume of 30 mg/kg/day from 9 weeks to 40 weeks. Then, they were sacrificed and measured BMD by dual-energy X-ray absorp- tiometry. They were also examined bone turnover markers, serum osteocalcin and urinary deoxypyridino- line.
Results: BMD values were significantly lower in diabetic controls than in normal controls. But, There was no significant difference in BMD between diabetic controls and rofecoxib treated diabetic rats. Serum osteocalcin and urinary deoxypyridinoline were not statistically significant among normal controls, diabetic controls and rofecoxib treated diabetic rats.
Conclusion: These findings suggest that BMD values are decreased in diabetes and rofecoxib has no effect on BMD in type 1 diabetes.
Key Words: Cyclooxygenase 2 inhibitor, diabetes mellitus, bone mineral density, osteocalcin, deoxypyridi- noline
3) 제2형 당뇨병 환자에서는 정상인보다 골밀도가 낮게 나왔다는 보고1,2 및 비슷하다는 결과도 있고3,4 오히려 증가한다는 보고도 있어5,6 아직까지 제2형
책임저자:정춘희, 연세대학교 원주의과대학 내분비내과 Tel: 033)741-1246/0506, Fax: 033)731-5884 E-mail: cchung@yonsei.ac.kr
* 본 연구는 한국 MSD의 지원에 의해 이루어진 것임.
당뇨병과 골밀도에서의 상관관계는 확립되어 있지 않은 상태인데 비해 제1형 당뇨병 환자에서는 골감 소증 및 골다공증이 증가한다는 일률적인 결과가 보 고되고 있다7-9. 또한 골밀도와 상관없이 당뇨병이 있을 경우 시력 저하, 뇌혈관질환, 말초신경손상 등 의 이유로 잘 쓰러지는 경향이 있어 외상성 척추골
절 및 대퇴골 골절이 현저히 증가한다고 보고되고
있다10-13. 이러한 이유로 당뇨병 환자에서 골절 예방
이 중요하게 여겨지고 있다. 골흡수는 대부분 prosta- glandin에 의해 조절되므로 selective nonsteroidal anti- inflammatory drugs (NSAIDs) 사용시 골흡수가 억제 되며 골밀도가 증가된 보고들이 있다17-20. 하지만 골 흡수를 억제하는 것과 반대로 nonselective NSAIDs 사용은 새로운 골생성을 억제하여 골절후 골치유 지 연을 일으킬 수 있어22,23 연구가 더 필요한 상태이다.
Cyclooxygenase-2 (cox-2) 길항제의 경우도 골치유 지 연이 있다는 보고가 있었지만24 다른 연구에서는 그 러한 골치유 길항 효과는 없으며25 오히려 골흡수를 억제한다는 보고가 있었다26. 이에 저자들은 인슐린 결핍성 당뇨병 모델 쥐에서 cox-2 길항제인 rofe- coxib을 투여한 후 골밀도 변화와 골형성지표 및 골 흡수지표 변화에 대한 영향을 연구하였다.
대상 및 방법
1. 실험 대상
8주된 수컷 Sprague-Dawley 쥐 18마리를 분양 받 아 이중 11마리는 streptozotocin (70 mg/kg)을 복강내 로 주사하여 당뇨병을 유발하였고 7마리는 정상대 조군으로 citrate buffer 용액을 복강내 주사하였다.
일주일 뒤 자가혈당 측정기 (Surestep, Lifescan Inc., MA, USA)로 혈당을 측정하고 혈당이 11.1 mmol/L (200 mg/dL) 이상일 경우 당뇨병이 유발된 것으로 판 단하였다. 이중 정상 Sprague-Dawley rat 7마리를 A 군으로 하였고 streptozotocin induced diabetic rat 11마 리를 다시 무작위로 두 군으로 나누어 5마리는 당뇨 병 대조군으로 B군으로 하여 식수만을 공급하였고 나머지 6마리는 C군으로 하여 rofecoxib (30 mg/kg, MSD)을 식수와 함께 공급하였다.
당뇨병 쥐들은 일주일에 3회 혈당을 측정하고 인 슐린 (Humulin-N)을 0.5 IU/kg를 피하주사 하였다. 모 든 쥐들은 10주마다 몸무게를 측정하였고 희생하기 전에 24시간 소변을 채취하였다.
2. 골밀도 검사
생후 40주에 실험 쥐들에게 케타민 (60 mg/kg)을
복강내로 주사하여 마취한 다음 복부를 절개하여 좌 측 대퇴골을 분리하였다. 분리된 대퇴골은 근육을 제거한 뒤 Dual Energy X-ray Absorptiometry (PIXI- mus2, GE Lunar, USA)를 이용하여 골밀도를 측정하 였다.
3. 골형성 지표 및 골흡수 지표 검사
생후 40주에 실험동물을 희생하여 대퇴골을 적출 하기 전 심장천자를 통하여 혈액을 채취한 다음 원 심분리기를 이용하여 혈청을 얻어 -70oC에서 냉동 보관하였다가 분석시 실온에서 해동한 뒤 EIA (Quidel Corporation, USA) 방법으로 bone ALP를 측 정하였고, IRMA (Techno genetics, Italy) 방법으로 serum osteocalcin을 측정하였다. 희생하기 전 채취했 던 24시간 소변에서 deoxypyridinoline (DPD)을 EIA (Quidel Corporation, USA) 방법으로 측정하였다.
4. 통계 분석
통계분석은 윈도우즈용 SPSS 11.0을 사용하였고 모든 실험 결과는 평균±표준편차로 표시하였다. 실 험군 간의 비교는 Kruskal-Wallis test로 유의성을 평 가하였고 P값이 0.05 미만일 때 통계적으로 유의하 다고 판정하였다.
결 과
1. 기초 자료 분석
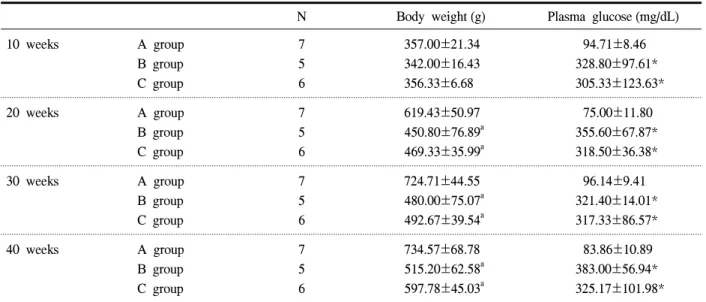
혈당치는 정상 대조군 (A군)에 비해 모든 당뇨병 군 (B and C군)에서 유의하게 높은 결과를 보였으나 당뇨병 대조군 (B군)과 rofecoxib 투약군 (C군) 사이 에는 유의한 차이를 관찰할 수 없었다 (Table 1). 체 중은 생후 10주에는 3군 사이에 차이가 없었으나 20 주 이후에는 정상 대조군 (A군)에 비해 당뇨병군 (B and C군)에서 통계적으로 유의한 체중 감소 소견이 관찰되었고 당뇨병 대조군 (B군)과 rofecoxib 투약군
(C군) 사이에는 차이가 없었다 (Table 1).
2. 골밀도 검사
생후 40주의 모든 쥐들의 혈당과 골밀도간의 상관 관계를 보았을 때 혈당이 증가할수록 골밀도가 감소
Table 1. Clinical characteristics of experimental rats
N Body weight (g) Plasma glucose (mg/dL)
10 weeks A group
B group C group
7 5 6
357.00±21.34 342.00±16.43 356.33±6.68
94.71±8.46 328.80±97.61*
305.33±123.63*
20 weeks A group
B group C group
7 5 6
619.43±50.97 450.80±76.89a 469.33±35.99a
75.00±11.80 355.60±67.87*
318.50±36.38*
30 weeks A group
B group C group
7 5 6
724.71±44.55 480.00±75.07a 492.67±39.54a
96.14±9.41 321.40±14.01*
317.33±86.57*
40 weeks A group
B group C group
7 5 6
734.57±68.78 515.20±62.58a 597.78±45.03a
83.86±10.89 383.00±56.94*
325.17±101.98*
Data are shown as mean±standard deviation. A group was normal controls, B group was diabetic controls and C group was rofecoxib treated diabetic group. * P<0.05 vs. A group.
Fig. 1. Relationship between glucose and BMD. An in- verse correlation was observed between glucose and BMD. BMD, bone mineral density.
Fig. 2. The comparison of BMD in three groups. A group was normal controls, B group was diabetic controls and C group was rofecoxib treated diabetic group. BMD, bone mineral density. * P<0.05 vs A group.
하여 뚜렷한 음의 상관관계를 보였다 (Fig. 1). 골밀 도는 A군에 비해 B군과 C군에서 통계적으로 유의하 게 감소하였으나, rofecoxib을 투여한 군과 비투약군 을 비교하였을 경우에는 통계적인 의미가 없었다 (Fig. 2).
3. 골형성 지표 및 골흡수 지표
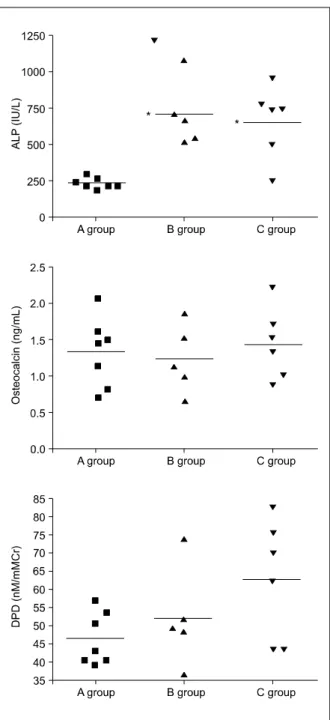
골형성 지표인 osteocalcin은 세군 모두에서 유의한
차이가 없었고 골흡수 지표인 DPD는 당뇨병 군에서 증가한 것처럼 보였으나 통계적인 의미는 없었다 (Fig. 3). Alkaline phosphatase의 경우 당뇨병 군에서 현저하게 증가하였으나 B군과 C군 사이에서는 유의 한 차이가 없었다 (Fig. 3).
R=-0.86 P<0.001
Fig. 3. Bone metabolism markers. A group was normal controls, B group was diabetic controls and C group was rofecoxib treated diabetic group.
ALP, alkaline phosphatase; DPD, deoxypyridi- noline. * P<0.05 vs A group.
고 찰
당뇨병 환자에서는 시력손상이나 말초신경장애, 심혈관 질환, 뇌혈관 질환 등의 이유로 생활하는데
기능적인 저하가 올 수 있으며 이로 인해 외상성 척추 골절 및 고관절 골절이 증가한다고 알려져 있
다10-13. 또한 제2형 당뇨병과는 달리 제1형 당뇨병
환자에서는 골감소증이나 골다공증이 많으며 비외 상성 골절도 현저히 증가한다고 알려져 있어7-9 당뇨 병 환자에서의 골절 예방이 중요하게 자리잡고 있 다. 본 연구에서는 streptozotocin을 투여하여 인슐린 결핍성 당뇨병을 유발한 쥐에서 혈당과 골밀도의 상 관관계를 보았으며 혈당이 증가할수록 골밀도는 감 소하는 것을 관찰하였다. 인슐린 결핍성 당뇨병에서 골밀도가 감소하는 이유는 정확하게 밝혀지진 않았 지만 골흡수 증가14 및 골생성 감소15 등 많은 가설이 세워지고 있다. Gallacher 등16에 의하면 제1형 당뇨 병에서 bone turnover marker가 증가하는 것으로 보 아 골교체가 증가하여 골절률이 증가한다고 보고되 었다. 본 연구에서도 인슐린 결핍성 당뇨병 쥐에서 alkaline phostphatase가 현저히 증가하였고 통계적으 로 의미는 없었지만 DPD도 당뇨병 쥐에서 증가하는 양상으로 보여 제1형 당뇨병에서 골교체가 증가한 다는 것을 간접적으로 보여주었다. 하지만 본 실험 만으로는 그 기전을 정확히 설명하기는 어려울 것으 로 생각된다.
NSAIDs는 파골세포의 골흡수를 증가시키는 pro- staglandin 생성을 억제시킴으로써 골소실을 감소시 키는 것으로 알려져 있다17-19. 이러한 기전을 바탕으 로 사람에서 NSAIDs를 사용한 후 요추 및 대퇴골에 서의 골밀도를 측정해 보았고, 골밀도는 NSAIDs 사용 후 증가된 것으로 밝혀진바 있다20,21. 하지만 NSAIDs 사용 후 골밀도가 증가한다는 일률적인 결과에 반하 여 골절률은 감소된다27는 연구 결과와 함께 감소되 지 않았다는 상반된 결과도 보고되었다21. 또한 골생 성을 감소시켜 골절 후 치유지연을 가져오기도 하기 때문에 아직까지 골다공증 예방에 NSAIDs 사용은 위험성이 있다. Cox-2 길항제의 경우에서도 골흡수 를 억제하는 효과도 있지만26 골치유가 억제된다는 보고가 많아24,28 연구가 계속되고 있는 실정이다. 하 지만 아직까지 Cox-2 길항제가 골밀도에 어떻게 작 용하는지에 대한 연구가 없으며 특히 당뇨병에서의 역할은 더더욱 연구된 바가 없었다. 이에 본 연구에 서는 cox-2 길항제인 rofecoxib가 인슐린 결핍성 당
뇨병 쥐 모델에서 골밀도에 어떠한 영향을 주는지 알아보았다. Streptozotocin을 투여하여 인슐린 결핍 을 유발한 당뇨병 쥐에서 정상 대조군에 비해 대퇴 골 골밀도가 감소하였고 이는 통계적으로 의미가 있 었다. 하지만 예상과는 다르게 rofecoxib을 투여한 당 뇨병 쥐에서 당뇨병 대조군과는 골밀도상 큰 차이를 보이지 않았다. 또한 골대사 지표도 당뇨병 대조군 과 rofecoxib을 투여한 당뇨병 쥐에서 의미 있는 변 화가 관찰되지 않았다. 이러한 결과로 인슐린 결핍 성 당뇨병에서는 골밀도가 감소하며 이는 골교체 증 가로 인한 것임을 간접적으로 알 수 있었고 골밀도 가 감소한 당뇨병에서 cox-2 길항제가 크게 영향을 미치지 않는 것으로 생각되었다.
본 연구는 정상 대조군에서 약물을 투여하여 비교 하지 못하였고 실험대상 쥐의 숫자가 많지 않아 제 한점이 있지만 cox-2 길항제를 당뇨병 쥐에서 투여 하여 그 영향을 알아보는데 있어 첫번째 연구로 의 미가 있을 것으로 생각되며 추후 더 많은 연구가 필 요할 것으로 생각된다.
요 약
목적: 당뇨병 환자에서는 여러 신체기능 이상으 로 외상성 척추골절 및 대퇴골 골절이 많으며 인슐 린 결핍성 당뇨병의 경우 골밀도 감소 소견을 보여 당뇨병 환자에서 골절률 예방이 중요한 상태이다.
이에 cox-2 억제제인 rofecoxib을 사용하여 인슐린 결핍성 당뇨병 쥐 모델에서 골밀도에 대한 영향을 알아보고자 하였다.
방법: 8주된 수컷 Sprague-Dawley 쥐 11마리에 streptozotocin을 70 mg/kg로 복강내 주사하여 당뇨병 을 유발하였고 7마리는 정상 대조군으로 citate buffer 용액을 주사하였다. 11마리의 당뇨병 쥐 중 6마리는 생후 9주부터 40주까지 rofecoxib (30 mg/kg/day)을 식 수에 섞어서 투여하였고 5마리는 당뇨병 대조군으 로 식수만 투여하였다. 40주에 모든 쥐들을 희생하 면서 심장 천자를 통하여 혈청을 얻어 -70oC에 보 관하였고 대퇴골은 깨끗하게 분리하여 dual-energy X-ray absorptiometry로 골밀도를 측정하였다. 혈청에 서 골형성 지표 및 골흡수 지표를 측정하였고 희생
직전 24시간 소변을 모아 deoxypyridinoline을 측정하 였다.
결과: 생후 40주의 모든 쥐들의 혈당과 골밀도간 의 상관관계를 보았을 때 혈당이 증가할수록 골밀도 가 감소하여 뚜렷한 음의 상관관계를 보였고 골밀도 는 정상 대조군에 비해 당뇨병 대조군 및 rofecoxib 을 투여한 당뇨병 쥐에서 통계적으로 유의하게 감소 하였으나 rofecoxib을 투여한 군과 비투약군을 비교 하였을 경우에는 통계적인 의미가 없었다. 골형성 지표인 osteocalcin은 세 군 모두에서 유의한 차이가 없었고 골흡수 지표인 DPD는 정상 대조군에 비해 당뇨병대조군 및 rofecoxib 투여한 당뇨병 군에서 증 가한 것처럼 보였으나 통계적인 의미는 없었다. Alka- line phosphatase의 경우 정상 대조군에 비해 당뇨병 대조군 및 rofecoxib 투여한 당뇨병 군에서 현저하게 증가하였으나 rofecoxib을 투여한 군과 비투약군을 비교하였을 경우에는 통계적인 의미가 없었다.
결론: 인슐린 결핍성 당뇨병에서는 골밀도가 감 소하며 당뇨병에서 rofecoxib을 투여하였을 경우 골 밀도에 대해서는 크게 영향을 미치지 않는 것으로 사료된다.
참 고 문 헌
1. Isaia G, Bodrato L, Carlevatto V, Mussetta M, Salamano G, Molinatti GM. Osteoporosis in type II diabetes. Acta Diabetol Lat 1987;24:305-10.
2. Gregorio F, Cristallini S, Santeusanio F, Filipponi P, Fumelli P. Osteopenia associated with non- insulin-dependent diabetes mellitus: what are the causes? Diabetes Res Clin Pract 1994;23:43-54.
3. Wakasugi M, Wakao R, Tawata M, Gan N, Koizumi K, Onaya T. Bone mineral density by dual energy x-ray absorptiometry in patients with non-insulin-dependent diabetes mellitus. Bone 1993;
14:29-33.
4. Sosa M, Dominquez M, Navarro MC, Segarra MC, Hernández D, de Pablos P, et al. Bone mineral metabolism is normal in non-insulin-dependent diabetes mellitus. J Diabetes Complications 1996;
10:201-5.
5. Van Daele PL, Stolk RP, Burger H, Algra D, Grobbee DE, Hofman A, et al. Bone density in non-insulin dependent diabetes mellitus: the Rotter- dam Study. Ann Intern Med 1995;122:409-14.
6. Stolk RP, van Daele PL, Pols HA, Burger H, Hofman A, Birkenhäger JC, et al. Hyperinsuli- nemia and bone mineral density in an elderly population: the Rotterdam Study. Bone 1996;18:
545-9.
7. Kayath MJ, Dib SA, Vieiaa JG. Prevalence and magnitude of osteopenia associated with insulin- dependent diabetes mellitus. J Diabetes Compli- cations 1994;8:97-104.
8. Forst T, Pfützner A, Kann P, Schehler B, Lobmann R, Schäfer H, et al. Peripheral osteopenia in adult patients with insulin-dependent diabetes mellitus.
Diabet Med 1995;12:874-9.
9. Tuominen JT, Impivaara O, Puukka P, Ronnemaa T. Bone mineral density in patients with type 1 and type 2 diabetes. Diabetes Care 1999;22:1196-200.
10. Gregg EW, Becles GL, Williamson DF, Levelille SG, Langlois JA, Engelgau MM, et al. Diabetes and physical disability among older U.S. adults.
Diabetes Care 2000;23:1272-7.
11. Gregg EW, Mangione CM, Cauley JA, Thompson TJ, Schwartz AV, Ensrud KE, et al. Diabetes and incidence of functional disability in older women.
Diabetes Care 2002;25:61-7.
12. Schwartz AV, Hillier TA, Sellmeyer DE, Resnick HE, Gregg E, Ensrud KE, et al. Older women with diabetes have a higher risk of falls: A prospective study. Diabetes Care 2002;25:1749-54.
13. Simoneau GG, Ulbrecht JS, Derr JA, Becker MB, Cavanagh PR. Postural instability in patients with diabetic sensory neuropathy. Diabetes Care 1994;
17:1411-21.
14. Rishaug U, Birkeland KI, Falch JA, Wahler S.
Bone mass in noninsulin-dependent diabetes mellitus.
Scand J Clin Lab Invest 1995;55:257-62.
15. Olmos JM, Peres-Castrillon JL, Garcia MT, Garrido JC, Amado JA, Gonzales-Macias J. Bone densito- metry and biochemical bone remodeling markers in type 1 diabetes mellitus. Bone Miner 1994;26:1-8.
16. Gallacher SJ, Fenner AK, Fisher BM, Quin JD, Fraser WD, Logue FC, et al. An evaluation of bone density and turnover in premenopausal women with type 1 diabetes mellitus. Diabet Med 1993;
10:129-33.
17. Kimmel DB, Coble T, Lane N. Long term effect of naproxen on cancellous bone in ovariectomized rats. Bone 1992;13:167-72.
18. Thompson DD, Rodan GA. Indomethacin inhibition of tenotomy-induced bone resorption in rats. J Bone Miner Res 1988;3:409-14.
19. Zeng QQ, Jee WS, Ke HZ, Wechter WJ. Keto- profen inhibits tenotomy-induced bone loss and dynamics in weanling rats. Bone Miner 1993;21:
203-18.
20. Bauer DC, Orwoll ES, Fox KM, Vogt TM, Lane NE, Hochberg MC, et al. Aspirin and NSAID use in older women: Effect on bone mineral density and fracture risk. J Bone Miner Res 1996;11:29-35.
21. Morton DJ, Barrett-Connor EL, Schneider DL.
Nonsteroidal anti-inflammatory drugs and bone mine- ral density in older women: The Rancho Bernardo study. J Bone Miner Res 1998;13:1924-31.
22. Dimer JR, Ante WA, Zhang YP, Glassman SD.
The effects of nonsteroidal anti-inflammatory drugs on posterior spinal fusions in the rat. Spine 1996;
15:1870-6.
23. Keller JC, Trancik TM, Young FA, St Mary E.
Effects of indomethacin on bone ingrowth. J Orthop Res 1989;7:28-34.
24. Goodman S, Ma T, Trindade M, Ikenoue T, Matsuura I, Wong N, et al. Cox-2 selective NSAID decreases bone ingrowth in vivo. J Orthop Res 2002;20:1164-9.
25. Suyama H, Kawamoto M, Gaus S, Yuge O. Effect of etodolac, a COX-2 inhibitor, on neuropathic pain
in a rat model. Brain Res 2004;1010;144-50.
26. Igarashi K, Woo JT, Stern PH. Effects of a selec- tive cyclooxegenase-2 inhibitor, celecoxib, on bone resorption and osteoclastogenesis in vitro. Biochem Pharmacol 2002;63:523-32.
27. Taggar HM. Do drugs affect the risk of hip frac-
ture in elderly women? J AM Geriatr Soc 1988;
36:1006-10.
28. Kenji E, Koichi S, Shinji K, Takahiro S, Hiroshi E, Daisuke Y, et al. Cyclooxygenase-2 inhibitor inhi- bits the fracture healing. J Physiol Anthropol 2002;
21:235-8.